Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Ciencias marinas
versão impressa ISSN 0185-3880
Cienc. mar vol.35 no.1 Ensenada Mar. 2009
Notas de investigación
Fatty acid composition of juvenile abalone (Haliotis tuberculata coccinea) fed formulated diets containing various n3 HUFA levels*
Composición de ácidos grasos en juveniles de abulón Haliotis tuberculata coccinea alimentados con dietas formuladas con diferentes contenidos de HUFA n3
P Toledo–Agüero1, MT Viana2
1 Departamento de Acuicultura, Facultad de Ciencias del Mar, Universidad Católica del Norte, Coquimbo, Chile, CEAZA. E–mail: ptoledo@ucn.cl
2 Instituto de Investigaciones Oceanológicas, Universidad Autónoma de Baja California, Km 107 Carretera Tijuana–Ensenada, 22860 Ensenada, Baja California, México.
Recibido en junio de 2008.
Aceptado en febrero de 2009.
Abstract
The effect of feeding different levels of n3 highly unsaturated fatty acids (HUFA) on the fatty acid profile was evaluated in soft tissue from juvenile Haliotis tuberculata coccinea. Five diets were formulated with different oil sources (palm, colza, fish, sunflower, and soybean), containing from 2.52% to 12.33% n3 HUFA, while fresh Ulva rigida was used as reference diet. The different diets were provided to groups of 20 abalone during 120 days in independent triplicates. Though no significant differences in growth (P < 0.05) were registered among all formulated diets, a tendency to accumulate different fatty acids in muscle was observed. The proximate composition of abalone tissue showed that the diet containing 6.8% HUFA resulted in higher lipid accumulation in muscle tissue than that observed in the other treatments. Our results suggest that H. tuberculata coccinea, contrary to to abalone species from colder environments, does not have high HUFA requirements; however, the fatty acid profile of muscle and viscera tissues of abalone may be modulated by the fatty acid content in diets.
Key words: abalone, fatty acids, lipids, n3 HUFA, nutrition.
Resumen
Se evaluó el efecto de diferentes niveles de ácidos grasos altamente insaturados (HUFAs, por sus siglas en inglés) n3 en el perfil de ácidos grasos de los tejidos blandos de juveniles de Haliotis tuberculata coccinea. Se formularon 5 dietas con diferentes fuentes de aceite (palma, colza, pescado, semilla de girasol y soya), que contenían de 2.52% a 12.33% de HUFA n3, usando Ulva rigida como dieta de referencia. Las diferentes dietas se suminitraron a grupos de 20 abulones durante 120 días por triplicado. Aunque no se registraron diferencias significativas en el crecimiento (P < 0.05) entre todas las dietas formuladas, se observó una tendencia a acumular diferentes ácidos grasos en el músculo de los organismos. La composición proximal del tejido de los abulones mostró que la dieta que contenía 6.8% de HUFAs dío como resultado mayor acumulación de lípidos en el tejido muscular que la observada en los otros tratamientos. Los resultados de este trabajo sugieren que H. tuberculata coccinea, a diferencia de algunas especies de abulón de ambientes más fríos, no requiere HUFAs; sin embargo, el perfil de ácidos grasos de los tejidos muscular y visceral del abulón puede estar regulado por el contenido de ácidos grasos en su dieta.
Palabras clave: abulón, ácidos grasos, HUFA n3, lípidos, nutrición.
Introducción
La acuacultura de abulón está creciendo a fin de satisfacer su creciente demanda, y la investigación de dietas nutricionalmente balanceadas se está volviendo crítica para sustituir a las macroalgas como su principal alimento (Fleming et al. 1996, Gordon y Cook 2004, Viana 2006). A pesar de que se han estudiado ampliamente los requirimientos nutricionales de las diferentes especies de abulón, aún se requiere profundizar en la investigación para entender completamente los requerimientos de cada una, así como sus mecanismos de alimentación, adaptaciones alimenticias y estrategias de manejo acuícola. Por ello, la formulación efectiva de alimentos balanceados no sólo es importante para lograr mejores crecimientos, sino también para asegurar un suministro constante de alimento (Dunstan et al. 1996).
En el sur de Europa la explotación del abulón canario Haliotis tuberculata coccinea R. se ha llevado a cabo durante muchos años sin considerar su sustentabilidad (fig. 1; Viera et al. 2005). Actualmente existe un creciente interés en el cultivo de esta especie para satisfacer mercados locales e internacionales. Existen pocos estudios sobre esta especie de abulón, pero considerando que todas las demás especies han mostrado un rango similar de requerimientos nutricionales (Fleming et al. 1996, Viana 2006), se ha considerado pertinente iniciar estudios específicos con un alimento que tenga la mayoría de los nutrientes requeridos por otras especies de abulón. En tales estudios se ha demostrado que los lípidos constituyen una importante fuente de energía almacenada en forma de triglicéridos (Durazo–Beltrán et al. 2003a, b). Los abulones ingieren su alimento para cubrir sus necesidades energéticas con una proporción proteína/energía (P/E) de 100 mg de proteína por caloría (estimada para H. fulgens por Gómez–Montes et al. 2003), por lo que resulta importante suministrar suficiente energía para aprovechar mejor la proteína para el crecimiento. Por ello, aún cuando un contenido de lípidos del 5% en la dieta pueda parecer suficiente para satifacer sus requerimientos nutricionales (Mai et al. 1995, Durazo–Beltrán et al. 2003a, b), experimentos previos sugieren que H. fulgens es capaz de desaturar y elongar los ácidos grasos 18:2n6 y 18:3n3 para sintetizar los ácidos grasos altamente saturados (HUFAs, por sus siglas en inglés) 20:4n6 (ARA) y 20:5n3 (EPA), respectivamente (Durazo–Beltrán et al. 2003a, b). Los mismos autores pudieron demostrar que H. fulgens alimentado con una dieta sin lípidos crece de manera similar al alimentado con una dieta con 5% de lípidos, sin que por ello se modifique el perfil de ácidos grasos de su tejido muscular. Esto podría ser un indicio de que los lípidos no son componentes importantes en la dieta del abulón; sin embargo, es crítico suministrar lípidos suficientes para que el abulón aproveche mejor la proteína ingerida para su crecimiento, por lo que es relevante estudiar los requerimientos energéticos de cada una de las especies. Por otra parte, de todos los lípidos, las fuentes de HUFAs como ingredientes de las dietas son las que tienen un impacto en el costo de los alimentos balanceados. Su presencia es importante debido a que los ácidos grasos insaturados de cadena larga propician el flujo a través de las membranas, lo cual es particularmente importante en ambientes más fríos (Sargent et al. 2002). En consistencia, los peces marinos de aguas más frías requieren mayores cantidades de HUFA n3 que los peces tropicales. Haliotis tuberculata coccinea vive en aguas más cálidas (19–26°C) que la mayoría de las especies de abulón, las cuales habitan en ambientes fríos y necesitan más ácidos grasos poliinsaturados. Por ello, el objetivo del presente estudio fue evaluar el efecto de la composición de ácidos grasos de la dieta en la composición final del tejido muscular y visceral del abulón, probando alimentos balanceados con diferentes niveles de HUFA n3 en juveniles de H. tuberculata coccinea.

Material y métodos
Preparación de las dietas
Se formularon 5 dietas (T1 a T5) con el mismo contenido proximal pero con diferentes niveles de HUFA n3 (2.52% a 12.33%) usando aceite de palma, colza, pescado, semilla de girasol y soya (tabla 1). La harina de pescado que se utilizó como fuente de proteínas fue desgrasada con triclorometano. Todos los ingredientes se pulverizaron en un molino (Retsch SK100) hasta un tamaño de partícula de 200 um. Se usó alga marina Ulva rigida fresca como dieta de referencia. El resto de los ingredientes fueron agregados como se ha recomendado para otras especies de abulón (Hahn 1989, Gómez–Montes et al. 2003). Todos los ingredientes fueron incorporados con 50% de agua hasta obtener una masa homogénea que posteriormente se aplanó a un espesor de 2 mm, se cortó en trozos de 10 x 5 mm, y se almacenó en bolsas selladas a –20°C hasta su utilización.
Condiciones experimentales
Para cada unidad experimental se utilizaron en total 334 abulones canarios juveniles de cinco meses de edad (10.17 ± 0.05 mm y 174.0 ± 3.0 mg) en grupos de 20 individuos. Los abulones fueron criados como un solo lote de un desove artificial de progenitores silvestres siguiendo el método descrito por Morse et al. (1977). Antes del experimento todos los abulones fueron alimentados por 30 días con U. rigida cultivada y enriquecida con efluentes del biofiltro de un sistema de acuacultura de peces en el Instituto Canario de Ciencias Marinas (Taliarte, España). Los abulones del experimento se mantuvieron en un tanque con sistema de flujo continuo de agua de mar (salinidad = 34, temperatura = 22.8 ± 0.5°C), a razón de 0.15 L seg–1, aereada y filtrada. Se registró el oxígeno y pH cada semana, mientras que el fotoperiodo (horas de luz/oscuridad) se midió diariamente. Durante el experimento el fotoperiodo varió entre 14.0 y 11.1 h d–1 de luz. Durante todo el experimento el contenido de oxí–geno en el tanque experimental fue de 7.6 ± 0.1 mg L–1, y el pH de 8.1 ± 0.1. Las unidades experimentales consistieron de tubos individuales de PVC de 19 cm de largo y 10 cm de diá–metro, cubiertos con malla por ambos lados, sumergidos dentro de un tanque circular de 2000 L. Cada 20 días se pesó y midió cada abulón usando un calibrador (±0.01 mm) y una báscula (Mettler Toledo AG204, ±0.001 g) digitales. Se tomaron muestras de Ulva cada 20 días para determinar su composición proximal, mientras que las dietas formuladas sólo se analizaron una vez. Además, se tomaron 10 abulones da cada unidad experimental al principio y al final del experimento, a los cuales se determinó composición proximal y perfil de ácidos grasos tanto en vísceras como en tejido muscular. Las dietas formuladas fueron suministradas húmedas (50% de humedad) a una tasa del 5% en peso del abulón (peso húmedo) cada noche (20:30). Todo el alimento que no fue consumido se retiró a la mañana siguiente (08:30) y se registró como peso seco constante, mientras que la Ulva fresca también fue suministrada diariamente pero a una tasa del 15% del peso del abulón (peso húmedo). La ingesta de alimento (FI) se determinó como lo reportan López y Viana (1995), siete días antes del pesaje de lo abulones:

donde G representa la cantidad de alimento suministrado; S la cantidad de alimento recuperado de los contenedores testigos, sin abulón, después de 12 h de inmersión; y R es el alimento no ingerido que quedó en los contenedores que contenían a los abulones del experimento. Después se calculó la ingesta media diaria de alimento para cada tratamiento, y ésta se expresó como porcentaje del peso corporal de los abulones. También se registró la ingesta de lípidos y HUFA n3.
Después se calculó la eficiencia de conversión alimenticia (FCE) de acuerdo con Uki y Watanabe (1992):

Después de 120 días de alimentación experimental se expresó el crecimiento como la tasa diaria de incremento en longitud (µm d–1) y peso (mg d–1), y el porcentaje de ganancia en peso de la manera siguiente:
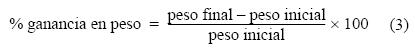
La tasa específica de crecimiento (SGR, % día–1) se estimó de acuerdo con Hopkins (1992):
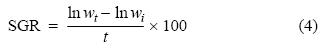
donde wt es el peso al tiempo t, y wi es el peso inicial.
Análisis químicos
Las composiciones proximales de las dietas formuladas, la Ulva fresca, y las vísceras y el músculo de abulón se analizaron por triplicado. El porcentaje en peso seco se calculó después de secar a 100°C hasta peso constante. El nitrógeno total se determinó mediante el método Kjeldahl (AOAC 2000), y se multiplicó por 6.25 para estimar el contenido de proteína cruda. La energía bruta de cada dieta se calculó a partir de la composición de nutrientes usando los valores teóricos reportados por Tacon (1990): 5.6, 9.5 y 4.1 Kcal g–1 de proteínas, lípidos y carbohidratos, respectivamente. Los lípidos totales se evaluaron gravimétricamente tras su extracción con cloroformo–metanol (2:1, v/v; Folch et al. 1957). El contenido de cenizas se determinó gravimétricamente tras incinerar las muestras durante 15 h a 550°C.
Los ésteres metílicos de ácidos grasos de las dietas y del tejido blando del abulón se prepararon por transesterificación con ácido sulfúrico al 1% en metanol, de acuerdo con Christie (1989); luego se purificaron usando filtros de NH2 Sep–pack (Waters SA, Milford, Massachusetts), como lo ha descrito Fox (1990), y se analizaron en un cromatógrafo de gases (Shimadzu GC–14a, Kyoto, Japón) con detector de ionización de flama y una columna capilar (Omega–wax 320, Supelco/Sigma–Aldrich; 30 m x 0.32 mm, con película de 0.25 mm de espesor), usando hidrógeno como gas transportador. Los ácidos grasos después fueron analizados, de acuerdo con Izquierdo et al. (1990), por área y tiempo de retención usando una muestra estándar de 37 PUFAs, y se reportaron como miligramos de cada ácido graso por gramo de materia seca total (alimento o tejido blando).
Análisis estadístico
Se utilizó un análisis de varianza de una vía para evaluar las posibles diferencias entre los tratamientos con las diferentes dietas formuladas. Las diferencias estadísticas entre grupos se determinaron con una prueba de Tukey y se reportaron como estadísticamente significativas a un nivel de P < 0.05 para todos los parámetros biológicos y bioquímicos probados. Los datos, expresados en forma de porcentajes, fueron transformados a su arco seno para su análisis.
Resultados
La composición proximal de las dietas formuladas (tabla 1) mostró contenidos de lípidos similares, entre 5.7% y 6.3%, mientras que la dieta de referencia (Rd) contuvo 4.9% ± 0.7% de lípidos totales. Las dietas fueron diseñadas para contener entre 2.52% y 12.33% de HUFA n3 entre el tratamiento T1 y el T5. Todas las dietas formuladas eran isoproteicas e isoenergéticas (41.3% a 48.1% de proteína cruda y 4.4 a 4.6 Kcal g–1, respectivamente), mientras que Rd contenía 14.6% ± 1.1% de proteína cruda y 4.2 ± 0.0 Kcal g–1 de energía bruta.
Se determinó el perfil completo de ácidos grasos de las diferentes dietas (tabla 2). El HUFA n3 total (expresado como mg g–1 de peso seco) en las dietas formuladas varió entre 1.08 (T1) y 6.92 (T4) en base a peso seco, mientras que el contenido de HUFA n3 en la dieta de referencia fue de 5.3 ± 4.4. Las proporciones EPA/ARA y EPA/DHA también eran diferentes entre las distintas dietas formuladas (tabla 2), con valores entre 0.05 y 6.2, y entre 0.01 y 8.86, respectivamente; mientras que Rd contuvo proporciones EPA/ARA = 4.0 y EPA/DHA = 1.7. La proporción n6/n3 varió de 0.6 a 2.3 en las dietas formuladas, mientras que para Rd ésta fue de 0.4 ± 0.2.
Las dietas formuladas mostraron diferencias significativas en su estabilidad en el agua entre tratamientos, referida como pérdida de materia seca tras 12 h de inmersión. Las dietas T2 y T3 tuvieron una pérdida de 9.0%, mientras que el resto de las dietas perdieron hasta 14.5% (tabla 3). La ingesta de alimento, calculada en materia seca, fue similar entre dietas incluyendo el tratamiento de referencia. A pesar de que la ingesta total de lípidos resultó menor con Rd en comparación con las dietas formuladas, la asimilación de HUFA n3 fue similar para T2, T3 y T5, y menor que la observada con T4, mientras que la ingesta de HUFA n3 con T1 resultó al menos cuatro veces menor que en el resto de los tratamientos. Además, la eficiencia de la conversión alimenticia con Rd fue significativamente mayor que con el resto de los tratamientos.
Con Rd se observó el mayor crecimiento en peso y en longitud, y éste fue significativamente mayor que con las dietas formuladas. No se detectaron diferencias significativas en la tasa de crecimiento específica ni en el incremento total de peso entre los tratamientos con dietas formuladas. Al final del experimento el crecimiento total con Rd había sido de 406.7% (table 3). A lo largo del experimento no se observaron diferencias significativas en la mortalidad entre tratamientos no obstante haberse registrado una gran variación (30.7–11.1%, tabla 3).
Se detectaron diferencias siginificativas en los contenidos de proteína de las vísceras, con los menores valores para T3. En general, el contenido de lípidos fue menor después del experimento para todos los tratamientos en comparación con la muestra inicial, incluso con Rd (table 4). El contenido de ceniza en las vísceras mostró diferencias significativas entre tratamientos, con el valor más alto para T3 (17.9%). La energía bruta también mostró diferencias significativas entre tratamientos, con el menor valor para T3 y el mayor para T5 (4.0 y 5.1 Kcal g–1, respectivamente). Por otra parte, el tejido muscular mostró diferencias significativas en su composición proximal (tabla 4), en la que T2 registró el menor valor de proteína cruda y el mayor de lípidos totales (66.5% y 1.9%, respectivamente), manteniéndose en ambos casos iguales a los de la muestra original. El contenido de ceniza fue mayor con T1, T2 y T3, mientras que la energía bruta en el tejido muscular mostró diferencias significativas en las que T4 tuvo el mayor contenido (5.2 Kcal g–1) y T5 el menor (4.9 Kcal g–1).
Los perfiles de ácidos grasos del tejido blando de abulón variaron entre tratamientos (tabla 5). T1 y T2 mostraron mayores valores del 18:4n3 que los demás tratamientos, mientras que el 20:3n3 se detectó en mayores concentraciones con T2, T3, T4 y T5, en comparación con Rd y T1. El ácido graso 20:4n3 sólo se observó en el tratamiento Rd, mientras que el ARA (20:4n6) no fue detectado en el tejido blando de los tratamientos T3 y T5, y sólo en poca cantidad en el T4. EPA (20:5n3) mostró valores decrecientes (1.0–1.5 mg g–1 p.s.) conforme se incluyó HUFA n3, excepto con T2 (4.6 mg g–1 p.s.). El ácido graso 22:5n3 fue encontrado en el tejido en mayores cantidades que en todas las dietas de tratamientos formulados (de 0.3 a 1.7 mg g–1 p.s.). También se encontró DHA (22:6n3) en todos los tratamientos, en un rango de 2.3 a 0.9 mg g–1 p.s. Los ácidos grasos saturados variaron entre 42.3 y 13.6 mg g–1 p.s. entre tratamientos. La presencia de ácidos grasos n3 totales varió entre 12.0 y 3.0 mg g–1 p.s., de los cuales HUFA n3 contribuyó con entre 9.0 y 2.3 mg g–1 p.s. Los ácidos grasos n6 totales en los tejidos blandos de abulón variarion entre 4.3 y1.7 mg g–1 p.s. La proporción n6/n3 fue 1.0 para T3 y 0.3 para Rd. En cuanto a las proporciones entre ácidos grasos, se observó una gran variación para EPA/ARA (4.2 a 58.5), mientras que para EPA/DHA varió entre 2.2 y 0.8.
Discusión
Las tasas de crecimiento obtenidas con las diferentes dietas experimentales usadas en este estudio fueron menores que las observadas con el tratamiento de referencia (tabla 1). Comparaciones previas entre organismos alimentados con macroalgas frescas y con dietas balanceadas (Viana et al. 1993) han reportado mayores crecimientos entre los alimentados con dietas balanceadas que entre los que ingirieron algas frescas. Shpigel y Neori (1996) encontraron que las algas de un biofiltro tenían un mejor contenido de nutrientes, resultando en un crecimiento adicional (300%) en comparación con algas similares provenientes de un cultivo en agua corriente. Por lo tanto, es de suponer que los nutrientes de las dietas formuladas no funcionaron como se esperaba. Por lo general, para cualquier especie de abulón (Haliotis spp.) se recomienda un contenido graso de 5–6% en la formulación de dietas experimentales (Fleming et al. 1996). En las dietas formuladas para este estudio se utilizó un contenido de HUFA n3 entre 2.52% y 12.33% (de T1 a T5, respectivamente). El objetivo de diseñar dietas con crecientes niveles de HUFA n3 es para evaluar su posible efecto en el desarrollo del abulón. Nuestros resultados muestran que las algas frescas (Rd) indujeron un mejor crecimiento. En estudios previos se ha demostrado que H. fulgens es capaz de sintetizar HUFAs para compensar los efectos de las bajas temperaturas de las aguas donde habita (Durazo–Beltrán et al. 2003b). Aquí, las distintas dietas utilizadas, con perfiles de ácidos grasos claramente diferentes particularmente en HUFA n3, no fueron capaces de inducir diferencias en el perfil correspondiente del tejido muscular. La acumulación de HUFAs permite a los organismos mantener el flujo a través de las membranas a bajas temperaturas. Haliotis tuberculata coccinea vive en aguas más cálidas y parece no necesitar niveles altos de HUFAs de cadena larga, contrariamente a lo observado en abulones de ambientes más fríos. Aquí, con excepción del abulón del tratamiento T2 (9.0 mg g–1), el contenido total de HUFA n3 varió de 2.3 a 4.3 mg g–1, que son valores menores al compararse con 13.98 mg g–1 de HUFA n3 total, reportados para H. fulgens (Durazo–Beltrán et al. 2003a). Es importante señalar que el abulón alimentado con U. rigida mostró mejores tasas de crecimiento y que sus perfiles de ácidos grasos en tejido muscular contuvieron 4.3 mg g–1 p.s. de HUFA n3 y una proporción n6/n3 de 0.3.
No se encontró que la ingesta de dietas con diferentes composiciones diera lugar a diferencias significativas en el crecimiento de los abulones (peso seco), ni aún en el tratamiento con la dieta Rd (referencia), la cual contenía una proporción P/ E de 35 en comparación con 93–105 de las dietas formuladas. Se sabe que para el abulón, como para otras especies acuáticas, los contenidos energéticos de las dieta son importantes para asegurar suficiente energía disponible para su actividad física y mantenimiento, lo que permite que la proteína sea utilizada exclusivamente para el crecimiento (Gómez–Montes et al. 2003). En nuestros experimentos, el mayor crecimiento logrado con Rd (cuya proporción P/E es menor) sugiere que para una misma cantidad de energía había más proteína disponible para el crecimiento. Entonces, la eficiencia en la conversión de energía fue significativamente mayor para el tratamiento con Rd que con cualquiera de las dietas formuladas. La ingesta de alimento aquí reportada (expresada como porcentaje de peso corporal) varió de 4.18% a 5.8% con las dietas formuladas. Estos valores son mucho mayores que los reportados con dietas formuladas similares para H. fulgens (1.4–1.7%) (Gómez–Montes et al. 2003), lo que sugiere que la ingesta de alimento en el presente trabajo pudo haberse sobreestimado. Por esta razón los valores obtenidos de eficiencia en la conversión alimenticia no son precisos, ya que se calcularon a partir de la ingesta alimenticia.
Aun cuando no se encontraron diferencias significativas en el contenido de lípidos de los tejidos blandos (vísceras y músculo) entre los organismos alimentados con las dietas formuladas, el abulón alimentado con U. rigida mostró menor cantidad de lípidos en vísceras y músculo, mientras que tales contenidos fueron ligeramente mayores en los organismos alimentados con la dieta T2. Además, el contenido de HUFA n3 en el músculo de los abulones también fue mayor con T2, siendo el doble del obtenido con el tratamiento Rd y del de la muestra inicial.
Nuestros resultados sugieren que, a diferencia de los abulones de ambientes más fríos, H. tuberculata coccinea no tiene mayores requerimientos de HUFAs; sin embargo, el perfil de ácidos grasos de los tejidos muscular y visceral del abulón puede aún estar modulado por el contenido de ácidos grasos en sus dietas.
Agradecimientos
Este trabajo fue apoyado por el Instituto Canario de Ciencias Marinas (Gran Canaria, España), y se agradece en especial al Grupo de Investigación en Acuacultura y a M Izquierdo. El primer autor agradece la beca de la Agencia Española de Cooperación Internacional (AECI, España) para obtener el doctorado. También agradecemos a E Durazo y L D'Abramo por sus valiosos comentarios al manuscrito.
Referencias
AOAC. 2000. Official Methods of Analysis of AOAC International (17th ed.). V.1 and 2. Association of Official Analytical Chemists, Gaithersburg, USA. [ Links ]
Christie WW. 1989. Gas Chromatography and Lipids: A Practical Guide. The Oily Press, Ayr, Scotland, pp. 67–69. [ Links ]
Dunstan GA, Baillie HJ, Barrett SM, Volkman JK. 1996. Effect of diet on the lipid composition of wild and cultured abalone. Aquaculture 140: 115–127. [ Links ]
Durazo–Beltrán E, D'Abramo LR, Toro–Vásquez JF, Vásquez–Peláez C, Viana MT (2003a). Effect of triacylglycerols in formulated diets on growth and fatty acid composition in tissue of green abalone (Haliotis fulgens). Aquaculture 224: 257–270. [ Links ]
Durazo–Beltrán E, Toro–Vásquez JF, Vásquez–Peláez C, Viana MT (2003b). Effect of the seaweed Macrocystis pyrifera and a formulated diet on growth and fatty acid compostion in the green abalone, Haliotis fulgens, under commercial culture conditions. Cienc. Mar. 29: 645–654. [ Links ]
Fleming AE, Van Barneveld RJ, Hone PW. 1996. The development of artificial diets for abalone: A review and future directions. Aquaculture 140: 5–53. [ Links ]
Folch BJ, Lees M, Sloanestanley GH. 1957. A simple method for the isolation and purification of total lipids from animal tissues. J. Biol. Chem. 226: 497–509. [ Links ]
Fox C. 1990. Studies on polyunsaturated fatty acid nutrition in larvae of marine fish: the herring, Clupea harengus L. Ph.D. thesis, University of Stirling, Scotland, 196 pp. [ Links ]
Gómez–Montes L, García–Esquivel Z, D'Abramo LR, Shimada A, Vásquez–Peláez C, Viana MT. 2003. Effect of dietary protein: Energy ratio on intake growth and metabolism of juvenile green abalone Haliotis fulgens. Aquaculture 220: 769–780. [ Links ]
Gordon HR, Cook PA. 2004. World abalone fisheries and aquaculture. Update: Supply and market dynamics. J. Shellfish Res. 23: 935–939. [ Links ]
Hahn KO. 1989. Survey of the commercially important abalone species in the world. In: Hahn KO (ed.), Handbook of Culture of Abalone and Other Marine Gastropods. CRC Press, Boca Raton, pp. 3–11. [ Links ]
Hopkins KD. 1992. Reporting fish growth: A review of the basics. J. World Aquacult. Soc. 23: 173–179. [ Links ]
Izquierdo MS, Watanabe T, Takeuchi T, Arakawa T, Kitajima C. 1990. Optimum EFA levels in Artemia to meet the EFA requirements of red sea bream (Pagrus major). In: Takeda M, Watanabe T (eds.), The Current Status of Fish Nutrition in Aquaculture. Tokyo Univ. Fisheries, Tokyo, pp. 221–232. [ Links ]
López LM, Viana MT. 1995. Determination of the quality of food elaborated from unheated and heated fish silages for abalone juveniles of Haliotis fulgens. Cienc. Mar. 21: 331–342. [ Links ]
Mai K, Mercer JP, Donlon J. 1995. Comparative studies on the nutrition of two species of abalone, Haliotis tuberculata L. and Haliotis discus hannai Ino. III. Response of abalone to various levels of dietary lipids. Aquaculture 134: 65–80. [ Links ]
Morse DE, Duncan H, Hooker N, Morse A. 1977. Hydrogen peroxide induces spawning in mollusks, with activation of prostaglandin endoperoxide synthetase. Science 196: 298–300. [ Links ]
Sargent JR, Tocher DR, Bell JG. 2002. The lipids. In: Halver JE, Hardy RW (eds.), Fish Nutrition. pp. 182–246. [ Links ]
Shpigel M, Neori A.1996. The integrated culture of seaweed, fish and clams in modular intensive land–based systems: I. Proportions of size and projected revenues. Aquacult. Eng. 15: 313–326. [ Links ]
Tacon A. 1990. Standard Methods for the Nutrition and Feeding of Farmed Fish and Shrimp. Argent Laboratories Press, Washington, 207 pp. [ Links ]
Uki N, Watanabe T. 1992. Review of the nutritional requirements of abalone Haliotis spp. and development of more efficient artificial diets. In: Shepherd SA, Tegner MJ, Guzmán del Próo SA (eds.), Abalone of the World: Biology, Fisheries and Culture. Shepherd, Fishing News Books, Oxford, Part IX (38), pp. 504–517. [ Links ]
Viana MT, López LM, Salas A. 1993. Diet development for juvenile abalone Haliotis fulgens. Evaluation of two artificial diets and macroalgae. Aquaculture 117: 149–156. [ Links ]
Viana MT. 2006. Abalone Aquaculture: An overview. In: Kelly A, Silverstein J (eds.), Aquaculture in the 21st Century. American Fishery Society, Bethesda, pp. 1–24. [ Links ]
Viera MP, Gómez Pinchett JL, Courtois de Vicose G, Bilbao A, Suárez S, Haroun RJ, Izquierdo MS. 2005. Suitability of three red macroalgae as a feed for the abalone Haliotis tuberculata coccinea Reeve. Aquaculture 248: 75–82. [ Links ]
*DESCARGAR VERSIÓN BILINGÜE (INGLÉS–ESPAÑOL) EN FORMATO PDF
Traducido al español por Manuel Gardea–Ojeda














