Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Ciencias marinas
versão impressa ISSN 0185-3880
Cienc. mar vol.35 no.1 Ensenada Mar. 2009
Artículos de investigación
Effect of solar and artificial UV radiation on photosynthetic performance and carbonic anhydrase activity in intertidal macroalgae from southern Spain*
Efecto de la radiación UV solar y artificial sobre la fotosíntesis y la actividad anhidrasa carbónica en macroalgas intermareales del sur de España
B Viñegla1, F López–Figueroa2
1 Ecology Area, Department of Plant Biology, Animal Biology and Ecology, University of Jaén, Faculty of Experimental Sciences (B3–158), Campus Las Lagunillas s/n, E–23071, Jaén, Spain. * E–mail: bvinegla@ujaen.es
2 Ecology Area, Department of Ecology and Geology, University of Málaga, Faculty of Sciences, Campus Universitario de Teatinos s/n, E–29071, Málaga, Spain.
Recibido en diciembre de 2008.
Aceptado en enero de 2009.
Abstract
The effect of UV radiation on photosynthetic rate and carbon uptake, estimated as carbonic anhydrase activity, was studied by incubating intertidal algae, Fucus spiralis (Phaeophyta) and Ulva olivascens (Chlorophyta), under both artificial and solar radiation. In these experiments, treatments excluding UV–B or UV–A + UV–B radiations were applied. Thalli of U. olivascens and F. spiralis showed completely different responses when exposed to artificial radiation and three different light treatments (PAR + UV–A + UV–B, PAR + UV–A, and only PAR). After exposure for 24 h, photosynthetic activity increased in F. spiralis, although the presence of UV–B slightly reduced the increase, whereas U. olivascens showed an inverse pattern, with decreasing photosynthetic rates in all the treatments and with the lowest decrease in the presence of UV–B radiation. Surprisingly, the presence of UV–B stimulated carbon uptake, though this effect was more clear in the case of F spiralis, while a similar inhibitory effect of UV–A radiation was found in both species. Thalli of U. olivascens and F. spiralis were also exposed to solar radiation for daily and yearly periods. The photosynthetic rate was coupled to incident irradiance in F. spiralis, whereas in U. olivascens a significant decrease in the presence of both UV–A or UV–A + UV–B was found. A significant increase of carbon uptake in the presence of UV–B radiation was observed in U. olivascens, while no clear pattern was found in F. spiralis under any of the light treatments. During an annual cycle, carbon uptake in U. olivascens decreased in winter, compared with the initial levels, in the PAR and PAR + UV–A treatments. The high level of carbon uptake was maintained until the end of spring, when higher levels of incident energy might promote photoinhibition (in the presence of UV–B). The absence of a general response to UV radiation in the macroalgae studied may be due to their different photoprotection mechanisms, physiological–morphological characteristics, and acclimation to environmental conditions.
Key words: carbon uptake, carbonic anhydrase activity, intertidal macroalgae, photoinhibition, UV radiation.
Resumen
En este trabajo se estudió el efecto de la radiación UV sobre la tasa de fotosíntesis y la incorporación de C, estimada mediante la actividad anhidrasa carbónica, incubando algas intermareales, i.e., Fucus spiralis (Phaeophyta) y Ulva olivascens (Chlorophyta), bajo radiación solar y artificial. En los experimentos se aplicaron tratamientos de exclusión de la radiación UV–B o UV–A + UV–B. Los talos de U. olivascens y F. spiralis mostraron respuestas completamente diferentes cuando se expusieron a radiación artificial y tres tratamientos de luz (PAR + UV–A + UV–B, PAR + UV–A y sólo PAR). La tasa de fotosíntesis aumentó en F. spiralis tras 24 h de exposición aunque en presencia de radiación UV–B el aumento fue un poco menor. Por otro lado, U. olivascens mostró el patrón contrario, con un descenso de las tasas de fotosíntesis en todos los tratamientos aunque éste fue menor en presencia de radiación UV–B. Por el contrario, la incorporación de C se vio estimulada en presencia de UV–B, siendo este efecto más claro en el caso de F. spiralis mientras que, en presencia de radiación UV–A, se dio un efecto inhibitorio similar en ambas especies. También se expusieron talos de U. olivascens y F. spiralis a radiación solar en periodos diarios y anuales. Existió un acoplamiento de la tasa de fotosíntesis con la irradiancia incidente en F. spiralis, mientras que en U. olivascens se dio un descenso en presencia de radiación UV–A o UV–A + UV–B. En U. olivascens se observó un incremento significativo de la incorporación de C pero no se encontró un patrón claro en ninguno de los tratamientos de luz en F. spiralis. Durante un ciclo anual la incorporación de C en U. olivascens disminuyó en comparación con los valores iniciales en los tratamientos PAR y PAR + UV–A durante el invierno. Los altos valores de incorporación de C se mantuvieron hasta el final de la primavera cuando los elevados niveles de energía incidente podrían estimular la fotoinhibición en presencia de UV–B. La ausencia de una respuesta general a la radiación UV en las microalgas estudiadas podría deberse a sus diferentes mecanismos de fotoprotección, a sus características fisiológicas–morfológicas y a su aclimatación a las condiciones ambientales particulares.
Palabras clave: actividad anhidrasa carbónica, fotoinhibición, incorporación de C, macroalgas intermareales, radiación UV.
Introducción
La luz es el principal factor ambiental que controla la actividad fisiológica de las macroalgas, tanto como fuente de energía como señal lumínica (Häder y Figueroa 1997). La radiación fotosintéticamente activa (PAR) provee de energía para la incorporación de nutrientes y la asimilación de carbono a través de la fotosíntesis. Por otro lado, longitudes de onda específicas en las regiones de PAR y UV del espectro representan señales ambientales para muchos de estos procesos mediante la acción de fotorreceptores fotomorfogénicos (Rüdiger y López–Figueroa 1992, Dring et al. 1996, Gordillo et al. 2004). Diferentes autores han mostrado en algas el papel de los fotorreceptores de radiación UV–B, UV–A, azul, verde y rojo/rojo lejano, involucrados en el control de la asimilación de nutrientes, i.e., incorporación de nitrógeno (Quiñones y Aparicio 1990, Rüdiger y López–Figueroa 1992, Döhler et al. 1995, Braune y Döhler 1996). Sin embargo, existen pocos trabajos que aborden el control de la calidad de luz sobre la actividad anhidrasa carbónica (Gómez et al. 1998, Flores–Moya et al. 1998, Figueroa y Viñegla 2001, Viñegla et al. 2006).
La luz muestra grandes fluctuaciones en su cantidad y su calidad espectral (Kirk 1976, Häder y Figueroa 1997, Villafañe et al. 2003). En especial se ha descrito a la radiación UV como la que estimula diferentes procesos en microalgas como la alteración del contenido pigmentario (Figueroa et al. 1997, 2003b), la acumulación de pigmentos fotoprotectores (Gómez et al. 1998, Karsten et al. 1999, Koibee et al. 2005), cambios en los patrones de mobilidad y orientación (Gerber y Häder 1993) o la inhibición del crecimiento (Altamirano et al. 2000a, b, 2003; Bañares et al. 2002). El aumento de la radiación UV como consecuencia de la disminución del grosor de la capa de ozono estratosférico (Frederick et al. 1993) ha sometido a las micro–algas a un mayor estrés lumínico, especialmente en ecosistemas semilitorales (Häder y Figueroa 1997, Bischof et al. 2006). Se han descrito numerosos efectos negativos de la radiación UV, como la formación de dímeros de timina en el ADN (van de Poll et al. 2001, Roleda et al. 2006), la fotoinhibición de la fotosíntesis (Flores–Moya et al. 1998) o la inhibición de la incorporación de nutrientes (Döhler et al. 1995). Por otro lado, la radiación UV–B puede tener efectos positivos sobre la fotosíntesis de macrófitos marinos aclimatados a alta irradiancia (Flores–Moya et al. 1999, Figueroa et al. 2002) y sobre la incorporación de N inorgánico (Kumar et al. 1996).
Ya antes se ha propuesto la relación de los mecanismos de concentración de carbono con la disponibilidad de energía lumínica en microalgas intermareales, aunque no con la disponibilidad de carbono inorgánico (Mercado et al. 1998). La interacción entre ambos factores puede dar lugar a mecanismos de aclimatación del aparato fotosintético que pueden tener efectos indirectos sobre los mecanismos de concentración de carbono (Mercado et al. 1998) y otros procesos fisiológicos como la asimilación de N (Viñegla et al. 2006). En este sentido, las algas intermareales bajo condiciones de desecación moderada presentan mayores tasas fotosintéticas (Mercado et al. 1998) y de incorporación de carbono (Flores–Moya et al. 1998). En cualquier caso, su posición en la costa implica que se verán sometidas a mayores niveles de radiación UV, con posibles consecuencias en la fotoinhibición de la fotosíntesis o la incorporación de C.
En este trabajo se discuten las diferentes respuestas de Fucus spiralis L (Phaeophytae) y Ulva olivascens Dangeard (Chlorophytae) a la exposición a radiación artificial y natural, a corto (24 horas de luz continua o un ciclo diario de radiación solar) y largo plazo (ciclo anual bajo radiación solar).
Material y métodos
Material vegetal y condiciones de pre–incubación
Los experimentos presentados en este trabajo fueron realizados con talos sanos y limpios de las microalgas intermareales Fucus spiralis y Ulva olivascens. En todos los casos los talos fueron recogidos en la costa rocosa intermareal de Tarifa (sur de España) (36°00' N, 05°36' O) y transportados inmediatamente al laboratorio a 4°C y en oscuridad. En el laboratorio los talos fueron preincubados durante al menos dos días en agua de mar natural con aireación a 17°C, bajo luz blanca, con un foto–periodo luz:oscuridad de 12:12 horas y una irradiancia de 21.7 W m–2. La luz provenía de una lámpara fluorescente F20 W/ CW (Osram, Alemania).
Tratamientos de luz
Independientemente de la fuente de luz aplicada en cada tratamiento (natural o artificial), se usaron los mismos tratamientos de calidad de luz en los sistemas experimentales empleados en este trabajo: (1) PAR + UV–A + UV–B, denominado PAB a partir de aquí; (2) PAR + UV–A, en adelante PA, y (3) sólo PAR. Para aplicar estos tratamientos de luz se situaron diferentes filtros que elminan UV sobre los cultivos durante la incubación como lo han descrito Figueroa et al. (1997). Así, se emplearon: (1) un filtro Ultraphan 295 (Digefra GmbH, Alemania), que excluye la radiación UV–C, para lograr el tratamiento PAB, (2) un filtro Folex 320 (Folex GmbH, Alemania), que excluye UV–C y UV–B, para lograr el tratamiento PA, y (3) un filtro Ultraphan 395 (Digefra GmbH, Alemania), que excluye las radiaciones UV–A, UV–B y UV–C, para lograr el tratamiento PAR.
La irradiancia de los tratamientos de luz se midió con un espectrorradiómetro Licor–1800 UW (LiCor Inc., EE.UU.) equipado con un sensor plano con corrección de coseno (2 ).
).
Metabolismo del C bajo radiación artificial a corto plazo
Se aclimataron algas de las dos especies (70–80 mg por talo individual para una biomasa total de 50 g de peso fresco) durante tres días en acuarios opacos a UV con 0.5 L de agua de mar natural filtrada y con aireación. Las condiciones de cultivo fueron de 17°C de temperatura y luz tenue. Tras el periodo de aclimatación, los talos fueron expuestos durante 24 horas a radiación artificial. La radiación fotosintéticamente activa (PAR, λ = 400 – 700 nm) se aplicó mediante una lámpara True Light Plus (DuroTest, USA), obteniéndose la radiación UV–A (λ = 315 – 400 nm) y UV–B (X = 280 – 315 nm) de lámparas Q–Panel 340 (Q–Panel, USA) y TL40 W/12 (Philips, The Netherlands), respectivamente. Las irradiancias aplicadas en las tres bandas se muestran en la tabla 1.
Metabolismo del C bajo radiación solar a corto plazo (ciclo diario)
Como se describió anteriormente, aproximadamente 50 g de peso fresco de las algas F. spiralis y U. olivascens se sacaron de los sistemas de pre–incubación y se aclimataron durante tres días bajo radiación solar en el tejado del laboratorio. El periodo de aclimatación se desarrolló en condiciones controladas de temperatura (ca. 17°C) para evitar los efectos de la alta temperatura durante el mediodía bajo radiación solar. Durante este periodo cada sistema experimental de talos fue cubierto con uno de los filtros para eliminar luz, aplicados al azar, para aclimatar los talos a los tratamientos. Tras el periodo de aclimatación se evaluó la actividad fisiológica de los talos durante un ciclo diario con una periodicidad de 2 horas, desde las 9:30 a las 19:30, hora local, en los tres tratamientos aplicados con los filtros de corte: PAB (radiación PAR + UV–A + UV–B), PA (radiación PAR + UV–A) y PAR (exclusión de la radiación UV). En la tabla 1 se muestran los valores de irradiancia en los tratamientos PAB, PA y PAR durante el ciclo diario.
Metabolismo del C bajo radiación solar a largo plazo (ciclo anual)
Para evaluar el efecto de la radiación solar sobre la actividad fotosintética de las macroalgas intermareales sólo se emplearon talos de U. olivascens, ya que no se encontraron talos de F. spiralis durante el periodo de verano en la costa rocosa en que se realizaron los muestreos.
En este caso se empleó un procedimiento ligeramente distinto al aplicado en el sistema experimental descrito anteriormente, a corto plazo bajo radiación solar. Así, la actividad anhidrasa carbónica total, considerada como un estimador del mecanismo de concentración de carbono, se determinó en talos directamente transportados desde la costa al laboratorio, inmediatamente después de un corto periodo de aclimatación (2 horas bajo luz tenue y 17°C) aplicado para permitir la recuperación de los talos del periodo a 4°C. El resto de los talos se pre–incubaron en el laboratorio como ya se ha descrito y, a continuación, se expusieron durante tres días a radiación solar y a los tres tratamientos de luz (PAB, PA y PAR) en el tejado del laboratorio, a una temperatura constante de 17°C en bandejas blancas con aeración. Al final del periodo de exposición se determinó la actividad anhidrasa carbónica en el mismo momento del día que en los talos no expuestos (iniciales).
Este procedimiento se repitió durante un ciclo anual completo, de julio 1997 a julio 1998, para poner de manifiesto la dependencia de los mecanismos de concentración de carbono respecto a la calidad (tratamientos de luz) y la dosis de luz (variaciones estacionales de la radiación solar). En la tabla 1 se muestran los valores de la dosis de luz recibida por los talos en este experimento.
Actividad fotosintética (evolución de O2)
El valor de la tasa neta de fotosíntesis en condiciones de luz saturante se determinó en talos de F. spiralis y U. olivascens mediante la medida de evolución de O2 en curvas fotosíntesis vs irradiancia. Los talos fueron expuestos a las diferentes irradiancias en una cámara de Plexiglás transparente hecha a medida (10 mL de volumen), equipada con agitación magnética y un electrodo de oxígeno tipo Clark YSI 5331 (Yellow Springs Inc., EE.UU.), a una temperatura constante de 17°C. Se incubaron 0.15 g de peso fresco durante 5 minutos en cada una de las irradiancias empleadas, de 0 a 1200 | mol de fotones m–2 s–1. La tasa neta de fotosíntesis se determinó como la pendiente de una tasa constante de evolución de O2, alcanzada tras ca. 1–2 minutos desde el cambio de irradiancia. La respiración en oscuridad se determinó al comienzo del procedimiento incubando los talos en oscuridad durante 15 minutos.
Finalmente, la tasa neta de fotosíntesis bajo irradiancia saturante fue estimada a partir del ajuste de los datos experimentales de evolución de O2 vs irradiancia, de acuerdo con la ecuación propuesta por Jassby y Platt (1976):

donde TFB es la tasa de fotosíntesis bruta, TFNmax es la tasa de fotosíntesis neta bajo irradiancia saturante, tanh es la función tangente hiperbólica, α es la eficiencia fotosintética, E la irradiancia de incubación (energía incidente) y Rd la tasa de respiración en oscuridad.
Tasa relativa de transporte electrónico (parámetros de fluorescencia in vivo)
La tasa relativa de transporte electrónico (rTTE) es un estimador indirecto no destructivo de la actividad fotosintética (Büchel y Wilhelm 1993) y es una buena medida alternativa a la tasa de transporte electrónico cuando es difícil calcular la absortancia de los talos. Para determinar rTTE se midió la fluorescencia de la clorofila a en el fotosistema II, inducida in vivo empleando un fluorímetro de amplitud modulada PAM–2000 (Waltz GmbH, Alemania) de acuerdo con el procedimiento descrito por Schreiber et al. (1995), expresando rTTE como:
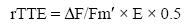
siendo ΔF/Fm' el rendimiento cuántico efectivo de fluorescencia del fotosistema II y E la irradiancia incidente. ΔF/Fm' fue determinado in situ bajo la irradiancia de incubación y calculado de acuerdo con Krause y Weiss (1991):
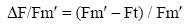
siendo ΔF la diferencia entre Fm', la fluorescencia máxima en el estado adaptado a luz, y Ft, el nivel transitorio de fluorescencia en el estado excitado bajo la irradiancia de incubación, con un determinado número de centros de reacción del fotosistema II en estado reducido.
La relación entre la tasa de transporte electrónico y la tasa de fotosíntesis bruta ya ha sido descrita en numerosas ocasiones (Figueroa et al. 2003a, Cabello–Pasini y Figueroa 2005).
Actividad anhidrasa carbónica total
La actividad anhidrasa carbónica (AC) total fue determinada mediante el método potenciométrico descrito por Haglund et al. (1992). Se lavaron pequeños trozos de talo (ca. 10–20 mg peso fresco) con agua destilada y se introdujeron en una cubeta de 3 mL en presencia de un tampón de ensayo (50 mM de TRIS, 25 mM de ácido ascórbico y 5 mM de EDTA). La reacción se inició añadiendo 1 mL de agua destilada a 4°C y saturada en CO2 al medio de ensayo y midiendo a continuación el tiempo necesario para una caída lineal de pH en el rango de 8.5 a 7.5. Así, una unidad de actividad enzimática relativa (AER) se definió como (to/tc) – 1, donde to y tc son los tiempos necesarios para el cambio de pH en ausencia y presencia del talo, respectivamente.
Análisis estadístico
Los datos de rTTE se calcularon como la media de 6 medidas independientes en tres talos distintos. En el caso de la evolución fotosintética de O2 y la actividad AC total, los datos se obtuvieron de tres talos diferentes en cada momento de muestreo.
Los datos de los tratamientos de luz fueron comparados mediante un análisis de varianza de una vía, mientras que los datos del mismo tratamiento en diferentes momentos del tiempo se compararon mediante un análisis de la varianza de medidas repetidas. Tras los análisis de la varianza se aplicó a los datos la prueba a posteriori LSD de Fisher (Sokal y Rolf 1995). La significancia se comprobó a un nivel de α = 0.01. Los requerimientos de normalidad (test de Kolmogorov–Smirnov) y homocedasticidad (test F de Bartlett) también fueron comprobados a un nivel de significancia α = 0.01.
Resultados
Metabolismo del C bajo radiación artificial a corto plazo
A pesar de que la actividad fotosintética mostró valores en un rango similar para F. spiralis y U. olivascens tras la incubación durante 24 horas bajo radiación artificial, se encontró un patrón diferente bajo los tratamientos de luz. Tras el periodo de incubación se dio un aumento de la tasa de fotosíntesis en F. spiralis, alcanzando un valor cuatro veces mayor en el tratamiento PA. El menor incremento se encontró en el tratamiento PAB, lo que sugiere un efecto inhibitorio de la radiación UV–B que puede ser compensado en presencia de radiación UV–A. Sin embargo, en U. olivascens se encontró el patrón contrario, con menores tasas netas de fotosíntesis tras la incubación en comparación con las iniciales. En este caso, la presencia de radiación UV parece ser necesaria para mantener los niveles de actividad fotosintética bajo radiación solar, ya que se encontró un descenso del 50% en el tratamiento PAB mientras que en los tratamientos PA y PAR se dio un descenso de 75 y 83%, respectivamente.
Por otro lado, la actividad AC total mostró un patrón similar en ambas especies aunque en diferentes rangos de variación. En este sentido, los valores de actividad AC total fueron un orden de magnitud mayor en los talos de F. spiralis que en los de U. olivascens (tabla 2), lo que puede estar reflejando los diferentes mecanismos de concentración de carbono de ambas especies de acuerdo con su distribución en la zona intermareal. Después del periodo de incubación bajo radiación artificial se dio un aumento de la actividad AC total en ambas especies. Este aumento fue claramente mayor en el tratamiento PAB en el caso de F. spiralis, lo que permite relacionar esta estimulación de la incorporación de C con la encontrada para la asimilación fotosintética de C. En el caso de U. olivascens se dio un aumento similar en los tratamientos PAB y PAR, probablemente relacionado con la inhibición de la actividad fotosintética antes mencionada.
Metabolismo del C bajo radiación solar a corto plazo (ciclo diario)
Como se describió anteriormente bajo radiación artificial, al estimar la actividad fotosintética mediante la tasa de transporte electrónico se encontró una respuesta diferente en F. spiralis y U. olivascens. Así, la evolución de la rTTE a lo largo del ciclo diario en los tres tratamientos de luz estuvo acoplada con la irradiancia incidente en F. spiralis (fig. 1a), con valores significativamente mayores en torno al mediodía, en comparación con los valores de los periodos inicial y final del día. Este fue un patrón común para los tres tratamientos de luz, dado que no se encontraron diferencias significativas entre éstos en ningún momento del día. Sólo se encontraron diferencias marginales en torno al mediodía en el tratamiento PA, en el que se encontraron valores ligeramente menores que los hallados en los tratamientos PAB y PAR. Sin embargo, en U. olivascens se dieron descensos significativos (P < 0.01) a las 13:30 h en el tratamiento PA y a las 15:30 h en el tratamiento PAB, cuando se compararon estos valores con los hallados a las 11:30 h (fig. 1b). Más aún, este descenso no se recuperó completamente en el tratamiento PA, mientras que en el tratamiento PAB sí se dio un aumento significativo, alcanzando los valores previos. Finalmente, en ausencia de radiación UV (tratamiento PAR) sólo se dio un descenso marginal de la actividad fotosintética al mediodía.

En el caso de la incorporación de C no se vio un efecto claro en F. spiralis hasta el final del día, cuando se produjo un aumento significativo de la actividad AC total simultáneamente con el descenso final de rTTE. Este incremento fue prácticamente lineal en los tratamientos PA y PAR, mientras que en el tratamiento PAB todavía se produjo un pequeño descenso al final de la tarde (fig. 2a).

Por otro lado, la actividad AC total medida en los talos de U. olivascens mostró un incremento significativo en los tres tratamientos de luz aunque su magnitud y el momento en que ocurrió dependió del tratamiento (fig. 2b). Así, el mayor incremento se produjo en talos que habían estado expuestos a radiación UV, especialmente radiación UV–B. Además, el incremento comenzó a las 13:00 h en el tratamiento PAB con niveles en torno a 150 unidades enzimáticas relativas (UER) g–1 peso fresco hasta las 15:30 h. En el caso del tratamiento PA, la actividad AC total sólo alcanzó 100 UER g–1 peso fresco a las 15:30 h. Finalmente, este nivel de actividad AC total también se encontró en el tratamiento PAR pero sólo al final del día, en torno a las 17:30 h.
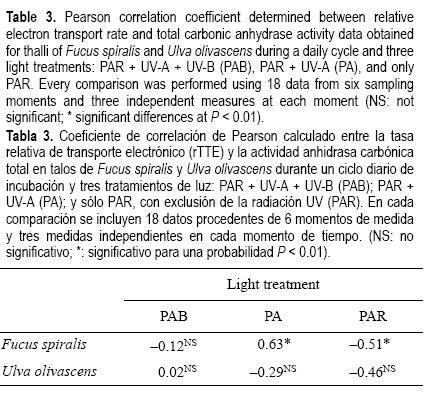
Para poner de manifiesto los posibles procesos de acoplamiento entre la transferencia de energía durante el proceso fotosintético y la incorporación de C debida a la actividad AC se calculó el coeficiente de correlación de Pearson entre los datos de rTTE y de actividad AC total del ciclo diario, en los tres tratamientos de luz y las dos especies. Mientras que para los tratamientos PAB, PA o PAR en U. olivascens no existió una correlación significativa, si se encontró una correlación negativa significativa para los talos de F. spiralis incubados en los tratamientos PA y PAR (PA: r = –0.63; PAR: r = –0.51; P < 0.01), pero no fue posible calcular una correlación significativa para el tratamiento PAB.
Metabolismo del C bajo radiación solar a largo plazo (ciclo anual)
La incorporación de carbono en los talos de U. olivacens mostró un patrón muy claro durante el ciclo anual. Las medidas realizadas en los talos directamente traídos de la costa mostraron que los menores valores de actividad AC total se dieron al final de la primavera y el verano, lo que sugiere que la actividad de incorporación de C puede ser inhibida por la irradiancia incidente (fig. 3a).
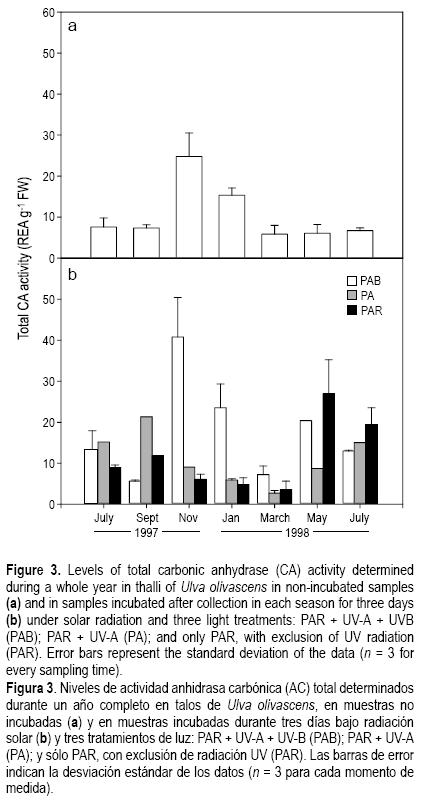
Después de los tres días de incubación bajo la radiación solar los mayores niveles de actividad AC total fueron encontrados en el tratamiento PAB, especialmente durante el invierno (fig 3b). Así, en el tratamiento PAB la actividad AC total mostró un 59% de incremento en comparación con el valor inicial mientras que en los tratamientos PA y PAR se encontró un descenso de 62 y 72%, respectivamente.
Los altos niveles de actividad AC total del tratamiento PAR se mantuvieron hasta el final de la primavera. De ahí en adelante, los elevados niveles de energía incidente podrían estar estimulando la fotoinhibición de la actividad fotosintética y la consecuente pérdida de energía para los mecanismos de concentración de carbono.
En los tratamientos PA y PAR se encontró un patrón diferente ya que el mayor descenso de la actividad AC total se encontró durante el invierno, en comparación con los valores iniciales, y los mayores niveles de actividad se encontraron al comienzo y al final del verano en los tratamientos PA y PAR, respectivamente.
En la figura 4 se muestra la relación entre la actividad AC total y la dosis lumínica durante el periodo experimental. Se representan en este caso los valores de la actividad de incorporación de C representados en la figura 3, pero en este caso frente a la dosis de luz (sumando la radiación PAR, UV–A y UV–B) recibida durante el periodo de 3 días de exposición a radiación solar.
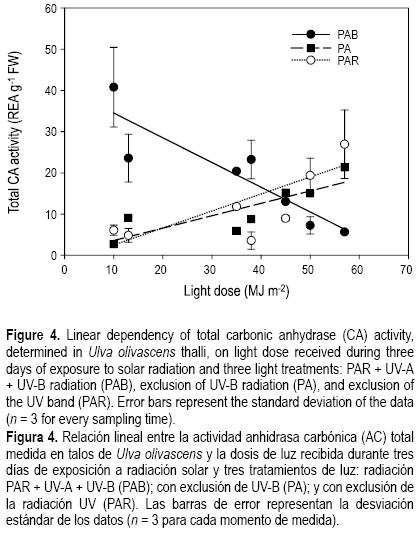
De forma similar a lo mostrado en la figura 3, la radiación UV–B estimula la actividad AC total pero únicamente a valores bajos de dosis. Este efecto estimulador no sólo depende de la calidad de luz sino también de la cantidad de energía recibida, ya que a altos niveles de radiación UV–B la inhibición de la actividad fue mayor, i.e., se observó una correlación lineal negativa y significativa entre la actividad AC total y la dosis de luz (tabla 3). Además, se encontró una relación inversa pero prácticamente idéntica en los tratamientos PA y PAR, donde el incremento de la dosis estimuló la actividad AC total, aunque sin alcanzar los valores iniciales observados bajo la radiación UV–B.
Discusión
Metabolismo del C bajo radiación artificial
Las diferentes respuestas encontradas en F. spiralis y U. olivascens en condiciones de laboratorio pueden ser explicadas por su aclimatación previa a las condiciones naturales. Fucus spiralis se localiza en la parte superior del intermareal mientras que U. olivascens se sitúa por debajo de la otra especie, entre la zona inferior del intermareal y la zona submareal. Así, mientras que F. spiralis puede verse sometida a diferentes ciclos de desecación y rehumedecimiento, más o menos intensos dependiendo de la época del año y otras condiciones ambientales que pueden, por tanto, afectar la disponibilidad de C (e.g., CO2 atmosférico durante los periodos de desecación en marea baja), la incorporación de C inorgánico en U. olivascens podría depender únicamente de la cantidad de HCO3– disuelto. Para adecuarse a esta variable ambiental, los talos de F. spiralis han optimizado sus mecanismos de incorporación de C, particularmente los relacionados con la actividad AC externa (Mercado et al. 1998), lo que podría explicar el rango de actividad que presenta en comparación con el de U. olivascens.
La zonación respecto a la profundidad de F. spiralis y U. olivascens en el medio natural podría también explicar los diferentes mecanismos de concentración de C y los procesos de asimilación de C observados bajo radiación artificial. Estudios ecofisiológicos indican que existe una buena correlación entre la tolerancia al estrés, i.e., la radiación UV, y la distribución vertical de las macroalgas (Hanelt 1998). En general, existe una relación entre la sensibilidad de las especies al estrés por radiación solar y la distribución en profundidad (Maegawa et al. 1993, Bischof et al. 1998, Gómez et al. 2004).
Más aún, las condiciones ambientales presentes en la zona superior del intermareal implican también altos niveles de irradiancia durante la mayor parte del día y durante largos periodos del año, especialmente en la costa sur de España. En este sentido, es de esperar que F. spiralis esté adaptada a recibir altos niveles de radiación solar, incluyendo la fracción UV. En este sentido, Jiménez et al. (1998) han demostrado que los niveles de fotoinhibición y recuperación en diferentes macroalgas del sur de España están relacionados con su historia previa de exposición a la luz. Bajo radiación artificial se encontró una respuesta inversa en F. spiralis y U. olivascens, con un descenso generalizado en la actividad fotosintética en ésta última en todos los tratamientos de luz, lo que podría ser una señal de fotoinhibición. En cualquier caso, este efecto inhibitorio fue menor en presencia de radiación UV–B, como ha sido mostrado previamente por otros autores (Bischof et al. 2002).
Metabolismo del C bajo radiación solar a corto plazo (ciclo diario)
En diversas ocasiones se han descrito distintos ritmos diarios de variación de la actividad fotosintética (Flores y Herrero 1994, Mori et al. 1996). En este trabajo, durante el ciclo diario se encontró un efecto fotoinhibitorio general de la radiación solar al mediodía, aunque éste fue mayor en ausencia de radiación UV–B (tratamientos PA y PAR). Bischoff et al. (2002) mostraron que durante ciclos diarios bajo radiación solar se estimuló la fotoinhibición, aunque esta estimulación fue mayor en muestras incubadas bajo radiación PAR que en presencia de radiación UV. Dado que en el intermareal lo normal es la presencia de radiación UV y, la exclusión de esta banda no es sino una manipulación experimental, nuestros resultados muestran que la presencia de radiación UV–B, en cierto rango de variación, puede estar actuando como una señal ambiental a través de la cual se activan los mecanismos de concentración de carbono de manera que se emplee la energía disponible durante el periodo central del día.
Algunos autores también han mostrado que la respuesta de fotoinhibición dinámica puede estar relacionada con la aclimatación a la radiación UV (Häder et al. 1996, Figueroa et al. 1997, Flores–Moya et al. 1998, Figueroa et al. 2003). Los ciclos diarios descritos en Rissoella verruculosa (Flores–Moya et al. 1998) y Plocamium cartilagineum (Viñegla 2000, Figueroa y Viñegla 2001) son similares a los encontrados en este trabajo para F. spiralis y U. olivascens, respectivamente. En este sentido, la localización de R. verruculosa en la zona intermareal es análoga a la de F. spiralis, también sometida a ciclos de secado–rehumedecimiento a lo largo del día. De la misma forma, P. cartilagineum se localiza habitualmente en la zona submareal o dentro de refugios rocosos, en condiciones de luz tenue. Teniendo en cuanta estas analogías, la localización de las algas en la zona intermareal y su régimen de exposición a radiación solar podrían explicar los cambios en la actividad fotosintética.
Si la energía generada en el proceso fotosintético se acopla con los mecanismos de concentración de carbono, la ausencia de actividad durante el mediodía debería reflejarse en la actividad AC. También lo contrario debe ocurrir bajo ciertas condiciones, ya que el aumento del transporte fotosintético de electrones al mediodía, dependiente del carbono asimilado previamente, debe actuar como una señal de demanda de nuevos incrementos en la incorporación de C, como se ha demostrado previamente (Viñegla et al. 2006). Un aumento similar de la actividad AC total bajo tratamientos PAB y PA ha sido mostrado para Dasycladus vermicularis (Gómez et al. 1998), como en el caso de U. olivascens en el presente trabajo, mostrando incluso la ausencia de efecto de la radiación PAR sobre la actividad. Esto sugiere de nuevo que la banda espectral de UV es una señal ambiental que es capaz de estimular la actividad en U. olivascens cuando se expone a radiación solar. Este resultado también está de acuerdo con los ritmos diarios mostrados por otras macroalgas como Ulva fenestrata (Gao et al. 1992) y Gracilaria tenuistipitata (Lopes et al. 1997) de ambientes lumínicos suaves. En el caso de F. spiralis parece haber un sistema bien acoplado en el que la cadena fotosintética de transporte de electrones genera la energía necesaria para los mecanismos de concentración de carbono. Esto explicaría el retraso en la estimulación de la actividad AC total en comparación con el máximo de rTTE. Por tanto, un proceso secuencial e interdependiente de incorporación de C, asimilación de C, síntesis de energía y de nuevo incorporación de C parece tener lugar durante un ciclo diario.
La ausencia de correlación entre rTTE y la actividad AC total en U. olivascens, i.e., entre la síntesis de energía mediante la fotosíntesis y la incorporación de C, se debe probablemente a la inhibición de la fotosíntesis bajo radiación solar, y la correlación negativa significativa encontrada en F. spiralis en los tratamientos PA y PAR puede estar indicando el acoplamiento de este proceso secuencial. En el caso del tratamiento PAB en F. spiralis debe estar presente un proceso más complejo, ya que debe estar presente el efecto mezclado de la calidad (señal lumínica) y la cantidad de luz (energía). Por tanto, aunque se encontraran altos niveles de actividad AC total en el tratamiento PAB durante la mayor parte del día, i.e., una respuesta a la señal lumínica asociada a la presencia de UV–B, un proceso que dependa no sólo de la calidad de luz sino también de la dosis podría explicar el descenso de la actividad AC total en el tratamiento PAB al final del día.
En U. olivascens, la combinación de ambos elementos, la presencia de radiación UV y su cantidad en cada banda espectral, es lo que está determinando la modulación diaria del proceso de estimulación. La probable alteración del balance entre la calidad de luz y su cantidad en el experimento de radiación artificial, podría explicar la ausencia de incremento en los resultados mencionados anteriormente tras 24 h de exposición a radiación artificial.
Metabolismo del C bajo radiación solar a largo plazo (ciclo annual)
La evolución anual de la actividad AC total en plantas traídas del intermareal indica la inhibición de los mecanismos de concentración de C durante los periodos de mayor energía incidente, tanto directamente como a través de la inhibición de la asimilación de C y la síntesis de energía asociada durante la fotosíntesis (fig. 3a). Esto debe estar relacionado con la presencia de radiación UV–B en el espectro de radiación recibido por las plantas en el campo, de acuerdo con las implicaciones ecológicas del papel benéfico de la radiación UV–B en plantas bien aclimatadas a intensa irradiancia (Flores–Moya et al. 1998, Figueroa et al. 2002). El efecto benéfico a largo plazo de la radiación UV–B contrasta con sus efectos negativos sobre la fotosíntesis a corto plazo (pocas horas o un día de exposición) observado en diferentes especies de Ulva (Figueroa et al. 2003b). Estos resultados señalan la importancia de la escala temporal en los estudios fotobiológicos (Villafañe et al. 2003). A corto plazo la radiación UV–B provocó la fotoinhibición de la fotosíntesis y el crecimiento, pero aumentar el tiempo de exposición no sólo redujo la fotoinhibición sino que además aumentó la fotosíntesis y el crecimiento en distintas especies de Ulva (Altamirano et al. 2000 a, b, Figueroa et al. 2003b). Entre los procesos de aclimatación en las especies de Ulva se incluyen la acumulación de compuestos que absorben UV–B y un aumento de la actividad antioxidante (Han y Han 2005). También se han encontrado efectos beneficiosos de la radiación UV–B sobre la recuperación de la fotosíntesis en algas pardas como Dictyota dichotoma (Flores–Moya et al. 1999). La radiación UV también estimuló la acumulación de sustancias pantalla frente al UV en algas pardas, incluyendo especies de Fucus, como los compuestos fenólicos (Pavia et al. 1997, Henry y van Alstyne 2004, Abdala–Díaz et al. 2006).
Al incubarse mediante los tratamientos PAB, PA y PAR los talos recolectados en el intermareal a lo largo del año, la respuesta pareció depender no sólo de la dosis sino también de la calidad de luz, ya que los mayores niveles de actividad AC total se encontraron en el tratamiento PAB (fig. 3b). De hecho, es posible sugerir una respuesta más compleja, ya que la calidad de luz es el factor más importante, actuando como una señal lumínica para la incorporación y asimilación de C en condiciones de baja dosis de luz. Esto explicaría los altos niveles de actividad AC total durante el otoño y el invierno en el tratamiento PAB. Sin embargo, durante el verano, con altos niveles de radiación, la dosis de luz asociada a la radiación UV–B se convierte en el factor determinante de la inhibición. Esta podría ser la razón de la activación enzimática en el tratamiento PAR durante el verano.
De la misma manera, la respuesta lineal de la actividad AC total frente a la dosis de luz (fig. 4) indica también esta dependencia de la calidad y la intensidad de luz. Así, los mayores niveles de actividad se encontraron en el tratamiento PAB con bajos niveles de dosis, disminuyendo la actividad a medida que aumentaba la dosis, mientras que en los tratamientos PA y PAR se encontró el patrón contrario. Además del efecto de la dosis de luz, parece que la radiación UV, especialmente UV–B, actúa como un detonador ambiental que puede estimular los procesos fisiológicos en un proceso secuencial donde la síntesis fotosintética de energía puede ser usada en los mecanismos de concentración de carbono.
Aunque se han mostrado respuestas de estimulación de la fotosíntesis o la incorporación de C bajo radiación UV–B en las dos especies estudiadas en condiciones de baja dosis, no se ha hallado una respuesta general a este tipo de radiación, probablemente debido a las características fisiológicas y morfológicas específicas de los talos y sus mecanismos fotoprotectores. La relación entre la morfología y la respuesta a la radiación UV ha sido ya discutida previamente en varios trabajos (Bañares et al. 2002; Gómez et al. 2004, 2005; Bishof et al. 2006).
Agradecimientos
Este trabajo fue financiado por el proyecto de la Unión Europea ENV4–CT96–0188 y por el Ministerio de Educación y Ciencia español (proyecto AGL2005–02655).
Referencias
Abdala–Díaz RT, Cabello–Pasini A, Pérez–Rodríguez E, Conde–Alvarez RM , Figueroa FL. 2006. Daily and seasonal variations of optimum quantum yield and phenolic compounds in Cystoseira tamariscifolia (Phaeophyta). Mar. Biol. 148: 459–465. [ Links ]
Altamirano M, Flores–Moya A, Figueroa FL. 2000a. Long–term effect of natural sunlight under various ultraviolet radiation conditions on growth and photosynthesis of intertidal Ulva rigida (Chlorophyceae) cultivated in situ. Bot. Mar. 43: 119–126. [ Links ]
Altamirano M, Flores–Moya A, Conde F, Figueroa FL. 2000b. Growth seasonality, photosynthetic pigments and C and N content in relation to environmental factors: A field study on Ulva olivascens (Ulvales, Chlorophyta). Phycologia 39: 50–58. [ Links ]
Altamirano M, Flores–Moya A, Figueroa FL. 2003. Effects of UV radiation and temperature on growth germlings of three species of Fucus (Phaeophyceae). Aquat. Bot. 75: 9–20. [ Links ]
Bañares E, Altamirano M, Figueroa FL, Flores–Moya A. 2002. Influence of UV radiation on growth of sporelings of three non–geliculate coralline red algae from southern Iberian Peninsula. Phycol. Res. 50: 23–30. [ Links ]
Bischof K, Hanelt D, Wienke C. 1998. UV–radiation can affect depth–zonation of Antarctic macroalgae. Mar. Biol. 131: 597–605. [ Links ]
Bischof K, Peralta G, Krabs G, van de Poll WH, Pérez–Llorens JL, Breeman AM. 2002. Effects of solar UV–B radiation on canopy structure of Ulva communities from southern Spain. J. Exp. Bot. 53: 2411–2421. [ Links ]
Bischof K, Gómez I, Molis M, Hanelt D, Karsten U, Lüder U, Roleda MY, Zacher, K, Wiencke C. 2006. Ultraviolet radiation shapes seaweed communities. Rev. Environ. Sci. Biotechnol. 5: 141–166. [ Links ]
Braune W, Döhler G. 1996. Impact of UV–B radiation on 15N–ammonium and 15N–nitrate uptake by Haematococcus lacustris (Volvocales). II. The influence of a recovery period. J. Plant Physiol. 149: 349–357. [ Links ]
Büchel C, Wilhelm C. 1993. In vivo analysis of slow chlorophyll induction kinetics in algae: Progress, problems and perspectives. Photochem. Photobiol. 58: 137–148. [ Links ]
Cabello–Pasini A, Figueroa FL. 2005. Effect of nitrate concentration on the relation between photosynthetic oxygen evolution and electron transport rate in Ulva rigida (Chlorophyta). J. Phycol. 41: 1169–1177. [ Links ]
Döhler G, Hagmeier E, David C. 1995. Effects of solar and artificial UV irradiation on pigments and assimilation of 15N ammonium and 15N nitrate by macroalgae. J. Photochem. Photobiol. B: Biol. 30: 179–187. [ Links ]
Dring MJ, Wagner A, Boeskov J, Lüning K. 1996. Sensitivity of intertidal and subtidal red algae to UVA and UVB radiation, as monitored by chlorophyll fluorescence measurements: Influence of collection depth and season and length of irradiation. Eur. J. Phycol. 31: 293–302. [ Links ]
Figueroa FL, Viñegla B. 2001. Effects of solar UV radiation on photosynthesis and enzyme activities (carbonic anhydrase and nitrate reductase) in marine macroalgae from southern Spain. Rev. Chil. Hist. Nat. 74: 237–249. [ Links ]
Figueroa FL, Salles S, Aguilera J, Jiménez C, Mercado J, Viñegla B, Flores–Moya A, Altamirano M. 1997. Effects of solar radiation on photoinhibition and pigmentation in the red alga Porphyra leucosticta. Mar. Ecol. Prog. Ser. 151: 81–90. [ Links ]
Figueroa FL, Jiménez C, Viñegla B, Pérez–Rodríguez E, Aguilera J, Flores–Moya A, Altamirano M, Lebert M, Häder DP. 2002. Effects of solar UV radiation on photosynthesis of the marine angiosperm Posidonia oceanica from southern Spain. Mar. Ecol. Prog. Ser. 230: 59–70. [ Links ]
Figueroa FL, Conde–Alvarez R, Gómez I. 2003a. Relations between electron transport rates determined by pulse amplitude modulated fluorescence and oxygen evolution in macroalgae under different light conditions. Photosynthesis Res. 75: 259–275. [ Links ]
Figueroa FL, Nygard C, Ekelund N, Gómez I. 2003b. Photobiological characteristics and photosynthetic UV responses in two Ulva species (Chlorophyta) from southern Spain. J. Photochem. Photobiol. 72: 35–44. [ Links ]
Flores E, Herrero A. 1994. Assimilatory nitrogen metabolism and its regulation. In: Bryant DA (ed.), The Molecular Biology of Cyanobacteria. Kluwer Academic Publ., Dordrecht, pp. 417–517. [ Links ]
Flores–Moya A, Gómez I, Viñegla B, Altamirano M, Pérez–Rodríguez E, Maestre C, Caballero RM, Figueroa FL. 1998. Effects of solar radiation on the endemic Mediterranean red alga Rissoella verruculosa: Photosynthetic performance, pigment content and the activities of enzymes related to nutrient uptake. New Phytol. 139: 673–683. [ Links ]
Flores–Moya A, Hanelt D, Figueroa FL, Altamirano M, Viñegla B, Salles S. 1999. Involvement of solar UV–B radiation in recovery of inhibited photosynthesis in the brown alga Dictyota dichotoma (Hudson) Lamouroux. J. Photochem. Photobiol. 49: 129–135. [ Links ]
Frederick JE, Soulen PF, Diaz SB, Smolskaia I, Booth CR, Lucas T, Neuschuler D. 1993. Solar ultraviolet irradiance observed from South Argentina: September 1999 to March 1991. J Geophys. Res. 98: 88–91. [ Links ]
Gao Y, Smith GJ, Alberte RS. 1992. Light regulation of nitrate reductase in Ulva fenestrata (Chlorophyceae). I. Influence of light regimes on nitrate reductase activity. Mar. Biol. 112: 691–696. [ Links ]
Gerber S, Häder DP. 1993. Effects of solar radiation on motility and pigmentation of 3 species of phytoplancton. Env. Exp. Bot. 33(4): 515–521. [ Links ]
Gómez I, Pérez–Rodríguez E, Viñegla B, Figueroa FL, Karsten U. 1998. Effects of solar radiation on photosynthesis, UV–absorbing compounds and enzyme activities of the green alga Dasycladus vermicularis from southern Spain. J. Photochem. Photobiol. B: Biol. 47: 46–57. [ Links ]
Gómez I, Figueroa F, Ulloa N, Morales V, Lovengreen C, Huovinen C, Hess S. 2004. Patterns of photosynthesis in 18 species of intertidal macroalgae from southern Chile. Mar. Ecol. Prog. Ser. 270: 103–116. [ Links ]
Gómez I, Ulloa N, Oréstegui M. 2005. Morpho–functional patterns of photosynthesis and UV sensitivity in the kelp Lessonia nigresscens (Laminaria, Phaeophyta). Mar. Biol. 148: 231–240. [ Links ]
Gordillo FJL, Segovia M, Figueroa FL. 2004. Cyclic AMP levels in several macroalgae and their relation to light quantity and quality. J. Plant Physiol. 161: 211–217. [ Links ]
Häder DP, Figueroa FL. 1997. Photoecophysiology of marine macroalgae. Photochem. Photobiol. 66: 1–14. [ Links ]
Häder DP, Lebert M, Mercado J, Aguilera J, Salles S, Flores–Moya A, Jiménez C, Figueroa FL. 1996. Photosynthetic oxygen production and PAM fluorescence in the brown alga Padina pavonica measured in the field under solar radiation. J. Phycol. 32: 614–620. [ Links ]
Haglund K, Björk M, Ramazanov Z, García–Reina G, Pedersén M. 1992. Role of carbonic anhydrase in photosynthesis and inorganic–carbon assimilation in the red alga Gracilaria tenuistipitata. Planta 187: 275–281. [ Links ]
Han Y–S, Han T. 2005. UV–B induction of UV–B protection in Ulva pertusa (Chlorophyta). J. Phycol. 41: 523–530. [ Links ]
Hanelt D. 1998. Capability of dynamic photoinhibition in Arctic macroalgae is related to their depth distribution. Mar. Biol. 131: 361–369. [ Links ]
Henry BE, van Alstyne KL. 2004. Effects of UV radiation on growth and phlorotannins in Fucus gardneri (Phaeophyceae) juveniles and embryos. J. Phycol. 40: 527–533. [ Links ]
Jassby AD, Platt T. 1976. Mathematical formulation of the relationship between photosynthesis and light for phytoplankton. Limnol. Oceanogr. 21: 540–547. [ Links ]
Jiménez C, Figueroa FL, Salles S, Aguilera J, Mercado J, Viñegla B, Flores–Moya A, Lebert M, Häder DP. 1998. Effects of solar radiation on photosynthesis and photoinhibition in red macrophytes from an intertidal system of southern Spain. Bot. Mar. 41: 329–338. [ Links ]
Karsten U, Bischof K, Hanelt D, Tüg H, Wiencke C. 1999. The effect of UV radiation on photosynthesis and UV screen substances in the endemic Arctic macroalga Devalarea ramentacea (Rhodophyta). Physiol. Plant. 105: 58–66. [ Links ]
Kirk JTO. 1976. Light and Photosynthesis in the Aquatic Ecosystems. Cambridge Univ. Press, Cambridge, 152 pp. [ Links ]
Korbee N, Figueroa FL, Aguilera J. 2005. Effect of light quality on the accumulation of photosynthetic pigments, proteins and mycosporine–like amino acids in the red alga Porphyra leucosticta (Bangiales, Rhodophyta). J. Photochem. Photobiol. 80: 71–78. [ Links ]
Krause GH, Weis E. 1991. Chlorophyll fluorescence and photosynthesis: The basics. Annu. Rev. Plant Physiol. Plant Mol. Biol. 42: 313–349. [ Links ]
Kumar A, Sinha RP, Häder DP. 1996. Effect of UV–B on enzymes of nitrogen metabolism in the cyanobacterium Nostoc calcicola. J. Plant Physiol. 148: 86–91. [ Links ]
Lopes PF, Oliveira MC, Colepicolo P. 1997. Diurnal fluctuation of nitrate reductase activity in the marine red alga Gracilaria tenuistipitata (Rhodophyta). J. Phycol. 33: 225–231. [ Links ]
Maegawa M, Kunieda M, Kida W. 1993. The influence of ultraviolet radiation on the photosynthetic activity in several red algae from different depths. Jap. J. Phycol. 41: 207–214. [ Links ]
Mercado JM, Gordillo FJ, Figueroa FL, Niell FX. 1998. External carbonic anhydrase and affinity to inorganic carbon in intertidal macroalgae. J. Exp. Mar. Biol. Ecol. 221: 209–220. [ Links ]
Mori T, Binder B, Johnson CH. 1996. Circadian gating of cell division in cyanobacteria growing with average doubling times of less than 24 hours. Proc. Nat. Acad. Sci. USA 93: 10183–10188. [ Links ]
Quiñones MA, Aparicio PJ. 1990. Flavin type action spectrum of nitrate utilization by Monoraphidium brauni. Photochem. Photobiol. 51: 689–692. [ Links ]
Pavia H, Cervin G, Lindgren A, Aberg P. 1997. Effects of UV–B radiation and simulated hebivory on phlorotannins in the brown alga Ascophyllum nodosum. Mar. Ecol. Prog. Ser. 157: 139–146. [ Links ]
Roleda MY, Wienke C, Hanelt D. 2006. Thallus morphology and optical characteristics affect growth and DNA damage by UV radiation in juvenile Arctic Laminaria sporophytes. Planta 223: 407–417. [ Links ]
Rüdiger W, López–Figueroa F. 1992. Yearly review: Photoreceptors in algae. Photochem. Photobiol. 55: 949–954. [ Links ]
Schreiber U, Endo T, Mi H, Asada K. 1995. Quenching analysis of chlorophyll fluorescence by saturation pulse method: Particular aspects relating to the study of eukaryotic algae and cyanobacteria. Plant Cell Physiol. 36: 873–882. [ Links ]
Sokal PR, Rohlf FJ. 1995. Biometry. WH Freeman ed., San Francisco, 880 pp. [ Links ]
Van de Poll WH, Eggert A, Buma AGJ, Breeman AM. 2001. Effects of UV–B induced DNA damage and photoinhibition of growth of temperate marine red macrophytes: Habitat–related differences in UV–B tolerance. J. Phycol. 37: 30–37. [ Links ]
Villafañe V, Sunfbãck C, Figueroa FL, Helbling W. 2003. Photosynthesis in the aquatic environment as affected by ultraviolet radiation. In: Helbling W, Zagarese H (eds.), UV Effects in Aquatic Organisms and Ecosystems. Comprehensive Series in Photosciences, pp. 357–397. [ Links ]
Viñegla B. 2000. Efecto de la radiación ultravioleta sobre las actividades enzimáticas relacionadas con el metabolismo del carbono y el nitrógeno en microalgas y fanerógamas marinas. Ph.D. thesis, Universidad de Málaga, Málaga, 302 pp. [ Links ]
Viñegla B, Segovia M, Figueroa FL. 2006. Effect of artificial UV radiation on carbon and nitrogen metabolism in the macroalgae Fucus spiralis L. and Ulva olivascens Dangeard. Hydrobiologia 560: 31–12. [ Links ]
* DESCARGAR VERSIÓN BILINGÜE (INGLÉS–ESPAÑOL) EN FORMATO PDF














