Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.35 no.1 Ensenada mar. 2009
Artículos de investigación
Phenanthrene and nitrite effects on juvenile sea bass, Dicentrarchus labrax, using hepatic biotransformation enzymes, biliary fluorescence, and micronuclei as biomarkers*
Efectos del fenantreno y el nitrito en juveniles del róbalo, Dicentrarchus labrax, mediante el uso de enzimas hepáticas biotransformadoras, fluorescencia biliar y micronúcleos como biomarcadores
MA Reis–Henriques1, 3*, M Ferreira1, 3, AM Coimbra1, 3, C D'Silva2, J Costa1, 3, MS Shailaja2
1 CIIMAR–UP – Centro Interdisciplinar de Investigação Marinha e Ambiental, Universidade do Porto, Rua dos Bragas 289, 4050–123 Porto, Portugal. * E–mail: mahenriq@icbas.up.pt
2 NIO – National Institute of Oceanography, Dona Paula, Goa 403004, India.
3 ICBAS–UP – Instituto de Ciências Biomédicas de Abel Salazar, Universidade do Porto, Largo do Professor Abel Salazar 2, 4090–003, Porto, Portugal.
Recibido junio de 2008.
Aceptado en diciembre de 2008.
Abstract
Aquatic organisms may absorb organic compounds mainly from water and by ingestion of contaminated food. The toxicity of such compounds may be intensified by the presence of certain inorganic compounds such as nitrite (NO2–). In order to evaluate the effect of phenanthrene (PHE), a polycyclic aromatic hydrocarbon, in the presence and absence of NO2–, juvenile sea bass, Dicentrarchus labrax L, were exposed to PHE i.p. and to NO2– in water, and several endpoints were measured at days 1, 3, and 6 of exposure. Sea bass exposed to PHE exhibited lower hepatic 7–ethoxyresorufin O–deethylase (EROD) activity as compared to the control group. The activity of the phase II enzyme, glutathione S–transferase (GST), was similar in all the groups of fish. The concentration of PHE metabolites, determined as fluorescent aromatic compounds, was nearly 14 times higher both in the presence and absence of NO2–, showing that even at low EROD activities this PAH is metabolized. The presence of micronuclei was observed to be significantly higher only in sea bass treated with PHE alone, suggesting that different PHE metabolites, without genotoxic properties, were formed in the presence of NO2–.
Key words: biotransformation enzymes, micronucleus, nitrite, phenanthrene, polycyclic aromatic hydrocarbons.
Resumen
Los organismos acuáticos pueden absorber compuestos orgánicos principalmente del agua y por ingestión de sustancias alimenticias contaminadas. La toxicidad de tales compuestos se puede ver intensificada por la presencia de ciertos compuestos inorgánicos como el nitrito (NO2–). Para evaluar el efecto del fenantreno (PHE), un hidrocarburo aromático policíclico, en presencia y ausencia de NO2–, se expusieron juveniles de róbalo, Dicentrarchus labrax L, a PHE intraperitoneal y NO2– en el agua, y se midieron varias respuestas a los 1, 3 y 6 días de exposición. Los organismos expuestos al PHE mostraron menor actividad de la 7–etoxiresorufina O–deetilasa (EROD) hepática en comparación con el grupo control. La actividad de la enzima de la fase II, glutatión S–transferasa (GST), fue similar en todos los grupos de peces. La concentración de metabolitos del PHE, determinada en forma de compuestos aromáticos fluorescentes, fue cerca de 14 veces mayor tanto en presencia como en ausencia de NO2–, lo que muestra que el PHE es metabolizado aun con bajas actividades de la EROD. Sólo se observó una presencia significativamente mayor de micronúcleos en róbalos tratados únicamente con PHE, lo que sugiere que en presencia de NO2– se formaron otros metabolitos del PHE que carecen de propiedades genotóxicas.
Palabras clave: enzimas biotransformadoras, fenantreno, hidrocarburos aromáticos policíclicos, micronúcleos, nitrito.
Introducción
Los hidrocarburos aromáticos policíclicos (PAHs, por sus siglas en inglés) son contaminantes muy tóxicos ampliamente distribuidos en el medio ambiente. Los organismos acuáticos, como los peces, pueden absorber estos compuestos del agua a través de las branquias y mediante la ingestión de sedimentos o alimentos contaminados. El fenantreno (PHE), un PAH con tres anillos, considerado uno de los PAHs prioritarios para la Agencia de Protección Ambiental de los Estados Unidos, se encuentra en el ambiente acuático debido a fuentes tanto petrogénicas como pirogénicas, y se ha comprobado su efecto tóxico en varias especies marinas (Albers 2003). El PHE es el menor PAH tricíclico con una región "bay" y una "K", regiones que son altamente reactivas donde se pueden formar las principales especies carcinogénicas (Correia et al. 2007), y por esta razón es comúnmente utilizado como un sustrato modelo en estudios sobre el metabolismo de los PAHs carcinogénicos.
El nitrito (NO2–) es muy reactivo y es producido de manera natural principalmente por procesos biológicos como la desnitrificación y la nitrificación dominada por la oxidación del amoníaco (NH3). Aunque el NO2– es un compuesto natural, su presencia en el ambiente es un problema potencial y existen muchos registros de sus efectos tóxicos en animales (Jensen 2003). Por lo general resulta menos tóxico en el agua de mar que en agua dulce debido a la alta concentración de cloruro y al gradiente osmótico opuesto en los peces; sin embargo, debido a la gran densidad de peces que se suele manejar en los cultivos marinos intensivos con recirculación de agua, los niveles de NO2– pueden llegar a ser altamente tóxicos (Doblander y Lackner 1996, Jensen 2003). La fauna acuática puede estar en riesgo de intoxicación por NO2– ya que cuando éste se encuentra disuelto en el agua puede ser absorbido por el epitelio branquial y el intestino, y acumularse en concentraciones muy altas en los fluidos corporales. El NO2– ejerce su toxicidad al reducir la capacidad de la sangre para transportar oxígeno y también se asocia con la inhibición de la fase I de la biotransformación (mediada por el citocromo P450) en peces (Arillo et al. 1984). Además, las concentraciones ambientales reales del NO2– pueden afectar la dinámica de las reacciones metabólicas de conjugación en los peces expuestos (Gonzalez et al. 2000), y en la tilapia Oreochromis mossambicus, el NO2– aumenta la toxicidad del PHE, incrementando la formación de metabolitos car–cinogénicos (Shailaja y Rodrigues 2003).
Varios estudios han demostrado que la inducción del sistema oxidasa de función mixta (MFO) dependiente del cito–cromo P450 es un marcador biológico de exposición a contaminantes orgánicos antropogénicos como los PAHs, los policlorobifenilos (PCBs), los pesticidas organoclorados, las dioxinas y los furanos (Eggens et al. 1996, Gagnon y Holdway 2002, Ferreira et al. 2004, 2006). Los metabolitos de la fase I quedan disponibles para su conjugación en la fase II con glutatión, glucurónido o sulfato, causando una reducción en la reactividad y un incremento en la excreción (Van der Oost et al. 2003). Al igual que los demás vertebrados, los peces tienen un sistema MFO bien desarrollado que rápidamente puede metabolizar los PAHs precursores en productos hidrofílicos que son excretados con mayor facilidad. En consecuencia, usualmente sólo es posible detectar concentraciones menores de los compuestos precursores en los tejidos de peces (Ariese et al. 1993, Di Giulio et al. 1995). Aunque la inducción del sistema MFO es considerada un biomarcador de exposición general, no es específico, por lo que la determinación de los metabolitos de PAHs en la bilis en forma de compuestos aromáticos fluorescentes ha sido usada como biomarcador de exposición tanto a PAHs pirogénicos como a petrogénicos (Krahn et al. 1986, Lin et al. 1994, Aas et al. 2000).
Dependiendo de la estructura química y el nivel de exposición, los PAHs y sus metabolitos pueden causar efectos tóxicos, mutagénicos y/o carcinogénicos en peces y otros vertebrados, incluyendo el ser humano (MacRae y Hall 1998, Monteiro et al. 2000), y es por esto que resulta preocupante el incremento registrado en los niveles de contaminación por PAHs en algunos sistemas acuáticos durante las últimas décadas (Weber y Janz 2001). Se ha demostrado que varios PAHs son carcinogénicos para el ser humano (Harvey 1991), y se ha observado una gran incidencia de tumores, especialmente en el hígado, en varias especies de peces recolectados de zonas contaminadas por estos químicos (Murchelano y Wolke 1985, Bauman et al. 1987, Myers et al. 1991). La prueba de micronú–cleos detecta estas estructuras que resultan ya sea de la ruptura de cromosomas durante la división celular o de la pérdida de cromosomas durante la anafase. En algunos peces esta prueba ha resultado ser una técnica in vivo útil para ensayos de genotoxicidad y para el potencial monitoreo in situ de la calidad del agua (Kim y Hyun 2006).
El róbalo es una especie acuacultural importante, con un alto potencial para sistemas de cultivo intensivo donde pueden presentarse niveles elevados de NO2– y PAHs, incluyendo PHE, ya que normalmente estos sistemas se localizan en aguas costeras. En la tilapia se ha encontrado que la asociación de estos dos compuestos aumentó la producción de metabolitos nitrogenados (Shailaja y Rodrigues 2003, Shailaja et al. 2006). El objetivo principal de este trabajo fue comparar la respuesta del róbalo expuesto a ambos compuestos, mediante la evaluación de varios biomarcadores de exposición: los niveles de metabolitos del PHE en la bilis, la actividad enzimática hepática de la etoxiresorufina O–deetilasa así como la glutatión S–transferasa, y la prueba de micronúcleos.
Materiales y métodos
Animales experimentales
El experimento se llevó a cabo con especímenes del róbalo Dicentrarchus labrax L, obtenidos de una granja local en el norte de Portugal. Antes de iniciar el experimento los peces se mantuvieron en tanques grandes con agua corriente, transfiriéndose a los tanques experimentales tres días antes de iniciar las exposiciones. Durante el periodo experimental los peces se mantuvieron en tanques de 200 L con agua aireada y sin alimentación.
Experimento
El experimento consistió en exponer a los animales al PHE en presencia o ausencia de NO2– (10 µM). Los especímenes de róbalo, de 63.2 ± 16.4 g de peso y 19.1 ± 1.5 cm de largo, fueron inyectados intraperitonealmente con 10 mg kg–1 de PHE en aceite de cacahuate, agregando o sin agregar simultáneamente una solución acuosa de nitrito de sodio (concentración final, 10 µM de NO2–) al tanque experimental. Otros dos grupos experimentales fueron inyectados intraperitoneal con aceite de cacahuate (VEH), y se mantuvieron en agua con o sin 10 µM de NO2–. Un quinto grupo (CTR), libre de cualquier exposición, se utilizó para llevar un control de posibles alteraciones debidas a la manipulación. Los animales fueron sacrificados después de 1, 3 y 6 días de exposición. Durante el periodo experimental los peces se mantuvieron con un fotoperiodo natural, con una temperatura del agua de 18.8 ± 0.1°C y salinidad de 20.1 ± 0.01.
A los días 1, 3 y 6 de exposición, los especímenes fueron anestesiados en agua helada antes de obtener las muestras. Se recolectó sangre de la vena caudal para el análisis de micro–núcleos. Se extrajo bilis de la vesícula biliar con una jeringa de 1 mL y se almacenó a –80°C hasta el análisis de componentes aromáticos fluorescentes. Los hígados se extirparon, pesaron, congelaron en nitrógeno líquido y almacenaron a –80°C hasta su análisis. Se calculó el índice hepatosomático como el porcentaje de peso corporal, y el factor de condición se calculó de la siguiente forma: peso x longitud–3 x 100.
Análisis bioquímico
Los hígados se homogeneizaron (1:10, p:v) en tampón de fosfato de sodio helado 50 mM, Na2EDTA 0.1 mM, pH 7.8, y se centrifugaron a 15,000 g durante 20 min a 4°C para los ensayos enzimáticos. La glutatión S–transferasa (GST) se determinó por el método de Habig et al. (1974), adaptado para microplaca según Ferreira et al. (2006), usando glutatión (GSH) 10 mM en tampón de fosfato 0.1 M, pH 6.5, y 1–cloro–2,4–dinitrobenceno (CDNB) 60 mM en etanol preparado justo antes del ensayo. La mezcla de reacción consistió de tampón de fosfato, solución GSH y solución CDNB, en una proporción de 4.95 mL de tampón de fosfato:0.9 mL de GSH: 0.15 mL de CDNB. En la microplaca se adicionó 0.2 mL de mezcla de reacción a 0.1 mL de muestra diluida (25–50 | g de proteína), llegando a una concentración final 1 mM de GSH y 1 mM de CDNB en el ensayo. La actividad de GST se midió inmediatamente cada 20 seg, a 340 nm, durante los primeros 5 min, calculándose en el periodo de cambio lineal de absorbancia. La actividad hepática de GST se expresa en nmol min–1 mg proteína–1.
La actividad hepática de la etoxiresorufina O–deetilasa (EROD) fue medida de acuerdo con Ferreira et al. (2004). Brevemente, se homogeneizó el hígado en tampón helado (Tris–HCl 50 mM, pH 7.4, KCl 0.15 M). Los microsomas se obtuvieron mediante centrifugación de los 9,000 g de sobrenadante a 36,000 g por 90 min en una centrífuga SIGMA 3K30. Se resuspendió la muestra en tampón (Tris–HCl 50 mM, NaE–DTA 1 mM, pH 7.4, ditiotreitol 1 mM, glicerol al 20% v/v) y se centrifugó a 36,000 g durante 120 min (Fent y Bucheli 1994). Los microsomas se suspendieron en tampón de resuspensión libre de EDTA y se almacenaron a –80°C hasta ser utilizados. La suspensión microsomal (50 | L) fue incubada con etoxiresorufina (0.5 µM) por 1 min, y se inició la reacción enzimática agregando 45 µM de NADPH. La actividad de la EROD se midió durante 5 min a λex = 530 nm y λem = 585 nm, y se determinó por comparación con una curva estándar de resorufina. La actividad hepática de la EROD se expresa en pmol min–1 mg proteína–1 .
Se determinaron los metabolitos de tipo PHE en la bilis mediante fluorescencia de longitud de onda fija (FF) (Ferreira et al. 2006). Brevemente, se utilizaron 5 | L de bilis diluida en 5 µL de etanol al 48% para la determinación de FF al par de longitudes de onda excitación/emisión de 260/380 nm, el cual es específico para PHE (Krahn et al. 1993). Las mediciones se realizaron usando un fluorímetro BIOTEK SFM25. Los valores de FF se expresaron como unidades arbitrarias de fluorescencia (a.f.u.) después de deducir los niveles de la señal del solvente. La biliverdina (pigmento biliar) se midió a 380 nm en todas las muestras para estimar la densidad biliar. Se normalizó la fluorescencia de los metabolitos de PHE a la biliverdina, la cual fue utilizada como control para comprobar si las diferencias en la intensidad de fluorescencia podrían deberse a diferencias en las densidades biliares (Ferreira et al. 2006).
Prueba de micronúcleos
Se prepararon dos placas con frotis de sangre de cada animal. Se fijaron en metanol durante 10 min y se tiñeron con Giemsa al 5% en tampón de fosfato 3 mM por 30 min. Todas las placas se observaron bajo un microscopio óptico, registrándose la presencia de micronúcleos en un total de 1000 eritrocitos por placa.
Análisis estadístico
Para evaluar el efecto de la manipulación, se compararon los grupos tratados (VEH, VEH+NO2–, PHE y PHE+NO2–) con el grupo no expuesto (CTR) usando un análisis de varianza (ANOVA) de dos vías, con una prueba de comparación múltiple (mínima diferencia significativa, LSD) a un nivel de significancia de 5%.
Se probaron las diferencias entre los grupos tratados mediante un ANOVA multivariado con una prueba de comparación múltiple (LSD) a un nivel de significancia de 5%. Se analizaron tres factores: el tiempo de exposición y los tratamientos con PHE y NO2–. Algunos de los datos fueron transformados logarítmicamente para ajustarse a las suposiciones del ANOVA. Todas las pruebas se realizaron con la paquetería Statistica 6.0 (Statsoft, Inc., 2001).
Resultados
El índice hepatosomático disminuyó gradualmente con el tiempo de exposición, mientras que el factor de condición permaneció igual (tabla 1).
Se evaluaron varios biomarcadores para determinar los efectos del PHE en presencia o ausencia de NO2–. El análisis del efecto de manipulación, mediante la comparación de los grupos tratados (VEH, VEH+NO2–, PHE y PHE+NO2–) con el grupo control (CTR), mostró que la actividad hepática de la EROD sólo se notó afectada por el proceso de manipulación al día 1, ya que a los 3 y 6 días ambos grupos inyectados con VEH presentaron valores de actividad similares a los del grupo CTR. Para evaluar la exposición al PHE en presencia o ausencia de NO2–, se compararon los grupos respectivos tratados con VEH.
En la figura 1 se observa como la actividad hepática de la EROD fue menor en todos los grupos tratados (VEH, VEH+NO2–, PHE y PHE+NO2–) al día 1, incrementándose progresivamente hacia el día 6. A los días 1 y 3 se observaron diferencias significativas entre los grupos tratados con PHE y VEH, mostrando los peces expuestos al PHE menores niveles de esta actividad. A los 6 días, aunque no de manera estadísticamente significativa, la actividad de la EROD continuó siendo menor que en el grupo VEH. Los peces tratados con PHE+NO2– mostraron niveles significativamente menores de actividad de la EROD que el grupo VEH+NO2– a los 1, 3 y 6 días. Además, para el día 6, el grupo PHE+NO2– mostró niveles significativamente menores de actividad de la EROD que el grupo PHE, lo que indica que el NO2– aumenta los efectos del PHE en esta actividad enzimática. El NO2– por sí solo no tuvo ningún efecto, como lo muestran los valores similares en los grupos VEH y VEH+NO2– .

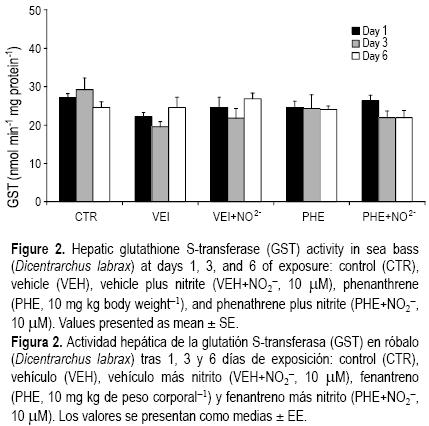
Se evaluó la fase II de biotransformación como actividad hepática de GST (fig. 2). La GST hepática no mostró diferencias significativas ni con el tiempo de exposición ni con la exposición al PHE, con o sin NO2– en el agua.
El análisis de los metabolitos de PHE en la bilis de róbalo confirmó la capacidad de esta especie para metabolizar este PAH (fig. 3). Los mayores niveles de metabolitos del PHE fueron medidos al día 3, decreciendo significativamente al día 6. El NO2– en el agua no tuvo ningún efecto sobre la presencia de metabolitos de PHE en la bilis.

Para determinar la capacidad genotóxica del PHE y sus metabolitos se evaluó la presencia de micronúcleos en los eritrocitos de róbalo (fig. 4). La exposición al PHE causó un aumento significativo en el número de micronúcleos a los 3 y 6 días (tres veces y cinco veces más, respectivamente) de exposición a este PAH. Es interesante notar que con la presencia de NO2– en el agua no se observaron cambios en el número de micronúcleos.

Discusión
El objetivo de este estudio fue caracterizar los efectos de la administración de PHE en juveniles de róbalo. Se evaluaron las siguientes respuestas bioquímicas y genotóxicas: las actividades enzimáticas en las fases I y II de biotransformación (EROD y GST), los niveles de metabolitos de PHE en la bilis, y la inducción de micronúcleos en los eritrocitos. También se evaluaron los efectos de la presencia de NO2– en el agua sobre el aumento en la toxicidad del PHE en una especie de alto valor comercial frecuentemente expuesta a niveles elevados de este compuesto en condiciones de cultivo.
El decremento en el índice hepatosomático observado del día 1 al día 6 del experimento (tabla 1) se debió a que los peces no fueron alimentados durante el mismo; sin embargo, los valores del factor de condición mostraron que la inanición no tuvo ningún efecto sobre la condición de los animales después de 6 días.
Los datos de actividad de CYP1A (EROD) indicaron que un día después de la inyección de PHE o aceite de cacahuate se presentó una reducción significativa en la actividad de esta enzima, lo cual se puede explicar como una respuesta de estrés a la manipulación durante la inyección ya que esta inhibición no se observó en el grupo CTR. Los datos también mostraron que, conforme progresó el experimento, la actividad de la EROD en los grupos VEH y VEH+NO2– tendió a regresar a los valores registrados para los especímenes control. Se observó el mismo patrón para los grupos tratados con PHE, aunque tal exposición resultó en una reducción significativa en la actividad de la EROD, siendo ésta más pronunciada en presencia de NO2– en el agua.
Los PAHs son considerados típicos inductores de las oxidasas de función mixta relacionadas con el citocromo P450, en particular el CYP1A, medido por la EROD en peces (Willett et al. 1997, Clemons et al. 1998, Whyte et al. 2000, Ferreira et al. 2006); no obstante, por lo contrario, en este trabajo se mostró que el PHE redujo la actividad hepática de la EROD en los juveniles de róbalo. En un estudio previo con tilapia (Oreochromis mossambicus) se registró un aumento en la actividad hepática de la EROD en presencia de PHE, la cual aumentó con la exposición simultánea a NO2– (Shailaja y D'Silva 2003). En estudios comparativos in vitro sobre el metabolismo de tres PAHs (benzo(a)pireno, criseno y PHE) en los microsomas hepáticos del bagre pardo (Ameiurus nebulosus) de agua dulce (Pangrekar et al. 1995, 2003), los resultados indicaron que los microsomas presentan un alto grado de estereoselectividad en la conversión metabólica de estos PAHs a sus dioles correspondientes, y que el criseno y el PHE fueron metabolizados por más de una isoenzima del citocromo P450, presuntamente con estereoselectividades diferentes. Asimismo, se encontró que el PHE fue un fuerte inhibidor de la actividad de CYP1A (EROD) en microsomas humanos (Shimada et al. 1998). Por otro lado, se han observado grandes variaciones en la inducción de la actividad de la EROD entre peces tropicales y de clima templado (e.g., tilapia del Nilo, Oreochromis niloticus, y trucha arco iris, Onchorynchus mykiss) (Pathiratne y George 1996). En un estudio in vivo reciente con juveniles de dorada (Sparus aurata) también se encontró que altas concentraciones de PHE en el agua redujeron significativamente la actividad de la EROD (Correia et al. 2007). Esto sugiere que el PHE no es un fuerte inductor del citrocromo P450 en comparación con los inductores de PAHs comúnmente utilizados (benzo(a)pireno, p–naftoflavona). La reducción en la actividad de la EROD también puede ser explicada por la concurrencia de varios inductores de CYP1A o la generación de productos metabólicos que pueden interferir con la integridad de la enzima causando una reducción de su actividad (Stegeman y Hahn 1994), como la producción de especies reactivas de oxígeno asociadas con el proceso de CYP1A (Schlezinger y Stegeman 1999). Por tanto, nuestro trabajo mostró que la inducción de la actividad de la EROD depende de la especie y el PAH. En el caso del tratamiento con PHE+NO2– comparado con el tratamiento utilizando sólo PHE, se observó una reducción en actividad similar (fig. 1), con una diferencia significativa (P < 0.05) el día 6. Para la tilapia se obtuvieron resultados opuestos (Shailaja y Rodrigues 2003), donde la actividad de la EROD en presencia de NO2– fue dos veces la actividad inducida por el PHE solo. Esto se explica por la capacidad que tiene el NO2– para oxidar el PHE, facilitando así una mayor oxidación del compuesto por la EROD. Aunque se ha demostrado que la presencia de NO2–en sistemas acuáticos puede ser tóxica para los animales al resultar en la formación de la metahemoglobina (Hargreaves 1998, Huertas et al. 2002, Svobodova et al. 2005), también se sabe que la salinidad del agua puede regular la toxicidad del NO2– (Jensen 2003, Wang et al. 2006). Los resultados de experimentos sobre toxicidad aguda del NO2– en tilapia a diferentes salinidades (Wang et al. 2006) indicaron que el porcentaje de metahemoglobina disminuyó conforme aumentó la concentración de cloruro en el agua. Nuestros resultados muestran que los juveniles de róbalo presentan una mayor tolerancia al NO2–ya que no se observaron cambios significativos en ninguno de los parámetros medidos después de la exposición a NO2– en el agua (VEH y VEH+NO2–). Esta capacidad de adaptación a la exposición a NO2– presentada por el róbalo puede deberse a una mayor capacidad de oxidar nitrito a nitrato, de forma similar a la capacidad de la trucha arco iris de destoxificar nitrito, mediante oxidación, a nitrato en sus eritrocitos (Doblander y Lackner 1997). Esta ventaja posiblemente crontribuye al éxito de la acuicultura del róbalo, en la que frecuentemente el oxígeno es limitado. Además, los resultados sugieren que la captación y la toxicidad del NO2– en el róbalo no son tan significativas como en los peces de agua dulce (Shailaja et al. 2006, Wang et al. 2006).
La enzima de biotransformación de la fase II, GST, no mostró diferencias significativas entre el grupo CTR y los demás grupos (fig. 2) probablemente debido al corto tiempo de exposición. Esta hipótesis es apoyada por los resultados obtenidos para el lenguado japonés (Paralichthys olivaceus) expuesto a PHE (de 0.5 a 2 µM), donde la actividad de la GST mostró un marcado incremento en el hígado, las branquias y el riñón sólo después de 2 y 4 semanas de exposición (Jee y Kang 2005). En otros estudios tampoco se ha encontrado una relación entre la excreción de PHE y la GST (Shailaja y D'Silva 2003, Jee y Kang 2005). Algunos PAHs también pueden ser excretados directamente como metabolitos polares no conjugados en la bilis (vía la vesícula biliar) (revisión en Van der Oost et al. 2003), o como formas conjugadas tales como sulfatos y glucurónidos (conjugación fase II) sin estar involucrada la GST (ver Watson et al. 2004).
La determinación de los metabolitos de PAHs es particularmente relevante en los peces ya que son los metabolitos biotransformados y activos los que causan efectos tóxicos, mutagénicos y carcinogénicos significativos (Stroomberg et al. 1996, Watson et al. 2004). El contenido de metabolitos de PHE en la bilis presentó un incremento rápido el primer día de tratamiento, seguido por un incremento más lento al tercer día y una reducción al sexto día. Igual a lo observado para la actividad de CYP1A, la exposición a PHE+NO2– no afectó el contenido de metabolitos biliares al compararse con el tratamiento con sólo PHE. A pesar de la menor actividad de la EROD en los grupos expuestos al PHE, este PAH continúa siendo metabolizado, como lo muestra el contenido de metabolitos de PHE en la bilis. Estos resultados también sugieren que otras isoenzimas de CYP podrían estar involucradas en tal metabolismo. Se sabe que las isoenzimas de CYP 1A1, 1A2, 2A6, 2B6, 2C8, 2C9, 2E1 y 3A4 metabolizan el PHE en el ser humano (Sai et al. 2000); por tanto, cualquiera de ellas, o más de una, pudiera ser responsable del metabolismo del PHE en el róbalo. Los resultados de este estudio no permiten afirmar cuáles otras isoenzimas de CYP podrían ser las responsables de la metabolización del PHE en los juveniles de róbalo, sino sólo es posible plantear una hipótesis.
La prueba de micronúcleos ha sido utilizada como una herramienta para la determinación de respuestas genotóxicas en diferentes grupos de animales, incluyendo a los peces (Carrasco et al. 1990, Pacheco y Santos 1997, 1998). Sólo es posible encontrar micronúcleos en células que se dividen, por lo que éstos proporcionan un índice útil y confiable de la ruptura y pérdida de cromosomas (Fenech 2000). En este estudio se observó un incremento significativo de la genotoxicidad en los peces expuestos al PHE del día 3 al 6. Estas propiedades genotóxicas comúnmente se asocian con la biotransformación, especialmente desarrolladas por monooxigenasas del citocromo P450, con la generación concomitante de metabolitos reactivos frecuentemente más tóxicos que los compuestos precursores.
Ya ha sido descrita la inducción de micronúcleos en eritrocitos de lisa (Liza aurata) tras su exposición a PHE en agua, sin una respuesta dependiente de la dosis (Oliveira et al. 2007); sin embargo, en un trabajo con tilapia a una salinidad de 15, se encontró que una exposición al PHE junto con NO2– indujo la formación de metabolitos mutagénicos de nitrofenantreno después de la inducción por la EROD (Shailaja et al. 2006). En los especímenes de róbalo se observó una reducción significativa en la actividad de esta enzima después de su exposición a la misma combinación de contaminantes, así como ausencia de efectos mutagénicos en los animales expuestos a PHE+NO2–. La ausencia de efectos genotóxicos en presencia de NO2–puede deberse al hecho de que la actividad de la EROD fue menor, o a que en presencia de NO2– se forman otros metabolitos con propiedades menos genotóxicas.
En este estudio se analizó si la presencia de niveles altos de NO2– incrementa la toxicidad del PHE en una especie cultivada intensivamente, en este caso el róbalo, como se ha demostrado para la tilapia. Los resultados indicaron que la presencia de NO2– no incrementó la genotoxicidad del PHE en juveniles de róbalo, y que las isoenzimas de CYP, además de la CYP1A, también pueden ser responsables del metabolismo del PHE, resultando en la formación de metabolitos menos tóxicos.
Agradecimientos
Este trabajo se realizó como parte del Programa Indo–Portugués de Cooperación en Ciencia y Tecnología (GRICES, Portugal/Departamento de Ciencia y Tecnología, India). Los autores (CD y MSS) agradecen al director del NIO su apoyo. El equipo portugués reconoce el apoyo técnico de H Santos y CRosa.
Referencias
Aas E, Baussant T, Balk L, Liewenborg B, Andersen OK. 2000. PAH metabolites in bile, cytochrome P4501A and DNA adducts as environmental risk parameters for chronic oil exposure: A laboratory experiment with Atlantic cod. Aquat. Toxicol. 51: 241–258. [ Links ]
Albers PH. 2003. Petroleum and individual polycyclic aromatic hydrocarbons. In: Hoffman DJ, Rattner BA, Burton GA, Cairns J (eds.), Handbook of Ecotoxicology. Lewis Publishers, New York, pp. 1–32. [ Links ]
Ariese F, Kok SJ, Verkaik M, Gooijer C, Velthorst NH, Hofstraat JW. 1993. Synchronous fluorescence spectrometry of fish bile: A rapid screening method for the biomonitoring of PAH exposure. Aquat. Toxicol. 26: 273–286. [ Links ]
Arillo A, Gaino E, Margiocco C, Mensi P, Schenone G. 1984. Biochemical and ultrastructural effects of nitrite in rainbow trout: Liver hypoxia as the root of the acute toxicity mechanism. Environ. Res. 34: 135–154. [ Links ]
Bauman PC, Smith WD, Parland WK. 1987. Tumour frequencies and contaminant concentrations in brown bullheads from an industrialized river and a recreational lake. Trans. Am. Fish. Soc. 116: 76–86. [ Links ]
Carrasco KR, Tilbury KL, Myers MS. 1990. An assessment of the piscine micronucleus test as an in situ biological indicator of chemical contaminant effects. Can. J. Fish. Aquat. Sci. 47: 2123–2136. [ Links ]
Clemons JH, Allan LM, Marvin CH, Wu Z, McCarry BE, Bryant DW, Zacharewski TR. 1998. Evidence of estrogen– and TCDD–like activities in crude and fractionated extracts of PM10 air particulate material ising in vitro gene expression assays. Environ. Sci. Technol. 32: 1853–1860. [ Links ]
Correia AD, Gonçalves R, Scholze M, Ferreira M, Reis–Henriques MA. 2007. Biochemical and behavioral responses in gilthead seabream (Sparus aurata) to phenanthrene. J. Exp. Mar. Biol. Ecol. 347: 109–122. [ Links ]
Di Giulio RT, Behar JV, Carlson DB, Hasspieler BM, Watson DE. 1995. Determinants of species susceptibility to oxidative stress: A comparison of channel catfish and brown bullhead. Mar. Environ. Res. 39: 175–179. [ Links ]
Doblander C, Lackner R. 1996. Metabolism and detoxification of nitrite by trout hepatocytes. Biochim. Biophys. Acta 1289: 270–274. [ Links ]
Doblander C, Lackner R. 1997. Oxidation of nitrite to nitrate in isolated erythrocytes: A possible mechanism for adaptation to environmental nitrite. Can. J. Fish. Aquat. Sci. 54: 157–161. [ Links ]
Eggens ML, Opperhuizen A, Boon JP. 1996. Temporal variation of CYP1A indices, PCB and 1–OH pyrene concentration in flounder, Platichthys flesus, from the Dutch Wadden Sea. Chemosphere 33: 1579–1596. [ Links ]
Fenech M. 2000. The in vitro micronucleus technique. Mutat. Res./ Fundam. Mol. Mech. Mutag. 455: 81–95. [ Links ]
Fent K, Bucheli TD. 1994. Inhibition of hepatic microsomal mono–oxygenase system by organotins in vitro in freshwater fish. Aquat. Toxicol. 28: 107–126. [ Links ]
Ferreira M, Antunes P, Gil O, Vale C, Reis–Henriques MA. 2004. Organochlorine contaminants in flounder (Platichthys flesus) and mullet (Mugil cephalus) from Douro Estuary, and their use as sentinel species for environmental monitoring. Aquat. Toxicol. 69: 347–357. [ Links ]
Ferreira M, Moradas–Ferreira P, Reis–Henriques MA. 2006. The effect of long–term depuration on phase I and phase II biotransformation in mullets (Mugil cephalus) chronically exposed to pollutants in River Douro estuary, Portugal. Mar. Environ. Res. 61: 326–338. [ Links ]
Gagnon MM, Holdway DA. 2002. EROD activity, serum SDH and PAH biliary metabolites in sand flathead (Platycephalus bassensis) collected in Port Phillip Bay, Australia. Mar. Pollut. Bull. 44: 230–237. [ Links ]
Gonzalez JF, Del Valle PL, Thohan S, Kane AS. 2000. Effects of waterborne nitrite on phase I–II biotransformation in channel catfish (Ictalurus punctatus). Mar. Environ. Res. 50: 29–32. [ Links ]
Habig WH, Pabst MJ, Jakoby WB. 1974. Glutathione S– Transferases: First enzymatic step in mercapturic acid formation. J. Biol. Chem. 249: 7130–7139. [ Links ]
Hargreaves JA. 1998. Nitrogen biogeochemistry of aquaculture ponds. Aquaculture 166: 181–212. [ Links ]
Harvey RG. 1991. Polycyclic Aromatic Hydrocarbons: Chemistry and Carcinogenicity. Cambridge Univ. Press, Cambridge. [ Links ]
Huertas M, Gisbert E, Rodriguez A, Cardona L, Williot P, Castello–Orvay F. 2002. Acute exposure of Siberian sturgeon (Acipenser baeri, Brandt) yearlings to nitrite: Median–lethal concentration (LC50) determination, haematological changes and nitrite accumulation in selected tissues. Aquat. Toxicol. 57: 257–266. [ Links ]
Jee JH, Kang JC. 2005. Biochemical changes of enzymatic defence system after phenanthrene exposure in olive flounder, Paralichthys olivaceus. Physiol. Res. 54: 585–591. [ Links ]
Jensen FB. 2003. Nitrite disrupts multiple physiological functions in aquatic animals. Comp. Biochem. Physiol. A 135: 9–24. [ Links ]
Kim IY, Hyun CK. 2006. Comparative evaluation of the alkaline comet assay with the micronucleus test for genotoxicity monitoring using aquatic organisms. Ecotoxicol. Environ. Saf. 64: 288–297. [ Links ]
Krahn MM, Kittle JLJ, MacLeod JWD. 1986. Evidence for exposure of fish to oil spilled into the Columbia River. Mar. Environ. Res. 20: 291–298. [ Links ]
Krahn MM, Ylitalo GM, Buzitis J, Bolton JL, Wigren CA, Chan S–L, Varanasi U. 1993. Analyses for petroleum–related contaminants in marine fish and sediments following the Gulf oil spill. Mar. Pollut. Bull. 27: 285–292. [ Links ]
Lin E, Cormier SM, Racine RN. 1994. Synchronous fluorimetric measurement of metabolites of polycyclic aromatic hydrocarbons in bile of brown bullhead. Environ. Toxicol. Chem. 13: 707–715. [ Links ]
MacRae JD, Hall KJ. 1998. Biodegradation of polycyclic aromatic hydrocarbons (PAH) in marine sediment under denitrifying conditions. Water Sci. Technol. 38: 177–185. [ Links ]
Monteiro PRR, Reis–Henriques MA, Coimbra J. 2000. Polycyclic aromatic hydrocarbons inhibit in vitro ovarian steroidogenesis in the flounder (Platichthys flesus L.). Aquat. Toxicol. 48: 549–559. [ Links ]
Murchelano RA, Wolke RE. 1985. Epizootic carcinoma in the winter flounder, Pseudopeurtaectes americanus. Science 228: 587–589. [ Links ]
Myers MS, Landhal JT, Krahn MM, McCain BB. 1991. Relationship between hepatic neoplasm and related lesions and exposure to toxic chemicals in marine fish from the West Coast. Environ. Health Perspect. 90: 7–15. [ Links ]
Oliveira M, Pacheco M, Santos MA. 2007. Cytochrome P4501A, genotoxic and stress responses in golden grey mullet (Liza aurata) following short–term exposure to phenanthrene. Chemosphere 66: 1284–1291. [ Links ]
Pacheco M, Santos MA. 1997. Induction of EROD activity and genotoxic effects by polycyclic aromatic hydrocarbons and resin acids on the juvenile eel (Anguilla anguilla L.). Ecotoxicol. Environ. Saf. 38: 252–259. [ Links ]
Pacheco M, Santos MA. 1998. Induction of liver EROD and erythrocytic nuclear abnormalities by cyclophosphamide and PAHs in Anguilla anguilla L. Ecotoxicol. Environ. Saf. 40: 71–76. [ Links ]
Pangrekar J, Kandaswami C, Kole P, Kumar S, Sikka HC. 1995. Comparative metabolism of benzo(a)pyrene, chrysene and phenanthrene by brown bullhead liver microsomes. Mar. Environ. Res. 39: 51–55. [ Links ]
Pangrekar J, Kole PL, Honey SA, Kumar S, Sikka HC. 2003. Metabolism of phenanthrene by brown bullhead liver microsomes. Aquat. Toxicol. 64: 407–418. [ Links ]
Pathiratne A, George S. 1996. Comparison of xenobiotic metabolizing enzymes of tilapia with those of other fish species and interspecies relationships between gene families. Mar. Environ. Res. 42: 293–296. [ Links ]
Sai Y, Dai R, Yang TJ, Krausz KW, Gonzalez FJ, Gelboin HV, Shou M. 2000. Assessment of specificity of eight chemical inhibitors using cDNA–expressed cytochromes P450. Xenobiotica 30: 327–343. [ Links ]
Schlezinger JJ, Stegeman JJ. 1999. Oxidative inactivation of cytochrome P450 1A (CYP1A) stimulated by 3,3',4,4'–tetrachlorobiphenyl: Production of reactive oxygen by vertebrate CYP1As. Mol. Pharmacol. 56: 588–597. [ Links ]
Shailaja MS, D'Silva C. 2003. Evaluation of impact of PAH on a tropical fish, Oreochromis mossambicus using multiple biomarkers. Chemosphere 53: 835–841. [ Links ]
Shailaja MS, Rodrigues A. 2003. Nitrite–induced enhancement of toxicity of phenanthrene in fish and its implications for coastal waters. Estuar. Coast. Shelf Sci. 56: 1107–1110. [ Links ]
Shailaja MS, Rajamanickam R, Wahidulla S. 2006. Increased formation of carcinogenic PAH metabolites in fish promoted by nitrite. Environ. Pollut. 143: 174–177. [ Links ]
Shimada T, Yamazaki H, Foroozesh M, Hopkins NE, Alworth WL, Guengerich FP. 1998. Selectivity of polycyclic inhibitors for human cytochrome P450s 1A1, 1A2, and 1B1. Chem. Res. Toxicol. 11: 1048–1056. [ Links ]
Stegeman JJ, Hahn ME. 1994. Biochemistry and molecular biology of monooxygenase: Current perspective on forms, functions and regulation of cytochrome P450 in aquatic species. In: Mallins DC, Ostrander GK (eds.), Aquatic Toxicology: Molecular, Biochemistry and Cellular Perspectives. Lewis Publishers, CRC Press, Boca Raton, pp. 87–206. [ Links ]
Stroomberg GJ, Reuther C, Kozin I, van Brummelen TC, van Gestel CAM, Gooijer C, Cofino WP. 1996. Formation of pyrene metabolites by the terrestrial isopod Porcellio scaber. Chemosphere 33: 1905–1914. [ Links ]
Svobodova Z, Machova J, Drastichova J, Groch L, Luskova V, Poleszczuk G, Velisek J, Kroupova H. 2005. Haematological and biochemical profiles of carp blood following nitrite exposure at different concentrations of chloride. Aquacult. Res. 36: 1177–1184. [ Links ]
Van der Oost R, Beyer J, Vermeulen NPE. 2003. Fish bioaccumulation and biomarkers in environmental risk assessment: A review. Environ. Toxicol. Pharmacol. 13: 57–149. [ Links ]
Wang YB, Zhang WJ, Li WF, Xu ZR. 2006. Acute toxicity of nitrite on tilapia (Oreochromis niloticus) at different external chloride concentrations. Fish Physiol. Biochem. 32: 49–54. [ Links ]
Watson GM, Andersen OK, Galloway TS, Depledge MH. 2004. Rapid assessment of polycyclic aromatic hydrocarbon (PAH) exposure in decapod crustacean by fluorimetric analysis of urine and haemolymph. Aquat. Toxicol. 67: 127–142. [ Links ]
Weber LP, Janz DM. 2001. Effect of [beta]–naphthoflavone and dimethylbenz[a]anthracene on apoptosis and HSP70 expression in juvenile channel catfish (Ictalurus punctatus) ovary. Aquat. Toxicol. 54: 39–50. [ Links ]
Whyte JJ, Jung RE, Schmitt CJ, Tillitt DE. 2000. Ethoxyresorufin–O– deethylase (EROD) activity in fish as a biomarker of chemical exposure. Crit. Rev. Toxicol. 30: 347–570. [ Links ]
Willett KL, McDonald SJ, Steinberg MA, Beatty KB, Kennicutt MC, Safe SH. 1997. Biomarker sensitivity for polynuclear aromatic hydrocarbon contamination in two marine fish species collected in Galveston Bay, Texas. Environ Toxicol. Chem. 16: 1472–1479. [ Links ]
* DESCARGAR VERSIÓN BILINGÜE (INGLÉS–ESPAÑOL) EN FORMATO PDF
Traducido al español por Christine Harris.














