Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.35 no.1 Ensenada mar. 2009
Artículos de investigación
Environmental factors influencing the variability of Lingulodinium polyedrum and Scrippsiella trochoidea (Dinophyceae) cyst production*
Factores ambientales que influyen en la variabilidad de la producción de quistes de Lingulodinium polyedrum y Scrippsiella trochoidea (Dinophyceae)
JL Peña–Manjarrez*1, 2, G Gaxiola–Castro2, J Helenes–Escamilla3
1 Dirección General de Educación en Ciencia y Tecnología del Mar, Centro de Estudios Tecnológicos del Mar en Ensenada, Km 6.5 Carretera Ensenada–Tijuana, Ensenada, Baja California, México.
2 Departamento de Oceanografía Biológica, División de Oceanología, Centro de Investigación Científica y de Educación Superior de Ensenada (CICESE), Km 107 Carretera Tijuana–Ensenada, Ensenada, Baja California, México. * E–mail: jopema@cicese.mx
3 Departamento de Geología, División de Ciencias de la Tierra, Centro de Investigación Científica y de Educación Superior de Ensenada (CICESE), Km 107 Carretera Tijuana–Ensenada, Ensenada, Baja California, México.
Recibido en febrero de 2008.
Aceptado en noviembre de 2008.
Abstract
This study analyzes the temporal variability of the abundance of Lingulodinium polyedrum and Scrippsiella trochoidea resting cysts in surface sediments, as well as the temporary cysts and vegetative cells of L. polyedrum in the upper water column of Todos Santos Bay (Baja California, Mexico). Samples were collected monthly from January 2002 to June 2005 at four sites. Multidimensional scaling analysis and analysis of similarities revealed that resting cysts are distributed heterogeneously according to the sedimentary environment. Surface water temperature, inorganic dissolved phosphate, and the abundance of temporary cysts were the main factors influencing the abundance of L. polyedrum resting cysts, while the variability of temporary cysts was explained by the abundance of planktonic cells. Scrippsiella trochoidea resting cysts showed no statistical relationship with the environmental factors considered. Local runoff during the rainy season and sewage from the city of Ensenada contribute to the eutrophication of the bay. This is an important factor for future blooms since inorganic dissolved nitrate + nitrite and daylight hours during the spring–summer season are not limiting factors for dinoflagellate growth. After the dinoflagellate blooms, there was massive cyst production of both species, and the new cysts settled on the surface sediments. Surface water temperatures between 17°C and 22.5°C during spring–summer appear to trigger excystment in these species.
Key words: Baja California, cysts, dinoflagellates, Lingulodinium, Scrippsiella.
Resumen
Se estudió la variabilidad temporal de las abundancias de quistes de reposo de Lingulodinium polyedrum y Scrippsiella trochoidea en los sedimentos superficiales, así como los quistes temporales y células vegetativas de L. polyedrum en la parte superior de la columna de agua en la Bahía de Todos Santos (Baja California, México). Las muestras fueron recolectadas mensualmente de enero de 2002 a junio de 2005 en cuatro localidades. El análisis multidimensional escalado y el análisis de similitud mostraron que los quistes de reposo se distribuyen heterogéneamente de acuerdo con el ambiente sedimentario. Los principales factores que influyeron en la producción de quistes de reposo para L. polyedrum son la temperatura superficial, los fosfatos inorgánicos y la abundancia de quistes temporales, mientras que la variabilidad de los quistes temporales se explicó por la abundancia de células planctónicas. Los quistes de reposo de S. trochoidea no tuvieron relación estadística con los factores ambientales considerados. Las escorrentías locales durante la temporada de lluvias y las aguas residuales de la ciudad de Ensenada contribuyen a la eutroficación de la bahía, lo cual es un factor importante para futuros florecimientos donde los nitratos + nitritos inorgánicos disueltos y las horas de luz durante primavera–verano no son limitantes para el crecimiento de los dinoflagelados. Al término de los florecimientos de dinoflagelados hubo una producción masiva de quistes de ambas especies, en los que los quistes recién formados se depositaron en los sedimentos superficiales. El factor que induce el desenquistamiento parece ser una ventana térmica entre 17°C y 22.5°C de la columna de agua durante primavera–verano.
Palabras clave: Baja Calirfornia, dinoflagelados, quistes, Lingulodinium, Scrippsiella.
Introducción
Varias especies de dinoflagelados producen quistes como parte de su ciclo de vida. Los quistes desempeñan varios papeles importantes en la ecología y dinámica de los florecimientos de dinoflagelados: recombinación genética (Dale 1983), dispersión (Anderson et al. 2003), supervivencia en condiciones desfavorables (Nehring 1993), terminación de los florecimientos (Heiskanen 1993), semilla para el inicio de futuros florecimientos y regulación de la sucesión estacional (Anderson et al. 1983, Ishikawa y Taniguchi 1996). Por lo tanto, la información sobre la distribución y abundancia de quistes en los sedimentos y en la columna de agua es esencial para conocer la ecología y la dinámica de los florecimientos de muchas especies de dinoflagelados.
Radi y DeVernal (2004) sugirieron que los conjuntos de quistes de dinoflagelados pueden utilizarse para deducir las condiciones de la producción primaria, la temperatura y la salinidad, y demostraron que los parámetros ambientales más importantes que se relacionan con la distribución de dinoquistes cerca de la isla de Vancouver son la distancia a la costa, la distancia al puerto, los valores de salinidad superficial en primavera, la concentración de fosfatos y la productividad de primavera. Holzwarth et al. (2007) estudiaron la distribución de quistes de dinoflagelados con paredes orgánicas, en los sedimentos superficiales de la plataforma del sistema de surgencias de Benguela en relación con las condiciones ambientales y reportaron que, además de los gradientes longitudinales, la distribución de dinoquistes reflejaba claramente las características ambientales.
Si bien los factores ambientales que controlan el enquistamiento y exquistamiento de dinoflagelados no se han entendido totalmente, algunos experimentos de laboratorio sugieren que el fósforo y/o la limitación de nitrógeno inducen la reproducción sexual y promueven el enquistamiento en algunas de estas especies (Figueroa y Bravo 2005). Sin embargo, no hay evidencias de que en condiciones naturales esta limitación produzca el mismo efecto (Godhe et al. 2001).
Varios estudios han documentado la influencia del calentamiento global reciente sobre los quistes de dinoflagelados de la Cuenca de Santa Barbara (Prauss 2002). Otros trabajos han explorado la variabilidad en la abundancia de quistes, su composición y su diversidad, y han concluido que estas diferencias muestran los grandes cambios en el clima y la circulación oceánica en la región durante los últimos 40,000 años (Pospelova et al. 2006, 2008). También se ha encontrado que los incrementos en los florecimientos algales nocivos durante los últimos 50 años en las costas del Atlántico y el Pacífico de Canadá parecen estar controlados por factores de escala global como el cambio climático y el incremento en el tráfico de embarcaciones comerciales (Mudie et al. 2002). Sin embargo, son escasos los estudios sobre la distribución espacial y temporal de quistes recientes, así como el registro palinológico de las costas de México (Martínez–Hernández y Hernández–Campos 1991, Peña–Manjarrez et al. 2005, Martínez–López et al. 2007, Vásquez–Bedoya et al. 2008).
La zona costera del Sur de California ha presentado florecimientos recurrentes de dinoflagelados al menos desde 1901 (Holmes et al. 1967). Las especies más reportadas durante estos florecimientos son Lingulodinium polyedrum (Stein) Dodge, Prorocentrum micans (Ehrenberg), Prorocentrum gracile (Schütt), Ceratium furca (Ehrenberg) Claparède y Lachmann, y Scrippsiella trochoidea (Stein) Loeblich III (Gregorio y Pieper 2000, Peña–Manjarrez et al. 2001). Lingulo–dinium polyedrum produce quistes con paredes de dinosporina, mientras que S. trochoidea produce quistes calcáreos.
La ecología del enquistamiento y exquistamiento de L. polyedrum y S. trochoidea en la Bahía de Todos Santos es un proceso complejo que involucra muchos mecanismos desconocidos. Además, las respuestas ecológicas a las condiciones ambientales que desencadenan la fase de transición de estas especies en la bahía son todavía poco conocidas. Por lo anterior, el objetivo de este trabajo fue relacionar factores ambientales como la disponibilidad de nutrientes inorgánicos disueltos, la irradiancia fotosintéticamente activa, la temperatura superficial y la salinidad, con la variabilidad de los quistes y las células vegetativas de dinoflagelados.
Materiales y métodos
Área de estudio
La Bahía de Todos Santos (BTS) se localiza en la costa noroeste del Pacífico de Baja California, México (31°42'–31°55' N, 116°36'–116° 48' W; fig. 1), y tiene una superficie aproximada de 250 km2 y una profundidad media de 50 m. En el suroeste de la bahía se ubica un cañón con profundidad ligeramente mayor a 300 m. La ciudad de Ensenada (228 km2, con aproximadamente 300,000 habitantes) está situada al este de la bahía. Los procesos de surgencia en las áreas costeras cercanas a la bahía introducen agua subsuperficial fría y rica en nutrientes, lo que resulta en una disminución de la temperatura superficial en la BTS (Torres et al. 2006).

Durante el periodo otoño–invierno las corrientes superficiales transcurren a un promedio de 5 cm s–1 (Álvarez–Sánchez et al. 1988). Este patrón de circulación promueve un flujo principalmente en dirección sureste hacia dentro de la bahía, excepto cuando el flujo cambia de dirección hacia el noreste al llegar a Punta Banda. Este cambio en la dirección promueve una celda de circulación contra solem que induce un flujo superficial hacia fuera de la bahía por el área de Punta Banda (fig. 1).
Aunque la región del sur de California está expuesta a sequías prolongadas, hay una breve temporada de lluvias de invierno caracterizada por oscilaciones multidecadales (~40 años), decadales (~15 años) e interanuales de la precipitación, que se asocian con las señales del Índice de Oscilación del Sur y la Oscilación Decadal del Pacífico (Reyes–Coca y Troncoso–Gaytán 2004).
Muestreo y análisis de laboratorio
Se recolectaron mensualmente sedimentos superficiales desde enero de 2002 hasta junio de 2005 en cuatro localidades dentro de la BTS: San Miguel (SM), Puerto Interior (PI), Arroyo el Gallo (AG) y Rincón Ballenas (RB) (fig. 1). Las muestras se recolectaron con una draga Birgé–Ekman modificada. Se recolectaron los primeros 2 cm de sedimentos y se mantuvieron en bolsas de plástico a 4°C hasta su análisis. Las muestras fueron tamizadas con mallas de 147 y 15 µm. La fracción resultante se separó por gradiente de densidad durante 15 min a 2250 g en una solución de politungstato de sodio (Na6 [H2W12O40]) con densidad específica = 2.0 g cm–3. El material recuperado se montó en preparaciones permanentes con gelatina glicerinada y sellado con resina óptica (NOA–61/Y37–322). Las preparaciones se analizaron en un microscopio de luz (Carl Zeiss AxioscoP40) con magnificación de 400x. Los quistes de L. polyedrum y S. trochoidea fueron contados en su totalidad en cada muestra. Debido a que no se utilizó una muestra externa como control; se estimaron las abundancias relativas como el total de quistes por gramo de sedimento en peso seco.
Se obtuvieron perfiles continuos de temperatura y salinidad de la columna de agua con un CTD (SBE19–03, Seabird Electronics). Las muestras para el análisis de nutrientes inorgánicos disueltos y células de dinoflagelados se recolectaron con un tubo segmentado (0 a 3 m de profundidad). Las concentraciones (µM) de nitratos + nitritos inorgánicos disueltos y fosfato inorgánico disuelto se determinaron con un autoanalizador de flujo segmentado (Skalar SANplus System II). Como medida del nivel de eutroficación, se estimó un índice de eutroficación por nutrientes aplicando el método propuesto por Karydis et al. (1983).
Las muestras de fitoplancton se fijaron con una solución concentrada de lugol–acetato. La cuantificación de las células de dinoflagelados y quistes temporales se realizó por el método de Utermöhl (1958) utilizando un microscopio invertido con contraste de fases (Olympus CK 2) y magnificación de 200x.
Análisis estadístico
Para interpretar el patrón de distribución de quistes de reposo se realizó un análisis multidimensional escalado (MDS, Primer v.5). Las matrices triangulares de similitud se construyeron utilizando la transformación log10 (x + 1) de Bray–Curtis sobre las abundancias de quistes de reposo. Como datos de entrada para el análisis se utilizaron las abundancias de quistes de reposo de ambas especies. Los factores considerados como parámetros pasivos fueron la localidad, estación del año, y el tamaño del sedimento. Después del análisis MDE se realizó un análisis de similitud de dos vías sin réplica (ANOSIM) para probar la significancia de las diferencias entre localidades, utilizando la prueba de permutación sobre la matriz de similitud (Clarke y Green 1988). Para conocer el efecto de las factores ambientales sobre la variabilidad en la abundancia de quistes de reposo se realizó un análisis de regresión múltiple (ARM, Statistica v.7).
Resultados
Temperatura
Durante todo el periodo la temperatura superficial media en todas las localidades varió entre 12.7°C y 22.8°C (fig. 2a). Los valores más bajos (12°C en SM y 14°C en RB) se registraron en el invierno cuando la mezcla vertical promovió una temperatura homogénea desde la superficie hasta 20 m de profundidad. Los valores máximos de temperatura superficial (22°C en SM y 24.5°C en RB) se registraron durante los periodos de verano, cuando la columna de agua estaba estratificada. La temperatura superficial de invierno–verano presentó una diferencia de 8°C a 8.5°C.
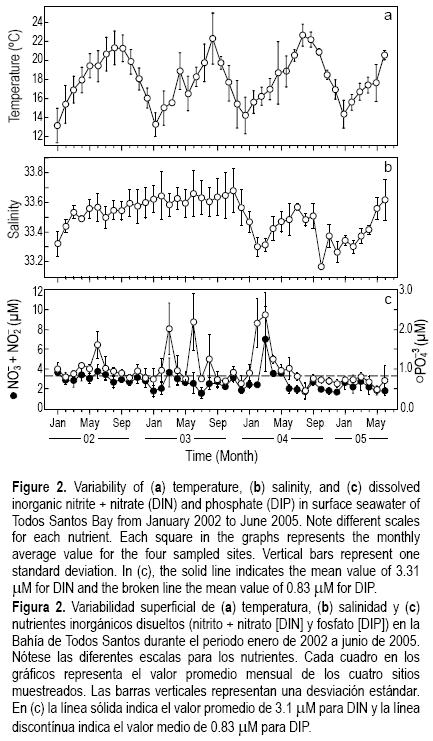
Los perfiles de CTD (datos no mostrados) indican que la BTS se caracterizó por una estratificación térmica durante primavera y verano. Esta estratificación fue muy variable entre las localidades de muestreo. Mientras que SM mostró una columna de agua bien mezclada durante la mayor parte del año, en contraste RB, PI y AG mostraron una columna de agua estratificada durante toda la temporada de primavera–verano. La máxima variabilidad en la temperatura superficial se midió en SM y PI, con un gradiente anual de 9°C, seguido por RB con un gradiente de 8°C y la mínima variabilidad anual de 4°C correspondió a AG (fig. 2a).
Salinidad
El promedio mensual de salinidad superficial de enero de 2002 a diciembre de 2003 no registró fuertes cambios, solamente un ligero aumento de 33.3 a 33.7 en el promedio mensual (fig. 2b). Las salinidades más bajas se registraron durante 2004, el año más lluvioso del periodo de estudio con una precipitación anual de 401.1 mm (Observatorio Meteorológico de CICESE; ftp://ftp.cicese.mx/pub/divOC/ocefisica/vientos/sauzal/MET/). Otros promedios bajos de salinidad se registraron en AG, SM y PI durante cada invierno, también asociadas con el aporte de los arroyos durante la temporada de lluvias. Los valores más altos del promedio mensual de salinidad superficial oscilaron entre 33.58 y 33.68 y se registraron de enero a noviembre de 2003, con una precipitación media de 18.9 mm.
Nitrógeno y fosfato inorgánicos disueltos
El nitrógeno y fosfato inorgánicos disueltos determinados como NO–3 + NO–2 (DIN) y PO–34 (DIP), siguieron un patrón similar en todas las localidades. Se registraron concentraciones medias de 3.31 µM para el DIN y 0.83 µM para el DIP (fig. 2c). Las concentraciones máximas de DIN para todas las localidades oscilaron entre 4.12 y 4.90 µM al inicio de la primavera, disminuyendo a 1.20 µM durante mayo y junio de cada año. Además, durante el verano se registraron incrementos irregulares de DIN, con concentraciones desde 4.14 µM en RB hasta 7.60 µM en SM. En contraste con el DIN, el DIP registró menor concentración y menor variabilidad. Los valores máximos al inicio de la primavera también fueron mayores al promedio, desde 0.93 µM en RB hasta 1.11 µM en SM, y desde 1.64 µM en PI hasta 7.94 en AG. El DIP también mostró incrementos aleatorios durante el verano de cada año, con pulsos de menor magnitud que el DIN.
Irradiancia
La irradiancia fotosintéticamente disponible (EPAR) en la parte subsuperficial alcanzó valores máximos desde mayo hasta agosto de cada año, con un promedio de 345 µmol cuanta m–2 s–1, entre las 8:00 y 14:00 horas (datos no mostrados). Cuando se presentaron los florecimientos de dinoflagelados cerca de la superficie la EPAR media fue de 125 µmol cuanta m–2 s–1 en las horas de la mañana.
Células de dinoflagelados y quistes temporales
Los dinoflagelados mostraron una fuerte variabilidad estacional. Los taxa comunes en la columna de agua (0–3 m) fueron Ceratium, Lingulodinium, Prorocentrum y Scrippsiella. Cuando no hubo florecimientos estos géneros coexistieron con abundancias totales del orden de 102 a 104 células L–1. Otros de los principales taxones que ocurrieron durante el verano fueron Protoperidinium (Bergh), Amphidinium, Gymnodinium, Gyrodinium, y el complejo mikimotoi.
Los florecimientos de dinoflagelados se desarrollaron periódicamente durante primavera–verano. Estos florecimientos comúnmente iniciaron en abril y permanecieron con abundancias intermitentes hasta agosto, y de forma excepcional hasta septiembre en 2005. La mayoría de estos eventos fueron dominados por L. polyedrum alcanzando abundancias de 105 a 106 células L–1 (fig. 3). Estos florecimientos no fueron siempre simultáneos en todas las localidades, pero presentaron una distribución irregular. Sus manchas superficiales cambiaron de posición durante el día en estrecha relación con el esfuerzo del viento sobre la superficie del mar.

Las especies formadoras de quistes L. polyedrum y S. trochoidea mostraron tendencias comparables en su variabilidad temporal y espacial. Durante los florecimientos L. polyedrum alcanzó abundancias de hasta tres órdenes de magnitud mayores que S. trochoidea.
Los quistes temporales de L. polyedrum mostraron abundancias máximas durante los florecimientos de julio a septiembre, cuando las células planctónicas se encontraban en grandes densidades y poco tiempo después de las proliferaciones, con poco o ningún desarrollo en otros meses (fig. 4). Las abundancias máximas de quistes temporales de 76 x 103 y 50 x 103 quistes L–1 se observaron en mayo de 2003 y mayo de 2005 en PI.

Quistes de reposo
Los quistes de reposo de L. polyedrum y S. trochoidea (fig. 5) en los sedimentos superficiales mostraron una fuerte variabilidad estacional en todas las localidades (fig. 6). Después del periodo primavera–verano los quistes de reposo para ambas especies tuvieron una fuerte disminución durante otoño–invierno de cada año. En SM, los quistes de reposo de L. polyedrum alcanzaron su máximo en agosto de 2002 (279 quistes g–1) y el mínimo en enero de 2004 (9 quistes g–1). Las menores abundancias de quistes de reposo para este género se asociaron con una temperatura superficial del mar <17°C, mientras que las mayores abundancias correspondieron a temperaturas superficiales en el intervalo de 17°C a 22.5°C. Además, en SM los quistes de reposo de S. trochoidea mostraron una tendencia similar durante los meses de verano.

Las abundancias de quistes de reposo en las otras localidades de BTS variaron entre 263 y 970 quistes g–1 para L. polyedrum en RB y AG, respectivamente; mientras que para S. trochoidea los conteos fueron de 13 y 76 quistes g–1 en PI y RB. Las mayores abundancias de quistes de reposo para L. polyedrum se encontraron en RB, con una fuerte señal para el máximo durante el verano de cada año (fig. 6), asociado con un promedio de 22°C de temperatura superficial, y grandes abundancias de células planctónicas en el intervalo de 1.5 x 103 a 3 x 103 células L–1.
La distribución de quistes de reposo mostró tres grupos (estrés 0.7): el primero correspondió a SM, asociado con la intensa dinámica física y sedimento grueso; un segundo grupo perteneció a RB con menor efecto dinámico y sedimentos finos; y el tercero asociado con los sedimentos más finos. El último grupo estuvo representado por PI y AG, con un patrón de distribución de los quistes de reposo similar a un núcleo en los sedimentos superficiales (fig. 7). El ANOSIM mostró que el patrón de distribución de las abundancias de los quistes de reposo para ambas especies no tuvo diferencias significativas entre las localidades PI, AG y RB (p***, r global = 0.236), pero si hubo una diferencia significativa para SM (p*, r =–0.06) (tabla 1).

El ARM mostró que el efecto combinado de la temperatura, el DIP y las abundancias de quistes temporales explicaron el 48% de la variabilidad (r2 = 0.48, p***, α = 0.05) para las abundancias de los quistes de reposo de L. polyedrum en los sedimentos superficiales. Además, 54% de la variabilidad de quistes temporales en la columna de agua se explicó por la abundancia de células planctónicas (r2 = 0.54, p***, α = 0.05), mientras que los otros factores ambientales no mostraron ninguna relación. El ARM para los quistes de reposo de S. trochoidea no mostró relación estadísticamente significativa con los factores ambientales considerados en este estudio.
Discusión
Se ha demostrado que L. polyedrum domina la composición del conjunto de quistes en BTS, y que la fuerte estacionalidad de los quistes de reposo de esta especie se asocia principalmente con la temperatura superficial (Peña–Manjarrez et al. 2005). De acuerdo con nuestras observaciones, los florecimientos de L. polyedrum en la BTS generalmente iniciaron cuando la temperatura superficial del mar se encontró entre 17°C y 22.5°C, sugiriendo que esta "ventana térmica" controla las diferentes etapas del ciclo de vida de la especie. Para Gymnodinium catenatum, Band–Smith et al. (2004) en cultivos encontraron que el intervalo óptimo de temperatura para su crecimiento fue de 11.5°C a 30°C con tasas máximas de crecimiento entre 21°C y 29°C.
En experimentos de germinación, Anderson (1980) encontró que la temperatura de 22°C condujo a un rápido desarrollo del hipnocigoto de Gonyaulax tamarensis (= Alexandrium tamarense), con la posible germinación un mes después de su formación. Los quistes formados en aguas templadas al final de la primavera son capaces de exquistar varios meses después conforme la temperatura de otoño disminuye; los quistes formados en el otoño requieren más tiempo para madurar pero son viables después de seis meses de invernación (Anderson 1980). Esto hace posible la ocurrencia de florecimientos alternados en primavera y otoño alimentados por poblaciones semilla de quistes de reposo.
Las concentraciones medias de nutrientes fueron de 3.31 µM para el DIN y de 0.83 µM para el DIP. Sin embargo, antes de los florecimientos y durante la primavera de cada año, a excepción de 2005, ambos nutrientes tuvieron un incremento importante, especialmente el DIP que alcanzó el doble o un poco más del doble de la concentración media (fig. 2c). Parece ser que estos aportes de nutrientes estuvieron relacionados con el inicio de los florecimientos de dinoflagelados, que generalmente empiezan en la primavera y continúan durante el verano.
De agosto de 2004 a mayo de 2005 las concentraciones de nutrientes registraron los valores más bajos, aunque en marzo de 2005 se registró un ligero incremento. En abril de 2005 inició el florecimiento de dinoflagelados de mayor duración que se haya registrado en la BTS, con grandes abundancias de especies tecadas (P. micans, C. furca y L. polyedrum). Durante junio la composición de dinoflagelados cambió, estando representado principalmente por géneros atecados (Amphidinium spp., Gyrodinium spp., Gymnodinium spp. y especies del complejo mikimotoi). Este florecimiento se desarrolló de abril a septiembre, con abundancias celulares intermitentes, pero en junio, cuando el florecimiento se encontraba en un periodo de decaimiento, el DIN alcanzó valores de 7.6 µM en SM, mientras que el DIP mantuvo concentraciones inferiores a 0.67 µM. Estas condiciones promovieron la recuperación de grandes abundancias celulares. La recuperación del florecimiento en junio de 2005 puede explicarse debido a que las horas de luz durante el día (14.15 h) y la temperatura superficial (20.7°C) fueron las apropiadas para promover el crecimiento de estas especies de dinoflagelados.
Existen diferentes fuentes locales de DIP y DIN en la BTS: agua de surgencias costeras transportadas al interior de la bahía (Espinosa–Carreón et al. 2001, Segovia–Zavala et al. 2007); aguas residuales vertidas desde la ciudad de Ensenada (Segovia–Zavala et al. 1988); escorrentías durante la temporada de lluvias; desechos de las granjas de atún, así como los cultivos de mejillón y ostión. En conjunto estos flujos contribuyen a mantener altas concentraciones de DIN y DIP, por lo que en consecuencia no existen limitaciones de estos recursos para el desarrollo de los florecimientos.
De acuerdo con el índice de eutroficación por nutrientes (IEN), en la BTS las aéreas influenciadas por descargas de aguas residuales (AG) recibieron las puntajes más altos (IEN > 5) para el DIN. Estos puntajes disminuyeron a niveles mesotróficos (3–5) en PI, RB y SM. En BTS no se encontraron áreas oligotróficas en DIN (IEN < 3). El IEN para el DIP presentó condiciones mesotróficas en AG y oligotróficas en PI, RB y SM. Estos índices sugieren que dentro de la BTS los nutrientes son prácticamente ilimitados para el crecimiento de los dinoflagelados.
La estequiometría media para las razones N:P en todas las localidades estuvo entre 4.0 y 9.67, lo que indica que los fosfatos siempre se encontraron en concentraciones superiores a las proporciones de Redfield en el medio marino natural (N:P = 16:1). El balance biogeoquímico de DIN y DIP indica que el ecosistema funciona como un sumidero para ambos tipos de nutrientes. Sobre una base anual la BTS puede ser considerada como un sistema "autotrófico" dado que la concentración de nutrientes asociada con la producción de materia orgánica se relaciona con el desarrollo florecimientos densos y recurrentes de dinoflagelados.
La mayor producción de quistes de reposo ocurrió durante y después de los florecimientos de primavera–verano. Una vez que inició la producción de quistes de reposo, ésta continúa durante todo el florecimiento incluyendo las fases de mantenimiento y decaimiento. Al final del periodo de florecimientos de cada año ocurre un enquistamiento masivo de las células planctónicas. Para S. trochoidea se han reportado procesos similares en cultivos estacionarios (Wang et al. 2006) y en condiciones naturales (Joyce y Pitcher 2004).
Después de que los quistes de reposo se forman en la columna de agua, su velocidad de asentamiento es controlada por sus características físicas, especialmente el tamaño, la densidad y la forma. Los quistes de S. trochoidea tienen una densidad de 1.32 g cm–3, mientras que Gonyaulax tamarensis (un Gonyaulacoideo similar a L. polyedrum) tiene una densidad de 1.24 g cm–3, y las velocidades de asentamiento estimadas son de 0.013 cm s–1 para el primero y 0.015 cm s–1 para el último (Anderson et al. 1985). Dado que la densidad media del agua de mar en la BTS es 1.026 g cm–3 (García–Córdova et al. 2005), sin la presencia de algún proceso físico que promueva la mezcla vertical, los quistes de ambas especies pueden llegar a los sedimentos superficiales en pocas horas y permanecer allí hasta presentarse una intensa perturbación física en la columna de agua. Nuestras observaciones mostraron que después del asentamientos los quistes de reposo pueden ser transportados hacia otras áreas, donde disminuye la velocidad de las corrientes dando lugar a un ambiente depositacional. Uno o varios de los siguientes mecanismos podrían estar implicados en este transporte: (1) la mezcla vertical es suficiente para remover los quistes del fondo, incluso durante la primavera–verano; (2) el flujo de marea transporta las partículas finas cerca de la costa; o (3) los quistes son resuspendidos en la columna de agua y quedan expuestos a la advección horizontal.
La mayor abundancia de quistes encontrados en RB estuvo asociada con la fracción de tamaño de los sedimentos en esa localidad (31 a 125 µm), que incluye el tamaño medio de los quistes de reposo de L. polyedrum (58 µm) y S. trochoidea (46 µm). Por otro lado, las grandes cantidades de quistes de reposo encontradas en PI y AG durante la primavera de cada año pueden estar relacionadas tanto con la fracción de arcillas finas y lodos con tamaños de 15 a 31 µm, y lo somero de esas localidades (10 y 12 m, respectivamente). Estas observaciones concuerdan con los resultados reportados por Hoorn (1997), quien determinó que las abundancias de palinomorfos, incluyendo a los dinoflagelados marinos, son ligeramente mayores en las muestras de lodos y menores en las muestras areno–lodosas.
Como PI y AG son localidades cercanas con características similares, se esperaba encontrar abundancias comparables de quistes de reposo en ambos sitios. Sin embargo, las menores cantidades de S. trochoidea en PI pueden explicarse por la presencia de H2S, que además de la ausencia de organismos bentónicos sugiere la presencia de condiciones anóxicas con altas concentraciones de amonio y bajo contenido de azufre, y valores de pH hasta 4.5 (Carreón–Martínez et al. 2002). Este ambiente puede causar intemperismo químico de las paredes calcáreas de los quistes de S. trochoidea, las cuales deben ser sensibles a los ácidos producidos en los sedimentos anóxicos donde podrían ser disueltas (Montresor et al. 1994, Persson y Rosenberg 2003).
Para determinar los quistes de reposo disponibles como semilla para iniciar un nuevo florecimiento se realizó una estimación considerando una viabilidad de exquistamiento media del 50% para L. polyedrum (Lewis et al. 1999). Además, se determinó que el peso seco de 1 m2 de los primeros 2 cm de la fracción arenosa es de 34 kg y de 10 kg para los sedimentos fango–arenosos de la BTS. Entonces, si las menores abundancias de L. polyedrum fueron de 62 quistes g–1 en los sedimentos arenosos de SM, y de 356 quistes g–1 en el fango de AG, estas localidades aportarían 1.05 x 106 y 1.78 x 106 quistes de reposo m–2, respectivamente.
En contraste, los quistes de S. trochoidea para los cuales se ha estimado una razón de germinación de 40–50% en condiciones naturales (Wang et al. 2007), tendrán un aporte de 0.081 x 106 y 0.99 x 106 células germinales m–2 en SM y AG. Estas cantidades de quistes de L. polyedrum y S. trochoidea son suficientes para aportar la semilla en la columna de agua e iniciar un nuevo florecimiento por lo menos en la franja costera de la BTS.
Los análisis MDE y ANOSIM confirman que hubo tres grupos de ambientes sedimentarios asociados con las abundancias de quistes de reposo. Este arreglo está claramente asociado con el tamaño de los sedimentos descritos para la BTS (Emery et al. 1957, Barrera–Gaona 1998); es decir, las arenas gruesas a finas con ø = 1 a 3 en SM, arena fina a limos gruesos con ø = 4 a 5 en RB y una fracción de fango con ø = 5 a 6 en PI y AG.
La homogeneidad de varianza entre los grupos RB, PI y AG, junto con la heterocedasticidad encontrada en SM, confirma que las abundancias de quistes de reposo estuvieron fuertemente controladas por factores físicos. Esto sugiere que existe una clasificación por tamaños de las partículas orgánicas de acuerdo con el ambiente sedimentario de la BTS como lo ha discutido Walton (1955).
Agradecimientos
Se agradece el financiero de la Coordinación Sectorial de Desarrollo Académico (COSDAC) y la Dirección General de Educación en Ciencia y Tecnología del Mar (DGECyTM) a través del proyecto 910.06–P. El primer autor obtuvo un beca de CONACYT y SEMARNAT (2004–COI–62). Se agradece a P Chagoya–Loli, L Lafarga–Cosio y M Ortega (CETMAR–Ensenada), y a V Acosta–Chamorro (SEMAR) y Z Mijangos–Alquisires (DGECyTM) por su ayuda en el trabajo de campo y laboratorio. Dos revisores anónimos y H Maske mejoraron la versión final de este trabajo. Gracias a JM Domínguez y F Ponce por las figuras.
Referencias
Álvarez–Sánchez LG, Hernández–Walls R, Durazo–Arvizu R. 1988. Drift patterns of Lagrangian tracers in Todos Santos Bay. Cienc. Mar. 14: 135–162. [ Links ]
Anderson DM. 1980. Effects of temperature conditioning on development and germination of Gonyaulax tamarensis (Dinophyceae) hypnozygotes. J. Phycol. 16: 166–72. [ Links ]
Anderson DM, Chisholm SW, Watras CJ. 1983. Importance of life cycle events in the population dynamics of Gonyaulax tamarensis. Mar. Biol. 76: 179–189. [ Links ]
Anderson DM, Lively JJ, Reardon EM, Price CA. 1985. Sinking characteristics of dinoflagellate cysts. Limnol. Oceanogr. 30: 1000–1009. [ Links ]
Anderson DM, Fukuyo Y, Matsuoka K. 2003. Cyst methodologies. In: Hallegraeff GM, Anderson DM, Cembella AD (eds.), Manual on Harmful Marine Microalge. UNESCO, Paris, pp. 165–189. [ Links ]
Band–Schmidt C, Morquecho L, Lechuga–Déveze CH, Anderson DM. 2004. Effects of growth medium, temperature, salinity and seawater source on the growth of Gymnodinium catenatum (Dinophyceae) from Bahía Concepción, Gulf of California, Mexico. J. Plankton Res. 26: 1459–1470. [ Links ]
Barrera–Gaona JA. 1998. Patrón de dispersión de sedimentos en la Bahía de Todos Santos, BC. Tesis de maestría, Facultad de Ciencias Marinas, UABC, Ensenada, BC. 54 pp. [ Links ]
Carreón–Martínez LB, Huerta–Díaz MA, Nava–López C, Sequeiros–Valencia A. 2002. Levels of reactive mercury and silver in sediments from the port of Ensenada, Baja California, Mexico. Bull. Environ. Contam. Toxicol. 68: 138–147. [ Links ]
Cembella AD, Turgeon J, Theriault JC, Béland P. 1988. Spatial distribution of Protogonyaulax tamarensis resting cysts in nearshore sediments along the north coast of the lower St. Lawrence Estuary. J. Shellfish Res. 7: 597–609. [ Links ]
Clarke KR, Green RH. 1988. Statistical design and analysis for a "biological effects" study. Mar. Ecol. Prog. Ser. 46: 226–231. [ Links ]
Dale B. 1983. Dinoflagellate resting cysts: "benthic plankton". In: Fryxell GA (ed.), Survival Strategies of the Algae. Cambridge Univ. Press, Cambridge, pp. 69–136. [ Links ]
Emery KO, Gorsline DS, Terry RD, Uchupi E. 1957. Sediments of three bays of Baja California [Mexico]: Sebastian Viscaino, San Cristobal and Todos Santos. J. Sediment. Res. 27: 95–115. [ Links ]
Espinosa–Carreón TL, Gaxiola–Castro G, Robles–Pacheco JM, Nájera–Martínez S. 2001. Temperature, salinity, nutrients and chlorophyll a in coastal waters of the Southern California Bight. Cienc. Mar. 27: 397–422. [ Links ]
Figueroa RI, Bravo I. 2005. Sexual reproduction and two different encystment strategies of Lingulodinium polyedrum (Dinophyceae) in culture. J. Phycol. 41: 370–379. [ Links ]
García–Córdova J, López MM, Pineda J, Pérez BP. 2005. Hidrografía de la costa oeste de California y Baja California. Reporte Técnico del crucero NOHYPE–1. R/V Gordon Sproul. Mayo 10–23 de 2001. Comunicaciones Académicas, Serie de Oceanografía Física, CICESE, Ensenada, BC. 37 pp. [ Links ]
Godhe A, Norén F, Kuylenstierna M, Ekbergi C, Karlson B. 2001. Relationship between planktonic dinoflagellate abundance, cysts recovered in sediment traps and environmental factors in the Gullmar Fjord, Sweden. J. Plankton Res. 23: 923–938. [ Links ]
Gregorio ED, Pieper RE. 2000. Investigations of red tides along the Southern California Coast. Bull. South. Calif. Acad. Sci. 99: 147–160. [ Links ]
Heiskanen AS. 1993. Mass encystment and sinking of dinoflagellates during a spring bloom. Mar. Biol. 116: 161–167. [ Links ]
Holmes RW, Williams PM, Eppley RW. 1967. Red water in La Jolla Bay, 1964–1966. Limnol. Oceanogr. 12: 503–512. [ Links ]
Holzwarth U, Esper O, Zonneveld K. 2007. Distribution of organic–walled dinoflagellate cysts in shelf surface sediments of the Benguela upwelling system in relationship to environmental conditions. Mar. Micropaleontol. 64: 91–119. [ Links ]
Hoorn C. 1997. Palynology of the Pleistocene glacial/interglacial cycles of the Amazon fan (Holes 940A, 944A and 946A). In: Flood RD, Piper DJW, Klaus A, Peterson LC (eds.), The Pleistocene sediments are Covered by Holocene Section. Proc. Ocean Drilling Project, Sci. Results, 155, College Station, Texas, pp. 397–409. [ Links ]
Ishikawa A, Taniguchi A. 1996. Contribution of benthic cysts to the population dynamics of Scrippsiella spp. (Dinophyceae) in Onagawa Bay, northeast Japan. Mar. Ecol. Prog. Ser. 140: 169–178. [ Links ]
Joyce LB, Pitcher GC. 2004. Encystment of Zigabikodinium lenticulatum (Dinophyceae) during a summer bloom of dinoflagellates in southern Benguela upwelling system. Estuar. Coast. Shelf Sci. 59: 1–11. [ Links ]
Karydis M, Ignatiades L, Moschopoulum N. 1983. An index associated with nutrient eutrophication in the marine environment. Estuar. Coast. Shelf Sci. 16: 339–344. [ Links ]
Lewis J, Harris A, Jones K, Edmonds R. 1999. Long–term survival of marine planktonic diatoms and dinoflagellates in stored sediment samples. J. Plankton Res. 21: 343–354. [ Links ]
Martínez–Hernández E, Hernández–Campos HE. 1991. Distribución de quistes de dinoflagelados y acritarcas en sedimentos holocénicos del Golfo de California. Paleontol. Mex. 57: 1–133. [ Links ]
Martínez–López A, Ulloa–Pérez AE, Escobedo–Urias DC. 2007. First record of vegetative cells of Pyrodinium bahamense (Gonyaulacales: Goniodomataceae) in the Gulf of California. Pac. Sci. 61: 289–293. [ Links ]
Montresor M, Montesarchio E, Marino D, Zingone A. 1994. Calcareous dinoflagellate cysts in marine sediments of the Gulf of Naples (Mediterranean Sea). Rev. Palaeobot. Palynol. 84: 45–56. [ Links ]
Mudie PJ, Rochon A, Levac E. 2002. Palynological records of red tide–producing species in Canada: Past trends and implications for the future. Palaeogeogr., Palaeoclimatol., Palaeoecol. 180: 159–186. [ Links ]
Nehring S. 1993. Mechanisms for recurrent nuisance algal blooms in coastal zones: Resting cyst formation as life–strategy of dinoflagellates. In: Sterr H, Hofstade J, Plag HP (eds.), Interdisciplinary Discussion of Coastal Research and Coastal Management Issues and Problems. Proc. Int. Coastal Congress, Frankfurt, pp. 454–467. [ Links ]
Peña–Manjarrez JL, Gaxiola–Castro G, Helenes–Escamilla J, Orellana–Cepeda E. 2001. Cysts of Lingulodinium polyedrum, red tide producing organism in Todos Santos Bay (winter–spring 2000). Cienc. Mar. 27: 543–558. [ Links ]
Peña–Manjarrez JL, Helenes–Escamilla J, Gaxiola–Castro G, Orellana–Cepeda E. 2005. Dinoflagellate cysts and bloom events at Todos Santos Bay. Cont. Shelf Res. 25: 1375–1393. [ Links ]
Persson A, Rosenberg R. 2003. Impact of grazing and bioturbation of marine benthic deposit feeders on dinoflagellate cysts. Harmful Algae 2: 43–50. [ Links ]
Pospelova V, Pedersen TF, de Vernal A. 2006. Dinoflagellate cysts as indicators of climatic and oceanographic changes during the past 40 kyr in the Santa Barbara Basin, southern California. Paleoceanography 21: 1–16. [ Links ]
Pospelova V, de Vernal A, Pedersen TF. 2008. Distribution of dinoflagellate cysts in surface sediments from the northeastern Pacific Ocean (43–25°N) in relation to sea–surface temperature, salinity, productivity and coastal upwelling. Mar. Micropaleontol. 68: 21–48. [ Links ]
Prauss ML. 2002. Recent global warming and its influence on marine palynology within the central Santa Barbara Basin, offshore Southern California, USA. Palynology 26: 217–238. [ Links ]
Radi T, DeVernal A. 2004. Dinocyst distribution in surface sediments from the nothesatern Pacific margin (40–60°N) in relation to hydrographic conditions, productivity and upwelling. Rev. Paleobot. Palinol. 28: 169–193. [ Links ]
Reyes–Coca S, Troncoso–Gaytán R. 2004. Multidecadal variation of winter rainfall in northwestern Baja California. Cienc. Mar. 30: 99–108. [ Links ]
Segovia–Zavala JA, Rivera–Duarte I, Del Valle–Villorín FJ. 1988. Efectos de desechos orgánicos en las zonas adyacentes a los efluentes en Bahía de Todos Santos: Nutrientes. Cienc. Mar. 14: 81–94. [ Links ]
Segovia–Zavala JA, Delgadillo–Hinojosa F, Muñoz–Barbosa A, Huerta–Díaz MA, Gutiérrez–Galindo EA, Canino–Herrera R, Hernández–Ayón JM. 2007. Variabilidad espacial y balance de fosfatos sobre la plataforma continental de la región fronteriza occidental México–EUA. Cienc. Mar. 33: 229–245. [ Links ]
Torres CR, Mejía A, Argote ML, Ramírez I, Mancillas M. 2006. Three–dimensional circulation in Todos Santos Bay, Ensenada, BC, Mexico. In: Gámez B, Ojeda D, Larrazabal G, Cerrolaza M. (eds.), Simulación y Modelado en Ingenieria y Ciencias. SVMNI, pp. MF115–MF122. [ Links ]
Utermöhl H. 1958. Zur vervollkommung der quantitativen phytoplankton–methodik. Verh. Int. Ver. Limnol. 9: 1–38. [ Links ]
Vásquez–Bedoya LF, Radi T, Ruiz–Fernández AC, de Vernal A, Machain–Castillo ML, Kielt JF, Hillaire–Marcel C. 2008. Organic– walled dinoflagellate cysts and benthic foraminifera in coastal sediments of the last century from the Gulf of Tehuantepec, South Pacific Coast of Mexico. Mar. Micropaleontol. 68: 49–65. [ Links ]
Walton RW. 1955. Ecology of living benthonic foraminifera, Todos Santos Bay, BC. J. Paleontol. 26: 952–1018. [ Links ]
Wang ZH, Yu–Zao Q, Chen Y. 2006. Phytoplankton abundance, community structure and nutrients in cultural areas of Daya Bay, South China Sea. J. Mar. Syst. 62: 85–94. [ Links ]
Wang ZH, Yu–Zao Q, Yu–Feng Y. 2007. Cyst formation: An important mechanism for the termination of Scrippsiella trochoidea (Dinophyceae) bloom. J. Plankton Res. 29: 209–218. [ Links ]
* DESCARGAR VERSIÓN BILINGÜE (INGLÉS–ESPAÑOL) EN FORMATO PDF














