Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Ciencias marinas
Print version ISSN 0185-3880
Cienc. mar vol.34 n.4 Ensenada Dec. 2008
Artículos
Caracterización biológica y ecológica del bagre Cathorops melanopus de la costa oeste de Campeche, México
Biological and ecological characterization of the catfish Cathorops melanopus off the west coast of Campeche, Mexico
LA Ayala-Pérez1,2, J Ramos-Miranda2, D Flores-Hernández2, BI Vega-Rodríguez1, UC Moreno-Medina1
1 Departamento El Hombre y su Ambiente, Universidad Autónoma Metropolitana Xochimilco, Calz. Del Hueso 1100, Col. Villaquietud, Coyoacán, 04960 México, DF. * E-mail: luayala13@yahoo.com.mx
2 Centro de Ecología, Pesquerías y Oceanografía del Golfo de México, Universidad Autónoma de Campeche, Av. Agustín Melgar s/n entre Juan de la Barrera y calle 20, Col. Buenavista, CP 24030, Campeche, Campeche, México.
Recibido en abril de 2008.
Aceptado en octubre de 2008.
Resumen
Cathorops melanopus es la especie de pez más abundante en la región occidental de la costa de Campeche. Su distribución está influenciada por la temperatura, la salinidad y la turbidez, mostrando preferencia por las desembocaduras de ríos. De febrero de 2003 a febrero de 2004 se recolectaron con una red de arrastre un total de 19,048 organismos en 37 estaciones ubicadas en la porción occidental de la costa de Campeche. De una submuestra, se midieron y pesaron individualmente 14,446 organismos. La longitud total de los organismos varió entre 35 y 302 mm, con una moda de 90 mm, y un intervalo de peso de 0.1 a 224 g, con una moda de 6 g. La mayor abundancia de organismos se registró en mayo, con valores de 1.24 ind m-2, 15.31 g m-2 y 12.26 g ind-1, y la menor en abril con 0.25 ind m-2, 2.5 g m-2 y 9.9 g ind-1. El modelo peso/talla se integró con los parámetros a = 1 × 10-5, b = 2.96 con una correlación de 0.95. El valor del factor de condición relativo presenta un pulso mayor en julio de 2.1 × 10-5. La proporción de sexos hembras:machos fue de 1:0.69. La mayoría de las hembras (111) de un total de 159 se encontraron en las fases II y III y sólo una en fase IV. El grupo alimenticio que más se encontró fue material orgánico no identificado con 79% de peso y 92.1% de frecuencia, seguido por restos de crustáceos, con 4.8% de peso y 10% de frecuencia. Los parámetros de crecimiento encontrados fueron L∞ = 317.5 mm, K = 0.45, C = 0.7, WP = 0.16 y t0 = -0.2163. La mortalidad total fue de 1.22 y la natural de 0.65. El reclutamiento se presenta con un pulso significativo entre julio y agosto con una aportación conjunta del 47.65%.
Palabras clave: bagre, Campeche, Cathorops melanopus, crecimiento, espectro trófico, mortalidad.
Abstract
Cathorops melanopus is the most abundant fish on the west coast of Campeche, Mexico. Its distribution is influenced by water temperature, salinity, and transparency, and it is frequently found in river outlets. To analyze the main biological and ecological patterns of this species, from February 2003 to February 2004 a total of 19,048 specimens were collected using a trawl net at 37 sampling stations along the west coast of Campeche. A subsample was formed of 14,446 randomly selected specimens, and each one was measured and weighed (length range = 35-302 mm, mode = 90 mm; weight range = 0.1-224 g, mode = 6 g). The highest mean abundance values were recorded in May (1.24 ind m-2, 15.31 g m-2, and 12.26 g ind-1), and the lowest in April (0.25 ind m-2, 2.5 g m-2, and 9.9 g ind-1). The parameters of the weight/length model were a = 1 × 10-5 and b = 2.96, with a correlation coefficient of 0.95. The relative condition factor showed a major pulse in July (2.1 × 10-5). The female:male ratio was 1:0.69. Of the 159 females collected, 111 had gonads at maturity stages II and III, and only one was in stage IV. The most common food item was unidentified organic matter, which represented 79% of the total stomach content weight and 92.1% of the encountered food types; the second most abundant food item was crustacean remains (4.8% of the total weight and 10% of the encountered contents). Growth parameters were: L∞ = 317.5 mm, K = 0.45, C = 0.7, WP = 0.16, and t0 = 7.5 × 10-12. Total mortality was 1.22, while natural mortality was 0.65. Recruitment patterns showed a significant pulse between July and August, which together contributed 47.65% of the total number of specimens collected.
Key words: Campeche, catfish, Cathorops melanopus, growth, mortality, trophic spectrum.
Introducción
El litoral entre Tabasco y Campeche es una zona importante para la pesca de camarón, especialmente del camarón siete barbas (Xiphopenaeus kroyeri Heller 1862 ). En esta actividad se observa una intensa captura de fauna de acompañamiento, la cual está integrada por cerca de 100 especies de peces con un aprovechamiento muy limitado. Entre las especies más abundantes de la fauna de acompañamiento del camarón siete barbas que no se aprovechan se encuentra el bagre Cathorops melanopus Günther 1864, que representa 42% del total de peces capturados incidentalmente. El bagre C. melanopus constituye un eslabón fundamental en el proceso de transformación, conducción, intercambio y almacenamiento de energía en el ecosistema. Esta especie ha sido reportada como habitante de diversos ambientes, desde hábitats con elevada salinidad, sedimentos arenosos y gran transparencia, con praderas de pastos marinos, hasta hábitats de aguas turbias, ricas en nutrientes, salinidad baja y de sedimentos limo-arcillosos, donde se le captura con más frecuencia, principalmente hacia la parte sur y suroccidental de la Laguna de Términos, en Campeche; es decir, en las áreas influenciadas por la descarga de ríos (Yáñez-Arancibia et al. 1985).
A pesar de la importancia ecológica de C. melanopus, sólo se han realizado unos cuantos trabajos específicos sobre su biología y ecología (Lara-Domínguez et al. 1981, Yáñez-Arancibia y Lara-Domínguez 1988, Vega-Cendejas 1990, Galindo-Cortes 2002). Estos trabajos coinciden en que C. melanopus tiene un alto nivel de adaptación morfológica, reproductiva, alimenticia y migratoria, íntimamente ligado a los procesos físico-ambientales y a la heterogeneidad del hábitat en los sistemas estuarino-lagunares, lo que ha permitido su gran éxito poblacional. Por ello, los objetivos de este estudio fueron: (a) analizar la distribución espacial y temporal de la abundancia; (b) determinar la relación talla-peso; (c) analizar la estructura por tallas de la población; (d) analizar temporalmente la frecuencia de tallas para generar los modelos de crecimiento, mortalidad y reclutamiento; (e) analizar gónadas para determinar sexo y fase de madurez para determinar la proporción de sexos y época de reproducción; y (f) analizar contenidos estomacales para determinar las preferencias alimentarias de C. melanopus.
Materiales y métodos
El área de estudio se localiza entre 18°15'-18°45' N y 91°30'-92°45' W (fig. 1), que es la zona de distribución del camarón siete barbas según lo reportado por Núñez-Márquez y Wakida (1999) y Núñez-Márquez et al. (2000). Se estableció una red de 37 sitios de muestreo que cubren los diversos ambientes identificados en la zona, considerando aspectos como profundidad, descarga de ríos, influencia estuarina y tipo de sedimento.

Las recolectas se realizaron con una frecuencia mensual, de febrero de 2003 a febrero de 2004. La captura se efectuó con una red de arrastre de 5 m de largo y 2.5 m de abertura de trabajo, con una luz de malla de 1.9 cm, equipada con tablas de 0.4 × 0.6 m, y operada a una velocidad de 2 nudos durante 12 min, cubriendo un área aproximada de 1800 m2. En cada estación se registraron los parámetros ambientales de oxígeno disuelto, pH, salinidad, y temperatura, a dos niveles de profundidad (fondo y superficie), con ayuda de un medidor Hydrolab H20 (Hach Co., EUA). Adicionalmente, se registró la profundidad y la transparencia con un disco de Secchi.
Los organismos capturados se identificaron con ayuda de claves de identificación (Fischer 1978, Castro-Aguirre 1999, Cervigón et al. 1992) y fueron medidos y pesados individualmente. La abundancia fue estimada en términos de biomasa (g m-2), densidad (ind m-2) y peso medio (g ind-1) y se analizó tanto en escala temporal como espacial. El análisis temporal consideró lo propuesto por Yáñez-Arancibia y Day (1982) sobre las épocas climáticas de la región: de secas (febrero a mayo), de lluvias (junio a septiembre) y de Nortes (octubre a enero). Para su representación espacial se generaron modelos de distribución a través de la técnica de interpolación Kriging con ayuda del programa Surfer (Smith et al. 1995).
La relación talla-peso se calculó como una función potencial donde a es la ordenada al origen y la pendiente b es el coeficiente de alometría (Pauly 1983). El factor de condición relativo de Fulton (K1) se determinó mediante la expresión:
K1 = PT/LTb
donde PT es el peso total y LT la longitud total (Ricker 1958).
Los modelos de crecimiento, mortalidad y reclutamiento se generaron a partir del análisis de frecuencia de tallas utilizando programas especializados de cómputo. Para la determinación de la distribución de frecuencia por tallas se aplicaron los estimadores de densidad por kernel (EDK) (Rosenblatt 1956):

donde fx es la estimación de densidad de la variable x, n es el número de observaciones, h es la amplitud de banda o parámetro de suavización, y K(x - Xi /h) es la función kernel (densidad de probabilidad suave, simétrica y que integra a la unidad). Se supuso que las muestras presentan un comportamiento normal por lo que se utilizó el kernel Gaussiano:

donde z = x - Xi/h (Salgado-Ugarte et al. 1995).
En todos los casos se utilizó el ancho de banda óptimo de Silverman (1986):

donde ĥ es la amplitud de banda estimada, n es el número de observaciones, y RIC es el recorrido intercuartílico. Los pasos antes mencionados se realizaron de acuerdo con las rutinas descritas por Salgado-Ugarte (2002), e incluidas en el software Stata (StataCorp 1999). Una vez construida la tabla de frecuencia por talla se incorporaron los valores al programa FiSAT (FAO-ICLARM Stock Assessment Tools) (Gayanillo et al. 1996). A través de la rutina ELEFAN I se estimaron los valores de los parámetros L∞ y K del modelo de crecimiento de von Bertalanffy; este software describe el crecimiento a partir de la versión estacionalizada:

donde Lt es la longitud a la edad t, L∞ es la longitud infinita, K es la constante de crecimiento, C es la amplitud de las oscilaciones de crecimiento con respecto al tiempo, t0 es la edad a la cual la longitud es cero, y ts = WP - 0.5 (winter point) es la parte del año en que la tasa de crecimiento es mínima (Sparre y Venema 1995).
El valor de t0 se calculó a partir de la ecuación inversa de von Bertalanffy:

La mortalidad total y el patrón de reclutamiento se determinaron con ayuda del programa FiSAT. La mortalidad total se cuantificó mediante la curva de captura linealizada con el siguiente modelo exponencial negativo:

donde Nt, es el número de organismos a la edad t y Z es la mortalidad total. Al linealizar esta expresión se obtiene:

donde el valor de Z (mortalidad total) es la pendiente y N0 el valor de la ordenada al origen.
La mortalidad natural se estimó mediante el algoritmo propuesto por Pauly (1980):

donde M es la mortalidad natural, L∞ es la longitud infinita, K es la constante de crecimiento, y T es la temperatura (°C).
El patrón de reclutamiento se obtuvo al proyectar un juego de muestras longitud-frecuencia hacia atrás en un eje de tiempo para inferir el número de pulsos de reclutamiento en el periodo de tiempo analizado. Por otra parte, para los análisis de sexo, madurez gonádica y contenido estomacal se tomó una sub-muestra seleccionada de manera aleatoria estratificada por tallas. Las determinaciones de sexo y madurez gonádica se realizaron con base en los criterios morfológicos propuestos por Nikolsky (1963), mientras que los contenidos estomacales se evaluaron de acuerdo los criterios propuestos por Laevastu (1971) y Prejs y Colomine (1981). Para establecer la preferencia alimenticia de la especie se utilizaron las técnicas gravimétrica, numérica y de frecuencia; además se calculó el índice de importancia relativa (IRI) (Pinkas et al. 1971) que se expresa como IRI = F (N + G), donde F es el porcentaje de frecuencia, N es el porcentaje numérico y G es el porcentaje gravimétrico.
Resultados
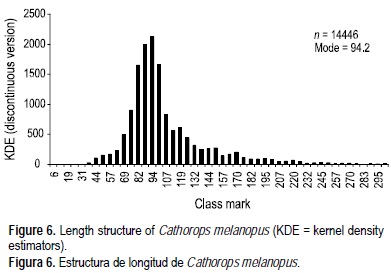
Se capturaron en total 19,048 organismos de C. melanopus, con un peso total de 253.57 kg, de los cuales 14,446 fueron medidos y pesados de manera individual con un peso conjunto de 199.98 kg y son la base del análisis en este trabajo. Las tallas de los organismos oscilaron entre 35 y 302 mm de longitud total, con una moda en la marca de clase 94.2 mm.
Cathorops melanopus mostró una amplia distribución en el área de estudio; sin embargo, los valores de abundancia son mayores en las estaciones cercanas a las desembocaduras de los sistemas fluviales Grijalva-Usumacinta, Palizada y Chumpam, y en los meses que corresponden a la época de lluvias. Las áreas de mayor concentración de abundancia se observaron en las desembocaduras de los sistemas Grijalva-Usumacinta y Palizada-Del Este (fig. 2). En octubre y diciembre se registraron los mayores valores de abundancia, pero los organismos de mayor talla se registraron en junio, agosto y septiembre (fig. 3).

La relación peso-talla en C. melanopus mostró un crecimiento cerca del isométrico con un valor de 2.96 y con un factor de condición medio de 1 × 10-5 (fig. 4). El comportamiento del promedio mensual del factor de condición de Fulton mostró dos pulsos principales de mejor condición de la población, el primero entre mayo y julio, y el segundo, menor, en diciembre (fig. 5).


La estructura por tallas de la población de C. melanopus se describe considerando el intervalo de clase estimado a partir del ancho de banda óptima de Silverman calculado mediante los EDK que fue de 6.28 mm. En la figura 6 se muestra una versión discontinua de los EDK por talla, donde se identifica una talla modal de 94.2 mm.
La tabla de frecuencia de tallas convertida a densidad por mes se incorporó al programa FiSAT para la búsqueda de los parámetros del modelo de crecimiento de von Bertalanffy. El mejor ajuste se encontró con L∞ = 317.5 mm, K = 0.45, C = 0.7, WP = 0.16, SS = 8, SL = 37.7 y t0= -0.2163, y un Rn = 0.157. La mortalidad total estimada (Z) mediante la curva de captura convertida a tallas es de 1.22 con un coeficiente de determinación R2 = 0.96 (fig. 7). La mortalidad natural estimada mediante el algoritmo de Pauly es de 0.65 con una temperatura media de 27.1°C. Finalmente en el modelo de reclutamiento se destaca un pulso entre julio y agosto con un porcentaje conjunto del 47.65% (fig. 7c).
De 279 organismos que fueron seleccionados en forma aleatoria estratificada por talla, y que corresponden a los meses de junio, agosto, octubre, noviembre y diciembre de 2003 y febrero de 2004, sólo en 159 casos fue posible reconocer claramente el sexo. Las tallas de los organismos seleccionados oscilaron entre 43 y 300 mm LT, y se encontraron 111 hembras y 48 machos. La proporción de sexos por fase gonádica mostró una prevalencia de hembras sobre todo en fases II y VI (fig. 8). Por otro lado, se observó la presencia de huevos en el hocico resultando que en proporción similar ambos sexos realizan la incubación oral.

En cuanto al análisis de estómagos se encontró que 41 estaban llenos, 45 casi llenos, 139 casi vacíos y 45 vacíos. De los que tenían algún contenido, éste se encontraba digerido en 201 casos y medio digerido en 22 casos. Numéricamente el grupo trófico mejor representado fue el de los anfípodos con 45.3%, seguido por los nemátodos con 17% y los anélidos con 10.7%; gravimétricamente el alimento mejor representado fueron los crustáceos con 7.82%, seguidos por restos de crustáceos con 4.9% y restos de peces con 2.9%, y por frecuencia de aparición se observó una mayor representación de restos de crustáceos con 10.1%, materia orgánica no identificada (MONI) con un 10%, y anfípodos con un 7.5%. El índice de importancia relativa de Pinkas et al. (1975) destaca como alimento preferente la MONI, seguida por los anfípodos y los restos de crustáceos (fig. 9).

Discusión
Cathorops melanopus presentó una distribución fuertemente asociada con las desembocaduras de los ríos, en particular en los sistemas Palizada-Del Este y Grijalva-Usumacinta durante el periodo de muestreo; sin embargo, muestra una amplia distribución y tolerancia a variaciones de salinidad (0.2 -40) y temperatura (20-34°C). De acuerdo con los modelos de distribución espacial de la abundancia, su hábitat se amplía durante las épocas de nortes y secas, y se reduce durante la época de lluvias. Este comportamiento se explica por el efecto retrasado del incremento en el volumen de la descarga de los ríos, dada la amplitud de la planicie costera. El máximo volumen de descarga se registra entre octubre y diciembre y el mínimo entre mayo y junio.
Cathorops melanopus se ha reportado como la especie más abundante de la comunidad de peces de la Laguna de Términos, y se caracteriza por su preferencia por zonas de alta turbidez y baja salinidad (Lara-Domínguez et al. 1981, Yáñez-Arancibia y Lara-Domínguez 1988). La presencia de C. melanopus en praderas de Thalassia testudinum donde prevalecen condiciones de alta salinidad y transparencia se ha reportado como cíclica (Yáñez-Arancibia y Lara-Domínguez 1983, Álvarez-Guillén et al. 1985, Vargas-Maldonado y Yáñez-Arancibia 1987), lo que permite argumentar la expansión temporal de su hábitat y su capacidad de movimiento y tolerancia a las variaciones ambientales.
La abundancia relativa de esta especie en la región se ha incrementado sensiblemente en años recientes. Mientras que Ayala-Pérez et al. (2003) reportaron una proporción de 26.5% de la captura total de peces en un estudio realizado en la Laguna de Términos, en el presente estudio se ha encontrado una proporción del 42%. En cuanto a la biomasa, los intervalos de variación encontrados en ambos trabajos también se incrementaron de 0.43-6.54 g m-2 a 2.53-15.32 g m-2, respectivamente.
El bagre C. melanopus mostró un crecimiento alométrico negativo (2.961), esto es, que el incremento de su talla es mayor en proporción a su peso. En el ajuste del modelo potencial, el factor de condición medio es de 0.00001 con un factor de determinación de 0.956. González y Santos (2000) reportaron valores de a = 0.0089 y b = 2.95 en un estudio realizado para esta especie en la Laguna de Términos entre 1997 y 1999. Lo anterior señala una mejor condición de los organismos al interior de la laguna. Esta situación es comprensible dada la gran disponibilidad de alimento y la gran variedad de hábitat de refugio y protección dentro de la laguna.
El factor de condición medio mensual refleja dos momentos importantes para la población durante el año, una entre mayo y julio y otra, aunque comparativamente menor, en diciembre. Este comportamiento está relacionado con los momentos de preparación para el desove ya que, dadas las preferencias alimentarias de la especie, podemos suponer que el alimento no es restrictivo y C. melanopus aprovecha tanto las condiciones de máxima descarga de los ríos como las condiciones de mínimo aporto fluvial.
Los organismos de tallas pequeñas (LT < 100 mm) mantienen las altas densidades en las desembocaduras de los sistemas fluvio-lagunares, y son organismos de tallas grandes los que con más frecuencia se registran en las zonas más alejadas a estos núcleos de abundancia, lo que hace suponer que con la talla se incrementa la tolerancia a los cambios de salinidad. La población está conformada por organismos con tallas entre 35 y 302 mm de longitud total, con una moda en la marca de clase 94.2 mm. Esta estructura por tallas refleja por una parte la selectividad del arte de pesca, pero también corresponde con una estrategia de reproducción temprana. La talla de primera madurez registrada es de 144.5 mm LT para hembras y 162.1 mm LT para machos, lo cual coincide con lo reportado por Lara-Domínguez et al. (1981), quienes encontraron una talla de primera madurez entre 160 y 165 mm LT.
La mayor concentración de organismos en fases I y II se localiza principalmente en las desembocaduras de los sistemas fluvio-lagunares (Palizada-Del Este y Grijalva-Usumacinta), lo que coincide con lo reportado por Yáñez-Arancibia y Lara-Domínguez (1988), destacando que la especie desova e incuba en condiciones de baja salinidad, poca transparencia y alta temperatura.
De acuerdo con Lara-Domínguez et al. (1981), Vidal (1985) y Yáñez-Arancibia y Lara-Domínguez (1988), C. melanopus muestra un comportamiento de reproducción continua; sin embargo, también coinciden en señalar que en la época de lluvias se presenta un evento masivo de reproducción. Esta condición es comparable con lo reportado por Rojas et al. (1994) para los bagres Cathorops spixii, Hexanematichthys guatemalensis, H. seemanni, H. osculus, H. dowii y Rhamdia guatemalensis. Galindo-Cortes (2002), en un estudio comparativo entre las poblaciones de bagre de Tampamachoco (Veracruz) y Pom-Atasta (Campeche), propuso que se pueden considerar como rangos razonables de parámetros de crecimiento para C. melanopus, L∞ entre 300 y 370 mm y K entre 0.3 y 0.5 por año. Estos valores son comparables con lo registrado en el modelo de crecimiento aquí desarrollado. También cabe mencionar que la base de datos FishBase (Froese y Pauly 2004) reporta una talla máxima de 230 mm LT y adicionalmente Vidal (1985) reporta una talla máxima de 401.3 mm para especímenes del Río Tonalá (Veracruz). Para la Laguna de Términos, González y Santos (2000) señalan los siguientes valores de parámetros de crecimiento para la especie: L∞= 400 mm, K = 0.44 por año; aunque el valor de L∞ es mayor que el obtenido en el presente estudio (L∞ = 317.5 mm) la constante de crecimiento es prácticamente la misma (K = 0.45 por año), señalando un crecimiento similar en ambos estudios.
El valor de la constante de amplitud (C = 0.7) refleja una importante oscilación del crecimiento debida a la variabilidad ambiental, en particular los cambios en salinidad y temperatura condicionados por el incremento en el volumen de descarga de los ríos y las épocas climáticas. Para el caso del punto de invierno (WP = 0.16) se ha considerado que el mes más frío es febrero (23°C temperatura media del agua); el WP refleja el momento del año en el que el crecimiento es menor, el cual puede estar influenciado además de la temperatura por otros factores como la alimentación y las variaciones en la salinidad.
González y Santos (2000) estimaron una mortalidad total de 3.0 y una mortalidad natural de 0.93 por año utilizando los mismos métodos que en este estudio. Estos datos son proporcionalmente más altos que los encontrados en el presente estudio, lo cual da pie para reflexionar sobre el éxito reproductivo de la especie particularmente al interior de la Laguna de Términos donde es evidente la tendencia de incremento en los niveles de abundancia. Las estrategias de reproducción, el desplazamiento de especies competidoras, el incremento en los niveles de materia orgánica transportada por los ríos e incluso los efectos de la protección del área natural constituyen temas de discusión para argumentar el incremento en la abundancia y la disminución de los índices de mortalidad de esta especie. Adicionalmente, González y Santos (2000) reportan un patrón de reclutamiento en dos periodos, el primero y más importante (72%) de marzo a junio y el segundo (27%) de agosto a octubre; sin embargo, no se reporta el valor de t0 por lo que no es posible una discusión comparativa.
En cuanto a los hábitos alimentarios de C. melanopus en la Laguna de Términos, Lara-Domínguez et al. (1981) y Lara-Domínguez (1986) coinciden en reportar como alimento preferente a la MONI, tanaidáceos y copépodos, y como alimento secundario a los pelecípodos, restos de crustáceos y nemátodos; mientras que en los sistemas fluvio-lagunares encontraron como alimento principal la MONI, restos vegetales y copépodos, y como secundario a los nematodos, larvas de insectos y tanaidáceos. Kobelkowsky y Castillo-Rivera (1995), en la Laguna de Pueblo Viejo (Veracruz), observaron que los copépodos y los tanaidáceos y anfípodos representaron el 34.75%, el detritus 35.92%, los peces 6.82%, las plantas 2.32% y los decápodos el 2.0% de importancia relativa en la dieta de C. melanopus. Vega-Cendejas (1990) reportó que, en el puerto de Celestún (Yucatán), los crustáceos constituyen el 41%, los peces el 25.2%, poliquetos 12.9%, materia vegetal 6.3%, detritus 5.7%, moluscos 3.3%, arena 2.5% y poríferos 1.3%, del total de la dieta de este pez. También en este mismo lugar, Vega-Cendejas et al. (1994) observaron que los poliquetos constituyen 35.9%, los microcrustáceos 21.1%, el detritus 14.1%, los peces 15%, los decápodos 7.5%, los moluscos 3.5%, restos vegetales 0.6% y los nematodos 1.9% del peso total del alimento.
Los resultados de este estudio sugieren que C. melanopus tiene una preferencia por los copépodos, peces, crustáceos y poliquetos, por lo que se considera un consumidor de segundo orden coincidiendo con los trabajos de Amezcua-Linares y Yáñez-Arancibia (1980), Vargas-Maldonado et al. (1981), Yáñez-Arancibia y Lara-Domínguez (1983), Vargas-Maldonado y Yáñez-Arancibia (1987) y Álvarez-Guillén et al. (1985). El valor ecológico de esta especie como transformador y vehículo de energía es fundamental para el funcionamiento del ecosistema; sin embargo, el monitoreo de su tamaño poblacional se plantea como una necesidad ya que puede representar la respuesta natural a modificaciones en los patrones de carga de materia orgánica aportada por los ríos y a su vez provocar efectos negativos en la diversidad de la comunidad de peces. En este sentido esta especie pudiera funcionar como un indicador biológico ya que aunque es una especie abundante muy tolerante, es precisamente esta condición la que pudiera marcar un cambio drástico en la comunidad.
Agradecimientos
Este trabajo fue realizado con fondos obtenidos a través del proyecto "Evaluación de los dos principales recursos pesqueros de importancia comercial: camarón (siete barbas, camarón blanco) y pulpo en el litoral de Campeche" (FOMIX CAMP 2005 C01 040)". La participación de O Chávez-Rivero, H Álvarez-Guillén y F Gómez-Criollo en los trabajos de campo y en el procesamiento de muestras en laboratorio fue muy activa y valiosa.
Referencias
Álvarez-Guillén H, Yáñez-Arancibia A, Lara-Domínguez AL. 1985. Ecología de la boca del Carmen, Laguna de Términos: El hábitat y estructura de las comunidades de peces. An. Inst. Cienc. Mar Limnol. 12:107-144. [ Links ]
Amezcua-Linares F, Yáñez-Arancibia A. 1980. Ecología de los sistemas fluvio-lagunares asociados a la Laguna de Términos. El hábitat y estructura de las comunidades de peces. An. Inst. Cienc. Mar Limnol. 7: 68-118. [ Links ]
Ayala-Pérez LA, Ramos-Miranda J, Flores-Hernández D. 2003. La comunidad de peces en la Laguna de Términos: Estructura actual comparada. Rev. Biol. Trop. 51(3-1): 738-794. [ Links ]
Castro-Aguirre JL. 1999. Ictiofauna Estuarino-lagunar y Vicaria de México. Limusa, 705 pp. [ Links ]
Cervigón F, Cipriani R, Fischer W, Garibaldi L, Hendrickx M, Lemus AJ, Márquez R, Poutiers JM, Robaina G, Rodríguez B. 1992. Guía de campo de las especies comerciales marinas de aguas salobres de la costa septentrional del sur de América. FAO, Rome, 513 pp. [ Links ]
Fischer W. 1978. FAO Species identification sheets for fishery purposes. Western Central Atlantic (Fishing Area 31). FAO, Rome. [ Links ]
Froese R, Pauly D. 2004. FishBase. www.fishbase.org. [ Links ]
Galindo-Cortes G. 2002. Aplicación de los estimadores de densidad por kernel en el estudio del crecimiento del bagre estuarino Cathorops melanopus para dos lagunas del Golfo de México. Informe de Servicio Social, Universidad Autónoma Metropolitana, Unidad Xochimilco, 129 pp. [ Links ]
Gayanillo Jr FC, Sparre P, Pauly D. 1996. The FAO-ICLARM Stock Assessment Tools (FiSAT) User's Guide. FAO Computarized Information Series (Fisheries), Rome, 126 pp. [ Links ]
González RME, Santos J. (2000). Fichas técnicas de peces importantes en la Laguna de Términos, Campeche. Jaina 11(2):15. [ Links ]
Kobelkowsky A, Castillo-Rivera M. 1995. Sistema digestivo y alimentación de los bagres (Pisces: Ariidae) del Golfo de México. Hidrobiológica 5: 95-103. [ Links ]
Laevastu T. 1971. Manual de Métodos de Biología Pesquera. FAO. Acribia, Spain, 243 pp. [ Links ]
Lara-Domínguez AL. 1986. Biología y ecología comparada de los bagres marinos de la Laguna de Términos, Campeche, sur del Golfo de México (Pisces: Ariidae). M.Sc. thesis, Instituto de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México, 200 pp. [ Links ]
Lara-Domínguez AL, Yáñez-Arancibia A, Amezcua-Linares F. 1981. Biología y ecología del bagre Arius melanopus Gunther (Pisces: Ariidae). An. Inst. Cienc. Mar Limnol. 8(1): 267-304. [ Links ]
Nikolsky GV. 1963. The Ecology of Fishes. Academic Press, New York, 352 pp. [ Links ]
Núñez-Márquez G, Wakida AT. 1999. Evaluación del efecto de la veda de 1999 sobre la población y la pesca de camarón blanco en Campeche y Tabasco (primera parte: mayo a agosto). Rep. Téc. CRIP, Instituto Nacional de Pesca, México, 22 pp. [ Links ]
Núñez-Márquez G, Wakida AT, Guzmán V, Marín JM, Zamudio I, Avalos JC, Gutiérrez M. 2000. Seguimiento del camarón siete barbas durante la época de veda. El Timón. Secretaria de Pesca del Gobierno del Estado de Campeche 2(6): 2-4. [ Links ]
Pauly D. 1980. On the interrelationships between natural mortality, growth parameters and mean environmental temperature in 175 fish stock. J. Cons. CIEM 39(3): 175-192. [ Links ]
Pauly D. 1983. Algunos métodos simples para la evaluación de recursos pesqueros tropicales. Documento Técnico de Pesca 234, FAO, Rome, 49 pp. [ Links ]
Pinkas L, Oliphant S, Iverson IL. 1971. Food habits of albacore, blue fin tuna and bonito in California waters. Tech. Rep. 152. Calif. Dept. Fish and Game. Fish. Bull. 105 pp.
Prejs A, Colomine G. 1981. Métodos para el estudio de los alimentos y las relaciones tróficas de los peces. Universidad Central de Venezuela, Caracas, y Universidad de Varsovia, Polonia, 129 pp. [ Links ]
Ricker W. 1958. Handbook of computations for biological statistics of fish population. Bull. Fish. Res. Bd. Canada 119, 300 pp. [ Links ]
Rojas JR, Castro M, Pizarro JF. 1994. Época de desove, fecundidad y morfología en cinco especies ícticas (Pisces: Ariidae) de manglar en Costa Rica. Rev. Biol. Trop. 42: 751-754. [ Links ]
Rosenblatt M. 1956. Remarks on some nonparametric estimates of a density function. Ann. Math. Stat. 27: 832-837. [ Links ]
Salgado-Ugarte IH, Shimizu M, Taniuchi T. 1995. ASH, WARPing, and kernel density estimation for univariate data. Stata Tech. Bull. 26: 23-31 [ Links ]
Salgado-Ugarte IH. 2002. Suavización no paramétrica para análisis de datos. Facultad de Estudios Superiores Zaragoza, UNAM, México, 139 pp. [ Links ]
Silverman BW. 1986. Density Estimation for Statistics and Data Analysis. Chapman & Hall, London, 175 pp. [ Links ]
Smith D, Wall W, Chen Z, Barnes R, Simons B. 1995. Surface Mapping System. Surfer (win 32) Ver. 6.0.1. Golden Software, Colorado. [ Links ]
Sparre P, Venema SC. 1995. Introducción a la evaluación de recursos pesqueros tropicales. Parte I. Manual FAO. Documento Técnico de Pesca No. 306/1, 490 pp. [ Links ]
StataCorp. 1999. Stata satistical software: Release 6.0. Stata Corporation. Collage Station Texas. [ Links ]
Vargas-Maldonado I, Yáñez-Arancibia A. 1987. Estructura de las comunidades de peces en sistemas de pastos marinos (Thalassia testudinum) de la Laguna de Términos, Campeche, México. An. Inst. Cienc. Mar Limnol. 14: 181-196. [ Links ]
Vargas-Maldonado I, Yáñez-Arancibia A. Amezcua-Linares F. 1981. Ecología y estructura de las comunidades de peces en áreas de Rizhophora mangle y Thalassia testudinum de la Isla del Carmen, Laguna de Términos, sur del Golfo de México. An. Inst. Cienc. Mar Limnol. 8(1): 241-266. [ Links ]
Vega-Cendejas E. 1990. Interacción trófica entre los bagres Cathorops melanopus (Agassiz 1829) y Arius felis (Linnaeus 1766), en las costas de Celestún, Yucatán, México. An. Inst. Cienc. Mar Limnol. 17(2): 271-285. [ Links ]
Vega-Cendejas ME, Hernández M, Arreguín-Sánchez F. 1994. Trophic interrelations in a beach seine fishery from the northwestern coast of the Yucatan peninsula, Mexico. J. Fish Biol. 44: 647-659. [ Links ]
Vidal QJ. 1985. Crecimiento y aspectos poblacionales del bagre Arius melanopus (Gunter 1864) del Río Tonalá, Veracruz. B.Sc. thesis, Universidad Nacional Autónoma de México, 35 pp. [ Links ]
Yáñez-Arancibia A, Day Jr. JW. 1982. Ecological characterization of Terminos Lagoon, a tropical lagoon-estuarine system in the southern Gulf of Mexico. In: Lasserre P, Postma H (eds.), Coastal Lagoons. Oceanol. Acta Spec. Publ. 5(4): 417-429. [ Links ]
Yáñez-Arancibia A, Lara-Domínguez AL. 1983. Dinámica ambiental de la boca del Estero Pargo y estructura de sus comunidades de peces en cambios estacionales y ciclos de 24 horas (Laguna de Términos, sur del Golfo de México). An. Inst. Cienc. Mar Limnol. 10(1): 85-116. [ Links ]
Yáñez-Arancibia A, Lara-Domínguez AL. 1988. Ecology of three sea catfishes (Ariidae) in a coastal ecosystem: Southern Gulf of Mexico. Mar. Ecol. Prog. Ser. 49: 215-230. [ Links ]
Yáñez-Arancibia A, Lara-Domínguez AL, Aguirre-León A, Díaz-Ruiz S, Amezcua-Linares F, Flores Hernández D, Chavance P. 1985. Ecología de poblaciones de peces dominantes en estuarios tropicales: Factores ambientales que regulan las estrategias biológicas y la producción. Chap. 15. In: Yáñez-Arancibia A (ed.), Fish Community Ecology in Estuaries and Coastal Lagoons: Towards an Ecosystem integration. Universidad Nacional Autónoma de México, pp. 311-366. [ Links ]














