Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.34 no.3 Ensenada sep. 2008
Artículos
Respuestas bioquímicas e histopatológicas a la toxicidad por cadmio in vivo en Sparus aurata
Biochemical and histopathological endpoints of in vivo cadmium toxicity in Sparus aurata
PM Costa* y MH Costa
IMAR-Instituto do Mar, Departamento de Ciências e Engenharia do Ambiente, Faculdade de Ciências e Tecnología da Universidade Nova de Lisboa, 2829-516 Caparica, Portugal. *E-mail: pmcosta@fct.unl.pt
Recibido en febrero de 2008.
Aceptado en julio de 2008.
Resumen
El cadmio (Cd) es un metal no esencial que se encuentra comúnmente en los cuerpos de agua sujetos a contaminación antropogénica. Debido a su toxicidad en organismos acuáticos y terrestres (incluyendo el ser humano) este metal se ha convertido en sujeto de particular interés en los estudios toxicológicos, especialmente en los relacionados con las especies de peces costeros que son importantes recursos marinos, tales como Sparus aurata. A fin de establecer las pruebas de laboratorio y las técnicas de biomarcadores para evaluar la toxicidad de Cd in vivo con un enfoque múltiple (desde histológico hasta bioquímico), se realizó un ensayo de corta duración (48 h) con juveniles de S. aurata inyectados intraperitonealmente con dosis individuales de Cd (0-8.1 μg Cd g-1 pez p.h.). Los resultados mostraron que el Cd genera una rápida y pronunciada degeneración histopatológica del tejido hepático y una inducción exponencial de las metalotioneínas (MTs) hepáticas fuertemente correlacionadas con la dosis de Cd inyectada (Spearman R = 0.97, P < 0.01) pero no con la bioacumulación de Cd o el tiempo de supervivencia. Las relaciones entre la dosis de Cd, el Cd hepático y la MT hepática indicaron la existencia de un umbral de absorción de Cd después del cual los animales ya no son capaces de regular y bioacumular este metal. Este umbral no dependió del tiempo de supervivencia, sino más bien de la dosis de Cd. Los resultados también confirmaron la conveniencia de utilizar S. aurata como un organismo de prueba para la toxicidad por Cd. De forma complementaria se describe una técnica histológica usando un fluorocromo (naranja de acridina) para intensificar los detalles del tejido, así como un método adecuado para la detección de MTs en geles de SDS-PAGE teñidos con azul de Coomassie coloidal.
Palabras clave: bioacumulación, cadmio, Sparus aurata, histopatología, inducción de metalotioneínas.
Abstract
Cadmium (Cd) is a non-essential metal common in water bodies subjected to anthropogenic pollution. Its proven toxicity to aquatic and terrestrial organisms (including humans) has made this metal a subject of particular interest in toxicological studies, especially concerning common coastal fish species that are important marine resources, such as Sparus aurata. In order to establish laboratory tests and biomarker techniques to assess in vivo Cd toxicity in a multilevel (from histological to biochemical) approach, a short-term (48 h) assay was performed using juvenile S. aurata injected intraperitoneally with individual Cd dosages (0-8.1 μg Cd g-1 fish w.w.). The results showed that Cd causes a fast and pronounced histopathological degeneration of liver tissue and an exponential induction in liver metallothionein-like proteins (MTs) strongly correlated to the injected Cd dosage (Spearman R = 0.97, P < 0.01) but not to Cd bioaccumulation or survival time. The relationships between Cd dosage, liver Cd, and liver MT suggested the existence of an absorbed Cd threshold after which the animals were no longer able to regulate and bioaccumulate the metal. This threshold was not dependent on survival time but rather on Cd dosage. The findings also confirmed the suitability of S. aurata as a test organism regarding toxicity caused by Cd. Complimentarily, a histological technique using a fluorochrome (acridine orange) to enhance tissue detail is described, as well as a method suitable for the detection of MTs in SDS-PAGE gels with a colloidal Coomassie blue stain.
Key words: bioaccumulation, cadmium, histopathology, metallothionein induction, Sparus aurata.
Introducción
El cadmio (Cd) es un metal no esencial que se puede encontrar en concentraciones potencialmente tóxicas en el agua y sedimentos de las zonas costeras sujetas a fuentes antropogénicas de contaminación. Además, la contaminación por metales en estas zonas es afectada por los gradientes fisico-químicos que se crean en la interfaz entre el agua de mar y el agua dulce (e.g., pH y salinidad), que en conjunto con los eventos de perturbación sedimentaria pueden contribuir a la liberación de metales a la columna de agua (Martínez et al. 2006). El Cd es uno de los metales que causa mayor preocupación después de eventos puntuales de contaminación como los derrames industriales y de buques petroleros. Su presencia en el ambiente y su acumulación y efectos en organismos fueron estudiados a fondo en el noroeste de la Península Ibérica después del incidente del petrolero Prestige (e.g., Férnandez et al. 2006, Prego et al. 2006). En cuanto a la contaminación continua, los ríos y estuarios bajo una fuerte influencia de actividades industriales y mineras son áreas típicamente problemáticas en lo que respecta a la contaminación por Cd. Waeles et al. (2004), por ejemplo, estimaron que diariamente se descargan hasta 14 kg de Cd disuelto, y por tanto muy biodisponible, del Río Loira (Francia) hacia la plataforma continental. Audry et al. (2004) encontraron concentraciones de Cd disuelto de hasta 6.7 μg L-1 en otro sistema estuarino de Francia, aún después de una década de haber sido clausurada una planta procesadora de minerales que descargaba efluentes contaminados por Cd. Cabe hacer notar que tal concentración se encuentra por arriba del umbral de toxicidad crónica en peces expuestos al Cd transportado por el agua (e.g., Chowdhury et al. 2004).
En vista de la bien sabida toxicidad del Cd, se han llevado a cabo varios estudios para evaluar su bioacumulación y su efecto en la salud de organismos acuáticos, especialmente en los que se consideran importantes recursos marinos como la dorada Sparus aurata L 1758, una especie cuyas pesquerías son importantes en todo el sur de Europa y el Mediterráneo. Esta especie es frecuentemente cultivada en granjas ubicadas en estuarios y otros cuerpos de agua protegidos especialmente susceptibles a la contaminación por metales. En los organismos, la toxicidad del Cd tiene efectos a nivel celular e histológico, como su efecto genotóxico que genera tanto la rotura de filamentos de ADN (causando mutagénesis y carcinogénesis), como clastogénesis cromosómica (originando micronúcleos y otras anormalidades nucleares; Risso-de Faverney et al. 2001, Costa y Costa 2007). Este metal causa ruptura de membranas de células y organelos, la disgregación de tejidos, lesiones neoplásicas, y anomalías en la embriogénesis de peces (Jones et al. 2001, Hallare et al. 2005). Desencadena diversas respuestas moleculares como la inducción de enzimas antioxidantes como la catalasa y la dismutasa superóxida (Zikic et al. 2001), y la transcripción de proteínas como el glutatión y las llamadas metalotioneínas que quelan los iones libres de Cd (Singhal et al. 1987, Wormser et al. 1990). El nivel de inducción o actividad de estas respuestas se utiliza con frecuencia como un biomarcador de la contaminación por Cd.
Las metalotioneínas (MTs), descritas por primera vez por Margoshes y Vallee (1957) como proteínas enlazantes del Cd en la corteza renal de equinos, son pequeñas proteínas citosólicas involucradas en el almacenamiento de metales y procesos de destoxificación. Tienen alrededor de 60 aminoácidos (ninguno de los cuales son aromáticos) y un alto contenido de residuos de cisteína que no forman puentes disulfito y son responsables del secuestro de metales. Estas proteínas son muy conservativas entre ciertos grupos animales y han sido ampliamente utilizadas como biomarcadores de la respuesta a la exposición a metales, especialmente al Cd, que es un conocido inductor de MTs (revisado por Romero-Isart y Vašák 2002) en especies como S. aurata (Tom et al. 1998, 2004; Costa et al. 2008).
La evaluación de histopatologías en peces es considerada una herramienta útil en el biomonitoreo de la calidad del agua (Handy et al. 2002). En los peces, las branquias y el hígado son los órganos más estudiados debido al papel que juegan en la entrada apical y el metabolismo de los contaminantes, respectivamente. Se ha utilizado la histopatología de las branquias de S. aurata como un biomarcador de la exposición a la contaminación ambiental (Morales-Caselles et al. 2007), así como la inmunohistoquímica de CYP1A en su hígado en relación con la exposición a contaminantes orgánicos (Arellano et al. 2001). Sin embargo, no existen referencias específicas para esta especie en cuanto al daño hepático histológico inducido por el Cd.
Es bien conocido que variables ambientales como la temperatura y el pH afectan la toxicidad de xenobióticos como el Cd, causando desde respuestas bioquímicas hasta histopatológicas (Carvalho et al. 2004, Hallare et al. 2005). La presencia de otros contaminantes también afecta la toxicidad: el Cr, por ejemplo, reduce la expresión de las MTs aun en presencia de fuertes inductores de éstas como el Cd y el Zn (Majumder et al. 2003) . Por estas razones, los estudios de los mecanismos toxicológicos del Cd bajo estrictas condiciones de laboratorio usando contaminantes aislados y evaluando diferentes clases de biomarcadores resultan de gran importancia para entender los efectos reales de un xenobiótico específico.
Los principales objetivos de este trabajo fueron: (i) probar y establecer el intervalo de los biomarcadores de contaminación por Cd y las condiciones de laboratorio para los ensayos in vivo usando S. aurata como organismo de prueba; (ii) evaluar los efectos y umbrales de letalidad del Cd inyectado (dosis agudas y subagudas) a esta especie para servir como referencia en pruebas futuras; y (iii) integrar los diversos efectos de contaminación, desde bioquímicos (inducción de MTs y acumulación de Cd en el hígado) hasta histológicos (en tejido hepático).
Materiales y métodos
Ensayo de laboratorio
Se inyectaron, intraperitonealmente, juveniles de S. aurata obtenidos de la misma cohorte en un criadero (95.3 ± 14.6 mm de longitud estándar, 22.5 ± 11.2 g de peso húmedo [p.h.] total) con 500 μL de una solución estándar de Cd (Merck, Darmstadt, Alemania) diluida en tampón de fosfatos 50 mM (pH = 7.4). Se utilizaron tres individuos como controles, los cuales sólo fueron inyectados con tampón. Otros seis individuos fueron inyectados con varias soluciones de Cd (100-250 μg Cd L-1). Junto con los diferentes tamaños de los animales, estas concentraciones permitieron obtener diferentes dosis individuales de Cd, con un intervalo proyectado entre 5 y 10 μg Cd g-1 pez p.h.
Cada animal fue sometido a un ensayo de corta duración (48 h) en un tanque de polivinilo de 15 L de capacidad, con recirculación de agua y aireación constante, conteniendo 12 L de la misma agua en la cual fueron criados. La temperatura se mantuvo constante a 18 ± 1°C, la salinidad fue 31 ± 1 y el pH 7.6 ± 0.1. Se usó un fotoperiodo de 12:12 h luz:oscuridad. Los peces fueron alimentados diariamente con ración para peces (Dibaq, Segovia, España). La mortandad fue monitoreada constantemente durante el ensayo, retirando inmediatamente los individuos muertos o moribundos de los tanques y procesándolos para los análisis de bioacumulación y biomarcadores.
Determinaciones de las MTs y el Cd en hígado
Se homogeneizaron porciones de hígado en tampón frío Tris-HCl 0.02 M (pH 8.6) y se centrifugaron durante 1 h a 30,000 g (4°C). Posteriormente se calentó el sobrenadante (citosol) a 80°C por 10 min para desnaturalizar las proteínas térmicamente inestables y se centrifugó (1 h a 30,000 g, 4°C) para precipitar la mayoría de las proteínas térmicamente inestables y de alto peso molecular. La determinación de las MTs en los citosoles tratados térmicamente se realizó mediante polarografía de pulso diferencial con un electrodo de gota de mercurio (DPP-SMDE, por sus siglas en inglés) con una base 694 y un procesador 693 de Metrohm (Herisau, Suiza). El sistema de electrodos consistió en un electrodo capilar de mercurio de trabajo, un electrodo de referencia de Ag/AgCl y un electrodo de platino. El electrolito soporte (NH4Cl 1 M, NH4OH 1 M, y [Co(NH3)6]Cl3 2 mM) fue preparado semanalmente y almacenado a 4°C (Palecek y Pechan 1971). En ausencia de una MT comercial de pez, se utilizó MT de conejo (formas I y II, Sigma, St. Louis, MO, EUA) como estándar. La extracción y la determinación de las MTs mediante DPP-SMDE se realizaron siguiendo el procedimiento descrito por Costa et al. (2008), adaptado de Bebianno y Langston (1989). Los resultados se presentan en mg MT-equivalente g-1 de hígado peso seco (p.s.).
La presencia de una proteína compatible con la MT de S. aurata se determinó mediante electroforesis en gel de poli-acrilamida con dodecil sulfato de sodio (SDS-PAGE, por sus siglas en inglés) de la fracción citosólica tratada térmicamente y los estándares de MT de conejo. Es difícil visualizar las MTs en geles debido a una serie de factores como son la casi nula presencia de aminoácidos aromáticos, a los cuales se une selectivamente el azul brillante de Coomassie, y la tendencia de las proteínas a formar polímeros en geles (Suzuki et al. 1998), un fenómeno que típicamente causa una mancha de proteínas tenue en vez de una banda clara. Se logró un método efectivo para detectar las bandas de MTs sin manchar los carriles de las proteínas citosólicas como sucede cuando se usa el nitrato de plata. Los geles de acrilamida se adaptaron de acuerdo con Laemmli (1970) y consistieron de un gel de apilamento al 5% (en tampón Tris-HCl 0.5 M, pH = 6.8) y un gel de separación al 15% (en tampón Tris-HCl 1.5 M, pH = 8.8), ambos con 10% de SDS. Un mayor porcentaje de acrilamida (15-19%) incrementa la resolución de proteínas pequeñas como las MTs. Se calentaron nuevamente las alícuotas de los citosoles tratados térmicamente a 100°C durante 5 min en un tampón que contenía p-mercaptoetanol como agente reductor, antes de agregar los geles, para promover la despolimerización de las MTs. La electroforesis se efectuó a baja velocidad (130 V) para fomentar la resolución de bandas, en un tampón de separación de 3% (p/v) de Tris, 14.4% (p/v) de glicina y 1% (p/v) de SDS. Después de enjuagar con agua Milli-Q para quitar todo el SDS, los geles se fijaron en 50% (v/v) de metanol y 2% (v/v) de ácido fosfórico (85%) hasta desaparecer el azul de bromofenol, se volvieron a enjuagar y se tiñieron durante 24 h con el método de plata azul de Coomassie coloidal (Candiano et al. 2004). Este método proporciona una resolución intermedia entre la tinción con plata y la tinción clásica con el azul brillante de Coomassie coloidal. La solución de tinción consistió en 20% (v/v) de metanol, 10% (v/v) de ácido fosfórico (85%), 10% (p/v) de sulfato de amonio y 0.12% (p/v) de azul brillante de Coomassie G250. El peso molecular de las MTs se determinó mediante la comparación de las distancias de migración con una escala de proteínas preteñida de amplio intervalo (ref. 161-0318, de Bio-Rad, Hercules, CA, EUA), usando la paquetería Quantity One 4.2.2 (Bio-Rad, Hercules, CA, EUA).
La bioacumulación de Cd se determinó usando muestras de hígado secadas al horno (cinco días a 80°C) y digeridas con HNO3 y H2O2 en botes de TFE (Clesceri et al. 1999). La determinación del Cd se realizó mediante voltametría de redisolución anódica de pulso diferencial con un electrodo de gota colgante de mercurio (DPASV-HMDE, por sus siglas en inglés), usando el aparato voltamétrico antes mencionado. El electrolito soporte consistió en tampón de acetato 1 M (pH = 4.6). Se empleó un método de adición estándar para la cuantificación del Cd, usando una solución de CdCl2 (Merck, Darmstadt, Alemania) como estándar. Para controlar la exactitud y la precisión del procedimiento, se digirió material de referencia de hígado de pez perro (DOLT-3, NRC-CNRC, Canadá) utilizando el mismo procedimiento y se determinó el Cd por DPASV-HMDE, resultando los valores obtenidos dentro del intervalo certificado. Los resultados se presentan en μg Cd g-1 hígado p.s.
Análisis histológico
Se fijaron porciones de hígado en una solución de Bouin-Hollande por 48 h, y se lavaron con agua destilada, se deshidrataron en una serie progresiva de etanol y se impregnaron con parafina (se utilizó xileno para una impregnación intermedia). Las secciones incluidas en parafina (2 μm de espesor) fueron teñidas con hematoxilina y eosina (HE) después de la desparafinación en xileno y la rehidratación, y posteriormente fueron montadas con medio resinoso DPX (BDH, Poole, RU). La preparación de las muestras para los análisis histológicos esencialmente se realizó de acuerdo con Martoja y Martoja (1967). Se prepararon secciones incluidas en parafina (2 μm de espesor) según lo descrito anteriormente antes de la tinción con naranja de acridina (NA), un fluorocromo que se une selectivamente a los ácidos nucleicos y que se utilizó para incrementar el contraste de estructuras celulares tales como núcleos y retículos endoplasmáticos. Se preparó la solución de tinción de NA usando 0.1 g L-1 NA base (Sigma, St. Louis, MO, EUA; máxima absorbancia a 488 nm) en agua destilada con 1% (v/v) de ácido acético. Las placas fueron teñidas con la solución de NA durante 30 min y montadas en DPX después de un breve enjuague con 0.5% (v/v) de ácido acético glacial en etanol absoluto, seguido por 1 min en etanol absoluto y 1 min en xileno. Todos los pasos a partir de la tinción (incluida ésta) se llevaron a cabo usando recipientes opacos tipo Hellendahl para prevenir la pérdida de fluorescencia.
Se analizaron cualitativamente las lesiones hepáticas sobre las placas con iluminación de campo brillante para la tinción con HE y con luz ultravioleta para la tinción con NA, usando un microscopio BX50 adaptado para epifluorescencia con un foco de mercurio de alta presión de 100 W U-ULH y un filtro de fluoresceína U-MWB (Olympus, Tokio, Japón).
Análisis estadísticos
El análisis de los datos se realizó con modelos de regresión lineal, usando el estadístico r2 para evaluar la bondad de ajuste de las funciones gráficas, y el estadístico R de la correlación de rangos de Spearman. No se consideraron las regresiones donde r2 < 0.5 y se estableció el nivel de significancia para las correlaciones en α = 0.05. Los cálculos estadísticos se realizaron con la paquetería Statistica 6 (Statsoft, Tulsa, OK, EUA), de acuerdo con Sheskin (2000).
Resultados
Umbrales letales, inducción de MTs y acumulación de Cd
Todos los individuos controles sobrevivieron el experimento pero solamente dos animales inyectados con Cd sobrevivieron hasta el final de la prueba. A pesar de que un individuo sobrevivió una dosis de 8.1 μg Cd g-1 pez p.h., es posible establecer un umbral de tiempo de supervivencia de por lo menos 48 h después de la inyección a dosis entre 4 y 5 μg Cd g-1 pez p.h. Se obtuvo un mejor ajuste del modelo de regresión entre la concentración de MT hepática y las dosis inyectadas de Cd que entre la MT hepática y el Cd hepático. El primer caso mostró una fuerte relación exponencial entre la MT hepática y las dosis inyectadas de Cd (fig. 1a), mientras que MT × Cd hepático (fig. 1b) presentó mejor ajuste a un modelo polinomial negativo de segundo orden. No se encontró una regresión significativa (r2 < 0.5) en lo que respecta a la dosis Cd × Cd hepática. Esto mostró que los niveles de Cd en el hígado no incrementaron con la dosis, y que fueron demasiado variables para poder observar una tendencia clara. De acuerdo con los resultados de la regresión, se encontró una fuerte correlación entre las dosis inyectadas de Cd y la MT hepática (Spearman R = 0.97, P < 0.01). Por lo contrario, no se observó una correlación significativa entre MT y Cd hepático (P > 0.05), lo que concuerda con que la MT hepática no incrementó a mayores niveles del Cd bioacumulado. No se encontraron correlaciones significativas entre las dosis inyectadas de Cd y el Cd hepático, ni entre el tiempo de supervivencia y las variables MT hepática, Cd acumulado y dosis inyectada de Cd (P > 0.05).
El modelo MT × Cd hepático mostró un punto de inflexión después de cuyo umbral el hígado no parece poder regular el Cd induciendo la biosíntesis de MTs. En cuanto a la inducción de MTs, hubo una notable disminución en la síntesis de MT hepática después del umbral de acumulación de Cd de ≈80 μg g-1 hígado p.s.
Los geles de SDS-PAGE mostraron una banda tenue pero consistente en las muestras de los citosoles tratados térmicamente, con aproximadamente el mismo peso molecular que la MT de conejo usada como estándar, el cual se puede asignar a la MT de S. aurata (fig. 2). El peso molecular estimado para la forma dímera de MT fue 15 ± 1 kDa tanto para la MT de conejo como para la de S. aurata.
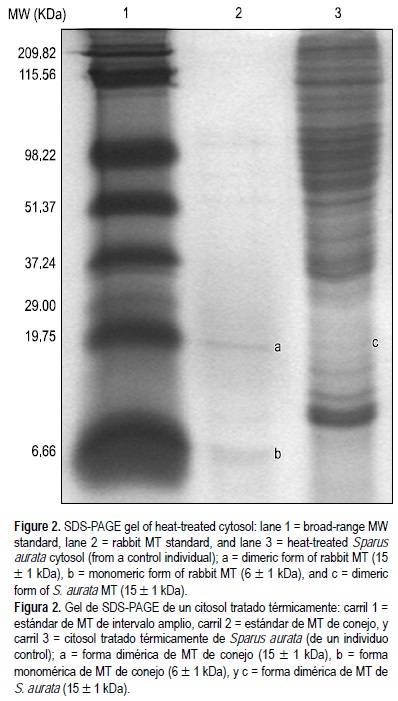
Histopatología
Los individuos controles mostraron una estructura normal en su tejido hepático: los hepatocitos se observaron bien diferenciados y de forma poliédrica, con núcleos conspícuos y de tamaño constante con nucléolos individuales. El hígado mostró inclusiones de tejido pancreático alrededor de las ramas de la vena porta hepática y muchos sinusoides (fig. 3).
Los individuos inyectados con Cd mostraron una degradación consistente y muy pronunciada del tejido hepático que aumentó progresivamente con la dosis de Cd, independientemente del tiempo de supervivencia (fig. 4). El daño más evidente fue la degeneración de los hepatocitos, los cuales perdieron su forma celular y cuya membrana plasmática se rompió. Las secciones de hígado también presentaron grandes zonas de necrosis en las que la organización del tejido ya no era perceptible, especialmente en los individuos inyectados con las mayores dosis de Cd (>6 μg Cd g-1 pez p.h.). Como era de esperarse, el tejido pancreático se tiñó intensamente con la NA, ya que el fluorocromo se une particularmente al ácido nucleico y, por tanto, el retículo endoplasmático, rugoso y denso, típico de células con alta secreción enzimática (como las células acinares del páncreas), emite una fuerte fluorescencia. Los individuos inyectados con Cd mostraron una degeneración conspicua, más prominente en la tinción con NA, del tejido pancreático, presentando necrosis total de éste a mayores dosis de Cd. La microscopía de fluorescencia usando la tinción con NA en general dio una mejor resolución a los núcleos y las membranas celulares que la HE, especialmente a magnificaciones mayores, y consecuentemente proporcionó mayores detalles del daño hepático.
No se observaron diferencias en cuanto al número y la estructura de los sinusoides entre los individuos controles y los inyectados con Cd. El análisis estructural global mostró una estructura "espumosa" de los animales inyectados con Cd probablemente debida a un incremento en el almacenamiento intracelular de lípidos (denominado degeneración grasa o lipidosis hepatocelular). Esto resultó en la proliferación de grandes estructuras vacuolares o conjuntos de vacuolas menores en los hepatocitos (fig. 5). Este resultado concuerda con estudios previos que han descrito la vacuolación hepática como una alteración no específica que sucede en peces expuestos crónicamente a metales en el agua (e.g., Arellano et al. 1999).
Discusión
En este trabajo se ha demostrado que la acumulación de Cd y la inducción de MTs en el hígado de peces no están linealmente correlacionadas. Más bien reflejan la capacidad metabólica del órgano, el cual es afectado progresivamente por la dosis del metal como se muestra en la evaluación histopatológica. Tanto la MT hepática como el Cd hepático muestran una disminución a partir de cuando el hígado ya no puede destoxificar/acumular el metal, iniciando un proceso de degeneración que eventualmente conduce a la disfunción del órgano y a la muerte del animal.
Según nuestros resultados, el tiempo transcurrido después de la inyección del Cd no parece ser un factor importante en cuanto a la magnitud de las respuestas y los efectos, a diferencia de las dosis. Esto parece ser un resultado razonable ya que el Cd inyectado intraperitonealmente probablemente es absorbido rápidamente por los órganos cercanos, quedando disponible para afectar tejidos y células. De hecho, se ha observado una rápida absorción del Cd y movilización intracelular en cultivos de células hepáticas y organismos unicelulares incubados en soluciones de Cd (Diep et al. 2005, Arunakumara et al. 2007). Sin embargo, algunos ensayos de exposición a metales en el agua revelan niveles pronunciados de efectos y respuestas que dependen del tiempo (Van Dyk et al. 2007), a diferencia de lo encontrado en este estudio en cuanto a que los niveles dependen de la dosis. Por tanto, se puede concluir que el Cd es un tóxico que actúa de forma rápida cuando entra al organismo y es absorbido por los órganos.
Con respecto a las respuestas directas a la intoxicación, la inducción de MTs no depende ni del tiempo de supervivencia después de la inyección ni del nivel de Cd hepático, sino que está fuertemente correlacionada con la dosis de Cd, lo que sugiere que la biosíntesis de las MTs en el hígado es inducida rápidamente por la presencia del Cd pero que no está necesariamente relacionada con la bioacumulación del Cd en este órgano. La baja correlación entre la inducción de MTs y el Cd acumulado concuerda con lo encontrado para hepatocitos cultivados y expuestos a este metal, pero esto aún no ha sido explicado (Diep et al. 2005). No obstante, los individuos inyectados con Cd que en promedio sobrevivieron menos de 24 h indujeron las MTs a niveles 2.5 veces mayores (7.2 ± 1.4 mg g-1 hígado p.s.) que los controles (3.0 ± 0.3 mg g-1 hígado p.s.). Los peces que sobrevivieron 48 h indujeron las MTs 1.6 y 4.1 veces, correspondiendo a dosis de Cd de 4.7 y 8.1 μg Cd g-1 pez p.h., respectivamente. Estos resultados concuerdan con la rápida inducción de otras proteínas involucradas en los procesos de destoxificación. Vaglio y Landriscina (1999), por ejemplo, describieron una inducción de 25% y 40% de proteínas relacionadas con CYP1A en S. aurata inyectada con 2.5 μg Cd g-1 pez p.h. después de sólo tres y cuatro días de la inyección, respectivamente, en una prueba similar in vivo.
Considerando la severidad de las lesiones hepáticas observadas, especialmente el daño irreversible de la necrosis, no debe descartarse que la salud del hígado puede influenciar la inducción de MTs y la bioacumulación de metales. Esto podría explicar la razón por la cual la proteína no fue inducida a mayores dosis de Cd inyectado y los animales no fueron capaces de acumular el metal, dado que el tejido hepático ya se encontraba muy dañado. La integridad del órgano puede ser un factor importante que contribuye a la gran variabilidad intra-poblacional típica observada para la inducción de MTs en otros estudios (e.g., Mouneyrac et al. 2002, Costa et al. 2008). Es necesario atender este punto, así como otras variables biológicas, como la edad y el sexo, que contribuyen a la variabilidad en la inducción de MTs (Hamza-Chaffai et al. 1995); por ejemplo, mediante el estudio de las lesiones hepáticas ya presentes en una población.
Nuestros resultados indican que la inducción de MTs en el hígado puede estar positivamente relacionada con el grado de las lesiones hepáticas. Esto se puede explicar por la conocida asociación entre las respuestas antioxidantes y la inducción de MTs, ya que es probable que la degeneración del tejido hepático produzca radicales oxidantes (Risso-de Faverney et al. 2001). Consecuentemente, los mecanismos antioxidantes pueden haber sido desencadenados por hepatocitos funcionales, intensificando aún más la transcripción de MTs (Bi et al. 2004). Por otro lado, la bioacumulación de Cd aparentemente resulta perjudicada por la gravedad de las lesiones observadas en los peces inyectados con las dosis más altas de Cd. Esto podría contribuir a una reducción general del tiempo de supervivencia después de la inyección ya que el Cd acumulado puede estar menos disponible para afectar las funciones celulares.
En cuanto al análisis de SDS-PAGE, el peso molecular estimado de la MT de S. aurata es consistente para las formas diméricas de las MTs de vertebrados de ≈6-7 kDa, un intervalo en el cual se encuentra la MT de S. aurata (Tom et al. 1998). Este método permitió visualizar las MTs sin la sobretinción de los péptidos con amplio intervalo de peso molecular encontrados en los citosoles tratados térmicamente, a pesar de las bajas concentraciones de MTs en las muestras citosólicas que dieron como resultado bandas tenues. Se ha observado la presencia de péptidos no identificados en extractos citosólicos en otros estudios similares de organismos marinos utilizando el mismo método de extracción (e.g., Bustamante et al. 2002, Correia et al. 2004), pero éstos no son inducidos por los metales y por tanto no deberían de interferir en la determinación de la inducción de MTs (Bebianno et al. 1992).
Los resultados aquí presentados han dado una idea de la mecánica toxicológica del Cd a nivel de tejido y bioquímico. Cabe señalar que los estudios toxicológicos en organismos acuáticos que incluyen contaminantes ambientales en el agua o sedimento están típicamente limitados por variables como la biodisponibilidad y las interacciones xenobióticas, así como por las características de los mecanismos de la entrada apical y la destoxificación. En conjunto, estos son factores que se confunden y pueden perjudicar la evaluación de los efectos y las respuestas reales de la toxicidad, por ejemplo, dando evaluaciones de biomarcadores y de bioacumulación con una variabilidad difícil de explicar. Los estudios in vivo como el aquí realizado permiten llevar a cabo una interpretación más objetiva de los efectos toxicológicos de contaminantes, lo cual es crucial para estudios posteriores que involucran xenobióticos ambientales probados bajo condiciones de laboratorio y hasta de campo. Este trabajo ha establecido técnicas de prueba y de biomarcadores para S. aurata y proporciona información de referencia sobre los biomarcadores estudiados.
Agradecimientos
Este trabajo fue aprobado por la Fundación de Ciencia y Tecnología de Portugal (FCT) y el proyecto de investigación POCTI (Programa Operacional Ciencia, Tecnologia e Inovação, ref. POCTI/AMB 57281/104) y financiado por el Fondo Europeo de Desarrollo Regional (FEDER). El primer autor recibió una beca doctoral de FCT (SFRH/BD/28465/2006). Un agradecimiento especial a M Diniz (IMAR) y J Inácio (FCT/ UNL) por su apoyo, y a Timar/Ria Mãe (Setúbal, Portugal) por proporcionar los peces utilizados en este experimento.
Referencias
Arellano JM, Storch V, Sarasquete C. 1999. Histological changes and copper accumulation in liver and gills of the Senegalese sole, Solea senegalensis. Ecotoxicol. Environ. Saf. 44: 62-72. [ Links ]
Arellano JM, Ortiz JB, González de Canales ML, Sarasquete C. 2001. Histopathological alterations and induction of cytochrome P-450 1A in the liver and gills of the gilthead seabream (Sparus aurata) exposed to 2,3,7,8-tetrachlorodibenzo-p-dioxin. J. Mol. Histol. 33: 663-674. [ Links ]
Arunakumara KKIU, Xuecheng Z, Song X. 2007. Comparative study on bioaccumulation of lead and cadmium by the cyanobacterium Synechocystis sp. PCC 6803 under laboratory conditions. Cienc. Mar. 33: 271-280. [ Links ]
Audry S, Schäfer J, Blanc G, Bossy C, Lavaux G. 2004. Anthropogenic components of heavy-metal (Cd, Zn, Cu, Pb) budgets in the Lot-Garonne fluvial system (France). Appl. Geochem. 19: 769-786. [ Links ]
Bebianno MJ, Langston WJ. 1989. Quantification of metallothioneins in marine invertebrates using differential pulse polarography. Port. Electrochim. Acta 7: 59-64. [ Links ]
Bebianno MJ, Langston WJ, Simkiss K. 1992. Metallothionein induction in Littorina littorea (Mollusca: Prosobranchia) on exposure to cadmium. J. Mar. Biol. Assoc. UK 72: 329-342. [ Links ]
Bi Y, Palmiter D, Wood KM, Ma Q. 2004. Induction of metallothionein I by phenolic antioxidants requires metal-activated transcription factor 1 (MTF-1) and zinc. Biochem. J. 380: 695-703. [ Links ]
Bustamante P, Cosson RP, Gallien I, Caurant F, Miramand P. 2002. Cadmium detoxification processes in the digestive gland of cephalopods in relation to accumulated cadmium concentrations. Mar. Environ. Res. 53: 227-241. [ Links ]
Candiano G, Bruschi M, Musante L, Santucci L, Ghiggeri GM, Carnemolla M, Orecchia P, Zardi L, Righetti PG. 2004. Blue silver: A very sensitive colloidal Coomassie G-250 staining for proteome analysis. Electrophoresis 25: 1327-1333. [ Links ]
Carvalho CS, de Araujo HSS, Fernandes MN. 2004. Hepatic metallothionein in a teleost (Prochilodus scrofa) exposed to copper at pH 4.5 and pH 8.0. Comp. Biochem. Physiol. B 137: 225-234. [ Links ]
Chowdhury MJ, Pane EF, Wood CM. 2004. Physiological effects of dietary cadmium acclimation and waterborne cadmium challenge in rainbow trout: Respiratory, ionoregulatory, and stress parameters. Comp. Biochem. Physiol. C 139: 163-173. [ Links ]
Clesceri LS, Greenberg AE, Eaton AD. 1999. Standard Methods for Examination of Water & Wastewater, 20th ed. American Public Health Association, Baltimore, 1220 pp. [ Links ]
Correia AD, Sousa A, Costa MH, Moura I, Livingstone DR. 2004. Quantification of metallothionein expression in whole body Gammarus locusta (Crustacea: Amphipoda) using differential pulse polarography. Toxicol. Environ. Chem. 86: 23-36. [ Links ]
Costa PM, Costa MH. 2007. Genotoxicity assessment in fish peripheral blood: A method for a more efficient analysis of micronuclei. J. Fish Biol. 71A: 148-151. [ Links ]
Costa PM, Repolho T, Caeiro S, Diniz ME, Moura I, Costa MH. 2008. Modelling metallothionein induction in the liver of Sparus aurata exposed to metal-contaminated estuarine sediments. Ecotoxicol. Environ. Saf. 71: 117-124. [ Links ]
Diep PTN, Denizeau F, Jumarie C. 2005. Kinetics of the early subcellular distribution of cadmium in rat hepatocytes. BioMetals 18: 255-267. [ Links ]
Fernández N, Cesar A, González M, DelValls TA. 2006. Level of contamination in sediments affected by the Prestige oil spill and impact on the embryo development of the sea urchin. Cienc. Mar. 32: 421-427. [ Links ]
Hallare AV, Shirling M, Luckenbach T, Köhler HR, Triebskorn R. 2005. Combined effects of temperature and cadmium on developmental parameters and biomarker responses in zebrafish (Danio rerio) embryos. J. Therm. Biol. 30: 7-17.s [ Links ]
Hamza-Chaffai A, Cosson RP, Amiard-Triquet C, El-Abed A. 1995. Physico-chemical forms of storage of metals (Cd, Cu and Zn) and metallothionein-like proteins in gills and liver of marine fish from the Tunisian coast: Ecotoxicological consequences. Comp. Biochem. Physiol. C 111: 329-341. [ Links ]
Handy RD, Runnals T, Russel PM. 2002. Histopahologic biomarkers in three spined sticklebacks, Gasterosteus aculeatus, from several rivers in southern England that meet the freshwater fisheries directive. Ecotoxicology 11: 467-479. [ Links ]
Jones I, Kille P, Sweeney G. 2001. Cadmium delays growth hormone expression during rainbow trout development. J. Fish. Biol. 59: 1015-1022. [ Links ]
Laemmli UK. 1970. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 227: 680-685. [ Links ]
Majumder S, Ghoshal K, Summers D, Bai S, Datta J, Jacob ST. 2003. Chromium (IV) down-regulates heavy-metal induced metallothionein gene transcription by modifying transactivation potencial of the key transcription factor, metal-responsive transcription factor 1. J. Biol. Chem. 278: 26216-26226. [ Links ]
Margoshes M, Vallee BL. 1957. A cadmium protein from equine kidney cortex. J. Am. Chem. Soc. 79: 4813-4819. [ Links ]
Martínez G, Senior W, Márquez A. 2006. Heavy metal speciation in the surface water dissolved fraction of the low watershed and plume of the Manzanares River, Sucre State, Venezuela. Cienc. Mar. 32: 239-257. [ Links ]
Martoja R, Martoja M. 1967. Initiation aux Tecniques de l'Histologie Animal. Masson & Cie., Paris, 345 pp. [ Links ]
Morales-Caselles C, Jiménez-Tenorio N, Riba I, Sarasquete C, DelValls TA. 2007. Kinetic of biomarker responses in juveniles of the fish Sparus aurata exposed to contaminated sediments. Environ. Monit. Assess. 131: 211-220. [ Links ]
Mouneyrac C, Amiard JC, Amiard-Triquet C, Cottier A, Rainbow PS, Smith BD. 2002. Partitioning of accumulated trace metals in the talitrid amphipod crustacean Orchestia gammarellus: A cautionary tale on the use of metallothionein-like proteins as biomarkers. Aquat. Toxicol. 57: 225-242. [ Links ]
Palecek E, Pechan Z. 1971. Estimation of nanogram quantities of proteins by pulse polarographic techniques. Anal. Biochem. 42: 59-71. [ Links ]
Prego R, Cobelo-García A, Marmolejo-Rodríguez J, Santos-Echeandía J. 2006. Trace elements in the Prestige fuel-oil spill: Levels and influence on Laxe Ria sediments (NW Iberian Peninsula). Cienc. Mar. 32: 179-186. [ Links ]
Risso-de Faverney C, Devaux A, Lafaurie M, Girard JP, Bailly B, Rahmani R. 2001. Cadmium induces apoptosis and genotoxicity in rainbow trout hepatocytes through generation of reactive oxygen species. Aquat. Toxicol. 53: 65-76. [ Links ]
Romero-Isart N, Vašák M. 2002. Advances in the structure and chemistry of metallothioneins. J. Inorg. Biochem. 88: 388-396. [ Links ]
Sheskin FJ. 2000. Handbook of Parametric and Nonparametric Statistical Procedures. 2nd ed. Chapman & Hall, Boca Raton, 982 pp. [ Links ]
Singhal RK, Anderson ME, Meister A. 1987. Glutathione, a first line of defense against cadmium toxicity. FASEB J. 1: 220-223. [ Links ]
Suzuki JS, Kodama N, Molotov A, Aoki E, Tohyama C. 1998. Isolation and identification of metallothionein isoforms (MT-1 and MT-2) in the rat testis. Biochem. J. 334: 695-701. [ Links ]
Tom M, Moran O, Jabukov E, Cavari B, Rinkevitch B. 1998. Molecular characterization of metallothionein-cDNA of Sparus aurata used for detecting heavy metal pollution along the Mediterranean coast of Israel. Mar. Pollut. Bull. 36: 131-137. [ Links ]
Tom M, Chen N, Segev M, Herut B, Rinkevitch B. 2004. Quantifying fish metallothionein transcript by real time PCR for its utilization as an environmental biomarker. Mar. Pollut. Bull. 48: 705-710. [ Links ]
Vaglio A, Landriscina C. 1999. Changes in liver enzyme activity in the teleost Sparus aurata in response to cadmium intoxication. Ecotoxicol. Environ. Saf. 43: 111-116. [ Links ]
Van Dyk JC, Pieterse GM, Van Vuren JHJ. 2007. Histological changes in the liver of Oreochromis mossambicus (Cichlidae) after exposure to cadmium and zinc. Ecotoxicol. Environ. Saf. 66: 432-440. [ Links ]
Waeles M, Riso RD, Maguer JF, Le Corre P. 2004. Distribution and speciation of dissolved cadmium and copper in the Loire Estuary and North Biscay continental shelf, France. Estuar. Coast. Shelf Sci. 59: 49-57. [ Links ]
Wormser U, Ben Zakine S, Nyska A. 1990. Cadmium-induced metallothionein synthesis in the rat liver slice system. Toxicol. In Vitro 4: 791-794. [ Links ]
Žikić RV, Štajn AŠ, Pavlović SZ, Ognjanović BI, Saićić ZS. 2001. Activities of superoxide dismutase and catalase in erythrocytes and plasma transaminases of goldfish (Carassius auratus gibelio Bloch.) exposed to cadmium. Physiol. Res. 50: 105-111. [ Links ]
Nota
Traducido al español por Christine Harris.














