Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Ciencias marinas
versão impressa ISSN 0185-3880
Cienc. mar vol.34 no.3 Ensenada Set. 2008
Artículos
Datos químicos ambientales y respuestas bioquímicas de Carcinus maenas en un ecosistema costero eutrófico (Laguna de Óbidos, Portugal)
Environmental chemical data and Carcinus maenas biochemical responses in a coastal eutrophic ecosystem (Óbidos Lagoon, Portugal)
P Pereira1,2*, H de Pablo1, C Vale1, M Pacheco2
1 National Institute of Biological Resources - IPIMAR, Av. Brasilia, 1449-006 Lisbon, Portugal. * E-mail: patbio@ipimar.pt
2 CESAM and Biology Department, Aveiro University, 3810-193 Aveiro, Portugal.
Recibido en febrero de 2008.
Aceptado en julio de 2008.
Resumen
Se evaluó el estado de la Laguna de Óbidos (Portugal) mediante la calidad del agua y del sedimento, así como las respuestas al estrés oxidativo en hembras de cangrejo Carcinus maenas. En octubre de 2005 se muestrearon dos estaciones en la laguna, una localizada en un brazo interno e impactado (brazo Barrosa) y otra en la parte media de la laguna, con mayor influencia de aportes oceánicos. Las concentraciones de amonio y nitrato + nitrito fueron notablemente mayores en Barrosa, mientras que las diferencias en los niveles de metales en el sedimento fueron mínimas. La disponibilidad de Mn, Cu, Ni y Cd disueltos fue mayor en Barrosa, especialmente por la mañana, lo que sugiere la influencia de procesos internos que ocurren cerca del sedimento durante la noche. Las hembras de C. maenas capturadas en Barrosa presentaron alteraciones en sus antioxidantes hepatopancreáticos, una clara indicación de que el brazo interno es una zona más contaminada. Los cangrejos mostraron un incremento en la actividad glutatión peroxidasa, catalasa y glutatión S-transferasa, así como daño peroxidativo de lípidos, mientras que para el glutatión total no se observaron diferencias. Las respuestas significativas no fueron acompañadas por un incremento significativo de los niveles de metales en el hepatopáncreas, lo que indica que los efectos adversos pudieron haber sido causados por el sinergismo de las fuentes de estrés.
Palabras clave: Carcinus maenas, estrés oxidativo, eutrofización, laguna costera, metales.
Abstract
The status of Óbidos Lagoon (Portugal) was assessed combining water quality, sediment quality, and oxidative stress responses in female shore crab Carcinus maenas. Two sites were surveyed in October 2005, one located in an impacted, confined inner branch (Barrosa) and another in the middle of the lagoon more influenced by the seawater input. Concentrations of ammonium and nitrate + nitrite were notably higher in Barrosa, although the differences in sediment metal contamination were minor. The availability of dissolved Mn, Cu, Ni, and Cd was higher in Barrosa, particularly in the morning, which suggests the influence of internal processes occurring near the sediment during the night. Female crabs captured at Barrosa exhibited alterations in hepatopancreas antioxidants, clearly indicating that the inner branch is a more polluted area. Crabs displayed increased activity of glutathione peroxidase, catalase, and glutathione S-transferase, as well as lipid peroxidative damage, whereas no differences were observed for total glutathione. Those significant responses were not accompanied by a significant elevation of metal levels in the hepatopancreas, suggesting that adverse effects may have been caused by the synergism of stressors.
Key words: Carcinus maenas, costal lagoon, eutrophication, metals, oxidative stress.
Introducción
Los ambientes eutróficos frecuentemente muestran una reducción en la oxigenación durante la noche, lo que provoca pulsos en la disponibilidad de los metales traza y nutrientes debido a su movilización desde los sedimentos (Point et al. 2007). Los organismos acuáticos que alli habitan están expuestos a múltiples agentes de estrés con diferentes mecanismos de toxicidad, y cada uno contribuye al efecto adverso general final. Para mejorar la eficacia de los programas de monitoreo bajo circunstancias tan complejas, resulta muy recomendable combinar los datos químicos con las respuestas biológicas (Walker y Livingstone 1992, van der Oost et al. 2003, Laffon et al. 2006). Dentro del amplio intervalo de respuestas biológicas que indican contaminación ambiental, los marcadores bioquímicos han jugado un papel singular, ya que son señales precoces de alerta cuya detección puede prevenir efectos adversos a niveles jerárquicos mayores (van der Oost et al. 2003). Para eliminar las especies reactivas de oxigeno (ROS) se desencadenan sistemas enzimáticos y no enzimáticos que permiten a los organismos superar el estrés oxidativo (Winston y Di Giulio 1991). La producción de ROS es ubicua en especies acuáticas, siendo la inducción antioxidante un componente importante de las respuestas adaptativas en los organismos expuestos a diferentes clases de contaminantes (Stohs y Bagchi 1995). Las defensas antioxidantes también pueden ser inducidas por el amoniaco y los nitritos (Das et al. 2004, Nimptsch y Pflugmacher 2007), realzando la importancia de las condiciones eutróficas en la respuesta global de los organismos.
El cangrejo común europeo Carcinus maenas L tiene una vida sedentaria, es un depredador agresivo y voraz que vive en contacto con el sedimento (Baeta et al. 2005). Esta especie ha sido muy utilizada como bioindicador debido a su amplia distribución geográfica, aunque son escasos los estudios que han examinado sus respuestas al estrés oxidativo en condiciones reales de campo (Astley et al. 1999, Martin-Díaz et al. 2008, Morales-Caselles et al. 2008). En este trabajo se determinaron las respuestas al estrés oxidativo en hembras de una población silvestre de C. maenas de una laguna costera (Laguna de Óbidos, Portugal) eutrófica y moderadamente contaminada por metales, y se evaluaron las implicaciones de la concurrencia de estas fuentes de estrés ambiental en la salud del ecosistema.
Material y métodos
Área de estudio
La Laguna de Óbidos, localizada en la costa occidental de Portugal, es una laguna costera somera con un área húmeda de 7 km2 (fig. 1). Mantiene contacto permanente con el mar a través de una entrada angosta y presenta zonas con diferentes características morfológicas y sedimentarias (Oliveira et al. 2006): varios bancos de arena, canales angostos y corrientes fuertes, en la parte inferior (más cerca del mar); corrientes menos intensas en su amplia parte media; y sedimentos lodosos en sus brazos internos. El brazo conocido como Barrosa es más somero (profundidad media de 1 m) y la circulación del agua depende principalmente de las mareas y de un pequeño afluente de agua que transcurre por campos agrícolas. Barrosa ha recibido las aguas residuales de una ciudad cercana (Caldas da Rainha, 50,000 habitantes) durante las últimas décadas y, por tanto, su calidad del agua se ha visto muy degradada, mostrando síntomas claros de eutrofización, lo cual favorece las especies oportunistas de macroinvertebrados así como el crecimiento de macroalgas (Carvalho et al. 2005, 2006). Las descargas antropogénicas en las partes inferior y media de la laguna son minimas o inexistentes, y no se ha registrado degradación ni del agua ni de la fauna macrobentónica.

Muestreo y preparación de las muestras
En octubre de 2005 se realizó un estudio en dos estaciones de muestreo: una localizada en un brazo interno confinado (Barrosa), y otra en la parte media de la laguna con alta renovación de agua marina y que sirvió como sitio de referencia (fig. 1). Se muestreó el agua superficial (profundidad de 0.2 m) durante la pleamar y la bajamar, por la mañana y tarde, respectivamente. La temperatura, la salinidad y el pH fueron medidos in situ con una sonda YSI 650. Las muestras de agua se recolectaron a mano en varias botellas siguiendo las especificaciones analíticas y se transportaron a un laboratorio de campo para su filtración y preservación. Los sedimentos se recolectaron con una draga Van Veen; los primeros centímetros fueron recogidos con una espátula y almacenados en bolsas de plástico. En el laboratorio las muestras de sedimento superficial se secaron en un horno a 40°C hasta lograr peso constante y se homogeneizaron. Se capturaron seis hembras de C. maenas usando nasas circulares encarnadas. Los especímenes fueron pesados (peso húmedo total) y medidos (ancho del cefalotórax). La observación morfológica de los especímenes en el laboratorio indicó la ausencia de hembras ovadas. El hepatopáncreas se extirpó, se dividió en dos partes, se congeló inmediatamente en nitrógeno líquido, y se almacenó a -80°C hasta su posterior análisis bioquímico y de metales.
Determinaciones analíticas
Parámetros fisicoquímicos del agua
El oxígeno disuelto se determinó utilizando un método modificado de Winkler (Carrit y Carpenter 1966). La materia particulada en suspensión se obtuvo mediante la filtración de 250 mL de agua a través de membranas de acetato de celulosa (0.45 μm) y fue determinada por gravimetría. Las muestras para la determinación de los nutrientes inorgánicos disueltos (nitrato + nitrito, NO3- + NO2-; amonio, NH4+) se pasaron por filtros MSI Acetate Plus y se analizaron usando un autoanalizador Bran Luebbe TRAACS 2000.
Análisis de metales, carbón y nitrógeno
La medición de Mn, Cu, Cr, Ni y Cd disueltos se realizó mediante gradientes difusivos en películas delgadas (DGT, por sus siglas en inglés; Davison y Zhang 1994) (0.4 mm de grosor) colocados en agua recolectada en botellas de polipropileno (2 L) descontaminadas durante 48 h a 20°C. La extracción de los metales de las muestras se llevó a cabo usando 5 mL de HNO3 (1 M). Todas las soluciones extraídas fueron analizadas directamente mediante espectrometría de masas con acoplamiento inductivo (ICP-MS, Thermo Elemental Serie X). Las muestras de sedimento (≈100 mg) fueron completamente mineralizadas con HF y agua regia a 100°C durante 1 h en bombas de Teflón cerradas. Posteriormente, los contenidos de las bombas se evaporaron hasta la sequedad en frascos de Teflón (DigiPrep HotBlock, SCP Science), se redisolvieron con 1 mL de HNO3 bidestilado y 5 mL de agua Milli-Q, se calentaron durante 20 min a 75°C, y se diluyeron con agua Milli-Q (Caetano et al. 2007). Las muestras de tejido liofilizadas y homogeneizadas (≈50 mg) fueron digeridas con una mezcla de HNO3 y H2O2 a 60°C durante 12 h, a 100°C durante 1 h, y a 80°C durante 1 h, según el método descrito por Ferreira et al. (1990). Se determinaron las concentraciones de Al, Fe y Zn por espectrometría de absorción atómica a la llama (Perkin Elmer AAnalyst 100), y las de Mn, Cu, Cr, Ni y Cd por ICP-MS. La precisión de los procedimientos analíticos se evaluó mediante el análisis de materiales de referencia certificados (MESS-3, AGV-1, BCSS-1 y NIST-1646a para sedimentos; TORT-1, TORT-2, DOLT-1 y DOLT-3 para el hepatopáncreas de cangrejo). Se analizaron blancos para verificar alguna posible contaminación durante el procedimiento analítico. Se determinaron el carbono orgánico y el nitrógeno orgánico en las muestras de sedimento siguiendo el método descrito por Verardo et al. (1990) en un analizador CHN Fisons NA 1500.
Parámetros de estrés oxidativo
Se homogeneizaron los hepatopáncreas a razón de 1:11 p/v (peso del hepatopáncreas:volumen del tampón) de 0.1 mol L-1 Tris-HCl (pH 7.4) con 0.15 mol L-1 KCl y glicerol al 20%. Se tomó una alícuota del homogeneizado para medir las sustancias reactivas al ácido tiobarbitúrico (TBARS) y el resto se centrifugó a 12,000 g durante 20 min para eliminar restos celulares, núcleos, mitocondrias y lisosomas. El sobrenadante fue recolectado y centrifugado a 135,000 g por 75 min. La fracción citosólica se congeló en nitrógeno líquido y se almacenó a -80°C hasta ser usada. El contenido de glutatión total (GSHt) se determinó usando el método de reciclaje enzimático con exceso de glutatión reductasa (GR), en el cual el grupo sulfidrilo del GSH reacciona con el reactivo de Ellman (DTNB) y produce un ácido 5-tio-2-nitrobenzóico (TNB) de color amarillo. La formación de TNB se midió mediante espectrofotometría a 412 nm y los resultados se expresaron en nanomoles de TNB formado por minuto por miligramo de proteína. Se determinó la actividad glutatión S-transferasa (GST) usando 1-cloro-2,4-dinitrobenceno (CDNB) como sustrato según el método de Habig et al. (1974), calculado como nanomoles de CDNB conjugado formado por minuto por miligramo de proteína usando un coeficiente de extinción molar de 9.6 × 103 M-1 cm-1. La actividad catalasa (CAT) se determinó mediante el método de Claiborne (1985). El cambio en la absorbancia fue registrado a 240 nm y la actividad CAT fue calculada en términos de nanomoles de H2O2consumido por minuto por miligramo de proteína. La actividad glutatión peroxidasa (GPx) se determinó midiendo la oxidación del fosfato nicotinamida adenina dinucleótido (NADPH) a 340 nm usando H2O2 como substrato (Mohandas et al. 1984). La determinación del daño por peroxidación lipídica (LPO) se realizó con base en la medición de las TBARS (535 nm), según la adaptación de Filho et al. (2001). La razón de LPO fue expresada como nanomoles de TBARS formadas por miligramo de tejido húmedo, usando un coeficiente de extinción molar de 1.56 × 105 M-1 cm-1. Las concentraciones de proteína citosólica fueron determinadas siguiendo el método de Biuret (Gornall et al. 1949), usando albúmina sérica de bovino (Merck, Darmstadt) como estándar.
Análisis estadístico
Para comparar los resultados entre los grupos de cangrejos se aplicó un análisis de varianza, seguido de una prueba de Tukey (Zar 1996). Las diferencias entre las medias se consideraron significativas cuando P < 0.05. Las concentraciones de metales en los cangrejos y los parámetros de estrés oxidativo fueron correlacionados con el análisis de Pearson (P < 0.05) para detectar las relaciones significativas entre las variables.
Resultados
Características del agua y el sedimento
La temperatura varió entre 18°C y 20°C. La salinidad fue ligeramente menor en el brazo interno de Barrosa, reflejando los pequeños aportes de agua dulce durante la bajante (tabla 1). La concentración de la materia particulada en suspensión fue mayor durante la bajamar en ambos sitios. Los niveles de oxígeno disuelto fueron aproximadamente 100% de saturación y las mayores diferencias de pH se observaron en Barrosa. En ambos sitios el amonio explicó entre el 80% y el 93% de las concentraciones de nitrógeno inorgánico total, siendo más alto en Barrosa (44-53 μM) que en la parte media de la laguna (16-28 μM). Se observó una diferencia similar entre las estaciones de muestreo respecto a las concentraciones de nitrato + nitrito (5.1-13 y 1.8-2.0 μM, respectivamente). En Barrosa se registraron concentraciones más altas durante la bajamar, lo que sugiere la influencia de descargas de agua dulce enriquecidas con nutrientes.

Los niveles de Cu, Cr, Ni y Cd disueltos mostraron una contaminación baja debida a estos metales, aunque los valores para Barrosa siempre fueron mayores que los registrados en el centro de la laguna. Los valores presentaron intervalos menos amplios en la parte media de la laguna que en Barrosa. Además, las concentraciones en Barrosa fueron mayores por la mañana (pleamar) que por la tarde cuando el volumen de agua era menor (bajamar). Esto indica que el aumento en las concentraciones de metales en el agua no está relacionado con los aportes de agua dulce, como lo ocurrido con los nutrientes, y por tanto deberían de considerarse otras fuentes internas.
Las concentraciones de metales en sedimentos superficiales fueron relativamente bajas (tabla 2) y los valores obtenidos para Barrosa fueron comparables con los de la parte media de la laguna, o ligeramente superiores (Cu y Zn). El contenido de Al resultó prácticamente igual en ambos sitios, lo que indica un tamaño de grano similar. Estos valores sugieren una mínima influencia industrial en la Laguna de Óbidos. El sedimento de Barrosa mostró mayores concentraciones de carbono y nitrógeno orgánicos, que concuerda con los datos de nutrientes.

Índice de condición, niveles de metales y respuestas al estrés oxidativo en el hepatopáncreas de C. maenas
El peso (g), el ancho del cefalotórax (cm) y el índice de condición (calculado como la razón entre peso húmedo y ancho del cefalotórax) de las hembras de C. maenas de las dos estaciones de muestreo no resultaron significativamente (P < 0.05) diferentes (tabla 3). Los niveles de Cu, Zn, Mn y Ni en el hepatopáncreas no variaron significativamente entre estaciones (tabla 3), pero los de Cr y Cd fueron más elevados en el hepatopáncreas de las hembras capturadas en Barrosa (0.88 ± 0.19 y 0.20 ± 0.04 μg g-1, respectivamente) que en las capturadas en la parte media de la laguna (0.50 ± 0.04 y 0.12 ± 0.03 μg g-1, respectivamente).

La CAT, GPx, GST y LPO en el hepatopáncreas de los cangrejos del brazo interno de Barrosa fueron significativamente mayores que en los animales del sitio de referencia en la parte media de la laguna (fig. 2). Aunque los especímenes capturados en Barrosa presentaron niveles más altos de GSHt, éstos no resultaron significativamente diferentes (P > 0.05). Las correlaciones entre todos los metales cuantificados y las respuestas al estrés oxidativo en el hepatopáncreas de los cangrejos fueron estadísticamente significativas entre Cr y TBARS (fig. 3).

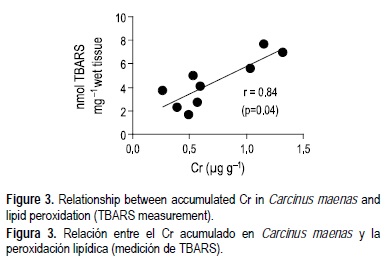
Discusión
La calidad del agua del brazo interno (Barrosa) de la Laguna de Óbidos es baja debido a las cargas orgánicas procedentes de las actividades urbanas y agrícolas en su cuenca de drenaje, así como por las débiles corrientes de marea, lo que facilita el depósito de partículas orgánicamente enriquecidas (Carvalho et al. 2006). Los niveles elevados de amonio y nitrato + nitrito que se registraron durante la bajamar corroboran estos efectos y proporcionan una explicación tanto para la abundancia de macroalgas verdes que cubren el sedimento como para los altos niveles de clorofila α (IPIMAR 2006). Las concentraciones de nutrientes fueron bajas en la estación de referencia, clasificada como oligotrófico, mientras que el brazo de Barrosa se ha clasificado como zona eutrófica (Pereira et al. en prensa).
Las concentraciones de metales en los sedimentos finos de Barrosa indicaron concentraciones bajas asociadas a fuentes antropogénicas, como ya ha sido documentado para los contaminantes orgánicos (Carvalho et al. 2006). No obstante, los niveles ligeramente mayores de los metales disueltos encontrados en la columna de agua, especialmente en la mañana, son indicativos de aumentos que ocurren durante la noche. De hecho, en verano se registró una disminución en la concentración de oxígeno disuelto durante la noche en el brazo interno y una mayor disponibilidad de metales en la columna de agua (IPIMAR 2006). Los niveles de nutrientes también aumentaron debido a su regeneración en los sedimentos y su flujo hacia al agua sobreyacente. La activación de fuentes internas bajo condiciones de baja oxigenación ha sido descrita para varios sistemas eutróficos (e.g., Lillebo et al. 2004, Point et al. 2007).
El índice de condición resultó indéntico para los cangrejos de ambas estaciones, lo que sugiere la ausencia de efectos tóxicos a este nivel de organización biológica (Ferreira et al. 2006); sin embargo, las diferencias significativas en los parámetros de estrés oxidativo observados en el hepatopáncreas de C. maenas sugieren alteraciones a nivel molecular y bioquímico en los especímenes de Barrosa. La presencia de estos indicios de alerta temprana en los cangrejos es una advertencia de posibles efectos tóxicos (Moore 1988). Las deterioradas condiciones del brazo interno parecen inducir las defensas antioxidantes enzimáticas, expresadas a través de un incremento en la actividad CAT, GPx y GST. Un aumento en la actividad de las enzimas antioxidantes puede reflejar una adaptación a una exposición recurrente a tóxicos, otorgando una mayor protección contra el estrés oxidativo. La inducción de al actividad CAT y GPx es indicación de una mayor producción de H2O2 en el hepatopáncreas de los especímenes de Barrosa, lo que sugiere la presencia de contaminantes activos de redox. En este contexto no se puede ignorar el papel del Cr, como se discute a continuación. El GST puede jugar un doble papel defensor en las células catalizando la conjugación de la fase II de los metabolitos reactivos de compuestos orgánicos o la reducción de hidroperóxidos orgánicos por GSH (GST de clase α), y por tanto también actuando como GPx (Cnubben et al. 2001). Considerando los niveles de GSHt inalterados, los antioxidantes enzimáticos, en particular las enzimas dependientes de GSH, parecen ser la primera línea de defensa contra los contaminantes en Barrosa. Se han descrito aumentos en las actividades CAT, GPx y GST en varias especies acuáticas de sitios impactados tanto por contaminantes orgánicos como por metales (Di Giulio et al. 1993, Stephensen et al. 2000). En particular, el hepatopáncreas de C. maenas mostró una inducción in situ de la actividad GST, que se asoció con los niveles de metales (As, Cd, Cr, Cu, Fe, Hg, Mn y Pb) en el sedimento (Martín-Díaz et al. 2008), mientras que en ese mismo estudio la inducción de GPx se relacionó con el Cr y Pb, así como con los contaminantes orgánicos. También se registró una inducción de actividad GST y GPx en cangrejos expuestos a sedimentos contaminados, en condiciones de laboratorio, la cual se asoció con la presencia de metales y contaminantes orgánicos (Martín-Díaz et al. 2007). A pesar de la activación de tales mecanismos de defensa, los cangrejos hembras no manejaron de forma eficiente la producción de ROS ya que se observó daño peroxidativo, lo que pone de manifiesto el estado de degradación ambiental del brazo interno.
La inducción del estrés oxidativo en el hepatopáncreas de los cangrejos capturados en Barrosa no fue seguida por un incremento significativo en los niveles de metales, excepto en el caso del Cr que mostró una correlación positiva (r = 0.84) con las TBARS (fig. 3). Aunque el Cr puede aumentar la generación intracelular de ROS a través de reacciones tipo Fenton (Winston y Di Giulio 1991, Ahmad et al. 2005, 2006), los niveles de estos contaminantes en el hepatopáncreas de los cangrejos fueron bajos en comparación con especímenes de ambientes contaminados (Pedersen et al. 1997, MacFarlane et al. 2006) o expuestos a sedimentos contaminados de estuarios españoles (Martín-Díaz et al. 2006). La mayor disponibilidad de metales en Barrosa aparentemente no fue suficiente para registrar incrementos en los niveles del hepatopáncreas; por tanto, no fue posible establecer una relación directa causa-efecto entre las respuestas biológicas y la acumulación de metales en el hepatopáncreas de C. maenas.
Es recomendable considerar la acción aditiva y sinérgica entre los metales o con otros tóxicos en la inducción del estrés oxidativo (Livingston 2001). Se han demostrado los efectos acumulados del Cr, el Cu y los hidrocarburos aromáticos policíclicos en el laboratorio (Ahmad et al. 2005, 2006) y se han observado en el campo (Nimptsch et al. 2005, Lima et al. 2006). Debería de considerarse una relación entre los mayores niveles de compuestos nitrogenados en Barrosa y la evidencia de estrés oxidativo observada, ya que se ha establecido que estos compuestos también pueden inducir respuestas bioquímicas. Se ha sugerido que el amoniaco y los nitritos pueden ser importantes fuentes de prooxidantes para peces, mejillones y plantas acuáticas, resultando en la producción de radicales nítricos (Das et al. 2004, Lima et al. 2006, Nimptsch y Pflugmacher 2007). En las plantas acuáticas se ha descrito la toxicidad del amoniaco como un fenómeno complejo que involucra una disminución en pH a causa del exceso de H+ intracelular originado por un mayor contenido de NH4+ (Nimptsch y Pflugmacher 2007). En peces, la exposición al nitrito produce anoxia en los tejidos debido a la metemoglobinemia (Das et al. 2004).
En resumen, las respuestas biológicas estudiadas indicaron efectos tóxicos a niveles bioquímicos en cangrejos de un brazo interno impactado de la Laguna de Óbidos y un eventual riesgo ecológico para las poblaciones autóctonas; sin embargo, no fue posible establecer relaciones causa-efecto entre presiones y respuestas biológicas bajo estas condiciones de campo.
Agradecimientos
La primera autora fue apoyada por una beca doctoral de la Fundación para la Ciencia y Tecnología de Portugal (FCT, No. SFRH/BD/17616/2004).
Referencias
Ahmad I, Oliveira M, Pacheco M, Santos MA. 2005. Anguilla anguilla L. Oxidative stress biomarker responses to copper exposure with or without β-naphthoflavone pre-exposure. Chemosphere 61: 267-275. [ Links ]
Ahmad I, Maria VL, Oliveira M, Pacheco M, Santos MA. 2006. Oxidative stress and genotoxic effects in gill and kidney of Anguilla anguilla L. exposed to chromium with or without pre-exposure to β-naphthoflavone. Mutat. Res.-Genet. Toxicol. Environ. Mutag. 608: 16-28. [ Links ]
Astley KN, Meigh HC, Glegg GA, Braven J, Depledge MH. 1999. Multivariate analysis of biomarker responses inMytilus edulis and Carcinus maenas from the Tees Estuary (UK). Mar. Pollut. Bull. 39: 145-154. [ Links ]
Baeta A, Cabral HN, Neto JM, Marques JC, Pardal MA. 2005. Biology, population dynamics and secondary production of the green crab Carcinus maenas (L.) in a temperate estuary. Estuar. Coast. Shelf Sci. 65: 43-52. [ Links ]
Caetano M, Fonseca N, Cesário R, Vale C. 2007. Mobility of Pb in salt marshes recorded by total content and stable isotopic signature. Sci. Total Environ. 380: 84-92. [ Links ]
Carrit DE, Carpenter JH. 1966. Comparison and evaluation of currently employed modifications of the Winkler method for determining oxygen in sea water. J. Mar. Res. 24: 286-318. [ Links ]
Carvalho S, Moura A, Gaspar MB, Pereira P, Cancela da Fonseca L, Falcão M, Drago T, Leitão F, Regala J. 2005. Spatial and inter-annual variability of macrobenthic communities within a coastal lagoon (Óbidos Lagoon) and its relationship with environmental parameters. Acta Oecol. 27: 143-159. [ Links ]
Carvalho S, Gaspar MB, Moura A, Vale C, Antunes P, Gil O, Cancela da Fonseca L, Falcão M. 2006. The use of the marine biotic index AMBI in the assessment of the ecological status of the Óbidos Lagoon (Portugal). Mar. Pollut. Bull. 52: 1414-1424. [ Links ]
Claiborne A. 1985. Catalase activity. In: Greenwall RA (eds.), CRC Handbook of Methods in Oxygen Radical Research. CRC Press, Boca Raton, pp. 283-284. [ Links ]
Cnubben NHP, Rietjens IMCM, Wortelboer H, van Zanden J, van Bladeren PJ. 2001. The interplay of glutathione-related processes in antioxidant defense. Environ. Toxicol. Pharmacol. 10: 141-152. [ Links ]
Das PC, Ayyappan S, Das BK, Jena JK. 2004. Nitrite toxicity in Indian major carps: Sublethal effects on selected enzymes in fingerlings of Catla catla, Labeo rohita and Cirrhinus mrigala. Comp. Biochem. Pysiol. C: Toxicol. Pharmacol. 138: 3-10. [ Links ]
Davison W, Zhang H. 1994. In situ speciation measurements of trace components in natural waters using thin-film gels. Nature 367: 546-548. [ Links ]
Di Giulio RT, Habig C, Gallagher EP. 1993. Effect of black rock harbor sediments on indices of biotransformation, oxidative stress, and DNA integrity in channel catfish. Aquat. Toxicol. 26: 1-22. [ Links ]
Ferreira A, Cortesão C, Castro O, Vale C. 1990. Accumulation of metals and organochlorines in tissues of the oyster Crassostrea angulata from the Sado Estuary. Sci. Total Environ. 97/98: 627-639. [ Links ]
Ferreira M, Moradas-Ferreira P, Reis-Henriques MA. 2006. The effect of long-term depuration on phase I and phase II biotransformation in mullets (Mugil cephalus) chronically exposed to pollutants in River Douro Estuary, Portugal. Mar. Environ. Res. 61: 326-338. [ Links ]
Filho DW, Tribess T, Gáspari C, Cláudio FD, Torres MA, Magalhães ARM. 2001. Seasonal changes in antioxidant defences of the digestive gland of the brown mussel (Perna perna). Aquaculture 203: 149-158. [ Links ]
Gornall AC, Bardawill CJ, David MM. 1949. Determination of serum proteins by means of the biuret reaction. J. Biol. Chem. 177: 751-766. [ Links ]
Habig WH, Pabst MJ, Jakoby WB. 1974. Glutathione S-transferases. The first enzymatic step in mercapturic acid formation. J. Biol. Chem. 249: 7130-7139. [ Links ]
IPIMAR. 2006. Caracterização da Lagoa de Óbidos e do emissário submarino da Foz do Arelho. Relatório Final (Janeiro 2006-Outubro 2006) (in Portuguese). [ Links ]
Laffon B, Aldao I, Pérez-Cadahía B, Pasaro E, Méndez J. 2006. First step in the evaluation of the effects of Prestige oil on the shore environment: Availability, bioaccumulation and DNA damage. Cienc. Mar. 32: 389-399. [ Links ]
Lilleb0 AI, Neto JM, Flindt MR, Marques JC, Pardal MA. 2004. Phosphorous dynamics in a temperate intertidal estuary. Estuar. Coast. Shelf Sci. 61: 101-109. [ Links ]
Lima I, Moreira SM, Osten JR, Soares AMVM, Guilhermino L. 2006. Biochemical responses of the marine mussel Mytilus galloprovincialis to petrochemical environmental contamination along the north-western coast of Portugal. Chemosphere 66: 1230-1242. [ Links ]
Livingston DR. 2001. Contaminant-stimulated reactive oxygen species production and oxidative damage in aquatic organisms. Mar. Pollut. Bull. 42: 656-666. [ Links ]
MacFarlane GR, Schreider M, McLennan B. 2006. Biomarkers of heavy metal contamination in the red-fingered marsh crab, Parasesarma erythodactyla. Arch. Environ. Contam. Toxicol. 51: 584-593. [ Links ]
Martín-Díaz ML, Riba I, Casado-Martínez MC, DelValls TA. 2006. Bioavailability of metals in sediments from Spanish estuaries using Carcinus maenas. Cienc. Mar. 32: 412-420. [ Links ]
Martín-Díaz ML, Blasco J, Sales D, DelValls TA. 2007. Biomarkers study for sediment quality assessment in Spanish ports using the crab Carcinus maenas and the clam Ruditapes philippinarum. Arch. Environ. Contam. Toxicol. 53: 66-77. [ Links ]
Martín-Díaz ML, Blasco J, Sales D, DelValls TA. 2008. Field validation of a battery of biomarkers to assess sediment quality in Spanish ports. Environ. Pollut. 151: 631-640. [ Links ]
Mohandas J, Marshall JJ, Duggins GG, Horvath JS, Tiller D. 1984. Differential distribution of glutathione and glutathione related enzymes in rabbit kidney. Possible implications in analgesic neuropathy. Cancer Res. 44: 5086-5091. [ Links ]
Moore MN. 1988. Cytochemical responses of the lysosomal system and NADPH-ferrihemoprotein reductase in molluscan digestive cells to environmental and experimental exposure to xenobiotics. Mar. Ecol. Prog. Ser. 46: 81-89. [ Links ]
Morales-Caselles C, Martín-Díaz ML, Riba I, Sarasquete C, DelValls TA. 2008. Sublethal responses in caged organisms exposed to sediments affected by oil spills. Chemosphere 72: 819-825. [ Links ]
Nimptsch J, Pflugmacher S. 2007. Ammonia triggers the promotion of oxidative stress in aquatic macrophyte Myriophyllum mattogrossense. Chemosphere 66: 708-714. [ Links ]
Nimptsch J, Wunderlin DA, Dollar A, Pflugmacher S. 2005. Antioxidant and biotransformation enzymes in Myriophyllum quitense as biomarkers of heavy metal exposure and eutrophication in Suquía River basin (Córdoba, Argentina). Chemosphere 61: 147-157. [ Links ]
Oliveira A, Fortunato AB, Rego JRL. 2006. Effect of morphological changes on the hydrodynamics and flushing properties of the Óbidos Lagoon (Portugal). Cont. Shelf Res. 26: 917-942. [ Links ]
Pedersen SN, Lundebye A-K, Depledge H. 1997. Field application of metallothionein and stress protein biomarkers in shore crab (Carcinus maenas) exposed to trace metals. Aquat. Toxicol. 37: 183-200. [ Links ]
Point D, Monperrus M, Tessier E, Amouroux D, Chauvaud L, Thouzeau G, Jean F, Amice E, Grall J, Leynaert A, Clavier J, Donard OFX. 2007. Biological control of trace metal and organometal benthic fluxes in a eutrophic lagoon (Thau Lagoon, Mediterranean Sea, France). Estuar. Coast. Shelf Sci. 72: 457-471. [ Links ]
Stohs SJ, Bagchi D. 1995. Oxidative mechanisms in the toxicity of metal ions. Free Radical Biol. Med. 2: 321-336. [ Links ]
Stephensen E, Svavarsson J, Sturve J, Ericson G, Adolfsson-Erici M, Forlin L. 2000. Biochemical indicators of pollution exposure in shorthorn sculpin (Myoxocephalus scorpius), caught in four harbours on the southwest coast of Iceland. Aquat. Toxicol. 48: 431-442. [ Links ]
Van der Oost R, Beyer J, Vermeulen NPE. 2003. Fish bioaccumulation and biomarkers in environmental risk assessment: A review. Environ. Toxicol. Pharmacol. 13: 57-149. [ Links ]
Verardo DJ, Froelich PN, McIntyre A. 1990. Determination of organic carbon and nitrogen in marine sediments using the Carlo Erba NA-1500 Analyzer. Deep-Sea Res. 37: 157-165. [ Links ]
Walker CH, Livingstone DR. 1992. Persistent Pollutants in Marine Ecosystems. SETAC Spec. Publ., Pergamon Press, Oxford. [ Links ]
Winston GW, Di Giulio RT. 1991. Prooxidant and antioxidant mechanisms in aquatic organisms. Aquat. Toxicol. 19: 137-161. [ Links ]
Zar JH. 1996. Biostatistical Analysis. 3rd ed. Prentice Hall, Englewood Cliffs, New Jersey. [ Links ]
Nota
Traducido al español por Christine Harris.














