Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.34 no.2 Ensenada jun. 2008
Artículos
Desove inducido y crecimiento larval del pargo manchado, Lutjanus guttatus, en la Estación de Biología Marina de Puntarenas, Costa Rica
Induced spawning and larval rearing of spotted rose snapper, Lutjanus guttatus, at the Marine Biology Station, Puntarenas, Costa Rica
J Boza-Abarca1*, E Calvo-Vargas1, N Solis-Ortiz1, J Komen2
1 Estación de Biología Marina, Escuela de Ciencias Biológicas, Universidad Nacional, Puntarenas, Costa Rica. * E-mail: jboza@una.ac.cr
2 Fish Culture and Fisheries Group, Department of Animal Sciences, Wageningen Agricultural University, Netherlands.
Recibido en abril de 2007.
Aceptado en mayo de 2008.
Resumen
Se capturaron y engordaron especimenes silvestres de pargo manchado (n = 400, 60-100 g), Lutjanus guttatus, en jaulas flotantes por un año (de febrero 2001 a febrero 2002). El estado de madurez de las hembras fue registrado mediante muestras de cánula y, cuando se detectó la madurez, las hembras fueron inducidas a desovar con gonadotropina coriónica humana (GCH) en una dosis total de 1600 UI de GCH kg-1 de peso corporal. Las hembras (n = 9) recibieron dos inyecciones (56% y 44% de la dosis total) y los machos fueron inyectados con una dosis de 200 UI de GCH kg-1 de peso corporal, simultáneamente con la segunda inyección de las hembras. La relación de sexos (hembra:macho) fue de 1:2. Los promedios de peso y talla de las hembras fueron de 604.9 ± 98.8 g y 36.4 ± 2.1 cm, respectivamente. El desove ocurrió entre 9 y 12 horas después de la segunda inyección (periodo de latencia) a 30-32%o de salinidad, 26.3-28.2°C y 5.5-6.6 g L-1 de oxígeno. El porcentaje de fertilización fue de 90% de los huevos flotantes, cuyos diámetros eran de 0.857 ± 0.044 mm. Las larvas eclosionaron 15 horas después del desove (hdd) a 26.3-28.2°C . Después de 65 hdd, las larvas empiezan a alimentarse, y 27 días después del desove (ddd) se observó el estado de postflexión. El periodo crítico se detectó, al igual que en otros lutjánidos, entre 3 y 5 ddd. La tasa de crecimiento a los 26 ddd fue de 0.243 mm d-1, y la supervivencia de 1.5%. El crecimiento de los juveniles (171 ddd), con un peso medio de 33.36 ± 9.13 g, fue de 0.2 g d-1. En larvas obtenidas con desove espontáneo, el periodo crítico ocurre a los 30 ddd, cuando se presenta una mortalidad masiva.
Palabras clave: Lutjanus guttatus, pargo manchado, reproducción, alevinaje.
Abstract
Wild spotted rose snapper, Lutjanus guttatus (n = 400, 60-100 g), were captured and grown out in cages during one year (February 2001 to February 2002). When the mature stage was detected by cannula samples, females (n = 9) were induced to spawn with a total dose of 1600 IU of human chorionic gonadotropin (HCG) per kilogram of body weight, given in two injections (56% and 44% of the total dose). Males received only one injection of 200 IU HCG kg-1 body weight, at the time of the second female injection. The sex ratio (female:male) was 1:2. Mean female body weight was 604.9 ± 98.8 g (36.4 ± 2.1 cm). Egg release occurred 9-12 hours after the second injection (latent period), at a temperature of 26.3-28.2°C, salinity of 30-32%o, and oxygen concentration of 5.5-6.6 g L-1. The fertilization rate was 90% of buoyant eggs, with a mean egg diameter of 0.857 ± 0.044 mm. Hatching occurred 15 hours after spawning (h.a.s.) at 26.3-28.2°C. Larvae started feeding 65 h.a.s. and the postflexion stage was observed 27 days after spawning (d.a.s.). The critical period was observed 3-5 d.a.s., as in other lutjanid species. At 26 d.a.s., the growth rate was 0.243 mm d-1 and the survival rate was 1.5%. The growth rate of the fingerlings (171 d.a.s.) was 0.2 g d-1, with a mean body weight of 33.36 ± 9.13 g. Naturally spawned larvae grew until 30 d.a.s., when massive mortality occurred.
Key words: Lutjanus guttatus, spotted rose snapper, reproduction, larval rearing.
Introducción
El pargo manchado, Lutjanus guttatus (Steindachner 1869), se distribuye a lo largo de la costa del Pacífico del continente americano (Grimes 1987, Fischer et al. 1995, Rojas et al. 2004), y es una especie de gran importancia comercial en Costa Rica (Siefke 1995). En 1996, tan sólo en la zona externa del Golfo de Nicoya se capturaron alrededor de 60 t (Vargas 1999). Sin embargo, mientras que el esfuerzo de pesca sobre esta especie se incrementa, su captura tiende a disminuir, .
Los pargos se consideran especies con potencial para la acuicultura comercial (Tucker y Jory 1991, Bennetti y Wilson 1996, Leu et al. 2003, Dumas et al. 2004, Ogle y Lotz 2006), y L. guttatus es una de las especies que ha mostrado buenas condiciones para la acuicultura (Cano 2003, Ibarra et al. 2004), junto con otras especies de lutjánidos (Watanabe et al. 1998, Turano et al. 2000, Emata 2003, Leu et al. 2003, Dumas et al. 2004). Esta especie acepta alimento peletizado, se puede mantener en jaulas sin presentar un comportamiento agresivo (Olivares y Boza 1999), y es posible controlar su reproducción (Valverde y Boza 1999, Cano 2003).
Varias especies de lutjánidos han sido desovadas espontánea o artificialmente en cautiverio, aunque la principal dificultad estriba en la inducción al desove y en que las larvas mueren durante los primeros días después de eclosionar, o durante la metamorfosis, con una supervivencia muy baja (Emata et al. 1994, Avilés-Quevedo et al. 1996, Leu et al. 2003, Ibarra et al. 2004, Ogle y Lotz 2006). En 1997, en Panamá se lograron desoves espontáneos y por inducción hormonal de L. guttatus en cautiverio, pero no se reportaron detalles acerca de la hormona utilizada, la dosis y demás condiciones del desove (Cano 2003).
Valverde y Boza (1999) estudiaron el efecto de la suspensión de pituitaria de carpa en hembras salvajes maduras de L. guttatus capturadas por medio de línea de fondo con anzuelos. Las hembras (2-3 kg de peso corporal) fueron inyectadas con 4 mg SPC kg-1 de peso corporal (alrededor de 800 UI GCH kg-1 de peso corporal), y 24 h después del tratamiento liberaron entre 11,550 y 12,550 huevos. También, en otros experimentos de inducción al desove en Costa Rica se ha utilizado hormona gonadotropina coriónica humana (GCH) con éxito (datos no publicados). Ibarra et al. (2004) utilizaron implantes del análogo de la hormona liberadora de la hormona luteinizante (HLHLa) en hembras de L. guttatus, logrando desoves con dosis de 25 ó 75 μg kg-1 de peso corporal.
En otras especies de lutjánidos se han evaluado los porcentaje de fertilización en los desoves, y de supervivencia de las larvas producidas. En cuanto a fertilización, para L. argentimaculatus, con inducción hormonal (IH), se han reportado porcentajes de 0-86.4% (Singhagraiwan y Doi 1993) y de 77.3-80% (Emata 2003), y 74.3% con desove natural (DN) (Leu et al. 2003); para L. analis se ha reportado un 75.7% con IH (Watanabe et al. 1998); para L. griseus un 85.9% con IH (Cabrera et al. 1998), y para L. campechanus de 1.74-79.0% con IH (Bourque y Phelps 2007). En cuanto al porcentaje de supervivencia larval, Lim et al. (1985) obtuvieron 5% de supervivencia de L. johni (IH) 35 días después de la eclosión (dde); para larvas de L. argentimaculatus, Singhagraiwan y Doi (1993) observaron un 3% de supervivencia (IH, 20 dde), y Leu et al. (2003) observaron 10.8-32.3% (DN, 50 dde). Duray et al. (1996, en Tucker 1998) reportan para el pargo rojo asiático un 16.2% de supervivencia larval (55 dde); Watanabe et al. (1998) para L. analis reportaron una supervivencia de 14.3% (IH, 38 dde), mientras que durante los 30 primeros días de cultivo para L. guttatus Cano (2003) obtuvo supervivencias de 9-30% .
Es necesario lograr la reproducción controlada de especimenes cautivos para así poder desarrollar una técnica confiable de manejo de reproductores, así como de producción de juveniles, y de esta manera asegurar la sostenibilidad de la acuicultura de esta especie (Bromage 1995).
En Costa Rica, el grupo de Peces Marinos de la Estación de Biología Marina, de la Universidad Nacional, ha utilizado GCH para inducir la maduración final y el desove, cultivando las larvas en condiciones de laboratorio. Este trabajo describe los resultados del desove inducido con GCH y las condiciones del cultivo de larvas. Estos son los primeros resultados reportados de un proyecto para establecer una técnica de producción y crianza de larvas de L. guttatus.
Materiales y métodos
Reproductores
Se recolectaron con caña de pescar pargos manchados juveniles (n = 400) en el Golfo de Nicoya en febrero de 2001, para ser utilizados como reproductores. Los peces fueron engordados durante un año observando cada mes el estado de madurez. Los peces, con un peso entre 60 y 100 g (76.76 ± 14.47 g, promedio ± DE) y una longitud total de 16 a 20 cm (18.60 ± 1.8 cm, promedio ± DE), fueron engordados en jaulas (4 × 4 × 3 m, 48 m3) a una densidad de 8 peces m-3. Los peces fueron alimentados con una dieta comercial con 38% de proteína. Después de 10 meses (305 días, diciembre de 2001), los peces promediaron un peso de 550 ± 150 g. Una vez que la maduración fue evidenciada (605 ± 99 g, 36.4 ± 2.1 cm, febrero 2002) por la presencia de ovocitos vitelogénicos en la biopsia ovárica preliminar (canulación), los reproductores se trasladaron a la Estación de Biología Marina de la Universidad Nacional para realizar la inducción hormonal.
Protocolo de desove
La inducción hormonal fue realizada de febrero a agosto de 2002. La maduración gonadal de las hembras fue evaluada mediante canulación. Los peces fueron anestesiados en un tanque con MS-222 (10-100 mg L-1). La madurez fue detectada en las hembras inmovilizándolas e insertando un tubo de polietileno (0.75 mm de diámetro interno) en el poro genital, y aspirando suavemente el contenido ovárico (ovocitos). En los machos, un masaje suave en el abdomen seguido de la liberación de semen, fue suficiente indicación para seleccionar los machos maduros (Singhagraiwan y Doi 1993, Leu et al. 2003, Bourque y Phelps 2007). Los peces fueron trasladados de las jaulas a la Estación de Biología Marina (alrededor de 30 min en una lancha rápida), donde se analizó en detalle otra biopsia ovárica midiendo el diámetro de los ovocitos (±0.01 mm; n = 50) y verificando su estado de madurez. Durante el periodo de desove se seleccionaron 27 reproductores (hembras, n = 9; machos, n = 18).
Antes de la primera inyección con GCH (Chorulon, Intervet Int.), los peces fueron anestesiados con MS-222 (10-100 mg L-1), pesados (balanza Sartorius, ± 0.1 g), introducidos en un baño de agua dulce por 3 min para eliminar ectoparásitos, e inyectados intramuscularmente al final de la aleta dorsal. Las hembras fueron inyectadas con una dosis total de 1600 UI GCH kg-1 de peso corporal, dividida en dos inyecciones; la primera inyección fue de 56% de la dosis total. Una vez inyectadas se colocaron junto a los machos en el tanque de desove, el cual consistió de un tanque cilíndrico de fibra de vidrio de 2.5 t, adaptado a las condiciones de desove (con colector de huevos, flujo de agua interno y externo). Se sacaron del tanque de desove 24 h después, y entonces se aplicó la segunda inyección (44% restante). Al momento de cada inyección se tomaron muestras de ovocitos por medio de canulación y se midieron (n = 50). Los machos recibieron solamente una inyección de 200 UI GCH kg-1 de peso corporal, junto con la segunda inyección de las hembras. La relación machos: hembras fue de 2:1.
Después de la segunda inyección, los peces inyectados (hembra y machos) permanecieron en el tanque de desove. Los machos fecundan los huevos naturalmente una vez que éstos son liberados por la hembra en el agua. El momento del desove fue registrado por la presencia de huevos en la superficie del tanque. El colector de huevos consistió de un contenedor de fibra de vidrio cubierto de malla fina menor a las 500 μm (volumen de 20 L). Una vez desovados, los peces fueron trasladados a un tanque cilíndrico de fibra de vidrio de 18 t con aireación constante, entrada y salida de agua, y cubierta de sarán, para su recuperación; estos peces fueron alimentados con alimento fresco (calamar, poliquetos, sardina picada y camarón vivo). Este último tanque también fue observado diariamente con el fin de detectar desoves. La salinidad, tanto en los tanques de desove como en los de recuperación, fue de 30-32%, la temperatura de 26.3-28.2°C y la concentración de oxígeno de 5.5-6.6 g L-1.
Huevos y cultivo larval
Los huevos en el tanque de desove fueron recolectados por rebalse (4-5 h después del desove), y se estimó su número total y porcentaje de fertilización. Los huevos se limpiaron bajo las mínimas condiciones asépticas (recambios de agua irradiada (30,000 μW sec cm-2) para eliminar impurezas, y luego fueron colocados en tanques cilíndricos de fibra de vidrio de 2.5 t, con 500 L de agua de mar filtrada (malla 10 μm) e irradiada (UV), a 26.3-28.2°C. Se instaló una cubierta de sarán (85% de sombra) para evitar la incidencia directa de la luz solar, y se suministró aireación leve (20 psi) con un soplador eléctrico. Al iniciar el proceso de alimentación (fig. 1), la densidad en el tanque fue de 20 huevos L-1. Al observarse la pigmentación en los ojos de la larva y la abertura de la boca, ésta se midió (n = 100) utilizando un estereoscopio con micrómetro (±0.01 mm), y los tanques fueron inoculados con el alga Isochrysis galbana (0.6 x 106 cel mL-1), rotíferos Brachionus plicatilis (15-20 ind mL-1), huevos de ostra fertilizados (Crassostrea gigas, 5 huevos mL-1), y zooplancton prefiltrado del Golfo de Nicoya (menos de 150 μm de tamaño) que contenía principalmente larvas de copépodos (5-10 ind mL-1). Excepto los huevos de ostra fertilizados que se mantuvieron un sólo día, las densidades de Isochrisys galbana, rotíferos, y zooplancton se mantuvieron respectivamente hasta los días 27, 29 y 35. El día 16 se inició la alimentación con nauplios de Artemia (3-5 nauplios mL-1, en tres raciones diarias). La alimentación con nauplios de Artemia terminó el día 36, ya que a partir de entonces las larvas aceptaron la sardina fresca como alimento (día 31). El destete se realizó combinando alimento semiseco (20%) con sardina fresca (80%). La proporción fue cambiando hasta que únicamente se suministró alimento seco (tabla 1, Olivares y Boza 1999). Todos los días se limpió el fondo de los tanques con sifones. Cuando fue posible, se recolectaron muestras de larvas cada dos días. Se registró el crecimiento hasta el día 26 midiendo la longitud total de al menos 10 larvas, mediante un estereoscopio con micrómetro (±0.01 mm).


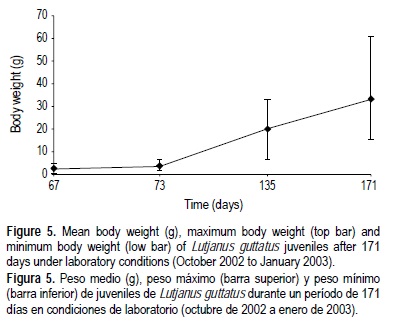
La supervivencia de las larvas fue determinada después de cada ciclo (alrededor de 45 días, hembras 8 y 9). El crecimiento en peso de los juveniles fue medido a los 67, 73, 135 y 171 días, por medio de una balanza digital (± 0.01 g, n = 30). Una vez pesados, los peces fueron devueltos a su respectivo tanque.
Resultados
Reproductores
Se realizaron nueve inducciones al desove con diferentes hembras (n = 9) de febrero a agosto de 2002. Las hembras inducidas al desove por medio del protocolo hormonal sólo desovaron una vez, y lo hicieron de 10-12 h después de la segunda inyección (periodo de latencia). La tabla 2 resume los resultados de los desoves. Las hembras tuvieron un peso de 604.89 ± 98.80 g (promedio ± DE). El peso máximo fue de 774 g (hembra 8), con ovocitos de 0.425 ± 0.020 mm de diámetro en la primera inyección, y de 0.516 ± 0.070 mm en la segunda inyección (fig. 2a, b), y una producción de 47,000 huevos con 90% de fertilización (huevos flotantes) (fig. 2c). El peso mínimo de las hembras fue de 450 g (hembra 9), con un diámetro en la primera inyección de 0.400 ± 0.035 mm, y de 0.502 ± 0.081 mm en la segunda, produciendo 47,000 huevos con 90% de fertilización de los huevos flotantes.
Una vez que se dio el desove inducido, los peces fueron colocados en un tanque cilíndrico de 18 t (hembras 8 y 9 con sus respectivos machos, agosto de 2002) y fueron alimentados con sardina fresca y calamar hasta saciarse, cada dos días.
Los huevos fertilizados fueron transparentes, esféricos, pelágicos y no adheribles, con un espacio perivitelino muy pequeño (fig. 2c, d). Los huevos fertilizados (hembra 8) tuvieron un diámetro de 0.857 ± 0.044 mm (n = 100), con un máximo de 0.943 mm y un mínimo de 0.761 mm. La gota de lípidos en los huevos desovados (hembras 8) midió 0.115 ± 0.013 mm (n = 100).
Huevos y cultivo larval
Una hora después del desove (hdd) fue fácil de observar la blástula (fig. 2c) y 3 hdd se observó la gástrula (fig. 2d). El embrión fue observado en forma C a las 5 hdd (fig. 2e, f), y la forma S fue observada 13 hdd (fig. 2g). Las larvas eclosionaron 15 hdd (fig. 3a), con una longitud total de 2.384 ± 0.043 mm (promedio ± DE, n = 30). La gota de lípidos fue visible en una posición anterior a la cabeza (pero inferior a ella), dentro del saco vitelino, el cual se extiende más allá de la cabeza. A las 37 hdd las larvas habían consumido aproximadamente la mitad del saco vitelino (fig. 3b) y 53 hdd lo habían consumido en su totalidad, pero prevalece la gota de lípidos (fig. 3c).
Las larvas abrieron la boca a las 65 hdd (0.105 ± 0.010 mm, n = 100) y se observó la pigmentación de los ojos, iniciando en ese momento la alimentación externa (fig. 3d). La preflexión de las larvas ocurrió a los 15 días después del desove (ddd) (4.225 ± 0.074 mm, n = 10; fig. 3e), la flexión a los 20 ddd (5.598 ± 0.088 mm, n = 10; fig. 3f), y la posflexión a los 27 ddd (8.711 ± 0.068 mm, n = 10; fig. 3g).
El crecimiento de las larvas de L. guttatus se realizó en dos grupos (hembras 8 y 9), y se muestra durante los primeros 26 ddd en la figura 4. La tasa de crecimiento fue 0.243 mm día-1, con larvas de 10.23 mm de longitud 25 ddd. A partir de 26 ddd el crecimiento se determinó pesando los peces individualmente (n = 30). Estos juveniles se mantuvieron en los mismos tanques hasta 67 ddd, siendo su promedio de peso 2.42 ± 0.84 g (n = 138) y su tasa de supervivencia, hasta ese momento, de 1.5%.

A los 67 ddd (inicios de octubre de 2002), los juveniles fueron divididos en dos tanques cilíndricos de 4 t, con aireación y condiciones de temperatura y salinidad similares (26.3-28.2°C y 30-32%, respectivamente). Hasta 171 ddd, el peso medio fue 33.36 ± 9.13 g (n = 30), con una tasa de crecimiento de 0.20 g día-1. El crecimiento durante este periodo se muestra en la figura 5. El peso máximo fue de 60.4 g, y la mortalidad hasta entonces fue de 5%.
Desove natural
Los reproductores (hembras 8 y 9, y sus respectivos machos, n = 6) fueron mantenidos en un tanque cilíndrico de 18 t de capacidad, con aireación constante y alimentados cada dos días hasta la saciedad con sardina y calamar. Después de cuatro meses (noviembre de 2002) empezaron a desovar naturalmente. Con la luna nueva y su consecuente débil fluctuación de marea (fig. 6), el comportamiento reproductivo fue más prolongado: las hembras desovaron durante más días. El comportamiento reproductivo fue observado en los tanques. Machos y hembras permanecen cerca de la superficie al atardecer, mientras que en la noche los machos siguen a las hembras con su cabeza cerca de la aleta anal de la hembra. Cuando la hembra libera los huevos, el macho incrementa su velocidad y fertiliza los huevos desovados.
La cantidad de huevos desovados fue entre 10,000 y 35,000, y la fertilización siempre fue mayor al 90% de los huevos flotantes (fig. 6). Las larvas obtenidas de estos desoves naturales no sobrevivieron 30 ddd ya que fueron muy sensibles a la manipulación.
Discusión
El pargo manchado, L. guttatus, alcanza su primera madurez durante el primer año de cautiverio, cuando se han capturado juveniles entre los 60 y 100 g de peso corporal. Bajo nuestras condiciones (pargos silvestres en jaulas, baja densidad, alimentación ad libitum), y después de la inducción, los peces estuvieron expuestos a cambios de clima y fases lunares, alcanzando la madurez sin ninguna inducción y liberando huevos naturalmente. Costa Rica es un país tropical, con pequeños cambios en la temperatura a lo largo del año, en donde mucho del comportamiento de las especies es influenciado por las precipitaciones pluviales, cambios en salinidad, fases lunares y mareas. Lutjanus analis alcanzó su primera madurez al tercer año de cautiverio (Watanabe et al. 1998), y en el pargo bermellón, Rhomboplites aurorubens, la maduración gonadal y el desove estuvieron asociados con un incremento en la duración del día y la temperatura del agua, a finales de primavera e inicios del verano (Grimes y Huntsman 1980). Las diferencias en la calidad de los desoves en L. guttatus, realizados casi uno por mes (tabla 2), probablemente sugieren cambios temporales en la respuesta al protocolo de inducción al desove. Algunas hembras de L. guttatus (8 y 9) inducidas en agosto de 2002 presentaron buena calidad de huevos, lo cual se refleja en la calidad de las larvas. Rojas (1997a, b) observó actividad reproductiva de L. guttatus todo el año, pero entre abril y octubre ocurrieron dos picos de desove. Este comportamiento en la reproducción coincide con el inicio de la época lluviosa y con el mes con mayores lluvias (octubre), respectivamente. Sin embargo, las hembras inducidas al desove en el laboratorio produjeron pocos huevos y bajas fertilizaciones (febrero de 2002 a mayo de 2002) (tabla 2). En junio de 2002 aumentó la tasa de fertilización hasta agosto de 2002, mejorando la supervivencia de las larvas.
La cantidad de huevos desovados por las hembras de L. guttatus por inducción hormonal (47,000 huevos en agosto de 2002, hembras 8 y 9) fueron bajas si se comparan con los producidos por otras especies. De hembras de L. argentimaculatus, por inducción hormonal Tucker (1998) obtuvo 1.3 × 106-10 × 106 huevos d-1, y Singhagraiwan y Doi (1993) obtuvieron 3.5 x 105-3.2 × 106 huevos d-1, mientras que por desove natural Emata (2003) obtuvo de 500,000-6,350,000 por desove y Leu et al. (2003) obtuvieron de 1,057-186,571 huevos d-1. En otros ensayos por inducción hormonal, para L. griseus Cabrera et al. (1998) obtuvieron de 190,000210,000 huevos; para L. analis Watanabe et al. (1998) obtuvieron 534,781 huevos; y Dumas et al. (2004), para L. peru, obtuvieron entre 5,000 y 35,000 huevos. Cano (2003) obtuvo desoves mediante inducción hormonal en L. guttatus en los que se produjeron 107 huevos por un grupo de 60 reproductores, mientras que Ibarra et al. (2004) no reportaron la cantidad de huevos obtenidos.
Los huevos desovados por L. guttatus se caracterizaron por tener una gota de lípidos, pero se observaron muy pocos huevos con varias gotas. La gota de lípidos de L. guttatus tuvo un tamaño similar (0.115 ± 0.013 mm, n = 100) al reportado en otras especies: 0.140 ± 0.005 mm y 0.14 ± 0.16 mm para L. argentimaculatus (Emata et al. 1994 y Leu et al. 2003, respectivamente); 0.139 mm para L. griseus (Cabrera et al. 1998); y 0.117 ± 0.015 mm para L. campechanus (Bourque y Phelps 2007).
En el medio natural L. guttatus se ha caracterizado como un desovador por grupos (Ibarra et al. 2004), liberando huevos varios días, parando varios días y empezando otra vez (fig. 6). El pargo rojo, L. campechanus, en condiciones artificiales en el Golfo de México, desovó en múltiples ocasiones entre mayo y junio, después de ser sometido a un fotoperíodo constante (Arnold et al. 1978). En L. guttatus los desoves naturales ocurren en el laboratorio después de una inducción hormonal, con un porcentaje de fertilización mayor a 90% de los huevos flotantes, sin necesidad de manipular el fotoperíodo o la temperatura.
Recientemente Cano (2003) reportó desoves naturales para L. guttatus durante todo el año, con un pico máximo entre agosto y septiembre. En nuestro caso, los días de desove natural en L. guttatus coinciden con la fluctuación de las mareas y los cambios en las fases lunares (fig. 6), pero no todos los lutjánidos presentan el mismo comportamiento. Este comportamiento es contrario al reportado por Jackson et al. (2006), quienes intentaron relacionar los ciclos de desove de L. campechanus con los ciclos lunares, y no encontraron ninguna relación evidente. Sin embargo, Davis y West (1993) reportaron una mayor actividad de desove de L. vittus cercana a las fases de luna nueva y luna llena, y relacionada con las mareas.
Lutjanus argentimaculatus desovó naturalmente durante la temporada de completa maduración gonadal (julio a septiembre), en un tanque de 500 m3 sin inyecciones hormonales, y el número de huevos desovados por día varió de <105 a 106 huevos, con una tasa de eclosión media de 73% (Singhagraiwan y Doi 1993). Lutjanus argentiventris produce espontáneamente de 1,000-15,000 huevos por hembra con un porcentaje de larvas viables de 89% (Avíles-Quevedo et al. 1996). La cantidad de huevos producidos naturalmente por L. guttatus en este trabajo (0.4-0.8 kg de su peso corporal), fue menor que la de L. argentimaculatus (4-7 kg de su peso corporal), probablemente debido a la gran diferencia en el peso corporal, y fue comparable con la de L. argentiventris (el peso corporal de las hembras fue de 0.5-0.6 kg). Cano (2003) reportó 107 huevos producidos espontáneamente por un lote de 60 reproductores de L. guttatus. Sin embargo, los datos no permiten establecer la relación de huevos producidos por hembra, ni si el desove fue en un solo día o en varios. Sin embargo, con respecto al número de huevos producidos por gramo de peso corporal, L. argentimaculatus (25-143 huevos g-1) es comparable con L. guttatus (60.70-104.44 huevos g-1), mientras que L. argentiventris presenta valores menores (1.85-24.59 huevos g-1).
La tasa de mortalidad en las larvas de L. guttatus obtenidas mediante inducción hormonal fue de 80% a los 3 ddd. A los 45 ddd, la mortalidad alcanzó casi el 98%. A partir de 45 ddd mueren muy pocos peces, con una supervivencia final de 1.5% (171 días). Singhagraiwan y Doi (1993) reportaron diferentes tasas de supervivencia para larvas obtenidas de L. argentimaculatus, alimentadas con nauplios de copépodo (Acartia y Oithona): 3.4% a los 8 dde y 1.6% a los 12 dde, en diferentes ensayos. Emata et al. (1994, 1999) alimentaron a esta misma especie con rotíferos (Brachionus), encontrando una supervivencia de cero (mortalidad en masa) a los 28 dde, sin alcanzar la metamorfosis. Cabrera et al. (1998) obtuvieron una supervivencia de 79% a las 24 hde para L. griseus, y a partir de sus datos 135 hde se puede calcular una supervivencia de 2.5%; esas larvas de L. griseus fueron alimentadas con rotíferos, trocóforas de ostra y Tetraselmis chui. Watanabe et al. (1998), trabajando con larvas de L. analis, lograron una supervivencia de 14.3% a los 38 dde alimentándolas con rotíferos tipo ss., mientras que Ogle y Lotz (2006) encontraron una supervivencia en L. campechanus 24 dde de 16.5% (1-31%). Como se puede observar las supervivencias son muy variables entre las diferentes especies, lo cual depende de la condición de los reproductores y de la calidad de la alimentación que se brinde a las larvas.
Las larvas obtenidas del desove natural de L. guttatus (fertilización de 90% de los huevos flotantes) fueron muy sensibles al manejo y a las condiciones del tanque, principalmente a la fluctuación de temperatura. En muchos casos, la larva sobrevivió alrededor de 30 ddd y luego ocurrió una mortalidad masiva. Mediante desoves naturales, Turano et al. (2000) obtuvieron 2.8% de supervivencia de las larvas desde huevos hasta juveniles (45 ddd) de pargo cola amarilla Ocyurus chrysurus, mientras que Leu et al. (2003) con L. argentimaculatus obtuvieron supervivencias entre 10.8-32.3% 50 ddd. En L. guttatus la supervivencia varió de 9% a 30% durante los primeros 30 días de cultivo (Cano 2003). Papanikos et al. (2003) reportaron que los huevos y larvas obtenidos en desoves naturales de L. campechanus fueron más viables en términos de fertilización, eclosión y supervivencia, y Leu et al. (2003) explican que los desoves naturales son una alternativa a los desoves inducidos. En nuestro caso, las larvas obtenidas por desove natural no fueron viables, pero la viabilidad se puede optimizar haciendo cambios en las condiciones de desove (tanques más grandes, mejor calidad de alimentación, manipulación de variables ambientales).
Para la larva de L. guttatus los rotíferos recién eclosionados (tamaño 100-200 μm) siguen siendo grandes como para iniciar la alimentación exógena, debido a que la boca de la larva tiene un tamaño reducido. Las larvas trocóforas de ostra y las células de la microalga Isochrysis han mostrado un tamaño adecuado para alimentar las larvas de L. guttatus; sin embargo, en los tanques siempre fue necesaria la presencia de rotíferos y zooplancton (<200 μm) debido a que algunas larvas crecen más rápido que otras. Cano (2003) alimentó las larvas de L. guttatus con rotíferos de diferentes tamaños, con artemia, larvas de peces y alimento artificial, lo cual confirma el protocolo utilizado. La estabilidad del agua fue asegurada por la presencia de microalgas en el sistema (agua verde), lo cual fue sugerido por Tucker (1998) y Turano et al. (2000) en condiciones de cultivo larval para las especies de lutjánidos. Durante este periodo no fue evidente el canibalismo ni las deformaciones observadas en las larvas de L. guttatus por otros autores en otras especies (Watanabe et al. 1998, Leu et al. 2003).
La tasa de crecimiento de L. guttatus (0.24 mm d-1) a los 26 ddd fue menor que los valores de 0.47 mm día-1 (23 ddd) y 0.37 mm día-1 (a los 28 ddd) reportados para L. argentimaculatus por Singhagraiwan y Doi (1993) y Emata et al. (1994), respectivamente; también fue menor que la tasa de 0.44 mm día-1 (24 ddd) obtenida por Ogle y Lotz (2006) para L. campechanus, pero fue similar a la obtenida de 0.23 mm día-1 a los 21 ddd por Watanabe et al. (1998) con larvas de L. analis.
Se han reportado tasas de crecimiento para juveniles de pargo cola amarilla, Ocyurus chrysurus, de 0.66 g día-1 en un ensayo de 900 días (Turano et al. 2000), de L. analis que crecieron 0.78 g día-1 en un ensayo de 168 días (Watanabe et al. 1998). Los juveniles de L. guttatus crecieron 0.2 g día-1 después de 171 días de ensayo. En general, los datos de crecimiento para las especies de pargos indican que son relativamente lentos en crecer. Sin embargo, el cola amarilla creció lento hasta el día 500, cuando un grupo de peces fue trasladado a un tanque de maduración para desovarlos; después de esto el crecimiento aumento drásticamente (Turano et al. 2000). Se ha observado que cuando se disminuye la densidad en las jaulas, siempre se ha obtenido una respuesta en el crecimiento.
Aunque existen diferencias entre los desoves obtenidos naturalmente o inducidos artificialmente, es necesario optimizar el protocolo de mantenimiento de los reproductores con el fin de obtener huevos y larvas de mejor calidad. También se debe investigar sobre los primeros días de alimentación de las larvas para poder obtener mejores porcentajes de supervivencia.
Agradecimientos
Este estudio formó parte del proyecto UNA-LUW, el cual financió la infraestructura en la Estación de Biología Marina de Puntarenas, Costa Rica, así como fue financiado por la Ley del Atún, No. 6267. Los autores agradecen al Capitán O Torres por recolectar y transportar los animales de las jaulas a la estación.
Se agradece en especial a M Verdegem del grupo de cultivo de peces y pesquerías, del Departamento de Ciencias Animales, de la Universidad Agrícola de Wageningen, Holanda, por financiar la investigación. Deseamos agradecer la detallada revisión realizada por los revisores anónimos al manuscrito.
Referencias
Arnold C, Wakeman J, Williams T, Treece G. 1978. Spawning of red snapper (Lutjanus campechanus) in captivity. Aquaculture 15: 301-302. [ Links ]
Avilés-Quevedo A, Reyes L, Valdés S, Hirales O, Rodríguez R, McGregor U, Lizawa M. 1996. Manejo de reproductores y producción de huevos de pargo amarillo Lutjanus argentiventris (Peters, 1869) bajo condiciones de cultivo. In: Silva A, Merino G (eds.), Acuicultura en Latinoamérica. IX Congreso Latinoamericano de Acuicultura. 2° Simposio Avances y Perspectivas de la Acuacultura en Chile. Coquimbo, Chile, pp. 244-247. [ Links ]
Benetti D, Wilson E. 1996. Estado actual y perspectivas del cultivo de peces marinos en el Ecuador. In: Silva A, Merino G (eds.), Acuicultura en Latinoamérica. IX Congreso Latinoamericano de Acuicultura. 2° Simposio Avances y Perspectivas de la Acuacultura en Chile. Coquimbo, Chile, pp. 5-14. [ Links ]
Bourque BD, Phelps RP. 2007. Induced spawning and egg quality evaluation of red snapper, Lutjanus campechanus. J. World Aquacult. Soc. 38: 208-217. [ Links ]
Bromage NR. 1995. Broodstock management and egg and seed quality. In: Bromage NR, Roberts RJ (eds.), Broodstock Management and Egg and Larval Quality. Blackwell, Oxford, pp. 1-24. [ Links ]
Cabrera JR, Cabrera TB, Millán JQ. 1998. Spawning induction of the mangrove snapper, Lutjanus griseus Linnaeus (Pisces: Lutjanidae), maturated in captivity. Arq. Cien. Mar. 31(1-2): 5763. [ Links ]
Cano A. 2003. Reproduction in captivity and cultivation of the Pacific rose spotted snapper Lutjanus guttatus in the Republic of Panama. World Aquaculture 2003. World Aquaculture Society, 153 pp. [ Links ]
Davis TLO, West GJ. 1993. Maturation, reproductive seasonality, fecundity, and spawning frequency in Lutjanus vittus (Quoy and Gaimard) from the North West Shelf of Australia. Fish. Bull. 91: 224-236. [ Links ]
Dumas S, Rosales-Velásquez M, Contreras-Olguín M, Hernández-Ceballos D, Silverberg N. 2004. Gonadal maturation in captivity and hormone-induced spawning of the Pacific red snapper Lutjanus peru. Aquaculture 234: 615-623. [ Links ]
Emata AC. 2003. Reproductive performance in induced and spontaneous spawning of the mangrove red snapper, Lutjanus argentimaculatus: A potential candidate species for sustainable aquaculture. Aquacult. Res. 34: 849-857. [ Links ]
Emata A, Eullaran B, Bagarinao T. 1994. Induced spawning and early life description of the mangrove red snapper, Lutjanus argentimaculatus. Aquaculture 121: 381-387. [ Links ]
Emata A, Damaso J, Eullaran B. 1999. Growth, maturity and induced spawning of mangrove red snapper, Lutjanus argentimaculatus, broodstock reared in concrete tanks. Israeli J Aquacult./Bamidgeh 51: 58-64. [ Links ]
Fischer W, Krupp F, Schneider W, Sommer C, Carpenter K, Niem V. 1995. Guía FAO para la identificación de especies para los fines de la pesca Pacífico centro-oriental. Vol. III. Vertebrados. Pt. 2. FAO, Rome, pp. 1201-1813. [ Links ]
Grimes C. 1987. Reproductive biology of the Lutjanidae: A review. In: Polovina JJ, Ralston S (eds.), Tropical Snappers and Groupers Biology and Fisheries Management. Westview press, pp. 239-294. [ Links ]
Grimes C, Huntsman GR. 1980. Reproductive biology of the vermilion snapper, Rhomboplites aurorubens, from North Carolina and South Carolina. Fish. Bull. 78: 137-146. [ Links ]
Ibarra L, Dumas S, Duncan N. 2004. Gonad development and LHRHa induced spawning in female spotted rose snapper Lutjanus guttatus. In: 5th International Symposium on Fish Endocrinology. 5-9 September. Castellón, Spain. [ Links ]
Jackson MW, Nieland DL, Cowan JH. 2006. Diel spawning periodicity of red snapper Lutjanus campechanus in the northern Gulf of Mexico. J. Fish Biol. 68: 695-706. [ Links ]
Leu MY, Chen IH, Fang LS. 2003. Natural spawning and rearing of mangrove red snapper, Lutjanus argentimaculatus, larvae in captivity. Israeli J. Aquacult./Bamidgeh 55: 22-30. [ Links ]
Lim LC, Cheong L, Lee HB, Heng HH. 1985. Induced breeding studies of the John's snapper Lutjanus johni (Bloch), in Singapore. Singapore J. Pri. Ind. 13: 70-83. [ Links ]
Ogle JT, Lotz JM. 2006. Characterization of an experimental indoor larval production system for red snapper. N. Am. J. Aquacult. 68: 86-91. [ Links ]
Olivares OP, Boza JB. 1999. Crecimiento de juveniles de pargo mancha (Lutjanus guttatus) utilizando alimento granulado en condiciones de laboratorio. UNICIENCIA 16: 45-48. [ Links ]
Papanikos N, Phelps RP, Williams K, Ferry A, Maus D. 2003. Egg and larval quality of natural and induced spawns of red snapper, Lutjanus campechanus. Fish Physiol. Biochem. 28: 487-488. [ Links ]
Rojas JR. 1997a. Hábitos alimentarios del pargo mancha Lutjanus guttatus (Pisces: Lutjanidae) en el Golfo de Nicoya, Costa Rica. Rev. Biol. Trop. 44/45: 471-476. [ Links ]
Rojas JR. 1997b. Fecundidad y épocas de reproducción del pargo mancha Lutjanus guttatus (Steindachner) (Pisces: Lutjanidae) en el Golfo de Nicoya. Rev. Biol. Trop. 44/45: 477-487. [ Links ]
Rojas JR, Maravilla E, Chicas B. 2004. Hábitos alimentarios del pargo mancha Lutjanus guttatus (Pisces: Lutjanidae) en Los Cóbanos y Puerto La Libertad, El Salvador. Rev. Biol. Trop. 52: 163-170. [ Links ]
Siefke K. 1995. Zur Fischerei und Populations dynamik des "pargo de la mancha" (Lutjanus guttatus) im Golf von Nicoya, Costa Rica. MSc thesis, University of Bremen, Germany, 72 pp. [ Links ]
Singhagraiwan T, Doi M. 1993. Induced spawning and larval rearing of the red snapper, Lutjanus argentimaculatus, at the Eastern Marine Fisheries Development Center. Thai Mar. Fish. Res. Bull. 4: 45-57. [ Links ]
Tucker JW Jr. 1998. Marine Fish Culture. 1st ed. Kluwer Academic, Netherlands, 750 pp. [ Links ]
Tucker J, Jory D. 1991. Marine fish culture in the Caribbean region. World Aquacult. 22: 10-25. [ Links ]
Turano M, Davis DA, Arnold CR. 2000. Observations and techniques for maturation, spawning, and larval rearing of the yellowtail snapper Ocyurus chrysurus. J. World Aquacult. Soc. 31: 59-68. [ Links ]
Valverde S, Boza JA. 1999. Inducción al desove en hembras del pargo mancha, Lutjanus guttatus (Steindachner, 1869). UNICIENCIA 15-16: 65-69. [ Links ]
Vargas MB. 1999. Estimación de parámetros biológico-pesqueros para el pargo mancha Lutjanus guttatus en el Golfo de Nicoya, Costa Rica. UNICIENCIA 15-16: 79-84. [ Links ]
Watanabe W, Ellis E, Ellis S, Chaves J, Manfredi C. 1998. Artificial propagation of mutton snapper Lutjanus analis, a new candidate marine fish species for aquaculture. J. World Aquacult. Soc. 29: 176-187. [ Links ]














