Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Ciencias marinas
versão impressa ISSN 0185-3880
Cienc. mar vol.34 no.2 Ensenada Jun. 2008
Artículos
Biología reproductiva del pepino de mar Parastichopus parvimensis (Echinodermata: Holothuroidea) de Isla Natividad y Bahía Tortugas, Baja California Sur, México
Reproductive biology of the sea cucumber Parastichopus parvimensis (Echinodermata: Holothuroidea) at Isla Natividad and Bahía Tortugas, Baja California Sur, Mexico
MC Fajardo-León1*, MCL Suárez-Higuera1, A del Valle-Manríquez1, A Hernández-López2
1 Centro Regional de Investigación Pesquera La Paz, BCS, Km 1 Carretera a Pichilingue, CP 23020, La Paz, Baja California Sur, México. * E-mail: cfajardol@yahoo.com.mx
2 Centro Interdisciplinario de Ciencias Marinas (CICIMAR), Instituto Politécnico Nacional, La Paz, BCS, México.
Recibido en octubre de 2007.
Aceptado en marzo de 2008.
Resumen
Se estudió la reproducción del pepino de mar Parastichopus parvimensis en Isla Natividad (abril de 2000 a agosto de 2001) y Bahía Tortugas (marzo de 2003 a marzo de 2004), Baja California Sur, México. Las muestras se recolectaron manualmente por medio de buceo semiautónomo. Parastichopus parvimensis es una especie dioica, sin dimorfismo sexual externo, con gónada ramificada. El desarrollo de la gónada confirmó la existencia de cinco estadios: indiferenciado, gametogénesis, madurez, desove y post-desove. Se determinó un periodo de reproducción anual sincrónico en ambos sitios. La proporción de sexos fue 1:1. La variación del índice gonadosomático se relacionó directamente con el desarrollo gonadal. La máxima madurez y desove se registraron de febrero a mayo en ambos sitios de estudio. El peso de primera madurez fue 140 g en Isla Natividad y 120 g en Bahía Tortugas. En ambas áreas P. parvimensis presentó atrofia estacional de vísceras, de agosto a octubre. Como alternativa de manejo pesquero se propone una época de veda de febrero a mayo, para proteger el evento de reproducción (madurez y desove) y otra de agosto a octubre para salvaguardar el periodo de ausencia y/o atrofia de órganos internos.
Palabras clave: ciclo reproductor, indice gonadosomático, primera madurez.
Abstract
The reproduction of the sea cucumber Parastichopus parvimensis was studied from April 2000 to August 2001 at Isla Natividad and from March 2003 to March 2004 at Bahía Tortugas, Baja California Sur, Mexico. Samples were collected manually by semi-autonomous diving. The sea cucumber is a dioecious species, without external sexual dimorphism, with ramified gonad. The development of the gonad confirmed five stages: undifferentiated, gametogenesis, ripe, spawning, and post-spawning; this indicated annual synchronous reproduction in both study areas. The sex ratio was 1:1. The variation of the gonadosomatic index was directly related to the gonadal development. Maximum maturity and spawning were recorded from February to May at both sites. The weight at first maturity was 140 g at Isla Natividad and 120 g at Bahía Tortugas. In both areas P. parvimensis showed seasonal visceral atrophy from August to October. As a fishery management alternative, we propose one closed season from February to May to protect the reproductive season (ripe/spawning), and another from August to October to protect the period when the internal organs are absent or atrophied.
Key words: reproductive cycle, gonadosomatic index, first maturity.
Introducción
El pepino de mar Parastichopus parvimensis (Clark 1913) es un equinodermo de la clase Holothuroidea, orden Aspidochirota, representada por la familia Stichopodiidae. Se distribuye desde Monterey Bay, California, EUA, hasta Bahía Tortugas, Baja California Sur, México. Habita aguas templadas, desde zonas someras hasta 40 m de profundidad, sobre fondos rocosos, pedregosos y arenosos, en donde promueve cambios fisicoquímicos por la ingestión del sedimento y por el enriquecimiento del sustrato por sus deposiciones (Yingst 1976, 1982). Esta especie presenta ausencia y/o atrofia estacional de vísceras (tracto digestivo, árbol respiratorio, gónada) o están poco desarrolladas.
Por su demanda y precio en el mercado asiático, P. parvimensis es es una de las principales especies de importancia comercial en la costa noroeste de la Península de Baja California, zona de distribución de la especie en México. De 1988 a 2000 su captura comercial se realizaba exclusivamente en el estado de Baja California. Su gran demanda y alto precio en el mercado asiático, aunados a la falta de reglamentación, originaron la sobreexplotación del recurso en Baja California (Tapia-Vázquez et al. 1996), por lo que de mayo de 2000 a mayo de 2004 su captura fue restringida al régimen de "pesca de fomento" con el fin de aumentar el conocimiento biológico-poblacional del recurso. Se han realizado pocos estudios sobre esta especie en el país. Entre ellos, en Baja California se han hecho algunos estudios sobre su ciclo reproductor y crecimiento (Pérez-Plascencia 1995, Tapia-Vázquez et al. 1996), mientras que en Baja California Sur (BCS) se han realizado investigaciones principalmente sobre índices de abundancia (Centro Regional de Investigación Pesquera-La Paz, Instituto Nacional de Pesca) y distribución de la especie en el estado (Fajardo-León y Turrubiates-Morales 2005), así como sobre el desarrollo gonádico por medio de observaciones morfocromáticas y algunos aspectos de crecimiento (Espinoza-Montes 2000). Sin embargo, en BCS no se han realizado investigaciones sobre la biología reproductiva de la especie para sugerir y complementar criterios de manejo (Conand 1981, Cameron y Fankboner 1986). Considerando que esta especie se captura ya comercialmente en BCS desde mayo de 2004, el objetivo del presente estudio fue describir el desarrollo gonádico, periodo y aspectos biológicos de la reproducción de P. parvimensis, para proponer estrategias de manejo para su aprovechamiento comercial responsable y sustentable y contribuir con el plan de manejo de la especie en el estado.
Materiales y métodos
Área de estudio
Este estudio se realizó en Isla Natividad (IN) y Bahía Tortugas (BT), BCS, México (fig. 1). Las zonas de muestreo fueron, en IN la localidad conocida como La Guanera (27°52' N, 115°09' W), y en BT, en Los Morros (27°39' N, 114°51'W y 27°42' N, 114°54' W), ambas localidades con sustrato arenoso, rocoso y grava.

Recolección de muestras
Las muestras en IN se recolectaron mensualmente de abril de 2000 a agosto de 2001 y en BT de marzo de 2003 a marzo de 2004. La recolección de muestras en ambas zonas fue manual, por medio de buceo semiautónomo, entre 4 y 10 m de profundidad. Se aplicó el método de búsqueda abierta, sin transectos, ni unidad de muestreo determinada (Pérez-Ruzafa y Marcos-Diego 1985, Espinoza-Montes 2000). En ambas zonas, el tamaño medio de muestra varió entre 40 y 50 individuos por mes. Los organismos se colocaron individualmente en bolsas de plástico para evitar la pérdida de vísceras al ser manipulados. A las bolsas se les hicieron pequeñas incisiones y se pusieron en una caja de plástico con agua para su traslado al laboratorio.
Morfometría
Los individuos se dejaron reposar 30 min para su relajación y que recuperaran sus dimensiones habituales. Posteriormente, se midió su longitud total (LT) con cinta métrica flexible de 1 m, el peso húmedo total (PT) (sin agua, incluyendo tegumento y órganos internos), peso húmedo de la pared del cuerpo (PC) (sin agua, ni órganos internos) y el peso húmedo de la gónada (PG), con una balanza digital de 0.1 g de precisión. Los datos de longitud y peso se agruparon por sexo y área de estudio obteniendo los estadísticos básicos (promedio, desviación estándar, máximo y mínimo). Se realizó un análisis exploratorio de los datos biométricos (longitud total y peso) por sexo y área para obtener la estadística descriptiva (promedio, desviación estándar, máximo y mínimo).
Proceso histológico
Se extrajo la gónada de cada animal, las cuales fueron disectadas registrando su anatomía, color, y peso húmedo. Posteriormente se fijaron en solución Davidson (Bell y Lighter 1988) durante 72 h, se eliminó la solución fijadora y se transfirieron a alcohol etílico al 70% para su conservación hasta el procesamiento (Bell y Lighter 1988, Muñetón-Gómez et al. 2000).
El proceso histológico del tejido gonádico (2 g) fue realizado de acuerdo con las técnicas de deshidratación, aclaración e impregnación. Se hicieron cortes entre 6 y 7 μm de espesor con un microtomo de rotación manual. Las preparaciones fueron teñidas con hematoxilina-eosina (Grant y Tyler 1983) y se montaron con resina sintética (Bell y Lighter 1988, Martoja y Martoja 1970).
Análisis reproductor cualitativo
La estructura de la gónada fue examinada bajo un microscopio óptico, y con base en las características celulares distintivas del núcleo, el citoplasma, la pared del epitelio folicular y el germinal, se establecieron las fases o estadios de desarrollo gonádico. El ciclo reproductor se definió con base en el reconocimiento y descripción de los tipos célulares de la gónada de acuerdo con los criterios utilizados por Cameron y Fankboner (1986) y Conand (1993a, b). Con la información generada se obtuvo el porcentaje y la frecuencia mensual de los estadios gonádicos por sexo, en cada zona.
Análisis estadístico
El peso de primera madurez sexual (BW50, por sus siglas en inglés) se obtuvo utilizando las frecuencias acumuladas relativas del PC (Conand 1993a) de los individuos maduros (estadios III y IV).
Para conocer la proporción de sexos en P. parvimensis primero se graficó el porcentaje observado de hembras, machos e indiferenciados, en cada zona. Después se aplicó la prueba χ2 de bondad de ajuste (Sokal y Rohlf 1995), comparando los valores observados y esperados de frecuencia de ocurrencia de hembras y machos, para verificar si la proporción de sexos en ambos sitios de estudio era 1:1.
Se calculó un promedio mensual del índice gonadosomático (IG) por sexo y zona, a partir de la ecuación: IG = (PG/PT × 100) (Conand 1990).
Se registró la temperatura del agua durante el muestreo únicamente en BT, con un termómetro de precisión 0.1°C, y se relacionó con el promedio mensual del IG.
Resultados
Se midieron y pesaron 688 individuos de IN y 584 de BT. En IN los promedios fueron: 22.1 ± 6.0 cm de LT, 267 ± 63 g de PT, 150.1 ± 24.6 g de PC y 11.3 ± 7.6 g de PG (tabla 1). En BT los promedios fueron 20.3 ± 2.6 cm de LT, 206.0 ± 50 g de PT, 104.5 ± 25.1 g de PC y 9.0 ± 7.9 g de PG (tabla 1). La disponibilidad de organismos se redujo de agosto a octubre debido a que los individuos se encontraron en lugares poco accesibles, lo que dificultó su localización. En estos meses se recolectaron entre 14 y 18 individuos con atrofia de órganos internos y sin gónada por zona.
Se analizaron histológicamente 413 gónadas provenientes de IN (35% hembras, 40% machos y 25% indiferenciados) y 365 de BT (36% hembras, 41% machos y 23% indiferenciados). En IN los promedios respectivos para hembras y machos fueron 21.8 ± 4.4 cm y 21.9 ± 4.3 cm de LT, 275.6 ± 101.5 g y 280.1 ± 110.2 g de PT, 143.3 ± 42.3 g y 144.3 ± 49.7 g de PC, y 15.6 ± 17.1 g y 13.4 ± 12.0 g de PG (tabla 1). En BT los promedios respectivos para hembras y machos fueron 20.2 ± 3.1 cm y 20.6 ± 2.8 cm de LT, 219.9 ± 62.1 g y 221.5 ± 51.7 g de PT, 103.3 ± 25.3 g y 105.1 ± 22.6 g de PC, y 9.8 ± 9.4 g y 93.5 ± 6.2 g de PG (tabla 1).
Porcentaje y proporción de sexos
El porcentaje mensual de organismos sexualmente diferenciados e indiferenciados y la época de ausencia estacional de la gónada por área de estudio se presentan en la figura 2. La prueba χ2 indicó que la distribución observada de la proporción de hembras y machos no fue significativamente diferente de la distribución esperada, por lo que se asumió una proporción de sexos de 1:1 en ambas zonas de estudio (IN: χ2 = 22.8, g.l. = 12, P > 0.05; BT: χ2 = 15.4, g.l. = 9, P > 0.05).
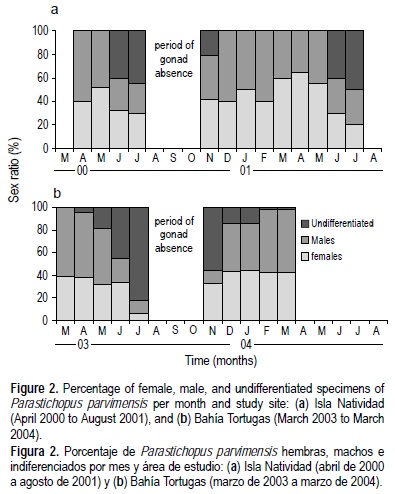
Morfología de sexos y descripción gonadal
En P. parvimensis los sexos están separados; no hay dimorfismo sexual externo. A la disección se observó la gónada impar colgando libremente en la parte anterior de la cavidad celómica. Morfológicamente tiene apariencia tubular racimosa, formada por túbulos bifurcados, y la textura y color dependió del grado de madurez, de transparente gelatinosa (inmadura) a granulosa (máxima madurez). En las hembras la gónada presentó túbulos más cortos y gruesos de color naranja, y en los machos los túbulos son más delgados y de color crema.
Estadios de madurez
Con base en las observaciones morfológicas e histológicas se describieron e identificaron cinco estadios de desarrollo para P. parvimensis de ambos sexos y áreas: indiferenciado, gametogénesis (desarrollo), madurez, desove y post-desove. En la figura 3(a-h) se presentan los cinco estadios observados para hembras y machos.
• Estadio I. Indiferenciado o en reposo. Gónada cristalina, ramificada, poco desarrollada. Túbulos cortos (3-6 mm de longitud) y delgados (0.5-1 mm de diámetro). El sexo no se puede definir. En los túbulos hay una gran cantidad de tejido conectivo con células germinales, pero no se distinguen gametos.
Estadios en machos
• Gametogénesis (II). Gónada en desarrollo. Túbulos de color blanquecino, aumento de longitud (3-6 mm) y diámetro (0.5-1.5 mm). En esta etapa las paredes de los túbulos se ven gruesas y con pliegues. Gran concentración de espermátidas en los márgenes de las paredes del folículo, los gametos se orientan hacia el lumen (fig. 3a).
• Madurez (III). Gónada turgente color crema, aumento máximo en longitud (5-6 cm) y diámetro (1.5-2 mm) de los túbulos. El lumen alcanzó su máximo diámetro, con pared delgada, lleno de espermatozoides maduros, y no se observan espacios vacíos (fig. 3b).
• Desove (IV). Fase de liberación de gametos. Se observan espacios vacíos y las paredes de los túbulos se ven menos gruesas; esto se nota en el grado de intensidad con que se tiñeron las capas gaméticas (fig. 3c).
• Post-desove (V). Disminución de la longitud y diámetro de los túbulos elongados, los cuales se ponen flácidos y semicristalinos, la pared del lumen se encuentra rota (fig. 3d).
Estadios en hembras
• Gametogénesis (II). La gónada, en crecimiento, adquiere un color naranja pálido. La longitud y diámetro de los túbulos aumentó (2-4 cm y 1-2 mm, respectivamente). Folículos con epitelio germinal en proceso de proliferación celular. Gran producción de oogonias previtelogénicas, esféricas, unidas al epitelio por un pedúnculo. Núcleo con nucleolo periférico. Pared folicular gruesa con pliegues. Gran cantidad de tejido conectivo. Crecimiento celular hacia el lumen y presencia de acinis (fig. 3e).
• Madurez (III). Gónada con máximo volumen, turgente y de color naranja intenso. Túbulos de 5-8 cm de longitud y de 2-3 mm de diámetro. Acinis llenos, pared folícular delgada, no hay tejido conectivo, llenos de ovocitos vitelogénicos. No hay espacios vacíos ni en el lumen ni entre las células. Núcleo con tres nucleolos periféricos y citoplasma granuloso (fig. 3f).
• Desove (IV). Reducción del tamaño y diámetro de túbulos semivacíos. Gónada flácida y decolorada. Paredes foliculares engrosadas, formando pliegues. Lumen con grandes espacios vacíos. En esta fase los oocitos se liberan; los oocitos remanentes reducen tamaño y pierden forma (fig. 3g).
• Post-desove (V). Fase degenerativa. Folículos colapsados, casi vacíos, en reabsorción, con gran cantidad de tejido conectivo, la pared rota y de forma irregular con ovocitos aislados y amorfos (fig. 3h).
Ciclo reproductor
El ciclo reproductor de P. parvimensis en ambos sitios presentó un patrón anual para ambos sexos. El evento reproductor inició con la fase de gametogénesis, con máximos porcentaje de organismos en este estadio en IN y BT en noviembre (44% y 38%, respectivamente) y diciembre (40% y 43%, respectivamente) (fig. 4a, b). En IN los máximos porcentajes de madurez se presentaron en abril (59%) de 2000, y febrero (65%) y marzo (70%) de 2001, mientras que en BT, sucedieron en marzo (60%) y abril (50%) de 2003, y en febrero (50%) y marzo (60%) de 2004 (fig. 4a, b). En ambas localidades el máximo desove se detectó en abril y mayo: en IN el porcentaje más alto fue en abril (55%) y mayo (59%) de 2000, y en mayo (65%) de 2001, mientras que en BT éste fue en mayo (65%) de 2003 (fig. 4a, b). El máximo post-desove tanto en IN como en BT ocurrió en junio (30-45%) y julio (30-40%) (fig. 4a, b), resultando el fin del periodo reproductivo. De agosto a octubre en ambas zonas no se registraron estadios gonádicos debido a que los individuos encontrados en estos meses no tenían gónada (fig. 4a, b). En estos meses los organismos evidenciaron también la ausencia y/o atrofia estacional de otros órganos internos (tracto digestivo, aparato circulatorio, etc). En noviembre los especímenes presentaron regeneración de órganos internos y gónada, marcando el reinicio el ciclo.

Los estadios mostraron una periodicidad anual, relacionada con las variaciones del IG en ambos sexos y áreas. El incremento del promedio mensual del IG, tanto en IN (hembras 4.3, machos 4.6) como en BT (hembras 4.5, machos 4.0) inicio en noviembre (fig. 5a, b). La gónada madura representó un alto porcentaje del peso corporal. El IG medio máximo en IN se presentó en abril (hembras 5.5, machos 5.0) de 2000 y marzo (hembras 11.0, machos 10.0) y abril (hembras 9.0, machos 8.5) de 2001, mientras que en BT éste se presentó en marzo (hembras 7.5, machos 6.8) de 2003, y febrero (hembras 6.2, machos 6.0) y marzo (hembras 6.6, machos 6.0) de 2004. En mayo los promedios de IG en ambos sexos y zonas disminuyeron (fig. 5a, b). Los valores más bajos de IG se registraron en junio y julio (IG = 2) (fig. 5a, b). De agosto a octubre el promedio de IG fue cero para ambos sexos en ambas áreas (fig. 5a, b).

Peso de primera madurez
El peso de primera madurez (cuando el 50% de los individuos de la población presentaron la gónada madura), para ambos sexos fue de 140 g en IN y de 120 g en BT (fig. 6a, b).

Temperatura
En IN no fue posible registrar la temperatura en la zona de muestreo. En BT la temperatura en la zona de muestreo varió estacionalmente y presentó una relación inversa con IG. La temperatura máxima (23.0°C) se registró en octubre y la mínima (14°C) en abril (fig. 5b).
Discusión
En los holotúridos es difícil medir la longitud debido a la capacidad que tienen para contraerse y distenderse con facilidad, la ausencia de un esqueleto y su pared corporal blanda. Estas características se constataron en P. parvimensis que, aunque se dejaron reposar 30 min en el laboratorio para que recuperaran su tamaño habitual, esto no fue de utilidad pues los individuos continuaron cambiando su longitud ante cualquier estímulo dificultando su medición (Conand 1990, 1993b; Wiedemeyer 1994; Pérez-Plascencia 1995; Espinoza-Montes 2000). En el presente estudio, la longitud y el peso total sólo fueron tomados como referencia de la talla y peso total de los organismos muestreados, por lo que no se hizo un análisis profundo de estas variables. La longitud de P. parvimensis no es una medida recomendable como para implementar y aplicar una talla mínima de captura como táctica de manejo, ya que ésta no seríala mejor opción (Pérez-Ruzafa y Marcos-Diego 1985, Conand 1990).
Por otra parte, PC es una variable precisa y confiable porque, independientemente de la forma y tamaño que adquirieron los individuos, su variación fue mínima entre sexos y zonas. Comparando los promedios de PC en IN entre hembras y machos no se observó diferencia significativa, al igual que sucedió en ambos sexos en BT; sin embargo, los promedios de PC en IN resultaron ligeramente mayores a los de BT. Actualmente PC es la variable biométrica más utilizada en estudios de biología reproductiva y dinámica poblacional de holotúridos, debido a que es un parámetro importante para el manejo del stock pues determina su valor comercial (Cameron y Fankboner 1986, Pérez-Plascencia 1995, Espinoza-Montes 2000).
Siguiendo los criterios anteriores (Cameron y Fankboner 1989) para determinar las características histológicas se pudo describir el desarrollo celular de la gónada y reconocer los cinco estadios observados en el presente estudio, éstos resultaron similares a los descritos para otras especies de holoturias de aguas templadas (Cameron y Fankboner 1989, Tapia-Vázquez et al. 1996, Espinoza-Montes 2000) y tropicales (Nuño-Hermosillo 2003, Skarbnik-López 2006).
Parastichopus parvimensis mostró un ciclo reproductivo anual tanto en IN como en BT. Tanto hembras como machos mostraron una marcada estacionalidad reproductiva en invierno/primavera (febrero/marzo) en ambas zonas. Estos resultados coinciden con lo reportado para esta especie por Pérez-Plascencia (1995) en Bahía Todos Santos (Baja California) y por Espinoza-Montes (2000) en IN. Cameron y Fankboner (1986) reportan lo mismo en P. californicus y señalan que el periodo de reproducción anual es característico de la mayoría de las especies de aguas templadas.
En la tabla 2 se compara el periodo de madurez y desove registrado para P. parvimensis en este estudio, con los registrados por otros investigadores en otros sitios. Se aprecia que la época de reproducción de esta especie presenta un gradiente latitudinal de sur a norte. En la zona sur el periodo de madurez/ desove es en invierno/primavera mientras que en el norte es en primavera/verano. Este gradiente probablemente se debe a las condiciones oceanográficas, a factores ambientales, a la latitud o a la distribución geográfica. Cameron y Fankboner (1986) indican que muchos holotúridos desovan en respuesta al incremento en la intensidad del régimen de luz ambiental, como P. californicus, que inicia su desove con el incremento de la duración e intensidad de la luz del día, lo que implica el incremento de la biomasa de fitoplancton, factores que pueden ser los posibles inductores del desove latitudinal. Pérez-Plascencia (1995) y Espinoza-Montes (2000) registraron que estos factores inducen el desove de P. parvimensis en Bahía Todos Santos y en IN, por lo que se considera que éstos podrían también ser los inductores de desove en IN y BT, pero ésto no fue evaluado.
El periodo de reproducción de P. parvimensis fue determinado con base en el estudio histológico y respaldado con la determinación de IG, que fue un indicador de la actividad y esfuerzo reproductivo estacional para esta especie, ya que los resultados indicaron el comportamiento reproductor de la especie. Sin embargo, es importante señalar que el IG es un índice que puede variar con el estado fisiológico del organismo, por factores ambientales (temperatura) y por la alimentación, por lo que resultaba necesario validar la actividad reproductora con el estudio histológico. Ambos estudios son complementarios y de uso generalizado (Engstrom 1980, Harriot 1985, Herrero-Pérezrul et al. 1999, Nuño-Hermosillo 2003). El promedio mensual del IG en hembras y machos de IN y BT reveló un comportamiento similar. El IG se incrementó a partir de noviembre, mes en el que la gónada aumentó de volumen y peso, coincidiendo con el inicio de la gametogénesis; posteriormente aumentó en enero y febrero, alcanzando los valores máximos en marzo y abril, cuando se registró la máxima madurez, y disminuyo en abril y mayo conforme avanzó el desove. Los valores más bajos de IG se observaron en junio y julio, meses en los que se incrementaron el post-desove y los individuos indiferenciados. De agosto a octubre el IG fue cero porque los individuos entraron en el periodo de ausencia estacional de vísceras. Con base en estos resultados se ratifica que P. parvimensis presenta un ciclo reproductor anual sincrónico similar al encontrado por Pérez-Plascencia (1995) para esta misma especie en Bahía Todos Santos, y por Espinoza-Montes (2000) también en IN. También Cameron y Fankboner (1986, 1989) han reportado reproducción sincrónica en P. californicus; Conand (1993a) en Stichopus variegatus; Fajardo-León et al. (1995), Herrero-Pérezrul et al. (1999) y Nuño-Hermosillo (2003) en Isostichopus fuscus; y Skarbnik-López (2006) en Holothuria (Selenkothuria) lubrica.
En BT se observó una relación inversa entre IG y la temperatura del agua en la zona de muestreo. El evento reproductor fue en primavera con las temperaturas más baja del periodo de estudio, mientras que la temperatura más alta se registró en septiembre y octubre, cuando los individuos están en el periodo de ausencia de órganos internos. En BT la temperatura jugó un papel significativo en el ciclo reproductor.
La ausencia estacional de visceras es un fenómeno común en los Aspidochirotas (Byrne 1985), y en este estudio se observó claramente entre agosto y octubre (en ambos sexos y áreas). En otras especies del género Parastichopus también se ha reportado este fenómeno fisiológico. Algunos investigadores sugieren que la ausencia de vísceras es el resultado de la autoevisceración (Yingst 1976, 1982; Dimock 1977; Muscat 1982), mientras que otros opinan que se debe a la reabsorción de los órganos internos (Fankboner y Cameron 1985, Pérez-Plascencia 1995, Espinoza-Montes 2000). Sin embargo, en el presente estudio este fenómeno se observó pero no se evaluó su causa.
Se estimó el peso de primera madurez como punto de referencia para el manejo del recurso, ya que éste es empleado como estrategia de decisión en el establecimiento de la época de veda (Pérez-Plascencia 1995, Espinoza-Montes 2000, Nuño-Hermosillo 2003). En BCS las dos zonas más productivas de P. parvimensis son IN y BT, por lo que resultó importante estimar el peso de primera madurez para incrementar los criterios de manejo pesquero del recurso en ese estado. En IN el peso de primera madurez (incluyendo ambos sexos) fue ligeramente mayor al de BT. Espinoza-Montes (2000) reportó para esta especie un peso de primera madurez (utilizando PC) de 122 g en IN, que resulta poco menor al registrado en este estudio en IN y muy cercano al de BT. Pérez-Plascencia (1995) reporta un peso de 160 g y uno mínimo de primera madurez de 120 g, y consideró que en este último peso P. parvimensis podría reproducirse por primera vez.
En el presente estudio se obtuvo la información necesaria para proponer un plan de manejo pesquero de P. parvimensis que cuya táctica consista en implementar dos épocas de veda, una de febrero a mayo para proteger el evento reproductor y otra de agosto a octubre para salvaguardar el periodo de ausencia y atrofia de órganos internos, un fenómeno fisiológico que se observó en la especie en las zonas de estudio.
Agradecimientos
Expresamos nuestro agradecimiento a JA Espinoza-Montes, técnico de la Sociedad Cooperativa de Producción Pesquera Buzos y Pescadores de la Baja California, y a M Ramade-Villanueva, técnico de la Sociedad Cooperativa de Producción Pesquera Bahía Tortugas, y al personal de ambas cooperativas por su colaboración y apoyo logístico.
Referencias
Bell TA, Lighter DV. 1988. A Handbook of Normal Penaeid Shrimp. Histology. Allen Press. Kansas, 114 pp. [ Links ]
Byrne M. 1985. Evisceration behavior and the seasonal incidence of evisceration in the holothurians Eupentacta quinquesemita (Selenka). Ophelia 24: 75-90. [ Links ]
Cameron JL, Fankboner PV. 1986. Reproductive biology of the commercial sea cucumber Parastichopus californicus (Stimpson) (Echinodermata: Holothuroidea). I. Reproductive periodicity and spawning behavior. Can. J. Zool. 64: 168-175. [ Links ]
Cameron JL, Fankboner PV. 1989. Reproductive biology of the commercial sea cucumber Parastichopus californicus. II. Observations on the ecology of development, recruitment and the juvenile life stage. J. Exp. Mar. Biol. Ecol. 127: 43-67. [ Links ]
Clark HI. 1913. Echinoderms from Lower California with descriptions of new species. Bull. Mar. Sci. 32: 185-235. [ Links ]
Conand C. 1981. Sexual cycle of three commercially important holothurian species (Echinodermata) from the lagoon of New Caledonia. Bull. Mar. Sci. 31: 523-543. [ Links ]
Conand C. 1990. The fishery resources of Pacific island countries. FAO Fish. Tech. Pap. Part 2. Holothurians. FAO, Rome, 143 pp. [ Links ]
Conand C. 1993a. Ecology and the reproductive biology of Stichopus variegatus, an Indopacific coral reef sea cucumber (Echinodermata: Holothuroidea). Bull. Mar. Sci. 52(3): 970-981. [ Links ]
Conand C. 1993b. Reproductive biology of the holothurians from the major communities of the New Caledonian Lagoon. Mar. Biol. 116: 439-450. [ Links ]
Dimock RV. 1977. Effects of evisceration on oxygen consumption by Stichopus parvimensis (Echinodermata, Holothuroidea). J. Exp. Mar. Biol. Ecol. 28: 125-132. [ Links ]
Engstrom AN. 1980. Reproductive cycles of Halodeima floridiana, Holothuria mexicana and their hybrids (Echinodermata: Holothuroidea) in southern Florida, USA. Int. J. Invertebr. Reprod. 2: 237-244. [ Links ]
Espinoza-Montes A. 2000. Ciclo reproductivo del pepino de mar Parastichopus parvimensis (HL Clarck, 1913) (Echinodermata, Holothuroidea) en Isla Natividad, Baja California Sur, México. Thesis, Universidad Autónoma de Guadalajara, 60 pp. [ Links ]
Fajardo-León MC, Turrubiates-Morales J. 2005. Distribución y densidad de Parastichopus parvimensis en la costa noroccidental de Baja California Sur. Simposio sobre Ciencias Pesqueras en México. Mayo 2005, La Paz, BCS, México. [ Links ]
Fajardo-León MC, Michel-Guerrero E, Vélez-Barajas JA, Massó-Rojas JA, Singh-Cabanillas J. 1995. Estructura poblacional y ciclo reproductor del pepino de mar Isostichopus fuscus (Ludwig 1875) en Santa Rosalía, Baja California Sur, México. Cienc. Pesq. 11: 45-53. [ Links ]
Fankboner PV, Cameron LJ. 1985. Seasonal atrophy of the visceral organs in a sea cucumber. Can. J. Zool. 631: 888-892. [ Links ]
Grant A, Tyler RA. 1983. The análisis of data in studies of invertebrate reproduction. I. Introduction and statistical analysis of gonad indices and maturity indices. Int. J. Invertebr. Reprod. 6: 259-269. [ Links ]
Harriot VJ. 1985. Reproductive biology of three congeneric sea cucumber species, Holothuria atra, H. impatiens y H. edulis, at Heron Reef in the Great Barrier Reef. Aust. J. Mar. Freshw. Res. 36: 51-57. [ Links ]
Herrero-Pérezrul MD, Reyes-Bonilla H, García-Dominguez F, Cintra-Buenrostro C. 1999. Reproduction and growth of Isostichopus fuscus (Echinodermata: Holothuroidea) in the southern Gulf of California, Mexico. Mar. Biol. 135: 521-532. [ Links ]
Martoja R, Martoja P. 1970. Técnica de Histología Animal. Toray-Marson, Barcelona, 373 pp. [ Links ]
McEuen FS. 1988. Spawning behaviors of Northeast Pacific sea cucumbers (Holothuroidea: Echinodermata). Mar. Biol. 98: 565-585. [ Links ]
Muñetón-Gómez MS, Villalejo-Fuerte M, García-Melgar G. 2000. Manual de Técnicas Histológicas Aplicadas a Organismos Marinos. Univ. Autónoma de Baja California Sur, La Paz, 81 pp. [ Links ]
Muscat A. 1982. Aspects of the biology of the sea cucumber Parastichopus parvimensis: A developing comercial fisheries. In: Planning and Management of California's Coastal Resources. U.S.C. Sea Grant Institutional Programs, 1981-1982. Trainee Rep., pp. 25-27. [ Links ]
Nuño-Hermosillo A. 2003. Ecología poblacional, ciclo reproductivo e historia de la pesquería del pepino de mar Isostichopus fuscus (Ludwig, 1875) (Echinodermata: Holothuroidea) en Bahía Chamela, Jalisco, México. M.Sc. thesis, Universidad de Guadalajara, México, 111 pp. [ Links ]
Pérez-Plascencia G. 1995. Crecimiento y reproducción del pepino de mar Parastichopus parvimensis en la Bahía de Todos Santos, Baja California, México. M.Sc. thesis, Universidad Autónoma de Baja California, México, 67 pp. [ Links ]
Pérez-Ruzafa A, Marcos-Diego C. 1985. Técnicas de recolección y estudio en la clase Holoturoidea. I. Generalidades, sistemática, ecología, biología y comportamiento. An. Biol. 3 (Biol. Anim.): 13-35. [ Links ]
Skarbnik-López J. 2006. Ciclo reproductor de Holothuria (Selenkothuria) lubrica Selenka, 1867 (Echinodermata: Holothuroidea) en el sur de la Bahía de La Paz, BCS, México. Tesis de licenciatura. Universidad Autónoma de Baja California Sur, México, 67 pp. [ Links ]
Sokal R, Rohlf JH. 1995. Biometry. 3rd ed. WH Freeman & Co., New York, 468 pp. [ Links ]
Tapia-Vázquez OM, Castro-González JJ, Valles-Ríos H. 1996. Madurez gonádica del pepino de mar Parastichopus parvimensis en la costa occidental de Baja California, México. Cienc. Pesq. 12: 5-12. [ Links ]
Tyler PA, Gage JD. 1983. The reproductive biology of Ypsilothuria talismani (Holothuroidea: Dendrochirota) from the NE Atlantic. J. Mar. Biol. Assoc. UK 63: 609-616. [ Links ]
Wiedemeyer WL. 1994. Biology of small juveniles of the tropical holothurian Actinopyga echinites: Growth, mortality, and habitat preferences. Mar. Biol. 120: 81-93. [ Links ]
Yingst JY. 1976. The utilization of organic matter in shallow marine sediments by an epibenthic deposit-feeding holothurian. J. Exp. Mar. Biol. Ecol. 23: 55-69. [ Links ]
Yingst JY. 1982. Factors influencing rates of sediment ingestion by Parastichopus parvimensis (Clark), an epibenthic deposit-feeding holothurian. Estuar. Coast. Shelf Sci. 141: 119-134. [ Links ]














