Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Ciencias marinas
versão impressa ISSN 0185-3880
Cienc. mar vol.34 no.1 Ensenada Mar. 2008
Notas de investigación
Crecimiento del coral hermatípico Montastraea cavernosa en el Sistema Arrecifal Veracruzano
Growth of the hermatypic coral Montastraea cavernosa in the Veracruz Reef System
G Horta-Puga1 y JD Carriquiry2
1 Facultad de Estudios Superiores Iztacala, UBIPRO, Universidad Nacional Autónoma de México, Av. de los Barrios 1, Los Reyes Iztacala, Tlalnepantla 54090, México. E-mail: horta@servidor.unam.mx
2 Instituto de Investigaciones Oceanológicas, Universidad Autónoma de Baja California, Carretera Tijuana-Ensenada Km 103, Ensenada 2800, Baja California, México. E-mail: jose_carriquiry@uabc.mx
Recibido en abril de 2007.
Aceptado en febrero de 2008.
Resumen
El coral hermatípico Montastraea cavernosa es uno de los más importantes constructores de arrecifes en el Sistema Arrecifal Veracruzano, un ecosistema arrecifal que se ha desarrollado en un ambiente de aguas con una gran turbidez. A pesar de la importancia ecológica de esta especie, los estudios sobre su tasa de crecimiento son escasos. El objetivo de este estudio es presentar las tasas de crecimiento anual del coral escleractinio M. cavernosa para el periodo 1923-2001 en el sur del Golfo de México (SGM). La tasa de extensión lineal media fue de 2.9 ± 0.9 mm año-1, la cual es ligeramente menor, aunque no significativamente diferente, que los registros previos para esta especie en otras localidades arrecifales. No se encontró correlación entre la temperatura océanica superficial y la tasa de extensión lineal, lo que indica que la tasa de crecimiento podría ser influenciada por algún otro factor ambiental. Se sugiere que, dado que el SGM es un ambiente con aguas turbias, las condiciones para el desarrollo coralino son más severas que en otras áreas arrecifales con aguas prístinas, lo que podría estar afectando negativamente el desarrollo del coral reduciendo su tasa de crecimiento.
Palabras clave: crecimiento, Montastraea cavernosa, sistema arrecifal veracruzano, Golfo de México.
Abstract
The hermatypic coral Montastraea cavernosa is one of the most important reef-builders in the Veracruz Reef System, an ecosystem that has developed in a highly turbid environment. Despite the ecological importance of this species, studies about its growth rate are scarce. This study therefore aims to present the annual growth rates of the scleractinian coral M. cavernosa for the period 1923-2001 in the southern Gulf of Mexico (SGM). Average extension rate was 2.9 ± 0.9 mm yr-1 (σ), which is slightly lower, although not significantly different, than previous records for this species from other reef settings. No correlation was found between sea surface temperature and extension rate, indicating that growth could be influenced by some other factor. We suggest that, as the coastal SGM is a turbid environment, the conditions for coral development are harsher than in other reef areas with pristine waters, and that this could negatively affect the coral's performance, reducing its growth rate.
Key words: growth, Montastraea cavernosa, Veracruz Reef System, Gulf of Mexico.
Introducción
Los sistemas arrecifales costeros pueden desarrollarse en ambientes de aguas turbias donde los sedimentos suspendidos y la turbidez son altos debido a aporte excesivo de sedimentos de origen continental, a través de las descargas fluviales (Rogers 1990). Se han identificado diversos efectos adversos en los corales como resultado de altas tasas de sedimentación: muerte por enterramiento (Wesseling et al. 1999, Nugues y Roberts 2003), interrupción del éxito reproductivo (Hodgson 1990, Gilmour 1999), reducción de la fotosíntesis y crecimiento coralino (Philipp y Fabricius 2003, Nugues y Roberts 2003), y disminución de la densidad de sus esqueletos (Carricart-Ganivet y Merino 2001). Los arrecifes coralinos del Sistema Arrecifal Veracruzano (SAV) se han desarrollado en un ambiente de aguas turbias generado por la descarga del Río Jamapa (Morelock y Koenig 1967, Carricart-Ganivet y Horta-Puga 1993, Tunnell 1988, Horta-Puga 2007). La turbidez en esta area es tan alta que podría inhibir el desarrollo de algunas especies de coral, pero el coral escleractinio Montastraea cavernosa (Linnaeus 1767) es una especie muy resistente a la sedimentación (Bak y Elgershuizen 1976) debido a su gran capacidad para rechazar materials particulados pequeños como limos y arcillas (Hubbard and Pocock 1972). Por ello llega a ser una especie sumamente competitiva y dominante en ambientes arrecifales de aguas turbias como en el arrecife Ponce en Puerto Rico (Acevedo et al. 1989). Por tanto, se considera que en los ambientes arrecifales del Atlántico tropical con concentraciones altas de material particulado, el coral hermatípico M. cavernosa será la especie dominante. Tal es el caso del SAV (Horta-Puga 2007), donde éste es el coral hermatípico más importante en las áreas someras (3-12 m) de los taludes arrecifales en los que su abundancia relativa llega hasta el 40% (Horta-Puga 2003).
La literatura reciente sobre escleractinios de México se ha enfocado en varios aspectos que incluyen paleoceanografía, taxonomía, biogeografía o reproducción (Carriquiry y Reyes-Bonilla 1997, Villaescusa y Carriquiry 2004, Medina-Rosas et al. 2005, Pérez-Vivar et al. 2006, Horta-Puga et al. 2007), y el crecimiento de M. annularis (Carricart-Ganivet et al. 1994, 2000; Carricart-Ganivet y Merino 2001; Carricart-Ganivet 2004), pero no en el crecimiento de M. cavernosa, y aunque hay algunos registros disponibles sobre las tasas de crecimiento de esta especie de coral ecológicamente importante (Weber y White 1977, Berger et al. 2002), no existen datos sobre M. cavernosa en el SAV, un ambiente de aguas turbias. La finalidad de este estudio es presentar el primer registro de las tasas de extensión esqueletal (TEL) para esta especie de coral.
Materiales y métodos
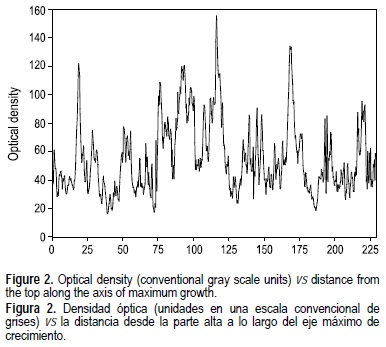
Se recolecto una colonia viva, completa y de aspecto saludable, de aproximadamente 60 cm de altura, del coral constructor de arrecifes M. cavernosa en octubre de 2002, a una profundidad de ~2.5 m en la zona posterior del arrecife Isla de Sacrificios, SAV (19°10'6" N, 96°05'32" O). Se radiografió una laja de 9 mm de espesor para determinar la posición de las bandas de crecimiento de densidad. La radiografía fue digitalizada, convertida a una imagen positiva (fig. 1) y procesada con el programa Scion Image Beta 4.0.2©. Dado que las bandas de densidad anuales no pudieron ser diferenciadas claramente por inspección visual de la imagen, la esclerocronología fue determinada midiendo la densidad óptica a lo largo de un transecto de 4 mm de ancho, siguiendo la trayectoria de crecimiento de una sola coralita y tratando de evitar el atravezar las paredes de la coralita (Dodge y Brass 1984). La densidad óptica varía en función de la densidad esqueletal, por lo cual se obtuvo un gráfico con el perfil de densidad promediando los datos de densidad óptica de los pixeles localizados a la misma distancia desde el margen superior de la colonia (fig. 2). La TEL fue determinada midiendo la distancia lineal entre los puntos más altos de picos sucesivos en el gráfico de densidad, los que corresponden a la posición de las bandas de alta densidad en el coral (Dodge y Brass 1984).

Resultados
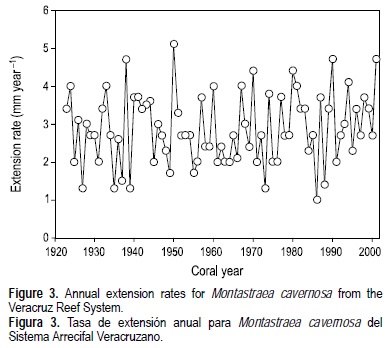
La figura 3 muestra las TEL anuales calculadas para cada año, la cual varió desde 1.0 mm año-1 en 1986 hasta 5.1 mm año-1 en 1951, con un promedio general de 2.9 ± 0.9 mm año-1 (σ) y un coeficiente de variación alto (CV = 32.4%). El modelo de edad de la colonia fue construido empezando con el segundo par de bandas de densidad (picos y valles correspondientes a 2001) por que el primer par no estaba formado completamente en el año en que el coral fue recolectado (2002). De esta forma, el año de formación de cada banda de densidad fue asignada retrospectivamente hasta 1923, dando como resultado un registro de 79 años de crecimiento coralino. No tomaron en cuenta los picos de densidad óptica que se sospechaban bandas de estrés dada su proximidad a una banda de alta densidad y su menor densidad óptica con relación a las bandas de alta densidad adyacentes. En octubre, cuando la colonia fue recolectada, se estaba formando en ella una banda de alta densidad, por lo que se supuso en el SGM M. cavernosa forma esta banda a fines del verano, tal y como se ha descrito previamente para esta especie (Berger et al. 2002).
Discusión
La tasa de crecimiento media resultó ligeramente inferior a la encontrada otras áreas arrecifales para esta especie: 3.2 mm año-1 en Belice, los Cayos de Florida y Panamá; 3.5 mm año-1 en Jamaica (Weber y White 1977); y 3.1 mm año-1 para el registro conocido más largo (~800 años) de las Bermudas, el cual también muestra un intervalo de variación similar, de 1.7- 5.0 mm año-1 (Berger et al. 2002). Sin embargo, no se encontró una diferencia significativa entre los datos registrados de crecimiento.
La tasa de crecimiento es sumamente variable a lo largo del tiempo, sin una tendencia temporal aparente (fig. 3). Para determinar si se presenta alguna tendencia, se calcularon las anomalías (TEL anual menos tasa media anual) para la TEL anual y los datos se filtraron utilizando una media móvil con ventana de 10 años para eliminar las señales o ruido de alta frecuencia en los datos crudos anuales (fig. 4). Como puede observarse, hay tres periodos en los que la TEL se encuentra por arriba del promedio, 1937-1948, 1977-1986 y 1992-1997, alternando con periodos de crecimiento por debajo del promedio especialmente en 1949-1976, casi 30 años de anomalías negativas. Dado que se sabe que la temperatura océanica superficial (TOS) es un agente de forzamiento positivo en la TEL y la tasa de calcificación (Dodge y Lang 1983; Lough y Barnes 1997, 2000), se investigó la relación entre TEL y TOS. La figura 4 muestra las series de tiempo de las anomalías de TEL y TOS, ambas suavizadas con un filtro de 10 años. Los datos de la TOS se obtuvieron para una celda de 2° × 2° (lat-long), centrada en 20°N, 96°W (ERSSTv2: Smith and Reynolds 2004). Las tendencias temporales de ambas variables son muy diferentes, con una correlación no significativa (r = -0.008, P < 0.05). Esto sugiere que podría estar involucrado algún otro factor ambiental, controlando o al menos influenciando el crecimiento coralino.
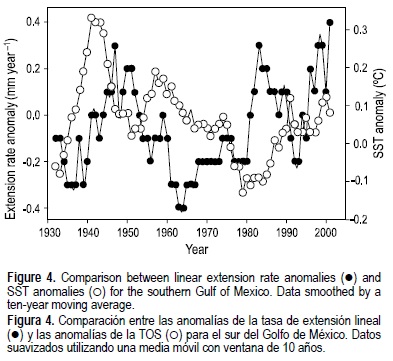
Patzold y Wefer (1992) estudiaron la tasa de crecimiento de una colonia de 800 años de M. cavernosa de las Bermudas, y reportaron una correlación inversa con la TOS. Tal correlación fue atribuida a la mezcla vertical inducida por el viento, el cual enfría las aguas superficiales pero también inyecta nutrientes en la zona fótica, posiblemene favoreciendo el crecimiento coralino. Por tanto, el crecimiento de M. cavernosa podría también estar siendo influenciado por la disponibilidad de nutrientes. Es importante señalar que la tasa media de crecimiento de 3.1 mm año-1 en la colonia de Bermudas es similar y no significativamente diferente de la que se observó en el SAV (2.9 mm año-1), aún a pesar de que la TOS anual media en Bermudas (23.2°C) es 3.5°C más baja que en el SAV (26.7°C) según se calculó para 1950-2004 (ERSSTv2: Smith and Reynolds 2004). Más aun la tasa de crecimiento en el SAV es menor que la registrada en Jamaica y Belice, con TOS medias anuales más altas. Una posible explicación para las ligeramente inferiores tasas de crecimiento de M. cavernosa podría ser que el SAV es un ambiente con aguas muy turbias, con baja visibilidad (<10-12 m) en la capa superficial (5-9 m de profundidad) a lo largo de todo el año (Tunnell 1988). Aunque no existen datos disponibles en la literatura con respecto a la concentración de sólidos suspendidos en las aguas costeras de Veracruz, el SAV está localizado en un área costera donde el Río Jamapa descarga todo el año provocando la presencia de sedimentos terrígenos en las áreas interarrecifales (Morelock y Koening 1967, Horta-Puga 2007). Viviendo en un ambiente turbio, los corales son forzados a utilizar considerables recursos energéticos para poder deshacerse de los sedimentos sobre su superficie (Hubbard y Pocock 1972). Tal comportamiento ya ha sido reportado en M. cavernosa (Bak y Elgerhuizen 1976, Lasker 1980). Los datos experimentales disponibles en la literatura demuestran que los corales arrecifales expuestos a una carga alta de sedimentos suspendidos muestran una dismución en su tasa neta de fotosíntesis debido a la reducción de la luz (Abdel-Salam y Porter 1988). Dado que en los corales zooxantelados la fotosíntesis está acoplada a la calcificación (Furla et al. 2000), la consecuencia obvia es un decremento en la tasa de extensión lineal esquelética, tal como ha sido registrada para otros corales arrecifales que se desarrollan en ambientes turbios (Torres y Morelock 2002). Sin embargo, Carricart-Ganivet y Merino (2001) analizaron la densidad y las tasa de extensión y calcificación, y encontraron que cuando M. annularis crece en el SAV sacrifica la densidad esquelética para poder mantener una tasa de extensión alta, con una tasa de calcificación reducida. Sin embargo, no ha sido posible atribuir este mismo mecanismo a M. cavernosa, dado que no se determinó su densidad.
Así, independientemente de que la TOS es más alta en Veracruz que en la Bermudas, ésta no es el agente principal de forzamiento del crecimiento en M. cavernosa. Quizás la tasa relativamente baja de crecimiento para esta especie de coral en el SAV podría ser explicada por un efecto fisiológico adverso debido a la alta concentración de sedimentos suspendidos en la columna de agua. Esta suposición podría estar apoyada por el hecho de que los corales que crecen en aguas más prístinas (p. ej. Belice, Florida y Jamaica) muestran tasas de crecimiento mayores (Weber y White 1977). Aunque M. cavernosa es una especie coralina dominante en ambientes arrecifales turbios por su gran capacidad para manejar sedimentos que caen sobre ella, su éxito ecológico puede depender de su habilidad para dedicar sus recursos energéticos a rechazar los sedimentos y no a otros procesos fisiológicos tales como el crecimiento. Sin embargo, esto tendría que ser abordado adecuadamente en el futuro.
Agradecimientos
Agradecemos al Acuario de Veracruz AC, por las facilidades para desarrollar el trabajo de campo, especialmente a MA Román, R Martínez y A Zorrilla. Nosotros también agradecemos los comentarios de un revisor anónimo.
Referencias
Abdel-Salam HA, Porter JW. 1988. Physiological effects of sediment rejection on photosynthesis and respiration in three Caribbean reef corals. Proc. 6th Int. Coral Reef Symp. 2: 285-292. [ Links ]
Acevedo R, Morelock J, Olivieri RA. 1989. Modification of coral reef zonation by terrigenous sediment stress. Palaios 4: 92-100. [ Links ]
Bak RPM, Elgershuizen JHBW. 1976. Patterns of oil-sediment rejection in corals. Mar. Biol. 37: 105-113. [ Links ]
Berger WH, Pätzold J, Wefer G. 2002. Times of quiet, times of agitation: Sverdrup's conjecture and the Bermuda coral record. In: Wefer G, Berger W, Behre KE, Jansen E (eds.), Climate Development and History of the North Atlantic Realm. Springer-Verlag, Berlin, pp. 89-99. [ Links ]
Carricart-Ganivet JP. 2004. Sea surface temperature and the growth of the West Atlantic reef-building coral Montastraea annularis. J. Exp. Mar. Biol. Ecol. 302: 249-260. [ Links ]
Carricart-Ganivet JP, Horta-Puga G. 1993. Arrecifes de coral en México. In: Salazar-Vallejo SI, González NE (eds.), Biodiversidad Marina y Costera de México. CONABIO, CIQRO, México, pp. 81-92. [ Links ]
Carricart-Ganivet JP, Merino M. 2001. Growth response of the reef-building coral Montastraea annularis along a gradient of continental influence in the southern Gulf of Mexico. Bull. Mar. Sci. 68: 133-146. [ Links ]
Carricart-Ganivet JP, Horta-Puga G, Ruiz-Zárate MA, Ruiz-Zárate E. 1994. Tasas retrospectivas de crecimiento en el coral hermatípico Montastrea annularis en arrecifes del sur del Golfo de México. Rev. Biol. Trop. 42: 515-521. [ Links ]
Carricart-Ganivet JP, Beltrán-Torres AU, Merino M, Ruiz-Zárate MA. 2000. Skeletal extension, density and calcification rate of the reef building coral Montastraea annularis (Ellis and Solander) in the Mexican Caribbean. Bull. Mar. Sci. 66: 215-224. [ Links ]
Carriquiry JD, Reyes-Bonilla H. 1997. Estructura de la comunidad y distribución geográfica de los arrecifes coralinos de Nayarit. Cienc. Mar. 23: 227-248. [ Links ]
Dodge RE, Lang JC. 1983. Environmental correlates of hermatypic coral (Montastrea annularis) growth on the East Flower Gardens Bank, northwest Gulf of Mexico. Limnol. Oceanogr. 28: 228-240. [ Links ]
Dodge RE, Brass GW. 1984. Skeletal extension, density and calcification of the reef coral Montastrea annularis: St. Croix, U.S. Virgin Islands. Bull. Mar. Sci. 34: 288-307. [ Links ]
Furla P, Galgani I, Durand I, Allemand D. 2000. Sources and mechanisms of inorganic carbon transport for coral calcification and photosynthesis. J. Exp. Biol. 203: 3445-3457. [ Links ]
Gilmour J. 1999. Experimental investigation into the effects of suspended sediment on fertilisation, larval survival and settlement in a scleractinian coral. Mar. Biol. 135: 451-462. [ Links ]
Hodgson G. 1990. Sediment and the settlement of larvae of the reef coral Pocillopora damicornis. Coral Reefs 9: 41-43. [ Links ]
Horta-Puga G. 2003. Condition of selected reef sites in the Veracruz Reef System (stony corals and algae). Atoll Res. Bull. 496: 360-369. [ Links ]
Horta-Puga G. 2007. Environmental impacts. In: Tunnell JW, Chávez EA, Withers K (eds.), Coral Reefs of the Southern Gulf of Mexico. Texas A & M Press, pp. 126-141. [ Links ]
Horta-Puga G, Vargas-Hernández JM, Carricart-Ganivet JP. 2007. Reef Corals In: Tunnell JW, Chávez EA, Withers K (eds.), Coral Reefs of the Southern Gulf of Mexico. Texas A&M Press, pp. 95-101. [ Links ]
Hubbard J, Pocock Y. 1972. Sediment rejection by recent scleractinian corals: A key to palaeoenvironmental reconstruction. Geol. Rundsch. 61: 598-626. [ Links ]
Lasker HR. 1980. Sediment rejection by reef corals: The roles of behavior and morphology in Montastrea cavernosa (Linnaeus). J. Exp. Mar. Biol. Ecol. 47: 77-87. [ Links ]
Lough J, Barnes DJ. 1997. Several centuries of variation in skeletal extension, density and calcification in massive Porites colonies from the Great Barrier Reef: A proxy for seawater temperature and a background of variability against which to identify unnatural change. J. Exp. Mar. Biol. Ecol. 211: 29-67. [ Links ]
Lough J, Barnes DJ. 2000. Environmental controls on growth of the massive coral Porites. J. Exp. Mar. Biol. Ecol. 245: 225-243. [ Links ]
Medina-Rosas P, Carriquiry JD, Cupul-Magaña AL. 2005. Reclutamiento de Porites (Scleractinia) sobre sustrato artificial en arrecifes afectados por El Niño 1997-98 en Bahía Banderas, Pacífico mexicano. Cienc. Mar. 31: 103-109. [ Links ]
Morelock J, Koenig KJ. 1967. Terrigeneous sedimentation in a shallow water coral reef environment. J. Sediment. Petrol. 37: 1001-100. [ Links ]
Nugues MN, Roberts CM. 2003. Coral mortality and interaction with algae in relation to sedimentation. Coral Reefs 22: 507-516. [ Links ]
Pätzold J, Wefer G. 1992. Bermuda coral reef record of the past 1000 years. Fourth International Conference on Paleoceanography, Kiel, pp. 224-225. [ Links ]
Pérez-Vivar TL, Reyes-Bonilla H, Padilla C. 2006. Corales pétreos (Scleractinia) de las Isla Marías, Pacífico de México. Cienc. Mar. 32: 259-270. [ Links ]
Philipp E, Fabricius K. 2003. Photophysiological stress in scleractinian corals in response to short-term sedimentation. J. Exp. Mar. Biol. Ecol. 287: 57-78. [ Links ]
Rogers CS. 1990. Responses to coral reefs and reef organisms to sedimentation. Mar. Ecol. Prog. Ser. 62: 185-202. [ Links ]
Smith TM, Reynolds RW. 2004. Improved extended reconstruction of SST (1854-1997). Jour. Climate 17: 2466-2477. [ Links ]
Torres JL, Morelock J. 2002. Effect of terrigenous sediment influx on coral cover and linear extension rates of three Caribbean massive coral species. Caribb. J. Sci. 38: 222-229. [ Links ]
Tunnell JW. 1988. Regional comparison of southwestern Gulf of Mexico to Caribbean Sea coral reefs. Proc. 6th Int. Coral Reef Symp. 3: 303-308. [ Links ]
Villaescusa JA, Carriquiry JD. 2004. Calibración de los paleotermómetros de Sr/Ca y Mg/Ca en el coral Porites sp. de Isla San Benedicto, Archipiélago Revillagigedo, México. Cienc. Mar. 30: 603-618. [ Links ]
Weber JN, White EW. 1977. Caribbean reef corals Montastrea annularis and Montastrea cavernosa: Long-term growth data as determined by skeletal X-radiography. In: Frost SH (ed.), Reefs and Related Carbonates: Ecology and Sedimentation. Am. Assoc. Pet. Geol. Stud. Geol. 4: 171-179. [ Links ]
Wesseling I, Uychiaoco AJ, Aliño PM, Aurin T, Vermaat JE. 1999. Damage and recovery of four Philippine corals from short-term sediment burial. Mar. Ecol. Prog. Ser. 176: 11-15. [ Links ]














