Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.34 no.1 Ensenada mar. 2008
Artículos
Fracción de nanoplancton en la estructura del fitoplancton en el sur del Golfo de México (abril de 2000)
Nanoplankton fraction in the phytoplankton structure in the southern Gulf of Mexico (April 2000)
DU Hernández-Becerril1, JA García-Reséndiz2, DA Salas-de León1*, MA Monreal-Gómez1, M Signoret-Poillon3, J Aldeco-Ramírez2,3
1 Instituto de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México (UNAM), Apartado postal 70-305, México DF 04510, Mexico. * E-mail: salas@mar.icmyl.unam.mx
2 Posgrado en Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México (UNAM), Apartado postal 70-305, México DF 04510, Mexico.
3 Departamento El Hombre y su Ambiente, Universidad Autónoma Metropolitana-Xochimilco, México, DF 04960, México.
Recibido en mayo de 2007.
Aceptado en febrero de 2008.
Resumen
Se estudió la fracción del fitoplancton que corresponde al nanoplancton y sus posibles relaciones con las condiciones hidrográficas en el sur del Golfo del México durante un crucero oceanográfico realizado en abril de 2000. Se analizaron datos hidrográficos y muestras de fitoplancton. La composición de las especies del fitoplancton mostró heterogeneidad entre las estaciones. Se encontraron 180 especies: 114 diatomeas, 32 dinoflagelados, 32 cocolitofóridos y dos silicoflagelados. Los índices de diversidad fueron variables (0.96-5.12 bits ind-1). Los cocolitofóridos y las diatomeas nanoplanctónicas fueron los grupos dominantes. La abundancia de células fue de baja a ligeramente alta, yendo de 5.3 × 103 a 1.4 × 105 cél L-1. Las especies más abundantes, de las dominantes fueron las formas nanoplanctónicas: dos cocolitoforidos, Emiliania huxleyi y Gephyrocapsa oceanica, las diatomeas pennadas, Nitzschia bicapitata, N. bifurcata y N. leehyi, y las especies de diatomeas céntricas Thalassiosira. La alta abundancia subsuperficial de cocolitoforidos en dos estaciones estuvo relacionada con el frente térmico de la pluma del sistema de ríos Grijalva-Usumacinta.
Palabras clave: nanoplancton, clorofila a, cocolitofóridos, diatomeas, Golfo de México.
Abstract
Phytoplankton, especially the nanoplankton fraction, and its possible relationships with the hydrographic conditions in the southern Gulf of Mexico were studied during an oceanographic cruise in April 2000. Hydrographic data and phytoplankton were analyzed. Phytoplankton species composition showed heterogeneity among stations. A total of 180 species were found: 114 diatoms, 32 dinoflagellates, 32 coccolithophores, and 2 silicoflagellates. Diversity indices were variable (0.96-5.12 bits ind-1). Phytoplankton was numerically dominated by coccolithophores or nanoplanktonic diatoms. Cell abundance was low to moderately high, ranging from 5.3 × 103 to 1.4 × 105 cells L-1. The most abundant, dominant species were nanoplanktonic forms: two coccolithophores, Emiliania huxleyi and Gephyrocapsa oceánica; the pennate diatoms Nitzschia bicapitata, N. bifurcata and N. leehyi; and centric diatoms of the genus Thalassiosira. The high subsurface abundance of coccolithophores at two stations was related to a thermal front in the Grijalva-Usumacinta river system.
Key words: nanoplankton, chlorophyll a, coccolithophores, diatoms, Gulf of Mexico.
Introducción
El sur del Golfo de México es altamente productivo, con gran cantidad de pesquerías comerciales y una importante industria petrolera, lo que hace de ésta una región económicamente importante. En esta área la plataforma continental es extensa e incluye parte de la plataforma de la Península de Yucatán. La zona costera contiene lagunas, humedales e islas que son importantes hábitats para la vida marina, con una gran diversidad biológica.
La Bahía de Campeche (fig. 1) se caracteriza por un giro ciclónico que se forma y deriva hacia el oeste, facilitando el transporte y distribución de organismos planctónicos. Los giros promueven el transporte de larvas de las áreas oceánicas hacia las costeras y viceversa. La distribución estacional de larvas de peces es influenciada por la posición del giro. La distribución de biomasa y la densidad de larvas de peces también son influenciadas por los frentes costeros (Salas-de León et al. 1998, Sánchez-Iturbe et al. 2006) que se forman por las descargas de los principales ríos en el sur del golfo: el sistema Grijalva-Usumacinta y el Río Coatzacoalcos (fig. 1). En abril las descargas de estos ríos son bajas (Czitrom et al. 1986). El sistema de ríos Grijalva-Usumacinta es el responsable de las mayores descargas en el sur del Golfo de México, representando 30% del agua dulce descargada (Ortiz-Zamora et al. 2002), y su influencia genera importantes frentes costeros (Czitrom et al. 1986, Monreal-Gómez et al. 1992).

Se ha observado un importante gradiente térmico subsuperficial sobre el borde de la plataforma continental del Banco de Campeche el cual corresponde a un domo de bajo contenido de oxígeno (menor a 90% de saturación) cercano a la base de la capa de mezcla y, un par anticiclónciclón sobre el Cañón de Campeche (Salas-de León et al. 2004). La presencia del domo y de la frontera del par anticiclónciclón ejerce un efecto importante sobre el contenido de clorofila a y de materia particulada suspendida (Salas-de León et al. 2004), y en la abundancia del fitoplancton (López-Calderón et al. 2006).
En el sur del Golfo de México se han realizado varias investigaciones sobre aspectos ecológicos del fitoplancton, incluyendo datos sobre productividad primaria (Cruz 1971; Hulburt y Corwin 1972; Kabanova y López-Baluja 1973; Santoyo y Signoret 1973, 1975; Zernova 1974; Furnas y Smayda 1987; Licea y Santoyo 1991; Licea y Luna 1999; Okolodkov 2003; Signoret et al. 1998), sobre florística y taxonomía de ciertos géneros o grupos del fitoplancton (Moreno-Ruiz et al. 1993, Licea 1994, Moreno y Licea 1994, Hernández-Becerril 1998, Hernández-Becerril y Flores 1998, Licea et al. 2004). Licea y Luna (1999) reportaron los valores más altos de biomasa durante la época de lluvias (julio a agosto), con abundancias máximas de 6.3 × 106 cél L-1, y los valores más bajos durante el invierno (noviembre a diciembre); sin embargo, no dan detalles de la composición de las especies.
La mayoría de los estudios se han enfocado en las diatomeas y los dinoflagelados, ya que éstos han sido tradicionalmente considerados como los grupos que más contribuyen a la biomasa y productividad en el golfo (Balech 1967, Saunders y Glenn 1969, Norris y Berner 1970, Steidinger y Williams 1970, Licea et al. 2004). Hulburt y Corwin (1972) encontraron que la flora planctónica en el sur del Golfo de México es dominada por los cocolitofóridos Emiliania (Coccolithus) huxleyi y Gephyrocapsa oceanica y las diatomeas Hemiaulus indicus, Pseudo-nitzschia (Nitzschia) delicatissima. Gaarder y Hasle (1971) describieron los cocolitofóridos a lo largo del golfo, pero pocas publicaciones han incluido otros grupos como los fitoflagelados, los cuales han sido considerados importantes en otras regiones del mundo.
El propósito de este estudio fue describir la estructura de la comunidad fitoplanctónica, especialmente la fracción del nano-plancton, su relación con la condiciones hidrográficas del sur del Golfo de México en tres zonas diferentes, considerando solamente la fracción preservable del fitoplancton, incluyendo las diatomeas, principalmente los dinoflagelados tecados, los silicoflagelados y los cocolitofóridos.
Material y métodos
Los datos hidrográficos y las muestras de fitoplancton fueron obtenidos durante el crucero oceanográfico PROMEBIO III (Procesos Oceánicos y Mecanismos de Producción Biológica en el sur del Golfo de México), a bordo del B/O Justo Sierra de la UNAM, en el sur del Golfo de México, del 6 al 19 de abril de 2000 (fig. 1). Se registró la conductividad, la temperatura y la presión con un CTD, y se calcularon la salinidad y la densidad (σt) usando los algoritmos de la UNESCO (Fofonoff y Millard 1983). Las muestras de salinidad fueron corroboradas con un salinómetro de inducción.
Las muestras de fitoplancton fueron tomadas con botellas en nueve estaciones de tres regiones: tres estaciones en la zona costera próxima a la desembocadura del Río Coatzacoalcos (estaciones 7, 15 y 22), tres cerca de los ríos Grijalva-Usumacinta (estaciones 37, 44 y 53) y tres en la zona oceánica sobre el Cañón de Campeche (estaciones 112, 118 y 126) (fig. 1), en tres profundidades, tratando de tener muestras de fitoplancton cerca del máximo profundo de clorofila (DCM). Las muestras de fitoplancton (aproximadamente 4 L) fueron filtradas a través de membranas de filtros Millipore (0.45 μm), con un diámetro de 47 mm, usando una bomba de vacío (<100 mm Hg). Los filtros fueron enjuagados inmediatamente con agua destilada (10-20 mL, pH 7) para eliminar la sal del agua de mar, secados a temperatura ambiente y guardados en cajas de Petri (Winter et al. 1999, Bollmann et al. 2002).
Se cortaron partes pequeñas de los filtros (aproximadamente 1 cm2), se montaron en portaobjetos y se añadió aceite de inmersión para aclarar el filtro; después fueron cubiertos y se observaron en microscopio de luz (LM), usando campo brillante y amplificación total de ×600 o ×1250, para contar e identificar las especies, respectivamente (Bollmann et al. 2002). La identificación y el conteo preliminar de especies se hicieron usando LM y la estimación del número de células por litro, se realizó mediante datos como el número de organismos contados, las áreas contadas y filtradas y el volumen filtrado, con un límite de detección entre 300 y 3000 cél L-1 (Bollmann et al. 2002). Para confirmar la identificación de las especies se realizaron observaciones con microscopio electrónico de barrido (SEM) usando pequeñas piezas de filtro tratadas convencionalmente para SEM (Bollmann et al. 2002). Se encontraron muy pocas células colapsadas (por efecto del cambio de pH o la bomba de vacío). Todas las observaciones y conteos fueron hechos durante el primer año de la colecta.
Se estimó la densidad del total de células de fitoplancton y se identificaron las especies/grupos, i.e. diatomeas, dinoflagelados tecados, cocolitofóridos y silicoflagelados. Se calculó el índice de diversidad de Shannon-Wiener para cada muestra, por especie y proporción (diversidad de especies). Se realizó un análisis de conglomerados (cluster) con el fin de analizar la similitud entre estaciones. Los resultados, que incluyen parámetros ambientales que afectan la población algal, fueron transformados mediante su raíz cuadrada para evitar el efecto de los valores extremos. El análisis de conglomerados se efectuó usando el paquete de programas para computadora Plymouth Routines in Multivariate Ecological Research (PRIMER 6), el cual permite realizar la transformación y estandarización de los datos de forma automática; una vez que se calcula la matriz de los coeficientes de correlación del producto de los momentos se efectúa el análisis de conglomerados.
Resultados
Características físicas
La temperatura superficial cerca del sistema fluvial Grijalva-Usumacinta estuvo entre 25.75°C y 27.75°C, decreciendo de la costa hacia el mar (fig. 2a). Se observó un débil frente térmico al oeste de la boca de este sistema. La salinidad superficial varió de 36 a 37, incrementándose hacia la costa (fig. 2b); la salinidad máxima estuvo asociada con una gran evaporación (Monreal-Gómez et al. 1992). En este estudio, la salinidad superficial no reflejó la pluma fluvial ni el frente halino costero reportado previamente como una característica de la región (Monreal-Gómez et al. 1992). Esta zona costera muestra altas salinidades (>36), y no se detectó una frontera bien definida entre las aguas de la descarga de los ríos y el agua oceánica como la reportada para abril de 1984 por Czitrom et al. (1986). La distribución de sigma-t mostró lentes de baja densidad fuera de la costa (fig. 2c) y un débil frente local con aguas de la región del este. En la zona del Río Coatzacoalcos, la temperatura superficial varió de 25.25°C a 26.50°C, incrementándose hacia la costa (fig. 2a), y la salinidad se observó entre 35.80 y 36.20, con valores bajos cerca de la boca del río (fig. 2b). La densidad osciló entre 23.5 y 24.2 kg m-3, distribuida de manera similar a la temperatura (fig. 2c). En la zona del Cañón de Campeche, la temperatura, la salinidad y la densidad superficial permanecieron muy homogéneas, con valores alrededor de 26°C, 36.2 y 24 kg m-3, respectivamente, por lo que no se muestran los gráficos correspondientes. La capa de mezcla se observó hasta una profundidad de ~35 m; abajo de esta profundidad, a 40 m, se observó un frente térmico horizontal.
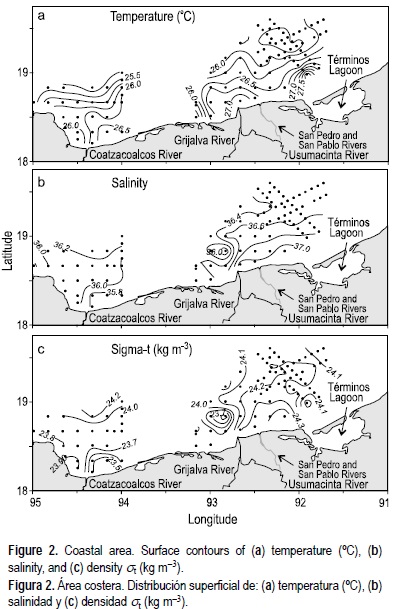
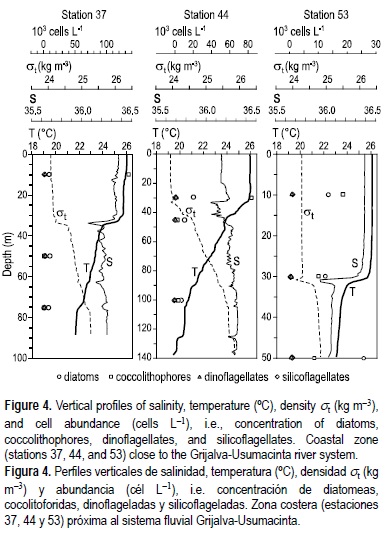
En el periodo de investigación de este estudio, que corresponde al principio de la primavera, los perfiles verticales muestran una estratificación halina débil debido a la turbulencia causada por los fuertes vientos de invierno (Salas-de León et al. 2004) (figs. 3-5)(4). La termoclina estacional se presenta de la costa hacia el mar en la zona próxima al Cañón de Campeche (fig. 5). La columna de agua mostró tres patrones: (1) estación somera (estación 7, ~50 m de profundidad), muy próxima a la costa con perfiles verticales de temperatura y salinidad muy uniformes, sin termoclina, indicando un alto grado de mezcla; (2) estaciones costeras (estaciones 15, 22, 37, 44, y 53) con termoclina débil entre 30 y 35 m; y (3) estaciones oceánicas (estaciones 112, 118 y 126) con termoclina entre 35 y 45 m (figs. 3-5)(4).


Estructura del fitoplancton
Se identificaron 180 especies: 114 de diatomeas, 32 de dinoflagelados (la mayoría de formas tecadas), 32 de cocolitofóridos y dos de silicoflagelados (tabla 1). Una revisión rápida de la comunidad muestra una relativa alta diversidad y abundancia de las formas del nanoplancton, principalmente de cocolitofóridos y diatomeas pennadas y céntricas.
El fitoplancton estuvo numéricamente dominado por cocolitofóridos y diatomeas, con densidades de células de bajas a relativamente altas, de 5.3 × 103 a 1.4 × 105 cél L-1 (tabla 2). No se encontraron diferencias significativas en las abundancia entre la zona costera y la oceánica; sin embargo, se encontraron las más altas densidades en dos muestras subsuperficiales, ambas en la zona costera (estaciones 37 a 10 m y 44 a 30 m), conteniendo cocolitofóridos que representaron 85% de la abundancia total (tabla 2).
Las especies dominantes en términos numéricos (tabla 2) fueron dos cocolitofóridos, Emiliania huxleyi y Gephyrocapsa oceanica; las diatomeas pennadas, Nitzschia bicapitata, N. bifurcata, N. leehyi, y las diatomeas céntricas, Thalassiosira spp., todas diatomeas de tamaño pequeño (<20 μm). Los dinoflagelados tecados y los silicoflagelados fueron escasos. En la estación 53 fue importante la abundancia de la diatomea béntica Psammodictyon panduriforme. Emiliania huxleyi y N. bifurcata se encontraron en todas las muestras, excepto en la estación 37 a 50 m de profundidad.
Los índices de diversidad fueron muy heterogéneos, con valores de 0.96 a 5.12 bits ind-1. El valor más bajo (0.96), que se presentó en la estación 37 a 10 m (tabla 2), coincidió con un bajo número de especies y uno alto de células, siendo la especie dominante Emiliania huxleyi. Por el contrario, el valor más alto (5.12) coincidió con el número más alto de especies (47) y un número moderado de células, en la estación 22 a 100 m (tabla 2); muchas especies de diatomeas ticoplanctónicas contribuyeron significativamente en el gran número de especies en esta estación.
La distribución vertical de fitoplancton fue difícil de establecer, ya que la profundidad de las muestras fue diferente en la mayoría de las estaciones. Sin embargo, en la estación poco profunda (7), con una columna de agua bien mezclada, el fitoplancton mostró una distribución homogénea, especialmente las diatomeas. En la estación 44 el máximo en la densidad de células coincidió con la profundidad de la termoclina (fig. 4).
Asociación entre estaciones
Mediante el análisis de conglomerados se identificaron tres regiones: costera, de plataforma y oceánica (fig. 6). La estación 7 apareció aislada, posiblemente por que ésta es la estación más somera con una composición de especies ligeramente diferente. Sobre la plataforma continental las estaciones formaron un grupo: las estaciones 37 y 44 fueron muy cercanas en el análisis de conglomerados, lo que indica una composición de especies muy similar, probablemente debido a la gran abundancia de la fracción de cocolitofóridos en estas estaciones (tabla 2, fig. 6). Las estaciones 118 y 126, sobre el Cañón de Campeche, también resultaron muy cercanas debido probablemente a la similitud de sus grupos dominantes.
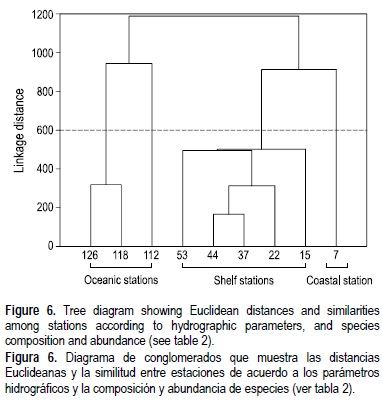
La temperatura resultó el factor más importante en la varianza del número de especies, mientras que la salinidad fue el factor que más influyó en la varianza de los grupos dominantes.
Discusión
Al principio de abril de 2000, el flujo de la descarga de los ríos Coatzacoalcos y Grijalva-Usumacinta fue baja (Riverón-Enzástiga 2008). Durante este mes, los vientos característicos provenientes del norte en la Bahía de Campeche, confinaron la pluma de los ríos hacia la costa. Debido a la reducida descarga, la pluma del Coatzacoalcos se constriñó a la zona costera cercana a la boca, resultando en un ambiente oceánico (Salas-de León et al. 1998). La zona costera próxima al sistema Grijalva-Usumacinta no mostró una frontera muy marcada entre la descarga de los ríos y el agua oceánica, como la reportada en varios trabajos anteriores (Czitrom et al. 1986, Monreal-Gómez et al. 1992). En la zona del Cañón de Campeche la capa superficial permaneció muy homogénea. Los altos valores de salinidad en las tres zonas indican condiciones oceánicas.
La abundancia de fitoplancton observada durante este estudio no fue particularmente alta; la densidad más alta fue de 1.4 × 105 cél L-1. Licea y Luna (1999) reportan valores mayores (4.14 × 105 cél L-1) durante la misma estación (febrero a marzo) frente a los ríos Coatzacoalcos y Grijalva-Usumacinta; mientras que en la estación de lluvias (julio a agosto) los valores máximos reportados por estos autores son de 6.3 × 106 cél L-1. El número de especies y el índice de diversidad mostraron una fuerte relación, especialmente en la estación 22 a 100 m, donde coincidieron los valores máximos del número de especies y del índice de diversidad (tabla 2). Los valores de diversidad de especies fueron similares a los reportados por Licea y Santoyo (1991) para la región central de la Bahía de Campeche.
Las especies sobresalientes: Emiliania huxleyi, Nitzschia bicapitata y Thalassionema nitzschioides, son consideradas cosmopolitas. Las asociaciones de especies costeras encontradas en este estudio pueden ser indicadoras de aguas de surgencia maduras (Mitchell-Innes y Winter 1987), las cuales fueron en su mayoría especies nanoplanctónicas: cocolitofóridos y diatomeas. Esto puede interpretarse también, en términos de sucesión de comunidades de fitoplancton, como parte del estadio 2, donde una mezcla entre asociaciones de cocolitofóridos con diatomeas de pequeño y mediano tamaño contribuye de forma importante a la comunidad (Margalef 1958, 1974; Smayda 1980, Reynolds 1995). Consideramos que el patrón 'normal' de sucesión puede modificarse al ocurrir eventos oceanográficos o climáticos locales importantes (i.e. frentes, turbulencia, vientos fuertes, lluvias intensas, etc.).
La asociación entre Emiliania huxleyi y Gephyrocapsa oceanica fue reportada en el Golfo de México por Hulburt y Corwin (1072), y la asociación entre estos dos cocolitofóridos y las diatomeas Nitzschia bicapitata/N. bifurcata/N. leehyi también fue reportada en aguas del Pacífico Mexicano hacia el final del evento de El Niño de 1997-1998 (Hernández-Becerril et al., 2007) y en el Pacífico ecuatorial (Lee y Fryxell 1996, Fryxell 2000). En algunas estaciones (i.e. muestras tomadas muy cerca del fondo) la contribución de las diatomeas no planctónicas tales como Psammodictyon panduriforme fue considerable, modificando significativamente las asociaciones de especies (estación 22 a 50 m y estación 53 a 100 m) (tabla 2).
Se definieron diferentes patrones en la columna de agua (i.e. presencia y profundidad de la termoclina) y, consecuentemente, el fitoplancton mostró diferencias en la estructura de la comunidad, especialmente en la abundancia y composición de especies. No se encontraron patrones generales en la distribución vertical de la comunidad del fitoplancton tales como máximo de células de fitoplancton asociados a la termoclina principal, distribución vertical más o menos homogénea, o la presencia de un máximo subsuperficial (10 m) de densidad de células, lo que resulta contrario al patrón horizontal en donde las máximas abundancias estuvieron asociadas al frente térmico. Sin embargo, se pudieron observar algunas tendencias en la distribución vertical de ciertos grupos taxonómicos. Los cocolitofóridos fueron más abundante y también dominaron numéricamente en algunas capas subsuperficiales (i.e. 40-60 m; estaciones 15, 22, 112). De hecho, el número de éstas aumenta cerca de la termoclina (estaciones 15, 22; tabla 2 y figs. 3, 4 y 5), igual a lo que ocurre en otras áreas del mundo (i.e. Golfo de California; Hernández-Becerril 1987). En general, se considera que el número de los cocolitofóridos aumenta de la capa subsuperficial hacia las aguas profundas (Margalef 1978, Brand 1994, Balch 2004). En este estudio las excepciones fueron las estaciones costeras 37 y 44, donde dos especies de este grupo, Emiliania huxleyi y Gephyrocapsa oceanica, tuvieron altas densidades a 10 y 30 m de profundidad, respectivamente, y contribuyeron numéricamente al fitoplancton con más del 75% (tabla 2). Las densidades de cocolitofóridos observadas no pueden ser consideradas como resultado de florecimientos algales, ya que de acuerdo con Tyrrell y Merico (2004), para ello deberían ser mayores a 1 × 106 cél L-1, tal y como ocurre en otras regiones del mundo (Brown y Yoder 1994, Balch 2004); sin embargo, estos florecimientos todavía no han sido reportados en el sur del Golfo de México. En la estación 44 a 45 m de profundidad, la densidad de fitoplancton disminuye considerablemente y dominaron las diatomeas (tabla 2 y fig. 4).
En general, en áreas costeras con aguas turbulentas y ricas en nutrientes, las diatomeas han sido tradicionalmente consideradas como el grupo dominante (tanto en número como en densidad). En este estudio, éstas estuvieron representadas por las formas nanoplanctónicas pennadas y céntricas.
La fracción del nanoplancton (cocolitofóridos y otras nanoalgas pequeñas) usualmente ha sido subestimada para el sur del Golfo de México. Varios estudios consideran tradicionalmente a la fracción del microplancton, especialmente las diatomeas y los dinoflagelados grandes (Balech 1967, Licea 1994, Hernández-Becerril y Flores 1998, Licea et al. 2004), como las que más contribuyen en la producción primaria.
Licea y Luna (1999) reportan altos valores de clorofila a (1.6 mg m-3) para invierno (febrero-marzo) en el frente del sistema fluvial Grijalva-Usumacinta a 20 m de profundidad, coincidiendo con el área y la profundidad en donde se encontraron altas densidades de cocolitofóridos en este trabajo.
El patrón de la circulación predominante en la zona costera fue anticiclónico, mientras que en la región del Cañón de Campeche fue ciclónico (http://www.ccar.colorado.edu/pub/gom/nrt/gif/). Las fronteras o interfaces entre los giros ciclónicos y anticiclónicos y las regiones frontales promueven la producción primaria mediante el aporte de nutrientes (Biggs y Müller-Karger 1994, Toner et al. 2003, Barocio-León et al. 2007). Adicionalmente, se ha propuesto que la alta producción fitoplanctonica sobre la plataforma continental es promovida por la pluma de los ríos en el sur del Golfo de México, con cambios en la estructura fitoplanctónica (Licea y Luna 1999).
En este estudio se encontró que el nanoplancton, especialmente los cocolitofóridos, juegan un papel importante en la estructura de las comunidades del fitoplancton en el sur del Golfo de México durante la primavera. La estructura de la comunidad del fitoplancton estuvo relacionada con las condiciones oceanográficas. Las mayores abundancias de fitoplancton, principalmente dominadas por dos especies de cocolitofóridos, estuvieron asociadas a un frente térmico. La diferencia en las condiciones oceanográficas entre las zonas costeras, de plataforma y oceánica, se reflejó en la estructura del fitoplancton, especialmente en la composición de las especies. Quedan preguntas sin responder en relación a cómo los procesos hidrodinámicos controlan la estructura de la comunidad del fitoplancton en el sur del Golfo de México a lo largo del año. En trabajos futuros se debe hacer énfasis en el estudio de las sucesiones y estacionalidad del fitoplancton, especialmente del nanoplancton y el picoplancton en el área de estudio.
Agradecimientos
Se agradece el apoyo recibido por el Consejo Nacional de Ciencia y Tecnología de México (CONACYT) mediante el proyecto G27777-B. JA García-Reséndiz recibió una beca de este proyecto. Se agradece el apoyo del capitán y la tripulación del B/O Justo Sierra de la UNAM durante la campaña oceanográfica PROMEBIO III, y a Jorge Castro por el apoyo en la preparación del material gráfico. También se agradecen los comentarios y sugerencias de los revisores, los cuales mejoraron sustancialmente este artículo.
Referencias
Balch WM. 2004. Re-evaluation of the physiological ecology of coccolithophores. In: Thierstein H, Young J (eds.), Coccolithophores: From Molecular Processes to Global Impact. Springer-Verlag, Berlin, pp. 65-190. [ Links ]
Balech E. 1967. Dinoflagelados nuevos o interesantes del Golfo de México y Caribe. Rev. Mus. Argent. Cienc. Nat. Bernardino Rivadavia (Hidrobiol.) 2: 77-144. [ Links ]
Barocio-León OA, Millán-Núñez R, Santamaría-del-Ángel E, González-Silveira A. 2007. Phytoplankton primary productivity in the euphotic zone of the California Current System estimated from CZCS imagery. Cienc. Mar. 33: 59-72. [ Links ]
Biggs DC, Müller-Karger FE. 1994. Ship and satellite observations of chlorophyll stocks in interacting cyclonic-anticyclonic eddy pairs in the western Gulf of Mexico. J. Geophys. Res. 99: 7371-7384. [ Links ]
Bollmann J, Cortés MY, Haidar AT, Brabec B, Close A, Hofmann R, Palma S, Tupas L, Thierstein HR. 2002. Techniques for quantitative analyses of calcareous marine phytoplankton. Mar. Micropaleontol. 44: 163-185. [ Links ]
Brand LE. 1994. Physiological ecology of marine coccolithophores. In: Winter A, Siesser WG (eds.), Coccolithophores. Cambridge Univ. Press, New York, pp. 39-49. [ Links ]
Brown CW, Yoder JA. 1994. Coccolithophorid blooms in the global ocean. J. Geophys. Res. 99: 7467-7482. [ Links ]
Cruz de la A. 1971. Estudios de plancton en el Banco de Campeche. In: Coloquio sobre Investigaciones y Recursos del Mar Caribe y Regiones Adyacentes. UNESCO, Paris, pp. 375-383. [ Links ]
Czitrom SPR, Ruiz F, Alatorre MA, Padilla AR. 1986. Preliminary study of a front in the Bay of Campeche, Mexico. In: Nihoul JCJ (ed.), Marine Interfaces Ecohydrodynamics. Elsevier, Amsterdam, pp. 301-311. [ Links ]
Fofonoff NP, Millard Jr RC. 1983. Algorithms for computation of fundamental properties of seawater. UNESCO Tech. Pap. Mar. Sci. 44: 53 pp. [ Links ]
Fryxell GA. 2000. Nitzschia bicapitata (Bacillariophyceae) and related taxa from oceanic aggregations. Diat. Res. 15: 43-73. [ Links ]
Furnas MJ, Smayda TJ. 1987. Inputs of subthermocline waters and nitrate onto the Campeche Bank. Cont. Shelf Res. 7: 161-175. [ Links ]
Gaarder KR, Hasle GR. 1971. Coccolithophorids of the Gulf of Mexico. Bull. Mar. Sci. 21: 519-544. [ Links ]
Hernández-Becerril DU. 1987. Vertical distribution of phytoplankton in the central and northern part of the Gulf of California (June, 1982). Mar. Ecol. 8: 237-251. [ Links ]
Hernández-Becerril DU. 1998. Morphological study of the marine planktonic diatom Chaetoceros okamurai (Chaetocerotales, Bacillariophyceae) from the Gulf of Mexico. Phycol. Res. 46: 1115. [ Links ]
Hernández-Becerril DU, Flores C. 1998. Species of the diatom genus Chaetoceros (Bacillariophyceae) in the plankton from the southern Gulf of Mexico. Bot. Mar. 41: 505-519. [ Links ]
Hernández-Becerril DU, Bravo-Sierra E, Aké-Castillo JA. 2007. Phytoplankton on the western coasts of Baja California in two different seasons in 1998. Sci. Mar. 71: 735-743. [ Links ]
Hulburt EM, Corwin N. 1972. A note on the phytoplankton distribution in the offshore water of the eastern and central Gulf of Mexico. Caribb. J. Sci. 12: 29-38. [ Links ]
Kabanova Yu, López-Baluja L. 1973. Producción primaria en la región meridional del Golfo de México y cerca de la costa noroccidental de Cuba. Academia de Ciencias de Cuba, Instituto de Oceanología, Ser. Oceanol. 16: 1-34. [ Links ]
Lee HY, Fryxell GA. 1996. Bicapitate Nitzschia species: Abundant nanoplankton in aggregates during November-December (1992) in the equatorial Pacific. J. Plankton Res. 18: 1271-1294. [ Links ]
Licea S. 1994. Thalassiosira species from the southern Gulf of Mexico. Proc. 11th Int. Diatom Symp. Mem. California Acad. Sci. 17: 311-335. [ Links ]
Licea S, Santoyo H. 1991. Algunas características ecológicas del fitoplancton de la región central de la Bahía de Campeche. An. Inst. Cienc. Mar Limnol. Univ. Nac. Autón. Méx. 18: 157-167. [ Links ]
Licea S, Luna R. 1999. Spatio-temporal variations of phytoplankton on the continental margin in the SW Gulf of Mexico. Rev. Soc. Mex. Hist. Nat. 49: 83-99. [ Links ]
Licea S, Zamudio ME, Luna R, Soto J. 2004. Free-living dinoflagellates in the southern Gulf of Mexico: Report of data (1979-2002). Phycol. Res. 52: 419-428. [ Links ]
López-Calderón J, Manzo-Monroy H, Santamaría-del-Ángel E, Castro R, González-Silvera A, Millán-Núñez R. 2006. Mesoescale variability of the Mexican Tropical Pacific using TOPEX and SeaWiFS data. Cienc. Mar. 32: 539-549. [ Links ]
Margalef R. 1958. Temporal succession and spatial heterogeneity in phytoplankton. In: Buzzati-Traverso AA (ed.), Perspectives in Marine Biology. Univ. California Press, Berkeley, pp. 323-349. [ Links ]
Margalef R. 1974. Ecología. Omega, Barcelona, 951 pp. [ Links ]
Margalef R. 1978. Life-forms of phytoplankton as survival alternatives in an unstable environment. Oceanol. Acta. 1: 493-509. [ Links ]
Mitchell-Innes BA, Winter A. 1987. Coccolithophores: A major phytoplankton component in mature upwelled waters off Cape Peninsula, South Africa in March, 1983. Mar. Biol. 95: 25-30. [ Links ]
Monreal-Gómez MA, Salas-de León DA, Padilla-Pilotze AR, Alatorre-Mendieta MA. 1992. Hydrography and estimation of density currents in the southern part of the Bay of Campeche, Mexico. Cienc. Mar. 18(4): 115-133. [ Links ]
Moreno-Ruiz JL, Soto JP, Zamudio ME, Hernández-Becerril DU, Licea S. 1993. Morphology and taxonomy of Chaetoceros diversus Cleve (Bacillariophyceae), with reference to material from the Southern Gulf of Mexico. Diat. Res. 8: 419-428. [ Links ]
Moreno JL, Licea S. 1994. Morphology of three related Coscinodiscus Ehrenberg taxa from the southern Gulf of Mexico and coastal North Pacific of Mexico. Proc. 11th Int. Diatom Symp. Mem. California Acad. Sci. 17: 113-127. [ Links ]
Norris DR, Berner Jr LD. 1970. Thecal morphology of selected species of Dinophysis (Dinoflagellata) from the Gulf of Mexico. Contrib. Mar. Sci. 1: 146-191. [ Links ]
Okolodkov YB. 2003. A review of Russian plankton research in the Gulf of Mexico and the Caribbean in the 1960-1980s. Hidrobiologica 13: 207-221. [ Links ]
Ortiz-Zamora G, Huerta-Díaz MA, Salas-de-León DA, Monreal-Gómez MA. 2002. Degrees of pyritization in the Gulf of Mexico in sediments influenced by the Coatzacoalcos and Grijalva-Usumacinta rivers. Cienc. Mar. 28: 369-379. [ Links ]
Reynolds CS. 1995. Succesional change in the planktonic vegetation: Species, structures, scales. In: Joint I (ed.), Molecular Ecology of Aquatic Microbes. Springer-Verlag, Berlin, pp. 115-132. [ Links ]
Riverón-Enzástiga ML. 2008. Análisis de la variabilidad de las descargas de agua de los principales ríos de la cuenca del Golfo de México. Tesis de licenciatura, Facultad de Ciencias, Universidad Nacional Autónoma de México, 86 pp. [ Links ]
Salas-de León DA, Monreal-Gómez MA, Sanvicente-Añorve L, Flores-Coto C. 1998. Influence de la circulation à long terme sur la répartition des organismes zooplanctoniques dans la Baie de Campeche, Mexique. Oceanol. Acta. 21: 87-93. [ Links ]
Salas-de León DA, Monreal-Gómez MA, Signoret M, Aldeco J. 2004. Anticyclonic-cyclonic eddies and their impact on near-surface chlorophyll stocks and oxygen supersaturation over the Campeche Canyon, Gulf of Mexico. J. Geophys. Res. 109: 1-10. [ Links ]
Sánchez-Iturbe A, Flores-Coto C, Zavala-García F. 2006. Seasonal variation in growth and mortality of larval Syacium gunteri (Piscis: Paralichthyidae) in the southern Gulf of Mexico (1992 and 1993). Cienc. Mar. 32: 83-95. [ Links ]
Santoyo H, Signoret M. 1973. Hidrología y fitoplancton en un transecto de la plataforma continental de la Bahía de Campeche, México (agosto de 1972). Rev. Latinoam. Microbiol. 15: 207-215. [ Links ]
Santoyo H, Signoret M. 1975. Variación nictemeral del fitoplancton en la Bahía de Campeche, México. Rev. Latinoam. Microbiol. 17: 161-167. [ Links ]
Saunders RP, Glenn DA. 1969. Memoirs of the Hourglass Cruises: Diatoms. Fla. Dept. Nat. Resour. Mar. Res. Lab. 1 (Pt. III), 119 pp. [ Links ]
Signoret M, Bulit C, Pérez R. 1998. Patrones de distribución de clorofila a y producción primaria en aguas del Golfo de México y Mar Caribe. Hidrobiológica 8: 81-88. [ Links ]
Smayda T. 1980. Phytoplankton species succession. In: Morris I (ed.), The Physiological Ecology of Phytoplankton. Univ. California Press, Berkeley, pp. 493-570. [ Links ]
Steidinger KA, Williams J. 1970. Memoirs of the Hourglass Cruises: Dinoflagellates. Fla. Dept. Nat. Resour. Mar. Res. Lab. 2 (Pt. III), 251 pp. [ Links ]
Toner M, Kirwan AD, Poje AC, Canta LH, Müller-Karger FE, Jones CK. 2003. Chlorophyll dispersal by eddy-eddy interactions in the Gulf of Mexico. J. Geophys. Res. 108: 3105, 12 pp. [ Links ]
Tyrrell T, Merico A. 2004. Emiliana huxleyi: Bloom observation and the conditions that induce them. In: Thiertein HR, Young JR (eds.), Coccolithophores: From Molecular Process to Global Impact. Springer, Berlin, pp. 75-97. [ Links ]
Winter A, Elbrächter M, Krause G. 1999. Subtropical coccolithophorids in the Weddell Sea. Deep-Sea Res. I 46: 439-449. [ Links ]
Zernova VV. 1974. Distribution of the biomass of phytoplankton in the tropical Atlantic Ocean. Okeanologiya 14: 1070-1076. [ Links ]














