Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.33 no.4 Ensenada dic. 2007
Artículos
Diversidad e historia natural de una comunidad de Lithothamnion muelleri y Sargassum horridum en el Golfo de California
Diversity and natural history of a Lithothamnion muelleri-Sargassum horridum community in the Gulf of California
MS Foster1*, LM McConnico1, L Lundsten1, T Wadsworth1, T Kimball1, LB Brooks1, M Medina-López2, R Riosmena-Rodríguez2, G Hernández-Carmona3, RM Vásquez-Elizondo2, S Johnson1, DL Steller1
1 Moss Landing Marine Laboratories, Moss Landing, CA 95039, USA. * E-mail: foster@mlml.calstate.edu.
2 Universidad Autónoma de Baja California Sur, Carretera al Sur km 5.5, La Paz, BCS, México.
3 Centro Interdisciplinario de Ciencias Marinas, Apartado postal 592, La Paz, BCS, México.
Recibido en noviembre de 2006;
Aceptado en julio de 2007.
Resumen
Se cuantificó la contribución relativa de la forma rodolítica de Lithothamnion muelleri, una especie fundamentales, a la diversidad de macroorganismos en una comunidad también habitada por la macroalga feofita Sargassum horridum, cerca de Cabo Los Machos, en la boca de Bahía Concepción, Baja California Sur, México. La composición y abundancia de algas marinas, invertebrados epibénticos y peces se estimó en marzo y octubre de 2003, mientras que los invertebrados endobiontes de los rodolitos (criptofauna) fueron cuantificados en marzo de 2003. De todos los organismos, los rodolitos y S. horridum tuvieron las mayores coberturas en los 0.5 km2 de fondos de cantos rodados y arena estudiados, de 2 a 8 m de profundidad. Se muestreó un total de 29 especies de algas, 40 taxones de invertebrados bénticos y 33 especies de peces. Como resultado de la pérdida y el reemplazo de taxones, las diversidades de microalgas y peces fueron similares en ambos muestreos, mientras que la de invertebrados disminuyó sin ocurrir reemplazo de marzo a octubre. La cobertura de rodolitos fue similar en ambos muestreos. La cobertura y densidad de S. horridum fue altamente estacional, y la flora no rodolítica varió de abundancia de S. horridum (35% de cobertura) en marzo a abundantes tapetes de algas rojas en octubre (22% de cobertura). Los invertebrados epibénticos más abundantes en marzo fueron el erizo Arbacia incisa, los tunicados y los poliquetos; sin embargo, para octubre, el primero ya no estaba presente. Haemulon maculicauda y Calamus brachysomus fueron los peces más abundantes en ambos muestreos, pero se observaron grandes variaciones temporales especialmente en especies de peces que forman cardúmenes. La densidad de rodolitos en marzo fue de 24 ind m-2, con numerosos individuos >8 cm de diámetro. Quince rodolitos de varias clases de talla contuvieron 114 taxones criptofaunales, con un promedio de 40 taxones/individuo para los rodolitos más grandes. Estos resultados muestran la importancia de los hábitats de rodolitos para la diversidad, las grandes variaciones temporales en algunas comunidades y la excepcional diversidad de esta comunidad subtropical.
Palabras clave: comunidad, Lithothamnion, rodolito, Sargassum, especie fundamental, diversidad.
Abstract
We quantitatively assessed the relative contribution of the rhodolith form of Lithothamnion muelleri, a likely foundation species, to macroorganism diversity in a community also inhabited by the large fucalean Sargassum horridum at a site near Cabo Los Machos at the mouth of Bahía Concepción, Baja California Sur, Mexico. The composition and abundance of seaweeds, epibenthic invertebrates, and fish were estimated in March and October 2003, and invertebrates within rhodoliths (cryptofauna) in March 2003. Rhodoliths and Sargassum horridum had the highest cover of all organisms within the 0.5-km2, 2-8-m-deep cobble-sand site. A total of 29 species of seaweeds, 40 taxa of benthic invertebrates, and 33 species of fish were sampled in transects and quadrats. Macroalgal and fish diversity were similar between sampling times as a result of loss and replacement of taxa, but benthic invertebrate diversity declined without replacement from March to October. Rhodolith cover was similar at both sampling times. The cover and density of S. horridum were highly seasonal, and the non-rhodolith flora changed from abundant S. horridum (35% cover) in March to abundant red algal turf in October (22% cover). The sea urchin Arbacia incisa, tunicates, and polychaetes were the most abundant epibenthic invertebrates in March, but declined by October, the former to zero. Grunts (Haemulon maculicauda) and porgies (Calamus brachysomus) were the most abundant fish at both sampling times, but there were large temporal changes in some other species, especially schooling fishes. Rhodolith density in March was 24 ind m-2, with numerous individuals >8 cm diameter. Fifteen rhodoliths from a range of size classes contained 114 cryptofaunal taxa with an average of 40 taxa/individual in the largest rhodoliths. These results show the importance of rhodolith habitat to diversity, the large temporal changes in some assemblages, and the exceptionally high diversity of this subtropical community.
Key words: community, Lithothamnion, rhodolith, Sargassum, foundation species, diversity.
Introducción
Durante mucho tiempo se ha reconocido que el número de especies (de aquí en adelante referido como la diversidad) incrementa con la complejidad del habitat. Las plantas marinas, especialmente las especies grandes de vida larga y morfología compleja, pueden ser la fuente de esta complejidad. Tales plantas (y animales) han sido llamadas especies fundamentales por el gran efecto que tienen en la estructura de la comunidad debido a su presencia, no a su actividad (Dayton 1972, modificado por Bruno y Burtness 2001). Las funciones de las especies fundamentales son similares a las de los "ingenieros del ecosistema", y Crain y Bertness (2006) han sugerido que las especies fundamentales son "ingenieros dominantes". Según Bruno y Burtness (2001) los hábitats marinos bentónicos son principalmente formados por la presencia de especies fundamentales. Esta tendencia, contraria al énfasis en efectos tróficos, ha propiciado una más amplia consideración de los procesos importantes para la conservación de la diversidad (Boogert et al. 2006).
Los rodolitos, los morfotipos de vida libre de varios géneros de algas coralinas no geniculadas, fueron reconocidos por primera vez como especies fundamentales por Weber-Van Bosse y Foslie (1904), quienes indicaron que ellos dan refugio a un gran número de animales distintos. Trabajos subsecuentes sobre la epifauna y epiflora de los rodolitos, así como sobre su criptofauna (fauna que vive dentro de ellos), han verificado consistentemente la importancia de los rodolitos para las especies asociadas (revisión en Steller et al. 2003). Aunque individualmente son pequeños (2-10 cm de diámetro), los rodolitos comúnmente se agregan en grandes mantos alrededor del mundo (Bosence 1983, Foster 2001). La diversidad de organismos que vive sobre los rodolitos probablemente sea resultado de que proporcionan superficies duras para la fijación en lo que de otra forma sería un fondo suave. La diversidad de la criptofauna de los rodolitos se relaciona con el tamaño del talo, la complejidad y posiblemente la dureza de sus formas ramificadas, mientras que la diversidad en los sedimentos circundantes probablemente esté relacionada con la complejidad estructural de las densas agregaciones de rodolitos y fragmentos de rodolitos (Kamenos et al. 2003, Steller et al. 2003). La diversidad entre las formas rodolíticas más "sólidas", como Lithothamnion muelleri, también puede estar asociada con el tamaño del talo así como con la longevidad.
La comunidad submareal de Cabo Los Machos en el Golfo de California nos brindó la oportunidad de examinar la contribución relativa de los rodolitos de L. muelleri a la diversidad de una comunidad que incluye también hábitats rocosos y de sedimento grueso, así como el hábitat proporcionado por el follaje de la macroalga feofita Sargassum horridum. Esta última muy probablemente pueda ser considerada también una especie fundamental ya que alberga una epifauna muy diversa (e.g., Edgar y Klumpp 2003). Se han realizado estudios previos de especies asociadas con rodolitos en mantos de rodolitos donde éstos y sus sedimentos derivados son los únicos hábitats disponibles (Foster 2001). Nuestros muéstreos y observaciones en el medio natural también proporcionaron información del ambiente abiótico y aspectos de la historia de vida de L. muelleri y S. horridum que pueden contribuir a la persistencia de la comunidad en un ambiente estacionalmente variable con perturbaciones físicas grandes y episódicas. Hasta donde sabemos, éste es el primer estudio taxonómico amplio sobre macroorganismos en una comunidad de roca y arena cerca de la costa en el Golfo de California. Los resultados proporcionan una base para estudios futuros diseñados para entender mejor la extensión espacial de esta comunidad, además de cómo funciona y contribuye a la diversidad de la región.
Sitio de estudio y métodos
El sitio de estudio fue observado por primera vez en junio de 2000. Se realizaron observaciones cualitativas en abril de 2001, junio de 2002, marzo de 2004, octubre de 2004 y octubre de 2006, y muestreos cuantitativos del 19 al 27 de marzo de 2003 (en lo sucesivo marzo) y del 26 al 30 de octubre de 2003 (en lo sucesivo octubre), usando botes inflables y equipo de buceo autónomo (Scuba). El sitio se localiza al final de un arroyo al occidente de la boca de Bahía Concepcíon, ~0.5 km al sureste de Cabo Los Machos (fig. 1). Su fondo consiste de una mezcla de roca (cantos rodados) y arena (mezcla de fragmentos de rodolitos, arena silicoclástica y rocas pequeñas) desde la zona intermareal hasta ~8 m de profundidad, y se extiende ~0.6 km mar adentro y ~1 km a lo largo de la costa. Las especies L. muelleri y S. horridum se encuentran en todo el sitio, la primera en parches de arena gruesa entre las rocas y la segunda fijada a rocas y ocasionalmente a rodolitos grandes (como lo indican Kendrick y Brearley [1997] para Sargassum spp. en Australia occidental). A profundidades mayores que 8-9 m, más allá del borde oceánico del sustrato rocoso, se observó una rápida disminución de L. muelleri y S. horridum, y un aumento en la abundancia de los rodolitos de Lithophyllum margaritae así como de sedimento fino.

Se realizó un mapa batimétrico con un sonar portátil para determinar la profundidad en transectos a lo largo del sitio, registrando simultáneamente la localización mediante GPS en el registro sonar. El mapa fue utilizado para localizar ocho subsitios verticales aleatorios para eliminar sesgos de selección pero asegurar la representación de todas las profundidades (fig. 1). Se colocaron sensores de temperatura 30 cm por arriba del fondo en los subsitios 2 y 5, y la temperatura se registró cada 8 h entre marzo de 2003 y marzo de 2004.
Los métodos de muestreo, los subsitios estudiados y la frecuencia del muestreo variaron según lo que se estaba estudiando y las limitaciones logísticas. En marzo se recolectaron todos los rodolitos >0.5 cm de diámetro que se encontraron en un solo cuadrante de 3.14 m2 (1 m de radio) de los ocho subsitios, y su diámetro mayor se midió al 1 mm más cercano. En ambos periodos de muestreo se contó el número de órganos de fijación de S. horridum en cinco cuadrantes de 0.25 m2 localizados aleatoriamente a lo largo de una línea de 20 m en los subsitios 1, 2, 3, 5 y 6. Se utilizó la densidad media en los cinco cuadrantes de cada sitio y para cada periodo como medida de abundancia de cada subsitio. En octubre de 2004 se anotaron las nuevas plantas (reclutas) de S. horridum que crecián sobre un marcador de concreto colocado en el subsitio 2 en octubre de 2003. Su morfología era marcadamente diferente a la de las plantas regeneradas de años anteriores (fig. 2). Para comenzar a evaluar la contribución relativa de estas dos fuentes a las densidades de adultos maduros, se contó el número de cada uno a lo largo de un solo transecto en los subsitios 1 y 2 en octubre de 2004 hasta que se habían contado ~50 individuos en total. Las plantas nuevas (reclutas) son pequeñas y con frecuencia sólo pudieron ser reconocidas después de eliminar el sedimento que las cubría y las algas filamentosas que, aunque debílmente, estaban fijas a ellas.

La cobertura de macroalgas, invertebrados sésiles, roca y arena fue estimada en cinco cuadrantes de puntos distribuidos al azar sobre una línea de 20 m en los subsitios 1, 2, 3, 5 y 6 en marzo y octubre. El cuadrante de puntos se formó con una barra de 1 m de largo a la cual se fijó una cuerda de 120 cm de largo, como una cuerda floja en un arco. Se utilizaron cinco nudos en la cuerda como puntos y los organismos o sustratos en ambos lados de la barra fueron muestreados dando 10 puntos por cuadrante (detalles en Foster 1975). El promedio porcentual de cobertura de cada taxón y sustrato en contacto con un punto fue determinado por subsitio y estación, dividiendo el número de puntos de contacto entre 50 y multiplicando por 100. La cobertura total podía exceder el 100% si debajo de un punto existían varias capas.
Se estimó la densidad de invertebrados epibénticos mediante conteos visuales en dos franjas de 2 × 5 m en los subsitios 1, 2, 3, 4, 6 y 7 en marzo y octubre. Se combinaron las dos franjas censadas en cada subsitio por fecha de muestreo para obtener el número de organismos en 20 m2.
En marzo y octubre se estimaron visualmente (visibilidad de 4 a 9 m) la composición y la abundancia de peces en dos franjas de 5 x 20 m separadas al menos 20 m entre sí, en los subsitios 1, 2, 3, 4, 6 y 7. Cada franja se muestreó dos veces, la primera vez nadando 1-1.5 m por encima del fondo a una velocidad constante y la segunda nadando más cerca del fondo y registrando los peces alojados debajo de rocas o en parches de algas que no fueron observados la primera vez. Se registraron los organismos pequeños y crípticos de las familias Gobiidae y Labrisomidae, pero no se contaron. Se combinaron los datos de las dos franjas para cada fecha de muestreo, como en el caso de los invertebrados bénticos, para obtener el número de individuos de cada taxón en 200 m2 de cada subsitio.
Se evaluó la criptofauna dentro de los rodolitos mediante la recolección aleatoria de cinco ejemplares de L. muelleri en cada una de tres clases de talla (<5, 5-8.5 y >8.5 cm de diámetro) dentro de un círculo con 20 cm de radio entre los subsitios 4 y 7, en marzo. Cada rodolito fue quebrado cuidadosamente y todos los animales >1 mm fueron retirados, preservados en formol, almacenados en alcohol e identificados al menor taxón posible. Los especímenes de algas e invertebrados representativos fueron archivados en el Laboratorio Marino de Moss Landing.
Los métodos estadísticos se presentan con los resultados. El error mostrado corresponde a un error estándar (EE), a menos de que se indique lo contrario.
Resultados
Ambiente abiótico
La temperatura varió de 21°C a 32°C entre marzo y octubre de 2003. El registro anual indicó que el muestreo de marzo (21°C) se realizó durante el inicio de un cambio oceanográfico regional de agua fría a cálida en el Golfo de California (revisión en Alvarez-Borrego 1983), y el de octubre (27°C) durante el inicio de un cambio de agua cálida a fría. Una característica interesante de los datos de temperatura consistió en grandes variaciones de hasta 6°C, aproximadamente diarias, entre mayo y octubre. Esta periodicidad sugiere que tales variaciones fueron resultado del movimiento inducido por la marea de agua más fría del golfo hacia la bahía y de agua más cálida de la bahía hacia el golfo.
Las observaciones cualitativas mostraron que el sitio estaba compuesto de ~40% de arena (tabla 1). El resto del sustrato estaba formado por roca, pero la cantidad de roca expuesta y no ocupada varió considerablemente entre los dos periodos de muestreo debido a cambios en la cobertura macroalgal, de ~100% en marzo a ~48% en octubre (tabla 1 pero excluyendo L. muelleri que se encuentra sobre arena).
Macroalgas
Se registró un total de 29 taxones macroalgales, con diversidad similar en marzo y octubre. Se observaron grandes cambios en la abundancia entre los periodos de muestreo, especialmente una reducción considerable de S. horridum, de algas coralinas no geniculadas incrustantes y de Helminthocladia australis (usualmente encontrada creciendo sobre S. horridum), así como un incremento de tapetes de algas rojas. La gran reducción de la cobertura de S. horridum se vio reflejada en los cambios en densidad estimados de los conteos en los cuadrantes: 11.5 (1.5) plantas 0.25 m-2 en marzo contra 5.8 (1.9) plantas 0.25 m-2 en octubre. En marzo las plantas eran grandes, con numerosas frondas de 1-2 m de largo, mientras que en octubre normalmente estaban compuestas de unos cuantos estipes erosionados de 2-3 cm de largo, cubiertos con epifitas y con 2-3 hojas nuevas (fig. 2). Los conteos de plantas regeneradas y nuevas (reclutas) en octubre de 2004 indicaron 52 plantas en una zona (45 regeneradas y 7 reclutas) y 49 plantas en otra zona (45 regeneradas y 4 reclutas).
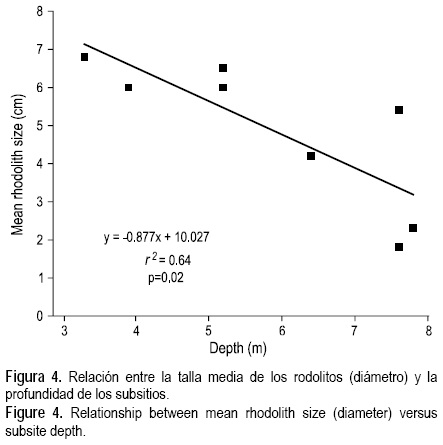
La cobertura de L. muelleri fue similar entre los dos periodos de muestreo (tabla 1), lo que junto con las observaciones cualitativas de su densidad en octubre indicó poca variación temporal en su abundancia. El muestreo de los cuadrantes en marzo mostró una densidad media de 23.9 (5.6) ind m-2, con las tallas más abundantes entre 1.5 y 4 cm de diámetro (fig. 3). El individuo más grande que se encontró tuvo 15 cm de diámetro. Los individuos mayores fueron más abundantes en aguas someras, y la regresión mostró una relación negativa significativa entre la profundidad y el diámetro medio de los rodolitos entre los ocho subsitios muestreados (fig. 4).

Invertebrados epibénticos y peces
Se muestrearon 40 taxones de invertebrados epibénticos, registrándose más taxones y muchos más individuos en marzo (tabla 2). La variación temporal de estos invertebrados se caracterizó por la reducción en taxones entre marzo y octubre, y no por el cambio de una comunidad a otra con diversidad similar como en el caso de las macroalgas. El erizo de mar Arbacia incisa fue el taxón más abundante en marzo, pero no se encontró en octubre. La abundancia de otros taxones comunes (e.g., tunicados solitarios, la anémona Phialoba steinbecki, el serpúlido Spirobranchus gigantea) también decreció durante el mismo periodo (tabla 2). Aunque por su tamaño pequeño no se contó, otra anémona (probablemente Aiptasia californica) fue también muy abundante en marzo (en particular sobre Sargassum horridum) pero no se observó en octubre. El decápodo excavador Neaxius vivesi se encontró en parches de arena; no es totalmente "epibéntico", pero se le observó saliendo parcialmente de sus madrigueras de 1-2 cm de diámetro para alimentarse de detritos. A diferencia de otros invertebrados comunes observados, su abundancia resultó muy similar en los dos periodos de muestreo.
La diversidad total de la comunidad de peces, incluyendo dos rayas, fue de 33 especies (tabla 3). Como con las macroalgas, la diversidad de peces fue similar en marzo y octubre, pero las especies cambiaron y sólo 15 fueron comunes para ambos periodos. A diferencia tanto de las macroalgas como de los invertebrados bénticos, la abundancia media por sitio fue mayor en octubre, principalmente debido a un incremento en los juveniles. Las especies más abundantes (>4 individuos en 200 m2) en marzo fueron la barracuda agujona Sphyraena lucasana, el ronco soldadito Haemulon maculicauda, la petaca chopa Abudefduf troschelii y el pez pluma Calamus brachysomus. En octubre las especies más abundantes fueron el chivo amarillo Mulloidichthys dentatus, H. maculicauda y C. brachysomus (tabla 3). Las mayores abundancias en octubre reflejan el incremento de varias especies, en particular de H. maculicauda y M. dentatus. Algunas especies muy abundantes en marzo (e.g., S. lucasana, A. troschelii) estuvieron completamente ausentes en octubre.
Criptofauna rodolítica
En general, los talos de los rodolitos estuvieron compuestos por ramas muy compactas y algunas veces fusionadas, con distribución y número de espacios variables, de tamaño irregular de hasta 1 cm (dimensión más larga) entre grupos de ramas. Además de estos espacios creados por los mismos rodolitos, los talos de carbonato de calcio y las ramas individuales estaban repletas de huecos y cavidades, algunos con más de 1 cm de diámetro, hechos por los invertebrados criptofaunales que viven dentro de ellos. La diversidad, especialmente dentro de los rodolitos grandes, fue mucho mayor a la encontrada en los otros grupos muestreados: un total de 114 taxones de invertebrados con un promedio de 40 taxones/individuo para los rodolitos grandes (tabla 4). Los poliquetos (52 taxones) y crustáceos (29 taxones) fueron los principales grupos presentes, seguidos por los moluscos (14 taxones) y equinodermos (10 taxones). Las madrigueras más grandes estaban ocupadas por el estomatópodo Gonodactylus zachae y los camarones fantasmas Upogebia rugosa y U. cocosia (tabla 4); éste es el primer registro de esta última especie en México.
La diversidad y abundancia totales de la criptofauna incrementaron junto con la talla de los rodolitos. Usando los datos de cada uno de los 15 rodolitos y comprobando la relación entre el número de individuos y el número de taxones versus el diámetro del rodolito, las regresiones presentaron valores altos de r2 (0.73 y 0.90, respectivamente) y pendientes positivas altamente signficativas (P << 0.01). Muchas de las especies más abundantes (e.g., Ophiactis savignyi, Pentamera chierchia, Marphysa sp., Ampelisca sp.) fueron las más abundantes en cada clase de talla.
Discusión
Diversidad del hábitat
En los rodolitos de Lithothamnion muelleri las macroalgas bénticas, la epifauna béntica, la fauna íctica y la criptofauna contribuyeron 29, 40, 33 y 114 taxones, respectivamente, a la diversidad de la comunidad en Cabo Los Machos. Si se eliminan los conteos dobles de las especies comunes a la epifauna béntica y la criptofauna, se muestrearon un total de 216 taxones. No se muestreó la diversidad epifaunal sobre Sargassum horridum en el sitio de estudio; sin embargo, si se supone similar a la asociada con el género en otras regiones (40-176 taxones; Edgar y Klumpp 2003, Fujita et al. 2003, Buschbaum y Chapman 2006) y cerca de La Paz en el Golfo de California (112 taxones; Medina-López en prep.), los rodolitos y el hábitat de S. horridum probablemente contribuyen de forma similar a la diversidad de la comunidad en Cabo Los Machos durante la primavera y principios del verano, cuando las frondas algales están presentes (discutido abajo). El hábitat creado por estas especies fundamentales alberga una gran parte de la diversidad de macroorganismos en la comunidad.
Estas especies fundamentales pueden influenciar indirectamente la diversidad íctica y béntica en esta y otras comunidades. Sargassum horridum pudo haber aumentado directamente la diversidad íctica en marzo mediante la estructura proporcionada por sus frondas, así como indirectamente mediante su epifauna que puede ser una fuente de alimento para algunos peces. Las plantas de Sargassum sueltas y flotantes pueden aumentar la diversidad aún más al continuar siendo hábitat para organismos en otras comunidades, capacidad que ha sido reconocida al designar al Sargassum flotante en la superficie como hábitat esencial para peces en EUA (Wells y Rooker 2004). Las plantas sueltas pero no flotantes son parte del flujo béntico (Foster obs. pers.), pero no se ha estudiado su uso por otras especies como hábitat. Las plantas fijas de S. horridum podrían afectar a L. muelleri por el efecto de su sombra, pero esto parece ser improbable en Cabo Los Machos ya que las tasas de crecimiento de L. muelleri (discutidas posteriormente) fueron similares a las de otro sitio donde Sargassum no era abundante.
En octubre no se muestrearon los rodolitos, pero las observaciones cualitativas en el campo realizadas al romper algunos ejemplares de diferentes tamaños mostraron una fauna diversa y abundante, lo que sugiere que la variación temporal de la criptofauna es baja. Aún se desconocen los posibles efectos de la criptofauna sobre el resto de la comunidad, particularmente los de predadores como los estomatópodos que pueden alejarse de los rodolitos para alimentarse.
Comparaciones con otros sitios
Nuestras estimaciones de diversidad serían mayores si se hubieran realizado más replicas en espacio y tiempo. En vista de que los cálculos dependen del diseño de muestreo, las comparaciones con la diversidad de otros sitios donde se emplearon otros diseños sólo deberían considerarse indicativas. La diversidad macroalgal en Cabo Los Machos ocurrió en la porción superior del intervalo/sitio encontrado por Paul-Chávez y Riosmena-Rodríguez (2000), quienes muestrearon (mediante buceo libre) siete veces en diez sitios alrededor de la Isla Espíritu Santo cerca de La Paz. También fue mayor que la flora asociada con mantos de Sargassum en la Bahía de La Paz (Riosmena-Rodríguez, datos no publicados). No tenemos conocimiento de ningún estudio cuantitativo y taxonómicamente amplio publicado sobre los macroinvertebrados en zonas someras y rocosas del Golfo de California. Holguín-Quiñones et al. (2000) realizaron un muestreo (recolecciones mediante buceo libre y conteos en dos zonas de 250 m2 en cada sitio) de erizos, estrellas y pepinos de mar en 11 sitios de la Bahía de Loreto; el mayor número de especies encontrado en un sitio fue de 9 en comparación con los 10 de nuestro estudio (equinodermos en la tabla 2 menos los ofiuros). González-Medina et al. (2006) muestrearon moluscos y equinodermos cuatro veces en nueve sitios alrededor de la Isla Espíritu Santo y encontraron un promedio de 5 a 11 especies/sitio y un total de 32 especies en todos los sitios y muestreos combinados. Nuestro promedio para estos grupos (equinodermos más moluscos en la tabla 2) fue de 16.5 de dos periodos de muestreo y un total de 22 especies. En el presente estudio se encontró una diversidad similar de macroalgas así como una diversidad de macroinvertebrados similar o mayor con menor esfuerzo de muestreo que el empleado en estudios cerca de Loreto y La Paz, lo que indica que la diversidad total de estos grupos puede ser considerablemente mayor en Cabo Los Machos.
Se muestrearon 33 especies de peces, de las cuales 13 no habían sido registradas anteriormente para Bahía Concepcíon. Rodríguez-Romero et al. (1992) muestrearon peces en varios sitios de Bahía Concepcíon usando una variedad de métodos, y Rodríguez-Romero et al. (1994) emplearon redes agalleras en siete sitios de la bahía para muestrear peces costeros en cuatro ocasiones. En este último estudio se capturaron 30 especies en un sitio cerca de Cabo Los Machos, y este y otros dos sitios cerca de la boca de la bahía presentaron la mayor diversidad. En un estudio similar al nuestro, Aburto-Oropeza y Balart (2001) encontraron 37 especies en un sitio de cantos rodados cerca de La Paz. Estas otras evaluaciones de la diversidad íctica sugieren que la estimación para nuestro sitio es razonable para este tipo de comunidad.
La diversidad de la criptofauna de los rodolitos de L. muelleri resultó sorprendentemente alta y similar a la diversidad criptofaunal en otros órganos de fijación de macroalgas mucho más grandes en California (~150 taxones; Ghelardi 1971). Los 40 taxones/individuo en los especímenes mayores es el número más grande registrado para cualquier rodolito, y la diversidad total fue similar a la encontrada por Medina-López (1999) en 160 rodolitos de Lithophyllum margaritae en cuatro sitios del Golfo de California estudiados en dos estaciones del año (118 taxones), y por Hinojosa-Arango y Riosmena-Rodríguez (2004) en 120 rodolitos de L. margaritae y Spongites (como Neogoniolithon) trichotomum recolectados en Bahía Concepcíon e Isla Coronados (104 taxones). La ausencia de cambios considerables en la abundancia de los taxones criptofaunales comunes con el incremento en la talla de los rodolitos indica que el aumento en la abundancia y diversidad de la criptofauna con la talla rodolítica es resultado de una acumulación de criptofauna a medida que crece el rodolito, y no de una sucesión en la que los colonizadores tempranos alteran el hábitat rodolítico y, en consecuencia, mueren facilitando la llegada de nuevos colonos. En general, estos datos y los de otros hábitats en Cabo Los Machos sugieren que este sitio es muy rico en especies.
Cambio temporal
Es bien sabido que la flora y fauna costera del Golfo de California presenta grandes cambios estacionales relacionados con cambios en la temperatura del agua (e.g., Dawson 1944, Brusca 1980, Thomson et al. 2000). Se observó poca diferencia en la diversidad de macroalgas o peces entre marzo y octubre, pero sí se encontró un cambio considerable en la composición de especies. Rodríguez-Romero et al. (1992, 1994, 1998) muestrearon peces en Bahía Concepcíon durante febrero, marzo, mayo, julio y septiembre, y encontraron un total de 55 especies, de las cuales sólo 9 se registraron en todos los muestreos. Se encontraron 18 especies a mediados de marzo y a finales de septiembre (temporadas del año similares a nuestro estudio), en comparación con las 15 especies que nosotros observamos ambas veces. Esto indica que la bahía sirve de hábitat para un grupo de especies "permanentes", mientras que muchas otras probablemente entran y salen de la bahía de manera estacional.
A diferencia de macroalgas y peces, la diversidad de invertebrados epibénticos disminuyó entre marzo y octubre; sin embargo, sin réplicas temporales y más registros cuantitativos estacionales de la composición de especies en este y otros sitios, la consistencia de estos patrones temporales y sus causas seguirán sin conocerse bien. Bahía Concepcíon es una bahía somera con una entrada pequeña, que es notoria por la gran variación estacional de temperatura propiciada por las altas temperaturas de verano (36°C; Dawson 1944). La variación estacional de macroalgas, peces e invertebrados ha sido asociada con estos cambios de temperatura (Mateo-Cid et al. 1993, Rodríguez-Romero et al. 1994, Steller et al. 2003). La variación diaria de las temperaturas estivales, aparentemente generada por la marea en la boca de la bahía, y las corrientes asociadas que incrementan la mezcla, pueden moderar estos efectos estacionales en relación con los sitios más internos de la bahía.
Entre los organismos muestrados, el erizo de mar Arbacia incisa y el alga S. horridum fueron los que mostraron unas de las mayores variaciones: entre marzo y octubre el primero decreció de 242.5/20 m2 a cero (tabla 2), y el número de plantas y la cobertura sobre el sustrato (tabla 1) de la segunda decrecieron considerablemente, perdiendo todas las frondas grandes. Dos de nosotros (Steller y Foster) observamos una disminución similar de A. incisa en un manto rodolítico de Isla El Requesón en 1990/91, y creemos que tales eventos pueden ser resultado de un gran reclutamiento periódico, seguido de mortandad por altas temperaturas. Las variaciones estacionales y anuales en la abundancia de las frondas de S. horridum son típicas para este género en el Golfo de California (McCourt 1984, Rivera y Scrosati 2006, obs. pers.); sin embargo, se desconoce si la persistencia de la población con esta variación se deba principalmente a que las plantas vuelven a crecer o al reclutamiento. Ambos procesos suelen presentarse en las feofitas, pero poco se sabe de su contribución relativa (Schiel y Foster 2006). Nuestros datos preliminares sugieren que en Cabo Los Machos ocurren ambos, pero durante nuestro muestreo el recrecimiento fue el proceso dominante. El hecho de que los nuevos reclutas fueran mucho más abundantes sobre sustratos artificiales recién colocados sugiere que las plantas que sobreviven de años anteriores pueden suprimir el reclutamiento de nuevas plantas. El entender mejor los procesos que afectan la supervivencia y el recrecimiento de las plantas existentes, así como el reclutamiento y crecimiento de nuevos individuos indudablemente ayudaría a explicar la variación anual en esta especie ecológicamente importante.
Historia natural de Lithothamnion muelleri
Los rodolitos de L. muelleri en el sitio de estudio probablemente consistituyen un hábitat longevo y persistente. La tasa de crecimiento (aumento en radio/tiempo) de estos rodolitos ha sido estimada en 0.6 mm año-1 en un sitio cerca de La Paz (Frantz et al. 2000 [como L. crassiusculum], Rivera et al. 2003), y datos preliminares (McConnico en prep.) basados en tinción en vida sugieren que la tasa de crecimiento en Cabo Los Machos es similar. Esta tasa, en combinación con los datos de frecuencia de talla, muestra que la población en el sitio está formada por numerosas plantas jóvenes e individuos de >50 años de edad (individuos >6 cm de diámetro en fig. 3). La mortandad puede ser episódica, asociada con tormentas muy grandes. El hecho de que los individuos más grandes se encuentren en agua somera (fig. 4) sugiere que pueden ser trasladados con mayor facilidad por el oleaje (quizás porque la abundante criptofauna reduce su densidad). De ser así, y dado que las olas generadas por los vientos más fuertes en la región provienen del nornoreste (Merrifield et al. 1987), los individuos grandes eventualmente serían transportados hacia la costa y dentro de la zona intermareal donde morirían. De que esto sucede durante grandes tormentas fue evidente en las observaciones realizadas en octubre de 2003, un mes después del paso del Huracán Marty directamente sobre el sitio (http://en.wikipedia.org/wiki/2003_Pacific_hurricane_season). En la zona intermareal y las áreas inmediatamente arriba de ella se encontraron esparcidos talos de L. muelleri recién depositados (aún parcialmente pigmentados) y con numerosas estrellas de mar (Pentaceraster cumingi). La distribución de frecuencia de tallas de los rodolitos arrojados sobre la playa estuvo sesgada hacia las clases de talla mayores (McConnico en prep.). La ausencia de grandes cambios en la abundancia de estas especies entre marzo y octubre (tablas 1, 2) indica que la mortandad por una perturbación individual puede ser baja aun cuando ésta sea muy grande. La gran cantidad de fragmentos de rodolitos en las arenas submareales sugiere que el oleaje también causa mortandad debido a la fragmentación y el enterramiento. La abundancia de arena aluvial gruesa y rocas pequeñas en el sedimento probablemente refleja la entrada de sedimentos a través de la boca del gran arroyo que descarga en el sitio, además de suficiente oleaje para inhibir la acumulación de partículas chicas.
La comunidad marina costera de Cabo Los Machos parece excepcionalmente diversa, y esta diversidad se debe principalmente a la existencia de múltiples especies fundamentales. En nuestros limitados estudios en otras áreas del Golfo de California encontramos dos sitios similares de roca y arena con abundancia de L. muelleri, y uno de éstos, en Punta Galeras cerca de La Paz, también tiene abundancia de corales grandes. Indudablemente han de existir otros sitios similares en la región. Se requiere de considerablemente más estudios y experimentos de campo para localizar tales comunidades, caracterizar mejor su diversidad y entender mejor la ecología poblacional de las especies fundamentales que en ellas existen. Sala et al. (2002) desarrollaron un modelo para el diseño de una red de áreas costeras protegidas en el Golfo de California basado principalmente en la diversidad de peces arrecifales, pero también usando los hábitats, incluidos entre ellos los mantos algales y bancos de rodolitos, como un indicador de la diversidad de plantas e invertebrados. Nuestros datos sugieren que la consideracion de hábitats simples (compuestos por una sola comunidad) deberían ampliarse a comunidades con multiples especies fundamentales (como lo son rodolitos y sargazos). Tales comunidades y sus especies fundamentales merecen una consideración especial en los esfuerzos de conservación de la diversidad.
Agradecimientos
Estamos endeudados con J Figurski y M Johnson por haber encontrado el sitio, y agradecemos a P Slattery su ayuda con la identificación de los invertebrados y a L McMasters la preparación de las figuras. El trabajo de campo fue parte de una clase en conjunto de la UABCS y MLML, desarrollado con apoyo de un Fulbright Alumni Initiative Award al primer autor. Se recibió apoyo adicional de MLML, UABCS, CICIMAR y BCSES.
Traducido al español por Christine Harris.
Referencias
Aburto-Oropeza O, Balart EF. 2001. Community structure of reef fish in several habitats of a rocky reef in the Gulf of California. PSZN: Mar. Ecol. 22: 283-305. [ Links ]
Alvarez-Borrego S. 1983. Gulf of California. In: Ketchum BH (ed.), Ecosystems of the World. 26. Estuaries and Enclosed Seas. Elsevier, Amsterdam, pp. 427-149. [ Links ]
Amado-Filho GM, Maneveldt G, Manso RCC, Marins-Rosa BV, Pacheco MR, Guimarães SMPB. 2007.Structure of rhodolith beds from 4 to 55 meters deep along the southern coast of Espírito Santo State, Brazil Cienc. Mar. 399-410. [ Links ]
Boogert NJ, Paterson DM, Laland KN. 2006. The implications of niche construction and ecosystem engineering for conservation biology. BioScience 56: 570-578. [ Links ]
Bosence DWJ. 1983. The occurrence and ecology of recent rhodoliths: A review. In: Peryt TM (ed.), Coated Grains. SpringerVerlag, Berlin, pp. 225-242. [ Links ]
Bruno JF, Bertness MD. 2001. Habitat modification and facilitation in benthic marine communities. In: Bertness MD, Gaines SD, Hay ME (eds.), Marine Community Ecology. Sinauer, Sunderland, Mass., pp. 201-218. [ Links ]
Brusca RC. 1980. Common Intertidal Invertebrates of the Gulf of California. 2nd ed. Univ. Arizona Press, Tucson, 513 pp. [ Links ]
Buschbaum C, Chapman AS. 2006. How an introduced seaweed can affect epibiota diversity in different coastal systems. Mar. Biol. 148: 743-754. [ Links ]
Crain CM, Bertness MD. 2006. Ecosystem engineering across environmental gradients: Implication for conservation and management. BioScience 56: 211-218. [ Links ]
Dayton PK. 1972. Toward an understanding of community resilience and the potential effects of enrichments to the benthos at McMurdo Sound, Antarctica. Proc. Colloquium on Conservation Problems in Antarctica, pp. 81-96. [ Links ]
Dawson EY. 1944. The marine algae of the Gulf of California. Allan Hancock Pac. Exp. 3: 189-453. [ Links ]
Edgar GJ, Klumpp DW. 2003. Consistencies over regional scales in assemblages of mobile epifauna associated with natural and artificial plants of different shape. Aquat. Bot. 75: 275-291. [ Links ]
Figueiredo MA de O, Santos de Menezes K, Costa-Paiva EM, Paiva PC, Ventura CRR. 2007. Experimental evaluation of rhodoliths as living substrata for infauna at Abrolhos Bank, Brazil. Cienc. Mar. 33: 427-440 [ Links ]
Foster MS. 1975. Algal succession in a Macrocystis pyrifera forest. Mar. Biol. 32: 313-329. [ Links ]
Foster MS. 2001. Rhodoliths: Between rocks and soft places. J. Phycol. 37: 659-667. [ Links ]
Frantz BR, Kashgarian M, Coale KH, Foster MS. 2000. Growth rate and potential climate record from a rhodolith using 14C accelerator mass spectrometry. Limnol. Oceanogr. 45: 1773-1777. [ Links ]
Fujita D, Ari S, Murase N, Tanaka J, Watanabe T, Shozen K, Matsumura W, Hasegawa K, Chimura T, Sasaki M, Matsui K. 2003. Vertical distribution, productive structure and epifauna of Sargassum forests in the vicinity of Abugashima Island, Himi, Toyama Bay. Bull. Toyama Pref. Fish. Exp. Stn. 14: 43-60 (abstract only). [ Links ]
Ghelardi RJ. 1971. "Species" structure of the animal community that lives in Macrocystis pyrifera holdfasts. Nova Hedwigia 32: 381420. [ Links ]
González-Medina FJ, Holguín-Quiñones OE, De la Cruz-Agüero G. 2006. Spatiotemporal variability of some shallow-bottom macroinvertebrates (Gastropoda, Bivalvia and Echinodermata) from Espíritu Santo Archipelago, Baja California Sur, Mexico. Cienc. Mar. 32: 33-44. [ Links ]
Hinojosa-Arango G, Riosmena-Rodríguez R. 2004. Influence of rhodolith-forming species and growth-form on associated fauna of rhodolith beds in the central-west Gulf of California, Mexico. PSZN: Mar. Ecol. 25: 109-127. [ Links ]
Holguín-Quiñones O, Wright-López H, Solís-Marin F. 2000. Asteroidea, Echinoidea y Holothuroidea en fondos someros de la Bahía de Loreto, Baja California Sur, México. Rev. Biol. Trop. 48: 749-757. [ Links ]
Kamenos NA, Moore PG, Hall-Spencer JM. 2003. Substratum heterogeneity of dredged vs un-dredged maerl grounds. J. Mar. Biol. Assoc. UK 83: 411-113. [ Links ]
Kendrick GA, Brearley A. 1997. Influence of Sargassum spp. attached to rhodoliths on sampling effort and demographic analyses of Sargassum spp. (Sargassaceae, Phaeophyta) attached to a reef. Bot. Mar. 40: 517-521. [ Links ]
Mateo-Cid LE, Sánchez-Rodríguez I, Rodríguez-Montesinos YE, Casas-Valdez MM. 1993. Floristic study on benthic marine algae of Bahía Concepción, BCS, Mexico. Cienc. Mar. 19: 41-60. [ Links ]
McCourt RM. 1984. Seasonal patterns of abundance, distributions, and phenology in relation to growth strategies of three Sargassum species. J. Exp. Mar. Biol. Ecol. 74: 141-156. [ Links ]
Medina-López, MA. 1999. Estructura de la criptofauna asociada a mantos de rodolitos en el suroeste del Golfo de California, México. Tesis, Universidad Autónoma de Baja California Sur, La Paz, México, 59 pp. + appendices. [ Links ]
Merrifield MA, Badan-Dangon A, Winant CD. 1987. Temporal behavior of lower atmospheric variables over the Gulf of California. 1983-1985. A data report. Ref. Ser. #87-6, Scripps Inst. Oceanography, La Jolla, 192 pp. [ Links ]
Paul-Chávez L, Riosmena-Rodríguez R. 2000. Floristic and biogeographical trends in seaweed assemblages from a subtropical insular island complex in the Gulf of California. Pac. Sci. 54: 137-147. [ Links ]
Rivera MG, Scrosati R. 2006. Population dynamics of Sargassum lapazeanum (Fucales, Phaeophyta) from the Gulf of California, Mexico. Phycologia 45: 178-189. [ Links ]
Rivera MG, Riosmena-Rodríguez R, Foster MS. 2003. Age and growth of Lithothanmion muelleri (Corallinales, Rhodophyta) in the southwestern Gulf of California, Mexico. Cienc. Mar. 30: 235-249. [ Links ]
Rodríguez-Romero J, Abitia-Cárdenas LA, de la Cruz-Agüero J, Galván-Magaña F. 1992. Systematic list of marine fishes of Bahía Concepción, Baja California Sur, Mexico. Cienc. Mar. 18: 85-95. [ Links ]
Rodríguez-Romero J, Abitia-Cárdenas LA, Galván-Magaña F, Chávez-Ramos H. 1994. Composition, abundance and specific richness of fishes from Concepción Bay, Baja California Sur, Mexico. Cienc. Mar. 20: 321-350. [ Links ]
Rodríguez-Romero J, Abitia-Cárdenas LA, Galván-Magaña F, Gutiérrez-Sánchez FJ, Aquilar-Palomino B, Arvizu-Martínez J. 1998. Ecology of fish communities from the soft bottom of Bahía Concepcíon, Mexico. Arch. Fish. Res. 46: 61-76. [ Links ]
Sala E, Aburto-Oropeza O, Paredes G, Parra I, Barrera JC, Dayton PK. 2002. A general model for designing networks of marine reserves. Science 298: 1991-1993. [ Links ]
Schiel DR, Foster MS. 2006. The population biology of large brown algae: Ecological consequences of multiphase life histories in dynamic coastal environments. Ann. Rev. Evol. Ecol. Syst. 37: 343-372. [ Links ]
Steller DL, Riosmena-Rodríguez R, Foster MS, Roberts CA. 2003. Rhodolith bed diversity in the Gulf of California: The importance of rhodolith structure and consequences of disturbance. Aquat. Conserv.: Mar. Freshwat. Ecosyst. 13: S5-S20. [ Links ]
Thompson DA, Findley LT, Kerstitch AN. 2000. Reef Fishes of the Sea of Cortez. Univ. Texas Press, Austin, 353 pp. [ Links ]
Weber-Van Bosse A, Foslie M. 1904. The Corallinaceae of the Siboga Expedition. Leiden Bull. Rep. 61: 1-110. [ Links ]
Wells RJD, Rooker JR. 2004. Distribution, age, and growth of young-of-the-year greater amberjack (Seriola dumerili) associated with pelagic Sargassum. Fish. Bull. 102: 545-554. [ Links ]














