Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.33 no.3 Ensenada sep. 2007
Artículos
Estudio comparativo de la bioacumulación del plomo y cadmio en cianobacterias Synechocystis sp. PCC 6803 bajo condiciones de laboratorio
Comparative study on bioaccumulation of lead and cadmium by the cyanobacterium Synechocystis sp. PCC 6803 under laboratory conditions
KKIU Arunakumara*1,2, Z Xuecheng1, X Song1
1 College of Marine Life Sciences, Ocean University of China, Qingdao 266003, People's Republic of China. * E-mail: kkiuaruna@yahoo.com.
2 Department of Crop Science, Faculty of Agriculture, University of Ruhuna, Kamburupitiya, Sri Lanka.
Recibido en enero de 2006;
Aceptado en mayo de 2007
Resumen
Con el objeto de limpiar cuerpos de agua que han sufrido contaminación por metales pesados, se han desarrollado técnicas de biorremoción. En el presente estudio de laboratorio, se evaluó la bioacumulación de Pb2+ y Cd2+. Se utilizaron cianobacterias Synechocystis sp. PCC 6803, organismo modelo que ha sido utilizado ampliamente en estudios genéticos, fisiológicos y morfológicos. El crecimiento fue medido mediante el conteo de células, revelando que a bajas concentraciones de Pb2+ (0.5 y 1 μg mL-1) su influencia es positiva en Synechocystis sp. PCC 6803 resultando en una ligera estimulación del crecimiento. Sin embargo, la especie no pudo resistir periodos largos expuesta a concentraciones altas de ambos metales (2, 4, 6 y 8 μg mL-1). Las inhibiciones más altas registradas despues del periodo de incubación de 6 días fueron de 53.14% y 70.07% para Pb2+ y Cd2+ respectivamente a una concentración de 8 μg mL-1. Se observó una rápida remoción de los metales durante los dos primeros días de incubación, seguida por una reducción gradual. Sin embargo, sólo se pudo encontrar una pequeña diferencia en la cantidad acumulada, ya que el porcentaje de Pb2+ removido de la solución fue mayor que el del Cd2+ en todos los tratamientos. Aunque las diferencias entre las cantidades acumuladas de los dos metales son muy reducidas, el porcentaje de Pb2+ removido de la solución fue más alto que el de Cd2+ en el transcurso de incubación. Las cantidades de metal acumulado aumentaron en una relación dependiente de la dosis para ambos metales. Las máximas acumulaciones (155.63 y 199.83 mg g-1 de peso seco, respectivamente para Pb2+ y Cd2+) se registraron después de 6 días. La especie resultó ser un buen acumulador de metales con altos factores de bioconcentración, de 20 657 y 24 980 respectivamente para Pb2+ y Cd2+.
Palabras clave: Synechocystis sp. PCC 6803, crecimiento, cantidades acumuladas, factor de bioconcentración.
Abstract
Bioremoval techniques have been employed in cleaning water bodies that suffer from detrimental effects of heavy metal pollution. In the present laboratory study, bioaccumulation of Pb2+ and Cd2+ was assessed using the unicellular cyanobacterium Synechocystis sp. PCC 6803, a model organism widely used in genetic, physiological and morphological studies. Growth was measured as cell counts and showed that Pb2+, at low exposure concentrations (0.5 and 1 μg mL-1), had a positive influence on Synechocystis sp. PCC 6803, resulting in slight growth stimulations; however, the species could not withstand long periods of exposure to both metals at higher concentrations (2, 4, 6 and 8 μg mL-1). The highest inhibitions (53.14% and 70.07% for Pb2+ and Cd2+, respectively, at 8 μg mL-1) were recorded after six days. Rapid metal removal was observed during the first two days of incubation, followed by a gradual reduction. Though the differences in accumulated amounts seemed to be narrow, the percentage of Pb2+ removed from the solution was always higher than that of Cd2+ in all the treatments. Accumulated amounts increased in a dose-dependent manner for both metals. The maximum accumulations (155.63 and 199.83 mg g-1 dry weight for Pb2+ and Cd2+, respectively) were recorded at the end of six days. The species can be considered a good accumulator of metals, with high bioconcentration factor values of 20 657 and 24 980 for Pb2+ and Cd2+, respectively.
Key words: Synechocystis sp. PCC 6803, growth, accumulated amount, bioconcentration factor.
Introducción
La contaminación del ambiente acuático con metales pesados es un tema de constante preocupación (Srivastava y Purnima 1998). La biodegradación lenta de metales pesados crea riesgos a todos los organismos (Sresty y Rao 1999), en particular, su bioacumulación en la cadena alimentaria acuática es muy peligrosa (Sanita-di-Toppi y Gabbrielli 1999). La biorremoción, definida como la acumulación y concentración de contaminantes presentes en soluciones acuosas mediante materiales biológicos (Sag y Kutsal 1997), es una alternativa potencial a métodos convencionales para eliminar metales pesados (Veglio et al. 1995). En este contexto han llamado la atención algunas especies de plantas que son capaces de procesar metales pesados, debido a su eficiencia y eficacia ecológica (Srivastava y Purnima 1998). Plantas y microorganismos acuáticos son capaces de remover metales del agua mediante procesos de bioabsorción y bioacumulación asociadas al metabolismo (Wang et al. 1998); tal es el caso de la fanerógama marina Cymodocea nodosa en la que Marín-Guirao et al. (2005) estudiaron la bioacumulación de metales como parte de una evaluación de la contaminación en la laguna costera del Mar Menor (SE de España).
Debido a su amplia presencia en la naturaleza y su asimilación metabólica con crecimiento continuo, las microalgas son consideradas candidatas ideales para realizar estudios de bio-acumulacion de metales (Sobhan y Sternberg 1999). Ya se han hecho estudios y se ha documentado sobre varios aspectos de la eliminación de metales por medio de algas (Sudhakar et al. 1991, Holan y Volesky 1994, deCarvalho et al. 1995).
Se sabe que los cuerpos intracelulares de polifosfatos de las algas vivas son los responsable del secuestro de metales (Zhang y Majidi 1994). Además, componentes de la pared celular de microorganismos tales como polisacáridos, proteínas y lípidos, ofrecen muchos grupos funcionales que pueden ligar iones metálicos (Ari et al. 1999). Las cianobacterias, un numeroso y diverso grupo de procariotas fotosintéticos, se han empleado ampliamente en evaluaciones de exposición con metales. La cianobacteria unicelular Synechocystis sp. PCC 6803 es un organismo modelo que presenta una combinación única de características moleculares, genéticas, fisiológicas y morfológicas, y ha sido utilizada en varios estudios sobre procesos fotosintéticos, reacciones de transferencia de electrones involucradas en la fotosíntesis y el desarrollo de los cloroplastos (Kashino et al. 2002, Roose y Pakrasi 2004). Se demostrado que las cepas de Synechocystis sp. desarrollan un cáliz grueso cuando crecen expuestas a estrés con cobre (Gardea-Torresdey et al. 1996). El presente estudio estuvo enfocado en la bioacumulación de plomo y cadmio en las cianobacterias unicelulares Synechocystis sp. PCC 6803 en condiciones de laboratorio.
Materiales y Métodos
Cepa experimental
Se tomó Synechocystis sp. PCC 6803 del stock de algas cultivadas y preservadas en el laboratorio del Colegio de Ciencias de la Vida Marina, de la Universidad del Océano, de China. La cepa experimental fue cultivada en medio BG11 (Rippka et al. 1979) ajustado a pH 7.0 y a 25 ± 1°C, agitada suavemente e iluminada con luz blanca fluorescente a una intensidad de 50 fotón mmol m-2 s-1 con un ciclo luz:oscuridad 14:10 h. En la fase de crecimiento exponencial tardío, los cultivos fueron centrifugados en 4000 g durante 10 min y las células fueron resuspendidas en medio BG11 fresco antes de ser usados en los respectivos tratamientos con metales.
Aparatos, productos químicos y métodos analíticos
Se utilizaron productos químicos de grado analítico sin purificación adicional. En todos los experimentos el agua fue ionizada mediante el sistema Millipore Milli-Q. La concentración de las soluciones de plomo y cadmio fue de 1000 μg mL-1, utilizando Pb(NO3)2 y CdCl2, respectivamente, a partir de solución madre. Para determinar la concentración de Pb2+ y Cd2+ en el medio se utlizó espectrofotometría de absorción atómica (PGeneral, TAS-986), mientras que la densidad óptica fue medida usando un espectrofótometro UV-2102. Todas las mediciones de peso se realizaron en una báscula digital (Sartorins, BS 210S) y el pH del medio fue medido con un aparato pH/ISE modelo 868.
Análisis de bioacumulación
Los análisis de bioacumulación se llevaron a cabo por separado para los dos metales utilizando frascos simples de 150 mL de capacidad con 100 mL de suspensión algal (OD750 inicial = 0.1). Las suspensión algal fue tratada inicilamente con varias concentraciones de metal (0, 0.5, 1, 2, 4, 6 y 8 μg mL-1) y homogeneizada continuamente en una coctelera rotatoria de 100 rpm. La incubación fue realizada durante 6 días en las condiciones anteriormente mencionadas. Cada dos días se tomaron alícuotas de 5 mL de cada suspensión, las cuales fueron centrifugadas a 15,000 rpm por 10 min separando el sobrenadante para determinar las concentraciones metálicas en el medio. Se calculó la cantidad acumulada (q) de metal (mg g-1 peso seco) usando el método diferencial de concentración simple (Volesky y Holan 1995):
q = (C0 - Ct) V/W
donde C0 es la concentración inicial del metal en el medio (mg L-1), Ct es la concentración del metal al tiempo t de incubación (mg L-1), V es el volumen total (L) y W es el peso seco del alga (g).
Para calcular el factor de bioconcentración (BCF) se utilizó la proporción entre la cantidad acumulada, que incluía el metal contenido en el precipitado adherido a la pared celular y el acumulado en las células, y la concentración de metal en la solución. [El grado al que un contaminante se concentrará en un organismo es expresado como BCF; así, un BCF de 100 significa que el organismo concentra la sustancia química 100 veces más que los medios circundantes.] Se monitoreó el crecimiento de las algas registrando la densidad óptica a 750 nm y mediante el conteo directo de las células (XB-K-25, Shanghai, 0.1 mm de hondo) al microscopio (Olimpo, Transmisión, LM). Se utilizó la relación lineal encontrada en el presente estudio [peso seco (g L-1) = 0.3574 × OD750 nm (r = 0.9923)] para estimar el peso seco de algas en valores de OD relevantes. A fin de medir el peso seco de algas, las células fueron filtradas a través de una membrana de 0.22 μm, y luego secadas a 103°C por 2 h. Todos los procedimientos fueron realizados en condiciones asépticas y los resultados fueron obtenidos por triplicado en cada una de las muestras de cultivo.
Resultados
Crecimiento
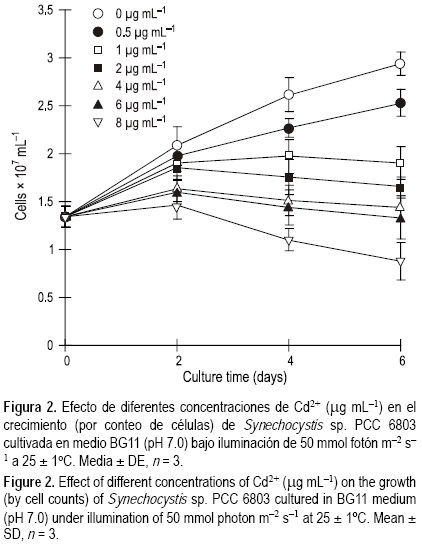
El resultado del crecimiento en las células expuestas a Pb2+ y Cd2+ es ilustrado en las figuras 1 y 2 respectivamente. Las concentraciones bajas de Pb2+ (0.5 y 1 μg mL-1) podrían influir positivamente en Synechocystis sp. PCC 6803, resultando leves estímulos en su crecimiento (2.69% y 6.99% después de dos días); sin embargo, la especie no pudo resistir por tiempos prolongados concentraciones >2 μg mL-1 de Pb2+. Por otra parte, el Cd2+ pareció afectar adversamente el crecimiento aun a concentraciones muy bajas (13.95% de inhibición a 0.5 μg mL). Además, las inhibiciones causadas por el Cd2+ resultaron considerablemente mayores que las causadas por el Pb2+ en todas las concentraciones. Las mayores inhibiciones (53.14% y 70.07% respectivamente para Pb2+ y Cd2+ a 8 μg mL-1) se observaron luego de 6 días.

Remoción de metal
La remoción de metal de la solución fue mayor durante los dos primeros días de la incubación, seguido de una reducción gradual (tabla 1). El porcentaje de Pb2+ removido resultó mayor que el de Cd2+ para todas las concentraciones a lo largo del periodo; sin embargo existen pocas diferencias entre las cantidades acumuladas de los dos metales. Las cantidades acumuladas de ambos metales aumentaron tanto con la concentración de metal en el medio como con el tiempo de exposición. Sin embargo, es posible ver algunas excepciones cuando los organismos fueron expuestos a menores concentraciones (por ejemplo, a 0.5 y 1 μg mL-1 Cd2+ y a 0.5, 1, 2, 4 μg mL-1 Pd2+), donde las cantidades acumuladas disminuyeron conforme avanzó la incubación. Las acumulaciones máximas fueron 155.63 y 199.83 mg g-1 peso seco para Pd2+ y Cd2+, respectivamente, a los 6 días (tabla 2).
Factor de bioconcentración
Las figuras 3 y 4 (para Pb2+ y Cd2+, respectivamente) ilustran los cambios de BCF durante el periodo de 6 días. En bajas concentraciones (0.5, 1, 2 y 4 μg mL-1), el BCF de Pb2+ alcanzó un máximo en 2 días, seguido por una reducción gradual. A concentraciones bajas de Cd2+ (0.5 y 1 μg mL-1) también se vió una tendencia semejante, mientras que a concentraciones altas el BCF continuó aumentado con el tiempo. Además, el BCF más alto después de 2 días se registró a la menor concentración (0.5 μg mL-1) para ambos metales.


Discusión
Como lo refleja el metabolismo de la célula, el crecimiento resultó ser un indicador clave de la toxicidad metálica en microorganismos. La densidad de células a menudo es usada como un parámetro de crecimiento en la evaluación de la respuesta de las algas a la toxicidad metálica (Carr et al. 1998). Heng et al. (2004) estudiaron el efecto del Cd2+ y el Pb2+ en Anabaena flosaquae y concluyeron que el Cd2+ es más tóxico para las cianobacterias que el Pb2+. Nuestras conclusiones confirmaron su punto de vista, dado que el 14% de inhibición del crecimiento se registró a 0.5 μg mL-1 de Cd2+ mientras que a la misma concentración de Pb2+ no se registró ninguna inhibición considerable. La alta toxicidad de Cd2+ en muy bacas concentraciones fue confirmada por Lasheen (1990), quien reportó una inhibición del crecimiento de algas hasta 0.05 μg mL-1. Entre las especies de algas sumamente sensibles al Cd2+ están Chlorella vulgaris, Chlorella saccharophila, Skeletonema costatum, Asterionella formosa y Selenastrum capricornutum, las cuales han mostrado inhibiciones del crecimiento a 0.06, 0.11, 0.05, 0.01 y 0.08 μg mL-1 de Cd2+, respectivamente (Bartlett et al. 1974, Bertand et al. 1977, Rosko y Rachlin 1977, Conway 1978, Rachlin et al. 1982). Observamos un leve estímulo al crecimiento con concentraciones bajas de Pb2+, lo que coincide con El-Enany e Issa (2000), quienes observaron también un estímulo en el crecimiento de Nostoc linckia y Nostoc rivularis a 0.4 y 1.6 μg mL1, de Cd2+ y Zn2+ respectivamente. Fathi et al. (2000) y Fathi (2002) observaron una reducción dependiente de la concentración, en el número de células de Scenedesmus bijuga y Anabaena spiroides. Fargasova (1999) estudió los efectos del Cd2+, Cu2+, Zn2+, Pb2+ y Fe2+ en el alga verde de Scenedesmus quadricauda y concluyó que la toxicidad aumentó con el aumento en la concentración de todos estos metales. Todos estos reportes confirman que la inhibición de crecimiento es dependiente de la dosis, tal y como se observó en el presente estudio.
Los metales pesados que penetran en las células de las algas eventualmente compiten por los sitios que ligan a las proteinas, las enzimas activas y varios grupos biorreactivos, interrumpiendo procesos metabólicos de rutina (Visviki y Rashin 1991). En el caso de Pb2+, el daño a la membrana (en particular, thaylakoids) que causa una pobre asimilación del carbono pareció ser la principal causa de la inhibición del crecimiento. Sin embargo, según un reporte realizado por Vymazal (1995), las interacciones del Pb2+ con polifosfatos también podrían influir negativamente en el crecimiento debido a la precipitación del fosfato. Por otra parte, la inhibición del crecimiento causada por el Cd2+ puede llevar a la interrupción de procesos metabólicos dado que el Cd2+ podría interactuar con los tiocomponentes de las cianobacterias (Mushrifah y Peterson 1990) y el metabolismo N2/NO3-(Mallick y Rai 1994).
La remoción de metales en solución por las algas puede ser descrito básicamente como un fenómeno de dos fases, a saber: intercambio independiente de la energía del ión metálico por los iones presentes en la pared celular y asimilación activa dependiente de la energía. En el caso de las cianobacterias, se sabe que la acumulación de metales en la superficie de la célula o pared celular es el mecanismo principal (Mahan et al. 1989). Esto fue reconfirmado por Chojnacka y Mowoyta (2001), quienes estudiaron el mecanismo de eliminación de metales pesados por Spirulina spp. La eliminación rápida del metal que observamos durante los primeros dos días de incubación podría ser la primera etapa de adsorción reportada por Sloof et al. (1995) para la asimilación del cadmio por Selenastrum capricornutum. La posterior remoción lenta, del segundo día en adelante, podría ser la etapa metabólica fisiológica. De hecho, los microorganismos vivos tienen la capacidad de regenerarse a sí mismos y así continuar eliminando metales efectivamente conforme avanza la incubación. La cantidad acumulada de metales aumenta con el tiempo de exposición y la concentración de metal en el medio (Lamaia et al. 2005). Esta pauta dependiente de la dosis en la acumulación se observó también en Chlorella para Cd2+ y Zn2+ (Costa y Leite 1990) y Stichococcus bacillaris para Pb2+ (Pawlik 2000). Los cambios en las cantidades acumuladas en el presente estudio están de acuerdo con los reportes anteriormente mencionados; sin embargo, cuando las cianobacterias fueronn expuestas a concentraciones muy bajas los resultados fueron un poco diferentes.
En general, las cantidades acumuladas de Pb2+ y Cd2+ resultaron elevadas. Lamaia et al. (2005) reportaron que C. fracta acumuló 61,400 mg g-1 de Pb2+ al exponerse a 80 μg mL-1, mientras que al exponerse a 8 μg mL-1 la acumulación fue de 4,090 mg g-1 de Cd2+. Anabaena flosaquae acumuló 70 mg g-1 de Pb2+ y 26 mg g-1 de Cd2+ al exponerse respectivamente a 1 y 0.15 μg mL-1 (Heng et al. 2004). La mayor cantidad acumulada de Pb2+ y Cd2+ en el estudio presente fue de 156 y 200 mg g-1, respectivamente, después de la exposición a 8 μg mL-1. Diversos informes de la capacidad de acumulación indican claramente que esta depende de la respuesta específica a la exposición a metales pesados; además de que la acumulación metálica por las algas está influenciada por varios factores abióticos (e.g., pH, agentes quelantes, potencial redox, temperatura, luz) y bióticos (e.g., actividad celular, concentraciones de biomasa de algas, productos extracelulares) (Fathi y Omair 2006).
El BCF ha sido ampliamente utilizado para comparar especies en cuanto a su capacidad de acumulación de metales (Raskin et al. 1994). Los valores de BCF registrados al segundo día del presente estudio concuerdan con Lamaia et al. (2005) quienes publicaron valores considerablemente más altos de BCF para Pb2+ que para Cd2+ para todas las concentraciones probadas con C. fracta; sin embargo, al avanzar la incubación progresó, el Cd2+ pareció generar valores de BCF más altos que el Pb2+. La disminución gradual encontrada en los valores de BCF cuando el Pb2+ y Cd2+ aumentan es también similar a lo reportado por Lamaia et al. (2005). Nuestras conclusiones también confirman lo reportado por Rai y Chandra (1992) quienes afirmaron que la concentración de metales en el ambiental es el principal factor que influye en la eficacia en la asimilación de metales y, en consecuencia, en el incremento en los valores de BCF. Desde el punto vista de la fitoremediación, un buen bioacumulador debería poseer un BCF de más de 1000 (Zayed et al. 1998) y sobre la base de este criterio, Synechocystis sp. PCC 6803 mostró ser un buen bioacumulador de metales, con altos valores de BCF: 20,657 y 24,980 para Pb2+ y Cd2+, respectivamente. Para concluir, a pesar de que el Cd2+ fue encontrado más tóxico para Synechocystis sp. PCC 6803 que el Pb2+, sólo se encontraron leves diferencias entre las cantidades acumuladas de los dos metales. Aunque la especie resultó tener buen potencial para ser usada en la limpieza de aguas contaminadas, la viabilidad práctica de este procedimiento debe ser confirmada mediante estudios realizados en condiciones de campo.
Agradecimientos
Se agradece el apoyo financiero del Consejo Chino de Becas a este estudio, así como a G Gómez su ayuda en la edicion del lenguaje y a todos los colegas de nuestro laboratorio por su ayuda.
Referencias
Ari AB, Mel M, Hasan MA, Karim MIA. 1999. The kinetics and mechanism of lead (II) biosorption by powderized Rhizopus oligosporus. World J. Microbiol. Biotechnol. 15: 291-298. [ Links ]
Bartlett L, Rabe FW, Funk WH. 1974. Effects of copper, zinc and cadmium on Selenastrum capricornutum. Water Res. 8: 179-185. [ Links ]
Bertand BR, Bonin DJ, Guerin-Ancey LJ, Kaplov VI, Arlhac DP. 1977. Action de metaux lourds a des doses subletales sur les caraceristiques de la croissance chez la diatomee Skeletonema costatum. Mar. Biol. (Bert.) 42: 17-30. [ Links ]
Carr HP, Carino FA, Yang MS, Wong MH. 1998. Characterization of cadmium-binding capacity of Chlorella vulgaris. Bull. Environ. Cantam. Toxicol. 60: 433-440. [ Links ]
Chojnacka K, Mowoyta A. 2001. Mechanism of heavy metal ion biosorption by a blue-green alga Spirulina species. Inzynieria Chemiczne Procesowa Poland 22: 331-336. [ Links ]
Conway HL. 1978. Sorption of arsenic and cadmium and their effects on growth, micronutrient utilization and photosynthetic pigment composition of Asterionella formosa. J. Fish. Res. Bd. Can. 35: 286-294. [ Links ]
Costa ACA, Leite SGF. 1990. Cadmium and zinc biosorption by Chlorella homosphaera. Biotechnol. Lett. 12: 941-944. [ Links ]
deCarvalho RP, Chong KH, Volesky B. 1995. Evaluation of the Cd, Cu and Zn biosorption in two-metal systems using algal biosorbent. Biotechnol. Prog. 11: 39-44. [ Links ]
El-Enany AE, Issa AA. 2000. Cyanobacteria as a biosorbent of heavy metals in sewage water. Environ. Toxicol. Phar. 8: 95-101. [ Links ]
Fargasova A. 1999. The green alga Scenedesmus quadricauda: A subject for the study of inhibitory effects of Cd, Cu, Zn, Pb and Fe. Biologia 54: 393-398. [ Links ]
Fathi AA. 2002. Toxicological response of the green alga Scenedesmus bijuga to mercury and lead. Folia Microbiol. 47: 667-671. [ Links ]
Fathi AA, Al-Omair MA. 2006. Effects of pH on toxicity of cadmium, cobalt and copper to Scenedesmus bijuga. Protistology 4(3): 221-226. [ Links ]
Fathi AA, Zaki FT, Fathy AA. 2000. Bioaccumulation of some heavy metals and their influence on the metabolism of Scenedesmus bijuga and Anabaena spiroides. Egypt. J. Biotechnol. 7: 293-307. [ Links ]
Heng LY, Jusoh K, Ling CHM, Idris M. 2004. Toxicity of single and combinations of lead and cadmium to the cyanobacteria Anabaena flos-aquae. Bull. Environ. Contam. Toxicol. 72: 373-379. [ Links ]
Holan ZR, Volesky B. 1994. Biosorption of lead and nickel by biomass of marine algae. Biotechnol. Bioeng. 43: 1001-1009. [ Links ]
Kashino Y, Lauber WM, Carroll JA, Wang Q, Whitmarsh J, Satoh K, Pakrasi HB. 2002. Proteomic analysis of a highly active photosystem II preparation from the cyanobacterium Synechocystis sp. PCC 6803 reveals the presence of novel polypeptides. Biochemistry 41: 8004-8012 [ Links ]
Lamaia C, Kruatrachuea M, Pokethitiyooka P, Upathamb ES, Soonthornsarathoola V. 2005. Toxicity and accumulation of lead and cadmium in the filamentous green alga Cladophora fracta: A laboratory study. ScienceAsia 31: 121-127. [ Links ]
Lasheen MR. 1990. Effect of cadmium, copper and chromium (VI) on the growth of Nile algae. Water Air Soil Pollut. 50: 19-30. [ Links ]
Mahan CA, Majidi V, Holcombe JA. 1989. Evaluation of the metal uptake of several algae strains in a multicomponent matrix utilizing inductively coupled plasma emission spectrometry. Anal. Chem. 61: 624-627. [ Links ]
Mallick N, Rai LC. 1994. Kinetic studies of mineral uptake and enzyme activities of Anabaena doliolum under metal stress. J. Gen. Appl. Microbiol. 40: 123-133. [ Links ]
Marín-Guirao L, Cesar A, Marín A, Vital R. 2005. Assessment of sediment metal contamination in the Mar Menor coastal lagoon (SE Spain): Metal distribution, toxicity, bioaccumulation and benthic community structure. Cienc. Mar. 31: 413-418. [ Links ]
Mushrifah I, Peterson PJ. 1990. Toxicity of cadmium and tin to chlorophyll a and protein content of Anabaena flos-aquae. Microbios Lett. 45: 151-160. [ Links ]
Pawlik B. 2000. Relationships between acid-soluble thiol peptides and accumulated Pb in the green alga Stichococcus bacillaris. Aquat. Toxicol. 50: 221-230. [ Links ]
Rachlin JW, Warkentino B, Jensen TE. 1982. The growth responses of Chlorella saccharophila, Navicula inserta and Nitzsehia closterium to selected concentrations of cadmium. Bull. Torrey Rot. Club 109: 129-135. [ Links ]
Rai UN, Chandra P. 1992. Accumulation of copper, lead, manganese and iron by field population of Hydrodictyon reticulatum (Linn) Lagerheim. Sci. Total Environ. 116: 203-211. [ Links ]
Raskin I, Kumar PBAN, Dushenkov S, Salt D. 1994. Bioconcentration of heavy metals by plants. Curr. Opin. Biotechnol. 28: 115-126. [ Links ]
Rippka R, Deruelles J, Waterbury JB, Herdman MRY. 1979. Generic assignments, strain histories and properties of pure cultures of cyanobacteria. J. Gen. Microbiol. 11: 1-61. [ Links ]
Roose JL, Pakrasi HB. 2004. Evidence that D1 processing is required for manganese binding and extrinsic protein assembly into photosystem II. J. Biol. Chem. 279: 45417-45422. [ Links ]
Rosko JJ, Rachlin JW. 1977. The effects of cadmium, copper, mercury, zinc and lead on cell division, growth and chlorophyll a content of the chlorophyte Chlorella vulgaris. Bull. Torrey Bot. Club 104: 776-783. [ Links ]
Sag Y, Kutsal T. 1997. The simultaneous biosorption process of lead (II) and nickel (II) on Rhizopus arrhizus. Process Biochem. 32: 591-597. [ Links ]
Sanita-di-Toppi LS, Gabbrielli R. 1999. Response to cadmium in higher plants. Environ. Exp. Bot. 41: 105-130. [ Links ]
Sloof JE, Viragh A, Van-Der-Veer B. 1995. Kinetics of cadmium uptake by green algae. Water Air Soil Pollut. 83: 105-122. [ Links ]
Sobhan R, Sternberg SPK. 1999. Cadmium removal using Cladophora. J. Environ. Sci. Health Part A 34: 53-72. [ Links ]
Sresty TVS, Rao KVM. 1999. Ultrastructural alterations in response to zinc and nickel stress in the root cells of pigeon pea. Environ. Exp. Bot. 41: 3-13. [ Links ]
Srivastava AK, Purnima X. 1998. Phytoremediation for heavy metals, a land plant based sustainable strategy for environmental decontamination. Proc. Natl. Acad. Sci. India. Sect. B Biol. Sci. 68(3-5): 199-215. [ Links ]
Sudhakar G, Jyothi B, Venkateswarlu V. 1991. Metal pollution and its impact on algae in flowing waters in India. Arch. Environ. Contam. Toxicol. 21: 556-566. [ Links ]
Veglio F, Beolchini F, Gasbarro A. 1995. Biosorption of toxic metals: An equilibrium study using free cells of Arthrobacter sp. Process Biochem. 32: 99-105. [ Links ]
Visviki K, Rashin JW. 1991. The toxic action and interactions of copper and cadmium to the marine algae Dunalliela minuta in both acute and chromic exposures. Arch. Environ. Contam. Toxicol. 20: 271-275. [ Links ]
Volesky B, Holan ZR. 1995. Biosorption of heavy metals. Biotechnol. Prog. 11: 235-250. [ Links ]
Vymazal J. 1995. Algae and Element Cycles in Wetlands. Lewis Publ., Florida, 689 pp. [ Links ]
Wang TC, Weissman JC, Ramesh G, Varadarajan R, Benemann JR. 1998. Heavy metal binding and removal by Phormidium. Bull. Environ. Contam. Toxicol. 60: 739-744. [ Links ]
Zayed A, Gowthman S, Terry N. 1998. Phytoaccumulation of trace elements by wetland plants: I. Duckweed. J. Environ. Qual. 27: 715-721. [ Links ]
Zhang W, Majidi V. 1994. Monitoring the cellular response of Stichococcus bacillaris to exposure of several different metals using in vivo 31P NMR and other spectroscopic techniques. Environ. Sci. Technol. 28: 1577-1581. [ Links ]














