Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Ciencias marinas
versão impressa ISSN 0185-3880
Cienc. mar vol.33 no.2 Ensenada Jun. 2007
Artículos
Variabilidad en la estructura poblacional del calamar gigante (Dosidicus gigas) en Santa Rosalía, región central del Golfo de California
Variability in the population structure of jumbo squid (Dosidicus gigas) in Santa Rosalía, central Gulf of California
G Bazzino1*, C Salinas-Zavala1, U Markaida2
1 Centro de Investigaciones Biológicas del Noroeste (CIBNOR), Mar Bermejo N° 195, Col. Playa Palo de Santa Rita, La Paz, Baja California Sur 23090, México. *E-mail: gbazzino04@cibnor.mx.
2 Departamento de Aprovechamiento y Manejo de Recursos Acuáticos, El Colegio de la Frontera Sur (ECOSUR), Calle 10 # 264, Col. Centro, 24000 Campeche, México.
Recibido en junio de 2006;
Aceptado en abril de 2007
Resumen
Se describió la estructura poblacional del calamar gigante (Dosidicus gigas) en el área de Santa Rosalía (región central del Golfo de California) durante 2003 y 2004 y se analizó la variabilidad interanual en la estructura de tallas durante un periodo más amplio, de 1996-2004 (excepto 2000-2002). Los resultados evidenciaron claras diferencias en la madurez sexual y en la estructura de tallas, tanto de machos así como de hembras, entre 2003 y 2004. La población de calamar gigante observada en la temporada de pesca de 2003 reflejó altas proporciones de individuos maduros y de gran tamaño, mientras que la observada en 2004 estuvo compuesta mayoritariamente por individuos sexualmente inmaduros y de menor tamaño. Al expandir nuestro periodo de estudio se observó la existencia de una fuerte variabilidad interanual en la estructura de tallas del calamar gigante dentro del Golfo de California, lo cual también se vio reflejado en la talla de madurez. Los cambios en la estructura poblacional del calamar gigante parecen estar relacionados no sólo con la ocurrencia de eventos El Niño sino también con la intensidad o magnitud de los mismos. Por tal motivo se recomienda tener en cuenta esta variabilidad al momento de implementar cada año la estrategia de manejo a utilizar en la pesquería de calamar gigante del Golfo de California.
Palabras clave: calamar gigante, Dosidicus gigas, estructura poblacional, variabilidad interanual, Golfo de California.
Abstract
This study describes the population structure of jumbo squid (Dosidicus gigas) in the area of Santa Rosalía (central Gulf of California) during the years 2003 and 2004, and analyzes the interannual variability in the size structure over a wider time period, 1996-2004 (except 2000-2002). The results revealed clear differences in the size structure and sexual maturity of males and females between 2003 and 2004. The jumbo squid population observed during the 2003 fishing season showed a high proportion of large and sexually mature individuals, whereas most specimens sampled during 2004 were smaller and immature. Expanding our time period, we observed a strong interannual variability in the size structure of jumbo squid within the Gulf of California, which was also reflected in the size at maturity. These changes in the population structure seem to be related to the occurrence and intensity of El Niño events. We recommend taking this variability into account at the beginning of each fishing season when the authorities establish the management strategy for the jumbo squid fishery in the Gulf of California.
Key words: jumbo squid, Dosidicus gigas, population structure, interannual variability, Gulf of California.
Introducción
El calamar gigante Dosidicus gigas (D'Orbigny 1835) es una especie endémica del Océano Pacífico oriental que se distribuye aproximadamente entre 40°N y 45°S (Nigmatullin et al. 2001). Constituye un importante recurso pesquero en el Golfo de California (Ehrhardt et al. 1983, Morales-Bojórquez et al. 2001), en la región del domo de Costa Rica (Ichii et al. 2002) y frente a las costas de Perú y Chile (Taipe et al. 2001).
Dosidicus gigas es un componente importante dentro del ecosistema del Golfo de California ya que sus juveniles pueden constituir una de las principales presas de tiburones (Aguilar-Castro y Galván-Magaña 2003) y grandes peces pelágicos (Abitia-Cárdenas et al. 1999, 2002; Rosas-Aloya et al. 2002), mientras que los adultos constituyen el principal alimento de los cachalotes (Ruiz-Cooley et al. 2004, Davis et al. 2007). A su vez, el calamar gigante es un predador activo que tiene gran impacto en los ecosistemas locales (Nigmatullin et al. 2001), alimentándose de peces mictófidos, calamares y crustáceos (Markaida y Sosa-Nishizaki 2003). Por todo lo anterior, D. gigas es considerada una especie clave dentro del funcionamiento trófico del Golfo de California (Rosas-Luis 2005).
La pesquería del calamar gigante en el Golfo de California se realiza en diferentes áreas según la época del año dependiendo de la distribución y disponibilidad del recurso. Desde 1994 se observa un patrón estacional bien marcado, localizándose en la región de Santa Rosalía durante los meses de verano (mayo a octubre) y en la región de Guaymas durante el invierno (noviembre a mayo) (Markaida y Sosa-Nishizaki 2001). Experimentos convencionales de marcado y recaptura han demostrado una migración recíproca y estacional de calamar entre ambas costas, lo cual define las temporadas de pesca mencionadas (Markaida et al. 2005).
Las capturas de calamar gigante de los últimos años reflejan la gran abundancia de esta especie y su importancia como recurso dentro del sistema productivo pesquero de México. Sin embargo, no se puede obviar la fuerte variabilidad interanual que se observa en la serie histórica de sus capturas (fig. 1). Hasta la fecha se desconocen las causas de esta variabilidad aunque algunos autores sugieren que puede estar relacionada con cambios en las condiciones ambientales u oceanográficas, como la ocurrencia de eventos El Niño (Lluch-Cota et al. 1999, Morales-Bojórquez et al. 2001, Nevárez-Martínez et al. 2002, Markaida 2006), mientras que otros sugieren que puede haber una relación con los patrones migratorios de alimentación, de reproducción o con el éxito en el reclutamiento (Klett-Traulsen 1981; Ehrhardt et al. 1982, 1986; Ramírez y Klett-Traulsen 1985).

Su estructura poblacional está compuesta por tres grupos de talla a la madurez: un grupo con ejemplares de tamaño pequeño (machos madurando a los 13-26 cm y hembras a los 14-34 cm de largo del manto, LM) principalmente en la región ecuatorial, otro grupo con ejemplares de tamaño mediano (2442 y 28-60 cm LM, respectivamente) en todo el rango de distribución de la especie, y un grupo de ejemplares grandes (>40-50 y >55-65 cm LM, respectivamente) en los extremos norte y sur del rango de distribución (Nesis 1983, Nigmatullin et al. 2001).
Existen antecedentes que indican que la estructura poblacional del calamar gigante dentro del Golfo de California puede variar considerablemente entre algunos años (Ramírez y Klett-Traulsen 1985, Markaida 2006). No obstante, aún no ha sido posible establecer patrones claros que reflejen dicha variabilidad interanual. Entre 1994 y 1997 la pesquería de calamar gigante dentro del Golfo de California estuvo operando sobre ejemplares de gran tamaño (hembras madurando a los 75 cm y machos a los 53-67 cm LM), con capturas que alcanzaron 108,000 y 121,000 toneladas en 1996 y 1997, respectivamente (Markaida y Sosa-Nishizaki 2001). Después de El Niño 1997-1998 la pesquería se desvaneció dentro del Golfo de California (Morales-Bojórquez et al. 2001). Dicho evento no sólo impactó la abundancia de calamar gigante sino también su estructura poblacional. En 1999 se observaron grandes cantidades de calamares madurando con tallas medianas (<45 cm LM) en varias regiones del golfo y las capturas alcanzaron las 58,000 toneladas (Markaida 2006). Luego de este periodo de transición se volvieron a observar calamares de gran tamaño en la pesquería durante el período 2000-2002 (Filauri 2005, Díaz-Uribe et al. 2006).
El presente estudio describe la estructura poblacional del calamar gigante D. gigas en el área de Santa Rosalía (región central del Golfo de California) durante 2003 y 2004. Además, se analiza la variabilidad interanual en la estructura de tallas durante el periodo 1996-2004, excepto los años 2000-2002.
Materiales y métodos
Durante las temporadas de pesca 2003 y 2004 se recolectaron muestras de calamar gigante en el área de Santa Rosalía, Baja California Sur, México (fig. 2). Cabe mencionar que el muestreo de noviembre de 2003 fue el único en el cual no se capturaron clamares (tabla 1). El método de captura fue el mismo que se utiliza en la pesquería artesanal de D. gigas con botes ("pangas") de 6-8 m y dos pescadores que operan manualmente líneas de pesca con poteras de 40 cm.

Se registró el sexo y el largo del manto (LM en centímetros) de cada calamar capturado. Además, se asignaron estadios de madurez sexual de acuerdo con la clasificación de Lipinski y Underhill (1995): I y II, inmaduro; III, madurando; IV y V, maduro; y VI, desovado.
La proporción de sexos se calculó para cada muestra y se aplicaron análisis χ2 para probar si existen desviaciones significativas del valor esperado 1:1 (hembras:machos). La talla media de madurez se estimó gráficamente ajustando curvas sigmoideas al porcentaje de individuos maduros en intervalos de talla de 2 cm y observando la talla cuando el 50% de los calamares estuvo maduro (LM50).
Los métodos estadísticos utilizados fueron no paramétricos debido a que no se cumplieron los supuestos de normalidad y homogeneidad de varianzas. Por un lado, se utilizaron análisis de varianza no paramétricos Kruskal-Wallis para detectar la existencia de diferencias significativas en la estructura de tallas de cada sexo según madurez sexual y temporada de pesca (año). De forma complementaria se aplicaron análisis a posteriori Mann-Whitney para detectar diferencias significativas entre años.
Para analizar la variabilidad interanual en la composición de tallas de calamar gigante se tomaron en cuenta los siguientes periodos: 1996-1997 (Markaida y Sosa-Nishizaki 2001), 1998-1999 (Markaida 2006) y 2003-2004. Cabe destacar que
existieron diferencias importantes en el tamaño de las muestras de algunos años debido a que la cobertura de los muestreos mensuales fue parcial en 1997 y también a la baja disponibilidad de calamar gigante en 1998.
Resultados
Proporción de sexos
Tanto en 2003 como en 2004 las hembras superaron significativamente a los machos (χ2, P < 0.05) y la proporción de sexos fue de 1.45:1 y de 1.72:1, respectivamente (tabla 1). Los muestreos mensuales registraron una fuerte variabilidad en la proporción de sexos, oscilando entre un máximo de 4.7:1 (agosto de 2004) y un mínimo de 0.8:1 (abril de 2004) (fig. 3). Las hembras superaron en número a los machos en la mayoría de los muestreos a excepción de octubre de 2003 y abril de 2004. No obstante, estas diferencias fueron significativas sólo en algunos meses (χ2, P < 0.05; tabla 1).

En todos los muestreos de 2003 y 2004 las hembras inmaduras superaron en número a los machos de la misma condición; sin embargo, las diferencias fueron significativas sólo en algunos meses (χ2, P < 0.05).
Durante 2003 las hembras madurando superaron en número a los machos de esa condición mientras que en 2004 se observó lo opuesto. De todas formas, las diferencias fueron significativas sólo en algunos meses (χ2, P < 0.05).
En la mayoría de los muestreos de 2003 y 2004 se observaron más machos maduros que hembras de esa condición. Sólo en los muestreos de agosto de 2003 y abril de 2004 las hembras superaron a los machos (fig. 3). Sin embargo, las diferencias entre machos y hembras no fueron significativas en ningún muestreo (χ2, P > 0.05).
El valor de la proporción de sexos de 2003 no difirió significativamente del obtenido en 2004 (χ2, P > 0.05). Esto se verificó tanto con los ejemplares inmaduros como con los ejemplares maduros. No obstante, en el caso de los ejemplares madurando la proporción de sexos de 2003 difirió significativamente del valor obtenido para 2004 (χ2, P < 0.05).
Madurez sexual
Hembras
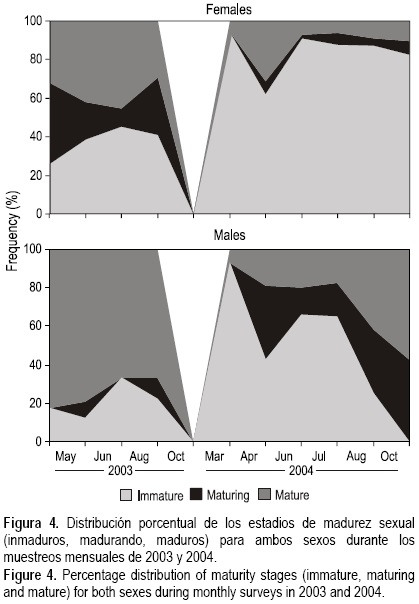
Durante la temporada de pesca de 2003 se observó una mayor proporción de hembras maduras y madurando en comparación con la temporada de pesca de 2004, en la cual se observó una fuerte dominancia de hembras inmaduras.
Los porcentajes de hembras inmaduras durante los muestreos de 2003 (26-45%) fueron menores a los valores de 2004 (63-94%). Por su parte, los porcentajes de hembras madurando durante los muestreos de 2003 (10-42%) fueron mayores a los de 2004 (0-7%). Los porcentajes de hembras maduras durante los muestreos de 2003 fueron superiores al 30%, con un máximo entre junio y agosto (42% y 45%, respectivamente), mientras que en los muestreos de 2004 las hembras maduras no superaron el 10% a excepción del mes de abril cuando alcanzaron el 31% (fig. 4). excepción de los últimos dos muéstreos (agosto y octubre) en los cuales se observó un aumento de machos madurando y maduros (fig. 4). Con respecto a los porcentajes de machos madurando durante los muestreos de 2003, los valores fueron muy bajos o incluso nulos en algunos muestreos (0-11%), mientras que los valores de 2004 fueron mayores y oscilaron en el rango 14-43%, con excepción del muestreo de marzo en el cual no se registraron machos madurando (fig. 4). La proporción de machos maduros fue dominante en todos los muestreos de 2003 (67-82%), mientras que para 2004 los valores fueron menores mostrando un aumento progresivo a lo largo de la temporada, con un mínimo en marzo (7%) y un máximo en octubre (57%) (fig. 4).
Composición de tallas
Tanto en 2003 como en 2004 la talla media de las hembras fue significativamente mayor a la de los machos (MannWhitney, P < 0.05). Esta característica se observó en todos los estadios de madurez sexual (inmaduros, madurando y maduros).
Hembras
Durante 2003 las hembras mostraron tallas (LM) entre 34 y 88 cm con una moda en 74 cm, mientras que en 2004 se observaron tallas más pequeñas, en el rango de 32 a 78 cm LM y una moda entre 52 y 58 cm (fig. 5). La talla media de las hembras en 2003 fue significativamente mayor (Mann-Whitney, P < 0.05) a la de 2004. Esta diferencia significativa se verificó con las hembras madurando y maduras, pero no en el caso de las hembras inmaduras.
Machos
Los machos analizados durante 2003 mostraron tallas (LM) entre 36 y 82 cm con una moda en 74 cm, mientras que en 2004 se observaron tallas más pequeñas, en el rango de 22 a 72 cm LM con una moda a los 50-54 cm (fig. 5). La talla media de los machos durante 2003 fue significativamente mayor (Mann-Whitney, P < 0.05) a la de 2004. Esta diferencia significativa se verificó exclusivamente con los machos maduros pero no en el caso de los inmaduros y madurando.
Talla media de madurez (LM50)
Durante 2003 las hembras maduraron a los 77 cm LM y los machos a los 57 cm LM, mientras que en 2004 las hembras maduraron a tallas menores (69 cm LM) y los machos a tallas levemente mayores (59 cm LM; fig. 6).

Variabilidad interanual de la estructura de tallas
Se observó una fuerte variabilidad interanual en la talla media, de machos y hembras, durante el periodo 1996-2004 (excepto 2000-2002). Los resultados del análisis de varianza no paramétrico Kruskal-Wallis mostraron diferencias muy significativas (P < 0.01) en las tallas medias según el sexo y la madurez sexual para todos los años considerados (tabla 2).
Durante los periodos 1996-1997 y 2003-2004, la pesquería de calamar gigante en Santa Rosalía estuvo dominada por calamares maduros de gran tamaño, mientras que en el periodo 1998-1999 se observaron calamares maduros de tamaño mediano (fig. 7).

Los análisis a posteriori Mann-Whitney se realizaron exclusivamente con las tallas medias de los ejemplares sexualmente maduros. La mayoría de dichos análisis registraron diferencias significativas (P < 0.05) entre los años considerados. Los únicos años en que se encontraron ejemplares maduros con tallas medias similares fueron 1996 y 1997 en el caso de las hembras y 1996, 1997 y 2004 en los machos.
Discusión
Los valores de la proporción de sexos obtenidos durante las temporadas de pesca 2003 y 2004 mostraron una clara dominancia de las hembras sobre los machos de D. gigas, tanto en el total de los ejemplares examinados así como en los ejemplares inmaduros y madurando (sólo en 2003). Sin embargo, el análisis con los ejemplares sexualmente maduros mostró lo opuesto, una dominancia de los machos sobre las hembras que podría estar indicando que la región de Santa Rosalía es principalmente un área de alimentación y no un área de reproducción. Esto fue sugerido previamente por Markaida y Sosa-Nishizaki (2001), quienes observaron resultados similares durante las temporadas de pesca 1995-1997, frente a Guaymas y Santa Rosalía (región central del Golfo de California).
Con respecto a la variabilidad de la proporción de sexos, en general no se observaron diferencias significativas entre 2003 y 2004 a excepción de los valores registrados para los ejemplares en proceso de maduración sexual. En 2003 las hembras madurando superaron significativamente a los machos, mientras que en 2004 se observó lo opuesto, una clara dominancia de los machos sobre las hembras en maduración. Se desconocen las posibles causas de esta variabilidad ya que los valores de la proporción de sexos calculados para los demás estadios de madurez sexual, así como para el total de ejemplares, no registraron diferencias significativas entre ambos años.
A lo largo de toda la temporada de pesca 2003 se observaron grandes proporciones de hembras maduras con un máximo durante junio y agosto. Por otro lado, los resultados obtenidos en la temporada 2004 reflejaron una disminución significativa en la proporción de hembras maduras con una baja presencia en todos los meses, excepto en abril, y una clara predominancia de hembras inmaduras. La presencia de hembras sexualmente activas durante la mayor parte del año sugiere la posibilidad de un amplio periodo reproductivo. Sin embargo, la imposibilidad de detectar un máximo reproductivo sustenta la idea de que el desove podría estar ocurriendo fuera de nuestra área de estudio. En este contexto, cabe destacar que ya se han recolectado algunas paralarvas de D. gigas en el área general de Santa Rosalía (identificación morfológica; datos inéditos) y en la cuenca de San Pedro Mártir (identificación molecular; Gilly et al. 2006). De todas formas, aún no se logra comprender claramente el significado de estos hallazgos y se requiere de más investigación a fin de poder detectar posibles áreas de desove. De hecho, se ha sugerido que el calamar gigante es una especie con desoves ocasionales en diferentes épocas del año y regiones, lo cual se refleja en una estructura poblacional compleja, con múltiples cohortes intra-anuales (Ehrhardt et al. 1983, Markaida et al. 2004, Filami 2005).
Los machos sexualmente maduros fueron dominantes en todos los muestreos de 2003, lo cual sugiere que están preparados para la reproducción durante gran parte del año. Sin embargo, en 2004 se observó una clara predominancia de machos inmaduros a excepción de los últimos dos muestreos mensuales (agosto y octubre). De esta forma, se evidencia una clara diferencia en la madurez sexual de los ejemplares de ambos sexos entre 2003 y 2004. La población de calamar gigante observada en la temporada 2003 reflejó altas proporciones de individuos maduros mientras que la observada en 2004 estuvo compuesta mayoritariamente por individuos sexualmente inmaduros. Estas diferencias también se vieron reflejadas en la estructura de tallas de machos y hembras, las cuales fueron significativamente mayores durante 2003.
Teniendo en cuenta la estructura poblacional del calamar gigante durante los periodos 1995-1997 y 1998-1999, se ha sugerido que El Niño 1997-1998 no sólo impactó la distribución y abundancia de calamar gigante dentro del golfo de California (Lluch-Cota et al. 1999, Nevárez-Martínez et al. 2002), sino que también afectó su estructura poblacional (Markaida 2006). Las capturas de D. gigas en el Golfo de California durante 1995-1997 estuvieron dominadas principalmente por individuos madurando a grandes tallas (Markaida y Sosa-Nishizaki 2001). Por otro lado, los estadios de madurez sexual de los calamares presentes en el Golfo de California durante 1998-1999 (posteriormente al evento El Niño) sugieren que éstos formarían parte del grupo de calamares madurando a tallas medianas (Markaida 2006). Luego de un periodo de transición, se desarrolló un evento La Niña, catalogado de moderado a fuerte, desde noviembre de 1998 hasta inicios de 2001 (Schwing et al. 2002). Al comienzo de 1999 se observaron calamares de tamaño mediano en el Golfo de California y para el año 2000 ya se estaban capturando nuevamente calamares de gran tamaño en el golfo (Markaida 2006). Aparentemente la talla de madurez reflejó un incremento gradual a partir de los tamaños medianos observados durante 1999 y esto podría estar indicando una readaptación a las condiciones existentes en el Golfo de California durante La Niña.
Según Filauri (2005), durante el periodo 2000-2002 la talla de madurez fue de 78.6 cm LM para las hembras y de 61.3 cm LM para los machos, lo cual indica la presencia de ejemplares madurando a grandes tallas. Por su parte, Díaz-Uribe et al. (2006) encontraron que la talla de madurez de las hembras durante las temporadas de pesca 2001 y 2002 fue de 74 cm LM. Los resultados reportados por estos autores son consistentes con los observados por Markaida y Sosa-Nishizaki (2001) durante 1996 y 1997, lo cual llevó a sugerir la existencia de una constancia en la talla de madurez y que podría suponer una estabilidad en la población de calamar gigante dentro del Golfo de California (Díaz-Uribe et al. 2006). Sin embargo, tanto los resultados obtenidos por Markaida (2006) como los nuestros demuestran claramente que dicha estabilidad no se cumple y que la talla de madurez ha variado significativamente durante dicho periodo.
Los resultados obtenidos en este trabajo reflejan una fuerte variabilidad interanual en la estructura de tallas del calamar gigante (machos y hembras) en la región de Santa Rosalía durante el periodo 1996-2004 (excepto de 2000-2002). Esta variabilidad muestra concordancia con la reportada por Nevárez-Martínez et al. (2006) sobre la costa este del Golfo de California en la región de Guaymas durante el periodo 19952002. De hecho, resulta lógico pensar en un paralelismo de este tipo teniendo en cuenta la migración recíproca y estacional que realiza el calamar gigante entre ambas costas o zonas de pesca (Markaida et al. 2005).
Durante el periodo 2002-2003 se registró la ocurrencia de un evento moderado El Niño en el Pacífico ecuatorial (McPhaden 2004). Las condiciones oceanográficas por debajo de los 100 m de profundidad en las aguas del Pacífico frente a la Península de Baja California sugieren la presencia de un evento El Niño débil (Durazo et al. 2005). La ocurrencia de este evento podría haber provocado cambios importantes en la abundancia y estructura poblacional del calamar gigante dentro del Golfo de California tales como los observados luego de El Niño 1997-1998. Sin embargo, nuestros resultados no reflejaron cambios drásticos en la estructura poblacional de calamar gigante. Las tallas de madurez calculadas para nuestro periodo de estudio (2003-2004) fueron similares a las reportadas por Filauri (2005) y Díaz-Uribe et al. (2006) previo a El Niño 2002-2003. Durante la temporada de pesca 2003 se observaron ejemplares madurando a grandes tallas (hembras a los 77 cm LM y machos a los 57 cm LM), mientras que durante la temporada de pesca 2004 se observó que las hembras maduraban a tallas menores (69 cm ML) y los machos a tallas ligeramente mayores (59 cm ML). Las capturas de calamar gigante dentro del golfo tampoco reflejaron cambios importantes en su disponibilidad (fig. 1). Al parecer los efectos que tuvo El Niño 2002-2003 sobre la población de calamar gigante en el Golfo de California no fueron tan intensos como los reportados durante El Niño 1997-1998. Una posible explicación a esta discrepancia hace referencia a que El Niño 2002-2003 fue catalogado como débil y que, además, se reportó la presencia de agua de origen subártico (baja salinidad y baja temperatura) en los primeros 100 m de la columna de agua (Durazo et al. 2005), lo cual puede haber matizado los efectos sobre el ecosistema del Golfo de California.
Según Nesis (1983) los grupos de calamar gigante de mayor tamaño son el resultado de habitar áreas con surgencia de aguas frías con abundante alimento y cuyas bajas temperaturas demoran el desarrollo sexual. La falta de productividad y la presencia de temperaturas superficiales cálidas como las observadas durante los eventos El Niño, podría favorecer el desarrollo de un grupo de calamares que maduran más tempranamente a tallas medianas en contraposición al grupo de calamares que maduran a grandes tallas que predomina en las aguas frías y ricas en alimentos (Anderson y Rodhouse 2001, Markaida et al. 2004). La dinámica poblacional de los cefalópodos parece estar determinada principalmente por una plasticidad fenotípica en respuesta a la variabilidad ambiental (Boyle y Boletzky 1996). Seguramente estos grupos de calamares que maduran a diferentes tallas presentan diferentes características en sus historias de vida. Por ejemplo, se han observado diferencias en los hábitos alimentarios de ambos grupos de calamares gigantes que podrían deberse a las diferencias en el tamaño (Markaida 2006).
Tanto los factores ambientales, así como los procesos que afectan el tamaño y la estructura poblacional de una especie (e.g., predación, inanición, competencia, éxito reproductivo, etc.) pueden variar considerablemente entre algunos años (Arkhipkin 2004, Pecl et al. 2004). De hecho, algunos aspectos de la dinámica poblacional del calamar gigante D. gigas (crecimiento, mortalidad y reclutamiento) han reflejado una alta plasticidad interanual (Nevárez-Martínez et al. 2006), producto de la respuesta fenotípica frente a factores bióticos (predadores y presas) y abióticos (ambientales). Dicha plasticidad interanual ya ha sido reportada en otras especies de calamares (Pecl et al. 2004) y está influenciada por numerosos factores, principalmente la cantidad y calidad de alimento, y la temperatura durante las primeras etapas de desarrollo cuando el crecimiento es de tipo exponencial. La ocurrencia de cambios en algunos de estos factores no sólo puede generar una gran variabilidad dentro de una misma cohorte sino que también puede provocar una importante variabilidad interanual.
Nuestros resultados indican la existencia de una fuerte variabilidad interanual en la estructura poblacional de calamar gigante dentro del Golfo de California, principalmente a nivel de la estructura de tallas y la madurez sexual, lo cual también se ve reflejado en la talla media de madurez. Los cambios en la abundancia y estructura poblacional del calamar gigante parecen estar relacionados no sólo a la ocurrencia de eventos El Niño sino también a la intensidad o magnitud de los mismos. Por tal motivo, se recomienda tener en cuenta esta variabilidad al momento de implementar en cada año la estrategia de manejo a utilizar en la pesquería de calamar gigante del Golfo de California.
La estrategia de manejo que se ha venido implementando en la pesquería de calamar gigante del Golfo de California desde 1994-1995 está basada en un método que contempla la existencia de una sola cohorte y utiliza como herramienta de manejo un escape proporcional del stock desovante, es decir de los ejemplares sexualmente activos o aptos para la reproducción (Hernández-Herrera et al. 1998, Nevárez-Martínez et al. 2000, Morales-Bojórquez et al. 2001). Dicha estrategia de manejo fue desarrollada originalmente para la pesquería del calamar Illex argentinus en las Islas Malvinas (Rosenberg et al. 1990) y busca regular el esfuerzo de pesca de tal forma que permita la supervivencia de un cierto porcentaje de la población para que pueda reproducirse. No obstante, en algunos años ha sido necesaria la implementación de otras medidas de manejo que aseguren la sustentabilidad del recurso. Por ejemplo, luego de la abrupta caída en las capturas de calamar gigante en 1998 y de la disminución observada en la talla media de los calamares, el Instituto Nacional de Pesca de México puso en práctica una veda por talla mínima (50 cm LM) a comienzos de 1999, la cual fue levantada en mayo luego de comprobar que en dicho año los calamares estaban madurando a tallas medianas (Markaida 2006). Tomando en cuenta estos antecedentes se hace evidente la necesidad de contar con estrategias de manejo alternativas más flexibles y que contemplen la existencia de múltiples cohortes en la pesquería del calamar gigante del Golfo de California.
Se recomienda continuar e intensificar los estudios para lograr un mejor entendimiento de los mecanismos a través de los cuales la población de calamar gigante responde frente a condiciones ambientales variables. Algunos factores tales como los cambios en la disponibilidad de presas o cambios en el hábitat reproductivo pueden contribuir a la plasticidad interanual observada en la población de calamar gigante del Golfo de California.
Agradecimientos
A los miembros del Grupo de Trabajo en Cefalópodos del Centro de Investigaciones Biológicas del Noroeste (CIBNOR): S Camarillo Coop, A Mejía Rebollo, R Rojo, N Dimate, R Rosas Luis, J Ramos y otros. A Prudencio (pescador de Santa Rosalía) y a su familia por la hospitalidad y la buena disposición para colaborar. Esta investigación fue financiada parcialmente por un proyecto del CIBNOR (clave 916-1). Finalmente, se agradece a N Burnett el apoyo económico ofrecido para la realización del presente estudio, el cual se enmarca dentro de la tesis de doctorado del primer autor.
Referencias
Abitia-Cárdenas L, Galván-Magaña F, Gutiérrez-Sánchez F, Rodríguez-Romero J, Aguilar-Palomino B, Moehl-Hitz A. 1999. Diet of blue marlin Makaira mazara off the coast of Cabo San Lucas, Baja California Sur, Mexico. Fish. Res. 44(1): 95-100. [ Links ]
Abitia-Cárdenas L, Muhlia-Melo A, Cruz-Escalona V, Galván-Magaña F. 2002. Trophic dynamics and seasonal energetics of striped marlin Tetrapturus audax in the southern Gulf of California, Mexico. Fish. Res. 57(3): 287-295. [ Links ]
Aguilar-Castro NA, Galván-Magaña F. 2003. Ecología trófica de juveniles del tiburón martillo Sphyrna lewini (Griffith y Smith 1834) en el Golfo de California. Resúmenes. Primer Foro de Intercambio Científico sobre Tiburones y Rayas: Biología, Ecología y Pesquerías. Guaymas (Sonora, México). [ Links ]
Anderson CIH, Rodhouse PG. 2001. Life cycles, oceanography and variability: Ommastrephid squid in variable oceanographic environments. Fish. Res. 54: 133-143. [ Links ]
Arkhipkin AI. 2004. Diversity in growth and longevity in short-lived animals: Squid of the suborder Oegopsina. In: Jackson GD, McGlashan DJ (eds.), Cephalopod Growth. Mar. Freshwat. Res. Spec. Issue 55(4): 341-355. [ Links ]
Boyle PR, Boletzky SV. 1996. Cephalopod populations: Definition and dynamics. Philos. Trans. R. Soc. Lond. B 351: 985-1002. [ Links ]
Davis RW, Jaquet N, Gendron D, Markaida U, Bazzino G, Gilly W. 2007. Diving behavior of sperm whales in relation to behavior of a major prey species, the jumbo squid, in the Gulf of California, Mexico. Mar. Ecol. Prog. Ser. 333: 291-302. [ Links ]
Díaz-Uribe JG, Hernández-Herrera A, Morales-Bojórquez E, Martínez-Aguilar S, Suárez-Higuera MC, Hernández-López A. 2006. Validación histológica de los estadios de madurez gonádica de las hembras de calamar gigante (Dosidicus gigas) en el Golfo de California, México. Cienc. Mar. 32(1A): 23-31. [ Links ]
Durazo R, Gaxiola-Castro G, Lavaniegos B, Castro-Valdez R, Gómez-Valdés J, Da S Mascarenhas Jr A. 2005. Oceanographic conditions west of the Baja California coast, 2002-2003: A weak El Niño and subarctic water enhancement. Cienc. Mar. 31(3): 537-552. [ Links ]
Ehrhardt NM, Jacquemin PS, González DG, Ulloa RP, García BF, Ortiz CJ, Solís NA. 1982. Descripción de la pesquería del calamar gigante Dosidicus gigas durante 1980 en el Golfo de California. Flota y poder de pesca. Cienc. Pesq. 3: 41-60. [ Links ]
Ehrhardt NM, Jacquemin PS, García BF, González DG, López BJM, Ortiz CJ, Solís NA. 1983. On the fishery and biology of the giant squid Dosidicus gigas in the Gulf of California, Mexico. In: Caddy JF (ed.), Advances in Assessment of World Cephalopod Resources. FAO Fish. Tech. Pap. 231: 306-340. [ Links ]
Ehrhardt NM, Solís NA, Jacquemin PS, Ortiz CJ, Ulloa RP, González DG, García BF. 1986. Análisis de la biología y condiciones del stock del calamar gigante Dosidicus gigas en el Golfo de California, México, durante 1980. Cienc. Pesq. 5: 63-76. [ Links ]
Filauri VN. 2005. Patrón de crecimiento y estructura poblacional del calamar gigante (Dosidicus gigas, Orbigny 1835) en la región central del Golfo de California. Tesis de maestría, Instituto de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México, Mazatlán, México, 59 pp. [ Links ]
Gilly WF, Elliger CA, Salinas CA, Camarillo-Coop S, Bazzino G, Beman M. 2006. Spawning by jumbo squid (Dosidicus gigas) in the San Pedro Mártir Basin, Gulf of California, Mexico. Mar. Ecol. Prog. Ser. 313: 125-133. [ Links ]
Hernández-Herrera A, Morales-Bojórquez E, Cisneros M, Nevárez-Martínez M, Rivera I. 1998. Management strategy for the giant squid (Dosidicus gigas) from the Gulf of California, Mexico. CalCOFI Rep. 39: 212-218. [ Links ]
Ichii T, Mahapatra K, Watanabe T, Yatsu A, Inagake D, Okada Y. 2002. Occurrence of jumbo flying squid Dosidicus gigas aggregations associated with the countercurrent ridge off the Costa Rica Dome during 1997 El Niño and 1999 La Niña. Mar. Ecol. Prog. Ser. 231: 151-166. [ Links ]
Klett-Traulsen A. 1981. Estado actual de la pesquería del calamar gigante en el estado de Baja California Sur. Ser. Cient. Depto. Pesca (México) 21: 1-28. [ Links ]
Lipinski MR, Underhill LG. 1995. Sexual maturation in squid: Quantum or continuum? S. Afr. J. Mar. Sci. 15: 207-223. [ Links ]
Lluch-Cota D, Lluch-Belda D, Lluch-Cota S, López-Martínez J, Nevárez-Martínez M, Ponce-Díaz G, Salinas-Zavala G, Vega-Velazquez A, Lara-Lara JR, Hammann G, Morales J. 1999. Las pesquerías y El Niño. En: Magaña-Rueda VO (ed.), Los Impactos de El Niño en México. DGPC-SG-UNAM-IAI-SEP-CONACYT, México, pp. 137-178. [ Links ]
Markaida U. 2006. Population structure and reproductive biology of jumbo squid Dosidicus gigas from the Gulf of California after the 1997-1998 El Niño event. Fish. Res. 79(1-2): 28-37. [ Links ]
Markaida U, Sosa-Nishizaki O. 2001. Reproductive biology of jumbo squid Dosidicus gigas in the Gulf of California, 1995-1997. Fish. Res. 54(1): 63-82. [ Links ]
Markaida U, Sosa-Nishizaki O. 2003. Food and feeding habits of jumbo squid Dosidicus gigas (Cephalopoda: Ommastrephidae) from the Gulf of California, Mexico. J. Mar. Biol. Assoc. UK 83: 507-522. [ Links ]
Markaida U, Quiñónez-Velázquez C, Sosa-Nishizaki O. 2004. Age, growth and maturation of jumbo squid Dosidicus gigas (Cephalopoda: Ommastrephidae) from the Gulf of California Mexico. Fish. Res. 66: 31-47. [ Links ]
Markaida U, Rosenthal JJC, Gilly WF. 2005. Tagging studies on the jumbo squid, Dosidicus gigas, in the Gulf of California, Mexico. Fish. Bull. 103(1): 219-226. [ Links ]
McPhaden MJ. 2004. Evolution of the 2002-2003 El Niño. Bull. Am. Meteor. Soc. 85, 677, doi:10.1175/BAMS-85-5-677. [ Links ]
Morales-Bojórquez E, Cisneros-Mata MA, Nevárez-Martínez MO, Hernández-Herrera A. 2001. Review of stock assessment and fishery biology of Dosidicus gigas in the Gulf of California, Mexico. Fish. Res. 54: 83-94. [ Links ]
Nesis KN. 1983. Dosidicus gigas. In: Boyle PR (ed.), Cephalopod Life Cycles. Vol. I. Species Accounts. Academic Press, pp. 215-231. [ Links ]
Nevárez-Martínez MO, Hernández-Herrera A, Morales-Bojórquez E, Balmori-Ramírez A, Cisneros-Mata MA, Morales-Azpeitia R. 2000. Biomass and distribution of the jumbo squid (Dosidicus gigas) in the Gulf of California, México. Fish. Res. 49: 129-140. [ Links ]
Nevárez-Martínez MO, Rivera-Parra GI, Moralez-Bojórquez E, López-Martínez J, Lluch-Belda DB, Miranda-Mier E, Cervantes-Valle C. 2002. The jumbo squid Dosidicus gigas fishery of the Gulf of California and its relation to environmental variability. In: Salinas S, Urban JH, Arntz WE (eds.), Extended Abstracts of the El Niño Symposium & Workshop. Invest. Mar. 30(1): 193-194. [ Links ]
Nevárez-Martínez MO, Méndez-Tenorio FJ, Cervantes-Valle C, López-Martínez J, Anguiano-Carrasco ML. 2006. Growth, mortality, recruitment, and yield of the jumbo squid (Dosidicus gigas) off Guaymas, Mexico. Fish. Res. 79: 38-47. [ Links ]
Nigmatullin CM, Nesis KN, Arkhipkin AI. 2001. A review of the biology of the jumbo squid Dosidicus gigas (Cephalopoda: Ommastrephidae). Fish. Res. 54: 9-19. [ Links ]
Pecl GT, Moltschaniwskyj NA, Tracey SR, Jordan AR. 2004. Inter-annual plasticity of squid life history and population structure: Ecological and management implications. Oecologia 139(4): 515-524. [ Links ]
Ramírez RM, Klett-Traulsen TA. 1985. Composición de la captura del calamar gigante en el Golfo de California durante 1981. Trans. CIBCASIO X: 123-137. [ Links ]
Rosas-Aloya J, Hernández-Herrera A, Galván-Magaña F, Abitia-Cárdenas L, Muhlia-Melo A. 2002. Diet composition of sailfish (Istiophorus platypterus) from the southern Gulf of California, Mexico. Fish. Res. 57(2): 185-195. [ Links ]
Rosas-Luis R. 2005. Importancia del calamar gigante Dosidicus gigas (D'Orbigny 1835) en la estructura trófica del ecosistema pelágico de la porción central del Golfo de California. Tesis de licenciatura, Universidad Autónoma de Baja California Sur, México,75 pp. [ Links ]
Rosenberg AA, Kirkwood GP, Crombie JA, Beddington JR. 1990. The assessment of stocks of annual squid species. Fish. Res. 8: 335-350. [ Links ]
Ruiz-Cooley RI, Gendron D, Aguíñiga S, Mesnick S, Carriquiry JD. 2004. Trophic relationships between sperm whales and jumbo squid using stable isotope of C and N. Mar. Ecol. Prog. Ser. 277: 275-283. [ Links ]
Schwing FB, Murphree T, deWitt L, Green PM. 2002. The evolution of oceanic and atmospheric anomalies in the northeast Pacific during the El Niño events of 1995-2001. Prog. Oceanogr. 54: 459-491. [ Links ]
Taipe A, Yamashiro C, Mariategui L, Rojas P, Roque C. 2001. Distribution and concentrations of jumbo flying squid (Dosidicus gigas) off the Peruvian coast between 1991 and 1999. Fish. Res. 54: 21-482. [ Links ]














