Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Ciencias marinas
Print version ISSN 0185-3880
Cienc. mar vol.33 n.1 Ensenada Mar. 2007
Artículos
Biología reproductiva del asteroideo de mar profundo Henricia abyssicola en el Atlántico NE
Reproductive biology of the deep-sea asteroid Henricia abyssicola from the NE Atlantic Ocean
F Benítez-Villalobos1*, JP Díaz-Martínez1, PA Tyler2
1 Universidad del Mar, Carretera a Zipolite Km 1.5, Puerto Ángel CP 70902, Oaxaca, México. *E-mail: fbv@angel.umar.mx.
2 School of Ocean and Earth Science, University of Southampton NOCS, Southampton SO143ZH, UK.
Recibido en marzo de 2006;
Aceptado en diciembre de 2006.
Resumen
Se determinó la biología reproductiva del asteroideo del Atlántico Norte Henricia abyssicola a partir de series de tiempos de muestras tomadas entre 1250 y 1900 m de profundidad en la Ensenada Marina Porcupine (Atlántico NE). Se determinaron la proporción de machos y hembras, el índice gonadosomático (IG), el índice de ciego pilórico (ICP), la fecundidad y la distribución de tallas de huevo y los resultados se corroboraron mediante examen histológico de las gónadas. Henricia abyssicola es un asteroideo gonocórico y la proporción de machos y hembras no difiere significativamente de la igualdad. La oogénesis es asincrónica. Los oocitos previtelogénicos crecen a una talla de ~230 μm antes de comenzar la vitelogénesis. La talla máxima de oocitos fue ~970 μm. El volumen del ovario se encuentra principalmente ocupado por oocitos vitelogénicos grandes (400-500 μm) en cualquier tiempo. No hubo variación estacional en los valores de IG, ICP y fecundidad; sin embargo, hubo variaciones en la producción de oocitos vitelogénicos de H. abyssicola sobrepuesta en la reproducción continua. Se propone que H. abyssicola hace uso de la fuente de energía proporcionada por la deposición de fitodetritus almacenándola en los oocitos en desarrollo y podría tener el beneficio de una larva planctotrófica facultativa.
Palabras clave: reproducción en invertebrados marinos, Asteroidea, biología de equinodermos, biología en mar profundo, Atlántico NE.
Abstract
The reproductive biology of the North Atlantic asteroid Henricia abyssicola is determined in time series samples taken from 1250 to 1900 m depth in the Porcupine Seabight (NE Atlantic). The male-female ratio, gonadosomatic index (GI), pyloric caecum index (PCI), fecundity and oocyte size distribution were determined and the results were corroborated by histological examination of the gonads. This species is a gonochoric asteroid and the male-female ratio did not differ significantly from the equality. Oogenesis was asynchronous. The previtellogenic oocytes grow to a size of ~230 μm before undergoing vitellogenesis. Maximum oocyte size was ~970 μm. The ovary volume was mainly occupied by large vitellogenic oocytes (400-500 μm) at any time. There were no seasonal variations in GI, PCI and fecundity. There were, however, variations in the production of vitellogenic oocytes of H. abyssicola superimposed on the continuous reproduction. We suggest that H. abyssicola makes use of the energy source provided by the deposition of phytodetritus by storing it in the developing oocytes and that it might have the benefit of a facultative planktotrophic larva.
Key words: marine invertebrate reproduction, Asteroidea, echinoderm biology, deep-sea biology, NE Atlantic.
Introducción
El examen detallado de la gametogénesis en una variedad de especies de asteroideos indica que existen dos métodos distintos de reproducción. Por un lado, el tamaño de los oocitos puede ser grande y la fecundidad baja, sin evidencia de estacionalidad, indicando desarrollo directo, lecitotrófico y posiblemente demersal (Tyler et al. 1982a). (Aunque Pearse et al. 1991 mostraron la existencia de formas de reproducción pelágica lecitotrófica en asteroideos Antarticos.) Por otra parte, el tamaño pequeño de los oocitos, la alta fecundidad y una aparente estacionalidad en la reproducción de las especies indica un desarrollo pelágico, planctotrófico (Tyler y Pain 1982a). Esta última estrategia se observa en una variedad de asteroideos de aguas someras, mientras que la presencia de oocitos grandes y fecundidad reducida es más común en especies de mar profundo (Tyler et al. 1982a).
A pesar de que la aparente constancia del ambiente debajo de la termoclina permanente indicaba que no era posible esperar que allí ocurriera una reproducción de tipo estacional y algunos datos para especies de equinodermos (ofiuroideos) en general soportaban esta suposición, a principios de la década de los ochenta se publicó una serie de artículos identificando reproducción estacional en varios equinodermos provenientes de muestras tomadas en series de tiempos entre 2200 y 2900 m de profundidad en Rockall Trough, en el Atlántico NE. Las especies que mostraban estacionalidad en la reproducción incluían a Ophiura ljungmani (Tyler y Gage 1980), Plutonaster bifrons (Tyler y Pain 1982a) y Echinus affinis (Tyler y Gage 1984). Posteriormente se ha demostrado que especies de otros filos de la zona batial del Atlántico NE exhiben una reproducción estacional (Van-Praet y Duchateau 1984, Harrison 1988, Van-Praet 1989). A principios de los años noventa se publicó un artículo mostrando la reproducción estacional en el asteroideo abisal Dytaster grandis en el Atlántico NE (Tyler et al. 1990).
El presente trabajo presenta el análisis del ciclo gametogénico de Henricia abyssicola, una especie de asteroideo perteneciente a la familia Echinasteridae, y que ha sido descrita como sinónima de Henricia cylindrella (Sladen) por Clark y Downey (1992). Esta especie se encuentra desde la parte norte de Rockall Trough hacia el sur hasta la Ensenada Marina Porcupine, al SW de Irlanda. Probablemente su distribución se extiende hasta Marruecos y las Islas Azores. Clark y Downey (1992) establecieron su distribución vertical entre 1015 y 1380 m de profundidad, pero Howell et al. (2002) demostraron un intervalo de profundidad para adultos de esta especie entre 1080 y 1910 m, siendo 1050-1150 m la profundidad de máxima abundancia.
Material y métodos
Los especímenes analizados en este trabajo pertenecen a la colección Discovery depositada en el National Oceanography Centre en Southampton (NOCS), Inglaterra. Este material fue recolectado en muestreos de series de tiempo entre 1979 y 1984 a una profundidad de 1250 a 1900 m en la Ensenada Marina Porcupine (Atlántico NE). Las muestras cubren diferentes meses del año, aunque no todas provienen del mismo año. Todas las muestras fueron recolectadas usando una red de arrastre de puertas (OTSB14). Los especímenes fueron fijados primero en formalina al 10% y después transferidos a alcohol al 70% para su preservación. Se considera que este método de fijación no tiene efectos en el análisis histológico, ya que ha sido ampliamente usado en estudios anteriores acerca de biología reproductiva de equinodermos (Scheibling 1981; Pain et al. 1982a, b; Tyler y Pain 1982a, b; Tyler et al. 1982 a, b; Tyler et al. 1990; Carvalho y Ventura 2002; Ramirez-Llodra et al. 2002) y no se ha reportado algún impacto en los tejidos de los especímenes.
Los animales completos fueron secados y pesados. Las gónadas y ciegos pilóricos de cinco brazos de 5 a 10 especímenes por muestra fueron disectados mediante una incisión en la zona oral del disco a lo largo de cada radio. Cada órgano fue secado y pesado separadamente.
El índice gonadosomático (PG/PT x 100) e índice de ciego pilórico (PCP/PT x 100) fueron calculados para cada individuo a partir del peso total corporal y el peso de cada órgano. Los datos fueron sumados para cada muestra y se calculó la media y límite de confianza al 95%.
Las gónadas fueron disectadas y procesadas para histología. La oogénesis y la espermatogénesis fueron descritas a partir de cortes histológicos. Al menos 100 oocitos por gónada que hubieran sido seccionados a través del núcleo fueron medidos (diámetro de Feret), usando el paquete de análisis de imágenes Matrox Rainbow Runner/SigmaScan Pro 4. Se construyeron diagramas de frecuencia de talla de oocitos para identificar posible evidencia de reproducción estacional. Para realizar la comparación de los datos de frecuencia de tallas de oocitos a partir de muestras de diferentes años, los datos fueron graficados en clases de 100 μm y como un solo año "compuesto". Dos laminillas por macho fueron preparadas para identificar el estadio de desarrollo del esperma. De cada laminilla se midieron 50 espermatogonias, 50 espermatocitos y 50 espermatozoos y sus datos se promediaron.
Se calculó el volumen de los ovarios a una precisión de 0.001 mL mediante el método de desplazamiento de fluido, usando la variación del balance hidrostático de Mohr-Westphal (Scherle 1970). Posteriormente las gónadas fueron procesadas mediante el método de parafina, se cortaron en secciones de 7 μm de grosor al microtomo y se tiñeron con hematoxilina y eosina.
La fecundidad fue cuantificada como el número de oocitos vitelogénicos por hembra (fecundidad real), a partir del volumen medio de oocitos y el volumen del ovario en cada hembra. El volumen de los oocitos (OV) fue calculado suponiendo una forma esférica [OV = (4 × π × R3)/3] y promediando. Se estimó el volumen del fluido gonadal que se solidifica durante la fijación a partir de 10 laminillas en 10 hembras, como ha sido propuesto por Ramirez-Llodra et al. (2002) y se concluyó que ocupa aproximadamente el 15% del volumen gonadal. Este porcentaje fue sustraído del volumen total de la gónada al hacer los cálculos.
La fecundidad se estimó mediante el siguiente cálculo:
Fvo = Vg /Vvo + (Vpvo × P)
donde Vg es el volumen de la gónada, Vpvo es el volumen medio de un oocito previtelogénico, Vvo es el volumen medio de un oocito vitelogénico y P es la relación entre oocitos vitelogénicos y previtelogénicos: P = Npvo/Nvo, donde Npvo es el número de oocitos previtelogénicos contados en una submuestra de 100 oocitos por gónada y Nvo es el número de oocitos vitelogénicos contados en una submuestra de 100 oocitos por gónada.
Resultados
Henricia abyssicola es un asteroideo gonocórico (tabla 1). La proporción de machos con hembras no difiere significativamente de la igualdad (χ2 = 0.77, g.l. = 1, P > 0.05).
Morfología gonadal
Las gónadas mostraron en general una morfología interna y externa similar. Existen cinco pares de gónadas por individuo, cada par localizado el la parte proximal de cada brazo entre la pared corporal y el estómago. Cada par de gónadas se encuentra suspendido en el celoma y unido a la pared corporal mediante un gonoducto corto que se abre en un gonoporo, localizado en la intersección de la superficie dorsal del brazo y las placas laterales, a corta distancia del interradio. Los ovarios son racimos de color naranja brillante y los testículos son racimos de túbulos nodulares de color crema pálido.
Microscópicamente tanto ovarios como testículos mostraron la típica estructura de la pared gonadal de asteroideos (Walker 1974) con un saco externo y un saco interno separados por el seno perihemal (figs. 1, 2).
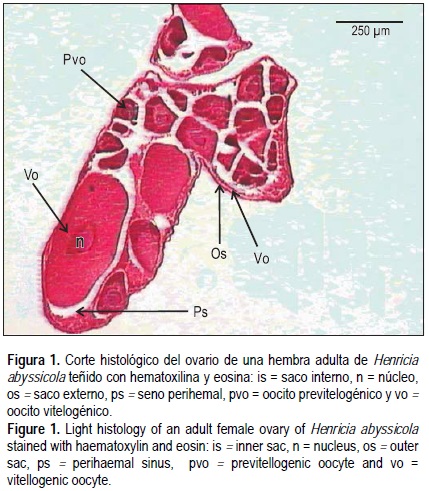

Oogénesis
Dentro de los ovarios las oogonias en crecimiento forraban el epitelio germinal. Las oogonias son las células más pequeñas (<50 μm) y presentan un núcleo grande que ocupa casi la mitad del diámetro de la célula. Los oocitos previtelogénicos se caracterizan por un núcleo central grande con un nucleolo excéntrico. El citoplasma es basófilo. Cuando los oocitos alcanzan un diámetro aproximado de 230 μm comienza la vitelogénesis. Los oocitos vitelogénicos presentan un núcleo excéntrico y citoplasma acidófilo (fig 1). La talla máxima de los oocitos maduros fue aproximadamente 970 μm.
En machos el epitelio germinal produce una densa capa de espermatogonias con un diámetro de 3.3 μm aproximadamente (fig. 2). Las espermatogonias se desarrollan en espermatocitos que tienen alrededor de 2 μm de diámetro y conforme proliferan se desarrollan en colonetes como se observa en una variedad de testículos de asteroideos (Walker 1974, Tyler et al. 1982). De los ápices de los colonetes se diferencian espermátidas que se desarrollan en espermatozoos (aproximadamente 1.5 μm) y éstos se acumulan como una densa masa de gametos maduros en el lumen de los testículos (fig. 2).
Indice gonadosomático (IG)
La media (± desviación estándar) del IG de H. abyssicola fue 5.6 ± 1.5 (n = 53) para hembras y 4.9 ± 1.9 (n = 52) para machos. Se observaron picos anuales en el IG en mayo y noviembre. El pico de mayo fue seguido por una marcada caída en los valores del IG, probablemente indicando un periodo importante de desove entre junio y julio. Los valores comienzan a incrementarse en agosto. No hubo muestreos de diciembre a febrero, por lo tanto no fue posible describir la conducta del IG después del pico de noviembre (fig. 3). El ANOVA mostró que las variaciones mensuales en el IG no fueron significativamente diferentes en hembras ni en machos (F = 6.608, g.l. = 5, P > 0.05 para hembras, y F = 4.965, g.l. = 5, P > 0.05 para machos), y el traslapo considerable de los limites de confianza al 95% sugiere que no existe sincronía en el desarrollo de los ovarios entre muestras.

Indice de ciego pilórico (ICP)
La media (± desviación estándar) del ICP de H. abyssicola fue 27.8 ± 10.3 (n = 53) para hembras y 24.1 ± 9.4 (n = 52) para machos. La tendencia de este índice fue similar a la del IG, mostrando los dos picos anuales ocurridos en mayo y noviembre, y el pico de mayo seguido por una marcada caída en los valores del índice (fig. 4). El ANOVA mostró que las variaciones mensuales del ICP para machos o hembras no fueron significativamente diferentes (F = 4.965, g.l. = 5, P > 0.05 para hembras, y F = 3.682, g.l. = 5, P > 0.05 para machos), por lo tanto no hay signos de un ciclo pilórico, indicando un almacenamiento continuo de nutrientes y una constante movilización de éstos hacia las gónadas a lo largo del año.

Fecundidad
La fecundidad real media de H. abyssicola fue 7400 ± 750 (n = 53) oocitos por hembra. No hubo diferencias significativas entre las muestras (ANOVA, F = 5.318, g.l. = 5, P > 0.05), indicando que esta especie tiene una producción relativamente constante de oocitos vitelogénicos a lo largo del año.
Distribucion de las tallas de oocitos
La oogénesis en H. abyssicola fue asincrónica, con producción de oocitos vitelogénicos a lo largo del año y los individuos mostraron un intervalo amplio de desarrollo de los oocitos independientemente del periodo de muestreo (fig. 5). Existe un amplio intervalo de tallas de oocitos con una alta proporción (10-56%) de oocitos previtelogénicos (<200 μm) con un pico (56%) en julio. El porcentaje de oocitos vitelogénicos grandes, principalmente en el intervalo de clase de 500 um, mostró un pico en mayo (20%) seguido por los valores mas bajos en julio, probablemente indicando un periodo de desove entre junio y julio, lo cual coincidió con los valores más bajos del IG. Después de julio la proporción de oocitos vitelogénicos grandes mostró un incremento constante en agosto (6%), octubre (8%) y noviembre (14%). En los machos los testículos tuvieron un suministro constante de espermatozoides a lo largo del año.
Discusión
La reproducción en asteroideos de mar profundo muestra una amplia variedad de patrones (Madsen 1961; Pain et al. 1982a, b; Tyler y Pain 1982a, b; Tyler et al. 1982a-c, 1990, 1993). En la mayoría de las especies de mar profundo la gametogénesis es asincrónica, conduciendo a una producción cuasicontinua de un número relativamente pequeño de oocitos grandes, lo cual indica un desarrollo lecitotrófico o directo. Por otra parte, se ha observado que unas cuantas especies de mar profundo producen un gran número de oocitos pequeños en un patrón estacional. La reproducción de estos asteroideos aparentemente está estrechamente relacionada con la deposición estacional de fitodetritus en el Atlántico NE (revisado por Tyler 1988).
El ciclo gametogénico de H. abyssicola es similar al de las especies confamiliares Hymenaster membranaceus y H. gennaeus (Pain et al. 1982b) y la mayoría de los astroideos estudiados en el Atlántico NE (Tyler y Pain 1982a, b; Tyler et al. 1990). En contraste, Henricia abyssicola también exhibe algunas diferencias cuando se le compara con las confamiliares Hymenaster membranaceus y H. gennaeus y sus patrones reproductivos tienen algunas similitudes a la estrella de lodo Ctenodiscus crispatus (Paxillosida: Goniopectinidae). Shick et al. (1981) observaron variaciones en la intensidad reproductiva de C. crispatus sobrepuestas en la reproducción continua. Esta especie presenta gametogénesis asincrónica con al menos algunos individuos reproduciéndose en cualquier estación del año, fecundidad baja, tamaño de huevo relativamente grande (hasta 400 μm) y una ligera variabilidad en el rendimiento reproductivo entre los meses, sobrepuesto en la reproducción continua e incrementado después de los florecimientos de fitoplancton de primavera y otoño.
En el mar profundo la reproducción estacional es interpretada como la producción de un estadio larval planctotrófico, el cual se encuentra presente en la columna de agua durante el periodo de flujo de fitodetritus hacia el fondo. El detritus puede actuar como una fuente de energía para la larva en proceso de alimentación, permitiendo un desarrollo óptimo y reduciendo la mortalidad larval, pero también puede incrementar la probabilidad de que la larva reubique el hábitat de los adultos (Barker 1979, Tyler y Gage 1980, Tyler y Pain 1982, Tyler et al. 1990).
La Ensenada Marina Porcupine y la planicie abisal del mismo nombre están sujetas a una mezcla profunda de la columna de agua hasta unos 500 m de profundidad en invierno. Esta mezcla permite un enriquecimiento de las aguas superficiales con nutrientes. Subsecuentemente hay cambios estacionales significativos en la productividad de la superficie que conducen a un fuerte pulso de fitodetritus hacia el fondo marino entre abril y septiembre siguiendo al florecimiento fito-planctónico de primavera en la superficie (Rice et al. 1994). Debido a que el hundimiento rápido del fitodetritus evita su completa utilización por planctótrofos pelágicos, el arribo de este material orgánico al fondo proporciona a las comunidades del mar profundo una fuente de alimento de alta calidad (Gooday y Turley 1990, Beaulieu y Smith 1998, Ginger et al. 2000).
La deposición de fitodetritus en el fondo marino puede también proporcionar una fuente intermitente de alimento lábil para las estrellas adultas (Billet et al. 1983, Rice et al. 1986). Se propone, de acuerdo a las características reproductivas de Henricia abyssicola, que en esta especie los adultos hacen uso de la fuente energética representada por el fitodetritus y los efectos se ven reflejados en los oocitos en desarrollo. Se observaron dos picos en los valores del IG en los meses de mayo y noviembre. Al pico de mayo siguió una disminución considerable en el IG, probablemente indicando un incremento importante en la liberación de gametos entre junio y julio. Algunos registros históricos del flujo descendente de fito-detritus en la Planicie Abisal Porcupine indican que es entre mayo y agosto cuando el fitodetritus alcanza el fondo marino a una profundidad aproximada de 3000 m (Lampitt et al. 2003) (fig. 6). Los valores de la fecundidad muestran la misma tendencia que el IG y el patrón de la proporción de tallas de oocitos a lo largo del año se asemeja de manera general al observado en especies de aguas someras que se reproducen estacionalmente. El porcentaje de oocitos vitelogénicos grandes, principalmente en el intervalo de clase de 500 um, presenta un pico en mayo (20%), seguido por el valor más bajo en julio (2%) cuando en las gónadas había principalmente oocitos previtelogénicos.

Howell et al. (2002) definieron la zona donde habita H. abyssicola (700-1100 m de profundidad) como la zona batial superior, que se caracteriza por una rápida sucesión de las especies, en las cuales se observan intervalos batimétricos totales estrechos de los adultos. El límite de los 1100 m en esta zona se encuentra asociado con cambios en las corrientes (McMahon et al. 1995, New y Smythe-Wright 2001). Flach et al. (1998) propusieron que la variabilidad en las corrientes tiene un efecto importante en el transporte de sedimento, el suministro de alimento y la dispersión de larvas, que afecta la zonación de asteroideos, particularmente de las especies suspensívoras.
Lampitt et al. (2003) realizaron estudios en el Atlántico NE acerca del flujo descendente de fitodetritus en la Planicie Abisal Porcupine, y concluyeron que existe una fuerte señal estacional en el flujo a 3000 m de profundidad relacionada con procesos en la superficie del océano y que los cambios importantes en la estructura de los ecosistemas bénticos no se relacionan con variaciones en las cantidades, sino más bien con los cambios cualitativos en el material que se hunde. Cuatro especies de asteroideos que habitan esta zona (Brisingella coronata, Henricia abyssicola, Poraniomorpha hispida rosea y Cheiraster sepitus) exhiben hábitos alimenticios similares, relacionados de forma directa o indirecta con la disponibilidad de material en suspensión (Pawson 1976, Rowe y Staresinic 1979, Jangoux 1982, Clark y Downey 1994). Por lo tanto, las especies de asteroideos que habitan esta zona básicamente son suspensívoras, aprovechando además las grandes agregaciones de organismos sésiles, especialmente esponjas. Aparentemente la disponibilidad de alimento y sus hábitos alimenticios tienen efecto en sus características reproductivas, mostrando una marcada tendencia a la estrategia oportunista descrita por Winemiller y Rose (1992). Estas especies poseen un tamaño corporal pequeño, fecundidad baja por evento de desove y reproducción no estacional (Benítez-Villalobos 2005), así como probablemente también múltiple frecuencia de desove, aunque el tamaño grande de huevo aparentemente sigue la tendencia general en aguas frías, para proporcionar a las larvas lecitotróficas energía suficiente para una probabilidad alta de supervivencia.
Existen invertebrados marinos que poseen larvas lecitotróficas que también son capaces de alimentarse de fitoplancton (Hadfield y Strathmann 1996). Un ejemplo de planctotrofía facultativa observada en un equinodermo es el equinoideo Clypeaster subdepressus (Emlet 1986), el cual posee una larva lecitotrófica que ingiere fitoplancton si éste se encuentra presente. La planctotrofía facultativa confiere flexibilidad a las especies en las cuales ocurre, permitiendo a las larvas meta-morfizarse pronto después de la eclosión y tener reclutamiento en las poblaciones cercanas de adultos (Hadfield y Strathmann 1996). El incremento estacional en la disponibilidad de alimento en la zona batial de la Ensenada Marina Porcupine pudiera permitir a H. abyssicola tener una larva planctotrófica facultativa, la cual tomaría ventaja de dicho incremento, aunque probablemente la calidad del material que llega no permite a esta especie cambiar su estrategia reproductiva a estrictamente estacional y aún conserva la reproducción continua. Se requiere de más estudios en la biología larvaria de esta especie para comprobar lo que este artículo propone.
Referencias
Barker MF. 1979. Breeding and recruitment in a population of the New Zealand starfish Stichaster australis (Verrill). J. Exp. Mar. Biol. Ecol. 41: 195-211. [ Links ]
Beaulieau SE, Smith KL. 1998. Phytodetritus entering the benthic boundary layer and aggregated on the sea floor in the abyssal NE Pacific: macro- and microscopic composition. Deep-Sea Res II 45: 781-815. [ Links ]
Benitez-Villalobos F. 2005. Reproduction and larval biology of North Atlantic asteroids related to the invasion of the deep sea. PhD dissertation, University of Southampton, UK. [ Links ]
Billett DSM, Lampitt RS, Rice AL, Mantoura RFC. 1983. Seasonal sedimentation of phytoplankton to the deep-sea benthos. Nature 302: 520-522. [ Links ]
Carvalho ALPS, Ventura CRR. 2002. The reproductive cycle of Asterina stellifera (Möbius) (Echinodermata: Astaroidea) in the Cabo Frio region, southeastern Brazil. Mar. Biol. 141: 947-954. [ Links ]
Clark AM, Downey ME. 1992. Starfishes of the Atlantic. Chapman & Hall, London. [ Links ]
Emlet RB. 1986. Facultative planktotrophy in the tropical echinoid Clypeaster subdepressus (Gray) (Clypeasteroida: Echinoida). J. Exp. Mar. Biol. Ecol. 95: 183-202. [ Links ]
Flach E, Lavaleye M, deStigter H, Thomsen L. 1998. Feeding types of the benthic community and particle transport across the slope of a NW European continental margin (Goban Spur). Prog. Oceanogr. 42: 209-231. [ Links ]
Ginger ML, Santos VLCS, Wolff GA. 2000. A preliminary investigation of the lipids of abyssal holothurians from the northeast Atlantic Ocean. J. Mar. Biol. Assoc. UK 80: 139-146. [ Links ]
Gooday AJ, Turley CM. 1990. Responses by benthic organisms to inputs of organic material to the ocean floor: A review. Philos. Trans. R. Soc. Lond. 331: 119-138. [ Links ]
Hadfield MG, Strathmann MF. 1996. Variability, flexibility and plasticity in life history of marine invertebrates. Oceanol. Acta 19: 323-334. [ Links ]
Harrison K. 1988. Seasonal reproduction in deep-sea Crustacea (Isopoda: Asellota). J. Nat. Hist. 22: 175-197. [ Links ]
Howell KL, Billett DSMB, Tyler PA. 2002. Depth-related distribution and abundance of seastars (Echinodermata: Asteroidea) in the Porcupine Seabight and Porcupine Abyssal Plain, NE Atlantic. Deep-Sea Res. I 49: 1901-1920. [ Links ]
Jangoux M. 1982. Food and feeding mechanisms: Asteroidea. In: Jangoux M, Lawrence JM (eds.), Echinoderm Nutrition. A.A. Balkema Publ., Rotterdam, pp. 117-159. [ Links ]
Lampitt RS, Popova EE, Totterdel IJ. 2003. Global distribution of downward particle flux from models and measurements. Do we believe any of them? Joint Global Ocean Flux Study Rep. 38: 54. [ Links ]
Madsen FJ. 1961. The Porcellanasteridae. A monographic revision of an abyssal group of sea-stars. In: Wolff T (ed.), Galathea Report. Scientific results of the Danish deep-sea expedition round the world, 1950-52. Danish Science Press, Copenhagen, pp. 36-176. [ Links ]
McMahon T, Raine R, Titov O, Boychuk S. 1995. Some oceanographic features of North-Eastern Atlantic waters west of Ireland. ICES J. Mar. Sci. 52: 221-232. [ Links ]
New AL, Smythe-Wright D. 2001. Aspects of the circulation in the Rockall Trough. Cont. Shelf Res. 21: 777-810. [ Links ]
Pain SL, Tyler PA, Gage JD. 1982a. The reproductive biology of the deep-sea asteroids Benthopecten simplex (Perrier), Pectinaster filholi Perrier, and Pontaster tenuispinus Duben and Koren (Phanerozonia: Benthopectinidae) from the Rockall Trough. J. Exp. Mar. Biol. Ecol. 65: 195-211. [ Links ]
Pain SL, Tyler PA Gage JD. 1982b. The reproductive biology of Hymenaster membranaceus from the Rockall Trough, northeast Atlantic Ocean, with notes on Hymenaster gennaeus. Mar. Biol. 70: 41-50. [ Links ]
Pawson DL. 1976. Some aspects of the biology of deep-sea echinoderms. Thalassia Jugoslav. 12: 287-293. [ Links ]
Pearse JS, McClintock JB, Bosch I. 1991. Reproduction of Antarctic benthic marine invertebrates: Tempos, modes, and timing. Am. Zool. 31: 65-80. [ Links ]
Rice AL, Billett DSM, Fry J, John AWG, Lampitt RS, Mantoura RFC, Morris RJ. 1986. Seasonal deposition of phytodetritus to the deep-sea floor. Proc. R. Soc. Edimb. 88B: 265-279. [ Links ]
Rice AL, Thurston MH, Bett BJ. 1994. The IOSDL DEEPSEAS programme: Introduction and photographic evidence for the presence of a seasonal input of phytodetritus at contrasting abyssal sites in the northeastern Atlantic. Deep-Sea Res A 41: 1305-1320. [ Links ]
Ramirez-Llodra E, Tyler PA, Billet DSM. 2002. Reproductive biology of porcellanasterid asteroids from three abyssal sites in the NorthEast Atlantic with contrasting food input. Mar. Biol. 140: 773-788. [ Links ]
Rowe GT, Staresinic N. 1979. Sources of organic matter to the deep-sea benthos. Ambio Spec. Rep. 6: 19-23. [ Links ]
Scheibling RE. 1981. The annual reproductive cycle of Oreaster reticulatus (L.) (Ecchinodermata: Asteroidea) and interpopulation differences in reproductive capacity. J. Exp. Mar. Biol. Ecol. 54: 39-54. [ Links ]
Scherle W. 1970. A simple method for volumetry of organs in quantitative stereology. Mikroskopie 26: 57-60. [ Links ]
Shick JM, Taylor WF, Lamb AN. 1981. Reproduction and genetic variation in the deposit feeding sea star Ctenodiscus crispatus. Mar. Biol. 63: 51-66. [ Links ]
Tyler PA. 1988. Seasonality in the deep sea. Oceanogr. Mar. Biol. Ann. Rev. 26: 227-258. [ Links ]
Tyler PA, Gage JD. 1980. Reproduction and growth in the deep-sea brittle star Ophiura ljungmani (Lyman). Oceanol. Acta 3: 177-185. [ Links ]
Tyler PA, Pain SL. 1982a. The reproductive biology of Plutonaster bifrons, Dytaster insignis and Psilaster andromeda (Asteroidea: Astropectinidae) from the Rockall Trough. J. Mar. Biol. Assoc. UK 62: 869-887. [ Links ]
Tyler PA, Pain SL. 1982b. Observations of gametogenesis in the deep-sea asteroids Paragonaster subtilis and Pseudarchaster parelii (Phanerozonia: Goniasteridae). Int. J. Inv. Rep. 5: 296-272. [ Links ]
Tyler PA, Gage JD. 1984. Seasonal reproduction of Echinus affinis (Echinodermata; Echinoidea) in the Rockall Trough, Northeast Atlantic Ocean. Deep-Sea Res. 31: 387-402. [ Links ]
Tyler PA, Pain SL, Gage JD. 1982a. Gametogenic cycles in deep-sea phanerozoan asteroids. In: Lawrence JM (ed.), International Echinoderms Conference, Tampa Bay. AA Balkema, Rotterdam, pp. 431-434. [ Links ]
Tyler PA, Pain SL, Cage JD. 1982b. The reproductive biology of the deep-sea asteroid Bathybiaster vexillifer. J. Mar. Biol. Assoc. UK 62: 57-69. [ Links ]
Tyler PA, Grant A, Pain SL, Gage JD. 1982c. Is annual reproduction in deep-sea echinoderms a response to variability in their environment? Nature 300: 747-749. [ Links ]
Tyler PA, Billet DSM, Cage JD. 1990. Seasonal reproduction in the sea stars Dytaster grandis from 4000 m in the Northeast Atlantic Ocean. J. Mar. Biol. Assoc. UK 70: 173-180. [ Links ]
Tyler PA, Cage JD, Paterson GJL, Rice AL. 1993. Dietary constraints on reproductive periodicity in two sympatric deep-sea astropectinid sea stars. Mar. Biol. 115: 267-277. [ Links ]
Van-Praët M. 1989. Reproduction in deep-sea anemones. Proc. Fifth International Conference on Coelenterate Biology, Southampton, 1989. [ Links ]
Van-Praët M, Duchateau G. 1984. Mise en evidence chez une Actinie abyssale (Paracalliactis stephensoni) d'un cycle saisonnier de reproduction. C.R. Hebd. Seances Acad. Sci. Paris 299: 687-690. [ Links ]
Walker CW. 1974. Studies on the reproductive system of seastars. I. The morphology and histology of the gonads of Asterias vulgaris. Biol. Bull. 147: 661-677. [ Links ]
Winemiller K, Rose K. 1992. Patterns of life history diversification in North American fishes: Implications for population regulation. Can. J. Fish. Aquat. Sci. 49: 2196-2218. [ Links ]














