Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.32 no.3 Ensenada sep. 2006
Notas de investigación
Crecimiento y perfil bioquímico de Chaetoceros muelleri cultivada en sistemas discontinuos y semicontinuos
Growth and biochemical profile of Chaetoceros muelleri cultured in batch and semicontinuous systems
N Lemus1, T Urbano1, B Arredondo-Vega2, M Guevara1*, A Vásquez1, L Carreón-Palau2, N Vallejo1
1 Laboratorio de Acuicultura, ext. Plancton, Departamento de Biología Pesquera, Instituto Oceanográfico de Venezuela, Universidad de Oriente, Av. Universidad, Cerro Colorado. Apartado 6101, Sucre, Venezuela. * E-mail: miguevara2003@yahoo.es
2 Laboratorio de Biotecnología de Microalgas, Centro de Investigaciones Biológicas del Noroeste, Apartado postal 128, La Paz, Baja California Sur, CP 23000, México.
Recibido en septiembre de 2005
Aceptado en agosto de 2006.
Resumen
Se caracterizó bioquímica y poblacionalmente una cepa de Chaetoceros muelleri procedente de la Península de Araya (Venezuela), la cual se cultivó en condiciones de laboratorio (25 ± 1°C, 156 μΕ m-2 s-1 y fotoperiodo 12:12) durante 13 días, bajo sistemas de cultivo discontinuo y semicontinuo con recambios diarios de 30% del volumen. Se evaluó la densidad celular y se determinó el tamaño celular. Se cuantificó el contenido de proteínas, lípidos, carbohidratos y ácidos grasos. La densidad celular tuvo poca variabilidad en el sistema semicontinuo en la fase de estabilización, obteniéndose en promedio 1.3 χ 106 cél mL-1, mientras que en el discontinuo, este parámetro incrementó significativamente hasta alcanzar un máximo de 3.5 χ 106 cél mL-1. Proteínas, lípidos y carbohidratos no variaron significativamente en los cultivos semicontinuos, alcanzando promedios de 21.4 ± 0.8, 18.4 ± 0.8 y 4.1 ± 0.1 pg cél-1, respectivamente. En el discontinuo, estas macromoléculas presentaron mayor variabilidad, con valores de proteínas entre 3.5 y 21.1 pg cél-1 , lípidos entre 8.5 y 11.6 pg cél-1 y carbohidratos entre 4.2 y 18.1 pg cél-1. Los ácidos grasos saturados y monoinsaturados mostraron valores superiores en los cultivos semicontinuos, con concentraciones de 47.5% y 34.8%, respectivamente. El contenido de ácidos grasos poliinsaturados fue mayor en el sistema discontinuo (31.4%), destacando la presencia del ácido eicosapentaenoico, 20:5 n-3 EPA, con una proporción de 16 ± 2%. El tamaño celular medio de la microalga no varió en los dos sistemas de cultivo, observándose un ancho y largo medios de 5 y 7.5 μm, respectivamente. La cepa de C. muelleri puede suministrarse como alimento de larvas de organismos cultivables, siendo el sistema semicontinuo garantía de una calidad nutricional más estable.
Palabras clave: Chaetoceros muelleri, semicontinuo, Araya.
Abstract
We characterized the growth and biochemical composition of a Chaetoceros muelleri strain from the Araya Peninsula, Sucre, Venezuela. The microalga was cultured under laboratory conditions (25 ± 1°C, 156 μE m-2 s-1 and 12:12 photoperiod) during 13 days, using two culture methods: batch and semicontinuous culture with a daily renewal rate of 30%. Cell density was determined and cells from each treatment were measured. The protein, lipid, carbohydrate and fatty acid contents were quantified to compare the quality of the Araya strain in both culture systems. Cell density showed little variability in the semicontinuous system during the steady-state phase (1.3 χ 106 cells mL-1 on average), but increased significantly in the batch system, reaching 3.5 χ 106 cells mL-1. Proteins, lipids and carbohydrates did not show significant variations in the semi-continuous system, with mean values of 21.4 ± 0.8, 18.4 ± 0.8 and 4.1 ± 0.1 pg cells-1, respectively. In the batch system, however, these macromolecules showed greater variability: proteins 3.5-21.1 pg cells-1, lipids 8.5-11.6 pg cells-1 and carbohydrates 4.2-18.1 pg cells-1. Higher levels of saturated (47.5%) and monounsaturated (34.8%) fatty acids were found in the semicontinuous system, whereas the content of polyunsaturated fatty acids (31.4%) was higher in the batch system, in particular of eicosapentaenoic acid (EPA, 20:5 n-3) (16 ± 2% of total fatty acids). Cell size did not vary significantly in the two culture systems and the mean width and length were 5 and 7.5 μm, respectively. The Araya strain of C. muelleri can be used as a food source for cultured larvae, the semicontinuous system providing a more stable nutritional quality.
Key words: Chaetoceros muelleri, semicontinuous, Araya, fatty acids, biochemical composition.
Introducción
Las microalgas son esenciales como alimento para las primeras fases de desarrollo de la mayoría de las especies de moluscos, crustáceos y peces en cultivo, debido a su tamaño, fácil cultivo y probada calidad nutricional (Brown y Jeffrey 1992). Sin embargo, aunque varias especies de microalgas han sido utilizadas como alimento en maricultura, no todas producen un buen crecimiento y supervivencia en todas las especies cultivadas. Algunos de los factores que intervienen en el mayor o menor éxito en su uso son la talla, la digestibilidad y la composición bioquímica. Los componentes más importantes para la nutrición animal son las proteínas, lípidos, carbohidratos y minerales, así como nutrientes específicos tales como aminoácidos y ácidos grasos esenciales, esteroles, azúcares y vitaminas (Brown et al. 1989).
La evaluación del valor alimenticio de varias especies de microalgas, medido en términos de crecimiento larvario de bivalvos y crustáceos, ha demostrado que especies del género Chaetoceros son uno de los mejores alimentos (Napolitano et al. 1990, Treece y Yates 1993, Mallo y Fenucci 2004).
En la búsqueda de mejores esquemas de manejo que permitan predecir el valor nutricional de las microalgas bajo condiciones controladas, se han ensayado diferentes estrategias de cultivo entre las que destacan la manipulación de las variables ambientales y los sistemas de cultivo. En el sistema de cultivo discontinuo o batch, no se añade ni se elimina medio de cultivo después de la inoculación, en el continuo se añade un suministro de nutrientes en forma continua al cultivo, manteniendo constante el volumen de cultivo, y en el semicontinuo se agrega medio de cultivo a una tasa de dilución constante.
En el presente estudio se planteó la caracterización de una cepa de Chaetoceros muelleri aislada del nororiente venezolano, de comprobada utilidad alimenticia en el cultivo de camarones peneidos (Núñez et al. 2002), como una forma de aumentar el número de estirpes autóctonas de microalgas con potencial para la maricultura, comparando los sistemas de cultivo discontinuo y semicontinuo.
Materiales y métodos
Microorganismo seleccionado y condiciones de cultivo
Chaetoceros muelleri cepa Araya (LAEP-35) se obtuvo del cepario del Laboratorio de Acuicultura, Extensión Plancton del Instituto Oceanográfico de Venezuela de la Universidad de Oriente, donde se mantiene a 37%o en el medio Algal (Fábregas et al. 1984). Ésta fue aislada de los canales de suministro de agua para las lagunas artificiales de las salinas de Araya, estado Sucre, Venezuela.
Los cultivos se iniciaron con una densidad de 2.3 χ 105 cél mL-1 en botellas de vidrio de 3 L de capacidad, conteniendo 1.5 L de agua de mar (37%) filtrada con filtros GFC de 47 mm de diámetro y 1.2 μm de tamaño de poro, esterilizada en autoclave a 121°C, 15 psi, 15 min y enriquecida con medio Algal a una concentración de 8 mM NaNO3 (Fábregas et al. 1984). Se mantuvieron a 25 ± 1°C, intensidad luminosa de 156 μE m-2 s-1 con fotoperiodo 12:12 y aireación constante (200 mL min-1).
Se emplearon seis botellas, tres para el sistema discontinuo y tres para el sistema semicontinuo, con recambios diarios del 30% del volumen, iniciados a partir de la fase de crecimiento logarítmica y hasta el día 13 del ensayo.
Densidad poblacional y tamaño celular
La densidad celular se determinó tomando diariamente durante el periodo de ensayo una alícuota de cada una de las botellas conteniendo la suspensión de algas, fijándola con una solución de Lugol al 1%. Los recuentos se realizaron con una cámara Neubauer. Al final del ensayo se determinó la longitud y el ancho de 100 células de cada cultivo, mediante mediciones en microscopio óptico con micrómetro ocular incorporado.
Composición bioquímica
Cuando se detectó la fase de equilibrio o de estabilización del cultivo semicontinuo y hasta el final del ensayo, se tomaron 5 mL, por triplicado, de ambos sistemas de cultivo y se centrifugaron durante 15 min a 5000 rpm. El precipitado resultante se mantuvo a -20°C para su posterior análisis bioquímico, que incluyó determinaciones de proteínas, lípidos, carbohidratos y ácidos grasos.
Las proteínas se determinaron según el método de Lowry (Lowry et al. 1951) modificado por Herbert et al. (1971). La extracción de los lípidos se realizó por el procedimiento de Bligh y Dyer (1959) y su determinación espectrofotométrica mediante el método de Marsh y Weinstein (1966). La cuantificación de los carbohidratos totales se realizó por el método fenol sulfúrico (Dubois et al. 1956). Los estándares utilizados fueron albúmina bovina, tripalmitina y D-glucosa, para proteínas, lípidos y carbohidratos totales respectivamente.
La derivatización de los ácidos grasos se realizó según Sato y Murata (1988) y el análisis de los mismos se realizó en un cromatógrafo de gases-espectrómetro de masas (GC-MS) Hewlett Packard Series G1800B, adicionado con una columna Omegawax TM 250 de sílica fundida (Supelco) de 30 m χ 0.25 mm de diámetro externo χ 0.25 μm de diámetro interno. Los ácidos grasos presentes en las muestras se identificaron mediante la comparación de los espectros de masas con los espectros contenidos en la biblioteca de espectros de masas NIST98, NBS75K y una biblioteca creada con 28 estándares de ácidos grasos metil esterificados (Sigma Chemical Company). Adicionalmente, se confirmó la identificación de los ácidos grasos mediante la comparación de los tiempos de retención de las muestras con los registrados para mezcla comercial de metil-ésteres de ácidos grasos poliinsaturados (Sigma).
Análisis estadísticos
Para la evaluación del bioensayo se realizó un análisis de varianza de dos factores, considerando los sistemas de cultivos y los diferentes días de muestreo como factores, siguiendo las recomendaciones de Sokal y Rohlf (1995).
Resultados
Densidad poblacional y tamaño celular
Las mayores densidades celulares de la microalga C. muelleri cepa Araya (LAEP-35) se registraron en el sistema discontinuo (fig. 1), alcanzando cifras de 3.5 ± 0.1 χ 106 cél mL-1 al final del ensayo (día 13). La densidad celular se incrementó paulatinamente con diferencias significativas (P < 0.05) hasta el día 11 y 12, para luego entrar en fase estacionaria. Los cultivos en el sistema semicontinuo alcanzaron su densidad celular máxima al sexto día (2.4 ± 0.1 χ 106 cél mL-1), a partir del cual la densidad disminuyó como producto de las diluciones, para luego incrementarse ligeramente y mantenerse con poca fluctuación (entre 1.8 y 2.2 χ 106 cél mL-1) y sin diferencias significativas (P > 0.05) durante los días 10-13, lo cual indica la fase de equilibrio o estabilización.
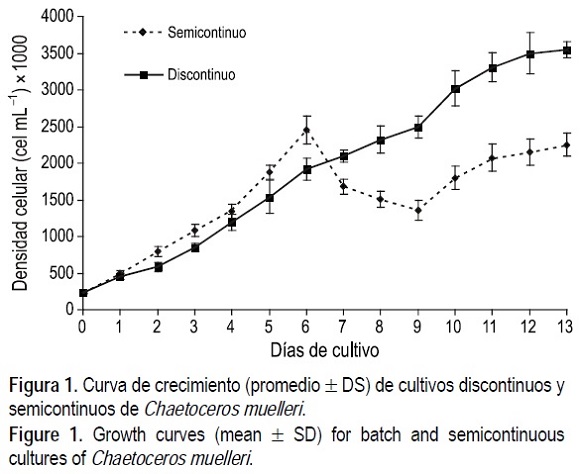
El tamaño celular de la microalga no mostró diferencias significativas (P > 0.05) entre los dos sistemas de cultivo, observándose un ancho y un largo medios de 5.3 ± 1.2 μm y 7.5 ± 0.3 μm respectivamente.
Composición bioquímica
Proteínas
Las proteínas celulares disminuyeron significativamente (P < 0.05) en los cultivos discontinuos desde 21.1 ± 2 pg cél1 (día 10) hasta 3.5 ± 0.2 pg cél-1 (día 13). En el sistema semicontinuo, las concentraciones de estas macromoléculas se mantuvieron entre 21 ± 2 y 23 ± 2 pg cél-1, sin diferencias significativas (P > 0.05) durante los días de muestreo (tabla 1).
Lípidos
Los niveles de lípidos se incrementaron significativamente (P < 0.05) en los cultivos discontinuos desde 8.5 ± 0.9 pg cél1 (día 10) hasta 12 ± 3 pg cél-1 (día 13). En los cultivos semicon-tinuos, las concentraciones de lípidos fueron mayores que en los discontinuos y mostraron diferencias no significativas (P > 0.05) en todos los muestreos, alcanzando concentraciones medias de 18 ± 4 pg cél-1 (tabla 1).
Carbohidratos
Los niveles de carbohidratos en los cultivos discontinuos variaron significativamente (P < 0.05) en los diferentes días de muestreo, mostrando una tendencia a la disminución a medida que el cultivo se desarrollaba, con concentraciones desde 18 ± 1 pg cél-1 (día 10) hasta 4.2 ± 0.2 pg cél-1 (día 13). Por el contrario, en los cultivos semicontinuos estas macromoléculas mostraron bajas concentraciones (4.2 ± 0.2 pg cél-1) y sin diferencias significativas (P > 0.05) durante la fase de estabilización (tabla 1).
Ácidos grasos
Los resultados de los ácidos grasos corresponden al día 12 del cultivo (cuarto día de la fase de equilibrio del sistema semicontinuo). El contenido total de los ácidos grasos saturados y monoinsaturados fue superior en los cultivos semicontinuos, obteniéndose proporciones de 47.5% y 34.8%, respectivamente. Los ácidos grasos saturados que presentaron mayores concentraciones, en ambos sistemas de cultivo, fueron el C14:0 (mirístico) y el C16:0 (palmítico), mientras que de los monoinsaturados, el C16:1 n-7 fue el predominante (tabla 2).
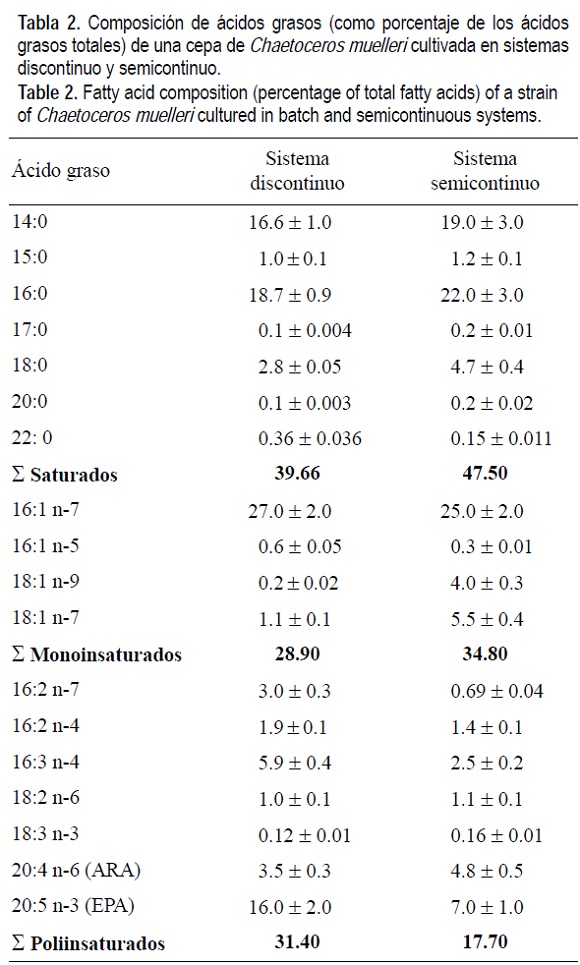
El contenido total de los ácidos grasos poliinsaturados fue mayor en el sistema discontinuo (31.4%). Los ácidos grasos poliinsaturados que mostraron una mayor proporción en ambos sistemas de cultivos, fueron el C20:5 n-3, 16:3 n-4 y C20:4 n-6; en el sistema semicontinuo se observaron menores proporciones de los dos primeros ácidos grasos, mientras que el C20:4 n-6 presenta una mayor proporción en este sistema (tabla 2).
Discusión
Nuestros resultados muestran que C. muelleri cepa Araya (LAEP-35) puede mantener una producción diaria de biomasa, con una composición bioquímica estable, durante la fase de equilibrio del régimen semicontinuo. Esta estabilidad de las macromoléculas y de la densidad celular puede deberse a la renovación de nutrientes, lo cual promueve en los cultivos una fisiología similar a la registrada durante la fase exponencial (Otero 1994, Fábregas et al. 1995).
La disminución de las proteínas y los carbohidratos, conjuntamente con el incremento de los lípidos en los cultivos discontinuos pareciera indicar el agotamiento de los nutrientes, principalmente nitrato, que tiene lugar a medida que el cultivo envejece (Brown et al. 1993). Diversos trabajos han reportado que la deficiencia de nitrógeno, necesario para la síntesis de proteínas y ácidos nucleicos, conduce a una desviación del carbono fotoasimilado hacia la biosíntesis de productos de reserva, preferentemente lípidos (Myers 1980). Por el contrario, estas macromoléculas mostraron, en la fase de equilibrio de los cultivos semicontinuos, concentraciones similares a lo largo del periodo de muestreo, manteniendo el orden de concentración: proteínas > lípidos > carbohidratos. Lo anterior puede deberse al suministro diario de medio de cultivo fresco cargado de nutrientes, tal como lo indica Otero (1994) para cultivos semicontinuos de Dunaliella tertiolecta, Chlorella autotrophica, Tetraselmis suecica, Isochrysis galbana y Phaeodactylum tricornutum. Por otra parte, el crecimiento activo de Chaetoceros muelleri cepa Araya con una composición bioquímica estable en el régimen semicontinuo puede deberse a la tasa de dilución empleada (30%), tal como ha sido señalado por Fábregas et al. (1995) para D. tertiolecta y Bermúdez et al. (2004) para Chroomonas sp.
El uso del régimen semicontinuo se convierte así en una herramienta útil para la producción de Chaetoceros muelleri cepa Araya con una calidad nutricional adecuada para el desarrollo normal de organismos sometidos a cultivo, lo cual se constató en los resultados obtenidos por Núñez et al. (2002) al alimentar con esta microalga larvas del camarón Litopenaeus vannamei y obtener una alta tasa de supervivencia (70%). Se sugiere la utilización de esta cepa de C. muelleri como alimento de larvas de bivalvos marinos, debido a su fácil ingestión por el tamaño que poseen (5.25 χ 7.55 μm), el cual está dentro de los rangos sugeridos por Doroudi et al. (2003); no obstante, falta precisar su digestión y/o asimilación. De igual forma, el contenido de ácidos grasos poliinsaturados que muestra esta cepa aseguraría una mayor supervivencia larvaria, tal y como lo señalan Izquierdo (1996) y Koven et al. (2001), quienes indicaron que una dieta para larvas de peces que contenga los ácidos grasos C20:4 n-6 y C20:5 n-3 promovería el desarrollo del sistema inmune, disminuyendo así las patologías relacionadas con el estrés propio de las actividades de cultivo.
Se recomienda evaluar la potencialidad de esta microalga en el cultivo de larvas de bivalvos y otros organismos cultivables diferentes a los peneidos.
Agradecimientos
La presente investigación fue financiada por el Consejo de Investigación de la Universidad de Oriente a través del proyecto CI-5-1802-1154/03.
Referencias
Bermúdez J, Rosales N, Loreto C, Briceño B, Morales E. 2004. Exopolysaccharide, pigment and protein production by the marine microalga Chroomonas sp. in semicontinuous cultures. World J. Microbiol. Biotechnol. 20(2): 179-183. [ Links ]
Bligh E, Dyer J. 1959. A rapid method of total lipid extraction and purification. Can. J. Biochem. Physiol. 37: 911-917. [ Links ]
Brown M, Jeffrey S. 1992. Biochemical composition of microlagae from the green algal classes Chlorophyceae and Prasinophyceae. 1. Amino acids, sugars and pigments. J. Exp. Mar. Biol. Ecol. 161: 91-113. [ Links ]
Brown M, Jeffrey S, Garland C. 1989. Nutritional aspect of microalgae used in mariculture; a literature review. CSIRO Marine Laboratories Rep. 205, 44 pp. [ Links ]
Brown M, Garland C, Jeffrey S, Jameson I, Leroi J. 1993. The gross and amino acid compositions of batch and semicontinuous cultures of Isocrhrysis sp. (clone T. ISO), Pavlova lutheri and Nannochloropsis oculata. J. Appl. Phycol. 5: 285-296. [ Links ]
Doroudi M, Southgate P, Lucas J. 2003. Variation in clearance and ingestion rates by larvae of the black-lip pearl oyster (Pinctada margaritifera, L.) feeding on various microalgae. Aquacult. Nutr. 9: 11-16. [ Links ]
Dubois M, Gillies K, Hamilton J, Rebers P, Smith F. 1956. Colorimetric method for the determination of sugars and related substances. Anal. Chem. 28: 350-356. [ Links ]
Fábregas J, Abalde J, Herrero C, Cabezas B, Veiga M. 1984. Growth of marine microalgae Tetraselmis suecica in batch cultures with different salinities and nutrient concentrations. Aquaculture 42: 207-245. [ Links ]
Fábregas J, Patiño M, Arredondo-Vega B, Tobar J, Otero A. 1995. Renewal rate and nutrient concentration as tools to modify productivity and biochemical composition of cyclostat cultures of the marine microalga Dunaliella tertiolecta. Appl. Microbiol. Biotechnol. 44: 287-292. [ Links ]
Herbert D, Phipps P, Stronce P. 1971. Chemical analyses of microbial cells. In: Norris J, Ribbons D (eds.), Methods in Microbiology. Academic Press (5B), pp. 209-344. [ Links ]
Izquierdo M. 1996. Essential fatty acid requirements of cultured marine fish larvae. Aquacult. Nutr. 2: 183-191. [ Links ]
Koven W, Barr Y, Lutzky S, Ben-Atia I, Weiss R, Harel M, Behrens P, Tandler A. 2001. The effect of dietary arachidonic acid (20:4 n-6) on growth, survival and resistance to handling stress in gilthead seabream (Sparus aurata) larvae. Aquaculture 193: 107-122. [ Links ]
Lowry O, Rosebrough H, Farr A, Randall R. 1951. Protein measurement with the folin-phenol reagent. J. Biol. Biochem. 193: 265-275. [ Links ]
Mallo J, Fenucci J. 2004. Alimentación de protozoeas del langostino Pleoticus muelleri Bate utilizando diferentes microencapsulados y especies de microalgas. Rev. Biol. Mar. Oceanogr. 39(1): 13-19. [ Links ]
Marsh J, Weinstein D. 1966. Simple charring method for the determination of lipids. J. Lipid Res. 7: 574-576. [ Links ]
Myers J. 1980. On the algae: Thoughts about physiology and measurements of efficiency. In: Falkowski P (ed.), Primary Productivity in the Sea. Plenum Press, New York, pp. 1-16. [ Links ]
Napolitano G, Ackman R, Ratnayake W. 1990. Fatty acid composition of three cultured algal species (Isochrysis galbana, Chaetoceros gracilis and Chaetoceros calcitrans) used as food for bivalve larvae. J. World Aquacult. Soc. 21(2): 122-130. [ Links ]
Núñez M, Lodeiros C, De Donato M, Graziani C. 2002. Evaluation of microalgae diets for Litopenaeus vannamei larvae using a simple protocol. Aquacult. Int. 10(3): 177-187. [ Links ]
Otero A. 1994. Modificación de la composición bioquímica de microalgas marinas en régimen de ciclostato. Ph.D. Thesis, University of Santiago of Compostela, Spain, 545 pp. [ Links ]
Sato N, Murata N. 1988. Membrane lipids. Methods Enzimol. 167: 251-259. [ Links ]
Sokal R, Rohlf F. 1995. Biometry. 3rd ed. WH Freeman, New York, 887 pp. [ Links ]
Treece G, Yates M. 1993. Manual de laboratorio para el cultivo de larvas de camarón peneido. Texas A & M University, Texas, 83 pp. [ Links ]














