Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Ciencias marinas
versão impressa ISSN 0185-3880
Cienc. mar vol.32 no.3 Ensenada Set. 2006
Artículos
Estimación de la producción secundaria de Uca uruguayensis (Decapoda, Brachyura, Ocypodidae) en Bahía Samborombón, Argentina
Estimating secondary production of Uca uruguayensis (Decapoda, Brachyura, Ocypodidae) from Samborombón Bay, Argentina
LC Armendáriz1*, II César1,2
1 División Zoología Invertebrados, Facultad de Ciencias Naturales y Museo, Universidad Nacional de La Plata, Paseo del Bosque S/N, La Plata, 1900, Argentina. * E-mail: lauraarm@netverk.com.ar.
2 Investigador CIC. Calle 526 s/n, e/10 y 11, La Plata, 1900 Argentina.
Recibido en septiembre de 2005
Aceptado en mayo de 2006.
Resumen
Se recolectaron individuos de Uca uruguayensis (n = 1200, 216 megalopas, 984 indiferenciados y adultos), se contaron y clasificaron en indiferenciados, machos o hembras. Cada uno se midió (ancho del caparazón, AC) y pesó (peso seco, PS). Los cangrejos fueron analizados y separados en cohortes mediante la conversión de la distribución polimodal de frecuencias de tallas en curvas normales. Se registraron seis cohortes durante el periodo de estudio, coexistiendo dos cohortes en septiembre y diciembre de 2001, abril y octubre de 2002, y tres en marzo y junio de 2001, diciembre de 2002 y febrero de 2003. Se capturaron hembras ovígeras en diciembre de 2001 y 2002, y febrero de 2003, esta última fecha en que se registró el establecimiento de las megalopas en todas las estaciones de muestreo. Se obtuvo la correlación entre AC y PS, y se analizó el patrón de crecimiento aplicando la función potencial (PS = a ACb). Machos, hembras e individuos indiferenciados fueron analizados, independientemente o en conjunto, evidenciándose una alometría positiva para el PS y presentando los machos los valores mayores de alometría. Para estimar la producción anual se utilizó el método de frecuencias de tallas, donde la mayor contribución a la producción estuvo dada por los individuos maduros, en particular por los incluidos en el intervalo de tallas de 10 a 11.99 mm. Por otra parte, se registró un número bajo de individuos en las tallas previas a la pubertad. La biomasa total (expresada en PS) varió entre 20 y 611 mg m-2 y los valores más altos se registraron durante el verano.
Palabras clave: producción secundaria, cangrejo violinista, Uca uruguayensis, Argentina.
Abstract
Specimens of Uca uruguayensis were collected (n = 1200, 216 megalopae, 984 undifferentiated and adults), counted and classified as males, females or undifferentiated individuals. Each was measured (total carapace width, CW) and weighed (dry weight, DW). The crabs were analyzed and separated into cohorts by the conversion of polymodal width-frequency distributions into normal curves. Six cohorts were recruited during the study period. Two cohorts coexisted in September and December 2001, and April and October 2002, and three in March and June 2001, December 2002, and February 2003. Ovigenous females were captured in December 2001 and 2002, and February 2003; on this last date, megalopal settlement was registered at all the sampling sites. The correlation between CW and DW was analyzed and the growth pattern was modelled by applying the power function (DW = a CWb). Males, females and undifferentiated individuals were examined separately and all together as a group. The data were fitted, indicating a positive allometry for DW, males showing the highest allometric values. To estimate the annual production we used a size-frequency method. Mature individuals, in particular those included in the 10-11.99 mm size class, contributed most to production. On the other hand, few individuals belonged to the size class prior to puberty. Total biomass (expressed in DW) varied between 20 and 611 mg m-2 and the highest values were recorded during summer.
Key words: secondary production, fiddler crab, Uca uruguayensis, Argentina.
Introducción
Uca uruguayensis (Nobili 1901) (Ocypodidae) es un cangrejo estuarial endémico de la región Neotropical y su área de distribución abarca desde Río de Janeiro (Brasil) hasta el Río Quequén (Buenos Aires, Argentina); habita substratos limosos o limoarenosos de los niveles más altos de la intermareal (Spivak et al. 1991; Spivak 1997a, 1997b). En los humedales de la Bahía Samborombón se halla la población permanente más austral de la especie, que junto a Chasmagnathus granulatus Dana 1851, configuran extensos cangrejales. Éstos constituyen amplias áreas de alimentación para aves migratorias tales como el chorlo dorado Pluvialis dominica (Müller) y la becasa de mar Limosa haemastica (Linnaeus), la cuál se alimenta de U. uruguayensis (Ieno 2000), así como también para peces de importancia económica y deportiva como la corvina rubia Micropogonias furnieri (Demarest 1823) y la corvina negra Pogonias cromis (Linnaeus 1766). La Bahía Samborombón representa uno de los humedales más atractivos y especiales de la Provincia de Buenos Aires, declarada Sitio Ramsar en 1997.
Las referencias acerca de la producción secundaria en Crustacea incluyen varios trabajos (Martien y Benke 1977, Dehdashti y Blinn 1991, Calcagno et al. 1997, Cartes y Sorbe 1999); así como existen otras para Decapoda (Fogarty y Idoine 1986, Ferreira-Fontoura y Buckup 1991, Hanekom y Baird 1992, Anastácio y Marques 1995, Whitmore y Huyn 1999) y para Brachyura (Waters 1977, Fredette et al. 1990, Heck et al. 1995), aunque no se han reportado estimaciones de la producción secundaria para U. uruguayensis.
El objetivo de esta contribución fue brindar información acerca de la producción secundaria de U. uruguayensis en Bahía Samborombón, con la finalidad de que ésta pueda ser utilizada por las autoridades correspondientes en programas de manejo de este ecosistema de humedales.
Área de estudio
La Bahía Samborombón es un depocentro que se extiende desde Punta Piedras (35°30' S, 56°45' W) hasta Cabo San Antonio (36°22' S, 57°23' W). Está formada por sedimentos marinos y provenientes de los ríos Uruguay y Paraná, generando extensas llanuras costeras y marismas (Violante et al. 2001). Sus costas son bañadas por aguas salobres y corresponden al área estuarial del Río de la Plata (Boschi 1988).
La vegetación en la llanura aluvial es principalmente herbácea y está representada por espartillo Spartina alterni-flora Loisel y S. densiflora (Brong.), pasto salado Distichlis scoparia (Kth.) Arech. y D. spicata (L.) Greene, y cortadera Cortaderia selloana (Schult.) Asch. et Graebn. En los suelos arcillosos inundables se encuentran praderas de jume Salicornia ambigua Michx., expuestas a las mareas, la erosión y depositación de sedimentos (Vervoorst 1967).
Materiales y métodos
Se realizaron nueve muestreos desde marzo de 2001 hasta febrero de 2003 en la desembocadura del Canal 1 en el Refugio de Vida Silvestre Bahía Samborombón. Se seleccionaron cinco estaciones de muestreo en 36°16' S, 57°06' W, una de ellas localizada en el terraplén norte del Canal, otra en el terraplén sur, otras dos en la pradera de S. ambigua y la última en la desembocadura del canal, caracterizada por una gran exposición a las mareas. Las fuertes lluvias e inundaciones ocurridas en la región durante 2001 afectaron las campañas, dificultando el acceso al área de muestreo, por lo que éstas sólo pudieron realizarse cada tres meses.
Los cangrejos se recogieron a mano, tanto los hallados en superficie como los ocultos en las cuevas (hasta 50 cm de profundidad), utilizando una cuadrícula de 5 χ 5 m con subunidades de 0.5 χ 0.5 m. Se realizó un muestreo preliminar a fin de determinar el número mínimo de muestras a tomar, con 35 subunidades tomadas al azar. De acuerdo a los resultados obtenidos, según Elliott (1983) el número mínimo de subunidades a muestrear fue diez. Los cangrejos fueron envasados en bolsas plásticas y congelados. Se tomaron muestras del sedimento, una por estación de muestreo, con corers (0: 6.5 cm; h: 8 cm) para el análisis granulométrico y la determinación de materia orgánica según el método de Walkley-Black (Allison 1965). Las variables fisicoquímicas medidas fueron temperatura (°C), pH y conductividad. En el laboratorio los cangrejos se descongelaron a temperatura ambiente y se fijaron en formol al 10%, luego se contaron y clasificaron en: indiferenciados (los que no presentaban caracteres sexuales secundarios), machos o hembras. Fueron medidos (ancho total del caparazón, AC), pesados (peso seco, PS, a 60°C durante 48 h) y se realizó un análisis de correlación entre AC y PS. Se separaron las cohortes mediante la conversión de la distribución polimodal de frecuencias de tallas en curvas normales.
El método utilizado para estimar la producción anual de U. uruguayensis fue el de frecuencia de tallas según Runck y Blinn (1990, 1993), entre otros. Se siguieron los procedimientos de Menzie (1980) y Krueger y Martin (1980) para establecer los intervalos de confianza de la producción:
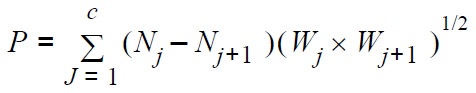
donde P es la producción anual, Nj es el número de individuos que alcanzan la talla j durante el año, c es el número de clases de tallas y Wj es el peso medio de la clase de talla j.
Como sugirió Waters (1977) para especies que tienen un ciclo de vida mayor a un año, la estimación de la producción anual debe ser dividida por el número de años del ciclo de vida. En U. uruguayensis el ciclo de vida, incluyendo los estadíos larvales, comprende dos años (Spivak et al. 1991), y por lo tanto, el cálculo de la producción anual se realizó dividiendo entre dos.
Resultados
Las variables fisicoquímicas registradas son las típicas de un ecosistema estuarial: la temperatura del agua varió entre 10°C (julio de 2002) y 30.7°C (diciembre de 2002), el pH entre 7.82 (diciembre de 2002) y 8.97 (julio de 2002), y la salinidad, obtenida al multiplicar la conductividad medida por 0.9, varió entre 607.5 (julio de 2002) y 6741 mg L-1 (febrero de 2003). El contenido de materia orgánica y carbono orgánico de los sedimentos presentó valores bajos a medios (1.29-2.52% y 0.75-1.46%, respectivamente) con referencia a suelos, y de acuerdo a la granulometria, los sedimentos son arcillosos.
Se recolectaron 1200 ejemplares de U. uruguayensis (216 megalopas y 984 indiferenciados y adultos) durante todo el período de muestreo, excepto en julio de 2002, fecha en que no se hallaron cangrejos en la superficie ni en sus cuevas hasta una profundidad de 50 cm.
Se reclutaron seis cohortes durante el periodo estudiado (fig. 1), dos de ellas coexistiendo en septiembre y diciembre de 2001 (n4 y n5), y dos en abril y octubre de 2002 (n3 y n4), mientras en las otras fechas de muestreo coexistieron tres: marzo y junio de 2001 (n4, n5 y n6), diciembre de 2002 (n2, n3 y n4) y febrero de 2003 (n1, n2 y n3). La cohorte n4 se halló durante casi todo el periodo de muestreo, desde marzo de 2001 hasta diciembre de 2002. Se capturaron hembras ovígeras en diciembre de 2001 y 2002 y en febrero de 2003; en esta última fecha se detectó un incremento notorio en la salinidad del agua, que coincidió con el asentamiento de las megalopas en todas las estaciones de muestreo.

Se estableció el patrón de crecimiento de U. uruguayensis mediante una función potencial (y = a xb), donde el ancho del caparazón (AC) fue la variable independiente (fig. 2). Machos, hembras y ejemplares indiferenciados se analizaron separadamente y en conjunto, demostrando una alometría positiva en el peso corporal (constante alométrica b > 3), excepto los individuos indiferenciados. Los machos presentaron el mayor incremento alométrico en el peso. Las ecuaciones de correlación obtenidas fueron: para los machos, PS = 1.6529 10-5 AC3.8753 (n = 396, r2 = 0.83, P < 0.01); en hembras, PS = 3.6959 10-5 AC3.3515 (n = 358, r2 = 0.85, P < 0.01); en indiferenciados, PS = 7.2861 10-5 AC2.8734 (n = 126, r2 = 0.69, P < 0.01); y en conjunto, PS = 3.008 10-5 AC3.5228 (n = 880, r2 = 0.96, P < 0.01).
Los cálculos realizados para obtener la producción anual en U. uruguayensis se presentan en la tabla 1. Según López-Greco y Rodríguez (1999), la talla mínima de madurez funcional en las hembras puede determinarse por la hembra ovígera más pequeña recolectada. Considerando que la menor hembra ovígera capturada midió 9.1 mm, la contribución mayor a la producción estuvo dada por individuos maduros, en particular por los incluidos en el intervalo de tallas de 10 a 11.99 mm. Por otro lado, se registró un escaso número de individuos dentro del intervalo de clase de 6 a 7.99 mm. Considerando a los machos, hembras y cangrejos indiferenciados en forma independiente, la producción anual fue de 1.4641, 0.9295 y 0.0302 g m-2 a-1, respectivamente.
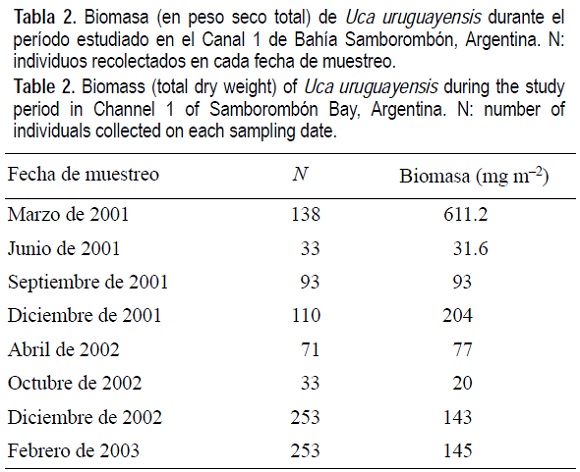
Durante el periodo estudiado la biomasa (expresada como PS total) varió entre 20 y 611 mg m-2 y, como puede apreciarse en la tabla 2, los mayores valores se registraron en el verano.
Discusión
Los cangrejos violinistas se distribuyen por las regiones tropicales y templadas del planeta, viven principalmente en los estuarios y bahías protegidas donde construyen cuevas y se alimentan de organismos y materia orgánica asociados a los sedimentos. En Argentina la población más numerosa y estable de U. uruguayensis habita en Bahía Samborombón, donde alcanza densidades de 42 ind m-2 (César et al. 2005).
Los sedimentos de esta llanura costera han sido descritos por Violante et al. (2001). En nuestras estaciones de muestreo predominaron las arcillas y los valores de materia orgánica hallados fueron similares a los citados para esa fracción por Ieno (2000), más al sur de la Bahía Samborombón. Aún queda por dilucidar que papel juegan los sedimentos y la estructura comunitaria de su fauna en la producción secundaria de U. uruguayensis.
En las especies de Uca de la zona tropical, donde su reproducción es casi continua a lo largo del año, los cangrejos violinistas presentan una distribución unimodal de tallas. Por el contrario, las especies de distribución templada, tienden a concentrar su reproducción en los meses cálidos del año con una progresión hacia una distribución polimodal de frecuencias de tallas (Thurman 1985). En la población estudiada en el Canal 1, encontramos dos o tres cohortes simultáneas, con el periodo de reproducción extendiéndose desde fines de primavera hasta fines de verano. Como se señalara anteriormente, los cangrejos se recolectaron durante todo el periodo de muestreo, excepto en el invierno de 2002. Esta ausencia de ejemplares en la superficie pudo deberse a mortalidad o al ocultamiento en las cuevas e inactividad, producto de las bajas temperaturas registradas durante esos días en la región. En consecuencia, los valores de biomasa registrados en la primavera siguiente fueron los menores de todo el periodo estudiado. Al respecto puede mencionarse que la población de U. uruguayensis estudiada por Spivak et al. (1991) en la Laguna Mar Chiquita, también presentó una distribución bimodal de frecuencias de tallas durante la mayor parte del año, inactividad de los organismos en el invierno y un descenso importante en las tasas de crecimiento de ambos sexos en otoño e invierno. En relación a ello parecería que esta especie presenta una dinámica poblacional semejante a lo largo de su distribución en Argentina.
En la bibliografía consultada (ver Introducción), los cálculos de la producción se basan en estimaciones no uniformes del peso corporal, algunos utilizan el peso húmedo (Ferreira-Fontoura y Buckup 1991, Anastácio y Marques 1995), el peso seco a 95°C (Hanekom y Baird 1992) o el PS libre de cenizas (Heck et al. 1995). De aquí que sólo encontramos valores de producción anual comparables en peso seco a los registrados en U. uruguayensis (e.g., 23 kg ha-1) en Orconectes virilis (Hagen) del Lago Michigan (Waters 1977), pero son menores que los calculados para el cangrejo de interés económico Callinectes sapidus Rathbun, 1896 (Fredette et al. 1990). Sin embargo, es de destacar la talla mucho mayor de este último cangrejo respecto a la especie estudiada.
Aquellos individuos que alcanzaron la madurez reproductiva fueron los que contribuyeron en mayor medida a la producción secundaria. En particular, los machos de Uca presentan un quelípedo hipertrofiado, que a menudo representa la mitad del peso total del animal (Kaestner 1970). Por otro lado, hubo una ausencia considerable de individuos prepúberes, la cual pudo deberse a un incremento en la mortalidad en esas tallas. Esto podría explicarse por una depredación diferencial: la becasa de mar y el chorlo dorado (ver Introducción) depredan sobre U. uruguayensis en diferente medida. La primera se alimenta principalmente de poliquetos como Laeonereis acuta Treadwell, 1923, y del cangrejo aquí estudiado, especialmente de individuos de tallas pequeñas a medianas. La otra especie depreda principalmente a U. uruguayensis mediante una táctica particular: observa con atención a la presa y luego de una rápida carrera extrae al cangrejo de su cueva (Ieno 2000).
El uso sustentable de los recursos naturales con propósitos de conservación es esencial para el manejo de las áreas naturales protegidas, por ello el conocimiento básico de la biología y ecología de las especies que las habitan es fundamental para lograr este objetivo (Shafer 1990). La contribución de U. uruguayensis al ecosistema del cangrejal, medida en valores de biomasa, fue variable a lo largo del periodo de muestreo, correspondiendo los valores máximos a los meses de marzo y diciembre de 2001 (611.2 y 204 mg m-2, respectivamente), diciembre de 2002 (143 mg m-2) y febrero de 2003 (145 mg m-2), lo que coincide con el periodo de mayor actividad de la especie, con temperaturas por encima de 23°C y con el desarrollo de la conducta de cortejo de los machos. Por el contrario, en junio de 2001 la biomasa desciende a 31.6 mg m-2 y comienza a aumentar en septiembre (93 mg m-2), registrando un aumento en abril de 2002 (77 mg m-2). Como se mencionara anteriormente, en julio de 2002, debido a los fenómenos climáticos acaecidos, no se registraron cangrejos en superficie y en octubre comenzó a crecer la biomasa, aunque en el verano de 2002 ésta no alcanza los valores registrados en el primer muestreo.
Finalmente, los resultados del presente trabajo brindan información básica acerca de la producción secundaria y biomasa de U. uruguayensis, con la finalidad de que pueda ser utilizada por la autoridad local en programas de manejo ambiental.
Agradecimientos
Queremos expresar nuestro agradecimiento a JE Giménez, del Instituto de Geomorfología y Suelos (IGS), por la determinación de la granulometría y materia orgánica del sedimento; y a los Guardaparques del Refugio de Vida Silvestre Bahía Samborombón, Daniel McLean y Pablo Rojas, por su apoyo en los muestreos efectuados.
Referencias
Allison LE. 1965. Organic carbon. In: Black CA (ed.), Methods of Soil Analysis. Part 2. Chemical and Microbiological Properties. American Society of Agronomy, Madison, Wisconsin, pp. 1367-1378. [ Links ]
Anastácio PM, Marques JC. 1995. Population biology and production of the red swamp crayfish Procambarus clarkii (Girard) in the lower Mondego River Valley, Portugal. J. Crust. Biol. 15(1): 156-168. [ Links ]
Boschi EE. 1988. El ecosistema estuarial del Río de la Plata (Argentina y Uruguay). An. Inst. Cienc. Mar Limnol. Univ. Nac. Autón. Méx. 15(2): 159-182. [ Links ]
Calcagno JA, López-Gappa J, Tablado A. 1997. Growth and production of the barnacle Balanus anphitrite in an intertidal area affected by sewage pollution. J. Crust. Biol. 17(3): 417-423. [ Links ]
Cartes JE, Sorbe JC. 1999. Estimating secondary production in bathyal suprabenthic peracarid crustaceans from the Catalan Sea slope (western Mediterranean; 391-1255 m). J. Exp. Mar. Biol. Ecol. 239: 195-210. [ Links ]
César II, Armendáriz LC, Becerra RV. 2005. Bioecology of the fiddler crab Uca uruguayensis and the burrowing crab Chasmagnathus granulatus (Decapoda, Brachyura) in the Refugio de Vida Silvestre Bahía Samborombón, Argentina. Hydrobiología 545(1): 237-248. [ Links ]
Dehdashti B, Blinn DW. 1991. Population dynamics and production of the pelagic amphipod Hyalella montezuma in a thermally constant system. Freshwat. Biol. 25: 131-141. [ Links ]
Elliott JM. 1983. Some methods for the statistical analysis of samples of benthic invertebrates. Freshwater Biological Association, Scientific Publication No. 25, 156 pp. [ Links ]
Ferreira-Fontoura N, Buckup L. 1991. Biomassa e produtividade de uma população natural de Parastacus brasiliensis (Crustacea, Parastacidae). Rev. Bras. Biol. 51(2): 289-293. [ Links ]
Fogarty MJ, Idoine JS. 1986. Recruitment dynamics in an American lobster (Homarus americanus) population. Can. J. Fish. Aquat. Sci. 43: 2368-2376. [ Links ]
Fredette TJ, Diaz RJ, van Montfrans J, Orth RJ. 1990. Secondary production within a seagrass bed (Zostera marina and Ruppia maritima) in Lower Chesapeake Bay. Estuaries 13(4): 431-440. [ Links ]
Hanekom N, Baird D. 1992. Growth, production and consumption of the thalassinid prawn Upogebia africana (Ortmann) in the Swartkops estuary. S. Afr. Tydskr. Dierk. 27(3): 130-139. [ Links ]
Heck KL, Able KW, Roman CT, Fahay MP. 1995. Composition, abundance, biomass, and production of macrofauna in a New England Estuary: Comparisons among eelgrass meadows and other nursery habitats. Estuaries 18(2): 379-389. [ Links ]
Ieno EN. 2000. Las comunidades bentónicas de fondos blandos del norte de la Provincia de Buenos Aires: Su rol ecológico en el ecosistema costero. Tesis doctoral, Facultad de Ciencias Exactas y Naturales, Universidad Nacional de Mar del Plata, Argentina. [ Links ]
Kaestner A, Levi HW, Levi LR. 1970. Invertebrate Zoology. Crustacea. Vol. III. Interscience Publishers, New York, 523 pp. [ Links ]
Krueger CC, Martin FB. 1980. Computation of confidence intervals for the size-frequency (Hynes) method of estimating secondary production. Limnol. Oceanogr. 25(4): 773-777. [ Links ]
López-Greco LS, Rodríguez EM. 1999. Size at the onset of sexual maturity in Chasmagnathus granulatus Dana, 1851 (Grapsidae, Sesarminae): A critical overall view about the usual criteria for its determination. Proc. Fourth International Crustacean Congress, Leiden, pp. 675-689. [ Links ]
Martien RF, Benke AC. 1977. Distribution and production of two crustaceans in a wetland pond. Am. Midl. Nat. 98(1): 162-175. [ Links ]
Menzie CA. 1980. A note on the Hynes method of estimating secondary production. Limnol. Oceanogr. 25: 770-773. [ Links ]
Runck C, Blinn DW. 1990. Population dynamics and secondary production by Ranatra montezuma (Heteroptera: Nepidae). J. N. Am. Benthol. Soc. 9(3): 262-270. [ Links ]
Runck C, Blinn DW. 1993. Secondary production by Telebasis salva (Odonata) in a thermally constant aquatic ecosystem. J. N. Am. Benthol. Soc. 12(2): 136-147. [ Links ]
Shafer CL. 1990. Nature Reserves Island. Theory and Conservation Practice. Smithsonian Institution Press, Washington, 189 pp. [ Links ]
Spivak ED. 1997a. Los crustáceos decápodos del Atlántico sudoccidental (25°-55°S): Distribución y ciclos de vida. Invest. Mar. 25: 69-91. [ Links ]
Spivak ED. 1997b. Cangrejos estuariales del Atlántico sudoccidental (25°-41°S) (Crustacea: Decapoda: Brachyura). Invest. Mar. 25: 105-120. [ Links ]
Spivak ED, Gavio MA, Navarro CE. 1991. Life history and structure of the world's southernmost Uca population: Uca uruguayensis (Crustacea, Brachyura) in Mar Chiquita Lagoon (Argentina). Bull. Mar. Sci. 48(3): 679-688. [ Links ]
Thurman C. 1985. Reproductive biology and population structure of the fiddler crab Uca subcylindrica (Stimpson). Biol. Bull. 169: 215-229. [ Links ]
Vervoorst FB. 1967. La vegetación de la República Argentina. VII. Las comunidades vegetales de la depresión del Salado (Provincia de Buenos Aires). Instituto Nacional de Tecnología Agropecuaria, Serie Fitogeográfica No. 7, 259 pp. [ Links ]
Violante RA, Parker G, Cavallotto JL. 2001. Evolución de las llanuras costeras del este bonaerense entre la bahía Samborombón y la laguna Mar Chiquita durante el Holoceno. Rev. Asoc. Geol. Arg. 56(1): 51-66. [ Links ]
Waters TF. 1977. Secondary production in inland waters. Adv. Ecol. Res. 10: 91-164. [ Links ]
Whitemore N, Huryn AD. 1999. Life history and production of Paranephrops zealandicus in a forest stream, with comments about the sustainable harvest of a freshwater crayfish. Freshwat. Biol. 42: 467-478. [ Links ]














