Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.32 no.1b Ensenada mar. 2006
Nota de Investigación
Ejercicio interlaboratorio con bioensayos marinos para la evaluación de la calidad ambiental de sedimentos costeros. III. Bioensayo con embriones del erizo de mar Paracentrotus lividus
Interlaboratory assessment of marine bioassays to evaluate the environmental quality of coastal sediments in Spain. III. Bioassay using embryos of the sea urchin Paracentrotus lividus
MC Casado-Martínez1*, N Fernández1, J Lloret2, A Marín3, C Martínez-Gómez4, I Riba5, R Beiras6, L Saco-Álvarez6, TA DelValls1
1 Departamento de Química Física, Facultad de Ciencias del Mar y Ambientales, Polígono Río San Pedro s/n, 11510 Puerto Real, Cádiz, España. * E-mail: mcarmen.casado@uca.es
2 Servicio de Cultivo Celulares, SACE, Universidad de Murcia, 30100 Murcia, España.
3 Departamento de Ecología e Hidrología, Facultad de Biología, Universidad de Murcia, 30100 Murcia, España.
4 Instituto Español de Oceanografía, Centro Oceanográfico de Murcia, Varadero, I. Lo Pagán, 30740 San Pedro del Pinatar (Murcia), España.
5 Consejo Superior de Investigaciones Científicas, Instituto de Ciencias Marinas de Andalucía, Polígono Río San Pedro s/n, 11510 Puerto Real, Cádiz, España.
6 Laboratorio de Ecoloxía Mariña, Universidade de Vigo, Campus Lagoas-Marcosende, E-36200, Vigo, España.
Recibido en noviembre de 2004;
aceptado en septiembre de 2005.
Resumen
El presente trabajo resume los resultados del ejercicio realizado para estudiar la variabilidad interlaboratorio del ensayo con estadios larvarios del erizo de mar Paracentrotus lividus. Este ejercicio, que se desarrolló en dos fases distintas, incluyó cuatro laboratorios cada uno de los cuales estudió la toxicidad de las seis muestras de sedimento distribuidas. Las muestras, provenientes de distintos puertos de la costa española, se caracterizaron mediante la exposición de embriones del erizo de mar Paracentrotus lividus durante 48 h a los lixiviados de los sedimentos. La Fase I se utilizó para rediseñar las condiciones del ensayo y evitar posibles factores de confusión al interpretar los resultados. Los resultados de la Fase II fueron más homogéneos al clasificar las muestras según la toxicidad registrada, a pesar de la variabilidad en los protocolos de obtención y ensayo de los lixiviados. De acuerdo con estos resultados, el ensayo es adecuado para la caracterización de este tipo de muestras con una variabilidad interlaboratorio similar a la encontrada para otros bioensayos en estudios interlaboratorio previos.
Palabras clave: material de dragado, toxicidad embrionaria, ecotoxicología, lixiviados.
Abstract
The present paper reports the results of an interlaboratory variability study of a bioassay using larval stages of the marine sea urchin Paracentrotus lividus. This exercise was developed in two different phases and included four laboratories, each of which determined the toxicity of six sediment samples. The samples were collected from different Spanish ports and were characterized by exposing sea urchin embryos for 48 h to sediment elutriates. Phase I was used to redesign test parameters and to avoid possible interfering factors when interpreting test results. Laboratories were more homogeneous in the classification of sediments according to the toxic responses in Phase II despite the high variability of the elutriate testing protocols. Based on our results, the test seems suitable to characterize dredged material, the interlaboratory variability being similar to that found for other bioassays in previous studies.
Key words: dredged material, embryo toxicity, ecotoxicology, elutriates.
Introducción
Los bioensayos con estadios embrionarios y larvarios de invertebrados marinos han sido frecuentemente utilizados para evaluar la calidad ambiental de muestras de sedimentos (Carr 1996; DelValls et al. 1998; Beiras et al. 2001, 2003a, 2003b; 1996; DelValls et al. 1998; Beiras et al. 2001, 2003a, 2003b; Mariño-Balsa et al. 2003), así como la toxicidad de contaminantes concretos (Fernández y Beiras 2001, Cesar et al. 2002), y son considerados un método rápido y sensible para la caracterización de la toxicidad de sedimentos marinos. Entre los bionsayos embrio-larvarios más utilizados se encuentran los realizados con ostras (Crassostrea gigas) y con erizos de mar (Paracentrotus lividus, Sphaerechinus granularis, Strongylocentrotus purpuratus, S. droebachiensis, Dendraster excentricus o Arbacia punctulata). Estas especies son abundantes y se encuentran distribuidas a lo largo de las costas españolas, generalmente son fáciles de recoger y pueden ser mantenidas fácilmente en el laboratorio. La obtención de gametos y su fecundación in vitro son relativamente simples y, debido a la rapidez con que se completa el desarrollo embrionario, pueden obtenerse resultados en un corto periodo de tiempo. Desde que el erizo de mar fue utilizado por primera vez en 1951 por Wilson, se han desarrollado numerosas investigaciones para la estandarización de protocolos y para evitar los diferentes factores de confusión que pueden interferir en los resultados y su interpretación. Hoy en día existen distintos protocolos estándar (SOPs) para la evaluación de la toxicidad de lixiviados de sedimentos con distintas especies, entre ellos cabe citar el USEPA (1995) para S. purpuratus y S. droebachiensis, RIKZ (1999) para C. gigas y el de la ASTM (1995) para A. punctulata, S. droebachiensis, S. purpuratus y D. excentricus.
Para este ejercicio interlaboratorio se distribuyó a cada laboratorio participante un protocolo obtenido de acuerdo con los distintos estándares disponibles. Los principales factores que podían contribuir a la variabilidad interlaboratorio incluían el distinto origen de los organismos (y por lo tanto distinto estado de desarrollo gonadal, distinta aclimatación y manipulación) y la introducción de variantes durante el proceso de obtención de los lixiviados. Otras fuentes de variabilidad importantes están relacionadas al contenido en sulfuros o material en suspensión de los lixiviados (Fernández 2002). El objetivo de este trabajo fue evaluar la habilidad de los diferentes laboratorios para caracterizar materiales de dragado mediante el ensayo con el desarrollo embrionario de erizos de mar, y evaluar las diferencias obtenidas entre los resultados de cada laboratorio.
Material y métodos
Fase I
El primer ejercicio de intercalibración se llevó a cabo en 2003. En esta primera fase se evaluó la toxicidad de seis muestras de sedimento provenientes de distintas zonas de la costa española (Casado-Martínez et al. 2006). Para la obtención de los lixiviados se recomendó la siguiente modificación del método USEPA (1998): los sedimentos previamente homogeneizados debían mezclarse con agua de mar control en una proporción 1:4 v/v (sedimento:agua) y mantenerse en agitación rotatoria durante 30 min a 20°C. Se recomendó un tiempo de decantación de 12 h transcurrido el cual se retiraría el sobrenadante sin remover el sedimento del fondo.
Los embriones utilizados para las pruebas provenían de una sola pareja de organismos maduros de P. lividus, recogidos in situ en la localidad correspondiente a cada laboratorio. Los gametos se obtuvieron o bien provocando la puesta por choque osmótico (inyectando 1 mL de KCl 0.5 M) o mediante la disección de los organismos y la extracción directa de los gametos. Los huevos se mantuvieron en agua de mar control mientras que el esperma se conservó en seco y en frío hasta el momento de su uso. Treinta minutos o menos después de la obtención de los gametos se realizó la fecundación in vitro añadiendo unos microlitros de esperma a la suspensión de huevos en agua de mar control. Tras una agitación suave para facilitar la fecundación, que ocurre en pocos minutos, se estimaron la densidad y el porcentaje de fecundación (indicado por la presencia de la membrana de fecundación característica) en al menos tres muestras y se tomó el valor medio. Una vez conseguida la fecundación, se introdujeron 20-30 embriones mL-1 en los recipientes de incubación conteniendo los lixiviados. Se recomendó un mínimo de cuatro réplicas por cada uno de los lixiviados, más una serie control conteniendo agua de mar como matriz. Este control negativo de toxicidad permite evaluar la calidad del agua utilizada para la obtención de los lixiviados así como la idoneidad del material biológico, evitando falsos positivos. Pasadas 48 h de incubación a 20°C y oscuridad, las muestras se fijaron con unas gotas de formaldehído al 40%. La respuesta biológica estudiada fue el éxito en la embriogénesis tras el periodo de incubación, medido como porcentaje de larvas pluteus normales (que presentraron los cuatro brazos bien desarrollados). Esta respuesta fue observada en cada réplica de 100 individuos. Los parámetros y condiciones para el desarrollo del ensayo se recogen en la tabla 1.
Fase II
El segundo ejercicio se realizó en 2004. El ensayo se realizó de acuerdo al protocolo estándar proporcionado para la Fase I, con algunas modificaciones encaminadas a mejorar la homogeneidad metodológica en base a los resultados obtenidos durante la fase previa. Se recomendó la aireación de los lixiviados antes de la incubación de los organismos, con el objetivo de eliminar falsos positivos causados por la presencia de sulfuros o amonio en las muestras.
Análisis de los resultados
Las diferencias significativas entre las respuestas a los distintos lixiviados se determinaron mediante ANOVA y el test de Tukey. Previamente se comprobó la homocedasticidad de los datos aplicando el test de Levene. Estos análisis se realizaron con el software estadístico SPSS 11.5. Para estudiar la variabilidad interlaboratorio se utilizó el coeficiente de la varianza (CV) calculado como el cociente entre la desviación estándar (SD) y la media de todos los laboratorios (X):

Resultados
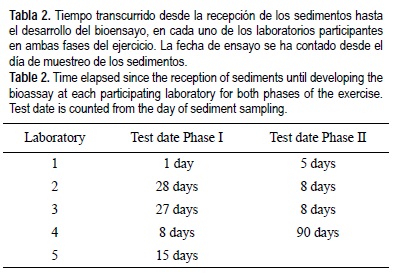
En la tabla 2 se muestran los laboratorios participantes y los días transcurridos desde la recepción de las muestras hasta que se desarrollaron ambas fases del estudio. El ejercicio contó con cinco participantes para la Fase I y cuatro para la Fase II con la estructura necesaria para realizar el bioensayo. Todos ellos finalizaron la primera fase en menos de un mes desde la recepción de los sedimentos (USEPA 1994) y por lo tanto no se esperan diferencias debidas a distintos tiempos de almacenamiento de los sedimentos. Para la Fase II del estudio todos los laboratorios iniciaron el ensayo en menos de tres días desde la recepción de las muestras, excepto el laboratorio 4 que realizó el ensayo después de tres meses de almacenaje de los sedimentos debido a problemas logísticos.
Los resultados de la Fase I se resumen en la tabla 3. Aunque se envió un protocolo con las muestras de sedimento, se encontraron diferencias importantes en las condiciones de ensayo de los distintos laboratorios: en algunos laboratorios los lixiviados se airearon antes de introducir los organismos y/o se filtraron después de la decantación. Todos los factores que podían introducir variabilidad en los resultados fueron estudiados antes de la preparación de la serie de muestras enviadas en la Fase II. Otro factor a tener en cuenta es el resultado de los controles de toxicidad negativos en tres de los laboratorios (marcados con un asterisco en la tabla) ya que no cumplían los criterios de aceptabilidad del ensayo al no obtenerse el porcentaje mínimo de larvas normales del 90%. Esto puede estar indicando una baja calidad del agua o del material biológico detectándose una toxicidad espuria.
Otros factores de confusión importantes son los relacionados con la obtención del lixiviado, como por ejemplo el uso de agitadores magnéticos en lugar del método del volteo, o el aumento del tiempo de decantación de la mezcla. Estos factores pueden influir en el resultado y la sensibilidad del ensayo ya que afectan directamente a la movilidad de los distintos contaminantes desde el sedimento a la fase líquida. Un factor relacionado con éstos es la aireación de la muestra. En este sentido se ha registrado una extremadamente alta inhibición en el desarrollo embrionario con la muestra A, con niveles de contaminación, aunque muy bajos, según los resultados de los análisis químicos (Casado-Martínez et al. 2006) y que podrían estar directamente relacionados con la presencia de sulfuro de hidrógeno. Esta sustancia, presente de forma natural en los sedimentos anóxicos y cuya concentración puede aumentar durante el almacenamiento de la muestra, puede producir resultados de toxicidad elevada para el ensayo con embriones del erizo de mar que pueden ser atribuidos erróneamente a la presencia de contaminantes en el sedimento (Lapota et al. 2000). En este sentido, al parecer, las muestras que han podido verse afectadas por este factor son las correspondientes al puerto de Cádiz (muestras A y B) con una gran variabilidad en el porcentaje de larvas normales y en la clasificación de las muestras. El CV medio para la Fase I fue de 61%, con valores comprendidos entre 9.7% para el control de toxicidad negativo y 115% para la muestra B. Las muestras D y E, no tóxicas, obtuvieron los CV más bajos, de 25.6% y 25.4% respectivamente.
Todos los factores que podían introducir variabilidad en los resultados fueron estudiados antes de la preparación de la serie de muestras enviadas en la Fase II. Para ésta se envió de nuevo un conjunto de muestras a cada uno de los laboratorios participantes, con un protocolo más detallado e instrucciones para evitar los factores de confusión encontrados en la Fase I. Los resultados de la Fase II se incluyen en la tabla 4 como porcentaje de pluteus normales (corregidos por el porcentaje de larvas normales en el control) así como X, SD y CV para cada muestra. Los resultados se representan en la figura 1 conjuntamente con el criterio para clasificar las muestras como tóxicas o no tóxicas (reducción del porcentaje de larvas pluteus normales superior a 20% respecto al control) establecido en base a resultados previos (DelValls et al. 2003). Excepto los resultados del laboratorio 3, en donde se encontraron niveles de toxicidad superiores en todas las muestras incluida la de menor contaminación, los de los otros tres laboratorios son más homogéneos que los obtenidos en la Fase I: todos los laboratorios consideraron la muestra E' (con niveles altos de compuestos de tipo orgánico; Casado-Martínez et al. 2006) altamente tóxica, y las muestras A' (excepto para el laboratorio 3) y B' no tóxicas. El resto de las muestras (C', D' y F') fueron consideradas tóxicas en todos los casos excepto la muestra F' en el laboratorio 2, aunque los porcentajes de larvas normales observados varían mucho entre laboratorios y por lo tanto una variación en el criterio de toxicidad podría hacer variar considerablemente la homogeneidad en la clasificación de las muestras de los laboratorios. Esta variabilidad en los porcentajes de larvas normales observados se refleja en los valores de CV, que varían entre 12% y 190% para esta segunda fase.
En el caso de la Fase II el porcentaje medio de larvas pluteus normales en los controles fue de 97% y en todos los laboratorios se superó el criterio de aceptabilidad del ensayo, con un CV menor a 1%. Para las muestras A' y B' el CV fue de 23% y 12% de acuerdo con la baja toxicidad registrada, las muestras con un grado de toxicidad intermedio obtuvieron CV entre 64% y 79% y, como se ha mencionado anteriormente, la muestra E' obtuvo la mayor variabilidad aunque los resultados sean más semejantes en la clasificación. Los resultados de los parámetros estadísticos calculados excluyendo los resultados del laboratorio 3 que parece evidenciar cierta tendencia anómala a registrar toxicidades superiores que el resto de laboratorios, reflejan una menor variabilidad especialmente para las muestras A', B' y C'.
Discusión
En general, se encontraron pocos laboratorios con infraestructura y un mínimo de experiencia en el desarrollo del ensayo con embriones de erizo de mar para la evaluación de la calidad de lixiviados de sedimentos. La variabilidad interlaboratorio de este ensayo, en estudios precedentes, ha sido de 63% cuando se calibra la EC50 (concentración efectiva que causa una disminución de la respuesta en el 50% de la población), valor similar a los registrados por los análisis químicos (Environment Canada 1992). Los resultados de este estudio son similares y, como en otros estudios, la variabilidad es mucho mayor cuando se ensayan sedimentos contaminados. En Holanda se han incluido dos ensayos para la evaluación de la toxicidad de lixiviados de sedimentos en los estudios de precisión interlaboratorio: el ensayo con embriones de ostra y el ensayo con rotíferos. Mientras el primero de ellos obtuvo CVs entre 34% y 210%, el ensayo con rotíferos fue considerado directamente no aconsejable ya que los resultados demostraron que era fundamental la experiencia previa para el desarrollo del ensayo (Stronkhorst 2003).
En nuestro estudio, el criterio para considerar las muestras como tóxicas o no tóxicas es doble e implica una diferencia estadística significativa (P ≤ 0.05) y una reducción del porcentaje de larvas pluteus normales superior a 20% respecto al control negativo de toxicidad. El resultado de estos análisis estadísticos se incluye en la figura 2. La clasificación es homogénea entre laboratorios aunque se encuentran algunas diferencias entre las estaciones de toxicidad intermedia (F', C' y D'). Se observaron determinadas tendencias en los resultados de algunos laboratorios y estas tendencias parecen ser debidas a los criterios utilizados por el operador para clasificar las larvas como normales o no normales. Por ejemplo, el laboratorio 2 tiende a detectar menor toxicidad que el resto de laboratorios mientras que el laboratorio 3 detecta siempre valores superiores. Parece no haber confusión en los controles o en las muestras claramente contaminadas donde los embriones no pasan de los primeros estadios de desarrollo (gástrula), pero este factor puede ser decisivo para niveles de toxicidad que interrumpen el desarrollo larvario en estados intermedios de desarrollo ya que el cambio exacto de pre-pluteus a pluteus es muy subjetivo (ver fig. 3). Por esta razón se recomienda la formación específica de los operadores.


Las diferencias entre los niveles de toxicidad interlaboratorio, pueden también deberse al contenido en material en suspensión de los lixiviados ya que éstos no fueron filtrados. La filtración no fue recomendada ya que puede introducir cambios o pérdidas de ciertos contaminantes (ASTM 1994). De cualquier modo, se ha demostrado que la presencia de material particulado puede afectar al desarrollo embrionario del erizo de mar y por tanto el resultado final (Carr 1998). Por ello, la centrifugación a altas velocidades para retirar el material particulado parece ser más recomendable en el caso de los ensayos realizados con el agua intersticial de los sedimentos (Ho et al. 1997). Del mismo modo, la centrifugación debe ser recomendable para evitar este factor de confusión y homogeneizar, en lo posible, los resultados entre laboratorios.
Agradecimientos
Este estudio fue parcialmente desarrollado bajo subvención del Ministerio Español de Ciencia y Tecnología (REN2002 01699/TECNO). El diseño de los ensayos agudos para la caracterización de materiales de dragado se realizó en un proyecto conjunto entre el CEDEX y la Universidad de Cádiz (2001 y 2003). MC Casado-Martínez agradece la financiación del Ministerio Español de Educación y Ciencia en el programa de becas de Formación de Personal Investigador (FPI). Nuestro agradecimiento a E Luque durante la preparación del manuscrito final.
Referencias
ASTM. 1994. Guide for collection, storage, characterization and manipulation of sediments for toxicological testing. Designation E1391-94. Vol. 11.04. Annual Book of ASTM Standards. American Society for Testing and Materials, Philadelphia, PA, 1786 pp. [ Links ]
ASTM. 1995. Standard guide for conducting static acute toxicity tests with echinoid embryos. Designation E1563-95. American Society for Testing and Materials, Philadelphia, PA. [ Links ]
Beiras R, Vázquez E, Bellas J, Lorenzo JI, Fernández N, Macho G, Mariño JC, Casas L. 2001. Sea urchin embryo bioassay for in situ evaluation of the biological quality of coastal sea water. Estuar. Coast. Shelf Sci. 52: 29-32. [ Links ]
Beiras R, Fernández N, Bellas J, Besada V, González-Quijano A, Nunes T. 2003a. Integrative assessment of marine pollution in Peninsula), metal concentrations in seawater, sediments and mussels (Mytilus galloprovincialis) versus embryo-larval bioassays using Paracentrotus lividus and Ciona intestinalis. Mar. Environ. Res. 56: 531-553. [ Links ]
Carr RS. 1996. Sediment quality assessment studies of Tampa Bay, Florida. Environ. Toxicol. Chem. 15: 1218-1231. [ Links ]
Carr RS. 1998. Marine and estuarine pore water toxicity testing. In: Wells PG, Lee K, Blaise C (eds.), Microscale Testing in Aquatic Toxicology: Advantages, Techniques, and Practices. CRC, Boca Raton FL, pp. 526-538. [ Links ]
Casado-Martínez MC, Buceta JL, Forja JM, DelValls TA. 2006. Interlaboratory assessment of marine bioassays to evaluate the environmental quality of coastal sediments in Spain. I. Exercise description and sediment quality. Cienc. Mar. (this issue).
César A, Marín-Guirao L, Vita R, Marín A. 2002. Sensitivity of Mediterranean amphipods and sea urchins to reference toxicants. Cienc. Mar. 28: 407-417. [ Links ]
DelValls TA, Forja JM, Gómez-Parra A. 1998. The use of multivariate analysis in linking sediment contamination and toxicity data to establish sediment quality guidelines: An example in the Gulf of Cádiz (Spain). Cienc. Mar. 24: 127-154. [ Links ]
DelValls TA, Casado-Martínez MC, Riba I, Martín-Díaz ML, Forja JM, García-Luque E, Gómez-Parra A. 2003. Investigación conjunta sobre la viabilidad de utilizar ensayos ecotoxicológicos para la evaluación de la calidad ambiental del material de dragado. Rep. Téc. CEDEX, noviembre de 2003, Puerto Real, Cádiz. [ Links ]
Environment Canada. 1992. Biological test method: Fertilisation Assay Using Echinoids Sea urchins and Sand dollars. EPS 1/RM/27. [ Links ]
Fernández N. 2002. Evaluación biológica de la contaminación marina costera mediante bioensayos con embriones del erizo de mar Paracentrotus lividus. Tesis doctoral, Universidad de Vigo, España. [ Links ]
Fernández N, Beiras R. 2001. Combined toxicity of dissolved mercury with copper, lead and cadmium on embryogenesis and early larval growth of the Paracentrotus lividus sea urchin. Ecotoxicology 10: 263-271. [ Links ]
Ho KT, McKinney RA, Kuhn A, Pelletier MC, Burgess RM. 1997. Identification of acute toxicants in New Bedford Harbor sediments. Environ. Toxicol. Chem. 16: 551-558. [ Links ]
Lapota D, Duckworth D, Word J. 2000. Confounding factors in sediment toxicology. Issue papers. SPAWAR Systems Center, San Diego, 19 pp. [ Links ]
Mariño-Balsa JC, Pérez P, Estévez-Blanco P, Saco-Álvarez L, Fernández E, Beiras R. 2003. Assessment of the toxicity of sediment and sea water polluted by the Prestige fuel spill using bioassays with clams (Venerupispullastra, Tappes decussatus, and Venerupis rhomboideus) and the microalga Skeletonema costatum. Cienc. Mar. 29: 115-122. [ Links ]
RIKZ. 1999. Standard operating procedure. Species-05. Marine oyster Crassostrea gigas embryo-larvae mortality and development sediment toxicity test. RIKZ/AB-99.118x. [ Links ]
Stronkhorst J. 2003. Ecotoxicological effects of Dutch harbour sediments. The development of an effects-based assessment framework to regulate the disposal of dredged material in coastal waters of the Netherlands. PhD thesis, Vrije Universiteit. [ Links ]
USEPA. 1994. Methods for assessing the toxicity of sediment-associated contaminants with estuarine and marine amphipods. United States Environmental Protection Agency, EPA/600/R-94/025. [ Links ]
USEPA. 1995. Short-term methods for estimating the chronic toxicity of effluents and receiving waters to West Coast marine and estuarine organisms. United States Environmental Protection Agency, EPA/600/R-95/136. [ Links ]
USEPA. 1998. Evaluation of dredge material proposed for discharge in waters of the US. Testing manual (The Inland Testing Manual). United States Environmental Protectio Agency, EPA-823-F-98-005. [ Links ]














