Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.32 no.1b Ensenada mar. 2006
Nota de Investigación
Ejercicio interlaboratorio de bioensayos marinos para la evaluación de la calidad ambiental de sedimentos costeros en España. II. Ensayo de inhibición de la bioluminiscencia para la evaluación rápida de la toxicidad de sedimentos
Interlaboratory assessment of marine bioassays to evaluate the environmental quality of coastal sediments in Spain. II. Bioluminescence inhibition test for rapid sediment toxicity assessment
MC Casado-Martínez1*, T Campisi2, A Díaz3, R Lo Re 4, R Obispo5, JF Postma6, I Riba7, AC Sneekes8, JL Buceta5, TA DelValls1
1 Departamento de Química Física, Facultad de Ciencias del Mar y Ambientales, Polígono Río San Pedro s/n, 11510 Puerto Real, Cádiz, España. *E-mail: mcarmen.casado@uca.es
2 Centro Ricerche e Servizi Ambientali Fenice, via C. Menotti 48 I, 48023 Marina di Ravenna (RA), Italy.
3 GAIKER Centro Tecnológico, Parque Tecnológico, Edificio 202, 48170 Zamudio, España.
4 Thetis Spa - Castello 2737/F, 30122 Venice, Italy.
5 CEDEX Centro de Estudios de Puertos y Costas, Antonio López 81, 28026 Madrid, España.
6 Aquasense Laboratories, PO Box 95125, 1090 Amsterdam, The Netherlands.
7 Consejo Superior de Investigaciones Científicas, Instituto de Ciencias Marinas de Andalucía, Polígono Río San Pedro s/n, 11510 Puerto Real, Cádiz.
8 TNO-B & O, Water System Quality, PO Box 57, NL-1780 AB Den Helder, The Netherlands.
Recibido en noviembre de 2004;
aceptado en septiembre de 2005.
Resumen
El presente trabajo resume el ejercicio interlaboratorio realizado para evaluar la variabilidad del ensayo Microtox® sobre fase sólida. El ejercicio se dividió en dos fases consecutivas, cada una de ellas desarrollada sobre seis muestras de sedimento de puertos españoles. La Fase I incluyó seis laboratorios y se obtuvieron resultados para el protocolo SPT (Solid Phase Test). La Fase II incluyó siete laboratorios y, además de obtenerse resultados del protocolo SPT, tres de ellos utilizaron también el protocolo para la fase sólida BSPT (Basic Solid Phase Test). Si bien se han identificado factores que pueden tener un cierto efecto sobre los resultados, y por lo tanto en la clasificación de las muestras, los coeficientes de variación obtenidos pueden considerarse entre los valores normales para ensayos biológicos. Si esto se tiene en cuenta para el análisis de los resultados, especialmente para los de la Fase I, la variabilidad baja considerablemente. El protocolo BSPT obtuvo resultados más consistentes que el protocolo SPT aun contando sólo con los resultados de un número reducido de laboratorios. La mayor simplicidad del ensayo pudo ser la causa de esta menor variabilidad.
Palabras clave: Microtox®, material de dragado, Vibrio fischeri, variabilidad interlaboratorio.
Abstract
The Microtox® bioassay was tested in an interlaboratory study to evaluate the variability when using solid-phase samples. The exercise consisted of two consecutive phases each one carried out with six sediment samples from Spanish ports. Phase I included six laboratories that reported results for the solid-phase test (SPT) protocol, while Phase II included seven laboratories for the SPT protocol and three laboratories for the basic solid-phase test (BSPT) protocol. Even though some interfering factors were identified that could affect the results and sample classification, the coefficients of variation (CV) can be considered in the range for biological tests. When these factors are considered for further assessments, interlaboratory variability is significantly reduced. The BSPT showed lower CV values than the SPT despite the small number of participating laboratories. This better performance may be explained either by the simplicity of the methodology.
Key words: Microtox®, round robin test, dredged material, Vibrio fischeri.
Introducción
El ensayo de bioluminiscencia utiliza un cultivo estandarizado de una bacteria marina, Vibrio fischeri NRRL B-11177 previamente conocida como Photobacterium phosphoreum), cuya emisión de luz puede medirse. La luz es emitida como resultado de un ciclo metabólico unido a la respiración celular y, por lo tanto, una interrupción de la respiración celular normal tiene como consecuencia una disminución inmediata de la emisión de luz. Este ensayo se desarrolló inicialmente para evaluar la toxicidad aguda de muestras de agua y aguas residuales así como para extractos (Bulich 1979). Posteriormente este protocolo inicial fue utilizado para la evaluación de la toxicidad de sedimentos mediante la exposición de las bacterias a los lixiviados, al agua intersticial o a extractos con disolventes orgánicos. Aunque este protocolo de ensayo fue ampliamente utilizado para caracterizar sedimentos (Demuth et al. 1993, Carr et al. 1996), más recientemente se ha adaptado como ensayo sobre la fase sólida. De esta manera, este nuevo protocolo incorpora el contacto directo de las bacterias con las partículas de sedimento, así como con el agua intersticial (Microbics 1992).
El ensayo sobre la fase sólida, denominado Microtox® Solid Phase Test (SPT) fue desarrollado por AZUR Environmental (Carlsbad, CA, USA) y se ha usado durante los últimos años en distintos estudios para evaluar toxicidad aguda (Stronkhorst 2003, Riba et al. 2004). El protocolo SPT mide la emisión de luz de las bacterias después de su incubación en contacto directo con una mezcla de sedimento y disolvente, y tras haber sido recuperadas mediante la filtración de la mezcla en estudio. El principal factor de confusión identificado para la interpretación de los resultados está relacionado con la granulometría del sedimento, ya que se ha encontrado un efecto directo del contenido en finos de la muestra sobre la toxicidad registrada (Benton et al. 1995, Ringwood et al. 1997). El más reciente de los protocolos desarrollados por el proveedor del aparato (AZUR 1998a) para muestras sólidas y de sedimento es el Basic Solid Phase Test (BSPT). Este protocolo, más simple y rápido que el SPT, suprime la filtración y mide la emisión de luz cuando la bacteria está aún en contacto con el sedimento, por lo que la emisión de luz no se ve afectada por las bajas tasas de recuperación de las bacterias durante ese paso adicional. El BSPT se ha usado recientemente en distintos estudios (Mowart and Bundy 2001, Abbondanzi et al. 2004, Campisi et al. 2005) y su uso para la evaluación inicial de toxicidad parece igualmente recomendable.
Material y métodos
Fase I
La Fase I del ejercicio para el ensayo Microtox® SPT se desarrolló sobre seis muestras de sedimento de puertos españoles distribuidas por la Universidad de Cádiz (Casado-Martínez et al. 2006) y según el procedimiento operacional estándar (AZUR 1998b). Los parámetros y las condiciones para el desarrollo del ensayo se incluyen en la tabla 1. Cualquier variación al protocolo inicial se incluyó en el informe final de resultados enviado por cada laboratorio participante. Los resultados del ejercicio se recibieron en forma de un valor IC50 (mg L-1), equivalente a la concentración que inhibe el 50% de la luminiscencia con relación a los controles. Para el cálculo de este valor se utilizó el programa informático suministrado con el aparato (Microtox® modelo 500). Cada uno de los laboratorios incluyó también con el informe de resultados los cálculos para la expresión respecto al porcentaje de peso seco de los sedimentos.
Fase II
En 2004, el laboratorio coordinador distribuyó una segunda serie de muestras (Casado-Martínez et al. 2006) sobre la que se desarrolló el SPT de acuerdo con el procedimiento operacional estándar. Tres de los laboratorios realizaron el ensayo siguiendo el protocolo BSPT sobre las mismas muestras. El BSPT se desarrolló de acuerdo con el protocolo operacional estándar proporcionado por la casa comercial (AZUR 1998a). Los parámetros y las condiciones para su desarrollo se incluyen en la tabla 2. Aunque se registraron los valores a los 5, 15 y 30 min de incubación sólo se han incluido los resultados de IC50 a los 30 min.
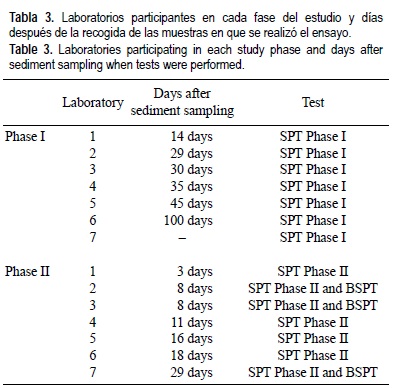
En la tabla 3 se incluyen los laboratorios participantes en cada una de las dos fases y las fechas en las que se desarrolló el ensayo. Los laboratorios se identificaron con un número asignado según el orden de realización del ensayo y por lo tanto los números asignados en la Fase II no corresponden al asignado en la Fase I. La Fase I se completó en un plazo de un mes en todos los laboratorios excepto en los laboratorios 6 y 7, donde el ensayo fue realizado posteriormente. La Fase II del ejercicio se completó en menos de 30 días.
Análisis de los datos
Para el estudio de la reproducibilidad interlaboratorio se calcularon los coeficientes de variación (CV) para cada una de las muestras dividiendo la desviación estándar (SD) por la media de los laboratorios (X),

Se utilizó este valor para esta estimación de la variabilidad ya que ofrece una medida muy descriptiva y altamente comparable con los CV utilizados en las técnicas para análisis químicos (USEPA 1994). En cualquier caso el CV no debería ser el único método para evaluar la precisión de un ensayo ya que los CVs pueden ser muy altos cuando se estudian muestras muy tóxicas o con una toxicidad muy baja. En estos casos el CV puede ser superior al 100% pero las respuestas pueden estar dentro de un rango aceptable. Se calcularon también los valores máximos y mínimos (UWL = X + 2 · SD y LWL = X -2 · SD, respectivamente) para las muestras analizadas para evitar la subjetividad a la hora de descartar los resultados anómalos.
Resultados
La tabla 3 resume la fase y el tiempo de almacenamiento de las muestras previamente al desarrollo del ensayo para cada laboratorio participante. Un código numérico se ha asignado a cada laboratorio de acuerdo a la fecha de ensayo, es decir, los códigos asignados a los laboratorios en la Fase I no tienen por qué corresponder a los asignados en la Fase II. Los resultados enviados por cada laboratorio para ambas fases no se han comparado entre sí ya que quedaba fuera de los objetivos de este estudio. La Fase I se completó en un mes por todos los laboratorios excepto los laboratorios 6 y 7, que enviaron resultados de ensayos realizados tras más de 8 semanas de almacenamiento de los sedimentos. Los resultados para ambas fases del estudio se resumen en la figura 1. Como valor de referencia para la clasificación de las muestras como tóxicas o no tóxicas (principal objetivo en este tipo de ensayos) se utilizó un IC50 de 1000 mg L-1 expresados en peso seco de sedimento para el SPT (Environment Canada 2002). Todas las muestras de la Fase I (fig. 1a) dieron resultados por debajo de este valor excepto la muestra A, la cual fue clasificada como no tóxica por todos los laboratorios aunque con valores de IC50 muy variables. Cada una de las otras cinco muestras fue clasificada como no tóxica por al menos uno de los laboratorios: la muestra E por el laboratorio 4, las muestras B, C y F por el laboratorio 6, y la muestra D por el laboratorio 7. Las muestras ensayadas durante la Fase II (fig. 1b) resultaron clasificadas de manera muy similar, a excepción de las muestras D y E que fueron clasificadas como no tóxica y tóxica, respectivamente, por todos los laboratorios menos uno en cada caso. El protocolo BSPT (fig. 1c) mostró resultados similares en todos los laboratorios participantes excepto para la muestra D que mostró una toxicidad muy distinta en uno de los laboratorios. Dado que no se encontró ningún otro factor de confusión durante el ensayo es posible que esta diferencia fuese debida a la homogeneización y/o muestreo de los sedimentos a la hora de hacer el reparto.
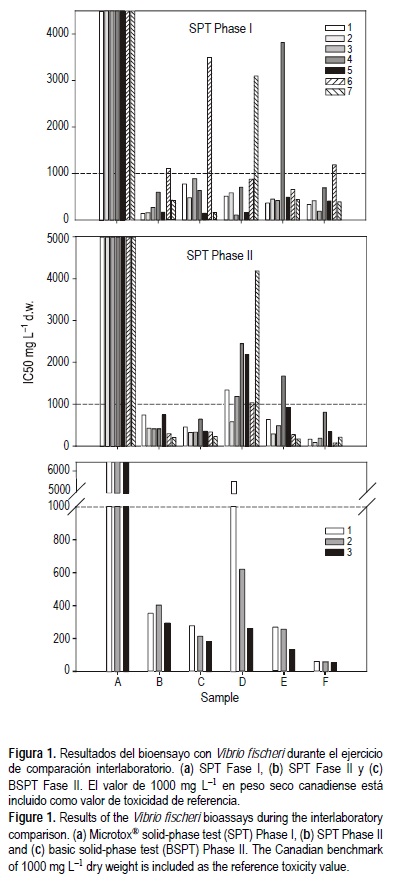
En las tablas 4, 5 y 6 se presentan los resultados de cada laboratorio y el promedio, la desviación estándar, el coeficiente de variación, y los valores máximos y mínimos de aceptación de los resultados calculados para cada muestra. Para la Fase I estos valores se calcularon para dos series de datos: una incluyendo los resultados de todos los laboratorios y otra sin incluir aquellos laboratorios que hicieron el ensayo fuera de los límites de tiempo (es decir, excluyendo los resultados de los laboratorios 6 y 7) y excluyendo los datos fuera de los rangos de aceptabilidad (UWL y LWL). Debido al bajo número de casos (laboratorios) los rangos de aceptabilidad de los resultados eran muy amplios, pero en total tres datos se encontraron fuera de ellos: dos datos correspondientes a ensayos realizados después del periodo de conservación de los sedimentos (cuatro semanas) y un dato proporcionado por el laboratorio 4. Estos datos, que en todos los casos correspondieron a una toxicidad menor a la estimada por el resto de los laboratorios, fueron eliminados de los cálculos posteriores. Cuando se incluyen todos los laboratorios, los CV iban de 64% a 134% con un promedio de 103%. Cuando se excluyen los laboratorios que hicieron sus ensayos a destiempo estos valores se encuentran entre 45% y 75% con un promedio de 53%.
En la Fase II la muestra A' fue clasificada claramente como no tóxica pero igual que en la Fase I con valores de IC50 muy distintos. La muestra C' dió valores alrededor de 1000 mg L-1 y las otras muestras resultaron con valores de 500 mg L-1 o menores. Sólo un valor, proveniente del laboratorio 4, estuvo fuera de los UWL y LWL, y fue excluido del resto de los cálculos. Los CV variaron entre 34% para la muestra C' y hasta 125% para la muestra A', con un promedio de 69% (57% si se excluye la muestra A'). Los resultados para el protocolo BSPT fueron más homogéneos aunque el CV para la muestra D fue muy elevado (139%). Para la muestra A, al igual que con el SPT, los resultados fueron muy variables aunque el valor de CV disminuye hasta 60%. Para el resto de muestras el CV varió entre 13% y 22%.
Discusión
Al comparar los resultados de la caracterización química de los sedimentos (Casado-Martínez et al. 2006) con los resultados del ensayo de toxicidad para la muestra A, que había sido clasificada en la categoría I y por tanto podría ser considerada apta para su vertido al mar tras una autorización normal, ésta también se clasifica claramente como no tóxica y esto causa la variabilidad de los valores obtenidos, pero con un alto CV. Como se ha mencionado anteriormente, la distribución del tamaño de los sedimentos se ha identificado como un importante factor de confusión a la hora de interpretar los resultados de este ensayo. El interés general se ha centrado en identificar la medida del efecto de la presencia de sedimentos finos en la toxicidad, habiéndose propuesto distintas correcciones (Ringwood et al. 1997, Stronkhorst 2003) aunque no parecen recomendables para la gestión de dragados en puertos españoles (DelValls et al. 2003). En el caso de muestras con porcentajes de arenas elevados, el efecto del tamaño de grano incrementa directamente la variabilidad del ensayo ya que existen dificultades para resuspender efectivamente el sedimento. Esta dificultad resulta especialmente decisiva a la hora de coger la alícuota de la suspensión inicial con lo que las concentraciones teóricas no se corresponden con las concentraciones reales a las que las muestras están expuestas y, por lo tanto, el dato de IC50 no es representativo de la toxicidad real de la muestra. En este sentido la agencia ambiental canadiense, que utiliza un valor absoluto para la clasificación de la toxicidad de los sedimentos, reconoce la problemática para la clasificación de las muestras arenosas y, si el sedimento en cuestión contiene un porcentaje de finos (igual o menos a 0.063 mm) mayor que 20% recomienda el uso de un sedimento control negativo de toxicidad con el cual comparar los resultados del sedimento problema (Environment Canada 2002); no obstante, la variabilidad entre los replicados continúa siendo un factor importante que debe tenerse en cuenta si los resultados van a ser utilizados para la autorización de permisos y la vigilancia ambiental. Otro factor a tener en cuenta pero que puede ser fácilmente minimizado es el tiempo de almacenamiento de los sedimentos. Las guías disponibles para la realización de ensayos de toxicidad en el laboratorio ya incluyen tiempos máximos dentro de los cuales deben de realizarse los ensayos de toxicidad para que los resultados sean representativos ya que durante el periodo de conservación de los sedimentos las especies químicas pueden variar en cantidad o en su forma disponible (GIPME 2000). Aunque el efecto de este factor puede ser más o menos evidente según la importancia de otros factores de confusión, se ha podido identificar cierta tendencia a generar valores superiores de IC50 y por lo tanto a subestimar la toxicidad de los sedimentos. Aunque este factor puede no tener mayor importancia cuando se estudian muestras no contaminadas, sí puede afectar decisivamente cuando se trata de sedimentos con contaminación de tipo orgánico, como es el caso de los sedimentos B y D que presentan una mayor variabilidad.
Los coeficientes de variación calculados en la Fase II del ejercicio son semejantes a los encontrados durante la Fase I, pero los resultados al clasificar las muestras parecen más homogéneos. Es posible que esto se deba a que el segundo ensayo se realizó en todos los laboratorios dentro del primer mes después de la recogida de los sedimentos, aunque también es de esperar una mayor experiencia de los laboratorios ya para la Fase II. De especial interés son los resultados para el protocolo BSPT en el que se obtuvieron CVs más bajos. El BSPT tiene dos ventajas importantes respecto al SPT que pueden contribuir en la reducción de la variabilidad interlaboratorio. La primera de ellas es la supresión de la filtración de la muestra, que evita el efecto en la disminución de la luminiscencia debido a la pobre recuperación de las bacterias del sedimento. Aunque el BSPT no incluye la posibilidad de incorporar un duplicado de la muestra como en el SPT, el porcentaje de inhibición de la luminiscencia se calcula para cada concentración analizada respecto al valor de emisión de las bacterias medido para cada concentración previamente a la adición de las concentraciones del sedimento problema y no respecto al valor de cuatro blancos como sucede con el SPT. De este modo se evita la variabilidad introducida por el volumen de reactivo (bacterias) adicionado a cada concentración, el cual puede ser muy distinto dependiendo de la experiencia del operador de la pipeta. La baja variabilidad interlaboratorio registrada para el protocolo BSPT también puede deberse a la mayor experiencia de los laboratorios con el ensayo aunque no todos habían utilizado este nuevo protocolo de forma rutinaria.
Según los resultados de este ejercicio, y teniendo en cuenta los factores de confusión en la interpretación de los resultados, el ensayo Microtox® parece adecuado como herramienta para la caracterización inicial de la toxicidad de materiales de dragado en España. En este sentido se recomienda el establecimiento de un valor guía como los utilizados en Holanda o Canadá de alrededor de 1000 mg L-1 expresados en peso seco de sedimento. La comparación entre el antiguo SPT y el nuevo protocolo BSPT parece apuntar a este último como el más recomendable no sólo por resultados previos con muestras de sedimentos (Campisi et al. 2005), sino también porque su diseño es más simple y económico en términos de tiempo y esfuerzo, y dada su menor variabilidad interlaboratorio, pudiera también ser más recomendable para efectos regulatorios. La disminución en los CV con el protocolo BSPT puede ser debida a una mayor experiencia en el desarrollo del ensayo o bien a la menor variabilidad en la metodología. En cualquier caso, la variabilidad sigue siendo elevada para muestras con alto porcentaje de arenas.
Agradecimientos
Los autores agradecen a Antonio de Bellerín de Instrumentación Analítica y a Joep Appels de MicroLan la subvención de 50% en todos los materiales y reactivos necesarios para este estudio que se realizó como parte de un proyecto de investigación conjunto entre el CEDEX y la Universidad de Cádiz. Parte del trabajo fue subvencionado por el Programa Nacional del Ministerio Español de Ciencia y Tecnología (REN2002 01699/ TECNO). MC Casado-Martínez agradece la financiación del Ministerio Español de Educación y Ciencia en el programa de becas de Formación de Personal Investigador (FPI). Nuestro agradecimiento a A. Luque por sus comentarios durante la preparación del manuscrito final.
Referencias
Abbondanzi F, Calace N, Campisi T, Iacondini A, Leoni M, Petronio BM, Pietroletti M. 2004. An integrated study to evaluate the paper mill sludge utilisation for metal-contaminated soil remediation. In: Magar VS, Kelley ME (eds.), In situ and On-site Bioremediation -2003. Proc. Seventh International In situ and On-site Bioremediation Symp. (Orlando, FL, June 2003). Battelle Press, Columbus, OH, paper L-05. [ Links ]
AZUR. 1998a. Basic Solid-Phase Test (Basic SPT). AZUR Environmental, Carlsbad, CA, 16 pp. [ Links ]
AZUR. 1998b. Solid-Phase Test (SPT). AZUR Environmental, Carlsbad, CA, 19 pp. [ Links ]
Benton MJ, Matt ML, Knight SS, Coopers CM, Benson WH. 1995. Influence of sediment composition on apparent toxicity in a solid-phase test using bioluminescent bacteria. Environ. Toxicol. Chem. 14: 411-414. [ Links ]
Bulich, A.A. 1979. Use of luminescent bacteria for determining toxicity in aquatic environments. In: Marking LL, Kimerle RA (eds.), Aquatic Toxicology. SPT 667. American Society for Testing and Materials, Philadelphia, PS, pp. 98-106. [ Links ]
Carr R, Long S, Edward R, Windom HL, Chapman DC, Thursby G, Sloane GM, Wolfe DA. 1996. Sediment quality assessment studies of Tampa Bay, Florida. Environ. Toxicol. Chem. 15: 1218-1231. [ Links ]
Campisi T, Abbondanzi F, Casado-Martínez C, DelValls TA, Guerra R, Iacondini A. 2005. Effect of sediment turbidity and color on light output measurement for Microtox® Basic Solid-Phase Test. Chemosphere 60: 9-15. [ Links ]
Casado-Martínez MC, Buceta JL, Forja JM, DelValls TA. 2006. Interlaboratory assessment of marine bioassays to evaluate the environmental quality of coastal sediments in Spain. I. Exercise description and sediment quality. Cienc. Mar. (this issue).
DelValls TA, Casado-Martínez MC, Riba I, Martín-Díaz ML, Forja JM, García-Luque E, Gómez-Parra A. (2003). Investigación conjunta sobre la viabilidad de utilizar ensayos ecotoxicológicos para la evaluación de la calidad ambiental del material de dragado. Reporte Técnico para CEDEX, Noviembre de 2003. Puerto Real, Cádiz. [ Links ]
Demuth S, Casillas E, Douglas AW, McCain BB. 1993. Toxicity of saline and organic solvent extracts of sediment of Boston Harbour, Massachusetts, and the Hudson River-Raritan Bay estuary, New York, using the Microtox® bioassay. Arch. Environ. Contam. Toxicol. 25: 377-386. [ Links ]
Environment Canada. 2002. Biological test method: Reference method for determining the toxicity of sediment using luminescent bacteria in a solid-phase test. Environmental Protection Service, Ottawa, ON, Report EPS 1/RM/42, April 2002. [ Links ]
GIPME, Global Investigation of Pollution in the Marine Environment. 2000. Guidance on Assessment of Sediment Quality. International Maritime Organization, London. [ Links ]
Microbics Corporation. 1992. Microtox® Manual. A toxicity testing handbook. Carlsbad, CA. [ Links ]
Mowart FS, Bundy KJ. 2001. Correlation of field-measured toxicity with chemical concentration and pollutant availability. Environ. Int. 27: 479-489. [ Links ]
Riba I, Casado-Martínez MC, Forja JM, DelValls TA. 2004. Sediment quality in the Atlantic coast of Spain. Environ. Toxicol. Chem., 23: 271-282. [ Links ]
Ringwood AH, DeLorenzo ME, Ross PE, Holland AF. 1997. Interpretation of Microtox solid phase toxicity test: The effects of sediment compositions. Environ. Toxicol. Chem. 16: 1135-1140. [ Links ]
Stronkhorst J. 2003. Ecotoxicological effects of Dutch harbour sediments. The development of an effects-based assessment framework to regulate the disposal of dredged material in coastal waters of the Netherlands. PhD thesis, Vrije Universiteit. [ Links ]
USEPA. 1994. Methods for assessing the toxicity of sediment-associated contaminants with estuarine and marine amphipods. United States Environmental Protection Agency, EPA/600/R-94/025. [ Links ]














