Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.31 no.3 Ensenada sep. 2005
Artículos
Crecimiento y estructura demográfica de Argopecten purpuratus en la Reserva Marina La Rinconada, Antofagasta, Chile
Growth and population structure of Argopecten purpuratus at La Rinconada Marine Reserve, Antofagasta, Chile
Miguel Avendaño* y Marcela Cantillánez
* Departamento de Acuicultura, Universidad de Antofagasta, Casilla 170 Antofagasta, Chile. * E-mail: mavendano@uantof.cl
Recibido en septiembre de 2004;
aceptado en abril de 2005.
Resumen
Se presentan los parámetros de crecimiento L∞ = 120.38 mm y K = 0.9668 para el banco de Argopecten purpuratus de la Reserva Marina La Rinconada (Antofagasta, Chile), obtenidos entre marzo de 2001 y mayo de 2003 usando métodos de marcaje y recaptura de ejemplares. La elevada recaptura de individuos marcados (60-80%) indica baja mortalidad natural y una conducta sedentaria del recurso. Las evaluaciones anuales realizadas para estimar el tamaño del banco confirmaron tal conducta, encontrándose la mayoría de los individuos agregados en el centro, con densidades que variaron entre años de 9 a 14.8 ind m-2. La abundancia de ejemplares también mostró variabilidad interanual, con cifras de 10.1 x 106 en 2001, 8.2 x 106 en 2002 y 12.4 x 106 en 2003. Estas evaluaciones mostraron, además, una disminución en la talla media de la estructura demográfica del banco entre un año y otro, reduciéndose de 75.8 mm en 2001 a 62.1 mm en 2002 y a 51.7 mm en 2003. Esta disminución también ocurrió con el número de ejemplares mayores o iguales a la talla mínima legal (90 mm), reduciéndose de 2.6 x 106 ejemplares presentes en 2001 a 3.7 x 105 ejemplares en 2003. La aplicación de los parámetros de crecimiento sobre la estructura poblacional del banco entre 2002 y 2003 señaló la integración de una nueva clase anual de 6.5 x 106 de ejemplares en 2002 y de 11.2 x 106 de individuos en 2003. El descuento de estas cifras, del número total de ejemplares presentes en ambos años, demuestra una pérdida cercana a los 8.4 x 106 de ostiones en 2002 y de cerca de 7.0 x 106 de individuos en 2003. Estas pérdidas correspondieron a ejemplares con tallas superiores a los 60 mm, lo cual es corroborado con el análisis de la curva de captura realizado con el programa Fisat, cuyos resultados señalan una mortalidad Z = 2.15 en 2002 para el segmento de la población entre 67.5 y 115.5 mm, y Z = 3.08 en 2003 para el segmento de 64.3 a 112.5 mm. Los resultados sugieren que las pérdidas de ejemplares fueron producidas por la pesca clandestina, actividad que contraviene la legislación chilena diseñada para conservar a A. purpuratus y sostener una explotación racional de este recurso.
Palabras clave: Argopecten purpuratus, crecimiento, estructura demográfica, reserva marina, Chile.
Abstract
Continuing studies at our Antofagasta (Chile) laboratory provided data from March 2001 to May 2003 on population parameters of Argopecten purpuratus in the scallop bed occupying the nearby La Rinconada Marine Reserve. Population growth parameters of L∞ = 120.38 mm and K = 0.9668 were obtained using marking and recapture methods. The high recapture percentage (60-80%) of marked individuals indicates a low natural rate of mortality, as well as a sedentary behavior. Annual population estimates confirmed the sedentary behavior of the scallops, with most of the individuals concentrating towards the center of the bed at densities between 9-14.8 ind m-2. Scallop abundance showed interannual variation, with total individual counts ó10.1 x 106 in 2001, 8.2 x 106 in 2002, and 12.4 x 106 in 2003. Evaluations showed a reduction in mean size within the population from one year to the next, the mean length of 75.8 mm in 2001 decreasing to 62.1 mm in 2002 and to 51.7 mm in 2003. This decrease also occurred in the number of individuals of legal extraction size (90 mm), from 2.6 x 106 individuals in 2001 to 3.7 x 105 in 2003. Application of the growth parameters to the population structure in the bed showed recruitment of a new year-class of 6.5 x 106 individuals in 2002 and 11.2 x 106 in 2003. Subtraction of these numbers from the total numbers present in both years showed losses of about 8.4 x 106 individuals in 2002 and 7.0 x 106 in 2003. Based on the population growth parameters and supported by analysis of the catch curve using the Fisat program, these losses concerned the size range of scallops over 60 mm in length with a mortality Z = 2.15 in 2002 for individuals ranging from 67.5 to 115.5 mm in length and Z = 3.08 in 2003 for those ranging from 64.3 to 112.5 mm. The results suggest that the loss of scallops from these size ranges was due to human intervention (clandestine harvesting), also reported by wardens in the field. Illegal harvesting of this resource contravenes Chilean national legislation designed to conserve A. purpuratus and maintain its rational exploitation.
Key words: Argopecten purpuratus, growth, population structure, marine reserve, Chile.
Introducción
El ostión del Norte, Argopecten purpuratus (Lamarck, 1819), es un bivalvo pectínido que habita en el Pacífico suro-riental a lo largo de la costa de Perú y Chile. Su distribución abarca desde Paita, Perú (5°S), hasta Valparaíso, Chile (33°S). Esta especie vive en bahías someras, entre 5 y 30 m de profundidad, y excepcionalmente hasta 40 m, siendo los tres principales bancos de Chile, los ubicados en las bahías de Mejillones, La Rinconada, al norte de Antofagasta, y de Tongoy al sur de Coquimbo (Cantillánez, 2000).
En Chile, A. purpuratus es una especie de importancia económica, a pesar de que entre 1958 y 1980 sus desembarques fueron relativamente bajos (ó500 ton año-1; Avendaño y Cantillánez, 1996), destinados esencialmente al mercado local. Sin embargo, a partir de 1982 se inician sus exportaciones regulares dada la demanda ejercida por los mercados internacionales, alcanzando en 1984 su producción cerca de 5000 ton como consecuencia del aumento del esfuerzo de pesca y el elevado reclutamiento asociado al fenómeno de El Niño (ENSO) de 1983 (Avendaño y Cantillánez, 1996; Stotz, 2000). Debido a la disminución drástica de los stocks, después de 1984 fue imposible mantener este nivel de desembarques (Stotz, 2000). Medidas de regulación pesquera tales como limitaciones de los periodos de pesca y talla mínima de captura no tuvieron efecto sobre los stocks y el gobierno chileno decretó el cierre total de la pesquería a partir de 1986 (Cantillánez, 2000; Stotz, 2000), mismo que continua vigente.
Paralelamente a esta disminución de los stocks naturales la pectinicultura chilena se desarrolló rápidamente alcanzando producciones cercanas a 20,000 ton en 2000, y convirtiendo a Chile en el tercer productor mundial por cultivo (Avendaño et al., 2001a). Sin embargo, la pesca clandestina sobre los bancos naturales ha continuado (Wolf y Alarcón, 1993; Dames y Moore, 1994; Avendaño y Cantillánez, 1996; Stotz y González, 1997; Stotz y Mendo, 2001), siendo el banco de La Rinconada uno de los más explotados del país (Avendaño y Cantillánez, 1996). Estudios previos indican que, de protegerese el área, ésta tendría un alto potencial para su recuperación natural dada la presencia de condiciones biológicas y oceanográficas favorables (Avendaño, 1993; Avendaño y Le Pennec, 1996, 1997; Avendaño y Cantillánez, 1996, 1997a). La nueva Ley General de Pesca y Acuicultura, promulgada en Chile en 1991, permitió que La Rinconada fuese decretada en 1997 como la primera reserva marina del país, disponiendo de fondos para estudios y protección a fines de 1998.
Los estudios realizados a fin de establecer medidas de conservación al momento de constituir la reserva indicaron que el sitio es una zona natural de retención larvaria y asentamiento de postlarvas de A. purpuratus (Cantillánez, 2000). Gracias a este fenómeno, a las medidas de protección y a la ocurrencia de un evento ENSO en 1997-1998, la población se incrementó de 6.1 x 106 ejemplares en 1997 (Avendaño y Cantillánez, 1997b) a 11.3 x 106 en 1999 (Avendaño et al., 2004). Sin embargo, en años posteriores el número de ejemplares en la reserva ha variado posiblemente debido a la extracción clandestina. En el presente trabajo se presentan los primeros parámetros de crecimiento obtenidos mediante marcaje y recaptura de ejemplares, así como la abundancia y estructura demográfica anual del banco de La Rinconada entre 2001 y 2003, estimándose además mediante curvas de captura el efecto del esfuerzo pesquero ejercido clandestinamente sobre el banco en esos años.
Metodología
Características del área de estudio
El área de estudio está localizada en el sector de La Rinconada de la Bahía de Antofagasta, ubicado en 23°28' S y 70°30' O, 20 km al norte de la ciudad de Antofagasta, Chile (fig. 1). Un estudio reciente llevado a cabo por Avendaño et al. (2004) ha demostrado que el área de la reserva marina está sujeta a flujos alternados de corriente que resultan de una corriente predominante hacia el norte que se encuentra con la barrera impuesta por la playa, reflejándose en forma cíclica en escalas de tiempo diarias. Esto produce intercambio y mezcla de masas de aguas y la retención de material particulado en suspensión, incluyendo larvas de A. purpuratus, en un área de 5 km de radio (Cantillánez, 2000; Avendaño et al., 2004).

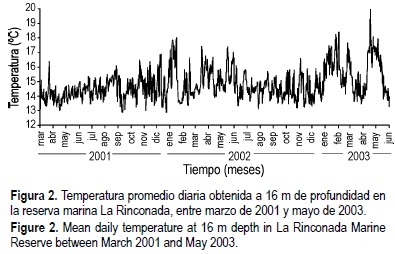
Esta bahía se caracteriza, además, por la existencia de zonas de surgencia de aguas frías que permiten la incorporación regular de nutrientes a las aguas superficiales durante gran parte del año (Guillen, 1983; Rodríguez et al., 1991; Marín et al., 1993; Escribano et al., 1995; Cantillánez et al., 2001). La incorporación de estos nutrientes en las aguas superficiales permiten el desarrollo de florecimientos fitoplanctónicos a lo largo de todo el año, con concentraciones de clorofila a que fluctúan de 1-12 ng L-1, superando en ocasiones los 20 ng L-1. El estudio de la composición específica de los florecimientos muestra que las diatomeas dominan sobre los flagelados y que los dinoflagelados tóxicos son poco abundantes (Avendaño et al. , 2004). La temperatura media diaria del agua de la bahía en años con ausencia de Niño o Niña, oscila en el fondo (16 m de profundidad) entre 13°C y 19°C, registrándose los promedios más altos durante los meses de verano (Cantillánez, 2000; Avendaño et al., 2004). Los promedios diarios de temperatura, obtenidos a través de mediciones continuas cada 6 h entre marzo de 2001 y mayo de 2003, realizadas con ayuda de un termógrafo electrónico instalado a 16 m de profundidad, se muestran en la figura 2.
Estimación de parámetros de crecimiento
Con el objeto de obtener antecedentes de parámetros de crecimiento de la población de A. purpuratus en La Rinconada se procedió al marcaje y recaptura de ejemplares, distribuyéndolos en un área de 100 m2 señalizada por medio de una boya fondeada a 17 m de profundidad. El marcaje se hizo adhiriendo una etiqueta numerada, con masilla epóxica submarina, a la valva derecha de los individuos. Durante abril de 2001 se marcaron y sembraron 300 ejemplares con tallas de 35 a 113 mm, de los cuales en julio de 2001 se recuperó un total de 186 ejemplares. Un segundo grupo de 250 individuos entre 10 y 100 mm fueron marcados y sembrados en agosto de 2001, recuperándose 152 ejemplares en noviembre de ese mismo año. Un tercer grupo de 140 nuevos ejemplares entre 5 y 60 mm fueron marcados y sembrados en diciembre 2001, recuperándose 115 ejemplares en abril de 2002.
El incremento individual de longitud fue graficado contra la talla, obteniendo los parámetros de crecimiento de von Bertalanffty (Gulland y Holt, 1959).
Estimación de la abundancia anual de A. purpuratus y estructura de talla de la población
El tamaño y estructura de talla que presentó la población en marzo de 2001 y mayo de 2002 y 2003 fue estimado a través de muestreo directo dentro del área de distribución de los ejemplares, para lo cual se procedió de la siguiente forma:
Determinación del área de distribución
El área de distribución del banco se delimitó mediante buceo y se marcó con boyas. La posición de las boyas se determinó con un GPS con una resolución de 15 m. La proyección de los puntos sobre el plano del área permitió calcular la superficie que ocupaba el banco, a través de un planímetro polar con compensación ZETING KP-27.
Muestreo piloto
Una vez delimitada el área de distribución de los organismos se procedió a realizar un muestreo piloto (Avendaño y Cantillánez, 2003) para determinar el número mínimo de muestras. De este modo se establecieron 26 estaciones de muestreo en 2001, 27 en 2002 y 19 en 2003, representando en cada ocasión cerca del 10% de la superficie total que ocupaba el banco en ese momento. En cada estación se muestreó diez veces un cuadrante de 1 m2 para obtener una densidad media por estación. Con los datos obtenidos se procedió a determinar el número mínimo de unidades de muestreo requeridas para estimar la densidad y abundancia total de la población de A. purpuratus, de acuerdo a la siguiente expresión (Thompson, 1992):

donde n0 = número mínimo de muestra, N = superficie total del banco expresada en unidades muestreales, d = límites inferior y superior del valor real de la abundancia (considerados como un 10% del estimador poblacional calculado a partir del muestreo piloto), Z = constante de distribución normal (1.964 para α = 0.05), y Γ2 = varianza de la media del número de individuos por unidad muestreal en el muestreo piloto.
Muestreo definitivo
Debido a que las densidades de ejemplares obtenidas en el muestreo piloto mostraron una variabilidad con respecto a la posición del área muestreada, se pudo establecer la presencia de una fuerte estratificación de la población estudiada, indicando la necesidad de realizar un muestreo al azar estratificado. El método consistió en establecer un muestreo aleatorio simple en cada estrato, una vez reconocida la existencia de éstos.
Una vez conocido el número mínimo de muestras, éstas se repartieron de acuerdo a la asignación diferencial en función de la superficie de cada estrato, muestreándose áreas de 4900 m2 (70 x 70 m) elegidas al azar en cada uno de ellos. La densidad de los ostiones en cada una de las áreas se determinó contando el número de organismos presentes en un cuadrante de 1 m2, el cual fue replicado al azar 10 veces. Se registró la profundidad media de cada área muestreada mediante un profundímetro de buceo y su posición geográfica utilizando un geoposicionador satelital (GPS).
Con el objeto de identificar cada una de las estaciones que conformaban cada estrato, la información del número de ejemplares por metro cuadrado recogida en el muestreo definitivo se ordenó sobre un plano. Posteriormente, en cada estrato se calcularon los valores medios de densidad y abundancia, de acuerdo con Thompson (1992).
El estimador de la varianza de la población se obtuvo multiplicando la varianza de la media estratificada por el cuadrado de la superficie total del banco expresada en unidades muestreales (Thompson, 1992).
El análisis de la abundancia en cada estrato se realizó agregando a los datos obtenidos en el muestreo definitivo, los datos del muestreo piloto, con el objeto de disminuir aún más los límites reales de la abundancia.
Determinación de la estructura demográfica de la población
En cada una de las estaciones destinadas a medir la densidad de organismos se recolectaron todos los ejemplares presentes en cinco cuadrantes de 1 m2. Los individuos fueron medidos (longitud máxima antero-posterior) con un calibrador Vernier de 0.1 mm de precisión. Los datos obtenidos fueron utilizados para determinar la estructura demográfica y se utilizaron como datos representativos de entrada (estructura de tallas de las capturas) para construir la curva de captura de esta población durante 2002 y 2003 a través del programa Fisat 1.0, dada la ausencia de datos reales de explotación de esta población por tratarse de una especie vedada para su extracción.
Resultados
Parámetros de crecimiento
Los resultados obtenidos señalan que la longitud infinita (L∞) para A. purpuratus en la reserva de La Rinconada es 120.38 mm, con un coeficiente K = 0.9668 (fig. 3). Estos parámetros fueron obtenidos a través de la recuperación de 62%, 60.8% y 82.1% de los ejemplares marcados y sembrados en abril, agosto y diciembre de 2001.

Distribución del banco
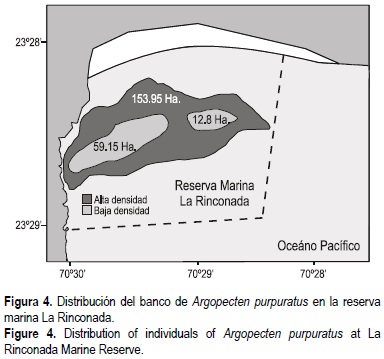
Los resultados obtenidos a través de las evaluaciones realizadas en la reserva entre 2001 y 2003 permiten señalar que el banco de A. purpuratus de La Rinconada se distribuyó en una sola área cuya superficie alcanzó 254.8 ha en 2001, 242.7 ha en 2002 y 225.9 ha en 2003, extendiéndose entre 23°28'13.5" S, 70°29'7.9" W y 23°28'38.2" S, 70°30'41.1" W, a profundidades entre 6 y 24 m. Dentro de estas áreas, los ejemplares se concentraron preferentemente en áreas de 50.4 ha en 2001, de 71.3 ha en 2002 y de 72.0 ha en 2003 entre profundidades de 7 y 17 m (fig. 4).
Densidad y abundancia
La densidad y abundancia de la población, estimadas a partir de las evaluaciones realizadas en 2001, 2002 y 2003, se presentan en la tabla 1. Estos resultados muestran que el tamaño de la población presentó una disminución de la abundancia de 18.6% entre 2001 y 2002, y un incremento de 51.4% (4.2 x 106 ejemplares) en 2003 respecto de 2002, este último asociado con un incremento de la densidad media en las áreas de mayor concentración. En contraste, las zonas periféricas a las anteriores en los tres años presentaron densidades que se mantuvieron bajo los 2 ind m-2.
Avendaño y Cantillánez: Crecimiento y estructura demográfica de Argopecten purpuratus en La Rinconada
Estructura de tallas
El análisis de la estructura de tallas que presentó el banco en esta reserva marina en cada una de las evaluaciones realizadas, indicó que en marzo de 2001, ésta variaba entre 10.2 y 137.2 mm, con un promedio de 75.8 mm (DE = 19.8), y 25.8% de los ejemplares se encontraban sobre la talla mínima legal de 90.0 mm (fig. 5a); en mayo de 2002, varió entre 10.0 y 135.2 mm, con un promedio de 62.1 mm (DE = 24.5), encontrándose 11.3% sobre los 90.0 mm (fig. 5b). En mayo de 2003 los resultados indicaron tallas entre 10.3 y 123.0 mm, con un promedio de 51.7 mm (DE = 19.3), y sólo 3% se encontraba sobre los 90.0 mm (fig. 5c).

Curvas de captura para la evaluación de mayo de 2002 y mayo de 2003
Los resultados obtenidos a través de este análisis (fig. 6a, b) señalan una mortalidad (Z) para 2002 de 2.15, sobre el segmento de la población entre 67.5 y 115.5 mm, y de 3.08 para 2003 sobre el segmento de 64.3 a 112.5 mm. Estos valores indican que la supervivencia alcanzó 11.5% en 2002 y 4.6% en 2003 para cada uno de los segmentos de la población señalados.

Discusión
Stotz y González (1997) señalaron parámetros de crecimiento similares a los obtenidos para A. purpuratus en la reserva de La Rinconada (L∞ = 120.19 mm; K = 0.9666) en una población de Puerto Aldea (Coquimbo, Chile). Esos autores indican una L∞ = 124.6 mm y un K = 0.84, lo que permite estimar que los individuos en dicha localidad alcanzarían la talla comercial (90 mm) en 18 meses, mientras que en La Rinconada lo harían a los 17.2 meses. Otros resultados para la región de Coquimbo sugieren un periodo de crecimiento de 27 ó 28 meses hasta alcanzar la talla comercial, basado en un valor de L∞ = 112 mm y K = 0.52 (Etchepare y Videla, 1989). Estos resultados indican un crecimiento más rápido conforme disminuye la latitud dentro de Chile, aunque resultados obtenidos en La Pampa, Tunga y Bahía Independencia, en Perú, indican que los ostiones podrían alcanzar la talla de 90 mm sólo después de 39 a 51 meses, con un L∞ que varía entre 106 y 109 mm, y con valores de K entre 0.43 y 0.52 (Yamashiro y Mendo, 1988). En contraste, Wolf (1987) determinó una L∞ = 112 mm y un K = 2.10 para esta especie en Bahía Paracas, Perú, bajo condiciones de El Niño ocurrido en 1983, indicando que la talla de 90 mm bajo estas condiciones de agua cálidas se alcanzaría entre 12 y 13 meses.
Las grandes variaciones en las tasas de crecimiento que muestran los pectínidos entre sitios, estaciones del año y profundidad, se deben principalmente a las variaciones de la temperatura y disponibilidad de alimento (Bricelj y Shumway, 1991; Emerson et al., 1994; Lodeiros et al., 2001). Sin embargo, las concentraciones normales de nutrientes en las aguas superficiales del área de estudio permiten el desarrollo de fitoplancton a lo largo de todo el año (Cantillánez et al., 2001), de manera que la capacidad trófica no sería un factor limitante para la subsistencia del recurso. En contraste, la gran variabilidad de la temperatura de fondo (16 m) en ese sector parece ser un factor principal que influye en el crecimiento. Deben realizarse experimentos que permitan evaluar el crecimiento diario de estos organismos, asociado a la temperatura, para contrastar la hipótesis antes señalada.
El alto porcentaje de recuperación de ejemplares marcados en esta experiencia (sobre 60% de los sembrados en abril y en agosto de 2001 y 82.1% de los marcados y sembrados en diciembre de 2002) sugiere, por una parte, bajas tasas de mortalidad natural, y por otra, una conducta sedentaria que explica las agregaciones con que este recurso se distribuye dentro del banco. Estos valores de recuperación son muy altos en comparación al 15% y 46% que obtuvieron con esta misma especie Stotz y González (1997) en la Bahía de Tongoy (Chile), o los obtenidos en otros experimentos realizados con especies como Aequipecten opercularis L. donde el porcentaje de recaptura fluctuó alrededor de 25% (Allison y Brand, 1995).
Los resultados obtenidos mediante las evaluaciones anuales señalaron variaciones en la superficie de distribución y en la abundancia de ejemplares. Estos mismos resultados señalan una distribución agregada de los ejemplares, ya indicada en estudios anteriores (Cantillánez y Avendaño, 1994; Avendaño y Cantillánez, 1996). Este tipo de distribución en la que los ejemplares tienden a mantenerse agrupados en el centro del banco es común en otras poblaciones de pectínidos. Así, en bancos explotados comercialmente se ha señalado la existencia de unidades importantes de "stock" que corresponden a áreas con un grado de continuidad espacial y similares densidades internas significativamente más altas que las de áreas circundantes (Caddy, 1989).
El análisis global de la estructura de tallas de los ostiones mostró una declinación en las tallas medias y reducción en el número de ejemplares de talla mínima legal entre 2001 y 2003, sugiriendo pérdidas de individuos de talla mínima legal del banco que ascendieron a 2,550,925 ejemplares en 2001 y a 373,281 ejemplares en 2003.
Con base en los parámetros de crecimiento obtenidos para esta población se puede señalar que los ejemplares con tallas inferiores a 80 mm encontrados en mayo de 2002 corresponden a ejemplares no presentes durante marzo de 2001; se estima que el 79% de los individuos (6.5 x 106 ostiones) son nuevos en este banco. Descontando esta cifra, del número total de ejemplares presentes en 2002 (8.2 x 106 ostiones) nos indica que sólo 1.7 x 106 individuos serían parte de los 10.1 x 106 ejemplares evaluados en marzo de 2001 (17.1%). En consecuencia, entre esta última fecha y mayo de 2002 se habrían perdido de la reserva cerca de 8.4 millones de ostiones. Este mismo análisis, realizado sobre la estructura de tallas presentes en este banco en mayo de 2003, señala que los ejemplares con tallas inferiores a 75 mm corresponderían a ejemplares no presentes durante mayo de 2002, es decir que el 89.9% de los individuos (11.2 x 106 ejemplares) se incorporaron a la población después de esa fecha. Descontando esta cifra, del número total de ejemplares presentes en esta nueva evaluación (12.4 x 106 ostiones) indica que sólo 1.2 x 106 individuos (15.24%) permanecerían de los 8.2 x 106 ejemplares estimados en mayo de 2002, de manera que entre ambas fechas se habrían perdido de la reserva cerca de 7.0 millones de ostiones.
La proyección de los parámetros de crecimiento sobre la estructura de tallas que la población presentó en marzo de 2001 y mayo de 2002, indican que las pérdidas detectadas en las evaluaciones de mayo de 2002 y 2003, respectivamente, afectaron principalmente a ejemplares con tallas superiores a 60 mm, lo que es corroborado con la reducción en el número de ejemplares de talla mínima legal y con la disminución de la tallas medias de estos ejemplares, anteriormente señaladas. La desaparición de estos individuos de tallas mayores demostraría que la talla estaría fuertemente influenciada por actividades de pesca clandestina que allí se desarrollan. A pesar de la normati-vidad vigente en Chile para A. purpuratus, los infractores últimamente evitan la fiscalización y el control diurno extrayendo en forma clandestina dicho recurso de la reserva marina, por medio de buceo nocturno y en la madrugada. Para ello utilizan embarcaciones artesanales que proveen de aire a los buzos mediante un compresor y a través de una manguera, portando éstos linternas submarinas para poder localizar el recurso. Esta actividad motivó que los guardias de la reserva realizaran 414 denuncias de embarcaciones extrayendo clandestinamente ostiones entre marzo de 2001 y mayo de 2002, y 414 entre esta última fecha y mayo de 2003, algunas de las cuales trabajaban con dos buzos simultáneamente. Debe señalarse que un solo buzo es capaz de extraer entre 4800 y 7200 ejemplares por día (Avendaño y Cantillánez, 1996; 2003).
La pesca ilegal en esta reserva impidió obtener una estimación real de la mortalidad natural de los individuos, obteniendo bajas tasas de supervivencia en nuestros resultados (11.5% en 2002, 4.6% en 2003). La obtención de datos de mortalidad natural se complicó, además, debido a que los infractores desconchan y tiran las valvas vacías dentro de las mismas áreas de extracción. Por lo tanto, se concluyó que las disminuciones que sufre el banco de A. purpuratus de la Reserva Marina La Rinconada obedecen principalmente a causas de origen humano como la sobreexplotación (manejo inadecuado), y no a mecanismos naturales de oscilación en el volumen de su población, frecuentemente observados en otras poblaciones de bivalvos y particularmente en los pectínidos (Orensanz et al., 1991).
La problemática del reclutamiento y su determinación ha sido el punto de focal de la mayor parte de los estudios de ecología de poblaciones y manejo de recursos. Así, después del trabajo pionero de Hjort (1914) se han desarrollado muchas teorías sobre regulación del reclutamiento. Actualmente los modelos deterministas (Cushing, 1982; Rothschild, 1986; Sinclair, 1988) asignan un rol preponderante a los factores físicos y tróficos, principalmente a la nutrición larvaria. Por otra parte, Thouzeau (1991a, 1991b, 1995), Chauvaud y Thouzeau (1995) y Chauvaud et al. (1996) señalan que la naturaleza sedimentaria del fondo, la hidrodinámica, la temperatura, la calidad trófica de las aguas y la intensidad de las interacciones bióticas (competencia y predación) son los principales factores que influyen en la abundancia de una clase de edad pre-reclutada. Sin embargo, en el presente trabajo, la aparición de grupos importantes de pre-reclutas de A. purpuratus que se integran cada año como nueva clase anual a esta población (6.5 x 106 ejemplares en 2002 y 11.2 x 106 en 2003), permiten señalar la efectividad del reclutamiento de este banco, el cual es ayudado además por el rápido crecimiento de sus ejemplares.
La efectividad del reclutamiento de A. purpuratus en esta reserva se debe a la gran capacidad reproductiva de su población, cuyos especímenes desovan en forma continua a lo largo de todo el año, con periodos de mayor o menor intensidad que se extienden desde septiembre hasta abril del año siguiente (Avendaño, 1993; Avendaño y Le Pennec, 1996, 1997; Avendaño y Cantillánez, 1997a; Cantillánez, 2000; Cantillánez et al., 2005). Este largo periodo reproductivo va acompañado de una permanente presencia de larvas que son retenidas en el lugar, y que a lo largo de todo el año colonizan colectores artificiales, coincidiendo su mayor intensidad con los periodos de mayor actividad reproductiva (Cantillánez, 2000; Cantillánez et al., 2001; Avendaño et al., 2004). En consecuencia, estas características de la especie, asociadas a las especiales condiciones del lugar, son las que están evitando el colapso de este banco ante el nivel de extracción que soporta.
Sin embargo, deberá tenerse presente que la pesca clandestina sistemática de los individuos grandes de la población (cuyo stock de talla mínima legal se redujo a 2.99% en 2003), además de impactar su estructura demográfica, incide directamente sobre su potencial reproductor, ya que la fecundidad potencial está en función de la talla (Avendaño, 1993; Le Pennec et al., 1998; Avendaño et al., 2001b). Esta pesca selectiva puede también llegar a alterar la selección genética de los individuos, generando una reducción en los parámetros de crecimiento de la población (Caddy, 1989). Antecedentes obtenidos después de 15 años de cultivo de A. purpuratus en Chile han señalado una selección negativa para esta especie, debida a que en los cultivos se cosechan primero los ejemplares de mayor crecimiento, quedando como reproductores individuos de menor calidad de crecimiento más lento, lo que da como resultado una pérdida de diversidad genética (Illanes, 1996; Stotz y Mendo, 2001).
Finalmente, se puede concluir que la extracción clandestina que afecta a este banco ha impedido, al igual que ocurre en bancos no protegidos de Chile, que las medidas de regulación impuestas por el Estado sobre el recurso tengan los efectos deseados, demostrando como señalan Morales y Gezan (1986) que el interés económico de corto plazo impuesto por las demanda, prevalece sobre una conciencia de protección racional de largo plazo.
Agradecimientos
Los autores agradecen a Louis Disalvo la traducción y los comentarios y sugerencias de este trabajo. Asimismo, agradecen a los tres revisores cuyos comentarios permitieron mejorarlo. El estudio fue realizado dentro del proyecto FNDR Cod. BIP N° 20127869-0.
Referencias
Allison, A.H. and Brand, A.R. (1995). A mark-recapture experiment on queen scallops, Aequipecten opercularis, on a North Irish Sea fishing ground. J. Mar. Biol. Assoc. UK, 75: 325-335. [ Links ]
Avendaño, M. (1993). Données sur la biologie de Argopecten purpuratus (Lamarck, 1819), mollusque bivalve du Chili. Ph.D. thesis, Université de Bretagne Occidentale, 167 pp. [ Links ]
Avendaño, M. y Cantillánez, M. (1996). Efecto de la pesca clandestina sobre Argopecten purpuratus (Lamarck, 1819), en el banco de La Rinconada, II Región. Cienc. Tec. Mar. CONA, 19: 57-65. [ Links ]
Avendaño, M. y Le Pennec, M. (1996). Contribución al conocimiento reproductivo de Argopecten purpuratus en dos poblaciones de la II Región, Chile. Estud. Oceanol., 15: 1-10. [ Links ]
Avendaño, M. y Cantillánez, M. (1997a). Necesidad de crear una reserva marina en el banco de ostiones de La Rinconada, II Región. Estud. Oceanol., 16: 109-113. [ Links ]
Avendaño, M. y Cantillánez, M. (1997b). Análisis para la recuperación del banco de ostiones de La Rinconada, Antofagasta, II Región. Informe Final Proyecto FNDR Cód. BIP N° 201004790, 49 pp. [ Links ]
Avendaño, M. and Le Pennec, M. (1997). Intraspecific variation in gametogenesis in two populations of the Chilean mollusc bivalve, Argopecten purpuratus (Lamarck). Aquacult. Res., 28: 175-183. [ Links ]
Avendaño, M. and Cantillánez, M. (2003). Population estimates, extraction, and translocation of the pectinid Argopecten purpuratus within Mejillones Bay, Chile. Sci. Mar., 67(3): 285-292. [ Links ]
Avendaño, M., Cantillánez, M., Le Pennec, M., Lodeiros, C. y Freites, L. (2001a). Cultivo de pectínidos iberoamericanos en suspensión. En: A.N. Maeda-Martínez (ed.), Los Moluscos Pectínidos de Iberoamerica: Ciencia y Acuicultura. Editorial Limusa, México, pp. 193-211. [ Links ]
Avendaño, M., Le Pennec, M. y Cantillánez, M. (2001b). Anormalidades en larvas de Argopecten purpuratus (Lamarck, 1819) (Mollusca: Pectinidae), una causal de los problemas en la producción artificial de semilla. Rev. Est. Oceanol., 20: 32-42. [ Links ]
Avendaño, M., Cantillánez, M., Rodríguez, L., Zúñiga, O., Escribano, R. y Oliva, M. (2004). Conservación y protección de la Reserva Marina La Rinconada, Antofagasta, Chile. Informe Final Proyecto FNDR Cód. BIP N° 20127869-0, 215 pp. [ Links ]
Bricelj, V.M. and Shumway, S. (1991). Physiology: Energy acquisition and utilization. In: S.E. Shumway (ed.), Scallops: Biology, Ecology, and Aquaculture. Elsevier, New York, pp. 305-346 [ Links ]
Caddy, J.F. (1989). A perspective on the population dymamics and assessment of scallop, Placopecten magellanicus Gmelin. In: J.F. Caddy (ed.), Marine Invertebrate Fisheries: Their Assessment and Management. FAO Rome, pp. 559-589. [ Links ]
Cantillánez, M. (2000). Reproduction, vie larvaire et pré-recrutement du Pectinidae Argopecten purpuratus (Lamarck, 1819) dans la baie d'Antofagasta (Chili). Ph.D. thesis, Univ. Brest, France, 168 pp. [ Links ]
Cantillánez, M. y Avendaño, M. (1994). Situación actual del recurso Ostión del Norte (Argopecten purpuratus, Lamarck, 1819), en el banco de La Rinconada, II Región, Chile. Informe Final Proyecto FNDR II Región, 58 pp. [ Links ]
Cantillánez, M., Thouzeau, G. and Avendaño, M. (2001). Reproductive cycle in Argopecten purpuratus during El Niño and la Niña conditions: A case study in the Rinconada Bay (Chile). 13th International Pectinid Workshop, Coquimbo, Chile, 18-24 April 2001, pp. 86-88. [ Links ]
Cantillánez, M., Avendaño, M., Thouzeau, G. and Le Pennec, M. (2005). Reproductive cycle of Argopecten purpuratus (Bivalvia: Pectinidae) in La Rinconada marine reserve (Antofagasta, Chile): Response to environmental effects of El Niño and La Niña. Aquaculture (in press). [ Links ]
Cushing, D.H. (1982). Climate and Fisheries. Academic Press, London, 373 pp. [ Links ]
Chauvaud, L. and Thouzeau, G. (1995). Captage des post-larves d'invertébrés benthiques en relation avec la variabilité spatio-temporelle des facteurs environnementaux en rade de Brest. Actes de Colloque 3èmes Rencontres Scientifiques Internationales, Programme Rade, 14-16 mars 1995, Brest, Vol. 2, pp. 29-41. [ Links ]
Chauvaud, L., Thouzeau, G. and Gralli, J. (1996). Experimental collection of great scallop postlarvae and other benthic species in the Bay of Brest: Settlement patterns in relation to spatio-temporal variability of environmental factors. Aquacult. Int., 4: 263-288. [ Links ]
Dames y Moore. (1994). Evaluación directa del Ostión del Norte de la III y IV regiones. Informe Técnico FIP-IT 94-14, 34 pp. [ Links ]
Emerson, C.M., Grant, J., Mollet, A. and Carver, C. (1994). Growth and survival of sea scallops Placopecten magellanicus: Effects of culture depth. Mar. Ecol. Prog. Ser., 108: 119-132. [ Links ]
Escribano, R., Rodríguez, L. and Irribaren, C. (1995). Temporal variability of sea temperature in Bay of Antofagasta, northern Chile (1991-1995). Estud. Oceanol., 14: 39-47. [ Links ]
Etchepare, V. y Videla, V. (1989). Estudio autoecológico de Chlamys (Argopecten purpurata), ostión del Norte, necesario para el futuro manejo de los bancos repoblados. Comisión Permanente del Pacífico Sur (CPPS), Rev. Pacífico Sur (No. especial), pp. 615-620. [ Links ]
Guillen, O. (1983). Condiciones oceanográficas y sus fluctuaciones en el Pacífico sur-oriental. En: G.D. Sharp y J. Csirke (eds.), Actas de la consulta de expertos para examinar cambios en la abundancia y composición por especies de recursos de peces neríticos, San José, Costa Rica, 1983. FAO Inf. Pesca (291) 3: 607-658. [ Links ]
Gulland, J.A. and Holt, S.J. (1959). Estimation of growth parameters for data at unequal time intervals. J. Cons. CIEM, 25(1): 47-49. [ Links ]
Hjort, J. (1914). Fluctuations in the great fisheries of northern Europe. Rapp. Cons. Expl. Mer, 20: 1-228. [ Links ]
Illanes, J.E. (1996). Cultivo del ostión: Valioso aporte del taller UCN. Aquanoticias, 28: 47-53. [ Links ]
Le Pennec, M., Robert, R. and Avendaño, M. (1998). The importance of gonadal development on larval production in pectinids. J. Shellfish Res., 17(1): 97-101. [ Links ]
Lodeiros, C., Maeda-Martínez, A., Freites, L., Uribe, E., Lluch-Cota, D. y Sicard, M.T. (2001). Ecofisiología de pectínidos iberoamericanos. En: A. Maeda-Martínez (ed.), Los Moluscos Pectínidos de Iberoamérica: Ciencia y Acuicultura. Editorial Limusa, México, pp. 77-88. [ Links ]
Marín, V., Rodríguez, L., Vallejo, L., Fuenteseca, J. y Oyarce, E. (1993). Efectos de la surgencia costera sobre la productividad primaria primaveral de Bahia Mejillones del Sur (Antofagasta, Chile). Rev. Chil. Hist. Nat., 66: 479-491. [ Links ]
Morales, H. y Gezan, L. (1986). La modernización de las pesquerías chilenas: Impactos sociales y ecológicos. Ambiente y Desarrollo, 2(2): 33-46. [ Links ]
Orensanz, J., Parma, A. and Iribarne, O. (1991). Population dynamics and management of natural stocks. In: S.E. Shumway (ed.), Scallops: Biology, Ecology, and Aquaculture. Elsevier, New York, pp. 625-713. [ Links ]
Rodríguez, L., Marín, V., Farías, M. and Oyarce, E. (1991). Identification of an upwelling zone by remote sensing and in situ measurements. Mejillones del Sur Bay (Antofagasta, Chile). Sci. Mar., 55(3): 467-473. [ Links ]
Rothschild, B.J. (1986). Dynamics of Marine Fish Populations. Harvard Univ. Press, 280 pp. [ Links ]
Sinclair, M. (1988). Marine Populations. An Essay on Population Regulation and Speciation. Univ. Washington Press, Seattle, 252 pp. [ Links ]
Stotz, W.B. (2000). When aquaculture restores and replaces a overfished stock, is the conservation of the species assured? The case of the scallop Argopecten purpuratus (Lamarck, 1819) in northern Chile. Aquacult. Int., 8: 237-247. [ Links ]
Stotz, W.B. and González, S.A. (1997). Abundance, growth, and production of sea scallop Argopecten purpuratus (Lamarck, 1819): Bases for sustainable exploitation of natural scallop beds in north-central Chile. Fish. Res., 32: 173-183. [ Links ]
Stotz, W.B. y Mendo, J. (2001). Pesquería, repoblamiento y manejo de bancos naturales de pectínidos en Iberoamérica: Su interacción con la acuicultura. En: A.N. Maeda-Martínez (ed.), Los Moluscos Pectínidos de Iberoamerica: Ciencia y Acuicultura. Editorial Limusa, México, pp. 357-374. [ Links ]
Thompson, S. (1992). Sampling. Wiley-Intercience, New York, 345 pp. [ Links ]
Thouzeau, G. (1991a). Experimental collection of postlarvae of Pecten maximus (L.) and other benthic macrofaunal species in the Bay of Saint-Brieuc, France. II. Reproduction patterns and postlarval growth of five mollusk species Settlement patterns and biotic interaction among the species collected. J. Exp. Mar. Biol. Ecol., 148: 181-200. [ Links ]
Thouzeau, G. (1991b). Déterminisme du pré-recrutement de Pecten maximus (L.) en baie de Saint-Brieuc: Processus régulateurs de l'abondance, de la survie et de la croissance des post-larves et juvéniles. Aquat. Living Resour., 4: 77-99. [ Links ]
Thouzeau, G. (1995). Aspects de la dynamique spatio-temporelle du pré-recrutement de Pecten maximus L., en baie de Saint-Brieuc. ICES Mar. Sci. Symp., 199: 31-39. [ Links ]
Yamashiro, C. y Mendo, J. (1988). Crecimiento de la concha de abanico (Argopecten purpuratus) en la Bahía Independencia, Pisco, Perú. En: H. Salwedel y A. Landa (eds.), Recursos y Dinámica del Ecosistema de Afloramiento Peruano. Bol. Inst. Mar. Perú-Callao, Vol. extraordinario, pp. 164-168. [ Links ]
Wolff, M. (1987). Population dynamics of the Peruvian scallop Argopecten purpuratus during the El Niño phenomenon of 1983. Can. J. Fish. Aquat. Sci., 44: 1684-1691. [ Links ]
Wolff, M. and Alarcón, E. (1993). Structure of scallop Argopecten purpuratus (Lamarck, 1819) dominated subtidal macro-invertebrate assemblage in northern Chile. J. Shellfish Res., 2: 295-304. [ Links ]














