Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Ciencias marinas
Print version ISSN 0185-3880
Cienc. mar vol.31 n.3 Ensenada Sep. 2005
Artículos
Acumulación de cobre y alteraciones histopatológicas en el ostión Crassostrea angulata
Accumulation of copper and histopathological alterations in the oyster Crassostrea angulata
A. Rodríguez de la Rua1, J.M. Arellano1, M.L. González de Canales1, J. Blasco2 y C. Sarasquete2*
1 Departamento de Biología Facultad de Ciencias del Mar y Ambientales, UCA Cádiz, Spain.
2 Instituto de Ciencias Marinas de Andalucía, CSIC Polígono Río San Pedro Apartado oficial 11510, Puerto Real, Cádiz, Spain. * E-mail: carmen.sarasquete@icman.csic.es,
Recibido en septiembre de 2003;
aceptado en enero de 2005.
Resumen
Ejemplares de ostión Crassostrea angulata fueron expuestos a concentraciones subletales de cobre (200 y 600 µg L-1 Cu2+) durante un periodo de 2 a 30 días. Se cuantificó la concentración de cobre, así como las alteraciones histopatológicas inducidas en branquias, glándula digestiva y corazón. Las concentraciones más elevadas de cobre correspondieron a las branquias, con valores alrededor de 2 mg g-1 peso seco en los organismos expuestos a la concentración más alta, al final del periodo de exposición (día 30). En la glándula digestiva la concentración alcanzada fue del orden de 1 mg g-1 peso seco. La tasa de bioconcentración (BCr), definida como la diferencia entre la concentración en el tejido a una concentración de exposición a tiempo t y la concentración media del control a lo largo del experimento, dividida por el tiempo de exposición, disminuyó en ambos tejidos. Los valores variaron en el intervalo entre 392 y 57 µg g-1 d-1 en las branquias y entre 133 y 18 µg g-1 día-1 en la glándula digestiva. En branquias de ejemplares tratados con una concentración de 200 µg L-1 Cu2+ se observó una desorganización del tejido conjuntivo, alteraciones en la porción apical de las células ciliadas e hiperplasia y fusión de laminillas, pudiendo llegar incluso a la pérdida de estas laminillas a 600 µg L-1 Cu2+. En la glándula digestiva (hepatopáncreas) de ejemplares sometidos a 600 µg L-1 Cu2+ se detectó un adelgazamiento del epitelio y, en algunos casos, oclusión de la luz de los túbulos digestivos y dilatación de los conductos digestivos. En el corazón de los organismos expuestos a concentraciones subletales de cobre se observó un adelgazamiento del epitelio de las aurículas y del ventrículo, un incremento de las células marrones (brown cells) en las paredes de las aurículas, así como una distensión de las fibras musculares y destrucción del tejido conectivo de soporte, tanto en las aurículas como en el ventrículo.
Palabras clave: acumulación, alteraciones histopatológicas, cobre, Crassostrea angulata.
Abstract
Specimens of Crassostrea angulata were exposed to sublethal copper concentrations (200 and 600 µg L-1 Cu2+) during 2 to 30 days. The accumulation of copper and histopathological effects on the gills, digestive gland and heart were studied. The highest copper concentrations were found in the gills, with values over 2 mg g-1 dry weight for organisms exposed to the highest concentration at the end of the exposure period (day 30). In the digestive gland, the concentration was 1 mg g-1 dry weight (highest exposure on day 30). The rate of bioconcentration (BCr, defined as the concentration in the tissue at an exposure concentration at time t minus the mean concentration of the control throughout the experiment, divided by the exposure time) decreased in both tissues. The values ranged from 392 to 57 µg g-1 day-1 for gills and from 133 to 18 µg g-1 d-1 for the digestive gland. In the gills, specimens exposed to 200 µg L Cu2+ showed disorganization and apical alterations of the cilia cells and hyperplasia, lamellar fusion and lamellar loss in organisms exposed to 600 µg L-1 Cu2+. In the digestive gland, specimens exposed to 200 µg L-1 Cu2+ showed hemocytic infiltration in the underlying connective tissue and numerous brown cells compared to the control specimens. On the other hand, thinning of the epithelium of the digestive tubules, occlusion in the lumen of some primary tubules and dilation of the digestive ducts occurred in organisms exposed to 600 µg L-1 Cu2+. The heart of oysters exposed to copper showed thinning of the epithelium of the auricles and ventricle and an increase in brown cells on the walls of the auricles, as well as connective tissue destruction in the auricles and ventricle.
Key words : accumulation, histopathological alterations, copper, Crassostrea angulata.
Introducción
Los metales engloban a un amplio conjunto de elementos que, en líneas generales, se caracterizan por ser no degradables, tener una elevada persistencia en el medio y ser susceptibles de ser incorporados y acumulados por los organismos (Allen-Gil et al., 1997). Desde la década de los ochenta, se ha extendido el uso de biomarcadores en programas de monitorización de la contaminación ambiental. Entre los organismos biomonitores se han usado diferentes especies de moluscos bivalvos y peces (Blasco et al., 2003), y como biomarcadores utilizados destacan, entre otros biomarcadores, métodos bioquímicos (actividades enzimáticas, lisosomas, peroxidación lipídica, proteínas de estrés, metalotioneinas, citocromo P450, etc.) y aproximaciones celulares (Moore, 1985; Cajaraville et al., 1990, 2000; Soto y Marigómez, 1995; Marigómez et al., 1995; Bernet et al., 1999; Blasco et al., 1999, 2003; Sarasquete y Segner, 2000; Sarasquete y Gutiérrez, 2004).
La histología (Capeta da Silva, 1997; Ortiz-Delgado et al., 1999; Arellano et al., 1999, 2001; Cargnin-Ferreira et al., 2003; Arufe et al., 2004; Hampel et al., 2004), complementada con métodos específicos de histoquímica e inmunocitoquímica (Arellano et al., 1999, 2001; Sarasquete y Segner, 2000; Ortiz-Delgado y Sarasquete, 2004), permite localizar daños tisulares, y conocer la distribución subcelular e inducción de biomarcadores específicos en tejidos diana.
El cobre es un elemento traza esencial para la vida de los organismos. Forma parte de la estructura de más de 30 enzimas y de otras moléculas (oxidasas, hidrolasas, hemocianina, metalotioneínas, etc.) (Harris, 1991). Sin embargo, dependiendo de la especie, determinadas concentraciones de cobre pueden ser tóxicas para los organismos, produciendo considerables alteraciones fisiológicas e histopatológicas (Sarasquete et al., 1992, 1997; Arellano et al., 1999; Ortiz-Delgado et al., 1999).
Diferentes especies de moluscos bivalvos (Crassostrea angulata, Scrobicularia plana, Venerupis sp., Mytilus sp.) han sido usados como biomonitores de la contaminación acuática (Blasco et al., 1993, 1999, 2003; Díaz-Méndez et al., 1998; López-Barea y Pueyo, 1998; DelValls et al., 1999; Cajaraville et al., 2000). Los bivalvos son indicadores adecuados de contaminación ambiental in situ, ya que poseen las siguientes y adecuadas características: son organismos sedentarios, muestran una alta capacidad de bioacumulación, son abundantes, de vida media larga, manejables y fácilmente aclimatables a las condiciones experimentales.
El ostión Crassostrea angulata Lamarck, 1819 es un molusco bivalvo de gran importancia en la región sudatlántica española, tanto desde el punto de vista ecológico como comercial. Las altas concentraciones de cobre que, a menudo, presentan los ostiones (Galtsoff, 1964; Establier, 1977; George et al., 1978; Capeta da Silva, 1997; Blasco et al., 1999) en relación a otros bivalvos (Establier, 1977; Blasco et al., 2003) puede ser explicada por la gran capacidad que posee esta especie para acumular cobre en sus diferentes compartimentos celulares, neutralizar sus efectos tóxicos, y excretar/eliminar el contaminante mediante diferentes estrategias fisiológicas (López-Artíguez et al., 1989; Cheung y Wong, 1992; Capeta da Silva, 1997; Sarasquete et al., 1997; Rodríguez de la Rua, 1999). Aunque precisamente por estas características (biodisponibilidad, biomagnificación, concentraciones ambientales, etc.) algunos autores desaconsejan su uso como bioindicadores, trabajos recientes (DelValls et al., 1999) realizados experimentalmente mediante transplantes, ponen de manifiesto un incremento de la acumulación de metales con el tiempo de exposición, y con la concentración ambiental, sugiriendo la adecuada utilidad del ostión en programas de biomonitoriza-ción ambiental.
El objetivo de este trabajo fue estudiar las alteraciones histopatológicas en branquias, glándula digestiva y corazón de ejemplares de C. angulata expuestos a concentraciones subletales de cobre (200 y 600 µg L-1 Cu2+) y determinar la cinética de acumulación de cobre en estos órganos, teniendo en cuenta el tiempo de exposición al contaminante (de 2 a 30 días), con el fin de establecer la relación toxicidad-bioacumulación.
Material y métodos
Los ejemplares de ostión C. angulata utilizados (peso fresco: 9.94 ± 0.36 g; longitud máxima: 3.37 ± 0.11 cm) fueron recogidos en el medio natural en salinas de la Bahía de Cádiz (Sancti Petri, Chiclana), en zonas alejadas de fuentes de contaminación (Garrido, 2002).
Hasta el momento de su utilización, los ostiones se mantuvieron en acuarios de cristal, con un flujo de agua de mar convenientemente aireada. Tras una semana de aclimatación, se expusieron durante 30 días a cobre (200 y 600 µg L-1 Cu2+) en acuarios de 10 L, renovando 0.66 del volumen de agua cada 24 h. De forma paralela se mantuvieron ejemplares control. Durante los días 2, 7, 15 y 30, se recogieron muestras de cada grupo experimental (n = 10) para el análisis cuantitativo de cobre y estudios histopatológicos. Durante todo el período experimental, los ejemplares fueron alimentados con microalgas (Tetraselmis chuii y Nannochloropsis gaditana). Las condiciones del agua durante el periodo experimental han sido: temperatura 18-20°C, pH 8.2 y 8.3, y salinidad 35.
Para la determinación de las alteraciones histopatológicas, las muestras (branquias, glándula digestiva y corazón) previamente fijadas en formol tamponado con fosfatos 0.1 M (pH 7.2) se incluyeron en parafina y se tiñeron con hematoxilina-eosina y hematoxilina/VOF (Verde Luz, Orange G y Fucsina Ácida) (Gutiérrrez, 1967). Por otro lado, las branquias fueron fijadas en glutaraldehído al 2.5% tamponado con cacodilato de sodio (0.1 M), procediéndose a la postfijación, deshidratación, secado y recubrimiento de muestras según Bozzola y Russel (1992), para la observación a microscopía electrónica de barrido.
Las muestras de tejido fueron digeridas según la metodología descrita por Amiard et al. (1987). A una alícuota de tejido seco, con un peso seco entre 0.1 y 0.2 g, se le adicionó HNO3 concentrado, y se colocó en un bloque calefactor a 95°C durante 1 h. Posteriormente, las muestras se enrasaron a un volumen final de 5 mL. El análisis se llevó a cabo por espectro-fotometría de absorción atómica de llama (FAAS), y los resultados se validaron mediante el empleo de material de referencia (DORM1, NRC Canadá), mostrando una buena concordancia (5.22 ± 0.33 y 5.45 µg g-1 peso seco) con los valores certificados (Blasco et al., 1999, 2003).
El tratamiento estadístico se realizó mediante el programa Statgraphics-plus 6.0, utilizándose la prueba múltiple de Student-Newman-Keuls (95%).
Resultados
Alteraciones histopatológicas Branquias
Las branquias del ostión, como de otras especies de bivalvos (Galtsoff 1964; Kennedy et al., 1996), están constituidas por dos pares de láminas branquiales formadas por filamentos ciliados, recubiertos por laminillas branquiales, dispuestas paralelamente entre sí (figs. 1, 2a).
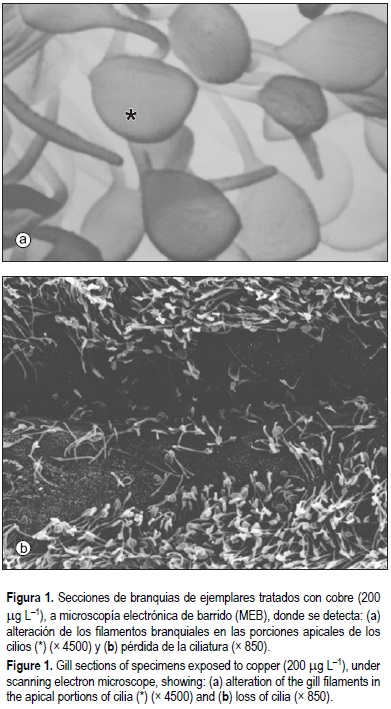

Las laminillas branquiales presentan unas estructuras de soporte denominadas varillas quitinosas y un epitelio ciliado constituido por distintos tipos celulares. En la zona más alejada de la base, donde se sitúan los cilios frontales, se encuentran células de tamaño uniforme, relativamente pequeñas y ciliadas. A cada lado de estas células existe una célula laterofrontal con un cirro. Las células latero-frontales son grandes y tienen un pequeño núcleo situado basalmente. A continuación, avanzando hacia la base de las laminillas, se observan mucocitos y un tipo de células grandes con cilios laterales.
En las branquias de ostiones expuestos a 200 µg L-1 de cobre durante 30 días, con una concentración en el tejido de 784 µg g-1 peso seco, se observa desorganización del epitelio e infiltración hemocitaria a nivel del tejido conjuntivo. En los filamentos branquiales se detecta una alteración de las porciones apicales de los cilios (figs. 1, 2b) y una pérdida de la ciliatura. En los ejemplares sometidos a concentraciones de 600 µg L-1 Cu2+ a partir de los 15 días de exposición, la concentración en el tejido fue de 1650 µg g-1 peso seco. Se observa además hiperplasia, fusión y pérdida de laminillas branquiales (fig. 2c). En consecuencia, en los tejidos se detecta un incremento del daño celular cuanto mayor es la acumulación de cobre.
Glándula digestiva
La glándula digestiva o hepatopancreas de C. angulata, como la de otros ostreidos (Galtsoff, 1964; Cargnin-Ferreira et al., 2003), es la gran masa compacta que rodea al estómago y a gran parte del intestino. Las partículas alimenticias son seleccionadas en el estómago a través de los ductos/conductos primarios que se ramifican en múltiples conductos secundarios y finalizan en masas de túbulos ciegos o divertículos digestivos (fig. 3a).

Los conductos digestivos presentan una forma externa redondeada con una luz irregular con entrantes y salientes, de forma estrellada, con un epitelio constituido por una zona ciliada y otra no ciliada. Los túbulos digestivos están formados por dos tipos celulares fácilmente diferenciables entre sí: las células digestivas, columnares, con un sistema lisosómico digestivo muy desarrollado, las cuales participan en la digestión intracelular del alimento, y las células basófilas, triangulares, con abundante retículo endoplasmático rugoso y relacionadas con la síntesis de proteínas.
En la glándula digestiva de ostiones expuestos a cobre se observan diferentes alteraciones histopatológicas. En el tejido conectivo de soporte de los ejemplares sometidos a 200 µg L-1 de cobre, a los 30 días de exposición (770 µg g-1 peso seco) se observó una infiltración hemocitaria y un aumento de células marrones (brown cells), las cuales son escasas en los ejemplares control. En los ostiones expuestos a 600 µg L-1 de cobre, a partir de los 7 días de exposición (638 µg g-1 peso seco) se observa un adelgazamiento del epitelio de la glándula digestiva y oclusión en la luz de algunos divertículos digestivos (fig. 3b). En algunos ejemplares se observa, además, una necrosis focal de células del tejido conjuntivo que, en algunos casos, finaliza con una necrosis masiva del tejido conectivo de soporte. En el sistema vascular se observa una obstrucción de la luz de algunos vasos, la cual es invadida por numerosos hemocitos. Conforme aumenta el tiempo de exposición al cobre, y por tanto un incremento de la concentración en los tejidos, se observa un incremento en el número de células basófilas de los túbulos digestivos (fig. 3b).
Corazón
La histofisiología del corazón de ostreidos ha sido ampliamente descrita (Galtsoff 1964; Kennedy et al., 1996). De forma similar, en C. angulata, el corazón está constituido por un ventrículo y dos aurículas. El ventrículo, más grande y voluminoso, presenta sus paredes constituidas por un armazón de gruesas fibras musculares rodeadas por tejido conjuntivo. La superficie externa del ventrículo está cubierta por una capa de tejido epitelial constituido por delgadas células que presentan núcleos visibles. Las paredes de las aurículas, más finas y claras que las del ventrículo, también están formadas por un armazón de tejido conjuntivo. Las aurículas están recubiertas externamente por un alto epitelio columnar.
Las alteraciones histológicas observadas en el corazón aumentan progresivamente con la concentración de cobre y con el tiempo de exposición. En general, se observa un adelgazamiento del epitelio de las aurículas, del ventrículo y un incremento de las células marrones en las paredes de las aurículas, así como una distensión de las fibras musculares y necrosis del tejido conectivo de soporte, tanto en las aurículas (fig. 4) como en el ventrículo. En los ostiones expuestos a cobre (200 y 600 µg L-1), el incremento de celulas marrones es paralelo y progresivo con el tiempo de exposición.

Acumulación de cobre
En las figuras 5 y 6 se muestran los niveles de cobre en las branquias y glándula digestiva de ejemplares de C. angulata control y sometidos a 200 y 600 µg L-1 Cu2+. Debido a la escasez de muestras de corazón y ante la imposibilidad de disponer de replicados, no se presentan los datos de acumulación de cobre en el corazón.


Branquias
En las branquias, tanto de ejemplares sometidos a 200 µg L-1 Cu2+ como a 600 µg L-1 Cu2+, se observan diferencias significativas en los niveles de cobre acumulados (P < 0.005), siendo el incremento de cobre progresivo con el tiempo de exposición (fig. 5). Por otra parte, los mayores niveles de cobre se observaron en los organismos expuestos a concentraciones de 600 µg L-1 Cu2+, obteniéndose concentraciones alrededor de 2200 µg g-1 de peso seco a los 30 días de exposición. Los niveles de cobre en los ejemplares control han sido <500 µg g-1. La tasa de bioconcentración (BCr)tejido, definida como la diferencia entre la concentración en el tejido (Ct) a una concentración de exposición a tiempo t y la concentración media del control (C0) a lo largo del experimento, dividida por el tiempo de exposición,

disminuyó y sus valores variaron en el intervalo entre 392 y 57 µg g-1 d-1 en las branquias.
Glándula digestiva
En la glándula digestiva los resultados obtenidos muestran un incremento de los niveles de cobre, al aumentar la concentración y el tiempo de exposición, observándose concentraciones de cobre de 880 µg g-1 peso seco a los 30 días de exposición en ostiones expuestos a 600 µg L-1 Cu2+, siendo los niveles de cobre en ejemplares control de 340 µg g-1 peso seco. En la glándula digestiva, la tasa de acumulación varió entre 133 y 18 µg g-1 d-1.
Discusión
La gran capacidad que presentan los ostreidos para acumular cobre en sus tejidos les confiere, cuando la concentración supera valores umbrales, un ligero y característico olor metálico y una fuerte coloración verde, principalmente en manto y branquias (Establier, 1977; George et al., 1978; Sarasquete et al., 1997). Según diferentes autores (Establier, 1977; López-Artíguez et al., 1989; Bou-Olayan et al., 1995; Sarasquete et al., 1997; Blasco et al., 2003) estos bivalvos pueden acumular metales en sus órganos/tejidos en proporción paralela al grado de contaminación ambiental.
En vertebrados e invertebrados acuáticos las branquias son los órganos directamente expuestos y los más susceptibles a las variaciones ambientales, siendo por ello un órgano diana para diferentes contaminantes (Cheung y Wong, 1992; Arellano et al. , 1999, 2001). Las branquias, además, constituyen el principal órgano implicado en la respiración, manteniendo una corriente constante; filtrando el agua y recolectando y reteniendo partículas alimenticias. Una vez que filtran el agua, las partículas atrapadas son absorbidas por el mucus branquial. Si estas partículas atrapadas han estado expuestas a metales, el tejido branquial mostrará un alto contenido de dichos contaminantes (Cheung y Wong, 1992).
Aunque el factor de bioconcentración y bioacumulación (BCF/BAF) del organismo entero se emplea como un criterio para clasificar el riesgo, éste no es adecuado en el caso de los metales, ya que éstos son más elevados a concentraciones bajas y menores a concentraciones más altas (McGeer et al., 2003). Las branquias y la glándula digestiva presentaron un comportamiento diferente; en las branquias BCF era mayor cuando la concentración era más elevada, mientras que en la glándula digestiva el valor de BCF disminuía al incrementar la concentración. Por tanto, no se puede establecer una relación entre BCF y toxicidad. Este comportamiento puede ser consecuencia de que en las branquias no se han alcanzado las condiciones de equilibrio, y los procesos de incorporación son más activos que los de eliminación. En ambos tejidos, BCr mostró un descenso, lo que implica que hay una fase inicial, correspondiente al periodo de una semana, donde a la menor concentración ensayada se produce una tasa de acumulación más elevada y constante, mientras que después se produce un descenso. En cambio, a concentraciones elevadas de cobre, el descenso en la tasa de eliminación es continuado. La presencia de transportadores específicos de membrana para este metal ha sido señalada por Percival y Harris (1990). La acumulación de cobre en Crassostrea virginica se encuentra condicionada por la presencia de otros metales; así en presencia de Cd, la acumulación de Cu es menor. La elevada concentración de cobre que se encuentra en las ostras, parece que es consecuencia de la falta de mecanismos eficaces de eliminación (Engel, 1999).
En las branquias de C. angulata expuestas a 200 y 600 µg L-1 de cobre se observó, mediante microscopía electrónica de barrido, una dilatación y engrosamiento en la porción apical de los cilios en forma de raqueta. Durfort et al. (1990) han descrito alteraciones ciliares similares en las branquias de almejas, Tapes decussatus parasitadas por Perkinsus sp. Blasco et al. (1997), en las branquias de ejemplares de Ruditapes philippinarum expuestos al tensioactivo aniónico (alquilbenceno sulfonato lineal, LAS) observaron descamación del epitelio branquial y signos de reacción inflamatoria con infiltración de hemocitos; alteraciones que relacionaron con una respuesta del organismo a los efectos estresantes e irritantes del LAS.
En la glándula digestiva de ejemplares de C. angulata expuestos a concentraciones subletales de cobre se producen diferentes alteraciones que se incrementan, de forma general, con la concentración y con el tiempo de exposición al contaminante. Entre las alteraciones observadas destacan: un aumento del número de células marrones; adelgazamiento del epitelio de la glándula digestiva; oclusión en la luz de algunos divertí-culos; dilatación de los conductos digestivos e incremento del número de células basófilas de los túbulos digestivos. Cajaraville et al. (1990) señalaron que la variación de células basófilas era un buen biomarcador celular de exposición a contaminantes orgánicos. Moore (1988), en la glándula digestiva de Mytilus edulis sometidos a contaminación por hidrocarburos policíclicos aromáticos (PAHs), observó un incremento de células marrones y una dilatación y degeneración de los túbu-los digestivos. Por otra parte, en el epitelio de la glándula digestiva de ejemplares de M. edulis contaminados por PCBs, PAHs y metales, Lowe (1988) observó un incremento de lípidos que relacionó con un aumento de lisosomas secundarios. Variaciones lipídicas/peroxidación lipídica y cambios en la actividad de enzimas lisosomales han sido observados en diferentes especies de bivalvos expuestos a cobre y cadmio (Sarasquete et al., 1992), así como en ejemplares del pez sapo, Halobatrachus didactylus, expuestos a concentraciones subletales de plomo (Campana et al., 2003).
En la glándula digestiva de C. angulata se observa una acumulación de cobre conforme aumenta la concentración y el tiempo de exposición, observándose menores concentraciones de cobre en la glándula que en branquias, debido posiblemente a que la glándula digestiva presenta mecanismos más eficaces para eliminar los metales como neutralización/excreción/ eliminación (vía lisosomas digestivos y/o cuerpos residuales, metalotioneínas, heces, orina, etc.) (Cheung y Wong, 1992; Dallinger, 1995; Marigómez et al., 1995). Sin embargo, Duquense y Coll (1995), en almejas Tridacna crocea expuestas a cobre observaron las mayores concentraciones de este metal en la glándula digestiva. Los mecanismos de incorporación, acumulación y eliminación de metales son específicos de las especies, las cuales parecen disponer de diferentes estrategias para la eliminación y/o disminución de la concentración metálica tóxica en el interior del organismo (Cheung y Wong, 1992; Dallinger, 1995).
En ejemplares de ostión expuestos a cobre, se detecta un incremento de células marrones en la glándula digestiva y corazón, como observaron Galtsoff (1964) y Zaroogian y Yevich (1993) en C. virginica. En el interior de estas células que muestran actividad lisosomal se han observado gránulos de lipofuschina, residuos de cistina y cisteina, etc. (Capeta da Silva, 1997; Sarasquete et al., 1997). Las células marrones constituyen la primera línea de defensa para la degradación y desintoxicación de los metales pesados (Zaroogian y Yevich, 1993). Sarasquete et al. (1997), en ejemplares de C. angulata con una intensa coloración verde, observaron numerosas células marrones en la pared de las aurículas y dispersas por el tejido conjuntivo. El número de estas células marrones se incrementa cuando el organismo es sometido a determinados agentes patógenos y/o agresiones ambientales (Gutiérrez, 1977).
En el corazón de los ostiones expuestos a diferentes concentraciones subletales de cobre (200 y 600 µg L-1 Cu2+) se observa un incremento de células marrones en las aurículas, que además es superior en los ejemplares expuestos a las mayores concentraciones de cobre (600 µg L-1 Cu2+). La eliminación de cobre en diferentes moluscos bivalvos puede realizarse, entre otros sistemas, a través de cuerpos residuales que contienen lipofuscinas, a través del sistema macrófago, etc. (Galsoff 1964; George et al., 1978; Sarasquete et al., 1992). En las ostras, las paredes de las aurículas se encuentran recubiertas por un alto epitelio columnar que contiene numerosas células glandulares y pigmentadas y constituyen parte del sistema excretor (Galtsoff, 1964; Kennedy et al., 1996). En ejemplares de zonas relativamente contaminadas, la hemolinfa fluye a través de las aurículas, entra en contacto con las células marrones donde se absorbe el material contaminante, pasando al interior de los lisosomas, donde se realiza el proceso de desintoxicación. En ostras que se encuentran en zonas altamente contaminadas, las células marrones están sobrecargadas y en su interior abundan las lisosomas (Zaroogian y Yevich, 1993; Sarasquete et al., 1997). Estas células son probablemente lisadas y su material es excretado a través de las paredes de las aurículas y hacia la cavidad pericárdica. Desde aquí, el material desintoxicado es filtrado por las células epiteliales de los túbulos renales, siendo finalmente excretado a través del poro urogenital (Zaroogian y Yevich, 1993).
Los resultados de este trabajo ponen en evidencia la utilidad de usar aproximaciones histológicas, en combinación con técnicas analíticas (cuantificación de contaminantes), como herramienta adecuada para evaluar el potencial efecto tóxico del cobre, así como para intentar explicar los complejos mecanismos, interespecíficos, implicados en los procesos de acumulación/biomagnificación, movilización y desintoxicación/excreción de metales entre los diferentes órganos y tejidos diana de bivalvos en general y del ostión C. angulata, en particular.
Agradecimientos
Deseamos expresar nuestro más sincero agradecimiento a Juan B. Ortiz-Delgado por la revisión del trabajo, que ha sido subvencionado por el Instituto de Ciencias Marinas de Andalucía, CSIC (Unidad Asociada de Calidad Ambiental y Patología, CSIC y UCA).
Referencias
Allen-Gil, S.M., Gubala, C.P., Dixon, H.L. and Lasorsa, B.K. (1997). Heavy metals accumulation in sediment and freshwater fish in US Arctic lakes. Environ. Toxicol. Chem., 16(4): 733-741. [ Links ]
Amiard, J.C., Pineau, A., Boiteau, H.L., Metayer, C. and Amiard-Triquet, C. (1987). Application of atomic absorption spectro-photometry using Zeeman effect for the determination of eight trace elements (Ag, Cd, Cr, Cu, Mn, Ni, Pb and Se) in biological materials. Water Res., 2(16): 693-697. [ Links ]
Arellano, J.M., Storch, V. and Sarasquete, C. (1999). Histological changes and copper accumulation in liver and gills of the Senegalese sole, Solea senegalensis. Ecotoxicol. Environ. Saf., 44: 62-72. [ Links ]
Arellano, J.M., Ortiz-Delgado, J.B., González de Canales, M.L. and Sarasquete, C. (2001). Histopathological alterations and CYP1A induction in the liver and gills of the gilthead seabream, Sparus aurata, specimens exposed to 2,3,7,8-tetrachlorodibenzo-p- dioxin-TCDD. Histochem. J., 33: 653-662. [ Links ]
Arufe, M.I., Arellano, J.M., Moreno, M.J. and Sarasquete, C. (2004). Toxicity of a commercial herbicide containing terbutryn and triasulfuron to seabream, Sparus aurata, larvae: A comparison with the Microtox® test. Ecotoxicol. Environ. Saf., 59: 209-216. [ Links ]
Bernet, D., Schidt, H., Meier, W., Burkhardt-Holm, P. and Wahli, T. (1999). Histopathology in fish: Proposal to assess aquatic pollution. J. Fish Dis., 22: 25-34. [ Links ]
Blasco, J., Puppo, J., González de Canales, M.L. y Sarasquete, C. (1993). Acumulación y efectos histopatológicos del cobre en Liza aurata L. y Sparus aurata L. Series de Química Oceanográfica. Ser. II. Vol 2/3, pp. 159-174. [ Links ]
Blasco, J., Sarasquete, C., González-Mazo, E., y Gómez-Parra, A. (1997). Influencia del alquilbenceno sulfonato lineal sobre algunas actividades enzimáticas de la almeja Ruditapes phillipinarum. VII Seminario de Química Marina. Servicio de Publicaciones de la Universidad de Cádiz, pp. 149-159. [ Links ]
Blasco, J., Arias, A.M. and Sáenz, V. (1999). Heavy metals in organisms of the River Guadalquivir estuary: Possible incidence of Aznalcóllar disaster. Sci. Total Environ., 242: 249-259. [ Links ]
Blasco, J., Sáenz, V., Arias, A.M., González-Pascual, R., Campana, O., Ransome, T., Moreno-Garrido, I. y Hampel, M. (2003). Efecto del accidente minero sobre los organismos residents en el estuario del Guadalquivir y en las zonas de la plataforma próxima a la desembocadura. En: J. Forja y A. Gómez-Parra (eds.), Contaminación por Metales Pesados del Estuario del Guadalquivir. Servicio Publicaciones Universidad de Cádiz, España, pp. 165-203. [ Links ]
Bou-Olayan, A-H., Al-Mattar, S., Al-Yacoob, S. and Al-Hazeem, S. (1995). Accumulation of lead, cadmiun, cooper and nickel by pearl oyster, Pinctada radiata, from Kuwait Marine Environment. Mar. Pollut. Bull., 30(3): 211-214. [ Links ]
Bozzola, J.J. and Russel, L.D. (1992). Electron Microscopy. Principles and Techniques for Biologists. Jones and Bartlett, pp. 40-62. [ Links ]
Cajaraville, M.P., Diez, G., Marogómez, J.A. and Angulo, E. (1990). Responses of basophilic cells of the digestive gland of mussels to petroleum hydrocarbon exposure. Dis. Aquat. Org., 9: 221-228. [ Links ]
Cajaraville, M.P., Bebianno, M.J., Blasco, J., Porte, C., Sarasquete, C. and Viarengo, A. (2000). The use of biomarkers to assess the impact of pollution in coastal environments of the Iberian Peninsula: A practical approach. Sci. Total Environ., 47: 295-311. [ Links ]
Campana, O., Sarasquete, C. and Blasco, J. (2003). Lead effect on ALA-D activity, metallothionein and lipid peroxidation in blood, kidney and liver of the toadfish Halobatrachus didactylus (Schneider,1801). Ecotoxicol. Environ. Saf., 55: 116-125. [ Links ]
Capeta da Silva, D. (1997). Efeito do cobre em peixes (Halobatrachus didactylus) e moluscos (Crassotrea angulata): Quantificao e efeitos histopatológicos. Relatório de estágio do curso de Licenciatura em Biologia Marinha e Pescas. Univ. do Algarve, Portugal, 72 pp. [ Links ]
Cargnin-Ferreira, E., González de Canales, M.L. y Sarasquete, C. (2003). Histología comparada de bivalvos comerciales en la región sudatlántica española. IX Congreso Nacional de Acuicultura, Cádiz, España, mayo, 2003. [ Links ]
Cheung, Y.H. and Wong, M.H. (1992). Trace metal contents of the Pacific oyster (Crassostrea gigas) purchased from markets in Hong Kong. Environ. Manage., 16(6): 753-761. [ Links ]
Dallinguer, R. (1995). Metabolism and toxicity of metals: Metallothioneins. In: M.P. Cajaraville (ed.), Cell Biology in Environmental Toxicology. Press Service. Universidad Pais Vasco, Bilbao, Spain, pp. 171-190. [ Links ]
DelValls, T.A., Sáenz, V., Arias, A.M. and Blasco, J. (1999). Thallium in the marine environment: First ecotoxicological assessments in the Guadalquivir estuary and its potential adverse effect on the Doñana European Natural Reserve after the Aznalcóllar mining spill. Cienc. Mar., 25(2): 161-175. [ Links ]
Díaz-Méndez, F.M., Rodríguez-Ariza, A., Usero-García, J., Pueyo, C. and López-Barea, J. (1998). Mutagenic activation of aromatic amines by molluscs as a biomarker of marine pollution. Environ. Mol. Mutagen., 31(3): 282-291. [ Links ]
Duquense, S.J. and Coll, J.C. (1995). Metal accumulation in the clam Tridacna crocea under natural and experimental conditions. Aquat. Toxicol., 32: 239-253. [ Links ]
Durfort, M., García-Valero, J. and Montes-Castillo, J. (1990). Modified cilia in epithelia of clams infested by Perkinsus sp. (Apicomplexa, Perkinsea). VI Colloque International de Pathologie en Aquaculture Marine. Abstracts, 40 pp. [ Links ]
Engel, D.W. (1999). Accumulation and cytosolic partitioning of metals in the American oyster Crassostrea virginica. Mar. Environ. Res., 47: 89-102. [ Links ]
Establier, R. (1977). Estudio de la contaminación marina por metales pesados y sus efectos biológicos. Inf. Téc. Inst. Inv. Pesq., 47: 1-36. [ Links ]
Galtsoff, P.S. (1964). The American oyster. Fish Wildlife Serv. Fish. Bull., 64: 1-180. [ Links ]
Garrido, M.C. (2002). Criterios de calidad ambiental. Aplicación a aguas limitadas del Golfo de Cádiz. Tesis doctoral, Universidad de Cádiz, España, 460 pp. [ Links ]
George, S.G., Pirie, B.J.S., Cheyne, T.L., Coombs, T.L. and Grant, P.T. (1978). Detoxification of metals by marine bivalves: An ultrastructural study of the compartmentation of copper and zinc in the oyster Ostrea edulis. Mar. Biol., 45: 147-156. [ Links ]
Gutiérrez, M. (1967). Coloración histológica para ovarios de peces, crustáceos y moluscos. Inv. Pesq., 31: 265-271. [ Links ]
Gutiérrez, M. (1977). Datos sobre la parasitología e histopatología del ostión, Crassostrea angulata Lmk, de la costa sudatlántica de España. Inv. Pesq., 41(3): 543-567. [ Links ]
Hampel, M., Ortiz-Delgado, J.B., Moreno-Garrido, I., Sarasquete, C. and Blasco, J. (2004). Effects of sodium linear alkylbencene sulphonate on larvae of the seabream (Sparus aurata): Histological approach. Histol. Histopathol., 19: 1061-1073. [ Links ]
Harris, E.D. (1991). Copper transport: An overview. Proc. Soc. Exp. Med., 192: 130-140. [ Links ]
Kennedy, U.S., Newell, R.I.E. and Eble, A.F. (eds.) (1996). The Eastern Oyster, Crassostrea virginica. Maryland Sea Grant, College Park, Maryland, 233 pp. [ Links ]
López-Artíguez, M., Soria, M.L. and Repetto, M. (1989). Heavy metals in bivalve molluscs in the Huelva estuary. Bull. Environ. Contam. Toxicol., 42: 634-642. [ Links ]
López-Barea, J. and Pueyo, C. (1998). Mutagen content and metabolic activation of promutagens by molluscs as biomarkers of marine pollution. Mutat. Res. Mar., 13(399): 3-15. [ Links ]
Lowe, D.M. (1988). Alterations in cellular structure of Mytilus edulis resulting from exposure to environmental contaminants under field and experimental conditions. Mar. Ecol. Prog. Ser., 46: 91-100. [ Links ]
McGeer, J.C., Brix, K.V., Skeaf, J.M., DeForest, D.K., Brigham, S.I., Adams, W.J. and Green A. (2003). Inverse relationship between bioconcentration factor and exposure concentration for metals in the aquatic environment. Environ. Toxicol. Chem., 22(5): 1017-1037. [ Links ]
Marigómez, I., Soto, M. and Cajaraville, M.P. (1995). Morphofunctional patterns of tissue systems involved in metal handling and metabolism. In: M.P. Cajaraville (ed.), Cell Biology in Environmental Toxicology. Press Service. Universidad Pais Vasco, Bilbao, Spain, pp. 89-134 [ Links ]
Moore, M.N. (1985). Cellular responses to pollutants. Mar. Pollut. Bull., 16: 134-139. [ Links ]
Moore, M.N. (1988). Cytochemical responses of the lysosomal system and NADPH-ferrihemoprotein in molluscan digestive cells to environmental and experimental exposure to xenobiotics. Mar. Ecol. Prog. Ser., 46: 81-89. [ Links ]
Ortiz-Delgado, J.B. and Sarasquete, C. (2004). Toxicity, histopathological alterations and immunohistochemical CYP1A induction in the seabream, Sparus aurata early life stages following waterborne exposure to B(a)P and TCDD. Histochem. J. Mol. Hist., 35: 29-45. [ Links ]
Ortiz-Delgado, J.B., González de Canales, M.L., Sarasquete, C. (1999). Cuantificación y alteraciones histopatológicas producidas por concentraciones subletales de cobre en Fundulus heteroclitus. Cienc. Mar., 25(1): 119-143. [ Links ]
Percival, S.S. and Harris, E.D. (1990). Copper transport from ceruloplasmin: Charcaterization of cellular uptake mechanism. Am. J. Physiol., 258, C140. [ Links ]
Rodríguez de la Rúa, A. (1999). Efecto del cobre en el ostión, Crassostrea angulata (Lmk.). Cuantificación y alteraciones histopatológicas e histoquímicas. Tesis de licenciatura, Universidad de Cádiz, España, 133 pp. [ Links ]
Sarasquete, C. and Segner, H. (2000). Cytochrome P450 1A (CYP1A) in teleostean fishes. A review of immunohistochemical studies. Sci. Total Environ., 247: 313-332. [ Links ]
Sarasquete, C. and Gutiérrez, M. (2004). New tetrachromic VOF stain (type III-G.S) for normal and pathological tissues. Eur. J. Histochem, 49(2): 105-114. [ Links ]
Sarasquete, C., González de Canales, M.L. and Gimeno, S. (1992). Comparative histopathological alterations in the digestive gland of marine bivalves exposed to Cu and Cd. Eur. J. Histochem., 36: 223-232. [ Links ]
Sarasquete, C., González de Canales, M.L., Blasco, J., Capeta Da Silva, D., Arellano, J.M. and Gutiérrez, M. (1997). Histochemical distribution and accumulation of trace metals in the heart of green and normal Crassostrea angulata specimens from different southwest Spanish coasts. Eur. J. Histochem., 41: 139-148. [ Links ]
Soto, M. and Marigómez, I. (1995). Techniques for the study of metals in cell biology. In: M.P. Cajaraville (ed.), Cell Biology in Environmental Toxicology. Press Service. Universidad Pais Vasco, Bilbao, Spain, pp. 59-88. [ Links ]
Zaroogian, G. and Yevich, P. (1993). Cytology and biochemistry of brown cells in Crassostrea virginica collected at clean and contaminated stations. Environ. Pollut., 79: 191-197. [ Links ]














