Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Ciencias marinas
versão impressa ISSN 0185-3880
Cienc. mar vol.31 no.1b Ensenada Mai. 2005
Artículos
Distribución de contaminantes orgánicos en sedimentos costeros de la Bahía de Cádiz (SO de España)
Distribution of organic pollutants in coastal sediments of Cádiz Bay (SW Spain)
P.A. Lara-Martín1 A. Gómez-Parra1 M. Petrovic2 D. Barceló2 E. González-Mazo1*
1 Departamento de Química Física Facultad de Ciencias del Mar y Ambientales Universidad de Cádiz Campus Río San Pedro s/n 11510 Puerto Real, Cádiz, España. * E-mail: eduardo.gonzalez@uca.es
2 Departamento de Química Ambiental Instituto de Investigación de Química Ambiental de Barcelona (IIQAB) Jordi Girona 18-26 08034 Barcelona, España.
Recibido en junio de 2003;
aceptado en mayo de 2004.
Resumen
Se han determinado las concentraciones de tensioactivos y compuestos orgánicos persistentes en sedimentos costeros (Bahía de Cádiz, SO de España) procedentes de dos zonas sometidas a distintos origen y grado de contaminación: un caño mareal (caño de Sancti Petri) en el cual se produce una descarga constante de aguas residuales urbanas sin tratamiento, y una zona estuárica (Río Guadalete) sometida a vertidos ocasionales de carácter agrícola y al efluente de una planta de tratamiento de aguas residuales urbanas e industriales. La determinación de sulfonato de alquilbenceno lineal (LAS), nonilfenol polietoxilados (NPEOs), hidrocarburos aromáticos policíclicos (PAHs), bifenilos policlorados (PCBs) y pesticidas organoclorados ha sido realizada por medio de un procedimiento analítico basado en el empleo de una unidad de extracción acelerada con disolventes (ASE), una etapa de purificación y preconcentración por fase sólida (SPE), y su posterior cuantificación por LC/MS y GC/MS. En general, las concentraciones más elevadas han sido encontradas en los sedimentos superficiales cercanos al vertido de aguas residuales urbanas sin depurar, con valores superiores a 80 mg kg-1 para el caso de LAS, de 200 µg kg-1 para los PAHs, y de 10 y 50 µg kg-1 para los PCBs y DDT, respectivamente. También se observa un descenso en la concentración de los compuestos con la profundidad del sedimento, a excepción de los PAHs y PCBs que presentan un máximo a unos 25-30 cm de profundidad. La zona sometida a vertidos de origen agrícola y al efluente de la depuradora muestra valores elevados para NPEOs (122 mg kg-1) y DDT (63 mg kg-1) como consecuencia de sus usos industrial y agrícola, respectivamente.
Palabras clave: sedimentos marinos, bahía, tensioactivos, PCBs, PAHs, organoclorados.
Abstract
Concentrations of surfactants and persistent organic pollutants have been determined in coastal marine sediments (Cádiz Bay, SW Spain) from two areas affected by different contamination sources and levels: a tidal channel (Sancti Petri Channel) subjected to the discharge of untreated urban effluents, and an estuarine zone (Guadalete River) subjected to the occasional discharge of effluents from agriculture and from an urban and industrial wastewater treatment plant. Linear alkylbenzene sulfonates (LAS), nonylphenol polyethoxylates (NPEOs), polycyclic aromatic hydrocarbons (PAHs), polychlorinated biphenyls (PCBs) and organochlorinated pesticides were determined by an analytical procedure based on the use of an accelerated solvent extraction unit, a preconcentration and cleaning stage using solid phase extraction, and later quantification by LC/MS and GC/MS. In general, the highest concentrations were found in surface sediments near the untreated urban effluent, with levels above 80 mg kg-1 for LAS, 200 µg kg-1 for PAHs, and 10 and 50 µg kg-1 for PCBs and DDT, respectively. Also observed was a decrease in the concentrations of the compounds with the depth of the sediment, with the exception of PAHs and PCBs, which show a maximum at 25-30 cm. In the area subjected to agricultural and wastewater treatment plant effluents, high levels of NPEOs (122 mg kg-1) and DDT (63 mg kg-1) were recorded as a result of their industrial and agricultural uses, respectively.
Key words: marine sediments, bay, surfactants, PCBs, PAHs, organochlorines.
Introducción
En la actualidad numerosos ecosistemas costeros continúan sometidos a la descarga de aguas residuales tratadas o no, de origen urbano e industrial. Asociados a estos vertidos se encuentran una gran cantidad de contaminantes orgánicos cuya presencia en el medio receptor es un hecho conocido (Preston y Raymundo, 1991; Eganhouse y Sherblom, 2001).
Los tensioactivos constituyen la materia activa de los detergentes y, por tanto, tienen un amplio uso sobretodo a nivel doméstico. El sulfonato de alquilbenceno lineal (LAS) y los nonilfenoles etoxilados (NPEOs) constituyen los tensioactivos aniónicos y no iónicos más usados a nivel doméstico e industrial, respectivamente. A pesar de que la producción de NPEOs es menor, su importancia radica en que sus compuestos de degradación, como es el caso del nonilfenol (NP), son disruptores endocrinos (Sonnenschein y Soto, 1998) y actualmente su uso está prohibido o restringido. En el grupo de los compuestos contaminantes orgánicos persistentes (POPs) se encuentran los hidrocarburos aromáticos policíclicos (PAHs), los bifenilos policlorados (PCBs) y otros organoclorados como el lindano, DDT, aldrín, etc. Estos contaminantes se caracterizan fundamentalmente por su gran persistencia e hidrofobicidad, lo cual les lleva a ser incorporados a lo largo de la cadena alimentaria, así como por su toxicidad y actividad mutagénica y carcinógena. Debido a esto, estos compuestos han sido incorporados a la lista de compuestos orgánicos prioritarios cuya descarga debe vigilarse (Directiva EC 76/464), y actualmente su uso o fabricación están prohibidos o restringidos. Los PAHs pueden ser generados por procesos tanto biogénicos (aerosoles oceánicos, incendios forestales, etc.) (Kawamura y Kaplan, 1986) como antropogénicos (quema incompleta de combustibles fósiles y aceites, principalmente) (Simoneit, 1989). Los PCBs, en cambio, suelen estar presentes en aceites de transformadores eléctricos, mientras que otros organoclorados analizados (DDT, lindano, aldrín, heptacloro, etc.) son usados como pesticidas.
Los sedimentos marinos constituyen un compartimento ambiental de especial relevancia en el estudio de este tipo de compuestos. A excepción del LAS, el resto de estos compuestos presenta baja solubilidad en agua (tabla 1) y en todos los casos el coeficiente de partición octanol-agua es elevado. Estas características quimicofísicas gobiernan el comportamiento de estos compuestos en disolución, mostrando una gran afinidad por la fase sólida y una elevada tendencia a asociarse con la materia orgánica de la misma. En este sentido existen numerosos trabajos de investigación que determinan la concentración de estos contaminantes en sedimentos superficiales fluviales y lacustres (Bennett y Metcalfe, 1998; Fernández et al., 2000; Stapleton et al., 2001); sin embargo, los realizados en sedimentos marinos son más escasos. Los valores encontrados en sedimentos superficiales son varios órdenes de magnitud superiores a los encontrados en agua, y muestran una gran variabilidad dependiendo de la zona de estudio y el origen de la contaminación. Así, para el caso del LAS se han encontrado niveles inferiores a 0.01 µg g-1 en la Bahía de Tokio (Japón) (Takada et al., 1992) y entre 0.1 y 10 mg kg-1 en la Bahía de Tarragona (NE de España), mientras que los valores de NPEOs son inferiores a 100 µg kg-1 en las costas de Marbella (S de España) (Petrovic et al., 2002). Se han encontrado concentraciones de 8-HCH, heptacloro y p,p'-DDE de 20 ng g-1 en lagunas costeras mexicanas (Botello et al., 2000), de 13 ng g-1 de PCBs en la Bahía de Liverpool (Inglaterra) (Camacho-Ibar y McEvoy, 1996) y superiores a 800 ng g-1 de PAHs en la Bahía de San Francisco (California, EUA) (Domagalski y Kuivila, 1993). En el caso del área estudiada en el presente trabajo, la Bahía de Cádiz, se han determinado varias decenas de ppm en el caso del LAS (León et al., 2001) y valores de NPEOs superiores a 400 µg kg-1 (Petrovic et al., 2002), no existiendo datos disponibles acerca de concentraciones de otros compuestos como PAHs o PCBs.

La investigación sobre la distribución vertical de contaminantes en sedimentos marinos costeros es aún más escasa y no existen en la actualidad datos disponibles para la Bahía de Cádiz. En el presente trabajo se han determinado las concentraciones de LAS, NPEOs, PAHs, PCBs y pesticidas organoclorados en dos zonas de la bahía sometidas a diferentes focos y grados de contaminación. Para la zona más contaminada se ha caracterizado la distribución vertical de la concentración de estos compuestos. Los objetivos del presente trabajo han sido conocer y comparar los niveles de los distintos contaminantes en función de la zona de estudio y de la influencia de diferentes vertidos sobre la misma, así como caracterizar la variación de los contaminantes detectados con la profundidad y su persistencia.
Materiales y métodos
Descripción del área de estudio
La Bahía de Cádiz es un ecosistema costero en el que predominan las marismas, declarado Parque Natural, que continúa sometido a la continua descarga de aguas residuales urbanas, en su mayor parte sin tratar. La primera zona de muestreo (denominada SP) está situada en una marisma de unos 60 km2 en la parte sur de la Bahía de Cádiz (SO de España), concretamente en el Caño de Sancti Petri (fig. 1), a 20 m del vertido de las aguas residuales urbanas sin tratamiento de la ciudad de San Fernando (100,000 habitantes). Este caño conecta la parte sur de la bahía con el Océano Atlántico, teniendo unos 18 km de longitud y escasa profundidad (3 a 6 m).

La segunda zona (RG, fig. 1) se sitúa más hacia el norte, en el estuario del Río Guadalete, a unos 8 km de su desembocadura. Con una cuenca de 3677 km2 de extensión, su cauce recibe los efluentes procedentes de la estación depuradora de aguas residuales de la ciudad de Jerez (150,000 habitantes) y de un gran polígono industrial, así como vertidos directos de cultivos agrícolas adyacentes.
Toma y pretratamiento de muestras
En ambas zonas, desde una embarcación neumática se tomaron sedimentos superficiales mediante dos dragas tipo Van Veen y en el caño de Sancti Petri se recolectaron ocho testigos de sedimento (50 cm de longitud y 5 cm de diámetro interno) por buzos. Los testigos fueron mantenidos vertical-mente y a 4°C hasta su traslado al laboratorio, en donde se congelaron hasta su análisis. Con objeto de disponer de una amplia resolución espacial, los testigos fueron cortados en rodajas de 0.5 cm de grosor de 0 a 2 cm, de 1 cm de 2 a 36 cm, y de 2 cm de 36 a 44 cm. El agua intersticial se separó mediante centrifugación a 10,000 g durante 30 min y la fase sólida fue liofilizada, se molturó con un molino de bolas de óxido de zirconio y fue tamizada a través de 0.063 mm. Los sedimentos tomados con dragas se liofilizaron, molturaron y tamizaron según lo descrito previamente.
Extracción y preconcentración
La extracción de los compuestos a analizar fue llevada a cabo mediante el uso de una unidad de extracción acelerada con disolventes Dionex ASE 200. En ella, la muestra es colocada en una celda de acero inoxidable, calentada a temperaturas entre 50°C y 200°C y presurizada con el objetivo de que los solventes apropiados permanezcan en estado líquido. Sus ventajas respecto a otras técnicas convencionales, como la extracción Soxhlet, son mayor rapidez y menor consumo de disolventes, pero manteniendo recuperaciones muy similares (Kreisselmeier y Werner-Dürbeck, 1997; Bandh et al., 2000; Hubert et al., 2000).
Todos los disolventes utilizados fueron grado pesticida (n-hexano, acetona, diclorometano), suministrados por Merck, o grado HPLC (metanol, trietilamina y acetonitrilo), suministrados por Scharlau. El agua fue de calidad Milli-Q, y el ácido acético y el sulfato de sodio anhidro fueron suministrados por Panreac.
Se tomaron 2.5 g de muestra, homogeneizándolos con sulfato de sodio anhidro. En el caso de la extracción de tensioactivos se utilizó una mezcla metanol/acetona (1:1) a 50°C de temperatura y 1500 psi de presión durante 15 min, mientras que para el caso de los POPs las condiciones fueron de 100°C a 1500 psi durante 15 min y empleando n-hexano/ diclorometano (1:1). El volumen obtenido en ambos casos, unos 20 mL, fue evaporado hasta 1 mL aproximadamente.
Posteriormente se llevó a cabo la preconcentración y purificación de los extractos obtenidos mediante extracción en fase sólida (SPE). Para ello se redisolvió el extracto correspondiente a los tensioactivos en 100 mL de agua Milli-Q, los cuales cuales fueron pasados a través de cartuchos LiChrolute C18 500 mg (Merck), previamente acondicionados con 7 mL de metanol y 3 mL de agua y eluidos con 8 mL de metanol, todo ello usando un sistema automatizado de SPE (ASPEC XL). El extracto resultante fue evaporado con una corriente de nitrógeno hasta secarlo y luego redisuelto a 1 mL de metanol con 50 µM de acetato de sodio. Se añadió C16-LAS como patrón interno.
En el caso de los POPs, el extracto resultante fue pasado a través de un cartucho Sep-Pak Alúmina N 2 g (Waters) previamente acondicionado con 15 mL de hexano/diclorometano (19:1) y extraido en dos fracciones (20 mL de hexano/dicloro-metano en proporciones 19:1 y 1:2) unidas finalmente en una. Ésta se evaporó hasta 1 mL de nuevo y de allí hasta estar seca mediante corriente de nitrógeno, redisolviendo a 150 mL en acetato de etilo. Se añadió antraceno deuterado como patrón interno, y pireno, perileno y benzoperileno deuterados como patrones para cuantificar la eficiencia de recuperación del método analítico.
La eficiencia del proceso de extracción fue determinada mediante el dopado de sedimentos con los contaminantes a analizar, obteniéndose valores de recuperación entre 60% y 105%, con desviaciones estándares inferiores al 5%.
Cuantificación
La cuantificación de los compuestos se realizó por espectrometría de masas, bien acoplada a un cromatógrafo de líquidos (LC/MS) en el caso de los tensioactivos o de gases (GC/MS) en el de los POPs. En todos los casos, ésta se llevó a cabo en modo SIM (selected ion monitoring) tras realizar un barrido completo (full-scan), empleando rectas de calibrado con cinco puntos y r2 > 0.99. El límite de detección fue calculado usando una relación señal-ruido de 3:1, estando comprendido en el rango entre 0.1 y 1 ng g-1 para cada uno de los compuestos estudiados. Los estándares empleados en la calibración y dopados fueron suministrados por Dr. Ehrenstorfer para el caso de los PAHs (acenafteno, acenafti-leno, antraceno, benzo(a)antraceno, benzo(b)fluoranteno, benzo(k)fluroanteno, benzo(g,h,i)perileno, benzo(a)pireno, criseno, dibenzo(a,h)antraceno, fluoranteno, fluoreno, indeno(1,2,3-c,d)pireno, naftaleno, fenantreno y pireno) y organoclorados (aldrín, cis-clordano, trans-clordano, oxiclordano, 2,4'-DDD, 4,4'-DDD, 2,4'-DDE, 4,4'-DDE, 2,4'-DDT, 4,4'-DDT, dieldrín, α-endosulfán, β-endosulfán, endrín, α-HCH, β-HCH, γ-HCH, δ-HCH, ε-HCH, heptacloro, heptacloro epóxido, hexaclorobenceno, isodrín, metoxycloro, mirex, 2,4,4'-triclorobifenilo, 2,2',5,5'-tetraclorobifenilo, 2,2',4,5,5'-pentaclorobifenilo, 2,2',3,4,4',5'-hexaclorobifenilo, 2,2',4,4',5,5'-hexaclorobifenilo y 2,2',3,4,4',5,5'-heptaclorobifenilo). El LAS comercial (C10-LAS 12.2%, C11-LAS 38.0%, C12-LAS 25.3% y C13-LAS 22.9%) fue suministrado por Petroquímica Española S.A. (PETRESA) y los NPEOs por Kao Corp.
La determinación de tensioactivos fue realizada inyectando 25 µL de muestra en un cromatógrafo de líquidos HP 1090 A LC con inyector automático HP 1100 acoplado a un detector de diodos UV-visible HP 1040 M, y a un espectrómetro de masas LC-MSD HP 1100 para el caso de los NPEOs. Para el caso del LAS se usó un cromatógrafo de líquidos acoplado a un espectrómetro de masas LC-MS Finnigan LCQ. Ambos equipos disponen de una interfase de electrospray (ESI) y una fuente de ionización atmosférica (API). Los NPEOs fueron determinados mediante ionización positiva de los iones m/z 287 y 331 correspondientes al [M + Na]+ del NP1EO y NP2EO, respectivamente, mientras que el LAS (m/z 297, 311, 325 y 339 para los homólogos C10, C11, C12 y C13 LAS, respectivamente) lo fue por ionización negativa. Otras características del análisis son presentadas en la tabla 2.

Para cuantificar los POPs se empleó un cromatógrafo de gases con inyector automático acoplado a un espectrómetro de masas Voyager MS ThermoQuest, inyectándose 2 mL de muestra en modo splitless a 1 min. Se usó impacto electrónico (EI), con 350 V en el detector, 200°C en la fuente y 250°C en la interfase, para todos los compuestos, los cuales fueron determinados en un mismo cromatograma usando la rampa de temperatura: de 60°C (1 min) a 175°C (4 min) a 6°C min-1, de 175°C a 240°C (5 min) a 3°C min-1, y de 240°C a 300°C (3 min) a 7°C min-1. Se empleó helio como gas portador a razón de 1mL min-1.
Resultados y discusión
En la tabla 3 se muestran las concentraciones totales de los compuestos encontrados en los sedimentos superficiales de cada una de las zonas de muestreo. Las mayores diferencias se observan para el LAS, cuya concentración en una zona a 20 m del vertido de aguas residuales urbanas sin depurar (Caño de Sancti Petri) supera los 80 mg kg-1. Estos resultados concuerdan con el amplio uso de este tensioactivo en la formulación de detergentes de uso doméstico. Los valores de los NPEOs en esta zona son también superiores, así como los de PAHs, cuya presencia ya ha sido descrita previamente en vertidos de estas características (Marcomini et al., 1987). Sin embargo, los niveles de DDT son ligeramente superiores en la zona del Río Guadalete, lo que guarda relación con la existencia de vertidos de origen agrícola en su cauce. La relación LAS/NPEOs es inferior en esta zona con respecto a la del Caño de Sancti Petri (16.4 frente a 79.5 respectivamente), lo que denota la influencia de los vertidos industriales. Por último, los valores de los PCBs son similares y están en concordancia con los resultados obtenidos por otros autores en sistemas costeros (Eganhouse et al., 2000).

La variación de la concentración de tensioactivos con la profundidad en la zona del Caño de Sancti Petri se muestra en la figura 2. En los primeros centímetros se observan las máximas concentraciones de LAS (120 mg kg-1) y de NPEOs (800 ng g-1) como cabría esperar teniendo en cuenta el carácter hidrófobo de los tensioactivos y, por tanto, su afinidad por la fase sólida una vez que son vertidos al medio. En el caso del LAS (fig. 2a), se observa un acusado descenso con la profundidad (como consecuencia de su biodegradación y del aumento de su consumo) hasta aproximadamente unos 10 cm, a partir de los cuales la concentración aumenta para finalmente descender y desaparecer. Este segundo máximo podría obedecer al aporte puntual de material de dragado procedente de una zona adyacente donde se construyó un puente, y que condujo a condiciones anaerobias bajo las cuales la degradación del tensioactivo no se produce o es muy lenta (Federle y Schwab, 1992; Larson et al., 1993). Este hecho queda reflejado también en los perfiles de porosidad e índice C/N (datos no mostrados), en los que se observan irregularidades entre 10 y 15 cm, en la zona correspondiente al segundo máximo de tensioactivos. Para el caso de los NPEOs (fig. 2b), aunque las concentraciones son inferiores y el descenso menos acusado, el perfil es muy similar al que presenta el LAS.
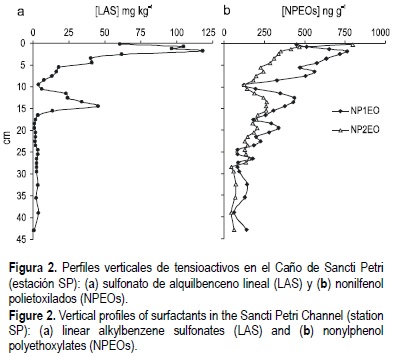
En cuanto a la distribución de los diferentes homólogos del LAS se observa que los que presentan mayor concentración son los de cadena más larga, esto es C13-LAS > C12-LAS > C11-LAS > C10-LAS, como consecuencia de su mayor carácter hidrófobo (mayor Kow) (González-Mazo et al., 1998). Para el caso de los nonilfenoles no se pueden formular conclusiones significativas como en el caso anterior, teniendo en cuenta que la presencia del NP1EO no es tan sólo debida a su porcentaje en el producto comercial sino también a la degradación del NP2EO (Talmage, 1994).
La variación de la concentración de los POPs con la profundidad del sedimento se muestra en la figura 3. En el caso del DDT (fig. 3a) y de sus intermedios de degradación (DDD y DDE), las concentraciones son varios órdenes de magnitud inferiores a los tensioactivos debido al origen urbano del vertido en la zona. Los intermedios de degradación presentan concentraciones superiores al compuesto original (45.7 y 37.8 µg kg-1 para DDD y DDE, respectivamente) y ponen de manifiesto la existencia de la degradación del DDT en los sedimentos. Al estar en mucho menor porcentaje en la formulación del pesticida original (un 20% frente al 70% del p,p '-DDT), ser menos tóxico, y más soluble y susceptible de degradación, no ha sido detectado el o,p '-DDT, al igual que ha ocurrido con los isómeros o,p' del DDD y DDE con respecto a los p,p'. Sus intermedios de degradación, en cambio, sí que alcanzan concentraciones más elevadas, especialmente desde los 15 cm hasta la superficie, con máximos de casi 50 ng g-1 en el caso del p,p'-DDD, el más abundante. Esto indica que se está llevando a cabo la degradación del pesticida original fundamentalmente por vía anaerobia (decloración reductiva), ya que en condiciones oxidantes se favorecería la formación de DDE (Aislabie et al., 1997). Similares casos han sido investigados por otros autores en zonas como las lagunas costeras de Chiapas (Botello et al., 2000), o la de Venecia (Pavoni et al., 1987), si bien la proporción PCBs/DDX era superior a 10 en esta última, indicando un claro origen industrial de la contaminación. En el caso del presente estudio este índice apenas llegó a 6, lo que junto con la presencia de máximos de DDX en los sedimentos más recientes a pesar de su prohibición hace unas décadas, pone de manifiesto que su concentración está controlada principalmente por la escorrentía desde campos agrícolas donde fue utilizado hace tiempo y por los procesos de resuspensión de otros depósitos sedimentarios marinos y fluviales (Santschi et al., 2001). No se han detectado otros pesticidas organoclorados, o bien han estado presentes en concentraciones muy bajas (inferiores a 1 ppb de hexaclorobenceno, o de 10 ppb de aldrina).
La distribución de la concentración de los PCBs y PAHs (fig. 3b, c), presentada como la suma de los diversos PCBs y PAHs analizados, es similar, apreciándose un máximo entre 25 y 30 cm de profundidad (28.3 µg kg-1 y 6.5 mg kg-1, respectivamente) que denota la persistencia de ambas familias de compuestos. Tanto en este punto como en el resto del perfil se observa la predominancia del pireno, fluoranteno, benzo(6)fluoranteno y benzo(k)fluoranteno respecto a los demás PAHs. En el caso de los PCBs se aprecia el predominio de los congéneres 138, 153 y 180, aquellos con mayor número de cloros (6 y 7), siendo menor la concentración de aquellos que contienen menor número (máximos inferiores a 5 ng g-1 para el PCB 101, con 5 cloros, y el PCB 52, con 4 cloros) por su mayor facilidad para ser degradados (de hecho, el PCB 28, con 3 cloros, no es detectado) y tendencia a volatilizarse. En general, el perfil de ambos con la profundidad es similar al obtenido por diferentes autores en otras zonas costeras (Pavoni et al., 1987; Eganhouse et al., 2000). La existencia de estos niveles puede ser explicada teniendo en cuenta el origen industrial de los PCBs, así como el origen antropogénico de los PAHs (quema incompleta de combustibles fósiles y aceites). Sin embargo, la coincidencia en la profundidad de ambos máximos podría ser debida al intenso tráfico marítimo que soportaba esta zona hace 30 años y que fue descendiendo paulatinamente hasta quedar reducido a embarcaciones de muy pequeño calado en la actualidad. El descenso drástico hacia la superficie es a su vez motivado por la prohibición de su vertido, como corroboran otros autores en zonas marinas con circulación restringida y similares concentraciones como Venecia (Pavoni et al., 1987), Tokio (Yao et al., 2002) y el Mississippi (Santschi et al., 2001).
En conclusión, en este artículo ha sido presentada por primera vez la distribución de contaminantes orgánicos en dos puntos de la Bahía de Cádiz. El uso de nuevas técnicas como la extracción acelerada con disolventes (ASE) permite la obtención de resultados de manera rápida y confiable. Las concentraciones detectadas reflejan claramente el diferente grado de contaminación que presentan las dos zonas analizadas. La naturaleza y las relaciones entre los distintos contaminantes como LAS, NPEOs, DDT, PCBs y PAHs permiten determinar el origen de la contaminación. Asimismo, su estudio a lo largo de la columna sedimentaria es una herramienta útil en el seguimiento de la evolución de la contaminación histórica en una zona y las posibles rutas degradativas de los diversos contaminantes, así como su persistencia.
Agradecimientos
Agradecemos a Antonio Rivera-Valdés, Israel Gude-Ramírez y Oscar Mansilla su colaboración en la toma de muestras. El trabajo fue realizado como parte del proyecto REN2001-2980-C02-01/HID, financiado por la Comisión Interministerial de Ciencia y Tecnología de España (CICYT).
Referencias
Aislabie, J.M., Richards, N.K. and Boul, H.L. (1997). Microbial degradation of DDT and its residues: A review. New Zealand J. Agric. Res., 40: 269-282. [ Links ]
Bandh, C., Björklund, E., Mathiasson, L., Näf, C. and Zebürh, Y. (2000). Comparison of accelerated solvent extraction and Soxhlet extraction for the determination of PCBs in Baltic Sea sediments. Environ. Sci. Technol., 34: 4995-5000. [ Links ]
Bennett, E.R. and Metcalfe, C.D. (1998). Distribution of alkylphenol compounds in Great Lakes sediments, United States and Canada. Environ. Toxicol. Chem., 17(7): 1230-1235. [ Links ]
Botello, A.V., Rueda-Quintana, L., Díaz-González, G. and Toledo, A. (2000). Persistent organochlorine pesticides (POPs) in coastal lagoons of the subtropical Mexican Pacific. Bull. Environ. Contam. Toxicol., 64: 390-397. [ Links ]
Camacho-Ibar, V.F. and McEvoy, J. (1996). Total PCBs in Liverpool Bay sediments. Mar. Environ. Res., 41(3): 241-263. [ Links ]
Domagalski, J.L. and Kuivila, K.M. (1993). Distribution of pesticides and organic contaminants between water and suspended sediment, San Francisco Bay, California. Estuaries, 16(3A): 416-426. [ Links ]
Eganhouse, R.P. and Sherblom, P.M. (2001). Anthropogenic organic contaminants in the effluent of a combined sewer overflow: Impact on Boston Harbor. Mar. Environ. Res., 51: 51-74. [ Links ]
Eganhouse, R.P., Pontolillo, J. and Leiker, T.J. (2000). Diagenetic fate of organic contaminants on the Palos Verdes Shelf, California. Mar. Chem., 70: 829-315. [ Links ]
Federle, T.W. and Schwab, B.S. (1992). Mineralization of surfactants in anaerobic sediments of a laundromat wastewater pond. Water Res., 26(1): 123-127. [ Links ]
Fernández, P., Vilanova, R.M., Martínez, C., Appleby, P. and Grimalt, J.O. (2000). The historical record of atmospheric pyrolytic pollution over Europe registered in the sedimentary PAH from remote mountain lakes. Environ. Sci. Technol., 34: 1906-1913. [ Links ]
González-Mazo, E., Forja, J.M. and Gómez-Parra, A. (1998). Fate and distribution of linear alkylbenzene sulfonates in the littoral environment. Environ. Sci. Technol., 32(11): 1636-1641. [ Links ]
Hubert, A., Klaus-Dieter, W., Manz, M., Weissflog, L., Engewald, W. and Schüürmann, G. (2000). High extraction efficiency for POPs in real contaminated soil samples using accelerated solvent extraction. Anal. Chem., 72: 1294-1300. [ Links ]
Kawamura, K. and Kaplan, I.R. (1986). Biogenic and anthropogenic organic compounds in rain and snow samples collected in southern California. Atmos. Environ., 20: 114-124. [ Links ]
Kreisselmeier, A. and Werner-Dürbeck, H. (1997). Determination of alkylphenols, alkylphenolethoxylates and linear alkylbenzenesul-fonates in sediments by accelerated solvent extraction and supercritical fluid extraction. J. Chromatogr. A, 775: 187-196. [ Links ]
Larson, R.J., Rothgeb, T.M., Shimp, R.J., Ward, T.E. and Ventullo, R.M. (1993). Kinetic and practical significance of biodegradation of linear alkylbenzene sulfonates in the environment. J. Am. Oil Chem. Soc., 70(7): 645-657. [ Links ]
León, V.M., González-Mazo, E., Forja-Pajares, J.M. and Gómez-Parra, A. (2001). Vertical distribution profiles of linear alkylbenzene sulfonates and their long-chain intermediate degradation products in coastal marine sediments. Environ. Toxicol. Chem., 20(10): 2171-2178. [ Links ]
Marcomini, A., Capri, S. and Giger, W. (1987). Determination of linear alkylbenzenesulfonates, alkylphenol polyethoxylates and nonylphenol in waste water by high-performance liquid chromatography after enrichment on octadecylsilica. J. Chromatogr., 403: 243-252. [ Links ]
Pavoni, B., Sfriso, A. and Marcomini, A. (1987). Concentration and flux profiles of PCBs, DDTs and PAHs in a dated sediment core from the lagoon of Venice. Mar. Chem., 21: 25-35. [ Links ]
Petrovic, M., Rodríguez-Fernández-Alba, A., Borrull, F., Marce, R.M., González-Mazo, E. and Barceló, D. (2002). Occurrence and distribution of noionic surfactants, their degradation products, and linear alkylbenzene sulfonates in coastal waters and sediments in Spain. Environ. Toxicol. Chem., 21(1): 37-46. [ Links ]
Preston, M.R. and Raymundo, C. (1991). The distribution of linear alkylbenzenes in coastal and estuarine sediments of the western North Sea. Mar. Pollut. Bull., 24(3): 138-146. [ Links ]
Santschi, P.H., Presley, B.J., Wade, T.L., García-Romero, B. and Baskaran, M. (2001). Historical contamination of PAHs, PCBs, DDTs, and heavy metals in Mississippi River Delta, Galveston Bay and Tampa Bay sediment cores. Mar. Environ. Res., 52: 51-79. [ Links ]
Simoneit, B.R. (1989). Organic matter of the troposphere. V. Application of molecular marker analysis to biogenic emissions into the troposphere for source reconciliations. J. Atmos. Chem., 8: 251-275. [ Links ]
Sonnenschein, C. and Soto, A.M. (1998). An updated review of environmental estrogen and androgen mimics and antagonists. J. Steroid Biochem. Mol. Biol., 65: 143-50. [ Links ]
Stapleton, H.M., Masterson, C., Skubinna, J., Ostrom, P., Ostrom, N.E. and Baker, J.E. (2001). Accumulation of atmospheric and sedimentary PCBs and Toxaphene in a Lake Michigan food web. Environ. Sci. Technol., 35: 3287-3293. [ Links ]
Takada, H., Ogura, N. and Ishiwatari R. (1992). Distribution of linear alkylbenzenes (LABs) and linear alkylbenzenesulfonates (LAS) in Tokyo Bay sediments. Estuar. Coast. Shelf Sci., 35: 141-156. [ Links ]
Talmage, S.S. (1994). Environmental and Human Safety of Major Surfactants. Alcohol ethoxylates and alkylphenol ethoxylates. The Soap and Detergent Association. [ Links ]
Yao, Y., Masunaga, S., Takada, H. and Nakanishi, J. (2002). Identification of polychlorinated dibenzo-p-dioxin, dibenzofuran, and coplanar polychlorinated biphenyl sources in Tokyo Bay, Japan. Environ. Toxicol. Chem., 21(5): 991-998. [ Links ]














