Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.31 no.1a Ensenada mar. 2005
Artículos
Ciclo reproductivo de Geukensia demissa (Bivalvia: Mytilidae) en la playa de Nazaret, El Moján, Estado Zulia, Venezuela
Reproductive cycle of Geukensia demissa (Bivalvia: Mytilidae) on a beach at Nazaret, El Moján, Zulia State, Venezuela
María Báez1, Yajaira García de Severeyn1 y Héctor Severeyn2
1 Laboratorio de Cultivo de Invertebrados Acuáticos.
2 Laboratorio de Sistemática de Invertebrados Acuáticos Departamento de Biología Facultad de Ciencias Universidad del Zulia Maracaibo, Estado Zulia, Venezuela.
Recibido en enero de 2004;
aceptado en agosto de 2004.
Resumen
Geukensia demissa es un mitílido que invadió el estuario del Lago de Maracaibo. De este mejillón, por ser una especie nueva en el lago, se desconocen todos los aspectos relacionados con su biología reproductiva, por lo que en este trabajó se describió el ciclo reproductivo de este molusco bivalvo, a partir de una población ubicada en el Estrecho del Lago de Maracaibo (Nazaret). Durante 12 meses (enero a diciembre) fueron recolectados 80 animales en la playa de Nazaret, sector El Moján. A cada animal se le realizó una disección, tomando muestras del fluido gonadal que posteriormente se observaron al microscopio para determinar la presencia y el estado de madurez de los gametos. Los diferentes estados de desarrollo gametogénico fueron tomados de la clasificación descrita por Shafee (1989). El índice gonadal se calculó mediante la ecuación IG = ∑ (n x V)/N. Los resultados mostraron que esta especie tiene un ciclo reproductivo continuo, presentando ejemplares maduros y desovados durante todo el año. Se observaron dos procesos gametogénicos: el primero comenzó en la época seca y se extendió hasta el comienzo de la época lluviosa, cuando los gametos alcanzaron su máxima madurez; el segundo comenzó en la época lluviosa (septiembre) y se extendió hasta finales de noviembre cuando los gametos volvieron a estar maduros. Se observaron dos picos de desove, uno en el mes de julio y el otro a finales de diciembre. No se observó 100% de desove en la población. Se pudo apreciar sincronía en la madurez y el desove tanto en las hembras como en los machos.
Palabras clave: Geukensia demissa, mejillón, ciclo reproductivo, Venezuela.
Abstrat
The mytilid Geukensia demissa invaded Lake Maracaibo and since it is a new species at this location, little is known about its reproductive biology. We describe the reproductive cycle of this bivalve mollusk on a beach (Nazaret) located along the straight that leads into Lake Maracaibo. During 12 months (January to December), 80 specimens were collected monthly from this beach. The animals were dissected and samples of their gonadal fluid were microscopically examined to detect gametes. The different stages of gonadal development are described according to Shafee, (1989). The gonad index was calculated by the equation IG = ∑ (n x V)/N. Results indicated that G. demissa presents a continuous reproductive cycle, with mature, spawning animals occurring throughout the year. Two gametogenic processes occurred, one beginning during the dry season and extending until the onset of the rainy season, and another beginning during the rainy season and extending until late November, when the animals are once again mature. Two spawning peaks were observed, one in July and the other in December; 100% spawning in the population was not observed. Synchrony was found in spawning and maturation in both male and female mussels.
Key words: Geukensia demissa, mussel, reproductive cycle, Venezuela.
Introducción
Geukensia demissa (Dillwyn, 1817) es un mejillón abundante en los niveles más bajos de las playas, especialmente en las orillas de sistemas estuarinos o pantanosos. Las poblaciones de este mejillón han sido reportadas desde el Golfo de San Lorenzo (Canadá) hasta el noreste de la Florida donde es abundante en lagos salobres y estuarinos. También se ha observado en zonas pantanosas del Atlántico medio, y se encuentra especialmente distribuido en Carolina del Norte, donde vive enterrado en el fango. Se introdujo en la Bahía de San Francisco, California, en la década de los ochenta (Fox, 1994; Rehder, 1998).
En Venezuela este mejillón se introdujo en el Sistema del Lago de Maracaibo aproximadamente en 1994 y se ha venido distribuyendo y extendiendo rápidamente por toda la zona noroccidental del Estrecho del Lago de Maracaibo. Después de haber sido encontrado en los bancos de La Rosita, se ha detectado también en pequeños parches en El Moján (Nazaret), los Coquitos y en el Refugio de Fauna Silvestre Los Olivitos en el Estado Zulia. En Venezuela ha ampliado su rango de distribución hasta el Caribe (Romero et al., 1996, 2002).
La información disponible sobre G. demissa en zonas tropicales es escasa y se refiere principalmente a su distribución y taxonomia. La mayoría de los estudios realizados en esta especie son de zonas templadas, enfocados a crecimiento y ecología pero pocos dedicados a establecer su ciclo reproductivo o aspectos relacionados con éste. Uno de estos pocos trabajos fue realizado por Brousseau (1982), quien describió la gametogénesis y el desove en una población de G. demissa en Westport, Connecticut. Posteriormente, Borrero (1987) comparó los ciclos reproductivos de poblaciones de G. demissa, que ocupan diferentes niveles de marea en el mismo hábitat estuarino en Carolina del Norte (EUA), y finalmente Franz (1996) trabajó con el tamaño y edad de primera reproducción de G. demissa, en dos niveles de marea en un estuario de New Cork (EUA).
El objetivo de este trabajo fue estudiar el ciclo reproductivo de G. demissa en la playa de Nazaret, Estado Zulia, Maracaibo, Venezuela, y compararlo con los estudios realizados en aguas más septentrionales.
Materiales y métodos
Durante un periodo de 12 meses (enero a diciembre) se recolectaron mensualmente 80 animales. Éstos fueron extraidos manualmente y al azar de un banco natural en la población de Nazaret, sector El Moján (10°55" N, 71°45 W), Estado Zulia, Venezuela (fig. 1), midiendo además en el lugar de recolecta los parámetros fisicoquímicos salinidad y temperatura, con un salinómetro refractómetro y un termómetro, respectivamente.

A cada animal se le realizó una disección, tomando muestras de fluido gonádico que posteriormente se observaron al microscopio para determinar la presencia y el estado de madurez de los gametos. Los diferentes estados de desarrollo gametogénico fueron tomados de la clasificación descrita por Shafee (1989). Estos estados se definen de la siguiente manera:
Estado de reposo (REP)
El sexo es indeterminado y no se observan folículos, ni en el tejido de la gónada ni en el del manto. Los canales genitales se observan confusos debido al tejido conectivo densamente empaquetado.
Desarrollo temprano (D.TEM)
Se hacen aparentes los primeros signos de gametogénesis, además se observan pequeños grupos de células germinales dentro de los folículos, los cuales pueden apreciarse alargados y empaquetados.
Desarrollo tardío (D. TAR)
Los folículos, tanto en machos como en hembras, ocupan gran parte del tejido gonádico y del manto. En los machos los folículos ocupan amplias bandas donde se pueden observar las espermátidas y los espermatozoides. En las hembras, los óvulos se observan alargados y adheridos a la pared folicular por un delgado pedúnculo de citoplasma, pero también se observan algunos óvulos maduros libres en el lúmen folicular.
Morfológicamente maduro (M.M)
En los machos se aprecian los folículos empaquetados y ocupando toda el área del tejido gonadal y del manto con espermatozoides ordenados y convergiendo hacia el centro del lúmen, pero también se pueden observar algunos espermatocitos y espermátidas. En las hembras, la mayoría de los óvulos alcanzaron su máximo tamaño y se observan estrechamente empaquetados dentro de los folículos.
Desovado (DES)
En las hembras se hacen visibles gran número de óvulos maduros expandidos en los folículos; en los machos se pueden apreciar densas bandas de espermatozoides maduros, el lumen se observa parcialmente empaquetado pero su arreglo en lamelas no desaparece.
Postdesove (P.DES)
Los folículos se colapsan y degeneran. Los amebocitos atacan los gametos y se observan células de desecho celular. El índice gonádico se calculó mediante la ecuación:

donde IG = índice gonádico, n = número de mejillones en cada estado, V = valor numérico del estado y N = tamaño de la muestra.
Los valores numéricos de cada estadio se definieron según Shafee (1989) de la siguiente manera: estado de reposo = 0; desarrollo temprano = 1; desarrollo tardío = 2; morfológicamente maduro = 3; desovado = 2; postdesove = 1.
Finalmente se aplicó un análisis de regresión lineal simple que permitió obtener la ecuación que predice la influencia de la salinidad sobre el índice gonádico.
Resultados
La tabla 1 muestra la distribución temporal de los estados de madurez gonádica del ciclo reproductivo de G. demissa para machos y hembras. Se pudo apreciar sincronía en la madurez y el desove de machos y hembras al presentar los mayores porcentajes de madurez en junio (35% para machos y 19% para hembras) y noviembre (43% para cada sexo). En cuanto al porcentaje de desove, se observó un pico en julio (19% para machos y 21% en hembras) y otro en diciembre (40% y 29%, respectivamente). La tabla 2 muestra los estados de desarrollo gonadal de G. demissa. Allí se observa el mayor porcentaje de organismos en desarrollo temprano encontrado en marzo y abril (71% y 47%, respectivamente). Se observó desarrollo tardío en casi todos los meses, pero su mayor porcentaje ocurrió en abril (34%). Se observaron organismos en etapa de madurez durante todo el año, pero los picos de madurez ocurrieron en junio y noviembre (54% y 86%, respectivamente).
Se registraron bajos porcentajes de desove que ocurrieron durante casi todo el año aunque se observaron dos picos, uno al principio de la época lluviosa (julio, 40%) y otro al inicio de la época seca (diciembre, 69%). El estado de postdesove se observó mayormente en los meses de enero y febrero (50% y 59%, respectivamente) y el estado de reposo se observó durante todo el año en porcentajes variables.
Por otro lado, se puede apreciar cómo la gametogénesis comenzó en enero y se extendió hasta finales de mayo, cuando los organismos alcanzan la máxima madurez para luego desovar entre los meses de junio y julio. Luego tuvo lugar un nuevo y rápido proceso gametogénico y los animales volvieron a estar maduros en los meses de octubre y noviembre para volver a desovar en diciembre.
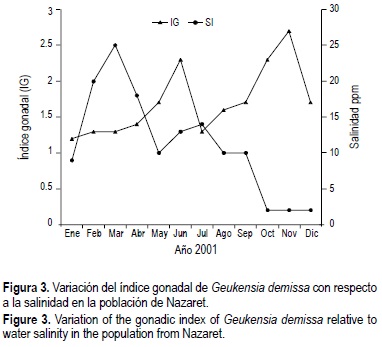
Las figuras 2 y 3 muestran la relación entre el índice gonadal, los desoves y los cambios de salinidad. El análisis de regresión demuestra que la relación es estadísticamente significativa (fig. 2).

Discusión
El ciclo gametogénico de los moluscos es en general anual, pero el periodo, la duración e incluso el número de ciclos, varían en el ámbito de la especie, de población a población y para cada zona (Bussani, 1983; Bautista, 1989). Los resultados del presente estudio muestran que G. demissa presenta ejemplares maduros y desovados durante casi todo el año. Esto coincide con lo informado por Ruiz et al. (1998) quienes señalan que los moluscos bivalvos en las zonas tropicales se caracterizan por tener desoves prolongados y procesos gametogénicos continuos, en contraste con los moluscos bivalvos de zonas templadas. Durante este estudio se observaron dos procesos gametogénicos, uno de menor intensidad en el que los organismos alcanzaron el mayor porcentaje de madurez al inicio de la época de lluvia (mayo a junio) y otro de mayor intensidad al inicio de la época seca (octubre a noviembre). Esta diferencia entre los dos procesos de gametogénesis sugiere que el comportamiento reproductivo de la especie es el resultado de la interacción de los factores ambientales ocurridos en el estuario del Lago de Maracaibo, principalmente la salinidad, la cual regula el patrón de maduración y desove de tal manera que modula el incremento en el número de hembras desovantes, coincidiendo con el mayor pico de desove en esta población. Esto se puede apreciar en la figura 2, donde el análisis de regresión demuestra que existe una relación significativa entre el índice gonádico y la salinidad.
Geukensia demissa es una especie originaria de zonas templadas subtropicales donde ocurren todas las estaciones del año y donde los cambios de temperatura, principalmente entre una estación y otra, son tan marcados que inducen en los organismos respuestas en su ciclo reproductivo. Los organismos que habitan en sistemas tropicales, donde sólo se dan dos estaciones en el año, se comportan de manera distinta. Según Cáceres y Figueras (1998) los mejillones, aun siendo de la misma especie, pero localizados en condiciones ambientales diferentes, presentan diferencias entre sus ciclos reproductivos y éstas pueden ser atribuidas a muchos factores, siendo los más importantes la temperatura, la salinidad, el fotoperiodo y el alimento, y en segundo lugar la reserva de nutrientes, los ciclos hormonales y el genotipo. La figura 3 muestra la variación del índice gonadal con respecto a la salinidad en la zona de estudio. En ella se puede apreciar que los descensos en el índice gonadal, los cuales implican la presencia de desoves, coinciden con los inicios de la época lluviosa (julio) y la época seca (diciembre). Esto sugiere que cambios drásticos en la salinidad inducen el desove y la actividad reproductiva, la cual se ve favorecida en condiciones de baja salinidad.
Estos resultados son similares a los obtenidos por Puyana (1995) para Mytilopsis sallei en el Caribe colombiano, quien señala que esta especie mostró dos picos de desove, uno entre octubre y noviembre y otro entre marzo y abril, coincidiendo con los descensos en la salinidad. De forma similar, Crassostrea rhizophorae en las costas venezolanas se reproduce a lo largo del año, pero presenta dos picos de desove cuando hay variaciones marcadas en la salinidad relacionadas con la época de lluvia (Vélez, 1976). Otras especies estuarinas tropicales como los venéridos Anomalocardia brasiliana (Gotta, 1980), Meretriz meretriz, M. casta y Katelysia pina (Jayabal and Kalvani, 1986) y árcidos como Anadara spp. (Natajaram, 1983; Broom, 1985) (citados por Puyana, 1995) tienen periodos reproductivos bastante largos, pero presentan picos de desove asociados con cambios de salinidad. Algo similar observó Urban (2000) en Pinctada imbricata, en Cabo de la Vela en las costas caribeñas, donde se observaron dos picos de desove principales, uno en junio y otro en octubre. En el caso concreto de G. demissa nuestros resultados difieren de los observados por Brousseau (1982) en Westport, Connecticut (EUA), quien observó un solo periodo de desove al año desde junio hasta agosto, relacionado con los cambios de temperatura. Otras especies de distribución subtropical como Perna picta (Shafee, 1989) en las costas Atlánticas de Marruecos, y Tapes decussatus (Rodríguez y Arnaiz 1998) en España, también presentan un periodo único de desove, desde marzo hasta junio. Los resultados obtenidos en G. demissa en esta investigación parecen demostrar que las poblaciones ubicadas en aguas tropicales tienen una estrategia reproductiva distinta a la encontrada en aguas templadas, como es el caso también de la almeja estuarina Polymesoda caroliniana, (Courtney, 1983).
Según Bautista (1989), la temperatura es uno de los factores principales que intervienen en el ciclo reproductivo; sin embargo, durante este estudio este parámetro no sufrió variaciones bruscas o notables a lo largo del año de estudio (28-35°C), contrario al caso de la salinidad que tuvo caídas bruscas evidentes. Aunque la variación observada en la temperatura parecería amplia, ésta sólo refleja el efecto de los cambios diarios ya que la actividad de campo se realizó a distintas horas del día. A este respecto la condición importante del muestreo era recolectar G. demissa en marea baja. Así, valores de 28°C indican la temperatura mínima anual del agua, temprano en la mañana, y valores de 35° corresponden a la máxima de temperatura anual que se observó alrededor de las 2:00 pm.
Otras especies de bivalvos que viven en el Sistema de Maracaibo, como Polymesoda solida (García de Severeyn et al., 1994) y Tivela mactroides (Severeyn et al., 1996), ambas asociadas con ambientes estuarinos, coinciden en la estrategia reproductiva detectada para G. demissa, confirmando que al menos en este sistema ecológico, los moluscos bivalvos que allí viven o los que logran introducirse, desarrollan estrategias reproductivas similares influenciadas principalmente por las variaciones predominates en las condiciones de salinidad. Geukensia demissa, a pesar de estar presente en el Lago de Maracaibo debido a una introducción accidental (probablemente en el casco o agua de lastre de un barco carguero o en las patas de un ave migratoria), para poder sobrevivir en allí tuvo que adaptarse desarrollando una estrategia reproductiva distinta a la usada en su ecosistema subtropical de origen.
Referencias
Bautista, C. (1989). Tecnología de los Moluscos. Ediciones Mundi Prensa, Madrid, España, 166 pp. [ Links ]
Borrero, F. (1987). Tidal height and gametogenesis: Reproductive variation among populations of Geukensia demissa. Biol. Bull., 173: 160-168. [ Links ]
Brousseau, D. (1982). Gametogenesis and spawning in a population of Geukensia demissa (Pelecypoda: Mytilidae) from Westport Connecticut. Veliger, 24(3): 247-251. [ Links ]
Bussani, M. (1983). Guía Práctica del Cultivo del Mejillón. Editorial Acribia, Zaragoza, España, 252 pp. [ Links ]
Cáceres, J. and Figueras, A. (1998). Long-term survey on wild and cultured mussels (Mytilus galloprovincialis LmK) reproductive cycles in the Ría de Vigo (NW Spain). Aquaculture, 162: 141-156. [ Links ]
Courtney, H. (1983). A note on the reproductive season of the Carolina marsh clam Polymesoda caroliniana (BOSC) in an irregularly flooded Mississippi Marsh. Gulf Res. Rep., 41(3): 281-284. [ Links ]
Franz, D. (1996). Size and age at first reproduction of the ribbed mussel marsh. J. Exp. Mar. Biol. Ecol., 205: 1-13. [ Links ]
Fox, R. (1994). http://www.lander.edu/rsfox/geukensi.html. [ Links ]
García de Severeyn, Y., Severeyn, H. and Ewald, J. (1994). Early development of the estuarine clam, Polymesoda solida (Bivalvia: Corbiculidae), in Lake Maracaibo, Venezuela. Bull. Am. Malacal. Union, 11: 56-62 . [ Links ]
Jayabal, R. and Kalyani, N. (1986). Reproductive cycle of some bivalves from Vellar Estuary, east coast of India. Indian J. Mar. Sci. 15: 59-60. [ Links ]
Puyana, M. (1995). Aspectos biológicos y ecológicos de Mytilopsis sallei (Recluz, 1849) (Bivalvia: Dreissenidae) en bancos de ostras de la Ciénaga Grande de Santa Marta, Caribe Colombiano. Bol. Inst. Invest. Mar. Punta Betin, 24: 39-53. [ Links ]
Rehder, H. (1998). The Audubon Society Pocket Guides. Chantieleer Press, 180 pp. [ Links ]
Rodríguez, E. and Arnaiz, R. (1998). Gametogenesis and energy storage in a population of grooved carpet-shell clam, Tapes decussatus (Linné, 1787), in northwest Spain. Aquaculture, 162: 125-139. [ Links ]
Romero, J., Ramírez, Y., López, M., Godoy, A. y Severeyn, H. (1996). Distribución y abundancia de Geukensia demissa (Bivalvia: Mytilidae) en el manglar de La Rosita, Estado Zulia. Acta Cient. Venez., 47, Supl. N° 1, p. 39. [ Links ]
Romero, J., Severeyn, H., Ramírez, Y., Chavez, R. y López, M. (2002). Geukensia demissa (Dillwyn, 1817) (Bivalvia: Mytilidae), nuevo género y especie de mejillón para Venezuela y el Caribe. Bol. Cent. Invest. Biol., 36: 231-243. [ Links ]
Ruiz, E., Cabrera, J., Cruz, R. y Palacios, J. (1998). Crecimiento y ciclo reproductivo de Polymesoda radiata (Bivalvia: Corbiculidae) en Costa Rica. Rev. Biol. Trop., 46: 643-648. [ Links ]
Severeyn, H., Morales, F., Godoy, A. y Delgado, J. (1996). Dinámica poblacional de la almeja Tivela mactroides en la playa de Caño Sagua. Edo. Zulia, Venezuela. Invest. Cient., 3:16-28. [ Links ]
Shafee, M. (1989). Reproduction of Perna picta (Mollusca: Bivalvia) from the Atlantic coast of Morocco. Mar. Ecol. Prog. Ser., 53: 235-245. [ Links ]
Urban, J. (2000). Culture potential of the pearl oyster (Pinctada imbricata) from the Caribbean. I. Gametogenic activity, growth, mortality and production of a natural population. Aquaculture, 189: 361-373. [ Links ]
Vélez, A. (1976). Crecimiento, edad y madurez sexual del ostión Crassostrea rhizophorae de Bahía de Mochima. Bol. Inst. Oceanogr. Univ. Oriente, 15: 65-72. [ Links ]














