Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.31 no.1a Ensenada mar. 2005
Artículos
Respuestas inmunológicas y cicatrización en el poliqueto Eurythoe complanata (Annelida: Amphinomidae) expuesto a cobre
Immunological responses and wound healing in the polychaete Eurythoe complanata (Annelida: Amphinomidae) exposed to copper
Edgar Zapata-Vívenes*, Osmar A. Nusetti, Leida Marcano, María M. Esclapés y Luis Arredondo
* Laboratorio de Bioquímica Escuela de Ciencias Universidad de Oriente Cumaná-Edo. Sucre, Venezuela * E-mail: ezapata@sucre.udo.edu.ve
Recibido en marzo de 2004;
aceptado en junio de 2004.
Resumen
Se dividieron grupos de poliquetos, controles y expuestos a 0.4 mg Cu+2 L-1 (2.14 mg CuSO4 5H2O L-1; 30% 96 h-CL50) por siete días, en tres grupos: sensibilizados y no sensibilizados con Micrococcus lysodeikticus para evaluar la actividad de lisozima del fluido celómico, y otro sensibilizado con levaduras inactivadas por calor para evaluar la respuesta fagocítica de los celomocitos. La lisozima fue medida a 2 h y la fagocitosis a los 15 min después de la sensibilización inmunológica. Además, se evaluó el efecto de la exposición al cobre sobre la respuesta de cicatrización en los poliquetos. Para ello, los organismos expuestos al cobre y no expuestos fueron cortados en dos mitades y mantenidos en acuarios conteniendo agua de mar (sin cobre), determinándose el porcentaje de individuos cicatrizados diariamente. Las respuestas de fagocitosis y lisozima fueron inducidas por la sensibilización e inhibidas después de la exposición al metal. Por otra parte, 60-80% de los individuos controles cicatrizaron al cabo de cuatro días, mientras que los individuos tratados con cobre no evidenciaron cicatrización en el mismo periodo de tiempo. En conclusión, la inhibición de la inducción experimental de la lisozima y la fagocitosis, y de la cicatrización en el poliqueto Eurythoe complanata por la exposición aguda al cobre, sugiere el potencial de toxicidad del metal sobre los mecanismos fisiológicos que modulan la inmunidad innata y la reparación de heridas en anélidos, funciones biológicas comunes en animales cuya supresión puede resultar en una disminuida tolerancia a infecciones microbianas.
Palabras clave: cobre, cicatrización, fagocitosis, lisozima, Eurythoe complanata.
Abstract
Polychaetes exposed to 0.4 mg Cu+2 L-1 (2.14 mg CuSO4 5H2O L-1; 30% 96 h-LC50) for seven days and control individuals were divided into three groups: the first two were sensitized and non-sensitized with Micrococcus lysodeikticus, and the third was sensitized with heat-killed yeast. Lysozyme activity was tested in the first two groups and phagocytosis in the third one. Lysozyme was measured at 2 h and phagocytosis 15 min after immune sensitization. The effect of copper on wound healing was also examined in the polychaetes. For this, the polychaetes exposed and not exposed to copper were cut in two halves, and the body fragments were held in aquaria containing clean seawater, and the cicatrization was periodically observed. The lysozyme and phagocytosis responses were induced by the sensitization; however, these responses were inhibited after the metal exposure. On the other hand, 60-80% of the body fragments from the control group healed within four days, whereas the copper-treated individuals did not show cicatrization in the same period of time. In conclusion, the inhibition of the experimental activation of lysozyme and phagocytosis, and of wound healing in the polychaete Eurythoe complanata exposed to acute copper exposure, suggests the metal's potential toxicity on the physiological mechanisms that modulate the innate immunity in annelids, whose alteration could affect their tolerance to microbial infection.
Key words: copper, wound healing, phagocytosis, lysozyme, Eurythoe complanata.
Introducción
En los últimos años ha surgido un creciente interés por el problema del deterioro de los sedimentos de las zonas costeras de las regiones tropicales, asociado a procesos de contaminación química. Se han dirigido numerosas investigaciones a la selección de organismos modelos y parámetros bioquímicos y fisiológicos apropiados para evaluar su condición biológica en áreas impactadas por contaminantes. En este sentido, los poliquetos (anélidos) han sido reconocidos como organismos sensores útiles para estudiar los distintos grados de contaminación del bentos (Reish, 1980, 1986, 1998; Méndez y Páez-Osuna, 1998).
El sistema inmunológico de los anélidos ofrece aspectos de interés para su aplicación en estudios de toxicología ambiental. Su capacidad inmunológica reside en el fluido celómico, y está conformada por un conjunto de elementos funcionales no específicos, humorales y mediados por las células, que presentan cierta analogía u homología con mecanismos de inmunidad de otros organismos (acuáticos y terrestres) de diferentes grupos taxonómicos (Cooper, 1976; Goven et al., 1994; Millar y Ratcliffe, 1994; Dhainaut y Scaps, 2001). Otro aspecto de interés en los anélidos es el potencial de cicatrizar tejidos heridos y a su vez reponer partes completas del cuerpo que han sido eliminadas. Este fenómeno está relacionado con respuestas inmunes mediadas por las células, que a su vez son funciones relacionadas con la actividad macrofágica (Ville et al., 1995; Cikutovic et al., 1999).
El poliqueto Eurythoe complanata (gusano de fuego), debido a su abundancia en las zonas costeras de Venezuela y su amplia distribución geográfica (Liñero, 1978), ha sido seleccionado como organismo modelo en bioensayos de análisis de inmunotoxicidad, midiendo la actividad de la lisozima y fagocítica de los celomocitos in vitro como biomarcadores de las respuestas de defensa innata, a fin de diagnosticar riesgos de inmunodeficiencia en organismos del bentos ante una situación eventual de contaminación (Marcano et al., 1996, 1997; Nusetti et al., 1998, 1999). En estas pruebas se ha utilizado como contaminante de referencia al cobre, debido a su persistencia (al igual que la de otros metales pesados) en ambientes estuarinos y costeros y su gran tendencia a bioacumularse en la biota con importantes implicaciones inmunotoxicológicas.
La susceptibilidad de las defensas inmunológicas al cobre en E. complanata y otras especies de invertebrados marinos ha sido demostrada después de fases de contaminación agudas y crónicas, basado fundamentalmente en mediciones de las respuestas inmunológicas in vitro (Chen et al., 1984; Anderson et al., 1994; Marcano et al., 1997; Nusetti et al., 1998; Nicholson, 2003). Los resultados sugieren efectos inmunosupresores en el organismo, pero no revelan una relación directa con la capacidad del organismo de responder adaptativamente a un material no propio. En general, investigaciones en este aspecto toxicológico son limitadas en invertebrados marinos.
Este estudio examinó la inmunocompetencia del poliqueto E. complanata después de un tratamiento de contaminación aguda con sulfato de cobre. Se midieron las funciones inmunológicas innatas en base a las actividades de la lisozima y fagocitosis en el fluido celómico, tras un proceso de inmunosensibilización microbiana. También, se evaluó el efecto del cobre sobre la capacidad de cicatrización del organismo a fin de establecer la relación entre las respuestas inmunológicas y los procesos de reparación de tejidos.
Materiales y métodos
Organismos
Los ejemplares de E. complanata fueron recolectados en la línea costera sur del Golfo de Cariaco, 20 km al este de Cumaná, Venezuela. Los poliquetos fueron mantenidos durante dos semanas en condiciones de laboratorio, en acuarios de 5 L de capacidad, conteniendo agua de mar filtrada (36%o, pH 7.8, 25 ± 1°C), aireación constante y sustrato arenoso proveniente del sitio de captura, el cual le sirvió de refugio y alimento.
Bioensayos de toxicidad
Se escogieron poliquetos con pesos comprendidos entre 1.2 y 1.4 g para realizar los bioensayos. Los organismos fueron expuestos a una concentración nominal de 0.4 mg Cu+2 L-1 de cobre (2.14 mg CuSO4 5H2O L-1) por un periodo de siete días, con sus respectivos controles. Esta concentración representa el 30% de la concentración letal media a 96 h, LC50: 1.30 mg L-1 CuSO4 5H2O, límite de confidencia de 0.4 a 2.0 mg L-1, estimada por Marcano et al. (1996). Se realizaron recambios de agua, sedimentos y contaminantes cada tres días para eliminar productos de desecho. El pH del agua de mar se mantuvo entre 7.6 y 7.8.
La concentración de Cu+2 usada en los bioensayos de toxicidad es equivalente a 0.39 g-1 de agua de mar, la cual es inferior a la cantidad señalada (10 g-1) para sedimentos superficiales no contaminados de las regiones costeras del Golfo de Cariaco (Martínez, 2002).
Bioacumulación de cobre
Después del periodo de exposición se determinó el contenido de cobre en la masa corporal libre de vísceras de E. complanata mediante espectrometría de llama, usando un espectrómetro Varian AA-20, con límite mínimo de detección de 0.03 µg mL-1 (Marcano et al., 1996).
Recolección del fluido celómico
Los poliquetos controles y expuestos a cobre, inoculados con 25 mL de una solución de Micrococcus lysodeikticus (Sigma Chemical Co., San Luis, Miss., EUA; 8 mg mL-1) y no inoculados fueron utilizados para recolectar fluido celómico. A las 2 h después de la inyección bacterial, el fluido celómico fue recolectado usando el método descrito previamente por Arredondo (1993). Los gusanos fueron colocados durante 5 min en una cápsula de Petri de 10 cm de diámetro conteniendo 40 mL de una solución constituida por 2.5 mg mL-1 de hidrato de cloral (Merck) y 0.1 mg mL-1 de éter glicerol guaiacolato (Sigma Chemical Co.) en agua de mar filtrada (Miliporo: 0.45 µm, salinidad 36%, pH 7.5-7.8), para estimular la expulsión del fluido celómico, el cual fue recolectado directamente del poro del pigidio con la ayuda de una pipeta Pasteur. Luego, el fluido fue transferido a un tubo de centrifugación de polietileno de 5 mL, seguida por centrifugación a 200 g y 4°C por 10 min. El sobrenadante fue usado como fuente de lisozima.
Actividad de lisozima
La actividad de la lisozima fue determinada por el método de McHenery et al. (1979). Se colocaron alícuotas de 40 µL de fluido celómico en pozos de 5 mm de diámetro en lisoplacas de agarosa 1.0% en buffer fosfato (pH 6.2), conteniendo M. lysodeikticus (0.6 mg cel secadas con frío mL-1) como sustrato en placas de Petri. Las placas fueron incubadas a 24°C por 48 h, periodo en el cual se hicieron claramente visibles los halos correspondientes a la lisis bacterial. La actividad de la lisozima fue determinada mediante una curva de calibración preparada con lisozima estándar de clara de huevo de gallina (5 mg mL-1 en buffer fosfato 100 mM, pH 6.2; HEL, Sigma Chemical Co.). Los resultados se expresaron como HEL-equivalentes (µg mL-1), calculados por el siguiente modelo de regresión:
HEL-equivalente (µg mL-1) = antilog10 {a + b (diámetro, mm)}
Fagocitosis
Los poliquetos controles y los expuestos al metal fueron inoculados con 25 µL de una suspensión de levaduras inactivadas por calentamiento (1 mg mL-1 agua de mar filtrada). Transcurridos 15 min de la sensibilización, el fluido celómico fue recolectado y centrifugado a baja velocidad, y el precipitado celular fue resuspendido en 400 µL de agua de mar EDTA, pH 7.8 a 4°C. Para cuantificar la actividad fagocítica se mezclaron 100 µL de la suspensión celular con 100 µL de una solución de cristal violeta y se contaron 100 células en el hemocitómetro a una magnificación 400x en un microscopio Nikon. Las células que mostraron por lo menos una inclusión citoplásmica de levadura claramente visible al microscopio fueron contadas como fagocíticas. El conteo total y la viabilidad celular de los celomocitos fueron determinados como se indica en Nusetti et al. (1998), antes de la prueba de fagocitosis.
Cicatrización
Se escindieron transversalmente en dos mitades diez poliquetos controles y diez poliquetos expuestos al cobre. Los fragmentos escindidos (anterior y posterior) fueron colocados en acuarios que contenían sólo agua de mar, sedimento y aireación. Se realizaron observaciones diarias para determinar el porcentaje de individuos cicatrizados y el tiempo de cicatrización total de la herida. Se consideraron totalmente sellados aquellos organismos que lograron desprender los restos de tejidos muertos y el coágulo.
Análisis estadísticos
Las diferencias de las actividades de la lisozima entre los controles y los grupos experimentales fueron evaluadas por el análisis de varianza sencillo. Se usó la prueba de diferencias significativas mínimas (LSD) para establecer diferencias significativas entre pares de grupos (Snedecor y Cochran, 1971). Se utilizó el análisis t de Student para determinar los efectos de la exposición al cobre sobre la actividad fagocítica en el fluido celómico, y una prueba de Kruskall-Wallis para determinar las diferencias entre los efectos de los tratamientos estudiados sobre el proceso de sellado total de las heridas.
Resultados
Los niveles de cobre acumulados durante el periodo de ensayo en tejido corporal de E. complanata fueron de 5.60 y 42.0 µg g-1 de tejido seco en poliquetos controles y expuestos al cobre, respectivamente. La bioconcentración del metal en los organismos experimentales indica su biodisponibilidad en el curso del bioensayo de toxicidad. Los niveles de cobre en los poliquetos se encuentran en el rango de las concentraciones de cobre (0.63-67.01 µg g-1) reportado por Martínez (2002) para la capa superficial de los sedimentos en la región costera sur del Golfo de Cariaco.
Los gusanos no sensibilizados con M. lysodeikticus, contaminados con el cobre, no mostraron cambios significativos en la actividad de la lisozima en comparación con el grupo control no sensibilizado (tabla 1). La lisozima fue estimulada por la sensibilización microbiana; sin embargo, esta respuesta fue inhibida significativamente por la exposición al cobre (Fs = 20.68, P < 0.001, prueba LDS) (tabla 1).
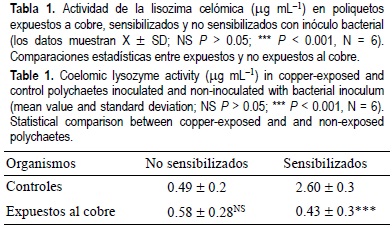
La viabilidad celular (90-95%) y el número total de celomocitos (7-9 x 105 cél mL-1) no fueron afectados por el tratamiento experimental con cobre. La fagocitosis fue estimulada por la inyección de levaduras en los organismos no expuestos, siendo esta respuesta inhibida significativamente por la exposición al cobre (11.0 ± 0.6 vs. 4.8 ± 0.6; Fs = 24.70, P < 0.001 ). El número de fagocitos en el fluido celómico de los poliquetos en presencia y ausencia de cobre alcanzó su máximo valor a los 15 min después de la inoculación con levadura.
El proceso de cicatrización fue afectado por el tratamiento con cobre (fig. 1); la capacidad de sellar completamente las heridas disminuyó significativamente en los organismos expuestos con respecto a los organismos controles (Kruskall-Wallis, P < 0.003). Entre 60% y 80% de los individuos controles cicatrizaron sus heridas al cabo de cuatro días, mientras que los individuos tratados con cobre no evidenciaron reparación del tejido en este mismo periodo de tiempo. Por otra parte, los fragmentos de la región posterior de los organismos expuestos al cobre presentaron un mayor retardo en la habilidad de recuperarse en comparación con los de la región anterior.

Discusión
Los niveles basales de la lisozima en E. complanata probablemente reflejan la existencia natural de un mecanismo de defensa humoral que protege al organismo de bacterias que viven en su ambiente, y controla también su flora simbiótica normal. La inducción de la actividad de la lisozima por la inoculación con M. lysodeickticus posiblemente está asociada con la activación de un mecanismo de vigilancia de primera línea en los procesos de reconocimiento de la carga infecciosa bacteriana y la potenciación de la capacidad bacteriolítica del fluido celómico. Se han observado concentraciones basales e inducción de esta enzima en la hemolinfa y fluido celómico de otros invertebrados (Perin y Jolles, 1972; McHenery et al., 1979; Hirigoyembeny et al., 1990; Hawking et al., 1993). El mecanismo de inducción de la lisozima en E. complanata inmunológicamente sensibilizado, podría estar vinculado con un aumento de la liberación de la proteína hacia el fluido celómico, lo que conlleva a un aumento de la inmunocompetencia innata de los individuos infectados. Posiblemente, esta respuesta funcional tiene relación, al menos parcialmente, con ajustes bioquímicos sobre la tasa de recambio de las proteínas (síntesis vs. degradación). En concordancia con esta posibilidad, Hirigoyemberry et al. (1990) observaron que los inhibidores de la síntesis de proteínas, actinomicina D y cicloheximida, afectaron la inducción de proteínas bacteriolíticas, incluyendo lisozima, en la lombriz de tierra Eisenia foetida inyectada con Aeromonas hydrophila. Aparentemente, la modulación de los mecanismos de biosíntesis de proteínas a nivel transcripcional desempeña una función clave en el control de la actividad bacteriolítica humoral en anélidos (Dhainaut y Scaps, 2001).
La contaminación con el cobre produjo un efecto inhibitorio sobre la actividad de la lisozima en los organismos inoculados con M. lysodeickticus; presumiblemente, el nivel de bioacumulación (42 µg gps-1) modificó los procesos de inducción de la enzima, limitando la capacidad de respuesta de defensa interna contra el agente bacterial invasor. Alternativamente, la bioacumulación de cobre en E. complanata pudo propiciar cambios moleculares y celulares (por ejemplo, estrés oxidativo; Nusetti et al., 2001) que podrían exacerbarse durante la fase de infección con consecuencias perjudiciales sobre la función de la lisozima. Tales alteraciones biológicas son factibles en organismos en el medio ambiente natural, en condiciones de infección microbiana y elevadas concentraciones de cobre en su hábitat, según reportó Martínez (2002) para el Golfo de Cariaco.
La exposición al cobre en poliquetos no sensibilizados no afectó la actividad de la lisozima; un hallazgo similar fue reportado por Marcano et al. (1997) en E. complanata. En contraste, Goven et al. (1994) describieron efectos inhibitorios sobre la lisozima en la lombriz de tierra Lumbricus terrestris asociados con un incremento de bioacumulación del cobre en condiciones experimentales agudas (cinco días a sulfato de cobre), mostrando una relación dosis-respuesta, y sugirieron que la toxicidad del metal estuvo probablemente relacionada con alteraciones en la estructura funcional de la proteína. Esta suposición concuerda con la inhibición, in vitro, de la lisozima de aves por cobre (Feeney et al., 1956). Es interesante destacar que en otras investigaciones realizadas en anélidos se han observado diferentes respuestas de la lisozima a la contaminación aguda con cobre, por ejemplo, activación en Amynthas hawayanus (Nusetti et al., 1999) e inhibición en Eisenia foetida (Nusetti et al., 1996).
Altos conteos y viabilidad de celomocitos indicaron que estas células fueron suficientes para probar su capacidad fagocítica en todos los organismos experimentales. La exposición aguda al cobre inhibió la respuesta fagocítica en los poliquetos. Este efecto inmunomodulatorio podría estar asociado con cambios en la composición relativa de los fagocitos, o estar relacionado con modificaciones bioquímicas sobre la capacidad de eliminar materiales extraños a través de mecanismos inmunes mediados por células. La fagocitosis es activada normalmente por estímulos antigénicos tales como microbios y otros agentes opsonisados, y esta respuesta es sensible a la exposición de metales pesados en anélidos (Chen et al., 1991; Fugeré et al., 1996; Nusetti et al., 1999; Sauvé et al., 2002). Nusetti et al. (1998) demostraron que la exposición aguda y crónica de E. complanata al cobre altera la capacidad de los celomocitos de formar rosetas secretorias y eritrocíticas contra eritrocitos de ratón, indicando deficiencias en los mecanismos de reconocimiento antigénico y en la producción de factores aglutinantes (lectinas y aglutininas), lo que resulta en una disminución de la inmunocompetencia humoral y celular. Se han realizado observaciones similares en la lombriz de tierra L. terrestis contaminada con bifenilos policlorados, o Aroclors (Rodriguéz-Grau et al., 1989; Goven et al., 1994).
La concentración nominal de cobre utilizada produjo efectos inhibitorios sobre el proceso normal de cicatrización de los fragmentos de E. complanata. Probablemente, la disminuida capacidad de los poliquetos de sellar completamente las heridas resultó de una acción tóxica del cobre bioacumulado sobre los mecanismos fisiológicos que determinan la capacidad de cicatrización, en especial sobre los mecanismos de inmunidad innata. El proceso de cicatrización en anélidos involucra eventos consecutivos tales como: la formación de un coágulo que evita la pérdida de líquido celómico, la inflamación de la región dañada y, a su vez, la activación del sistema inmuno-celular y humoral. La inhibición de la actividad de la lisozima y de los fagocitos en el fluido celómico puede afectar la inmunocompetencia del organismo, y por consiguiente, su capacidad de cicatrización. En anélidos, específicamente oligoquetos, se ha encontrado que diversos xenobióticos, en especial los metales pesados, actúan como factores que alteran el proceso de cicatrización, afectando directamente parte del sistema inmunológico (Cooper y Roch, 1992; Ville et al., 1995; Cikutovic et al., 1999). Por otra parte, es factible que la exposición al cobre haya generado una condición de estrés oxidativo (Nusetti et al., 2001; Geracitano et al., 2002), causando cambios bioquímicos y celulares que podrían alterar la capacidad de cicatrización del poliqueto. El procesamiento metabólico del cobre, al igual que el de otros metales pesados y xenobióticos orgánicos, puede causar un incremento de las especies reactivas de oxígeno y otras moléculas reactivas, que al exceder las defensas antioxidantes resultan en una posible disfunción inmunológica promoviendo alteraciones en los mecanismos de reparación de tejidos lesionados.
El retardado proceso de cicatrización observado en los fragmentos posteriores de los poliquetos contaminados con cobre, posiblemente es resultado de la distinta acción tóxica del metal sobre las diferentes regiones anatómicas del organismo. Es conocido que ciertos anélidos poseen la capacidad de bioacumular altas concentraciones de metales pesados (cobre, plomo) mayormente en la región posterior-caudal (Lucan-Bouche et al., 1999), haciendo esta región más vulnerable que la región anterior a la acción tóxica del metal sobre el proceso de sanado de las heridas. Este aspecto de toxicidad de metales pesados sobre los mecanismos biológicos de cicatrización en anélidos no ha sido aclarado.
En conclusión, la inducción de la actividad de la lisozima y la fagocitosis por la inoculación microbiana en E. complanata, posiblemente está asociada con la activación de un mecanismo de protección de primera línea entre los procesos de inmunidad innata (humoral y celular). Los efectos tóxicos del cobre sobre la lisozima y fagocitosis presumiblemente afectaron la capacidad de los poliquetos para reparar heridas, alteraciones biológicas que pudieron estar relacionados con el desarrollo de un estrés oxidativo inducido por el metal. La supresión de estas respuestas funcionales pueden causar manifestaciones patológicas en organismos silvestres. Por lo tanto, la estimulación microbiana de las defensas inmunológicas y la capacidad de sellar heridas en E. complanata pueden ser adecuadas para su uso en monitoreos de bentos contaminados por químicos.
Agradecimientos
Se agradece al Consejo de Investigación del Núcleo de Sucre, de la Universidad de Oriente, el apoyo institucional y económico a este estudio, y al Instituto Oceanográfico de Venezuela-Universidad de Oriente la infraestructura facilitada para la realización de este estudio.
Referencias
Anderson, R., Mora, L. and Thomson, S. (1994) Modulation of oyster (Crassostrea virginica) hemocyte functions by copper, as measured by luminol-enhanced chemiluminescence. Comp. Biochem. Physiol., 108C: 215-220. [ Links ]
Arredondo, L. (1993). Desarrollo de un método para colección de celomocitos en el poliqueto Eurythoe complanata (Annelida: Amphinomidae). Trabajo de Grado, Maestría en Biología Aplicada: Contaminación Ambiental, Universidad de Oriente, Venezuela. [ Links ]
Chen, T.C. and Sullivan, J.P. (1984). Effects of heavy metals on phagocytosis by molluscan hemocytes. Mar. Environ. Res., 14: 305-315. [ Links ]
Chen, S.C., Fitzpatrick, L.C., Goven, A., Venables, B. and Cooper E. (1991). Nitroblue tetrazolium dye reduction by earthworm (Lumbricus terrestris) coelomocytes: An enzyme assay for nonspecific immunotoxicity of xenobiotics. Environ. Toxicol. Chem., 10: 1037-1043. [ Links ]
Cikutovic, M.A., Fitzpatrick, L.C., Goven, A.J., Venables, B.J., Giggleman, M.A. and Cooper E.L. (1999). Wound healing in earthworms Lumbricus terrestris: A cellular-based biomarker for assessing sublethal chemical toxicity. Bull. Environ. Contam. Toxicol., 62: 508-514. [ Links ]
Cooper, E.L. (1976) Phagocytosis. In: E.L. Cooper (ed.), Comparative Immunology. Prentice-Hall, Englewood Cliffs, NJ, pp.40-60. [ Links ]
Cooper, E.L. and Roch, P. (1992). The capacities of earthworm to heal wound and to destroy allografts are modified by polychlorinated biphenyls (PCB). J. Invert. Pathol., 232: 67-72. [ Links ]
Dhainaut, A. and Scaps, P. (2001). Immune defense and biological responses induced by toxics in Annelida. Can. J. Zool., 79: 233-253. [ Links ]
Feeney, R.E., Macdonnell, L.R. and Ducay, D. (1956). Irreversible inactivation of lysozyme by copper. Arch. Biochem. Biophys., 61: 72-83. [ Links ]
Fugére, N., Brousseau, P., Krzystyniak, K., Coderre, D. and Founder, M. (1996). Heavy metal-specific inhibition of phagocytosis and different in vitro sensitivity of heterogeneous coelomocytes from Lumbricus terrestris (Oligochaeta). Toxicology, 109: 157-166. [ Links ]
Geracitano, L., Monserrat, J.M. and Bianchini, A. (2002). Physiological and antioxidant enzyme responses to acute and chronic exposure of Laeonereis acuta (Polichaeta, Nereididae) to copper. J. Exp. Mar. Biol. Ecol., 277: 145-156. [ Links ]
Goven, A.J, Fitzpatrick, L. and Venables, B. (1994). Chemical toxicity and host defense in earthworms. Ann. NY Acad. Sci., 712: 280-299. [ Links ]
Hawking, L.E., Brook, J. and Hutchison, S. (1993). The effects of tidal exposure an aspects of metabolic and immunological activity in the hard clam Mercenaria mercenaria (Linnaeus). Comp. Biochem. Physiol., 104A: 225-228. [ Links ]
Hirigoyemberry, F., Lasalle, F. and Lassagues, M. (1990). Antibacterial transcription and regulation of lysozyme and proteins evidenced after bacterial infestation. Comp. Biochem. Physiol., 95B: 25-28. [ Links ]
Liñero, I. (1978). Algunos aspectos biológicos y ecológicos de los poliquetos errantes. Lagena, 41-42: 45-53. [ Links ]
Lucan-Bouche, M.L., Biagianti-Risbourg, S., Arsac, F. and Vernet, G. (1999). An original decontamination process developed by the aquatic oligochaete Tubifex tubifex exposed to copper and lead. Aquat. Toxicol., 45: 9-17. [ Links ]
Marcano, L., Nusetti, O., Rodríguez-Grau, J. and Vilas, J. (1996). Uptake and depuration of copper and zinc in relation to metal-binding protein in the polychaete Eurythoe complanata. Comp. Biochem. Physiol., 114C: 179-184. [ Links ]
Marcano, L., Nusetti, O., Rodríguez-Grau, J., Briceño, J. and Vilas, J. (1997). Coelomic fluid lysozyme activity induction in the polychaete Eurythoe complanata as a biomarker of heavy metal toxicity. Bull. Environ. Contam. Toxicol., 59: 22-28. [ Links ]
Martínez, G. (2002). Algunos metales pesados en sedimentos superficiales del Golfo de Cariaco, Edo. Sucre, Venezuela. Bol. Inst. Oceanogr. Univ. Oriente., 41: 83-93. [ Links ]
McHenery, J.G., Birbeck, T.H. and Allen, L. (1979). The occurrence of lysozyme in marine bivalves. Comp. Biochem. Physiol., 63B: 25-28. [ Links ]
Méndez, N. and Páez-Osuna, F. (1998). Trace metals in two populations of the fireworm Eurythoe complanata from Mazatlan bay: Effects of body size on concentrations. Environ. Pollut., 102(2-3): 279-285. [ Links ]
Millar and Ratcliffe, N.A. (1994). Immunology: A comparative approach. John Wiley, New York, pp. 50-52. [ Links ]
Nicholson, S. (2003). Lysosomal membrane stability, phagocytosis and tolerancia to emersion in the Perna viridis (Bivalvia: Mytilidae) following exposure to acute, sublethal copper. Chemosphere, 52(7): 1147-1151. [ Links ]
Nusetti, O., Marcano, L. y Cordova, L. (1996). Desarrollo de protocolos estandarizados de evaluación de toxicidad subletal a nivel inmunológico, empleando la lombriz de tierra Eisenia feotida (Annelida: Lumbricidal). Boletín Técnico de la Gerencia General de Investigaciones Ecológicas y Ambientales. INTEVEP, S.A. [ Links ]
Nusetti, O.A., Salazar-Lugo, R., Rodríguez-Grau, J. and Vilas, J. (1998). Immune and biochemical responses of the polychaete Eurythoe complanata exposed to sublethal concentration of copper. Comp. Biochem. Physiol., 119C(2): 177-183. [ Links ]
Nusetti, O.A., Parejo, E., Esclapés, M.M., Rodríguez-Grau, J. and Marcano, L. (1999). Acute-sublethal copper effects on phagocytosis and lysozyme activity in the earthworm Amynthas hawayanus. Bull. Environ. Contam. Toxicol., 63: 350-356. [ Links ]
Nusetti, O., Esclapés, M., Salazar, G., Nusetti, S. and Pulido, S. (2001). Biomarkers of oxidative stress in the polychaete Eurythoe complanata (Amphinomidae) under short term copper exposure. Bull. Environ. Contam. Toxicol., 66: 576-581. [ Links ]
Perin, J. and Jolles, P. (1972). The lysozyme from Nephthys hombergy (Annelid). Biochim. Biophys. Acta, 263: 683-689. [ Links ]
Reish, D.J. (1980). Use of polychaetous annelids as test organisms for marine bioassays experiments. In: A.L. Buikema and J.C. Cairs (eds.), Aquatic Invertebrate Bioassays. ASTM 715, Philadelphia, pp. 140-145. [ Links ]
Reish, D.J. (1986). Benthic invertebrates as indicators of marine pollution: 35 years of study. IEEE Oceans'86 Conference Proc. Washington, DC, September 23-25, pp. 885-888. [ Links ]
Reish, D.J. (1998). The use of larvae and small species of polychaetes in marine toxicological testing. In: P. Well, K. Lee and C. Blaise (eds.), Microscale Testing in Aquatic Toxicology: Advances, Techniques and Practice. 1st ed. CRC Press, pp. 383-392. [ Links ]
Rodrígez-Grau, J., Venables, B., Fitzpatric, L., Goven, A. and Cooper, E. (1989). Suppression of secretory rosette formation PCBs in Lumbricus terrestris, and earthworm immune assays for humoral immunotoxicity of xenobiotics. Environ. Toxicol. Chem., 8: 1201-1207. [ Links ]
Sánchez-Alvardo, A. (2000). Regeneration in the metazoans: Why does it happen? Bioassays, 22: 578-590. [ Links ]
Sauvé, S., Hendawi, M., Brousseau, P. and Founder, M. (2002). Phagocytic response of terrestrial and aquatic invertebrates following in vitro exposure to trace elements. Ecotoxicol. Environ. Safety, 5(1): 21-29. [ Links ]
Snedecor, W.G. and Cochran, E.G. (1971). Statistical Methods. Iowa State Univ. Press, Ames, Iowa, pp. 258-298. [ Links ]
Ville, P., Roch, P., Nasson, P. and Narbonne, J. (1995). PBCs increase molecular-related activities (lysozyme, antibacterial hemolysis, proteases) but inhibit macrophage-related function (phagocytosis, wound healing) in earthworm J. Invert. Pathol., 65: 217-224. [ Links ]














