Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Ciencias marinas
versão impressa ISSN 0185-3880
Cienc. mar vol.30 no.4 Ensenada Dez. 2004
Artículos
Fases geoquímicas del Fe y grado de piritización en sedimentos de la Ría de Pontevedra (NO de España): Implicaciones del cultivo del mejillón en bateas
Geochemical phases of Fe and degree of pyritization in sediments from Ría de Pontevedra (NW Spain): Implications of mussel raft culture
I. León1, G. Méndez2, B. Rubio2*
1 Universidad del Atlántico Antigua Vía Puerto Colombia, km 7 Barranquilla, Colombia.
2 Departamento de Geociencias Marinas y Ordenación del Territorio Universidad de Vigo 36310, Vigo, España. *E-mail: brubio@uvigo.es
Recibido en septiembre de 2003;
aceptado en mayo de 2004.
Resumen
Se analizaron seis testigos de sedimento de la Ría de Pontevedra para valorar la influencia que ejercen los sistemas de bateas sobre las propiedades texturales y geoquímicas del sedimento (contenido de carbonatos, materia orgánica, fases geoquímicas del Fe y grado de piritización). Cuatro de los testigos se extrajeron en zonas dedicadas al cultivo de mejillón en bateas y los otros dos en áreas adyacentes no sometidas a dicha actividad. El grado de piritización (DOP) osciló entre 11.89% y 67.30%, con un valor medio de 46.36 ± 13.15%. Los valores máximos se obtuvieron en los sedimentos de las zonas con bateas (biodepósitos) que presentaron, a su vez, mayores contenidos de Fe pirítico, fango y materia orgánica que las zonas libres de bateas. Por el contrario, en estas últimas zonas predominó el Fe asociado con los silicatos, junto con las fracciones más gruesas (arena y grava) y elevados porcentajes de carbonatos. Estos resultados muestran un predominio de condiciones más reductoras en los biodepósitos, que favorecen la formación de una mayor cantidad de pirita frente a las áreas donde no hay maricultura. Los valores del DOP indican que el Fe reactivo no se ha convertido en su totalidad en Fe pirítico. La materia orgánica se confirma como el factor limitante en la formación de pirita por la correlación significativa (r = 0.61) encontrada entre ésta y el DOP. Los resultados permiten concluir que el cultivo del mejillón en bateas modifica sustancialmente la textura del sedimento e influye, significativamente, en las formas químicas del Fe, con las consecuentes implicaciones geoquímicas y ambientales.
Palabras clave: grado de piritización, Ría de Pontevedra, hierro reactivo, hierro pirítico, bateas.
Abstract
To assess the influence of mussel raft systems on several geochemical and sedimentological properties (carbonate and organic matter contents, fractions of Fe and degree of pyritization), six sediment cores were collected from the Ría de Pontevedra area. Four of those cores were collected in mussel raft areas (biodeposits) and the other two in adjacent areas where mussel rafts do not operate. The degree of pyritization (DOP) varied between 11.89% and 67.30%, with a mean value of 46.36 ± 13.15%. The maximum values of DOP were obtained in sediments from the mussel raft areas, which in turn showed higher values of pyrite Fe, organic matter and mud than the areas without mussel rafts. On the contrary, in the latter areas, coarser sediments with high carbonate content and Fe bound to silicates were the predominant phases. The results show a dominance of more reducing conditions in the biodeposit areas than in the adjacent areas. The DOP values indicate that reactive Fe was not totally converted to pyrite Fe. The significant correlation (r = 0.61) between DOP and organic matter confirmed that the latter is the limiting factor in pyrite genesis. These results allow us to conclude that mussel raft culture significantly changes the sediment texture and geochemical forms of Fe, with the consequent geochemical and environmental implications.
Key words: degree of pyritization, Ría de Pontevedra, reactive iron, pyrite iron, mussel rafts.
Introducción
La Ría de Pontevedra forma parte de las Rías Baixas de Galicia. Está situada en el NO de la Península Ibérica entre las coordenadas 42°21'-42°09' N y 8°54'-8°37' O (fig. 1). Estas rías constituyen una serie de pronunciadas entrantes en la costa como dientes de sierra, separadas por relieves elevados que llegan a superar los 600 metros de altitud, y protegidas de la influencia oceánica por islas ubicadas en sus bocas (Vilas et al., 1996).
La Ría de Pontevedra se halla orientada en dirección SO-NE según una fractura geológica de 23 km, que comprende desde la desembocadura del Río Lérez hasta la Isla de Onza. Presenta una morfología en embudo con una longitud axial de 30 km y una anchura máxima de unos 12 km en su boca, que decrece a 2.5 km en la cabecera (Vilas et al., 1996). Tiene una profundidad media en su eje central de 31 m, ocupa una superficie de 141 km2 y contiene un volumen de 4450 hm3 de agua (Ibarra y Prego, 1997). El accidente geográfico más destacado en los márgenes de la Ría de Pontevedra, a la cual hace asimétrica, es la corta (7 km) y relativamente profunda (40 m) Ría de Aldán (fig. 1), que se halla orientada hacia el NNO y cuya boca limita con la parte meridional externa de la Ría de Pontevedra por una abertura de 3.5 km. La principal fuente de agua dulce a la ría está localizada en su cabecera (Río Lérez). Existen otros ríos pequeños y arroyos a lo largo de la costa que tienen una influencia menor en la oceanografía y sedimentología de la ría (Vilas et al., 1996). La geología del área está dominada por rocas metamórficas e ígneas, dispuestas en bandas alternas de dirección N-S a NNO-SSE (Vilas et al., 1996).
Los sedimentos submareales superficiales de la Ría de Pontevedra están constituidos principalmente por arenas fangosas y fango, con un contenido variable de carbonato. Existe un depósito axial principal de sedimentos cohesivos relativamente ricos en materia orgánica, particularmente en la parte interna de la ría (Vilas et al., 1996; García-Gil et al., 1999). Estos elevados contenidos de materia orgánica (superiores al 15%) se deben fundamentalmente a su alta productividad biológica, a consecuencia del afloramiento costero (Figueiras et al., 1985, 1986). Además, los aportes urbanos e industriales a la ría, derivados de sus principales actividades económicas (especialmente el cultivo de organismos marinos) han incrementado notablemente los niveles de materia orgánica en el sedimento (Macías et al., 1991; Arbones et al., 1992; Rubio et al., 1995, 1996; Vilas et al., 1996; León et al., 2001). La actividad de maricultura más importante es el cultivo de mejillón, que se realiza en unas estructuras flotantes denominadas bateas, dispuestas en grupo configurando una forma poligonal. Los polígonos de bateas se sitúan frente a Combarro, Raxó y Bueu, y en la costa oeste de la Ría de Aldán (fig. 1). La posición, el tamaño y la antigüedad de dichos polígonos se han ido modificando en los últimos 25 años, aunque nunca han ocupado el eje central de la ría para dejar aquel disponible al tráfico portuario.
En general, los estudios indican que el principal impacto del cultivo de organismos marinos se produce sobre el lecho marino y la fauna macrobentónica (Jaramillo et al., 1992; Chamberlain et al., 2001; Hayakawa et al., 2001; Heilskov y Holmer, 2001). En particular, en la Ría de Pontevedra el cultivo del mejillón ha ocasionado cambios significativos en el sedimento en los últimos treinta años debido a las grandes cantidades de materia orgánica producidas por los mejillones en forma de heces que se depositan en el fondo de la ría. La estructura comunitaria bentónica de las áreas bajo bateas se ha alterado, predominando los organismos detritívoros y carroñeros (López-Jamar, 1978a, b). Las 121 bateas presentes en la Ría de Pontevedra representan el 3% del total en las Rías Baixas. Cada batea genera unos 190 kg día-1 de biodepósito (en peso seco) que contiene, aproximadamente, entre 31 y 32 kg día-1 de materia orgánica (Cabanas et al., 1979). Esta elevada carga orgánica es suficiente para generar importantes modificaciones biogeoquímicas. La tasa de sedimentación, que en la parte interna de la ría se ha estimado en 0.1 cm año-1 (Rubio et al., 2001), se incrementa significativamente en las zonas con bateas, alcanzando valores entre 0.5 y 1.5 cm año-1 (Tenore y González, 1975; Cabanas et al., 1979). Ello ha dado lugar a un cambio en las condiciones físico-químicas del sedimento hacia un ambiente más reductor y/o anóxico (Cabanas et al., 1982).
En estos ambientes anóxicos la degradación de materia orgánica es la responsable de la diagénesis temprana de los minerales sedimentarios de Fe, en los cuales la pirita (FeS2) es el compuesto termodinámicamente más estable (Luther, 1991; Morse y Luther, 1999). Existe abundante información sobre la génesis y mecanismos de formación de la pirita y otros sulfuros de Fe en diferentes ambientes sedimentarios marinos (Raiswell y Berner, 1985; Calvert y Karlin, 1991; Muramoto et al., 1991; Huerta-Díaz y Morse, 1992; Wilkin et al., 1997). Numerosos autores (Wang y Morse, 1996; Morse y Wang, 1997; Wilkin y Barnes, 1996) han reconocido que son varios los factores que limitan la formación de pirita. Existe consenso en la comunidad científica acerca de que para la génesis de este mineral, además de una adecuada difusión y reducción bacteriana de sulfato, debe haber una disponibilidad de Fe reactivo y materia orgánica. Aunque con respecto a este último factor las opiniones son contradictorias (Berner, 1970, 1984; Goldhaber y Kaplan, 1974; Berner et al., 1978; Morse et al., 1987; Morse y Mackenzie, 1990; Ferdelman et al., 1991; Lebron y Suarez, 1996; Luther et al., 1996; Wilkin y Barnes, 1996; entre otros).
En ambientes sedimentarios de rías prácticamente se desconocen estos aspectos. En concreto, en la Ría de Pontevedra únicamente Rubio et al. (2001) abordan la distribución espacio-temporal de la pirita de un modo cualitativo. Resulta de gran interés geoquímico y ambiental establecer la influencia que pueda ejercer la materia orgánica en la especiación del Fe y/o génesis de la pirita, así como estimar la influencia que puedan ejercer los sistemas de bateas en la sedimentología y geoquímica de las rías. Los trabajos existentes (Chamberlain et al., 2001; Hartstein y Rowden, 2004) enfatizan el impacto del cultivo de mejillón desde el punto de vista del estudio de fauna bentónica, sin considerar los aspectos que se abordan en este trabajo. Debe tenerse en cuenta asimismo que los sistemas de rías, a diferencia de los de estuarios y bahías (Vilas, 2002), se caracterizan por su particular abundancia de materia orgánica, además del aporte extra que supone la presencia de las bateas en la totalidad de las Rías Baixas. Como objetivo último este estudio permitiría establecer los modelos de facies geoquímicas en sistemas de rías, y compararlos con otros sistemas sedimentarios costeros similares.
Materiales y métodos
La toma de muestras se realizó en febrero de 2000, utilizando el buque de investigación oceanográfica del Instituto de Investigaciones Pesqueras de Vigo. Se escogieron seis estaciones de muestreo cuya localización se muestra en la figura 1. Los testigos de sedimentos P7, P8, P9 y P11 se extrajeron en zonas de batea. Los testigos P5 y P6 se tomaron en áreas donde no existen bateas con el propósito de establecer comparaciones en el comportamiento y patrón de distribución vertical de los diferentes parámetros medidos en este trabajo. Las zonas de muestreo localizadas en los polígonos de bateas fueron escogidas siguiendo el criterio de antigüedad de los mismos, ya que los polígonos han variado en forma y posición a lo largo de las últimas décadas. Los testigos de sedimentos se obtuvieron mediante un sacatestigos de gravedad de 4.5 m de longitud y 12 cm de diámetro, aproximadamente, dotado de una camisa interior de PVC en la que se recoge el sedimento. La profundidad a la que se extrajeron varió entre 20 y 40 m de profundidad y su longitud entre 0.25 y 3.06 m. En el laboratorio se guardaron en cámara frigorífica a temperatura inferior a 4°C hasta su análisis.
Los testigos, una vez divididos longitudinalmente se cortaron con espátula de plástico en secciones transversales individuales de 5 cm. Se analizaron granulometría, materia orgánica, carbonatos y hierro de un total de 136 muestras. Para la especiación del Fe se seleccionaron 49 muestras representativas de las variaciones de cada testigo en cuanto a textura y otros parámetros físico-químicos. Todos los materiales de laboratorio fueron lavados previamente con jabón libre de fosfatos, enjuagados varias veces con agua destilada y dejados 24 horas en una solución de HCl al 5%. Posteriormente, el material se enjuagó tres veces con agua desionizada de grado Milli-Q y se dejó secar a temperatura ambiente. Todos los reactivos utilizados fueron de grado reactivo o superior.
Las cantidades de grava y arena se determinaron por tamizaje en seco, y el contenido de fango por el método de la pipeta, previa eliminación de la materia orgánica con peróxido de hidrógeno (Guitián y Carballas, 1976).
El contenido de carbono orgánico se determinó por el método de oxidación húmeda utilizando una versión modificada del método de Sawerlandt. Los valores obtenidos se transformaron a materia orgánica usando un factor de 1.724 (Guitián y Carballas, 1976).
El carbonato cálcico se determinó tanto sobre la muestra total (CaCO3 T) como en la fracción del sedimento menor de 0.063 mm (CaCO3 F) utilizando el método de Guitián y Carballas (1976).
La extracción secuencial del hierro se realizó mediante el método propuesto por Huerta-Díaz y Morse (1990). Debido a los elevados contenidos de materia orgánica en los sedimentos analizados se utilizó H2SO4 concentrado tal como sugieren estos autores. Los análisis se realizaron en la fracción menor de 0.063 mm. En la tabla 1 se muestran las fracciones geoquímicas definidas según el método utilizado. El hierro total (FeT) en el presente estudio representa la suma de las fracciones geoquímicas del Fe. La exactitud o selectividad de cada una de ellas no se verificó por no existir material de referencia adecuado disponible. Ésta es una limitación común a otros estudios que han utilizado esta técnica (Huerta-Díaz y Morse, 1992).
Las concentraciones de hierro se determinaron en un espectrómetro de plasma acoplado inductivamente (ICP-AES). Por cada serie de 7 muestras se introdujo una muestra por triplicado para verificar la precisión y reproducibilidad del método. En todos los casos la precisión fue de ± 2% a un nivel de confianza del 95%. Los resultados están expresados en miligramos por kilogramo de sedimento seco (mg kg-1).
Se determinó el grado de piritización (DOP) propuesto por Berner (1970) para establecer la cantidad de Fe presente como pirita en relación con el llamado Fe reactivo según la siguiente expresión:
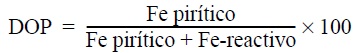
Resultados y discusión
Características generales de los sedimentos
La distribución en el registro sedimentario de las fracciones granulométricas se muestra en la figura 2. La fracción arena fue la más abundante en todos los testigos, excepto en P7 donde predominó el fango. Aquella presentó un valor medio de 44.99 ± 22.03%, mostrando una tendencia al incremento hacia la base de los testigos. El fango fue la segunda fracción granulométrica en los sedimentos estudiados. Únicamente dominó en P7 en todo el registro sedimentario, presentando un contenido medio superior al 74%. Cabe destacar, para esta fracción, un incremento progresivo hacia la parte superior de los testigos donde alcanzó los máximos valores. La fracción grava fue la menos abundante, con porcentajes medios cercanos al 15%, y estando representada principalmente por fragmentos de conchas de bivalvos. El patrón de distribución vertical y los porcentajes medios de las distintas fracciones granulométricas concuerdan con lo señalado en trabajos previos en la Ría de Pontevedra (Rubio et al., 1995, 1996, 2001) y en las otras Rías Baixas (Nombela et al., 1995; Rubio et al., 2000a; entre otros).
El contenido en carbonato cálcico, tanto en muestra total como en la fracción fina, presentó un amplio rango de variación en sus valores y con cierta tendencia a incrementarse progresivamente hacia la base de los testigos, excepto en P9 (fig. 3). Los valores de carbonato cálcico en muestra total oscilaron entre 10.39 y 61.79% con un valor medio de 32.08 ± 15.03%, mientras que en la fracción fina los porcentajes fueron menores (entre 6.30 y 39.01%) con un porcentaje medio del 18.30 ± 8.00%. Los contenidos medios en ambas fracciones son superiores a los señalados por otros autores en estuarios (Piron et al., 1990; entre otros), y reflejan la influencia del cultivo de bivalvos en los sedimentos de la ría (Vilas et al., 1996).
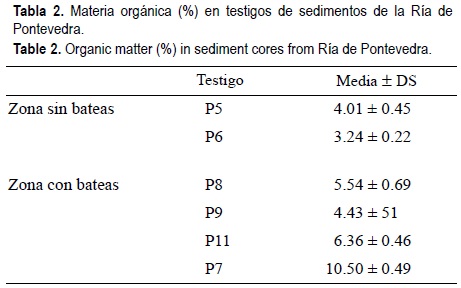
La materia orgánica (tabla 2) presentó un amplio rango de variación (1.13-23.09%) alcanzando los menores valores en los testigos extraídos en zonas libres de bateas (P5 y P6), cuyos contenidos medios fueron inferiores al 5%. Sin embargo, estos valores son del orden de los citados por algunos autores (Barreiro, 1991; Rubio et al., 1995; Vilas et al., 1999) para rías gallegas, pero superiores a otras áreas costeras (Lückge et al., 1999). En los biodepósitos se presentaron los valores más altos de materia orgánica, especialmente en el testigo P7 (más del 10%, por término medio). Este testigo se localiza en la zona más próxima a los núcleos urbanos de Marín y Pontevedra, y por tanto, posible receptora de aportes domésticos e industriales que contribuyen a aumentar la carga orgánica en el sedimento.
Hierro total
Las concentraciones de hierro total (FeT) oscilaron entre 7.52 X 103 y 27.30 x 103 mg kg-1 con un valor medio de 12.80 X 103 ± 3.77 mg kg-1. Los valores más elevados se obtuvieron en los testigos P6 y P7 y los menores en P9 y P11. Estos valores son inferiores a los señalados en otros trabajos en la Ría de Pontevedra (Rubio et al., 2000b; Rubio et al., 2001) y en las otras Rías Baixas (Marcet, 1994; Belzunce-Segarra et al., 1997) debido a que el FeT no se ha extraído completamente con el método de extracción utilizado (Huerta-Díaz and Morse, 1990).
Fases geoquímicas del hierro
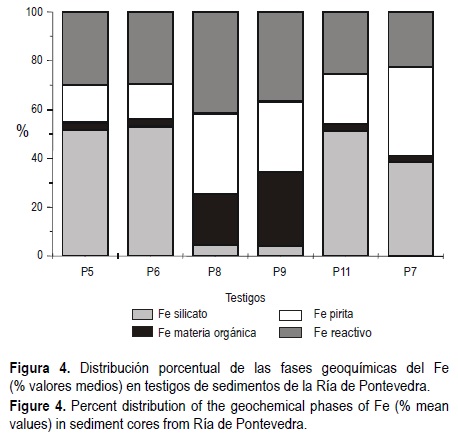
Los porcentajes medios por testigo de las fases geoquímicas del Fe se muestran en la figura 4. El Fe ligado a los silicatos (Fe silicatos) fue la fracción dominante en los testigos P5, P6 y P11 (> 50%). El Fe ligado a la materia orgánica (Fe materia orgánica) presentó los valores más bajos, excepto en P8 y P9 donde representó más del 20 y 30%, respectivamente, superando más de cinco veces a los del resto de los testigos. Para el Fe reactivo los valores oscilaron entre 22% y 37% con un valor medio cercano al 30%. Para esta fracción los porcentajes máximos se obtuvieron en P8 y P9 y los menores en P7. Las proporciones del Fe pirítico fueron del orden de las del Fe reactivo (> 26%), oscilando entre 14% y 37%. Los fondos bajo bateas presentaron marcadamente más Fe pirítico que las áreas no sometidas al cultivo del mejillón. Los valores máximos correspondieron al testigo P7 y los menores a P5 y P6. A excepción de los testigos P8 y P9, en general el orden de las fases geoquímicas del Fe fue: Fe silicatos > Fe reactivo > Fe pirítico > Fe materia orgánica.
La distribución de las formas geoquímicas del Fe en el registro sedimentario se muestra en la figura 5. El Fe en la fracción silicatos presentó una distribución vertical prácticamente constante en la mayoría de los testigos, aunque algunos de ellos (P6 y P11) presentaron un ligero incremento hacia la parte superior de los mismos, posiblemente debido al mayor contenido en finos en estos testigos hacia techo. Los valores de esta fracción oscilaron en un amplio rango (0.28 X 103 a 17.35 x 103 mg kg-1) con un valor medio de 4.59 X 103 ± 3.40 X 103mg kg-1, alcanzándose los menores valores en los testigos P8 y P9, y los máximos en el P6.
El Fe ligado a materia orgánica presentó, en la mayoría de los testigos, una distribución vertical constante con valores muy bajos (<1 x 103 mg kg-1), excepto en los testigos P8 y P9. Así, en el P8 los valores aumentan desde la superficie hasta los primeros 15 cm de profundidad y, a partir de este nivel, experimentan un brusco descenso hacia la base del testigo. Por el contrario, en el P9 las concentraciones de Fe materia orgánica descienden desde la superficie hasta los 30 cm de profundidad y, a partir de allí, los valores aumentan hacia la base del testigo. Los máximos subsuperficiales (> 3 x 103 mg kg-1) encontrados en ambos testigos sugieren que el aumento del Fe ligado a materia orgánica se debe a procesos diagenéticos. Es decir, una parte del Fe reactivo reacciona con la materia orgánica y se incorpora a su estructura incrementando las concentraciones en esas profundidades. Se ha reconocido que algunos compuestos de la materia orgánica, como los ácidos húmicos, establecen interacciones fuertes con el Fe para formar complejos ferroorgánicos (Morse y Wang, 1997).
Las concentraciones de Fe reactivo presentaron un patrón vertical heterogéneo que está asociado a las diferentes condiciones óxido-reductoras en el registro sedimentario en cada uno de los testigos. En el testigo P8 la tendencia es a aumentar los valores hacia la base. Por el contrario, en P6 los valores disminuyen hacia el fondo del testigo debido a condiciones más reductoras que favorecen la transferencia de Fe reactivo a Fe pirítico (fig. 5). Debe hacerse notar que en el testigo P8 el Fe reactivo y el Fe pirítico aumentan simultáneamente en profundidad, además el Fe reactivo es muy abundante y por ello no se aprecia la mencionada transferencia en el perfil vertical. Este mecanismo de transferencia ha sido observado también en otras Rías Baixas (Álvarez-Iglesias et al., 2003a) y se debe a la disolución de los oxihidróxidos de Fe en condiciones reductoras transformándose en otras fases sedimentarias, principalmente sulfuros de hierro.
Las concentraciones de Fe pirítico, en general, aumentan desde la superficie hasta profundidades intermedias donde alcanzan los máximos valores (a 15 cm en P5; a 75 cm en P7 y a 20 cm en el resto de los testigos) (fig. 5). Este comportamiento en el registro sedimentario coincide con lo observado en otros lugares (Carreón et al., 2001) e indica que con el enterramiento del material sedimentario se incrementan las condiciones reductoras favoreciendo la producción de esta forma química del Fe, que será mayor en aquellas zonas que posean un mayor contenido de materia orgánica.
Con el fin de establecer un comportamiento general del Fe reactivo y el Fe pirítico en el área de estudio, se compararon las concentraciones superficiales (0-5 cm) y de fondo (últimos 5 cm de cada testigo) de ambos parámetros (tabla 3). Los valores del Fe reactivo fueron mayores en superficie que los del Fe pirítico y viceversa en el fondo, constatando que la mayor transferencia de Fe reactivo a Fe pirítico ocurre en las capas más profundas del sedimento tal como han demostrado otros autores en otras Rías Baixas (Informe del proyecto PGIDT99 MAR AE, 2001). Sin embargo, cabe resaltar que en la mayoría de los testigos es a nivel subsuperficial donde ocurren con mayor intensidad los procesos diagenéticos que favorecen la transferencia de Fe reactivo a Fe pirítico, debido al enterramiento del material sedimentario.
Grado de piritización
El DOP ha sido utilizado para clasificar ambientes sedimentarios marinos por ser un índice geoquímico paleoambiental útil que ha sido correlacionado y corroborado con datos paleoecológicos (Raiswell et al., 1988). Estos autores, basándose en un estudio de sedimentos antiguos, propusieron que los sedimentos con DOP < 0.42 indican condiciones aeróbicas, sedimentos con DOP > 0.75 reflejan un fondo inhóspito y entre ambos se encontrarían los ambientes restringidos, aunque Raiswell et al. (1988) no establecen límites precisos. Posteriormente varios autores (Wij sman et al., 2001; Álvarez-Iglesias et al., 2003b; Roychoudhury et al., 2003) han aplicado los límites del DOP de Raiswell et al. (1988) a sedimentos recientes con resultados satisfactorios, sin embargo, han modificado de modo variable la nomenclatura y establecido límites más precisos en las fronteras de la clasificación de Raiswell et al. (1988).
Con el fin de homogeneizar la citada diversidad de nomenclaturas se propone una nueva clasificación que combina los trabajos citados y la pionera clasificación geoquimica de ambientes sedimentarios de Berner (1981). Esta nueva clasificación, basada en los valores del DOP del sedimento determinados mediante la extracción con HCl (DOPHCl), establece que el ambiente sedimentario es óxico cuando los valores del DOP son < 42%, dióxico o subóxico entre 42 y 55%, anóxico entre 55 y 75% y euxínico cuando el DOP es > 75%.
Los valores del DOP para los testigos de la Ría de Pontevedra oscilaron en un amplio rango (entre 11.89 y 67.30%) con un valor medio de 46.36 ± 13.15%. Los valores medios del DOP para cada testigo indican claramente la existencia de diferentes ambientes sedimentarios en la Ría de Pontevedra. En las áreas no sujetas directamente al cultivo de mejillón en bateas (testigos P5 y P6), considerando la clasificación antes expuesta, el ambiente sedimentario es óxico prácticamente en todo el registro sedimentario, mientras que en las áreas debajo de las bateas varía desde un ambiente dióxico o subóxico en los testigos P8, P9 y P11 a un ambiente anóxico en P7 (fig. 6) siendo las diferencias estadísticamente significativas (P < 0.01) entre testigos de zonas de bateas y zonas sin ellas.
La distribución del DOP en el registro sedimentario (fig. 7) indica que los valores aumentan desde la superficie hasta profundidades intermedias (entre 10 y 25 cm) donde alcanzan los valores máximos. A partir de esas profundidades el DOP tiende a estabilizarse con pocas variaciones hacia la base de los testigos. En las zonas con bateas el DOP en el registro sedimentario fue mayor que en las áreas sin bateas. Sus valores son del orden de los señalados en otras Rías Baixas, pero pueden considerarse relativamente altos si los comparamos con los indicados en otros lugares del mundo (tabla 4), particularmente el DOP en el testigo P7 que está dentro del rango señalado para cuencas anóxicas como los fiordos noruegos (Müller, 2002) y el Mar Negro (Wijsman et al., 2001).
Para los testigos P8, P9 y P11 los valores medios del DOP fluctuaron en un estrecho rango (entre 43 y 45%), pero superaron ligeramente a los señalados para ambientes óxicos. En los testigos P8 y P9, a pesar de haber sido extraídos en zonas con bateas, las condiciones reductoras no son tan intensas como para producir un agotamiento del oxígeno con la reducción importante de sulfatos, como ocurriría en el testigo P7, obteniéndose DOPs que superan ligeramente el valor considerado por Raiswell et al. (1988) como límite del ambiente óxico. Conviene recordar que en estos testigos se obtuvieron las concentraciones más elevadas de Fe materia orgánica. Así, la reacción del Fe con algunos compuestos de la materia orgánica, como los ácidos húmicos, podría favorecerse en ambientes deposicionales dióxicos que tengan contenidos moderados de materia orgánica metabolizable. Probablemente esto sea lo que ocurre en los testigos P8 y P9, y que se corrobora por las correlaciones negativas altamente significativas (r2 = 0.89 y r2 = 0.92, P < 0.001, respectivamente) entre el Fe reactivo y el Fe materia orgánica (fig. 8). En P7 el DOP (valor medio > 60%) sugiere un ambiente altamente reductor que se origina debido a una completa reducción del sulfato, además de una elevada degradación de la materia orgánica. Según Berner (1981) una vez agotados los diferentes aceptores de electrones con energía libre mayor que el sustrato se forma gas metano. La presencia de este gas en la zona interna de la Ría de Pontevedra ha sido recientemente constatada por García-Gil (2002). En esta zona de la ría se registra una menor energía del oleaje que conlleva una mayor acumulación de materiales finos con la consiguiente y bien conocida asociación con la materia orgánica (Rubio et al., 2000a, b). Este hecho, junto con la existencia de los polígonos de bateas que persisten desde hace más tiempo (desde al menos 1974), concuerda con la presencia de campos de gas relativamente superficiales (menos de 1 m) cartografiados en esta zona (García-Gil et al., 2000) y que indican, claramente, un alto grado de transformación de la materia orgánica en este sector de la ría.
La presencia de sectores anóxicos en la Ría de Pontevedra es una situación atípica en un ecosistema donde el oxígeno disuelto de la columna de agua no se agota totalmente, dada la alta productividad biológica como consecuencia del proceso de afloramiento costero que allí tiene lugar (Figueiras et al., 1986). Sin embargo, debido a la alta tasa de sedimentación y carga orgánica en los fondos debajo de bateas (Tenore y González, 1975; Cabanas et al., 1979) se produce un ambiente reductor en la interfase agua-sedimento en estas zonas, y a nivel de poros, generándose condiciones anóxicas.
Relaciones entre las propiedades del sedimento y las formas químicas del hierro
Los coeficientes de correlación de Spearman (r) entre las propiedades del sedimento y el FeT confirman la influencia del tamaño de grano y el efecto diluyente de los carbonatos en el contenido del mismo (tabla 5). En general, las correlaciones del FeT son positivas y estadísticamente significativas con la materia orgánica y el contenido en fango, y son negativas y estadísticamente significativas con las fracciones más gruesas y el contenido de carbonato cálcico. Se han señalado resultados similares sobre el FeT en trabajos previos en otras Rías Baixas (Rubio et al., 2001). La materia orgánica juega un papel fundamental en el DOP en la Ría de Pontevedra. La correlación positiva significativa entre el DOP y la materia orgánica permite sugerir que ésta es el factor limitante en la génesis de pirita, no así el Fe reactivo por presentar una correlación negativa baja con el DOP indicando que no ha sido utilizado en su totalidad para la formación de pirita. La especiación del Fe también está influenciada por la materia orgánica, lo cual se corrobora por la correlación negativa significativa con el Fe reactivo. Esto indica que durante el proceso de descomposición orgánica se generan las condiciones para que se convierta Fe reactivo en Fe pirítico, proceso que será más intenso en aquellas zonas que presenten condiciones reductoras de potencial más negativo. En consecuencia, aumentan los valores del DOP con la profundidad en el registro sedimentario, alcanzando los máximos en las zonas con bateas, especialmente las ubicadas en la parte interna de la ría.
Implicaciones del cultivo del mejillón en bateas en la sedimentología y geoquímica del hierro
En la tabla 6 se muestran los resultados de la comparación, a través del análisis de varianza de una vía (ANOVA), entre las zonas con bateas (biodepósitos) y las áreas no sujetas al cultivo del mejillón en función de los parámetros estudiados. Se observa que existen diferencias estadísticamente significativas entre ambos sectores en cuanto a las propiedades generales del sedimento (excepto en gravas), las formas químicas del Fe (excepto Fe reactivo) y el DOP.
Las zonas libres de bateas se caracterizaron por presentar mayores contenidos de carbonatos y un predominio de las fracciones más gruesas en el sedimento. Además, la fracción geoquímica del Fe dominante fue la asociada a los silicatos, característica común en la mayor parte de los sedimentos marinos y, a su vez, el DOP encontrado fue relativamente bajo. Estas condiciones son típicas de ambientes con poca actividad diagenética, donde el contexto deposicional de la pirita corresponde a aguas bien oxigenadas propias de sedimentos marinos "normales" (Berner, 1981; Raiswell et al., 1988). Por el contrario, en las zonas con bateas son más elevados los contenidos en fango, materia orgánica y DOP, y la forma química del Fe dominante fue el Fe pirítico. Este panorama configura en los fondos bajo bateas un ambiente muy reductor con una intensa actividad diagenética que permite una mayor reactividad y movilización del Fe en el sedimento. Por eso el Fe reactivo, cuyos valores son muy cercanos entre ambas zonas, se transforma en Fe pirítico o reacciona con compuestos orgánicos más rápidamente y en mayor proporción en las zonas con bateas que en las áreas no utilizadas para el cultivo. Ahora bien, entre los testigos correspondientes a los fondos con bateas la magnitud de las variables y la intensidad de los procesos geoquímicos no son iguales. Estas diferencias están asociadas a su ubicación en la ría más que a la antigüedad de las bateas. Esto se explica por la influencia del sistema de corrientes y configuración de los fondos de la ría en los procesos sedimentarios de la misma. La circulación del agua se hace más lenta hacia la parte interna (Rey, 1993; Durán et al., 2000), por lo tanto, en estos sectores menos energéticos se acumulará más material fino enriquecido orgánicamente, como es el caso del testigo P7. Esta influencia se aprecia también en los testigos P5 y P6 (area sin bateas), cuyo alto contenido en fango en la superficie puede deberse a su posición axial en la ría y, consecuente, mayor batimetría (superior a 30 m). En el sector medio, donde se localiza el testigo P9 (zona con bateas más antiguas), al ser más energético que la parte interna de la ría, la acumulación de finos y materia orgánica es menor, lo que conlleva condiciones menos reductoras.
Un condicionante físico de este comportamiento geoquímico es que la materia orgánica juega un doble papel. Por un lado aísla el poro del medio y, por otro, consume el oxígeno del agua del poro creando las condiciones reductoras necesarias para la formación de pirita. En este caso se hace evidente que los testigos situados fuera de la influencia de las bateas son más arenosos (y más porosos) y el agua intersticial presenta condiciones oxidantes, próximas al agua del medio, debido a una circulación del agua por los poros. En cambio, los testigos influenciados por las bateas son más finos y más orgánicos, encontrándose las condiciones ideales para la formación de pirita.
Agradecimientos
Los autores quieren agradecer los comentarios y sugerencias de tres revisores anónimos que han contribuido a mejorar significativamente este trabajo. Este trabajo es parte de los proyectos REN2003-02822 MAR, REN2003-03233 MAR, VEM2003-20093-C03-03 del MCYT y PGDIT03RMA 30101PR de la Xunta de Galicia. Trabajo n° 321 del Grupo de Geología Marina y Ambiental (XM2) de la Universidad de Vigo.
Referencias
Álvarez-Iglesias, P., Rubio, B. and Vilas, F. (2003a). Pollution in intertidal sediments of San Simón Bay (Inner Ría de Vigo, NW of Spain): Total heavy metal concentrations and speciation. Mar. Pollut. Bull., 46: 491-521. [ Links ]
Álvarez-Iglesias, P., Rubio, B. and Vilas, F. (2003b). Grado de piritización de metales traza en sedimentos intermareales de la Ensenada de San Simón (parte interna de la Ría de Vigo, Noroeste de España). In: F. Vilas, B. Rubio, J.B. Diez, G. Francés, A.M. Bernabeu, E. Fernández, D. Rey and G. Rosón (eds.), 4th Symposium on the Atlantic Iberian Continental Margin, Spec. Vol. Thalassas, 19(2b): 73-75. [ Links ]
Arbones, M., Andrade, M., Marcet, P. y Montero, M. (1992). Niveles de materia orgánica, nitrógeno y fósforo depositados por efluentes en la zona de costa de la Ría de Pontevedra. Thalassas, 10: 59-69. [ Links ]
Barreiro, R. (1991). Estudio de metales pesados en medio y organismos de un ecosistema de ría (Pontedeume, A Coruña). Tesis doctoral, Universidad de Santiago de Compostela, 227 pp. [ Links ]
Belzunce-Segarra, M., Bacon, J., Prego, R. and Wilson, M. (1997). Chemical forms of heavy metals in surface sediments of the San Simón Inlet, Ría de Vigo, Galicia. J. Environ. Sci. Health, A32(5): 1271-1292. [ Links ]
Berner, R. (1970). Sedimentary pyrite formation. Am. J. Sci., 268: 1-23. [ Links ]
Berner, R. (1981). A new geochemical classification of sedimentary environments. J. Sedimen. Petrol., 51(2): 359-365. [ Links ]
Berner, R. (1984). Sedimentary pyrite formation: An update. Geochim. Cosmochim. Acta, 48: 605-615. [ Links ]
Berner, R., Westrich, J., Graber, R., Smith, J. and Martens, C. (1978). Inhibition of aragonite precipitation from supersaturated seawater. A laboratory and field study. Am. J. Sci., 278: 816-837. [ Links ]
Cabanas, J., Mariño, J., Pérez, A. y Román, G. (1979). Estudio del mejillón y de su epifauna en los cultivos flotantes de la Ría de Arousa. III. Observaciones previas sobre la retención de partículas y la biodeposición de una batea. Bol. Inst. Esp. Oceanogr. 268: 45-50. [ Links ]
Cabanas, J., González, J. and Iglesias, M. (1982). Physico-chemical conditions in winter in the Ría of Pontevedra (NW Spain) and their influences on contamination. ICES CMIE: 53. [ Links ]
Calvert, S. and Karlin, R. (1991). Relationships between sulphur, organic, and iron in the modern sediments of the Black Sea. Geochim. Cosmochim. Acta, 55: 2483-2490. [ Links ]
Carreón, L., Huerta-Díaz, M., Nava-López, C. and Siqueiros, A. (2001). Mercury and silver concentrations in sediments from the port of Ensenada, Baja California, Mexico. Mar. Pollut. Bull., 42(5): 415-418. [ Links ]
Chamberlain, J., Fernandes, T., Read, P., Nickell, T and Davies, I. (2001). Impacts of biodeposits from suspended mussel (Mytilus edulis L.) culture on the surrounding surficial sediments. ICES J. Mar. Sci., 58: 411-416. [ Links ]
Durán, R., García-Gil, S. y Vilas, F. (2000). Aplicación del Sonar de Barrido Lateral a la cartografía de fondos marinos. Ejemplo de la Ría de Pontevedra (Galicia, NO España). J. Iberian Geol., 26: 45-66. [ Links ]
Ferdelman, T., Church, T. and Luther, G. (1991). Sulfur enrichment of humic substances in a Delaware salt marsh core. Geochim. Cosmochim. Acta, 55: 979-988. [ Links ]
Figueiras, F., Niell, F. y Zapata, M. (1985). Hidrografía de la Ría de Pontevedra (NO de España) con mención especial al banco de Placeres. Invest. Pesq., 49: 451-472. [ Links ]
Figueiras, F., Niell, F. y Mouriño, C. (1986). Nutrientes y oxígeno en la Ría de Pontevedra (NO de España). Invest. Pesq., 50: 97-115. [ Links ]
García-Gil, S. (2002). A brand new laboratory for shallow gas: The Rias Baixas (Spain). 7th International Conference. Gas in Marine Sediments. Azarbaijan National Academy of Science Geology Institute, 7-12 October, pp. 61-63. [ Links ]
García-Gil, S., Vilas-Martin, F., Muñoz, A., Acosta, J. and Uchupi, E. (1999). Quaternary sedimentation in the Ría de Pontevedra (Galicia), Northwest Spain. J. Coast. Res., 15: 1083-1090. [ Links ]
García-Gil, S., Durán, R. and Vilas, F. (2000). Side scan sonar imagen and geologic interpretation of the Ría de Pontevedra seafloor (Galicia, NW Spain). Sci. Mar. (Barc.), 64(4): 393-402. [ Links ]
Goldhaber, M. and Kaplan, I. (1974). The sulfur cycle. In: M. Golhaber (ed.), Marine Chemistry. Wiley, New York, pp. 559-655. [ Links ]
Guitián, F. y Carballas, T. (1976). Técnicas de Análisis de Suelos. Ed. Pico Sacro, Santiago de Compostela, 288 pp. [ Links ]
Hartstein, N.D. and Rowden, A.A. (2004). Effect of biodeposits from mussel culture on macroinvertebrate assemblages at sites of different hydrodynamic regime. Mar. Environ. Res., 57: 339-357. [ Links ]
Hayakawa, Y., Kobayashi, M. and Izawa, M. (2001). Sedimentation flux from mariculture of oyster (Crassostrea gigas) in Ofunato estuary, Japan. J. Mar. Sci., 58: 435-444. [ Links ]
Heilskov, A. and Holmer, M. (2001). Effects of benthic fauna on organic matter mineralization in fish-farm sediments: Importance of size and abundance. J. Mar. Sci., 58 : 427-434. [ Links ]
Huerta-Díaz, M. (1989). Geochemistry of trace metals associated with sedimentary from anoxic marine environments. Ph.D. thesis, Texas A & M University, 299 pp. [ Links ]
Huerta-Díaz, M. and Morse, J. (1990). A quantitative method for determination of trace metal concentrations in sedimentary pyrite. Mar. Chem., 29: 119-144. [ Links ]
Huerta-Díaz, M. and Morse, J. (1992). Pyritization of trace metals in anoxic marine sediments. Geochim. Cosmochim. Acta, 56: 2681-2702. [ Links ]
Ibarra, E. y Prego, R. (1997). La Ría de Pontevedra: Revisión de su conocimiento. Monogr. Química Oceanogr., 1: 55-87. [ Links ]
Informe del Proyecto PGIDT99 MAR AE (2001). Procesos biogeoquímicos y comunidades bentónicas en fondos de rías bajo bateas de mejillón. Departamentos de Biología Animal y Química Agrícola. Universidad de Santiago de Compostela. [ Links ]
Jaramillo, E., Bertrán, C. and Bravo, A. (1992). Mussel biodeposition in an estuary in southern Chile. Mar. Ecol. Prog. Ser., 82: 85-94. [ Links ]
Lebron, I. and Suarez, D. (1996). Calcite nucleation and precipitation kinetics as affected by dissolved organic matter at 25°C and pH > 7.5. Geochim. Cosmochim. Acta, 60: 2765-2776. [ Links ]
León, I., Rubio, B. y Méndez, G. (2001). Formas químicas de metales pesados en testigos de sedimentos de la Ría de Pontevedra (NO España). Taller y Tertulia en Oceanografía. Congreso Interdisciplinar en Ciencias del Mar. Universidad de Vigo, 19-23 de noviembre, 9. [ Links ]
López-Jamar, E. (1978a). Primeros datos sobre la biomasa y la composición del bentos infaunal de la Ría de Pontevedra, en relación con el contenido en materia orgánica del sedimento. Bol. Inst. Esp. Oceanogr., 4 (240): 57-69. [ Links ]
López-Jamar, E. (1978b). Macrobentos infaunal de la Ría de Pontevedra. Bol. Inst. Esp. Oceanogr., 4: 111-130. [ Links ]
Lückge, A., Ercegoval, M., Strauss, H. and Littke, R. (1999). Early diagenetic alteration of organic matter by sulphate reduction in Quaternary sediments from the northeastern Arabian Sea. Mar. Geol., 158: 1-13. [ Links ]
Luther, G. (1991). Pyrite synthesis polysulfide compounds. Geochim. Cosmochim. Acta, 55: 2839-2849. [ Links ]
Luther, G., Shellenbarger, P. and Brendel, P. (1996). Dissolved organic Fe (III) and Fe (II) complexes in salt marsh porewaters. Geochim. Cosmochim. Acta, 60: 951-960. [ Links ]
Macías, F., Fernández de Landa, J.L. y Calvo de Anta, R. (1991). Composición química y mineralógica de biodepósitos bajo bateas de mejillón. Datos para la evaluación de su uso como fertilizante y/o enmendante de suelos de Galicia. Thalassas, 9: 23-29. [ Links ]
Marcet, P. (1994). Contribución al estudio de la contaminación de la Ría de Vigo. Contenido y distribución de nutrientes y metales pesados. Tesis doctoral, Universidad de Vigo, 287 pp. [ Links ]
Morse, J. and Luther, G. (1999). Chemical influences on trace metalsulfide interactions in anoxic sediments. Geochim. Cosmochim. Acta, 63(19/20): 3373-3378. [ Links ]
Morse, J. and Mackenzie, F. (1990). Geochemistry of Sedimentary Carbonates. Elsevier, Amsterdam, 707 pp. [ Links ]
Morse, J. and Wang, Q. (1997). Pyrite formation under conditions approximating those in anoxic sedimens. II. Influence of precursor iron minerals and organic matter. Mar. Chem., 57: 187-193. [ Links ]
Morse, J., Millero, F., Cornwell, J. and Rickard, D. (1987). The chemistry of the hydrogen sulfide and iron sulfide systems in natural waters. Earth Sci. Rev., 24: 1-42. [ Links ]
Müller, A. (2002). Pyritization of iron and trace metals in anoxic fjord sediments (Nordsvannet fjord, western Norway). Appl. Geochem., 17: 923-933. [ Links ]
Muramoto, J., Honjo, S., Fry, B., Howarth, R. and Cisne, J. (1991). Sulfur, iron and organic carbon fluxes in the Black Seasulfur isotopic evidence for origin of sulfur fluxes. Deep-Sea Res., 38: S1151-S1187. [ Links ]
Nava-López, C. and Huerta-Díaz, M. (2001). Degree of trace metal pyritization in sediments from the Pacific coast of Baja California, Mexico. Cienc. Mar., 27(2): 289-309. [ Links ]
Nombela, M., Vilas, F. and Evans, G. (1995). Sedimentation in the mesotidal Rías Bajas of Galicia (north-western Spain): Ensenada de San Simón. Inner Ría de Vigo. Int. Assoc. Sedimentol. Spec. Publ., 24: 295-302. [ Links ]
Piron, M., Pineau, A. and Mabele, R. (1990). Sediment, parameters and distribution of metals in fine sediments of Loire estuary. Water, Air and Soil Pollut., 50: 267-277. [ Links ]
Raiswell, R. and Berner, R. (1985). Pyrite formation in euxinic and semi-euxinic sediments. Am. J. Sci., 285: 710-724. [ Links ]
Raiswell, R., Buckley, F., Berner, R. and Anderson, T. (1988). Degree of pyritization of iron as a paleoenvironmental indicator of bottom-water oxygenation. J. Sedimen. Petrol., 58: 812-819. [ Links ]
Rey, J. (1993). Relación morfosedimentaria entre la plataforma continental de Galicia y las Rías Bajas y su evolución durante el cuaternario. Publ. Esp. Inst. Esp. Oceanogr., 17: 232 pp. [ Links ]
Roychoudhury, A.N., Kostka, J.E. and Van Cappellen, P. (2003). Pyritization: A palaeoenvironmental and redox proxy reevaluated. Estuar. Coast. Shelf Sci., 57 (5-6): 1183-1193. [ Links ]
Rubio, B., Nombela, M., Vilas, F., Alejo, I., García-Gil, S., García-Gil, E. y Pazos, O. (1995). Distribución y enriquecimiento de metales en sedimentos actuales de la parte interna de la Ría de Pontevedra. Thalassas, 11: 35-45. [ Links ]
Rubio, B., Gago, L., Vilas, F., Nombela, M., García-Gil, S., Alejo, I. y Pazos, O. (1996). Interpretación de tendencias históricas de contaminación por metales pesados en testigos de sedimentos de la Ría de Pontevedra. Thalassas, 12: 137-152. [ Links ]
Rubio, B., Nombela, M. and Vilas, F. (2000a). Geochemistry of major and trace elements in sediments of the Ría de Vigo (NW Spain): Assessment of metal pollution. Mar. Pollut. Bull. 40, (11): 986-980. [ Links ]
Rubio, B., Nombela, M. y Vilas, F. (2000b). La contaminación por metales pesados en las Ría Baixas gallegas: Nuevos valores de fondo para la Ría de Vigo (NO de España). J. Iberian Geol., 26: 121-149. [ Links ]
Rubio, B., Pye, K., Rae, J. and Rey, D. (2001). Sedimentological characteristics, heavy metal distribution and magnetic properties in subtidal sediments, Ría de Pontevedra, NW Spain. Sedimentology, 48: 1277-1296. [ Links ]
Tenore, K. and González, N. (1975). Food chain patterns in the Ría de Arousa, Spain: An area of intense mussel aquaculture. 10th European Symposium of Marine Biology, Ostend, Belgium, 17-23 September, 12: 601-619. [ Links ]
Vilas, F., (2002). Rías and tidal-sea stuaries. Chap. 11.6.3. In: UNESCO-EOLSS (ed.), Knowledge for Sustainable Development, an Insight into the Encyclopedia of Life Support Systems. Vol. II. UNESCO-EOLSS, Oxford, UK, pp. 799-829. [ Links ]
Vilas, F., García-Gil, G., García-Gil, S., Nombela, M., Alejo, I., Rubio, B. y Pazos, O. (1996). Cartografía de sedimento submarinos, Ría de Pontevedra. E: 1:50000. Xunta de Galicia, Consellería de Pesca, Marisqueo e Acuicultura, 39 pp. [ Links ]
Vilas, F., García-Gil, S., García-Gil, E., Nombela, M., Alejo, I., Francés, G. y Méndez, G. (1999). Cartografía de sedimentos submarinos, Ría de Arousa. E: 1:50000. Ed. Xunta de Galicia, Consellería de Pesca, Marisqueo e Acuicultura, 31 pp. [ Links ]
Wang, Q. and Morse, J. (1996). Pyrite formation under conditions approximating those in anoxic sediments. I. Pathway and morphology. Mar. Chem., 52: 99-121. [ Links ]
Wijsman, J., Middelburg, J. and Heip, C. (2001). Reactive iron in Black Sea sediments: Implications for iron cycling. Mar. Geol., 172: 167-180. [ Links ]
Wilkin, R. and Barnes, H. (1996). Pyrite formation by reactions of iron monosulfides with dissolved inorganic and organic sulfur species. Geochim. Cosmochim. Acta, 60(21): 4167-4179. [ Links ]
Wilkin, R., Arthur, M. and Dean, W. (1997). History of water-column anoxia in the Black Sea indicated by pyrite framboid size distributions. Earth Planet. Sci. Lett., 148: 517-525. [ Links ]