Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Ciencias marinas
versão impressa ISSN 0185-3880
Cienc. mar vol.30 no.2 Ensenada Jun. 2004
Artículos
Embriogénesis y desarrollo larvario intra-capsular de Plicopurpura pansa (Gould, 1853) (Prosobranchia, Muricidae) en condiciones de laboratorio
Embryonic and intracapsular larval development of Plicopurpura pansa (Gould, 1853) (Prosobranchia, Muricidae) under laboratory conditions
Ludwig C.A. Naegel1 y Ma. del Carmen Gómez del Prado-Rosas2
1 Departamento de Biología Experimental Centro Interdisciplinario de Ciencias Marinas (CICIMAR-IPN). Apartado postal 592, La Paz, Baja California Sur, CP 23000, México. E-mail: lnaegel@cibnor.mx
2 Departamento de Biología Marina Universidad Autónoma de Baja California Sur Apartado postal 19-B La Paz, Baja California Sur, México. E-mail: mcgomez@uabcs.mx
Recibido en abril de 2003;
aceptado en diciembre de 2003.
Resumen
Se estudió el desarrollo de embriones del murícido marino Plicopurpura pansa (Gould, 1853) hasta su eclosión. Cada hembra depositó alrededor de 150 cápsulas con huevos en un periodo de desove de 10 semanas. Los huevos tuvieron segmentación espiral seguida de una gastrulación por epibolia con la formación de larvas trocóforas no típicas, y veliger. Los embriones se alimentaron del vitelo contenido en el huevo. No se observó la presencia de huevos nutritivos. En 13% de las cápsulas, se presentaron diferentes estadios de desarrollo embrionario o larval en una misma cápsula. El desarrollo intra-capsular terminó a una temperatura de 21-23°C en un periodo de 5 a 8 semanas después de la puesta de la cápsula con la eclosión de larvas veliger planctotróficas.
Palabras clave: gasterópodos, murícidos, Plicopurpura pansa, embriogénesis, desarrollo intra-capsular.
Abstract
The embryonic development of the marine muricid Plicopurpura pansa (Gould, 1853) until hatching is described. Each female spawned about 150 egg capsules in a 10-week period. The egg showed spiral segmentation, followed by gastrulation through epiboly, the formation of a non-typical trochophore and veliger larva. The embryos fed on the egg yolk. Nurse eggs were not observed. In 13% of the egg capsules, different embryonic or larval stages of development were found in the same capsule. At 21-23°C the intracapsular development was completed with the hatching of planktotrophic veliger larvae after a period of 5 to 8 weeks.
Key words: gastropods, muricids, Plicopurpura pansa, embryogenesis, intracapsular development.
Introducción
El caracol marino púrpura Plicopurpura pansa (Gould, 1853), de acuerdo con Wellington y Kuris (1983) y Kool (1993) sinónimo de Purpura pansa (Gould, 1853), vive en playas rocosas intermareales expuestas a alto impacto de oleaje marino y en el Océano Pacífico se distribuye desde la costa noroeste de México (Baja California Sur) (Clench, 1947; Keen, 1971) hasta el norte de Perú (Peña, 1970; Paredes et al., 1999).
Desde la época prehispánica, la tinta de P. pansa ha sido explotada por los indígenas para teñir sus telas y vestidos tradicionales; sin embargo, esta tradición se ha mantenido sólo en algunas regiones del Pacífico mexicano (en los estados de Oaxaca y Michoacán) y en la comunidad de los Borucas en Costa Rica (Turok, 1999). Actualmente, en la búsqueda de colorantes naturales, la explotación comercial del caracol púrpura por su tinte purpura tiriano ha alcanzado niveles tales que su supervivencia se ha visto amenazada, por lo que el gobierno mexicano (Anónimo, 1988, 1994) declaró a P. pansa como una especie bajo protección especial.
A pesar de la importancia de P. pansa como recurso natural potencial para tinte púrpura tiriano y de su nivel actual de recuperación, persisten dudas acerca de aspectos básicos de su biología: (a) ¿A qué edad y talla alcanzan estos organismos su madurez sexual y su primera reproducción en la naturaleza? (b) ¿En qué estación o época del año ocurre la reproducción de esta especie y la puesta de sus cápsulas en las costas de Baja California Sur? (c) ¿Cuántos periodos de puesta de cápsulas ocurren en un año? (d) ¿Cuál es su tipo de desarrollo embrionario, cuánto tiempo tardan en eclosionar y qué tamaño alcanzan las larvas?
Esta información es indispensable para desarrollar técnicas que ayuden a la recuperación de las poblaciones naturales, haciendo posible su restablecimiento como especies comerciales, ayudando también a amortiguar el efecto de la sobreexplotación. Hasta ahora, poco se conoce de la embriogénesis y desarrollo larvario intra-capsular de esta especie protegida, debido a los problemas que se presentan para obtener, en condiciones naturales, cápsulas con huevos de una determinada edad. Sin embargo, existen observaciones preliminares presentadas en una reunión nacional (Acevedo-García et al., 1993), y un trabajo de Acevedo-García (1995). En este estudio se presentan resultados preliminares sobre la embriogénesis y desarrollo larvario intra-capsular de P. pansa, a partir de cápsulas con huevos obtenidas en condiciones de laboratorio.
Material y métodos
Se cultivaron adultos de P. pansa de ambos sexos en 10 garrafones de vidrio sin fondo invertidos y cada uno con 10 L de agua de mar (con 28-36%o de salinidad, intercambiada a diario con agua a temperatura ambiente de 20-28°C, con una temperatura en el laboratorio de 20-23°C y 12 horas de luz/ obscuridad). Se mantuvieron 30 animales en cada frasco, alimentándolos diariamente a saciedad con cantidades ilimitadas de calamar, mejillones o corazón de res. Las cápsulas estudiadas fueron puestas de abril a julio de 2001. La fecha de la puesta se marcó en la pared externa de los frascos. Para los estudios morfológicos las cápsulas se sacaron periódicamente y se fijaron en frascos viales con formaldehído al 4% neutralizado. Las cápsulas fijadas se abrieron, y los huevos, embriones y larvas fueron colocados en canastillas de vidrio con malla de plancton de 50 |jm. Se tiñeron con carmín acético, se aclararon en salicilato de metilo y se montaron con resina sintética en preparaciones permanentes, de acuerdo con la metodología propuesta por Schmidt (1988). La descripción de las diferentes estructuras se realizó con el microscopio compuesto Zeiss-Axiomate. Las imágenes se digitalizaron con el programa PCITV98 y se editaron con COREL Photopaint v. 9. En cada estadio de desarrollo se midieron, con un ocular micrométrico, el largo (distancia del polo animal al polo vegetal) y ancho (diámetro) de 25 embriones o larvas, pero solamente los de 19 organismos en fase de segmentación. Se registraron (en micras) talla media, rango y desviación estándar para cada etapa de desarrollo. En las figuras la escala corresponde a las tallas medias.
Resultados
Las conchas de los gastrópodos murícidos carecen de dimorfismo sexual por lo que, para la determinación del sexo, es necesario revisar las partes blandas buscando la presencia o ausencia de pene, teniendo la precaución de no dañar a los animales. Las hembras depositaron en las paredes de los frascos y bajo el nivel del agua de 1 a 20 cápsulas diarias. Los caracoles tendieron a unir sus cápsulas formando una gran masa comunal, lo cual dificultó distinguir cuál hembra depositó determinadas cápsulas. Después de la oviposición, las cápsulas mostraron cambios de color que están relacionados con el grado de desarrollo de los embriones. Inicialmente las cápsulas son blanquecinas y, en dos días, cambian a su color a blanco-cremoso. Después de dos a tres semanas de desarrollo, presentan un color café claro que luego se obscurece. Ocasionalmente algunas cápsulas tomaron un color púrpura y éstas contenían embriones muertos. Conforme fueron pasando los días, las características de cada etapa de desarrollo del caracol púrpura fueron las siguientes:
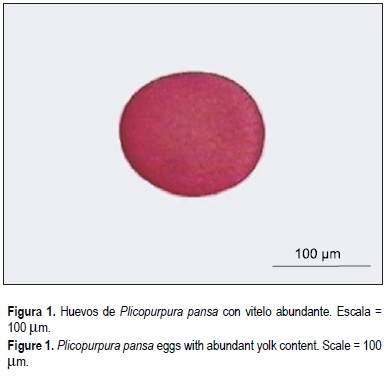
Día 0: Ovocitos/huevos. Huevos telolécitos. No se observa núcleo debido a la cantidad de gránulos de vitelo que ocupan la totalidad del volumen celular (fig. 1). Diámetro medio: 149.8 um (DE ± 6.7, rango: 137-159 µm).
Días 3-7: Segmentación. Segmentación espiral con un macrómero vegetativo lleno de vitelo y más de 20 micrómeros de tamaño variable con núcleos evidentes en el polo animal, los mayores adyacentes al macrómero y los más pequeños distales (fig. 2a, b). Largo: 198 µm (DE ± 88.5, rango: 166-282 µm). Ancho: 172 µm (DE ± 58.6, rango: 128-343 µm).
Días 8-12: Gastrulación. En embriones con gastrulación inicial, los micrómeros periféricos se aplanan para iniciar su desplazamiento mediante epibolia (fig. 3a, b). En aquellos donde ésta ha terminado, se observa el blastoporo (fig. 3c, d). Largo: 198 µm (DE ± 88.5, rango: 166-282 µm). Ancho: 172 µm (DE ± 58.6, rango: 128-343 µm). Posteriormente inicia la formación de los llamados riñones larvarios que, de acuerdo con Fretter and Graham (1994), son proyecciones del ectodermo de una o varias células en las que se acumulan productos de excreción durante la fase embrionaria. Se observa la presencia de cilios en el blastoporo, en las protuberancias laterales (riñones larvarios) y en el extremo opuesto al blastoporo. Largo: 187 µm (DE ± 57, rango: 147-408 µm). Ancho: 164 µm (DE ± 42.4, rango: 132-361 µm).
Día 15: Larva trocófora. Riñones larvarios bien desarrollados. Cilios presentes en ambos extremos (anterior y posterior) de la larva. Se observan el estomodeo (fig. 4a) y la prototroca. El extremo posterior no es tan redondeado como el anterior, y se observó en él una placa con células planas que se tiñó más fuertemente y que corresponde a la placa de la concha, a partir de la cual se forma la glándula de la concha (fig. 4b). Largo: 242 µm (DE ± 17.2, rango: 210-282 µm). Ancho: 207 µm (DE ± 25.6, rango: 163-289 µm).
Días 17-18: Larva preveliger. Una capa de células aplanadas recorre toda la periferia de la larva y dará origen el ectodermo. Su región anterior es ciliada hasta el inicio de los riñones larvales. Se observa un espacio entre este epitelio ciliado y la zona ligeramente anterior al estomodeo, en el cual se llevará a cabo la formación del velum de la larva veliger, y el epitelio ciliado constituirá el inicio de sus lóbulos (fig. 5a, c, d). Los riñones larvarios son más protuberantes y más alargados, alcanzando casi el extremo posterior de la larva. El estomodeo de la larva preveliger está delimitado por células que van de aplanadas a cúbicas ciliadas (fig. 5b). De la boca hacia la región posterior de la larva se esboza la presencia de una estructura tubular-sacular que termina hacia el vitelo y que corresponderá al futuro tracto digestivo (fig. 5c). El vitelo relacionado con el futuro aparato digestivo es muy diferente a las plaquetas que contenía el macrómero, y presenta un aspecto granular muy fino. Se observaron estatocistos en algunas larvas preveliger. Largo: 262 µm (DE ± 23.7, rango: 222-334 µm). Ancho: 187 µm (DE ± 34.4, rango: 132-238 µm).
Días 19-24: Larva veliger. Las larvas se presentan parcial y totalmente introducidas en la concha, mostrando ésta varias etapas de desarrollo, sin y con espira (protoconcha); las más tempranas muestran el extremo anterior ciliado con un aspecto muy similar al del estadio anterior. También se presentan cilios de la prototroca (fig. 6b), los riñones larvarios son aún notorios (fig. 6a, d), y la región cardiaca aparece como una estructura bipartita (fig. 6e). La calcificación de la protoconcha ya es evidente (fig. 6f). Otras larvas muestran una membrana externa muy teñida (periostraco). Ojos y estatocistos están presentes (fig. 7a, b). Los estatocistos muestran una zona central de aspecto granulado y un epitelio externo con una ornamentación radial a manera de rayos de bicicleta. Algunas larvas presentan el proceso de torsión completo. El opérculo se observa como una zona alargada, muy delgada y refringente en el lado externo del pie. El pie está formado por células cúbicas ciliadas en su extremo distal (fig. 8a, b). Largo: 262 µm (DE ± 18.2, rango: 249-271 µm). Ancho: 194 µm (DE ± 36.3, rango: 141-217 µm).
Días 27-56. En las larvas que muestran concha más desarrollada se observó un espacio considerable entre ésta y el cuerpo de la larva. El manto es visible en la pared interna de la abertura de la concha, con áreas blanquecinas como si fueran células secretoras. Es notorio el velum bilobulado y ciliado con células que van de cúbicas a cilíndricas. En ambos lados de la región anterior de la larva se observaron pequeños bordes con cilios más grandes que los demás, y que corresponden a los cilios preorales del velum. Los cilios del velum son muy largos y se dirigen hacia la abertura de la concha (fig. 8b). En algunas larvas se observa el complejo ojo-estatocisto rodeado por un epitelio plano. Es notoria la presencia de tentáculos relativamente largos y aparentemente no asociados directamente a los ojos, ya que éstos se ven muy separados de ellos. En larvas con mayor desarrollo el pie está constituido por paquetes musculares cortos que lo hacen más grueso y grande, con pigmentación roja, y el epitelio cúbico ya no es ciliado.
Hay fibras musculares que corren del pie hacia el extremo opuesto y que representan al músculo retractor, que se hace más ancho en las larvas más desarrolladas (fig. 8c). Inmediatamente posteriores a los cilios preorales, se encuentran los riñones larvales de tamaño notablemente más reducido y aparentemente iniciando su absorción. Boca ligeramente anterior al inicio de los riñones. El vitelo relacionado con el futuro aparato digestivo mantiene el aspecto granular muy fino, acompañado de gránulos de pigmento oscuro, también muy fino y de arreglo disperso. En la parte posterior de la larva el vitelo es menos abundante, por lo que se ve un mayor espacio entre éste y la concha, observándose un pigmento rojo donde antes había vitelo. Se observa un cambio en el aspecto de lo que antes era vitelo, tornándose ahora más vesicular y de tonalidad más clara: la glándula digestiva (figs. 7b, 8c). La porción terminal del vitelo-glándula digestiva se encuentra adherida por su pared a la concha. Posible estómago ciliado. Latero-ventralmente, entre la concha y el vitelo fino, se observa una estructura ligeramente alargada constituida por dos regiones que parece ser la región cardíaca de la larva. Presencia de pigmento rojo en las áreas adyacentes. Largo: 188 µm (DE ± 40.4, rango: 153-332 µm). Ancho: 222 µm (DE ± 32.4, rango: 180-343 µm).
Una observación interesante fue que en 13% de las cápsulas estudiadas se encontraron, en la misma cápsula, diferentes estadios de desarrollo: huevos y larvas preveliger.
Discusión
Cada una de las hembras depositó más de 150 cápsulas por estación reproductiva y cada cápsula contenía, en promedio, 400 huevos/embriones, indicando que una hembra produce más de 50,000 huevos/embriones por estación reproductiva (obs. pers., no publicadas). Fecundidades altas en animales van acompañadas de mortalidades larvales altas (Spight, 1976). Una hembra, en promedio, produce tal cantidad de huevos durante su ciclo de vida que asegura que al menos una hembra de su descendencia sobreviva y se reproduzca, como Spight (1975) dedujo de estudios sobre fecundidad, estructura de tallas y conteos de juveniles de Thais lamellosa (Gmelin).
En relación con el cambio de color de las cápsulas observado a lo largo del desarrollo, de blanquecino a amarillento y a café oscuro, éste se debe al desarrollo de embriones/larvas vivos. Los embriones/larvas en cápsulas de color púrpura corresponden a organismos no viables. Al respecto, Gallardo (1973) y Riquelme y Chávez (1991) mencionaron que el color púrpura de las cápsulas de huevos no viables del murícido Concholepas concholepas (Brugière, 1789), se debía a su contaminación por bacterias. Asimismo, D'Asaro (1966) identificó que el color púrpura de las cápsulas de Thais haemastoma floridana (Conrad, 1837) se debía a que contenían embriones muertos. Solamente las cápsulas recién puestas, dañadas, cambian el color de blanquecino a púrpura. En cápsulas con el desarrollo avanzado no se nota el cambio de la coloración. Sin embargo esto contradice las observaciones de Turok et al. (1988), quienes mencionaron que el cambio al color púrpura de las cápsulas con huevos de P. pansa era debido a la maduración de los embriones.
Benkendorff et al. (2000) mencionaron que los precursores de la tinta observados en cápsulas del murícido australiano Dicathais orbita (Gmelin, 1791) podrían tener propiedades antimicrobiales cuyos efectos disminuyen con el desarrollo. Cerca de la eclosión las cápsulas desarrollan el color púrpura.
En cuanto a la talla de huevos y larvas así como al número de éstos contenido por cápsula, se puede considerar que en este estudio el promedio coincide el registrado para otros murícidos (tabla 1). Todos los huevos observados de P. pansa estaban fecundados y no se encontraron huevos nutricios, lo que indica un desarrollo dependiente de los recursos vitelinos al igual que lo observado en el murícido C. concholepas (Gallardo, 1973).
Los huevos de P. pansa presentaron segmentación espiral, marcadamente desigual, con la formación de micrómeros en el polo animal y un macrómero de mayor tamaño debido a la cantidad de vitelo contenido en el polo vegetal, similar a lo descrito en otros muricidos como C. concholepas (Gallardo, 1973), T. haemastoma floridana (D'Asaro, 1966), T. haemastoma canaliculata (Roller y Stickle, 1988) y T. chocolata Duclos, 1832 (Bautista et al., 1995). Asimismo, la gastrulación por epibolia se realiza tanto en P. pansa como en las especies antes mencionadas.
Acevedo-García et al. (1993) mencionaron en P pansa una larva trocófora típica similar a la de los bivalvos, cilíndrica, con forma característica de barril, sin embargo no se hace mención de la presencia de los riñones larvarios, lo que nos sugiere una diferencia morfológica. Con relación a la morfología de la larva trocófora, Roller y Stickle (1988) con ayuda del microscopio electrónico de barrido, observaron en T. haemastoma canaliculata una larva distinta a la típica. En este trabajo, el resultado obtenido usando la técnica de tinción de carmín acético fue muy similar al obtenido en T. haemastoma canaliculata por Roller y Stickle (1988), al descrito en C. concholepas por Gallardo (1973), y en T. chocolata por Bautista et al. (1995).
La transición de un estadio embrionario a un estadio larvario de vida libre es más obvia en el sistema excretor. Fretter y Graham (1994) mencionan que la formación de los riñones definitivos en las diferentes especies de gasterópodos puede realizarse mediante el desprendimiento o absorción de los riñones larvarios. En las larvas de P. pansa del presente estudio se observó la reabsorción de los riñones larvarios como lo describe D'Asaro (1966) para T. haemastoma floridana. Por su parte, Gallardo (1973) mencionó que los riñones larvarios de C. concholepas se desprenden aproximadamente dos semanas antes de eclosionar.
En este trabajo la formación de la concha y de algunas estructuras internas de P. pansa se realizó en tiempos más tardíos que los registrados en otros murícidos. Gallardo (1973) observó la presencia de la protoconcha a partir del 10° día de desarrollo en C. concholepas, en contraste con el presente trabajo en el que dicha estructura fue notoria en el día 15 de desarrollo. El pie y opérculo se hicieron presentes a los 19 días, coincidiendo con lo descrito por Gallardo (1973), al igual que la presencia de los ojos y el velum. Es importante mencionar que los ojos variaron en forma, desde simples agregados de células pigmentarias hasta estructuras compactas semilunares o redondeadas.
El músculo rectractor es visible a partir de los 22 días en C. concholepas (Gallardo, 1973), en contraste con los 27 días a los que fueron visibles en P. pansa. El mismo autor menciona que el desarrollo de otras estructuras como el estómago larval, la glándula digestiva, el corazón larval, los estatocistos y los tentáculos con escaso desarrollo, se observan a los 30-31 días del desarrollo. En este trabajo, los estatocistos empiezan a observarse en la etapa preveliger, es decir a los 17 días, y el resto de estructuras a los 27 días. La temperatura de cultivo tiene un impacto significativo en el desarrollo larvario. Este hecho es claro en los estudios con C. concholepas: a una temperatura del agua de 12-14°C, el desarrollo tomó de 60-84 días hasta la eclosión, mientras que a una temperatura de 16.6°C tardó solamente 36 días. El periodo del desarrollo de Xanthochorus cassidiformis (Blainville, 1832) hasta la eclosión a una temperatura de 16-20°C tardó solamente 30-34 días (Gallardo y González, 1994). La temperatura alta del agua acorta el periodo de desarrollo larvario. La temperatura en nuestro laboratorio (21-23°C) fue similar a la temperatura del agua en el campo de enero a marzo, periodo en el que se encontraron cápsulas en el campo. No se conoce la duración del desarrollo intra-capsular hasta la eclosión en el campo. El tiempo de eclosión registrado en nuestros experimentos fue prolongado, y éste pudo deberse a la temperatura fría del agua utilizada en el sistema de cultivo, así como a las variaciones en la temperatura del agua usada en los recambios, la cual de manera excepcional durante pocos días en el verano alcanzó más de 28°C (tabla 1).
Roller y Stickle (1989) encontraron que salinidades bajas retardan el desarrollo intra-capsular del murícido T. haemastoma canaliculata. Gallardo (1994) también demostró el mismo efecto en C. concholepas. Debido a intrusiones de agua dulce en el suministro de agua de mar durante mareas excepcionales, se tuvieron fluctuaciones en la salinidad en el sistema de cultivo, por lo que, en futuros experimentos sobre desarrollo intra-capsular, se tendrá que poner más atención en mantener estables las condiciones de temperatura y salinidad de los sistemas de cultivo.
Como se mencionó antes, en 13% de las cápsulas estudiadas se encontraron diferentes estadios de desarrollo embrionario y larvario en la misma cápsula, pudiendo observarse en la misma cápsula, la presencia de huevos y larvas preveliger. Al respecto, Le Boeuf (1971) describió una situación similar en el patrón de desarrollo intra-capsular de 25% de T. emarginata (Deshayes, 1839) donde las veliger contenidas en una sola cápsula tendían a variar en talla o en estadio de desarrollo, o en ambos. Moore y Sander (1978) describen una situación semejante al encontrar en la masa de huevos, y en la misma cápsula, de Murex pomum (Gmelin, 1791) un desarrollo no sincronizado, eclosionando en un periodo mayor a los 12 días. Algunas cápsulas contenían embriones/larvas de diferentes tallas y de diferentes incrementos en el desarrollo. Estas diferencias pueden deberse a que la fecundación se realiza en diferentes momentos o por variación en las tasas de desarrollo individual.
Agradecimientos
Agradecemos la ayuda indispensable de colegas de Chile, Alemania y los EUA por intercambiar experiencias y enviar literatura al "fin del mundo", además al Consejo Nacional de Ciencia y Tecnología (CONACYT) por el apoyo financiero (proyecto No. 32566-N). Gracias a Carlos Augusto Aguilar Cruz (UABCS) por su colaboración en la preparación de las muestras y a Gerardo Ayala Amezcua (UABCS) por la digitalización y edición de las figuras. Agradecemos también a los revisores anónimos por sus valiosas aportaciones al trabajo. L. Naegel es becario de la COFAA-IPN.
Referencias
Acevedo-García, J. (1995). Aprovechamiento del tinte de Purpura pansa en el Pacífico Mexicano. Secretaría de Medio Ambiente, Recursos Naturales y Pesca (SEMARNAP), Instituto Nacional de Pesca (INP) y Centro Regional de Investigación Pesquera (CRIP)-Patzcuaro, 22 pp. [ Links ]
Acevedo-García, J., Escalante-Cavazos, M.A. y Turok-Wallace, M. (1993). El caracol púrpura. Su uso y manejo en México. Resumen. III. Reunión Nacional para el Estudio del Caracol Púrpura Plicopurpura pansa. Universidad Autónoma de Nuevo León, México, 35 pp. [ Links ]
Anónimo (1988). Diario Oficial de la Federación. Órgano del Gobierno Constitucional de los Estados Mexicanos. Secretaría de Pesca, 30 de marzo 30, pp. 10-12.
Anónimo (1994). Diario Oficial de la Federación. Norma Oficial Mexicana NOM-ECOL-059-1994, que determina las especies y subespecies de flora y fauna silvestres y acuáticas en peligro de extinción, amenazadas, raras y loas sujetas a protección especial y que establece especificaciones para su protección. 16 de mayo de 1994, pp. 2-56. [ Links ]
Bautista, J., Gamarra, C., Silva, I. y Retuerto, F. (1995). Observaciones sobre el desarrollo intercapsular en Thais chocolata (Duclos, 1832) (Gastropoda: Muricidae). Biotempo, 2: 91-96. [ Links ]
Benkendorff, K., Bremner, J.B. and Davis, A.R. (2000). Tyrian purple precursors in the egg masses of the Australian muricid, Dicathais orbita: A possible defensive role. J. Chem. Ecol., 26(4): 1037-1050. [ Links ]
Castilla, J.C. and Cancino, J. (1976). Spawing behaviour and egg capsules of Concholepas concholepas (Mollusca: Gastropoda: Muricidae). Mar. Biol., 37: 255-263. [ Links ]
Clench, W.J. (1947). The genera Purpura and Thais in the western Atlantic. Johnsonia, 2(23): 61-91. [ Links ]
D'Asaro, C.N. (1966). The egg capsules, embryogenesis, and early organogenesis of a common oyster predator, Thais haemastoma floridana (Gastropoda: Prosobranchia). Bull. Mar. Sci., 16(4): 884-914. [ Links ]
Fretter, V. and Graham, G. (1994). British Prosobranch Mollusks. Their Functional Anatomy and Ecology. Revised and updated edition. The Ray Society, London, 820 pp. [ Links ]
Gallardo, C. (1973). Desarrollo intracapsular de Concholepas concholepas (Brugière) (Gastropoda, Muricidae). Museo Nacional de Historia Natural, Santiago de Chile, Publ. Ocas., 16: 3-16. [ Links ]
Gallardo, C.S. (1994). Efecto de diferentes salinidades en la sobrevivencia embrionaria y desarrollo intracapsular del gastrópodo Concholepas concholepas (Brugière, 1789) bajo condiciones de laboratorio. Rev. Biol. Mar., Valparaíso, 29(2): 263-279. [ Links ]
Gallardo, C.S. and Perron, F.E. (1982). Evolutionary ecology of reproduction in marine benthic mollusks. Malacologia, 22(1-2): 109-114. [ Links ]
Gallardo, C.S. y González, K. (1994). Ovipostura y desarrollo intracapsular de Xanthochorus cassidiformis (Blainville, 1832) (Gastropoda, Muricidae) de la costa sur de Chile. Gayana Zool., 58(1): 79-90. [ Links ]
Keen, A.M. (1971). Sea Shells of Tropical West America: Marine Molluscs from Baja California to Peru. Stanford Univ. Press. Stanford, California, 1064 pp. [ Links ]
Kool, S.P. (1993). Phylogenetic analysis of the Rapaninae (Neogastropoda: Muricidae). Malacologia, 35(2): 155-259. [ Links ]
LeBoeuf, R. (1971). Thais emarginata (Deshayes): Description of the veliger and egg capsule. The Veliger, 14(2): 205-211. [ Links ]
Lewis, J.B. (1960). The fauna of the rocky shores of Barbados, West Indies. Can. J. Zool., 38: 391-435. [ Links ]
Moore, E.A. and Sander, F. (1978). Spawning and early life history of Murex pomum (Gmelin, 1791). The Veliger, 20(3): 251-259. [ Links ]
Paredes, C., Huamán, P., Cordoso, F., Vivar, R. y Vera, V. (1999). Estado actual del conocimiento de los moluscos acuáticos en el Perú. Rev. Peruana Biol., 6(1): 5-47. [ Links ]
Peña, G.G.M. (1970). Zonas de distribución de los gasterópodos marinos del Perú. An. Cient. Univ. Nac. Agraria, 8: 153-170. [ Links ]
Ramorino-M., L. (1975). Ciclo reproductivo de Concholepas concholepas en la zona de Valparaíso. Rev. Biol. Mar., Valparaíso, 15(2): 149-177. [ Links ]
Ramorino-M., L. (1979). Conocimiento científico actual sobre reproducción y desarrollo de Concholepas concholepas (Mollusca: Gastropoda: Muricidae). Biol. Pesq. Chile, 12: 59-70. [ Links ]
Riquelme, C.E. and Chavez, P.C. (1991). Colonization of vibrios on developmental stages of Concholepas concholepas (Bruguière, 1789) (Mollusca: Muricidae). In: K. Koop (ed.), Ecology of Marine Aquaculture. Workshop on Research in Aquaculture. Osorno, Chile, International Foundation for Science, Stockholm, pp. 84-95. [ Links ]
Roller, R.A. and Stickle, W.B. (1988). Intracapsular development of Thais haemastoma canaliculata (Gray) (Prosobranchia: Muricidae) under laboratory conditions. Am. Malacol. Bull., 6(2): 189-197. [ Links ]
Roller, R.A. and Stickle, W.B. (1989). Temperature and salinity effects of the intracapsular development, metabolic rates, and survival to hatching of Thais haemastoma canaliculata (Gray) (Prosobranchia: Muricidae) under laboratory conditions. J. Exp. Mar. Biol. Ecol., 125: 235-251. [ Links ]
Schmidt, G.D. (1988). Essentials of Parasitology. 4th ed. W.C. Brown Publ., Dubuque, Iowa, 244 pp. [ Links ]
Spight, T.M. (1975). On a snail's chances of becoming a year old. OIKOS (Copenhagen), 26: 9-14. [ Links ]
Spight, T.M. (1976). Ecology of hatching size for marine snails. Oecologia (Berlin), 24: 283-294. [ Links ]
Turok, M., Sigler-M., A., Hernández-C., E., Acevedo-G., J., Lara-C., R. y Turcott, V. (1988). El Caracol Púrpura. Una Tradición Milenaria en Oaxaca. Secretaría de Educación Pública, Dirección General de Culturas Populares, México, DF, 164 pp. [ Links ]
Turok, M. (1999). El caracol Purpura pansa: Un pequeño gran recurso. Programa Cultural Tierra Adentro. http://www.cnca.gob.mx/cnca/buena/descentra/tierra/mturok.html. [ Links ]
Wellington, G.M. and Kuris, A.M. (1983). Growth and shell variation in the tropical eastern Pacific intertidal gastropod genus Purpura: Ecological and evolutionary implications. Biol. Bull., 164: 518-535. [ Links ]














