Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Ciencias marinas
versão impressa ISSN 0185-3880
Cienc. mar vol.30 no.1b Ensenada Mar. 2004
Artículos
Edad y crecimiento de Lithothamnion muelleri (Corallinales, Rhodophyta) en el suroeste del Golfo de California, México
Age and growth of Lithothamnion muelleri (Corallinales, Rhodophyta) in the southwestern Gulf of California, Mexico
M.G. Rivera1, R. Riosmena-Rodríguez1* y M.S. Foster2
1 Programa en Botánica Marina Departamento de Biología Marina Universidad Autónoma de Baja California Sur Apartado postal 19-B, La Paz, CP 23080, BCS, México. * E-mail: riosmena@uabcs.mx
2 Moss Landing Marine Laboratories. Moss Landing CA 95039, USA.
Recibido en septiembre de 2002;
aceptado en octubre de 2003.
Resumen
El alga coralina no geniculada Lithothamnion muelleri Lenormand ex Rosanoff es comúnmente encontrada formando mantos de rodolitos en zonas someras expuestas al oleaje dentro del suroeste del Golfo de California. Esta especie tiene bandas de crecimiento a todo lo largo de las ramas principales del talo que sugieren un crecimiento periódico y que probablemente podrían ser utilizadas para determinar su tasa de crecimiento y edad. Como parte de la investigación que se está desarrollando sobre los mantos de rodolitos y su ecología, se desarrollaron observaciones sobre la naturaleza de esas bandas en la estructura de las plantas y en experimentos de crecimiento en campo y laboratorio. Se marcaron con alizarina plantas individuales de diferentes clases de talla en el campo y otro conjunto de plantas fue al laboratorio llevado para su análisis. La mitad de las plantas fueron muestreadas después de 6 meses y el resto recolectadas a los 12 meses. Los resultados muestran una tasa de crecimiento de 0.60 mm año-1 en el campo y 0.87 mm año-1 en el laboratorio. Los análisis estadísticos mostraron que no existen diferencias significativas entre las ramas de una planta, ni entre plantas de diferentes tamaños. El crecimiento fue estacional, con mayores tasas en invierno y primavera y menores en verano y otoño. Esto puede explicar la alternancia de bandas claras y obscuras (hasta 4) a lo largo de una rama principal. Las tasas de crecimiento sugieren que las plantas más grandes (p.ej. 15 cm de diámetro) podrían tener más de 100 años de antigüedad.
Palabras clave: edad, crecimiento, Lithothamnion muelleri, rodolitos, Corallinales.
Abstract
The nongeniculate coralline alga Lithothamnion muelleri Lenormand ex Rosanoff is commonly found as a free-living rhodolith in the wave-exposed shallow waters of the southwestern Gulf of California. This species has bands along the main branch axes suggesting that growth is periodic and that may be used to determine age and growth. As part of our ongoing research related to rhodoliths and their ecology, we have made observations on the nature of these bands based on their structure in entire plants and on field and laboratory growth experiments. Individual plants from different size classes were tagged, stained with alizarin and returned to the field, while another set was tested in the laboratory. Half of the plants were sampled after 6 months and the rest after 12 months. The data indicate that this species grew at a rate of 0.60 mm yr-1 in the field and 0.87 mm yr-1 in the laboratory. There were no significant differences among branches within a plant, or among plants of different size. Growth was seasonal, with high rates in winter and spring, and low rates in summer and fall. This may explain the observed alternating light-dark bands (up to 4) along branch axes. The growth rates suggest that larger plants (ca 15 cm diameter) may be over 100 years old.
Key words: age, growth, Lithothamnion muelleri, rhodoliths, Corallinales.
Introducción
Las algas coralinas son importantes componentes ecológicos y geológicos de diversos ambientes, y se ha establecido que comparadas con las algas blandas, su producción primaria es baja pero son eficientes productoras de carbonato de calcio (Littler et al., 1991). Existen pocos trabajos sobre su contribución a la producción de carbono orgánico y carbonato de calcio o acerca de su tasa de crecimiento, debido principalmente a problemas metodológicos y taxonómicos (Payri, 1997). Foster (2001) ha sugerido que no existen estudios sobre edad y crecimiento de muchas especies de rodolitos y lo que se conoce en este sentido se basa en métodos de validación dudosas. En función de la depositación diferencial, los rodolitos se consideran estructuras con potencial para caracterizar paleoambientes (Bosellini y Ginsburg, 1971; Prager y Ginsburg, 1989; Foster et al., 1997). Wehrmann (1998) observó bandas claras y obscuras en Lithothamnion corallioides (P. y H. Crouan) P. y H. Crouan y Phymatoliton calcareum (Pallas) Adey y McKibbin, y determinó que éstas representan un ciclo anual con mayor densidad de magnesio en la banda clara y menor en la obscura, depositándose la primera en el verano y la última en el invierno. Además, indirectamente estimó para estas especies una tasa de crecimiento de 0.310 a 0.620 mm año-1. Adey y Macintyre (1973), asumiendo un crecimiento continuo, dedujeron edades de hasta 800 años para rodolitos de zonas profundas. Bosence (1983), basado en el mismo método, estimó edades de 600 años para rodolitos de 20 cm, suponiendo un crecimiento continuo con una tasa de 0.02 mm mes-1. Sin embargo, hasta el momento no se ha determinado claramente si existe una relación estrecha entre la forma del crecimiento con respecto de la edad de las plantas.
Particularmente Lithothamnion muelleri presenta bandas diferenciales de carbonato de calcio que podrían utilizarse como indicadores de edad, sin embargo para ello se requieren estudios de validación, que consisten en establecer el periodo de formación de la marca y la regularidad con la que esta se forma (Mathews y Bawazeer, 1987; Stanton y Hurley, 1991). La validación puede realizarse mediante diversos métodos, entre los que se encuentran el seguimiento periódico de las bandas (Mathews y Bawazeer, 1987) y los experimentos mediante marcado de organismos (Andrake y Johansen, 1980; Agegian, 1981). Para el Golfo de California, Franz et al. (2000) calcularon una tasa de crecimiento en 0.6 mm año-1 basados en datos de C14. Halfar et al. (1998) observaron bandas claras y obscuras en Lithothamnion sp. y determinaron una proporción Mg/Ca de 0.17-0.3 (14-25 mol% MgCo3). Luego, correlacionando estas determinaciones con las bandas claras y obscuras, respectivamente, concluyeron que cuatro bandas corresponden a un ciclo anual de crecimiento. Sin embargo, la periodicidad de las bandas de crecimiento no ha sido validada para ninguna especie, y dicha validación puede ser de gran utilidad para futuros estudios paleoambientales dado que en diversos estudios se ha sugerido que los rodolitos pueden ser utilizados con este fin (Foster et al., 1997). Por lo anterior, los objetivos del presente estudio fueron: (1) estimar la tasa de crecimiento de L. muelleri por medio de datos provenientes de experimentos de campo y laboratorio, (2) validar las bandas de depositación diferencial como estructuras de edad, y (3) estimar la edad de los especímenes con base en las bandas que presentan.
Material y métodos
Estudio piloto
Debido a que no hay antecedentes sobre si los individuos de diferentes tallas crecen diferencialmente se decidió trabajar utilizando grupos específicos de tallas, por lo que fue necesario conocer su distribución en la población. De los mantos de rodolitos conocidos en el Golfo de California (Foster et al., 1997), se ha determinado que L. muelleri representa 100% del de Punta Galeras (Riosmena-Rodríguez, datos no publicados). Se realizó una visita a la localidad y se midieron todos los organismos que se encontraron en la población en un recorrido de una hora (500 m2). Las mediciones se realizaron por dos personas y usando equipo de buceo autónomo; una localizaba los individuos y otra los medía y apuntaba la información en tablas de acrílico. Se midió el largo total (eje más largo) a cada individuo usando un vernier con una precisión de 0.1 mm. Las determinaciones a nivel de especie se realizaron con cortes histológicos y de acuerdo con las características anatómicas definidas por Riosmena-Rodríguez (2002).
Preparación de muestras
Debido a que las bandas de crecimiento se presentan a todo lo largo de las ramas se consideró necesario realizar un corte longitudinal de los rodolitos para poder observar las bandas. Dado que no existe una técnica formal para hacerlo se diseñó una para realizar secciones delgadas de rodolitos utilizando como base la técnica petrográfica para secciones delgadas. La técnica modificada se describe a continuación:
• Si el organismo es frágil se le debe dar un baño en resina epóxica (Epo-Kwick® Fast Cure Epoxy) para evitar la fragmentación durante el corte.
• El rodolito se corta siguiendo su eje más largo y por el centro, usando un disco con punta de diamante como los usualmente utilizados en trabajos petrográficos.
• Se elige cualquiera de las dos secciones y se pule utilizando primero un disco giratorio y polvo abrasivo de 400 µm, y posteriormente un cristal como base y polvo abrasivo de 800 µm.
• Una vez pulida la sección elegida, se lava perfectamente, se seca, se pega a un cristal usando resina epóxica (Epoxi-Patch®) y se deja secar durante 24 h.
• Se corta el sobrante de rodolito pegado utilizando un disco diamantado, después de lo cual debe quedar una lámina de aproximadamente 3 mm, que luego se desbasta hasta un grosor de 2 mm.
• Una vez cortado se da el acabado final puliendo la lamina sobre un cristal, con polvo abrasivo de 800 µm.
Una vez que se tuvieron las secciones delgadas, se realizaron diferentes experimentos para determinar la forma en que se observan mejor las bandas:
• Tinción con rojo de alizarina. Se prepararon tres soluciones de la siguiente manera: 0.005, 0.01 y 0.1 mg de rojo de alizarina diluidos en 5 mL de alcohol etílico y aforados con 500 mL de agua destilada.
• Quemado. Se realizaron experimentos de quemado de las láminas y de rodolitos cortados a la mitad a diferentes temperaturas. Los tiempos fueron de 1, 2, 3, 5, 10 y 15 min, mientras que las temperaturas de exposición fueron de 100-110°C, 120-130°C, 140-150°C, 200-210°C, 250-260°C y 300-310°C.
• Rayos X. Se tomaron radiografías de láminas y de rodolitos partidos a la mitad para determinar si es posible contar las bandas sobre una placa de rayos X.
• Pulido. Se pulieron láminas con polvo abrasivo de diferentes tamaños (400, 600 y 800 µm), y se observaron constantemente con un estereoscopio con luz transmitida, para determinar con qué tamaño de grano y a qué grosor de la lámina se observaban mejor las bandas.
Método de marcado
Para la validación de las bandas como estructuras de edad y para la determinación de la tasa de incremento longitudinal se utilizó una técnica de captura-marcaje-recaptura. Se usaron dos tipos de marca: una metálica y una de rojo de alizarina. En el caso de la marca metálica se hizo una incisión en el organismo utilizando un taladro y se insertó un alambre inoxidable de 1 cm de largo que se fijó con resina marina quedando un extremo sobre la superficie del organismo. Para la segunda marca, fue necesario determinar previamente la concentración adecuada de rojo de alizarina con la que se forma una marca reconocible, para lo que se experimentó con cuatro concentraciones de esa substancia (0.25, 0.50, 0.75 y 1 g L-1), siendo la primera la más utilizada para teñir algas coralinas geniculadas (Andrake y Johansen, 1980). Los experimentos a mayores concentraciones se realizaron debido a que L. muelleri es de mayor tamaño y grosor que las coralinas con las que se ha utilizado anteriormente. Se recolectaron 10 organismos; 8 fueron sumergidos por pares en cada concentración durante 24 h y dos funcionaron como control. Una vez teñidos se colocaron en un acuario de 40 L con un fotoperiodo similar al que se presentaba en esa época del año (12/12) y se mantuvieron así durante todo el experimento. Se realizaron recambios de agua cada 15 días. El experimento tuvo una duración de dos meses (octubre a noviembre), tiempo que se consideró el mínimo indispensable para observar si se marcaban los organismos con el colorante.
Experimentos de campo y laboratorio
Para validar las bandas y determinar la tasa de incremento longitudinal se realizaron experimentos de campo y de laboratorio con base en los resultados del estudio piloto. Durante la fase de campo se estimó la tasa de crecimiento de los organismos in situ. En Punta Galeras se eligió un área aproximada de 4 x 4 m de superficie a 3 m de profundidad. Se trabajó con tres clases de talla que se determinaron a partir del estudio piloto: chica (<5 cm), mediana (5-10 cm) y grande (>10 cm). Se recolectaron tres grupos de seis organismos de cada clase de talla, se midieron y se marcaron fijando con resina una pequeña marca de plástico a cada individuo para facilitar su posterior localización. Se tiñó un grupo de 18 organismos (6 de cada talla) con rojo de alizarina, usando el siguiente procedimiento: utilizando bolsas de plástico con capacidad de 5 L se colocó el colorante en una esquina sujetándolo con una liga (0.25 mL L-1); después, bajo el agua, se pusieron de dos a tres organismos dentro de cada bolsa y, llenando la bolsa con agua, se cerró ésta y se soltó el colorante. Transcurridas 24 h se retiraron las bolsas, se quitó el exceso de colorante sacudiendo los organismos y se colocaron dentro del cuadrante. Adicionalmente, a otro grupo con un número similar de organismos (18) se les colocó una marca metálica haciéndoles una incisión con un taladro dentro de la que se colocó un alambre inoxidable y que se rellenó con resina marina Z-spar, cuidando que quedara la marca justo en el borde del individuo. Finalmente a otro grupo (18 individuos) se les aplicó tanto la marca metálica como el colorante.
El experimento tuvo una duración de un año (noviembre de 1996 a noviembre de 1997), a lo largo del cual se realizaron visitas cada tres meses para medir el largo, ancho y alto de los organismos. A los seis meses se realizó una recolección y seis meses después la última; los organismos se transportaron al laboratorio en donde fueron procesados. El experimento de laboratorio se realizó en la Unidad Pichilingue de la Universidad Autónoma de Baja California Sur. Se recolectaron 6 organismos de cada clase de talla en Punta Galeras y se transportaron a laboratorio donde se distribuyeron homogéneamente en tanques de 1.40 m de largo por 0.70 m de ancho y 20.5 cm de altura, con una capacidad máxima de 200 L. Se mantuvo flujo constante y directo de agua de mar depurada primero por decantación y posteriormente filtrada con filtro Voltrex. El control de la luz se realizó mediante pantallas de malla, que permiten el paso de aproximadamente el 50% de la luz. Esta pantalla se eligió después de experimentar con pantallas de 1, 2 y 3 mallas siendo la segunda la que funcionó mejor para evitar la proliferación de algas verdes.
Los organismos se marcaron, midieron y tiñeron siguiendo el mismo procedimiento utilizado en el campo. Como control se colocó en los tanques el mismo número de organismos sin teñir. Los rodolitos se distribuyeron homogéneamente en dos tanques, en donde permanecieron por un período de ocho meses (marzo de 1997 a noviembre de 1997). Durante este lapso de tiempo los organismos y los tanques fueron limpiados una vez por semana para retirar sedimentos y epífitos. Durante todo el experimento se contó con tres tanques, dos se usaban para los organismos y el tercero de apoyo en las operaciones de limpieza, exponiéndolos alternadamente al sol durante una semana para evitar proliferación de invertebrados. Los tanques eran vaciados y lavados para quitar el polvo acumulado en el fondo y los invertebrados que se pegaban en la pared.
Tasa de crecimiento
Una vez terminados los experimentos se determinó la supervivencia de los organismos, expresada ésta como el porcentaje de organismos vivos al final del experimento con respecto al número inicial, distinguiendo entre los tres tratamientos (marcados y teñidos, sólo marcados y controles). Se realizaron comparaciones pareadas de la proporción de sobrevivientes, mediante una prueba de diferencia de proporciones para determinar si la marca o el colorante afectan la supervivencia de los organismos.
Se hicieron secciones delgadas de cada individuo y se realizaron las lecturas de aumento en longitud (distancia entre la marca del colorante y el borde), número de bandas formadas en el tiempo del experimento y número total de bandas. Para mayor rapidez y precisión en la lecturas, las láminas fueron digitalizadas con un Scanner Scan Jet 4C/TMR usando una resolución de 500 puntos por pulgada (pixels), y posteriormente fueron analizadas en el programa de medición de imágenes Sigma Scan ProMR.
Se midió el incremento en longitud a partir de la marca y hasta el borde obteniendo de esta manera el crecimiento neto durante el tiempo de experimentación y con base en éste se determinó la tasa de crecimiento anual. Para estimar si la tasa de crecimiento fue diferente entre las clases de talla y entre los individuos se realizó un análisis de variancia anidado (Zar, 1996), en donde los individuos se encuentran anidados en las tallas. Dado que este análisis requiere homogeneidad en el tamaño de la muestra se eligieron azarosamente dos individuos de cada talla con seis ramas cada uno. Se determinó si hubo diferencia en las medias del crecimiento con respecto a la época del año (verano vs. invierno) mediante una prueba de diferencia de medias (Zar, 1996).
Determinación de la edad
Inicialmente se determinó en qué consiste una banda; esto se llevó a cabo mediante observaciones de varias ramas realizadas por dos personas. Posteriormente se hicieron conteos de bandas en una distancia conocida para 40 ramas y se compararon las lecturas de las dos personas mediante la prueba no paramétrica U de Mann-Whitney, la cual permite evaluar si las tendencias de los lectores pueden ser consideradas iguales. Para determinar la periodicidad de las bandas, indicativas de la edad, se analizó su tiempo de formación (número de bandas formadas en un tiempo conocido) para poder así asociar el patrón de bandeo a una escala cronológica. Para esto se utilizó como punto cronológico inicial la marca del colorante, a partir de la cual se contaron las bandas. Posteriormente se estimó la media y la moda de bandas formadas en el tiempo de experimentación. La edad de cada individuo se determinó contando el número de bandas a lo largo del eje principal de cada rama y dividiendo este valor entre el número de bandas formadas anualmente (previamente determinado).
Resultados
Estudio piloto
Se midieron en total 117 individuos cuya longitud total (eje más largo) fue de 2 a 15 cm (fig. 1). Debido a que no se logró saber si había un crecimiento diferencial por tallas, se decidió arbitrariamente separar a la población en tres grupos, considerando individuos pequeños a los de 0 a 5 cm, medianos a los de 5 a 10 cm y grandes a los de 10 a 15 cm de longitud.

Al lijar una rama hasta obtener una superficie plana aparecieron las bandas claras y obscuras. Parte del trabajo previo consistió en encontrar la mejor forma en que dichas bandas pueden ser observadas, para lo que para hacer la láminas de rodolitos se adaptó una técnica petrográfica. Una vez obtenida la lámina delgada, ésta se trató con diversos métodos cuyos resultados se muestran a continuación:
• Tinción: Teñir las láminas con diferentes concentraciones de rojo de alizarina (0.005, 0.01 y 0.1 mg) no permitió observar mejor las bandas. En todos los casos la lámina se tiñó uniformemente y las bandas no se podían observar.
• Quemado: En el experimento de quemado no se lograron buenas observaciones ya que produjo un quemado también uniforme, donde no se lograron resaltar las bandas.
• Rayos X: En las radiografías obtenidas apareció una coloración homogénea y tampoco fue posible apreciar las bandas de crecimiento.
• Pulido: Pulir las láminas resultó el mejor método para observar las bandas. El pulido con abrasivo fino (800 µm) fue el que permitió observar las bandas más claramente, dado que cuando se cortan y desbastan las láminas quedan rayones que pueden ser desvanecidos con el abrasivo fino.
Método de marcado
Los organismos sometidos a cuatro concentraciones de rojo de alizarina se retiraron del experimento a los dos meses y se procesaron para observar las puntas. No se pudo medir crecimiento en este lapso de tiempo, pero el colorante fue asimilado por los organismos en todas las concentraciones. En la concentración de 0.25 mg L-1 la marca se mostró más homogénea (fig. 2) por lo que se decidió trabajar con esta concentración, además de ser la más utilizada para otras algas coralinas.

Experimentos de campo y laboratorio
En los estudios de campo se obtuvo un porcentaje de recaptura del 40%; de los 56 individuos marcados solamente se recolectaron 22 (tabla 1). Se realizaron visitas en febrero, mayo y agosto, en las que se corroboró la presencia de los individuos (tabla 1). Además, en estas visitas se tomaron medidas de los individuos para detectar su incremento en longitud. Después de dos salidas se corroboró que no fue posible medir el incremento de talla directamente con el vernier debido a la forma irregular de los organismos y a la lenta tasa de crecimiento que presentan.
Con respecto a los dos tipos de marcas (rojo de alizarina y marca metálica), una vez recolectados y cortados los individuos, no fue posible encontrar la marca metálica ya que ésta quedó inmersa dentro del organismo y, a pesar de que se colocaron en una posición reconocible, no fue posible encontrarlas. En el caso de la marca de alizarina, ésta fue clara y homogénea en una gran cantidad de ramas de los individuos (fig. 2) y, por lo tanto, fue usada para marcar los organismos y poder medir posteriormente el crecimiento y determinar el número de bandas formadas en el tiempo del experimento.
Durante los experimentos de laboratorio de las 16 plantas marcadas y teñidas sobrevivieron 11; de las 18 que sólo se marcaron sobrevivieron 15 y de las 10 usadas como control sobrevivieron 8. No se encontró diferencia significativa en la supervivencia entre los tres tratamientos (2 x 3, Χ2 = 0.41, P = 0.93), indicando que las formas de marcado usadas no afectan significativamente la mortalidad.
Tasa de crecimiento
Se procesaron un total de 43 organismos, 23 de campo y 18 de laboratorio, de los que se obtuvieron un total de 250 ramas para analizar (tablas 2, 3). Del grupo de individuos procesados, sólo en 18 (12 en campo y 6 en laboratorio) fue posible medir el crecimiento, teniéndose en total 137 ramas distribuidas en diferentes clases de talla (tablas 2, 3). A partir de estas observaciones se determinó un incremento neto promedio de 0.68 mm con una tasa de crecimiento de 0.60 mm año-1 (tabla 2). A la mitad del experimento (en marzo) se realizó una colecta en el campo, lo que represento el crecimiento en invierno (octubre a marzo, tabla 2). El resto de los organismos se recolectaron en noviembre, lo que representó una tasa de crecimiento anual. La tasa de crecimiento de verano resulta de restar el crecimiento de invierno de los valores de crecimiento anual (tabla 2). Los resultados indican que en los organismos de campo se presentó un crecimiento rápido en invierno y lento en verano. Durante el verano, el crecimiento en laboratorio fue mayor que en el campo; aun así, fue menor al crecimiento invernal en el campo (tabla 3). Al comparar las medias del crecimiento en invierno y verano se encontraron diferencias significativas (t = 8.47, P < 0.001).

Se utilizó el incremento en longitud como un indicador de la tasa de crecimiento y ésta se comparó entre las diferentes clases de edad para determinar si los organismos crecían diferencialmente. El análisis de variancia anidado indicó que no hubo diferencias entre las clases de talla (F = 955, P = 0.52), ni entre los individuos de la misma talla (F0.05(1) 3,30 = 2.92, P = 0.57).
Determinación de la edad
Al comparar mediante una prueba U de Mann Whitney el número de bandas encontradas por dos lectores en una distancia conocida, se encontró que la tendencia en las lecturas de las dos personas fueron semejantes (U = 781, P = 0.85). Por lo tanto, era indiferente quién realizara la lectura, y en lo sucesivo se trabajó con un solo lector. El número de bandas encontradas se relacionó linealmente con la longitud del individuo, considerándose ésta la segunda prueba de validación de las bandas como estructuras para la determinación de edad. Con respecto al tiempo de formación de las bandas, al contar el número de bandas formadas después del marcaje con alizarina, se encontraron variaciones entra las diferentes ramas. Al calcular los intervalos de confianza se encontró que, al 95%, los individuos forman en promedio entre dos y tres bandas en un año. Además, el número de bandas formadas en un año fue mayor en laboratorio que en campo (t005 107 = 3.16, P = 0.001).
Edad y crecimiento
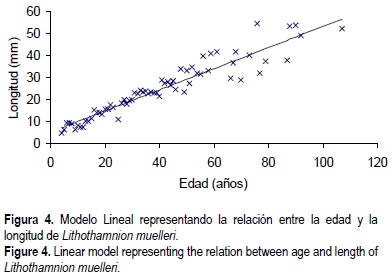
Para estimar la edad de los individuos se contaron las bandas a lo largo de las ramas en la distancia que fueran visibles (sin interrupciones) y su número se extrapoló a la longitud total de la rama. Posteriormente se estimó la edad del individuo dividiendo entre dos, que son las bandas que se forman anualmente; de esta manera se determinó la edad para cada rama siendo la edad total del rodolito la que corresponde a la rama más larga. Posteriormente se analizó cómo crecen estos organismos. Dado que no se encontraron diferencias en crecimiento entre las clases de talla, se ajustó un modelo lineal, obteniendo un coeficiente de correlación de 86% (fig. 3). Este modelo puede ser utilizado para estimar la edad de los rodolitos conociendo únicamente la talla de los mismos (fig. 4); ésta debe determinarse midiendo a partir del núcleo, y hasta la punta, la rama más larga del rodolito. Los datos que se utlizaron para el retrocálculo de la edad para los individuos procesados a partir del modelo propuesto y a partir únicamente de la tasa de crecimiento se muestran en Rivera (1999) y su representación gráfica muestra que individuos de aproximadamente 60 mm de largo pueden corresponder a una edad de casi 110 años (fig. 4). Durante el desarrollo del retrocalculo se evidencia que en los organismos pequeños las edades calculadas a partir de la tasa de crecimiento tienden a ser mayores que las calculadas a partir de la edad por número de bandas, mientras que en los organismos grandes sucede lo contrario, siendo la edad calculada a partir de la tasa de crecimiento la que tiende a ser menor que la obtenida a partir del número de bandas.

Discusión
La separación por tallas para el experimento fue muy útil, dado que era imposible saber si los organismos crecían diferencialmente dependiendo de la talla; de no haber probado que el crecimiento era diferencial, no hubiera sido válido tratar a todos los organismos como un solo grupo. La tinción de las láminas con rojo de alizarina para resaltar las bandas de crecimiento no fue exitosa, aun cuando este método es usado con éxito para observar bandas de crecimiento en otras estructuras calcáreas (Monaghan, 1993). Su uso en los rodolitos resultó infructuoso debido a que la alizarina es afín al carbonato de calcio y el esqueleto que se analizó está constituido en su mayoría por este material, a diferencia de otras estructuras calcáreas que están compuestas de dos tipos de sustancias principalmente, la otolina y el carbonato de calcio (Blacker, 1974). Dado que el calcio es el componente principal de la estructura de los rodolitos, las ramas se tiñeron uniformemente.
Entre las algas no geniculadas formadoras de rodolitos encontramos tasas de crecimiento muy bajas, como por ejemplo 0.4 mm año-1 en los rodolitos (no identificados) de las Bermudas (Bosellini y Ginsburg, 1971) y 0.01 a 0.05 mm año-1 para Lithophyllum sp. (Littler et al., 1991). Éstas son aún más bajas que la determinada en el trabajo presente (0.6 mm año-1). Pero es difícil realizar comparaciones dados que en aquellos trabajos no se especificó el método por el cual se determinó la tasa de crecimiento. Sin embargo, el presente trabajo verificó de manera independiente la tasa presentada por Franz et al. (2000) mostrando que la técnica del marcado con alizarina es eficiente en los estudios de edad y crecimiento.
La elevada tasa de crecimiento mostrada por L. muelleri puede deberse a que estos organismos viven en un área subtropical con temperaturas medias de 26°C y apenas 3 m de profundidad, en donde hay suficiente luz para la actividad fotosintética. Para las algas geniculadas, el intervalo de tasa de crecimiento conocido es mucho mayor, desde 1.92 hasta 60 mm año-1. En este caso es de considerar que las geniculadas tienen una forma de crecimiento diferente, presentando una alternacia de zonas calcificadas y no calcificadas (la genícula) y viven sujetas al substrato como la mayoría de las macroalgas, mientras que los rodolitos viven no sujetos en habitats arenosos y arenoso-rocosos (Foster et al., 1997).
Entre las macroalgas existe una menor competencia por espacio en las zonas arenosas, lo que podría propiciar que una espora pueda generar, dependiendo de las condiciones, una costra o un rodolito. La estrategia de la costra conlleva un tiempo de residencia menor (1 a 12 años; Edyvean y Ford, 1987). Al considerar que en el ambiente el alga se va a enfrentar a diversos factores negativos, uno de ellos la competencia; la existencia de dos formas (sujeta y libre) permite explorar ambientes como el arenoso, aumentando así la probabilidad de los individuos de sobrevivir. El constante movimiento y epifitismo pueden resultar en una disminución del crecimiento neto debido a que el movimiento provoca que los organismos se golpeen entre sí o contra las rocas, así como que se friccionen con el fondo arenoso y se entierren. Además, se presenta la bioerosión debida al ramoneo de herbívoros que consumen las nuevas capas de células, así como la ocasionada por organismos horadadores que destruyen partes calcificadas (Wehrmann, 1998).
No se encontraron diferencias significativas en el crecimiento entre tallas e individuos, es decir, no hay diferencias en el crecimiento entre las diferentes clases de talla ni entre los individuos de una misma talla. El no encontrar diferencias en la tasa de crecimiento entre tallas se puede deber a que únicamente la capa externa del rodolito está viva (Foster et al., 1997), por lo que el tener un tamaño grande no tiene implicaciones fisiológicas de gasto energético excesivo. Ya sea un individuo de 2 o 15 cm de diámetro, el costo energético es proporcional a la superficie del organismo, ya que la masa interna está constituida de material muerto.
Considerando lo anterior, las limitaciones para aumentar indefinidamente el tamaño de los rodolitos son mecánicas, ya que estos organismos están sujetos a movimientos involuntarios provocados por el medio que los rodea y que generan abrasión. Además, movimientos bruscos pueden resultar en fragmentación de los organismos, principalmente de los organismos grandes, debido a su peso y a que con el tiempo pueden hacerse más porosos tanto por la acción del medio ambiente como por la de organismos crípticos, de tal manera que para esta especie encontramos un límite de talla a los 15 cm de longitud.
Acerca de la temporalidad del crecimiento, se encontraron diferencias significativas entre invierno y verano (1.02 y 0.40 mm año-1, respectivamente, tabla 2). Inicialmente los resultados parecerían contradictorios ya que en el verano, dada la tasa de calcificación directamente proporcional a la tasa fotosintética (Borowitzca, 1981), el crecimiento debería ser mayor. Para explicar esto, es necesario considerar que 1997 fue un año anómalo en que el fenómeno de El Niño se presentó desde el mes de mayo, prolongándose hasta mayo de 1998. Así, quizá el comportamiento del crecimiento se deba a que a temperaturas superiores a la óptima la fotosíntesis puede inhibirse o disminuir, con lo que la tasa de calcificación también disminuye. No se conoce la temperatura óptima de fotosíntesis para L. muelleri, pero se asume que ésta pudo ser rebasada durante el periodo de estudio dado que El Niño 1997/98 fue una anomalía muy fuerte en la que se registraron hasta 5°C por encima de la temperatura normal durante su punto máximo ocurrido en el mes de junio (Alatorre-Mendieta, 2001).
La tasa de crecimiento encontrada en laboratorio fue mayor a la observada en el campo. Esto puede deberse a que en el laboratorio (verano) los organismos estuvieron protegidos parcialmente de la intensidad luminosa pero, debido a que no fue posible medir la cantidad exacta de luz incidente tanto en el laboratorio como en el campo para igualarlas, ésta se mantuvo igual durante todo el experimento. En el campo la intensidad pudo ser mayor, resultando en una disminución del crecimiento neto debida a la fotoinhibición.
La formación de las bandas de crecimiento en L. muelleri puede ser producto de la depositación diferencial de magnesio. Borowitzca (1981) determinó que el contenido de magnesio en las algas coralinas es directamente proporcional a la tasa fotosintética, depositándose más magnesio durante el crecimiento rápido. Además, la densidad de depositación de calcio es de gran importancia, y ésta es mayor durante el crecimiento lento (Wehrmann, 1998). El número de bandas por rama encontradas en L. muelleri se relacionó linealmente con la longitud de la rama, lo que constituye uno de los criterios de validación de una estructura de edad y nos indica que la estructura está relacionada con la variable utilizada (Mathews y Bawazeer, 1987; Stanton y Hurley, 1991), en este caso la longitud. Otro método de validación es el tiempo de formación de la banda, y en este trabajo se encontró que, en promedio, se forman dos bandas obscuras observables con 40 aumentos al estereoscopio, así como en computadora con 80x y 100x de aumento. La edad se calculó suponiendo la formación de dos bandas por año, ya que ésta es la media encontrada en los experimentos de campo y se considera representativa; así, la estimación de la edad se obtuvo al contar el número total de bandas en una rama y dividirlo entre dos. Además se corroboró que dos personas observaban aproximadamente el mismo número de bandas en una longitud determinada, de tal manera que dos bandas obscuras representan un año de vida del organismo.
El número de bandas encontradas en un año (de dos a tres), y las diferencias en la tasa de crecimiento, indican que, en general, se registraron dos condiciones de crecimiento: una en el invierno, con temperaturas bajas y tasa de crecimiento alta, y otra en el verano, con temperaturas altas y tasa de crecimiento baja. Es probable que el organismo registre variaciones en su crecimiento (por ejemplo, durante los cambios de marea) entre estas dos épocas, pero en este estudio no se identifican debido a las técnicas utilizadas. Para Lithothamnium sp., en el sur del Golfo de California, Halfar et al. (1998) mencionan cuatro bandas anuales, obtenidas al analizar la proporción Mg/Ca, y relacionan las mayores concentraciones de calcio con las bandas obscuras y las menores con las claras. En ese trabajo los autores no especifican si fueron cuatro bandas obscuras en un año o dos obscuras y dos claras, además de que no realizaron el estudio de validación, con por lo menos un año de seguimiento, el cual es necesario para que estas determinaciones sean confiables.
Por otro lado, al analizar también la proporción Mg/Ca, Wehrmann (1998) concluyó que en L. corallioides y Phymatolithon calcareum se forman dos bandas en un año (una clara y una obscura), pero su trabajo tampoco contó con una validación, y únicamente asume que el marcado es anual de manera similar a los corales, es decir, que se forman una banda obscura y una clara en un año. Sin embargo, se deben tener precauciones al respecto dado que no existe la seguridad de que todos los organismos formen bandas anuales, o incluso que éstas estén relacionadas con un período determinado. Por ejemplo, en este trabajo se encontraron dos bandas obscuras y dos claras, y Félix-Uraga y Ramírez (1989) reportan la formación de dos bandas obscuras anuales para la sardina monterrey, cuando los trabajos anteriores asumían que se formaba una cada año.
La forma de crecimiento de los rodolitos puede ser explicada adecuadamente por un modelo lineal. El utilizar este modelo resultante de la estimación de la edad por número de bandas para explicar el crecimiento es más recomendable que utilizar un retrocálculo de la edad usando la tasa de crecimiento. El retrocálculo de la edad a partir de la tasa de crecimiento es un método fácil y rápido para estimar la edad cuando se conoce la tasa de crecimiento. Debido a que los rodolitos son organismos muy longevos (>100 años de edad) es factible que, en períodos tan largos, la tasa de crecimiento presente variaciones, mientras que es más probable que el número de bandas formadas en un año se mantenga estable aunque éstas sean pequeñas o grandes dependiendo de las condiciones que imperen en un año determinado.
Una vez establecido el modelo para esta especie, es factible determinar la edad de los organismos a partir del número de bandas conociendo únicamente su longitud. Debido a la forma redonda de los rodolitos es importante considerar la edad de la rama más larga como la edad mínima que puede tener cada organismo, ya que al medir la rama más larga estamos seguros de que al menos tiene la edad que le corresponde a esta rama. Por otro lado, si sólo medimos el eje más largo del rodolito no estamos considerando si el núcleo era pequeño o grande, o si creció más en una dirección que en otra.
Agradecimientos
El presente estudio fue realizado bajo los auspicios de la CONABIO proyecto B086 financiado a RRR. Se agradece a Alejandra Ángeles-Pérez la elaboración de las láminas histológicas y su apoyo durante la realización de este trabajo. MSF agradece el apoyo de la Comisión Fulbright que apoyó su año sabático en México. MGR fue técnico del proyecto CONABIO y el presente estudio constituye su tesis de licenciatura. Agradecemos los comentarios de dos revisores anónimos.
Referencias
Adey, W.H. and Macintyre, I.G. (1973). Crustose coralline algae: A re-evaluation in the geological sciences. Geol. Soc. Am. Bull., 84: 833-904. [ Links ]
Agegian, C.R. (1981). Growth of the branched coralline alga, Porolithon gardineri (Foslie) in the Hawaiian Archipielago. Fourth International Coral Reef Symp., Manila, 2: 419-423. [ Links ]
Alatorre-Mendieta, M.A. (2001). El Niño en el Golfo de California. En: E. Escobar, M. Bonilla, A. Badan, M. Caballero y A. Winckell (eds.), Los Efectos del Fenómeno El Niño en México 1997-8, CONACYT, México, pp. 50-54. [ Links ]
Andrake, W. and Johansen, H.W. (1980). Alizarin red dye as a marker for measuring growth in Corallina officinalis (Corallinaceae, Rhodophyta). J. Phycol., 16: 620-622. [ Links ]
Blaker, R.W. (1974). Recent advances in otholith studies. In: F.R. Harden-Jones (ed.), Sea Fisheries Research, John Wiley, New York, pp. 67-90. [ Links ]
Borowitzca, M.A. (1981). Calcification in algae: Mechanisms and the role of metabolism. CRC Crit. Rev. Plant Sci., 6(1): 1-45 [ Links ]
Bosellini, A. and Ginsburg, R.N. (1971). Form and internal structure of recent algal nodules (Rhodolites) from Bermuda. J. Geol., 79: 669-682. [ Links ]
Bosence, D.W. (1983). The occurrence and ecology of recent rhodoliths (rodoids, rhodolites). In: T.M. Peryt (ed.), Coated Grains. Springer-Verlag, Heidelberg, pp. 225-242. [ Links ]
Edyvean, R.G.J. and Ford, H. (1987). Growth rates of Lithophyllum incrustans (Corallinales, Rhodophyta) from southwest Wales. J. Phycol., 22: 139-146. [ Links ]
Félix-Uranga y Ramírez (1989). Verificación en las determinaciones de edad de Sardinops sagax caerulea basadas en la lectura de otolitos. Invest. Mar. CICIMAR, 4(1):59-64. [ Links ]
Foster, M.S. (2001). Rhodolith beds: between hard and soft places. J. Phycol., 37: 639-667. [ Links ]
Foster, M.S., Riosmena-Rodríguez, R., Steller, D.L. and Woelkerling, W.J. (1997). Living rhodolith beds in the Gulf of California and their implications for paleoenviromental interpretations. In: M.E. Johnson and J. Ledesma-Vázquez (eds.), Pliocence Carbonates and Related Facies Flanking the Gulf of California, Baja California Sur, Mexico. Bull. Am. Geol. Soc. Spec. Pap., 318: 127-139. [ Links ]
Franz, B.R., Kashgarian, M., Coale K.H. and Foster, M.S. (2000). Growth rate and potential climate record from a rhodolith using 14C accelerator mass spectometry. Limnol. Oceanogr., 45: 1773 - 1777. [ Links ]
Halfar, J., Zack, T., Kronz, A. and Zachos, J.C. (1998). Paleoenvironmental signals and growth rates of rhodoliths: A geochemical approach. Mineral. Mag., 62(1-3): 559-560. [ Links ]
Littler, M.M., Littler, D.S. and Hanisak, M.D. (1991). Deep-water rhodolith distribution, productivity, and growth history at sites of formation and subsequient degradation. J. Exp. Mar. Biol. Ecol., 150: 163-182. [ Links ]
Mathews, M.S. and Bawazeer, A.S. (1987). Age and validation of age from fishes from the Arabian Gulf. In: R.C. Summerfelt and E.H. Gordon (eds.), The Age and Growth of Fish. Iowa State Univ. Press, Iowa, pp. 253-265. [ Links ]
Monaghan, J.P. (1993). Comparison of calcein and tetracycline as chemical markers in summer flounder. Trans. Am. Fish. Soc., 122: 298-301. [ Links ]
Payri, C.E. (1997). Hidrolithon reinboldii rhodolith distribution, growth and carbon production of a French Polynesian reef. Proc. 8th International Coral Reef Symp., 1: 755-760. [ Links ]
Prager, E.J. and Ginsburg, R.N. (1989). Carbonate nodule growth on Florida's outer shelf and its implications for fossil interpretations. Palaios, 4: 310-317 [ Links ]
Riosmena-Rodríguez, R. (2002). Taxonomy of the order Corallinales (Rhodophyta) for the Gulf of California, Mexico. Ph.D. thesis, La Trobe University, xvi + 200 pp + 89 plates. [ Links ]
Rivera, M.G. (1999). Edad y crecimiento de Lithothamnion crassiusculum (Foslie) Mason 1943 (Corallinales, Rhodophyta) en el suroeste del Golfo de California, México. Departamento de Biología Marina, UABCS, 65 pp. [ Links ]
Stanton, L.H. and Hurley, D.H. (1991). Validation of daily increment formation in the otoliths of juvenile silver perch, Bairdiella chrysoura. Estuaries, 14(2): 199-206. [ Links ]
Wehrmann, A. (1998). Modern cool-water carbonates on a coastal platform of northern Brittany, France: Carbonate production in macrophytic system and sedimentary dynamics of bioclastic facies. Senckenb. Marit., 2(4/6): 151-166. [ Links ]
Zar, J.H. (1996). Bioestatistical Analysis. Prentice Hall, USA, 662 pp. [ Links ]














