Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.30 no.1a Ensenada feb. 2004
Notas de investigación
Variabilidad de la comunidad del fitoplancton en Bahía San Quintín estimada mediante el análisis de pigmentos
Variability of the phytoplankton community in San Quintín Bay based on pigment analysis
Roberto Millán-Núñez1*, E. Millán-Núñez2, S. Álvarez-Borrego2, C.C. Trees3 y E. Santamaría-del-Ángel1
1 Facultad de Ciencias Marinas, Universidad Autónoma de Baja California. Apartado postal 453 Ensenada 22800, Baja California, México. *E-mail: rmillan@uabc.mx
2 Centro de Investigación Científica y de Educación Superior de Ensenada. Km 103 carretera Tijuana-Ensenada Ensenada 22860, Baja California, México.
3 Center of Hydro-Optics and Remote Sensing, San Diego State University.
Recibido en septiembre de 2002;
Aceptado en abril de 2003.
Resumen
Se realizó una caracterización de la comunidad fitoplanctónica de Bahía San Quintín mediante el análisis de pigmentos estimados por cromatografía líquida de alta precisión (HPLC) y el programa de taxonomía química CHEMTAX, de tal manera que no se excluyeran las células pequeñas (< 5 µm). Se generó una serie de tiempo de 24 h, con muestras de agua superficial cada hora, el 23-24 de abril de 2001. Además, se tomaron muestras en seis localidades de la bahía. Hubo una contribución significativa de siete grupos del fitoplancton. Los que más contribuyeron al total de la clorofila a fueron criptofitas, cianobacterias, baciliarofitas y clorofitas. En general, los pigmentos tuvieron concentraciones mayores en la zona de la boca de la bahía, con disminución hacia los extremos internos. Por primera vez se reporta la presencia del pigmento divinil clorofila a en Bahía San Quintín, sugiriendo fuertemente la presencia de Prochlorococcus sp. Este grupo contribuyó hasta un 40% del total de la clorofila a total. Las otras cianobacterias alcanzaron un máximo de 13% de contribución al total de clorofila a. Estos porcentajes indican grandes abundancias de estos grupos.
Palabras clave: pigmentos, HPLC, fitoplancton, Bahía San Quintín, CHEMTAX.
Abstract
The purpose of this work was to characterize the phytoplankton community of San Quintín Bay using pigment concentrations from HPLC and the CHEMTAX program, so that small cells (< 5 ^m) would not be excluded. On 23-24 April 2001, a 24-h time series was generated, sampling surface water every hour. Samples were also taken from six localities throughout the bay. There was a significant contribution of seven phytoplankton groups. Those that contributed the most to total chlorophyll a were cryptophytes, cyanobacteria, bacilliarophytes and chlorophytes. In general, pigment concentrations were higher in the mouth region and decreased towards the internal extremes. This is the first report of the presence of the pigment divinyl chlorophyll a in San Quintín Bay, which firmly suggests the presence of Prochlorococcus sp. This group contributed up to 40% of the total chlorophyll a. Other cyanobacteria contributed up to 13% of the total chlorophyll a. These percentages are indicative of a very high abundance of these groups.
Key words: pigments, HPLC, phytoplankton, San Quintín Bay, CHEMTAX.
Introducción
Durante los últimos 30 años se ha reconocido a Bahía San Quintín, México, por su actividad ostrícola. El fitoplancton es importante como alimento para los filtroalimentadores nativos y cultivados y, además, es un índice de la fertilidad de la bahía, por lo que es necesario caracterizar apropiadamente la variabilidad del fitoplancton dentro de la misma. Sin embargo, este tipo de estudios han sido escasos (Lara-Lara et al., 1980; Millán-Núñez et al., 1982; Silva-Cota y Álvarez-Borrego, 1988). El uso del microscopio invertido ha subestimado la abundancia del nanofitoplancton, además de que la identificación del fitoplancton mediante microscopio requiere de una gran destreza taxonómica y consume mucho tiempo. Lara-Lara et al. (1980) reportaron que las diatomeas fueron más abundantes en la boca que en los interiores de la bahía. Millán-Núñez et al. (1982) reportaron que las diatomeas fueron más abundantes sólo durante eventos de intensificación de surgencias en la boca, seguido de mayor abundancia de dinoflagelados durante los períodos de relajamiento. Estas células de diatomeas y dinoflagelados eran > 20 µm. No obstante la gran proporción de células menores a 10 µm, no se han realizado estudios que evalúen su abundancia en Bahía San Quintín.
Con el uso de epifluorescencia ha sido posible hacer conteos más apropiados de las células pequeñas. La citometría de flujo también permite conteos para generar espectros de tamaños, sin embargo, estas técnicas no permiten una clasificación taxonómica. En los últimos 16 años la taxonomía química del fitoplancton ha sido utilizada para una mejor comprensión de la distribución y composición de sus poblaciones. La utilización de datos de pigmentos fotosintéticos ha permitido estimar cuantitativamente la abundancia de clases (Mackey et al. , 1998). El uso del método de cromatografía líquida de alta precisión (HPLC) para la estimación de pigmentos ha sido útil para muestras recolectadas en áreas oligotróficas donde las células muy pequeñas pueden ser identificadas correctamente sólo por microscopio electrónico (Anderson et al., 1996). Se ha reportado que en lugares con alta concentración de clorofila a las células pequeñas también son abundantes.
Muchas de las clases representadas en el picoplancton (< 2 µm) y nanoplancton (< 20 µm) tienen pigmentos específicos (clorofilas y carotenos) que indican su presencia y abundancia en una comunidad mezclada (Jeffrey et al., 1975; Gieskes y Krayay, 1986). Algunos pigmentos son exclusivos de ciertas clases, tales como aloxantina en criptofitas, prasinoxantina en prasinofitas, peridinina en dinoflagelados, clorofila b en clorofitas, y divinil clorofila a y b en Prochlorococcus sp. Algunos pigmentos son encontrados en gran proporción en ciertas clases del fitoplancton, tales como la fucoxantina en diatomeas, haptofitas, primnesiofitas y crisofitas, y la zeaxantina en cianobacterias y clorofitas (Chisholm et al., 1988; Jeffrey et al., 1997).
En años recientes el uso de divinil clorofila a y b como pigmentos específicos de Prochlorococcus sp. ha facilitado el estudio del fitoplancton de 0.2-2.0 µm. Prochlorococcus sp. es un procariote que presenta grandes abundancias (5-200 x 107 cel L-1) en aguas subtropicales y tropicales del Océano Atlántico (Chisholm et al., 1988) y del Pacífico (Letelier et al., 1993), y posiblemente estas abundancias también se presentan en aguas eutróficas. El objetivo de este trabajo es hacer una caracterización preliminar de la comunidad fitoplanctónica de Bahía San Quintín mediante el análisis de pigmentos y el programa de taxonomía química (CHEMTAX), de tal manera que no se excluyan las células pequeñas.
Metodología
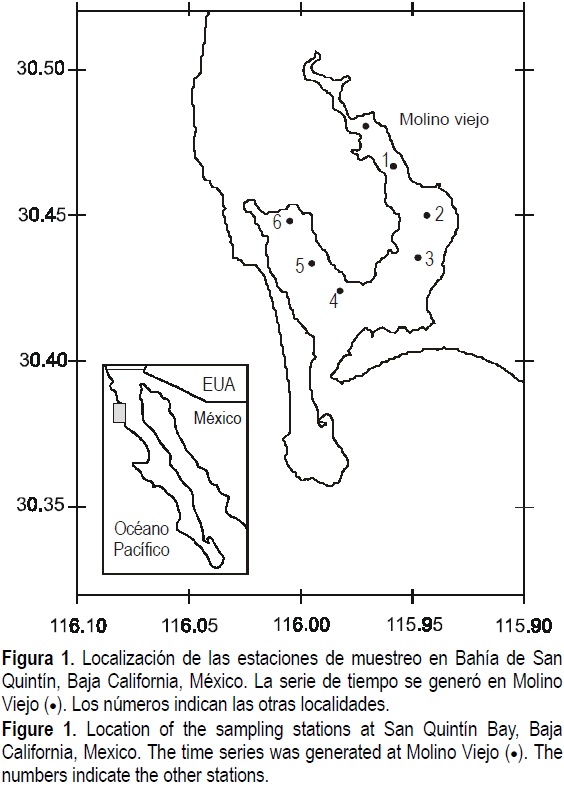
Se generó una serie de tiempo de 24 h, con muestras de agua superficial cada hora, durante el 23 y 24 de abril de 2001 frente a Molino Viejo. Además, se tomaron muestras en seis localidades de la bahía (fig. 1). Para la estimación de la concentración de pigmentos se filtró 1 L de agua de mar con filtros de fibra de vidrio de 25 mm de diámetro y con tamaño de poro de 0.7 µM GF/F. Éstos fueron almacenados en un contenedor con nitrógeno líquido hasta su análisis en el laboratorio del Centro de Hidro-Óptica y Sensores Remotos de la Universidad Estatal de San Diego. El método utilizado para HPLC fue el propuesto por Wright et al. (1991). La extracción de los pigmentos se realizó con acetona al 100%. Los pigmentos fueron separados mediante una columna Spherisorb ODS-2 C18, utilizando un sistema de gradiente de tres solventes, siguiendo la metodología descrita por Bidigare y Trees (2000): (a) 80:20 metanol: 0.5 M acetato de amonio (v/v); (b) 90:10 acetonitrilo: agua (v/v); y (c) acetato de etilo) a un flujo de 1 mL min-1. Con el propósito de comparar y complementar los datos se estimó la abundancia de fitoplancton mediante el método Utermöhl (1958), para lo cual se tomaron muestras de agua de mar en botellas Nalgene obscuras de 250 mL y se les agregó 2.5 mL de Lugol con base acetato de sodio para su preservación.
Para estimar la contribución de las diferentes clases del fitoplancton mediante los pigmentos se utilizó el programa CHEMTAX (Mackey et al., 1996). Este programa calcula la proporción de clases de fitoplancton a partir de concentraciones de clorofilas y carotenos determinados por HPLC. Los pigmentos usados para la caracterización de la taxonomía química y la cuantificación de las contribuciones de los diferentes grupos al total de la comunidad fitoplanctónica fueron peridinina, butanoloxyfucoxantina, fucoxantina, 19-hexanoloxyfucoxantina, prasinoxantina, aloxantina, luteína, zeaxantina, clorofila b, divinil clorofila a y clorofila a, alómero de clorofila a y epímero de clorofila a.
Resultados
La concentración del total de clorofila a (clorofila a + divinil clorofila a + alómero de clorofila a + epímero de clorofila a) y la concentración de clorofila a presentaron una variación directa con el nivel del mar. Los valores de concentración de clorofila a variaron de 0.43 mg m-3 en marea alta, hasta 0.09 mg m-3 en marea baja. La variación local de la concentración de clorofila a muestra un cambio de hasta ~50% en una hora (fig. 2a). La concentración de divinil clorofila a tuvo una amplia variación temporal con valores de hasta 0.19 mg m-3 al inicio de la serie y valores de ~0.02 mg m-3 hacia el final del muestreo. La concentración de fucoxantina fue relativamente constante, con valores fluctuando alrededor de 0.05 mg m-3. Las concentraciones de aloxantina, clorofila b y zeaxantina presentaron el mismo patrón que presentó la clorofila a, con concentraciones mayores durante el flujo y menores durante el reflujo (fig. 2b). Los pigmentos luteina, diatoxantina, diadinoxantina, prasinoxantina, hexanoloxifucoxantina, butanoloxifucoxantina y peridinina presentaron en general bajas concentraciones menores a 0.02 mg m-3, excepto la violaxantina que presentó concentraciones de hasta 0.05 mg m-3 (fig. 2c) en las primeras horas de la serie.

El porcentaje de contribución de las clases del fitoplancton al total de clorofila a estimado mediante el programa CHEMTAX se muestra en la figura 3a, donde se observa una contribución significativa de ocho grupos del fitoplancton. La contribución de Prochlorococcus sp. al total de clorofila a presentó la misma tendencia del pigmento divinil clorofila a (figs. 2b, 3a). De la misma manera la clase criptofita se asocia con el pigmento aloxantina, siendo ésta la más abundante a lo largo de la serie de tiempo.

Las diatomeas tamién fueron relativamente abundantes con una gran contribución al total de clorofila a en toda la serie de tiempo. Esta clase presentó una variación similar a la fucoxantina (figs. 2b, 3a). La concentración de clorofila b es indicadora de la variación de clorofitas y prasinofitas, mientras que la prasinoxantina es sólo de prasinofitas, la contribución de las prasinofitas al total de clorofila a fue alrededor del 10%. Los demás grupos del fitoplancton como dinoflagelados y haptofitas presentaron contribuciones menores al 10% al total de clorofila a (fig. 3a).
Los taxones dominantes determinados mediante el conteo por microscopio invertido siguiendo la técnica Utermöhl fueron dos géneros de diatomeas, Nitzschia y Cocconeis, que en algunos casos alcanzaron más del 70% de la abundancia total (tabla 1).
En el muestreo espacial, todos los pigmentos tuvieron concentraciones mayores en la zona de la boca de la bahía (estación 4), con disminución hacia los extremos internos.
En general las concentraciones encontradas en la variación espacial son mayores que la reportada en la serie de tiempo. Por ejemplo la clorofila a alcanzó valores de hasta 1.9 mg m-3 (fig. 3b), cuatro veces más que las concentraciones estimadas en la variación temporal. La excepción fue la divinil clorofila a que presentó concentraciones de hasta 0.08 mg m-3 en la variación espacial y de 0.19 mg m-3 en la temporal (fig. 3c).
El resto de los pigmentos pueden ser integrados en dos grupos: aquellos con concentraciones de hasta 0.5 mg m-3 (fig. 3b, clorofila b, fucoxantina, aloxantina y hexanoloxyfucoxantina), y los que presentaron concentraciones <0.1 mg m-3 (fig. 3c, peridinina, butanoloxyfucoxantina, violaxantina, diadinoxantina, diatoxantina, luteina, zeaxantina).
Discusión
Las series temporales de la concentración total de clorofila a y de clorofila a mostraron una clara asociación con la marea; en general, las abundancias altas de fitoplancton se presentan con la marea en flujo y viceversa. Este patrón ha sido descrito en detalle para esta zona por Lara-Lara et al. (1980) y Millán-Núñez et al. (1982).
Éste es el primer trabajo que reporta las concentraciones de pigmento del fitoplancton mediante el uso de HPLC en Bahía San Quintín, y en él se detectó la presencia de divinil clorofila a, que sugiere fuertemente la presencia de Prochlorococcus sp. (Jeffrey et al., 1997). La aloxantina, que es el pigmento especifico de la clase criptofita, fue abundante a lo largo de la serie de tiempo, lo que nos da una idea de que estos organismos son dominantes en la estructura fitoplanctónica de la bahía. Además presentó una variación similar a la clorofila a.
Los pigmentos con concentraciones menores a 0.02 mg m-3 (luteína, diatoxantina, diadinoxantina, butanoloxyfucoxantina), corresponden a pigmentos presentes en varias clases del fitoplancton, lo que dificulta la estimación del porcentaje de contribución al total de clorofila a, a diferencia de los pigmentos específicos de una sola clase de fitoplancton (como la peridinina, prasinoxantina y hexanoloxyfucoxantina). La violaxantina presentó concentraciones mayores a 0.02 mg m-3; sin embargo, aunque este pigmento se encuentra en clorofitas y prasinofitas, los porcentajes de estas clases no fueron muy abundantes en la serie de tiempo.
Anteriormente no se había reportado la divinil clorofila a en esta zona debido a que las estimaciones de pigmentos se basaban en técnicas espectrofotométricas y/o fluorométricas que estimaban únicamente las concentraciones de clorofilas a, b y c, y sus productos de degradación (Millán-Núñez y Álvarez-Borrego, 1978; Millán-Núñez et al., 1982; Silva-Cota y Álvarez-Borrego, 1988). Tampoco se había reportado la presencia de Prochlorococcus sp. en la bahía (Silva-Cota y Álvarez-Borrego, 1988) debido a que los estudios en taxocenosis fitoplanctónica se basaron en la técnica Utermöhl, siendo imposible observar estos organismos que, por su tamaño (0.50.7 µM), son considerados como los organismos fotosintéticos mas pequeños conocidos a la fecha (Palinska et al., 2000).
En años recientes, el uso de divinil clorofila a como un marcador altamente específico de Prochlorococcus sp. ha mejorado nuestra comprensión del papel del picoplancton (0.2-2 µM) en el ecosistema marino (Gibb et al., 2001). Este grupo presenta abundancias máximas de hasta tres órdenes de magnitud mayores que las máximas del microfitoplancton (Chisholm et al., 1988; Letelier et al., 1993). Millán-Núñez et al. (2003), utilizando citometría de flujo, encontraron Prochlorococcus y Synechococcus con abundancias de 3.3 x 106 cél L-1 y 10.3 x 106 cél L-1, respectivamente, en la región de la Corriente de California frente al noroeste de Baja California.
Recientemente, Prochlorococcus sp. ha sido clasificado como cianobacteria (Palinska et al., 2000). En este trabajo la presencia de divinil clorofila a ha permitido separar a Prochlorococcus sp. del resto de las cianobacterias. En Bahía San Quintín Prochlorococcus sp. contribuyó hasta un 40% del total de la clorofila a, mientras que el resto de las cianobacterias sólo alcanzaron hasta un 13%. Tomando en conjunto ambas contribuciones se alcanza el 53% del total de clorofila a, lo cual concuerda con Barlow et al. (1997, 1999), quienes reportaron razones de divinil clorofila a al total de clorofila a entre 11% y 40% para el Mediterráneo y de hasta 53% para el Mar Arábigo.
Para la estimación del porcentaje de contribución al total de clorofila a por los grupos del fitoplancton se utilizaron las razones de pigmentos reportados en la literatura para cada uno de ellos. Sabemos que las razones de pigmentos en un grupo en particular cambian con las condiciones físicas y químicas del agua de mar (Mackey et al., 1998). Por tanto, sugerimos que las razones de pigmentos que se usen en CHEMTAX sean las de las especies del fitoplancton del área de estudio. Es por lo anterior que los resultados sobre los porcentajes de contribución de los diferentes grupos deben ser tomados como una primera aproximación.
En general las concentraciones de pigmentos en las localidades cercanas a la boca fueron mayores que las que se encontraron en la parte interna de la bahía. Este patrón se debe a que en la boca de la bahía se encuentran mayores abundancias microfitoplanctónicas (Millán-Núñez et al., 1982; Silva-Cota y Álvarez-Borrego, 1988).
La presencia de los diferentes pigmentos en todas las localidades muestreadas indica que los grupos fitoplanctónicos reportados para la serie de tiempo están presentes en toda la bahía. Sin embargo, no se hicieron cálculos de porcentaje de contribución al total de clorofila a por la escasez de los datos, ya que para el uso del CHEMTAX se requiere un número de muestras mayor que el número de pigmentos (Mackey et al., 1997).
Los dinoflagelados estimados por microscopio para la serie de tiempo fueron escasos y su abundancia es consistente con su pigmento específico que es la peridinina, la cual reflejó un porcentaje bajo de contribución al total de clorofila a. De la misma manera, las abundancias de diatomeas estimadas por microscopio fueron consistentes con la concentración de fucoxantina (pigmento de alta proporción en este grupo). Sin embargo, el resultado del CHEMTAX indicó que las diatomeas tuvieron una contribución menor al 70% como lo indicaron las muestras de microscopio invertido (tabla 1). Estas comparaciones enfatizan la importancia de tomar en cuenta, mediante taxonomía química, la contribución de las células pequeñas, ya que por su tamaño los Prochlorococcus sp. y las cryptofitas no pueden ser observadas mediante microscopio invertido. En este trabajo ambos taxones acumularon hasta el 50% del total de clorofila a.
Agradecimientos
Los autores agradecen a dos revisores anónimos sus comentarios y sugerencias que hicieron que este manuscrito mejorara en su contenido.
Referencias
Anderson, R.A., Bidigare, R.R., Keller, M.D. and Latasa, M. (1996). A comparison of HPLC pigments signatures and electron microscopic observations for oligotrophic waters of the North Atlantic and Pacific Oceans. Deep Sea Res., 43: 517-537. [ Links ]
Barlow, R.G., Mantoura, R.F.C., Cummings, D.G. and Fileman, T.W. (1997). Pigment chemotaxonomic distribution of phytoplankton during summer in the western Mediterraneum. Deep Sea Res., 44: 833-850. [ Links ]
Barlow, R.G., Mantoura, R.F.C. and Cummings, D.G. (1999). Monsoonal influence on the distribution of phytoplankton pigments in the Arabian Sea. Deep Sea Res., 46: 677-700. [ Links ]
Bidigare, R.R. and Trees, C.C. (2000). HPLC phytoplankton pigments: Sampling laboratory methods, and quality assurance procedures. In: G.S. Fargion and J.L. Mueller (eds.), Ocean Optics Protocols for Satellite Ocean Color Sensor Validation, Revision 2, Chapter 14. NASA Tm 2000-209966, Goddard Sapce Flight Center, Greenbelt, MD, pp. 154-161. [ Links ]
Chisholm, S.W., Olson, R.J., Zettler, E.R., Goericke, R., Waterbury, J.B. and Welschmeyer, N.A. (1988). A novel free living prochlorophyte abundant in the oceanic euphotic zone. Nature, 334: 340-343. [ Links ]
Gibb, W.S., Cummings, G.D., Irigoien, X., Barlow, G.R., Fauzi, R. and Mantoura, C. (2001). Phytoplancton pigment chemotaxonomy of the northeastern Atlantic. Deep Sea Res., 48: 795-823. [ Links ]
Gieskes, W.W.C. and Krayay, G.W. (1986). Analysis of phytoplankton pigments by HPLC before, during and after mass occurrence of the microflagellates Corembellus aureus during the spring bloom in the open Northern Sea in 1983. Mar. Biol., 92: 45-52. [ Links ]
Jeffrey, S.W., Suielicki, M. and Haxo, F.T. (1975). Chloroplast pigment patterns in dinoflagellates. J. Phycol., 1: 374-384. [ Links ]
Jeffrey, S.W., Mantoura, R.F.C. and Wright, S.W. (eds.) (1997). Phytoplankton Pigments in Oceanography: Guidelines to Modern Methods. UNESCO Monograph in Oceanographic Methods, Report for SCOR WH 78. SCOR-UNESCO Monographs on Oceanographic Methodology, Paris. [ Links ]
Lara-Lara, J.R., Álvarez-Borrego, S. and Small, L.F. (1980). Variability and tidal exchange of ecological properties in a coastal lagoon. Estuar. Coast. Mar. Sci., 11: 613-637. [ Links ]
Letelier, R.M., Bidigare, R.R., Hebel, D.V., Ondruseck, M., Winn C.D. and Karl, D.M. (1993). Temporal variability of phytoplankton community structure based on pigment analysis. Limnol. Oceanogr., 38: 1420-1437. [ Links ]
Mackey, M.D., Mackey, D.J., Higging, H.W. and Wright, S.W. (1996). CHEMTAX: A program for estimating class abundances from chemical markers application to HPLC measurements of phytoplankton. Mar. Ecol. Prog. Ser., 144: 265-283. [ Links ]
Mackey, M.J., Higging, H.W., Mackey, M.D. and Wright, S.W. (1998). Algal class abundances in the western equatorial Pacific: Estimation from HPLC measurements of chloroplast pigments using CHEMTAX. Deep Sea Res., I 45: 1141-1468. [ Links ]
Millán-Núñez, R. y Álvarez-Borrego, S. (1978). Series de tiempo de clorofilas a, b, c y sus feofitinas en las bocas de dos lagunas costeras. Ciencias Marinas, 5:41-52. [ Links ]
Millán-Núñez, R., Álvarez-Borrego, S. and Nelson, D.M. (1982). Effects of physical phenomena on the distribution of nutrients and phytoplankton and productivity in a coastal lagoon. Estuar. Coast. Shelf Sci., 15: 317-335. [ Links ]
Millán-Núñez, E., Sieracki, M.E., Millán-Núñez, R., Lara-Lara, J.R., Gaxiola-Castro, G. and Trees, C.C. (2003). Specific absorption coefficient and flow cytometry phytoplankton biomass in the southern region of the California Current. Deep Sea Res. (in press). [ Links ]
Palinska, A.K., Jahns, T., Rippka, R. and Tandeau de Marsac, N. (2000). Prochlorooccus marinus strain PCC 9511, a picoplankton cyanobacterium, synthesizes the smallest urease. Microbiology, 146: 3099-3104. [ Links ]
Silva-Cota, S. and Álvarez-Borrego, S. (1988). The "El Niño" effect on the phytoplankton of the Northwestern Baja California coastal lagoon. Estuar. Coast. Shelf Sci., 27:109-115. [ Links ]
Utermöhl, H. (1958). Zur Vervollkommnung der quentitativen Phytoplankton-Methodik. Mitteilungen der International Vereinigung fur heorestische und Angewandte Limnologie 9, 1-38. [ Links ]
Wright, S.W., Jeffrey, S.W., Mantoura, R.F.C., Llewellyn, C.A., Bjornland, T., Repeta, D. and Welschmeyer. (1991). Improved HPLC method for the analysis of chlorophylls and carotenoids from marine phytoplankton. Mar. Ecol. Prog. Ser., 77: 183. [ Links ]














