Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Ciencias marinas
versão impressa ISSN 0185-3880
Cienc. mar vol.29 no.4 Ensenada Out. 2003
Artículos
Transporte con las mareas de carbono inorgánico y nutrientes en una marisma litoral (Bahía de Cádiz, SO de España)
Tidal transport of inorganic carbon and nutrients in a coastal salt marsh (Bay of Cádiz, SW Spain)
J. M. Forja1*, T. Ortega1, R. Ponce1, M. de la Paz1, J. A. Rubio1 y A. Gómez-Parra1
1 Departamento de Química Física, Facultad de Ciencias del Mar, Universidad de Cádiz, Campus Río San Pedro, 11510 Puerto Real, Cádiz (España). *E-mail: jesus.forja@uca.es
Recibido en noviembre de 2001;
aceptado en noviembre de 2002.
Resumen
La Bahía de Cádiz se encuentra rodeada de una amplia zona de marismas que intercambian agua a través de un brazo de mar de 18 km de longitud (Caño de Sancti Petri). Estas zonas litorales se caracterizan por ser muy someras (con una profundidad media inferior a 1 m) y poseer un elevado contenido de materia orgánica relativamente mayor en los sedimentos superficiales (entre 1.2% y 2.6% de carbono orgánico). Bajo estas condiciones, se produce una intensa regeneración bentónica de nutrientes, con flujos medios en la zona de 83.2 ± 36.9 mmol m-2 d-1 de carbono inorgánico, 6.36 ± 4.56 mmol m-2 d-1 de NH4+, 1.14 ± 0.56 mmol m-2 d-1 de HPO42-, y 4.54 ± 2.25 mmol m-2 d-1 de SiO2. Una parte de estos nutrientes y carbono inorgánico producidos acceden a través de canales secundarios hasta el Caño de Sancti Petri, y posteriormente se transporta con las mareas a la Bahía de Cádiz y otras zonas litorales limítrofes. En este trabajo se han determinado las concentraciones de carbono inorgánico y nutrientes (NH4+, NO2-, NO3-, HPO42- y SiO2) a tres profundidades diferentes cada hora durante ciclos de marea completos. Simultáneamente se han medido de forma continua las velocidades de corriente a diferentes profundidades. A partir de este conjunto experimental de datos se ha calculado la evolución de las velocidades instantáneas de estas sustancias en los extremos, y por integración, el balance neto para el ciclo de mareas completo. En líneas generales existe una exportación de carbono inorgánico y nutrientes con las mareas, aunque los transportes netos son muy variables, y dependen en gran medida de la hidrodinámica en la zona. Los resultados obtenidos se relacionan con balances previos realizados en la Bahía de Cádiz.
Palabras clave: intercambio con las mareas, flujos bentónicos, nutrientes, carbono inorgánico, marismas costeras.
Abstract
The Bay of Cádiz is surrounded by a broad zone of salt marshes that exchange water through a seawater channel 18 km in length (the Sancti Petri Channel). These littoral zones are characterized by their extreme shallowness (with a mean depth of less than 1 m) and their high content of organic matter, which in relative terms is highest in the surface sediments (between 1.2% and 2.6% organic carbon). Under these conditions, an intensive benthic regeneration of nutrients takes place, with mean fluxes in the zone of 83.2 ± 36.9 mmol m-2 d-1 of inorganic carbon, 6.36 ± 4.56 mmol m-2 d-1 of NH4+, 1.14 ± 0.56 mmol m-2 d-1 of HPO42- and 4.54 ± 2.25 mmol m-2 d-1 of SiO2. A proportion of these nutrients and inorganic carbon produced make their way through secondary channels to the Sancti Petri Channel, and the material is later transported by the tides to the Bay of Cádiz and other bordering littoral zones. In this work, the concentrations of inorganic carbon and nutrients (NH4+, NO2-, NO3-, HPO42- and SiO2) have been determined at three different depths, every hour, during complete tidal cycles. Simultaneously, the current velocities at different depths have been measured continuously. From this set of experimental data, calculations have been made of the evolution of the instantaneous velocities of these substances at each end of the channel, and by integration, the net balance for the complete tidal cycle. In general terms, there is an export of inorganic carbon and nutrients with the tides, although the net transports are very variable and depend to a large extent on the hydrodynamics of the zone. The results obtained correlate with balances previously made in the Bay of Cádiz.
Key words: tidal exchange, benthic fluxes, nutrients, inorganic carbon, coastal salt marshes.
Introducción
Los sistemas costeros se caracterizan por recibir importantes aportes de materia orgánica que sedimenta rápidamente como consecuencia de su escasa profundidad. De hecho, aproximadamente el 80% del carbono orgánico de los océanos se encuentra acumulado en los sistemas litorales (Wollast, 1998). Esta materia orgánica experimenta importantes procesos de mineralización en el sedimento, que originan un importante flujo de especies entre el sedimento y la columna de agua. Desde hace unos 70 años se conoce la importancia de la regeneración bentónica en la dinámica de nutrientes de los sistemas costeros (e.g., Atkins, 1930; Cooper, 1933). En los últimos 20 años se han realizado numerosos trabajos que tienen por objeto la cuantificación de los flujos bentónicos de carbono inorgánico, oxígeno y nutrientes en los sistemas costeros (Callendar y Hammond, 1982; Fisher et al., 1982; Hammond et al., 1985; Devol et al., 1997; Nicholson y Longmore, 1999; Friedrich et al., 2002). En la actualidad, la información disponible no permite establecer modelos simples que permitan la estimación de estos flujos entre el agua y el sedimento a partir de un conjunto reducido de variables experimentales como la temperatura, la profundidad, el contenido de carbono orgánico en sedimentos superficiales, la constitución de esta materia orgánica o la granulometría. Estas relaciones si han sido descritas en algunos sistemas concretos (e.g., Smith y Hinga, 1983; Jergensen, 1983; Klump y Martens, 1989; Cermelj et al., 2001), aunque estos trabajos tienen en gran medida una importancia local, y sólo se verifican en sistemas relativamente homogéneos donde existen importantes gradientes espaciales de alguna de estas variables.
Esta dificultad para modelar los flujos bentónicos de carbono inorgánico, oxígeno y nutrientes en los sistemas litorales se encuentra relacionada con el elevado número de procesos que afectan a la transferencia de estas especies entre el sedimento y la columna de agua. Además de las variables antes indicadas, los flujos bentónicos dependen de la disponibilidad de oxidantes en la cercanía de la interfase (Wollast, 1998), de la distribución de microorganismos bentónicos (Aller y Yinst, 1980), de la acción irrigadora de la macrofauna bentónica (Aller et al., 1985; Giordani y Hammond, 1985; Nicholson y Longmore, 1999; Cermelj et al., 2001), y de la alteración física de los sedimentos por la acción de las corrientes (Klump y Martens, 1981; Hammond et al., 1985), entre otros factores.
El resultado neto de la regeneración bentónica es la existencia de importantes flujos de nutrientes y carbono inorgánico desde el sedimento a la columna de agua, que permiten en muchos casos el sostenimiento de las elevadas productividades primarias que generalmente soportan estas zonas. De hecho, los flujos bentónicos son capaces de suministrar una parte importante de los nutrientes que requiere el fitoplancton en la columna de agua (Dollar et al., 1991).
El objetivo principal de este trabajo consiste en establecer la importancia de la regeneración bentónica en la dinámica del carbono inorgánico y los nutrientes en un sistema somero de la Bahía de Cádiz (SO de España). Para ello, se han cuantificado los flujos bentónicos mediante técnicas in situ en distintas estaciones, y se ha realizado un balance entre las entradas y salidas de carbono inorgánico y nutrientes con las mareas al sistema.
Material y métodos
Descripción de la zona
La Bahía de Cádiz se encuentra situada en el centro del litoral sur Atlántico de la Península Ibérica (fig. 1). El saco interior de la bahía tiene una extensión de 36.6 km2 y una profundidad media de unos 3 m; se encuentra conectada con el Atlántico por medio del Caño de Sancti Petri, un brazo de mar de 18 km de longitud que constituye la vía de alimentación de agua de una zona de aproximadamente 10 km2 de marismas intermareales, por medio de una compleja red de canales secundarios. A 4 km de su extremo norte, el caño recibe vertidos urbanos de la ciudad de San Fernando. Aunque en las proximidades del efluente la concentración de nutrientes aumenta puntualmente, fundamentalmente la de amonio, existe una rápida disminución hacia los extremos hasta alcanzar valores similares a los encontrados en la Bahía de Cádiz (González-Mazo et al., 1998).

Los flujos bentónicos se han determinado en las estaciones GA, situada en la parte central del caño de Sancti Petri que fue dragado previamente a los muestreos, SL, en un estero de la zona de marismas, y PR, en el saco interno de la bahía. El intercambio de carbono inorgánico y nutrientes con las mareas a través de los extremos del caño se ha caracterizado en las estaciones LC y SP.
Los sedimentos de esta zona son fundamentalmente arcillosos (> 50% de su composición), a excepción de los de la desembocadura sur del Caño de Sancti Petri (SP), donde el contenido en arena es mayor. El espesor de la zona óxica es reducido (Gómez-Parra y Forja, 1994) y la densidad de macrofauna bentónica es moderada, con predominio de poliquetos (53-93%), moluscos (3-30%) y crustáceos (2-32%) (DelValls et al., 1998).
Toma de muestras y métodos analíticos
Para la medida de flujos bentónicos se emplearon dos cámaras opacas semiesféricas de 0.385 m2 de superficie y volúmenes de 78.3 y 89.8 L, provistas de sistemas de recirculación/ agitación, y la toma de muestra se realizó desde la superficie cada 30 minutos aproximadamente por aspiración a presión controlada (Gómez-Parra et al., 1987). En cada muestreo, se fondearon simultáneamente las cámaras con la ayuda de buzos. Los flujos se han calculado a partir de las dimensiones de las cámaras y los mejores ajustes lineales o exponenciales de la concentración con el tiempo. Detalles sobre la metodología empleada han sido descritos por Forja y Gómez-Parra (1998). Los flujos bentónicos se han determinado en las estaciones PR, GA y SL entre julio de 1997 y noviembre de 1998.
El intercambio de carbono inorgánico y nutrientes en los extremos del Caño de Sancti Petri (estaciones LC y SP) se ha realizado mediante balances de materia para un ciclo de marea completo. En este caso, los muestreos se realizaron en días consecutivos (13 y 14/07/99) para que no existieran variaciones importantes en el coeficiente de marea (0.95 y 0.96). La toma de muestra se ha realizado con botellas Ruttner a 3 profundidades diferentes con una periodicidad de 1 hora. Simultáneamente se han dispuesto 3 correntímetros Aanderaa Instruments (mod. RCM7) a distintas profundidades. Cada estación se ha considerado constituida por 3 secciones. Las secciones media y de fondo se han supuesto constantes (455 m2 en LC y 500 m2 en SP) y se han calculado a partir de sondas para bajamar escorada. Para la sección de superficie se ha considerado la evolución de la altura de marea y la presencia de las zonas intermareales. De esta forma, sus valores varían con el instante de marea siguiendo funciones seno (S = 291.6 + 252.4 sen (0.531 t -0.572), en LC, y S = 482.0 + 399.1 sen (0.550 t + 0.984) en SP, donde t es el tiempo en horas y S la superficie en m2). Las velocidades de transferencia, en mol s-1, se han obtenido para cada sección a partir del producto de la superficie, velocidad de corriente y concentración.
La concentración de nutrientes se ha medido mediante un autoanalizador TRAACS 800 (Bran and Luebbe) utilizando métodos espectrofotométricos clásicos (Grasshoff et al., 1983). La concentración de carbono inorgánico se ha obtenido a partir del pH y de la valoración potenciométrica de 50 mL de muestra con HCl 0.1 M en NaCl 0.7 M (Metrohm, 716). El algoritmo de cálculo empleado en la especiación del carbono inorgánico ha sido descrito por Ortega et al. (1999). La concentración de oxígeno se ha determinado por el método de Winkler (Grasshoff et al., 1983) y el contenido de carbono orgánico en los sedimentos superficiales mediante oxidación química (El Rayis, 1985). La salinidad de ha medido con un salinómetro de inducción (Rosemount, RS-10).
Resultados y discusión
Flujos bentónicos
En la figura 2 se muestra la variación del pH y las concentraciones de oxígeno, carbono inorgánico, amonio, nitrito, nitrato, fosfato y silicato durante el fondeo de las dos cámaras bentónicas, y se observa la gran similitud que se ha encontrado entre las dos cámaras empleadas en este trabajo. Puede apreciarse que existe una disminución de la concentración de oxígeno a medida que éste se utiliza en la oxidación aeróbica de la materia orgánica, así como de otras sustancias en estado reducido (e.g., sulfuro) productos de la diagénesis. La concentración de carbono inorgánico aumenta durante la incubación, generalmente acompañado por una disminución de los valores del pH. Las concentraciones de amonio, fosfato y silicato en el interior de las cámaras también aumentaron con el tiempo en todos los muestreos realizados. La evolución de las concentraciones de nitrito y nitrato en las incubaciones son menos intensas que las de amonio, y más variables, produciéndose incluso diferencias en el sentido de los flujos.
En la tabla 1 se muestran los intervalos de variación de los flujos bentónicos para los distintos muestreos efectuados. Sus valores pueden considerarse altos en comparación con otros sistemas costeros (e.g., Hammond et al., 1985; Dollar et al., 1991; Giordani et al., 1992; Friedrich et al., 2002).

La relación entre los flujos bentónicos de carbono inorgánico y oxígeno disuelto (CRQ) varía entre 0.9 y 3.7, con un valor medio próximo a 2.2. Por tanto, existe una producción de carbono inorgánico desde los sedimentos que no tiene su origen en la degradación aeróbica de la materia orgánica. Los valores inferiores del CRQ se han obtenido en GA, donde debido a los dragados realizados en la zona se han puesto en contacto sedimentos profundos, de carácter más reductor, con la columna de agua. De ahí que gran parte del consumo de oxígeno disuelto se deba a la oxidación de distintas especies reducidas, y no a la degradación de la materia orgánica (Jergensen, 1977; Canfield et al., 1993; Glud et al., 1999; Thamdrup y Canfield, 2000).
En estaciones de la Bahía de Cádiz cercanas al Caño de Sancti Petri, se han encontrado variaciones muy intensas de la concentración de sulfato en el agua intersticial con la profundidad, lo que indica que la sulfatorreducción es un mecanismo importante de oxidación de la materia orgánica en condiciones anóxicas (Forja et al., 1994).
Por otra parte, los flujos de carbono inorgánico pueden estar potenciados por procesos de disolución de carbonato cálcico biogénico (Hulth et al., 1997; Jahnke y Jahnke, 2000; Mucci et al., 2000; Cermelj et al., 2001), que son abundantes en los sedimentos de la zona. La relación estequiométrica entre los flujos de carbono y amonio varía entre 4 y 70, superior en la mayoría de los casos a la propuesta por Redfield (6.6). Estos elevados valores pueden deberse a la pérdida de nitrógeno por desnitrificación (Seitzinger et al., 1984; Giordani et al., 1992; Friedrich et al., 2002). Asimismo, en sedimentos donde gran parte de la materia orgánica está parcialmente mineralizada la relación C/N suele ser elevada (Wollast, 1998). Por el contrario, las relaciones entre los flujos de carbono inorgánico y fosfato son generalmente menores a la relación de Redfield, con valores comprendidos entre 20 y 178.
Los elevados flujos bentónicos afectan a la distribución de carbono inorgánico y nutrientes en la columna de agua, fundamentalmente para aquellos sistemas que tienen una circulación restringida. En la estación SL, un estero situado en la zona de marismas, se ha descrito una importante estratificación de las concentraciones de oxígeno y amonio en la columna de agua, así como evoluciones circadianas asociadas a la intensidad relativa de los procesos de fotosíntesis y respiración en la lámina de agua más superficial (Forja et al., 1990).
Intercambio con las mareas
En la figura 3 se muestra la variación de la velocidad de corriente a lo largo de un ciclo de marea en los dos extremos del Caño de Sancti Petri. Como criterio general de signos, tanto para las velocidades de corriente como para las velocidades de transferencia, se han asignado valores positivos a las entradas en el Caño de Sancti Petri desde cualquiera de sus extremos, y negativos para las salidas. Las curvas de velocidad que se han obtenido no son simétricas, lo cual es debido al desfase que presenta la marea en la zona interna de la Bahía de Cádiz (5 minutos) con respecto a la entrada desde el Atlántico. A partir de un balance hídrico entre las entradas y salidas entre ambos extremos, se ha estimado un caudal neto de aproximadamente 80 m3 s-1 desde la estación SP hacia la estación LC. Además, las zonas intermareales que se abastecen de agua a través del Caño de Sancti Petri hacen que la hidrodinámica de esta zona sea muy compleja.

En las figuras 4 y 5 se ha representado la evolución con el instante de marea de las velocidades de transferencia de carbono inorgánico disuelto, nitrógeno inorgánico disuelto, fosfato y silicato. En la estación SP (fig. 4) se observa como las mayores velocidades de transferencia se obtienen en la sección de superficie y durante periodos de marea creciente. Estos elevados valores de flujos instantáneos se encuentran en gran medida condicionados por la presencia de una amplia zona intermareal, de aproximadamente 80 m de longitud, que hace que la superficie de esta sección varíe entre 90 y 880 m2 dependiendo del instante de marea. Como consecuencia de la hidrodinámica de la zona, las velocidades de entrada de todos los compuestos son superiores a las de salida, a pesar de que las concentraciones de carbono inorgánico y nutrientes en el agua que sale del caño durante la marea decreciente son más elevadas en todos los casos (tabla 2). En lo que respecta a la estación LC (fig. 5), las velocidades instantáneas de salida de carbono inorgánico y nutrientes son superiores a las de entrada. En este caso, tanto las velocidades de corriente (fig. 3) como las concentraciones (tabla 2) son mayores cuando el agua sale del caño durante los periodos de marea decreciente.
La integración de estas velocidades de transferencia para los periodos de tiempo comprendidos entre una bajamar y la pleamar siguiente, permite establecer las entradas y salidas netas que se producen en el sistema. En la figura 6 se muestran los valores obtenidos para las entradas y salidas en las 3 secciones consideradas de las estaciones LC y SP. En la estación LC el transporte se produce preferentemente en las secciones seleccionadas a profundidad media y en el fondo. Este hecho no indica que exista una estratificación de la velocidad de corriente o de la concentración de los compuestos estudiados, sino que el intercambio se encuentra condicionado por la menor superficie que presenta la sección más superficial (entre 110 y 500 m2), en comparación con las establecidas a profundidad media o en el fondo (455 m2). En esta estación, se ha encontrado una salida neta hacia la Bahía de Cádiz de carbono, nitrógeno y fósforo inorgánicos disueltos, así como de silicio disuelto, en las 3 secciones (superficie, media y fondo) cuando se considera un ciclo completo de marea. Los valores de las entradas y salidas con las mareas en la estación SP son más parecidos que en LC, y el intercambio es más intenso en la sección superficial como consecuencia de la presencia de zonas intermareales. En comparación con LC, cabe destacar las bajas entradas y salidas de nitrógeno inorgánico disuelto, fosfato y silicato a través del extremo sur del caño (SP), motivado por las bajas concentraciones encontradas de estos compuestos.
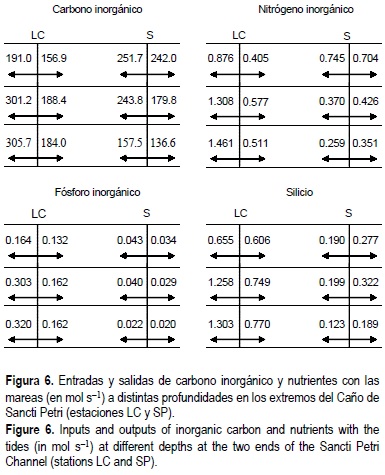
En la figura 7 se presenta el balance final entre las entradas y salidas en las dos estaciones. En lo que respecta al carbono inorgánico disuelto, existe una entrada de 94.6 mol s-1 a través de la estación SP y una salida de 268.6 mol s-1 por LC. Por tanto, el conjunto formado por el Caño de Sancti Petri y la zona de marismas circundantes actúa como un sistema productor de carbono inorgánico, posiblemente relacionado con su producción durante la mineralización de la materia orgánica y con la disolución de CaCO3 biogénico en los sedimentos más superficiales (Cai et al., 1995; Mucci et al., 2000). Para el nitrógeno inorgánico disuelto se ha encontrado una salida neta por ambos extremos, fundamentalmente de amonio, aunque la exportación se produce fundamentalmente por la estación LC (2.152 mol s-1). El fósforo inorgánico disuelto presenta una entrada poco importante a través de SP, y una salida de 0.331 mol s-1 por LC. Por tanto, esta zona se comporta como una fuente de N y P, que a su vez es consecuencia del balance entre la producción bentónica, los vertidos en la zona y su consumo por el fitoplancton. El silicio se exporta hacia el exterior a través de los dos extremos del caño, lo cual se encuentra relacionado con los elevados flujos bentónicos que se han medido en la zona (tabla 1).
Puesto que en los sistemas litorales se suele producir una interconversión de carbono inorgánico y nutrientes en carbono, nitrógeno y fósforo orgánicos particulados (Valiela y Teal, 1978), un balance más riguroso conllevaría la medida del intercambio con las mareas de material particulado. Aunque en este trabajo no se han realizado estas medidas, si existe una intensa salida de sólidos en suspensión por ambos extremos del caño, como puede observarse en la figura 8. Las velocidades de transferencia son sensiblemente mayores para las salidas que para las entradas, motivadas por un aumento importante del contenido de sólidos en suspensión. Como balance final, se obtiene un transporte hacia el exterior del caño de 4470 g s-1 en LC y 1870 g s-1 en SP. Se puede realizar una primera estimación de la cantidad de C, N y P particulados que se exportan con las mareas si se supone que su constitución es similar a la de los sedimentos superficiales de la zona, y por tanto, que la salida de sólidos se produce como consecuencia de una remoción física del sedimento por la acción de las mareas. Los contenidos medios de C, N y P totales en el sedimento superficial de la zona son 3.78 ± 0.79%, 0.066 ± 0.008% y 0.094 ± 0.021% respectivamente (Ortega, 2001; Ponce, 2002), lo que supondría una salida adicional de 20 mol s-1 de C, 0.3 mol s-1 de N y 0.2 mol s-1 de P formando parte de este material particulado. El intercambio real de C, N y P particulados posiblemente sea más elevado, ya que parte de los sólidos en suspensión podría estar formada por material autóctono o vertidos urbanos y de piscifactorías, que poseen una mayor cantidad relativa de C, N y P.

La salida neta de nitrógeno desde el caño hacia la Bahía de Cádiz (aproximadamente 2.5 mol s-1) es similar a la exportación que se produce desde el saco interior de la bahía hacia otras zonas costeras limítrofes (3.9 mol s-1, Gómez-Parra y Forja, 1992).
Consideraciones finales
El balance entre las entradas y salidas con las mareas en el Caño de Sancti Petri y su zona de marismas adyacentes muestra una exportación neta de carbono inorgánico y nutrientes, fundamentalmente hacia la Bahía de Cádiz (180 t d-1 de C, 2.73 t d-1 de N, 0.85 t d-1 de P y 3.31 t d-1 de Si). La elevada productividad primaria de la zona (Gómez-Parra y Forja, 1992), los vertidos principalmente de tipo urbano que se producen, así como la compleja hidrodinámica de la red de drenaje de la zona intermareal dificultan establecer la importancia relativa de las fuentes de carbono inorgánico y nutrientes responsables de este intercambio. No obstante, los elevados flujos bentónicos que se han medido en el sistema, y su elevada relación superficie/volumen, sugieren que la producción desde los sedimentos constituye uno de los factores determinantes de su dinámica, y es responsable en gran medida de su carácter de exportador de estos elementos hacia zonas marinas próximas.
Agradecimientos
El trabajo experimental ha sido financiado por medio del proyecto de investigación CICYT REN2001-3577/MAR.
Referencias
Aller, R.C. and Yingst, J.Y. (1980). Relationships between microbial distributions and the anaerobic decomposition of organic matter in surface sediments of Long Island Sound, USA. Mar. Biol., 56: 29-42. [ Links ]
Aller, R.C., Mackin, J.E., Ullman, W.J., Chen-Hou, W., Shing-Min, T., Jian-Cai, J., Yong-Nian, S. and Jia-Zhen, H. (1985). Early chemical diagenesis, sediment-water solute exchange, and storage of reactive organic matter near the mouth of the Changjiang, East China Sea. Cont. Shelf Res., 4(1/2): 227-251. [ Links ]
Atkins, W.R.G. (1930). Seasonal variations in the phosphate and silicate seawater in relation to the phytoplankton crop. Part V November 1927 to April 1929 compared with earlier years from 1923. J. Mar. Biol. Ass. U.K., 16: 821-852. [ Links ]
Cai, W.J., Reimers, C.E. and Shaw, T. (1995). Microelectrode studies of organic carbon degradation and calcite dissolution at a California Continental rise site. Geochim. Cosmochim. Acta, 59: 497-511. [ Links ]
Canfield, D.E., Jergensen, B.B., Fossing, H., Glud, R., Gundersen, J., Ramsing, N.B., Thamdrup, B., Hansen, J.W., Nielsen, L.P. and Hall, P.O.J. (1993). Pathways of organic carbon oxidation in three continental margin sediments. Mar. Geol., 113: 27-40. [ Links ]
Callendar, E. and Hammond, D.E. (1982). Nutrient exchange across the sediment-water interface in the Potomac River estuary. Estuar. Coast. Shelf Sci., 15: 395-413. [ Links ]
Cermelj, B., Ogring, N. and Faganeli, J. (2001). Anoxic mineralization of biogenic debris in near-shore marine sediments (Gulf of Trieste, northern Adriatic). Sci. Total Environ., 266: 143-152. [ Links ]
Cooper, L.H.N. (1933). Chemical constituents of biological importance in the English Channel, November 1930 to January 1932. Part.I Phosphate, silicate, nitrate and ammonia. J. Mar. Biol. U.K., 18: 677-725. [ Links ]
DelValls, T.A., Conradi, M., García-Adiego, E., Forja, J.M. and Gómez-Parra, A. (1998). Analysis of macrobenthic community structure in relation to different environmental sources of contamination in two littoral ecosystems from the Gulf of Cádiz (SW Spain). Hydrobiologia, 385: 59-70. [ Links ]
Devol, A.H., Codispoti, L.A. and Christensen, J.P. (1997). Summer and winter denitrification rates in western Artic shelf sediments. Cont. Shelf Res., 17(9): 1029-1050. [ Links ]
Dollar, S.J., Smith, S.V., Vink, S.M., Obrebski, S. and Hollibaugh J.T. (1991). Annual cycle of benthic nutrient fluxes in Tomales Bay, California, and contribution of the benthos to total ecosystem metabolism. Mar. Ecol. Prog. Ser., 79: 115-125. [ Links ]
El Rayis, O.A. (1985). Re-assessment of the tritation methods for determination of organic carbon in recent sediments. Rapp. Commm. Int. Mer Mediter., 29: 45-47. [ Links ]
Fisher, T.R., Carlson, P.R. and Barber, R.T. (1982). Sediment nutrient regeneration in three North Carolina estuaries. Estuar. Coast. Shelf Sci., 14: 101-116. [ Links ]
Forja, J.M., Gómez-Parra, A. y Blasco, J. (1990). Ritmos circadianos y perfiles verticales en un ecosistema litoral somero. Scient. Mar., 54: 9-18. [ Links ]
Forja, J.M., Blasco, J. and Gómez-Parra, A. (1994). Spatial and seasonal variation of in situ benthic fluxes in the Bay of Cádiz (SW Spain). Estuar. Coast. Shelf Sci., 39: 127-141. [ Links ]
Forja, J.M. and Gómez-Parra, A. (1998). Measuring nutrient fluxes across the sediment-water interface using benthic chambers. Mar. Ecol. Progr. Ser., 164: 95-105. [ Links ]
Friedrich, J., Dinkel, C., Friedl, G., Pimenov, N., Wijsman, J., Gomoiu, M.T., Cociasu, A., Lopa, L. and Wehrli, B. (2002). Benthic nutrient cycling and diagenetic pathways in the Northwestern Black Sea. Estuar. Coast. Shelf Sci., 54: 369-383. [ Links ]
Giordani, P. and Hammond, D.E. (1985). Techniques for measuring benthic fluxes of 222Rn and nutrients in coastal waters. Consiglio Nazionale delle Ricerche Istituto per la Geologia Marina. Bologna, Rapporto Tecnico N. 20: 1-33. [ Links ]
Giordani, P., Hammond, D.E., Berelson, W.M., Montanari, G., Poletti, R., Milandri, A., Frignani, M., Langone, L., Ravaioli, M., Rovatti, G. and Rabbi, E. (1992). Benthic fluxes and nutrient budget for sediments in the Northern Adriatic Sea: burial and recycling efficiences. Sci. Total Environ., Suppl.: 251-275.
Glud, R.N., Gundersen, J.K. and Holby, O. (1999). Benthic in situ respiration in the upwelling area off central Chile. Mar. Ecol. Prog. Ser., 186: 9-18. [ Links ]
Gómez-Parra, A., Forja, J.M. and Cantero, D. (1987). A new device for sampling water in a shallow ecosystems. Wat. Res., 21: 1437-1443. [ Links ]
Gómez-Parra, A. and Forja, J.M. (1992). Significance of benthic regeneration in nutrient balance in the Bay of Cadiz, SW Spain (a shallow semi-closed coastal ecosystem). Sci. Tot. Environ., Suppl. 1992: 1079-1086. [ Links ]
Gómez-Parra, A. and Forja, J.M. (1994). An operative definition of alkalinity in interstitial water. Mar. Chem., 45: 53-65. [ Links ]
González-Mazo, E., Forja, J.M. and Gómez-Parra, A. (1998). Identifying the processes involved in the hydrochemistry and environmental quality of a littoral system (bay of Cádiz, Spain): a case study using factor analysis. TRAC trends in Anal. Chem., 17: 58-69. [ Links ]
Grasshoff, K., Ehrhardt, M. and Kremling, K. (1983). Methods of Seawater Analysis, 2nd. rev. and extended ed. Verlag-Chemie, Weinheim. Germany, 419 pp. [ Links ]
Hammond, D.E., Fuller, C., Harmon, D., Hartman, B., Korosec, M., Miller, L.G., Rea R., Warren, S., Berelson, W. and Hager, S.W. (1985). Benthic fluxes in San Francisco Bay. Hydrobiologia, 129: 69-90. [ Links ]
Hulth, S., Tengberg, A., Landén, A. and Hall, P.O.J. (1997). Mineralizacion and burial of organic carbon in sediments of the southern Weeddell Sea (Antartica). Deep-Sea Res. I, 44: 955-981. [ Links ]
Jahnke, R.A and Jahnke, D.B. (2000). Rates of C, N, P and Si recycling and denitrification at the US Mid-Atlantic continental slope depocenter. Deep-Sea Res. I, 47: 1405-1428. [ Links ]
Jørgensen, B.B. (1977). The sulfur cycle of a coastal marine sediment (Limnfjorden, Denmark). Limnol. Oceanogr., 22: 814-832. [ Links ]
Jergensen, B.B. (1983). Processes at the sediment-water interface. In: B. Bolin and R.B. Cook (eds.), The Major Biogeochemical Cycles and Their Interactions SCOPE 21, Wiley, New York, pp. 477-509. [ Links ]
Klump, J.V. and Martens, C.S. (1981). Biogeochemical cycling in an organic rich coastal marine basin- II. Nutrient sediment-water exchange processes. Geochim. Cosmochim. Acta, 45: 101-121. [ Links ]
Klump, J.V. and Martens, C.S. (1989). The seasonality of nutrient regeneration in an organic-rich coastal sediment: kinetic modeling of changing pore-water nutrient and sulfate distributions. Limnol. Oceanogr., 34: 559-577. [ Links ]
Mucci, A., Sundby, B., Gehlen, M., Arakaki, T., Zhong, S. and Silverberg, N. (2000). The fate of carbon in continental shelf sediments of eastern Canada: a case study. Deep-Sea Res. II, 47: 733-760. [ Links ]
Nicholson, G.J. and Longmore, A.R. (1999). Causes of observed temporal variability of nutrient fluxes from a southern Australian marine embayment. Mar. Freshwater Res., 50: 581-588. [ Links ]
Ortega, T., Forja, J.M. y Gómez-Parra, A. (1999). Especiación del carbono inorgánico en sistemas marinos límites. Aplicación a sistemas estuáricos y agua intersticial de sedimentos marinos. Bol. Inst. Esp. Oceanogr., 15: 441-446. [ Links ]
Ortega, T. (2001). Flujos de carbono inorgánico en sistemas costeros de la península Ibérica. Tesis Doctoral. Universidad de Cádiz. 390 pp. [ Links ]
Ponce, R. (2002). Regeneración bentónica y dinámica de nutrientes en sistemas litorales de la Península Ibérica. Tesis Doctoral. Universidad de Cádiz. 465 pp. [ Links ]
Seitzinger, S.P., Nixon, S.W. and Pilson, M.E.Q. (1984). Denitrification and nitrous oxide production in a coastal marine ecosystem. Limnol. Oceanogr., 29(1): 73-83. [ Links ]
Smith, K.L. and Hinga, K.R. (1983). Sediment community respiration in the deep sea. In: T. Rowe (ed.), The Sea. Wiley & Sons, New York, pp. 331-370. [ Links ]
Thamdrup, B. and Canfield, D.E. (2000). Benthic respiration in aquatic sediment. In: O.E. Sala, R.B. Jackson, H.A. Mooney and R.W. Howarth (eds.), Methods in Ecosystem Science. Springer, New York, pp. 86-103. [ Links ]
Wollast, R. (1998). Evaluation and comparison of the global carbon cycle in the coastal zone and in the open ocean. In: K.H. Brink and A.R. Robinson (eds.), The Sea. Willey & Sons, New York, pp. 213-252. [ Links ]














