Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Ciencias marinas
versão impressa ISSN 0185-3880
Cienc. mar vol.29 no.3 Ensenada Set. 2003
Artículos
Ciclo de muda y reproducción de la población del langostino Pleoticus muelleri (Crustacea, Penaeoidea) de Mar del Plata
Molting cycle and reproduction in the population of the shrimp Pleoticus muelleri (Crustacea, Penaeoidea) from Mar del Plata
Ana Cristina Díaz1,3*, Ana María Petriella2,3 y Jorge L. Fenucci2,3
1 CIC Pcia Buenos Aires.
2 CONICET Argentina.
3 Departamento de Ciencias Marinas, Universidad Nacional de Mar del Plata. Funes 3350, B7602AYL Mar del Plata, Argentina. *E-mail: acdiaz@mdp.edu.ar
Recibido en marzo de 2003;
aceptado en junio de 2003.
Resumen
El objetivo del trabajo fue estudiar el ciclo de muda de la población de Pleoticus muelleri de Mar del Plata mediante el análisis de la proporción de estadios de muda y su relación con la madurez gonadal. El análisis del ciclo de muda reveló patrones de actividad que se relacionan con el estadio reproductor y con la estación del año. Machos y hembras exhibieron sincronía en la muda. Durante el pico de la estación reproductora, el verano, se prolonga la duración de la intermuda. Las hembras maduras detienen el ciclo de muda en la intemuda o inicio de la premuda y sólo lo reanudan después del desove; en premuda avanzada los ovarios están en reabsorción. La actividad reproductora se inicia en la primavera y se extiende hasta el otoño, con el máximo de hembras impregnadas en verano. Los ovarios tienen crecimiento rápido, desde inmaduros hasta maduración total, desde la primavera hasta el verano, como respuesta al incremento de la temperatura y del fotoperíodo. La potencialidad de impregnación en las hembras es independiente de la talla; la talla inicial corresponde a los 6 g de peso. El incremento del índice gonadosomático durante la maduración indica la gran cantidad de reservas que requiere el desarrollo ovocitario. Este requerimiento se evidencia por los valores de los índices hepatopancreáticos de las hembras que fueron más altos que los de los machos.
Palabras clave: Crustacea, Penaeoidea, crecimiento, muda, reproducción.
Abstract
The relationship between the molting cycle and gonadal maturation was investigated in the Pleoticus muelleri population from coastal waters of Mar del Plata, Argentina. The analysis of the molting activity revealed activity patterns that vary conspicuously with both the changes in shrimp reproductive status and the season. Males and females exhibited a molt synchronism and the intermolt lengthened during the reproductive season. Intermolt and early premolt females presented ripe ovaries, but in late premolt females, ovaries were in resorbed condition. The reproductive activity begins in spring and extends until autumn, with the maximum of impregnated females in summer. Ovarian development from immature to ripe was rapid in spring and summer, probably due to the increase in temperature and photophase. The potentiality of impregnation is independent of the size of females at least 6 g in weight. The large quantity of reserves and food needed for oocyte development was evidenced by the increment of the gonadosomatic index during maturation. Females showed higher hepatopancreatic indexes than males, which could be related to the high energetic requirement.
Key words: Crustacea, Penaeoidea, growth, molt, reproduction.
Introducción
Las poblaciones de crustáceos decápodos muestran una periodicidad en los ritmos individuales de muda que varía geográficamente; la temperatura, el fotoperíodo y otros factores ambientales interactúan como señales que desencadenan los ciclos de muda y reproductor. Una manera de inferir la duración relativa de cada estadio de muda dentro del ciclo completo es el análisis del porcentaje de animales recolectados en un determinado estadio (Drach, 1944; Scheer, 1960). Se dispone de poca información acerca de la relación entre el proceso de muda y las fluctuaciones del ambiente. La mayoría de los trabajos sobre poblaciones se refieren a las pesquerías de crustáceos y no se interesan directamente en fenómenos tales como la regulación de la muda.
En general, la elaboración de curvas de crecimiento es una herramienta empleada frecuentemente en el estudio del manejo de las pesquerías de crustáceos. El análisis de la frecuencia de tallas muestra los picos de abundancia de cada estadio. Examinando muestras secuenciales, la diferencia entre las medias de estas distribuciones indica el crecimiento. Este método de estudio del crecimiento sólo es practicable si los individuos presentan un crecimiento significativo a lo largo del año, poseen una época de cría limitada y no realizan migraciones que alteren la composición de la población estudiada (Petriella y Boschi, 1997).
La relación entre muda y reproducción en los crustáceos ha sido estudiada desde hace décadas (Adiyodi y Adiyodi, 1970). En algunas especies, la cópula, el desove y el período de incubación de los huevos son más exitosos si están sincronizados con la muda. El intervalo entre el apareamiento y la oviposición varía ampliamente en las distintas especies de crustáceos; esta variación está relacionada con los estadios del ciclo de muda de las hembras en el momento de la cópula, el método de transferencia y almacenamiento del esperma y la forma en que los huevos eclosionan. Las diferentes modalidades han evolucionado en los distintos grupos de crustáceos de acuerdo con los ciclos de vida particulares y el ambiente en donde se desarrollan. En general, en los camarones de télico cerrado, el apareamiento ocurre entre hembras "blandas" (recién mudadas) y machos "duros" (en intermuda) (Browdy, 1992), por lo que la impregnación de la hembra sólo es posible durante un corto intervalo de tiempo. En las especies de télico abierto como Pleoticus muelleri (Bate) la cópula se produce entre animales en intermuda e inmediatamente antes del desove (Yano et al., 1988).
El fotoperíodo y la temperatura parecen ser las señales estacionales que sincronizan los ciclos individuales de muda. En un determinado momento del año, todos las hembras de una población tienen el mismo estado de desarrollo ovárico; generalmente estos patrones de puesta altamente sincrónicos se producen en las especies con larva planctónica que, en las latitudes más altas, dependen para su alimentación de los picos de producción primaria (Sastry, 1983). La interacción entre la temperatura del agua de mar y el fotoperíodo es una señal que induce la muda cuando las condiciones en el ambiente son las adecuadas para el crecimiento y permite que los ciclos de muda y reproducción se sincronicen adecuadamente (Conan, 1985).
El langostino argentino P. muelleri se distribuye en el litoral Atlántico desde los 20° S, frente a Espíritu Santo, Brasil, hasta el litoral patagónico a los 50° S, frente a las costas de San Julián, Santa Cruz, Argentina. El ciclo de vida de esta especie se desarrolla totalmente en el mar, sin ingresar a regiones estuarinas costeras. Se han realizado investigaciones acerca de su importancia como recurso pesquero en la región de pesca de Mar del Plata (Angelescu y Boschi, 1959) y en el litoral de Chubut (Boschi y Mistakidis, 1966). Más recientemente se han realizado estudios de las pesquerías de Bahía Blanca (Wyngaard y Bertuche, 1982) y del litoral patagónico (Boschi, 1989). Si bien la pesquería de esta especie es muy importante en cuanto a su volumen y extensión geográfica, los volúmenes medios anuales en la zona de estudio (Mar del Plata, Argentina) son de apenas 204 t, con una fuerte fluctuación de la biomasa mensual (Bertuche et al., 2000).
El objetivo del presente trabajo fue estudiar el ciclo de muda y su relación con la madurez gonadal en la población de P. muelleri de la zona costera de Mar del Plata, Argentina.
Materiales y métodos
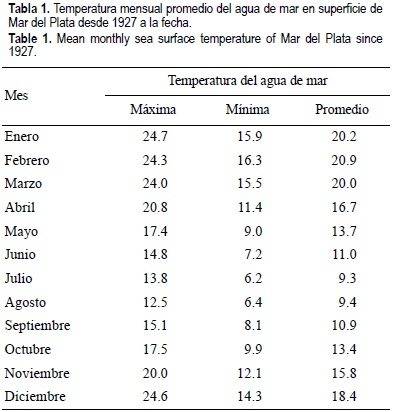
Las observaciones de campo sobre muda y reproducción se realizaron a partir de cuatro muestras correspondientes a cada estación del año, de verano a primavera, tomadas en los meses de octubre, enero, abril y agosto de 2000. Éstas se obtuvieron en el área costera de Mar del Plata mediante pesca con una lancha costera, analizando entre 58 y 100 ejemplares por muestra. El arte de pesca utilizado fue una red de arrastre de 40 mm de malla (medidos entre centros de nudos opuestos con la malla estirada) y 1.2 m de abertura vertical. Se realizaron lances de 30' a 15 m de profundidad, registrándose la temperatura del agua. En la tabla 1 se indica la temperatura mensual promedio del agua de mar en la superficie del área de muestreo (38°03' S; 57°33' W) (http://www.hidro.gov.ar).
En cada ejemplar se determinó el sexo por la presencia del petasma en el macho y se midieron el largo de cefalotórax (desde el margen postorbital hasta el extremo dorsal posterior) y el peso húmedo (con una precisión a la centésima de gramo).
Se efectuó la disección de hembras y machos. El ovario se observó macroscópicamente, clasificándolo de acuerdo con su color y forma en estadios: I, inmaduro; II, previtelogénesis; III, vitelogénesis primaria; IV, maduración total; y V, desovados (Díaz, 2001). La observación macroscópica se fundamentó en la descripción histológica previa de la misma especie (Angelescu y Boschi, 1959). El estado de madurez de los machos se determinó de acuerdo con la presencia de esperma-tóforo en las coxas del quinto par de pereiópodos, de acuerdo con la escala propuesta por King (1948): I, coxas vacías; II, coxas con espermatóforo inmaduro; y III, coxas con esperma-tóforo maduro. Se estimó el tamaño del 50% de las hembras impregnadas y la talla de la primera madurez sexual.
Para reconocer el estadio de muda se observaron los urópodos en cada ejemplar, determinándose los estadios A, B, C y D, y los subestadios D0, D1 y D2, según los criterios establecidos previamente (Díaz y Petriella, 1990).
Se calculó el índice hepatopancreático (IH) e índice gonadosomático (IG) pesando en fresco los hepatopáncreas y ovarios o testículos, respectivamente, y relacionándolos con el peso total de acuerdo con la siguiente fórmula:
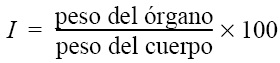
Los datos obtenidos se analizaron estadísticamente mediante análisis de regresión y ANCOVA para la relación entre el largo de cefalotórax y el peso; test de homoscedastici-dad de Barttlet y ANOVA para comparar largo de cefalotórax, peso, IH e IG; y Χ2 para comparar los porcentajes de aparición de estadios de muda y estadíos de maduración gonadal (Sokal y Rohlf, 1995).
Resultados
Datos morfométricos
Se analizaron un total de 346 ejemplares. La red de arrastre utilizada fue selectiva ya que en las capturas no se obtuvieron langostinos menores de 12 mm de largo de cefalotórax. Las tallas máximas y mínimas observadas en el área de estudio a lo largo del año fueron de 13 y 42 mm, correspondientes a 1.4 y 34.4 g de peso.
Los datos morfométricos y los índices somáticos de los machos y hembras recolectados se muestran en la tabla 2.

La proporción de sexos en el total de las muestras analizadas fue de aproximadamente 2:1 (hembras:machos), pero ésta no fue homogénea en todas las épocas del año. En la muestra correspondiente al invierno el 65% fueron machos, mientras que en el otoño el 60% estuvo constituido por hembras. Los machos presentaron valores de peso, largo de cefalotórax, IH e IG menores que los de las hembras en todas las muestras.
La relación entre el peso y el largo de cefalotórax se ajusta a una regresión exponencial tanto en los machos como en las hembras, sin diferencias significativas entre sexos (fig. 1).
Con respecto al IH, el correspondiente a las hembras fue significativamente más alto que el de los machos (P < 0.05). Las variaciones estacionales de los IH indican que los más bajos se registran en primavera (2.15%) y verano (2.55%), se incrementan durante el otoño y alcanzan sus valores máximos en invierno (3.06%).
En la tabla 3 se presentan los valores medios de IG de hembras y machos en los diferentes estadios de maduración. En el caso del índice ovárico se observa que los valores para los distintos estadios de maduración son estadísticamente diferentes (P < 0.05), variando desde 0.99 para el estadio I (inmaduro) hasta 8.05 en el estadio IV (maduro). Los IG de los machos también muestran diferencias significativas entre los distintos estadios.

Ciclo de muda
Se realizó el reconocimiento del estadio del ciclo de muda en todos los ejemplares muestreados. Las frecuencias de estadios de muda a lo largo del año se muestran en la figura 2.
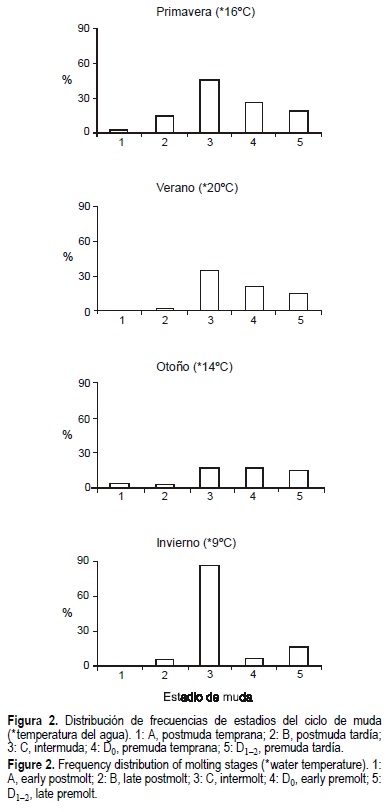
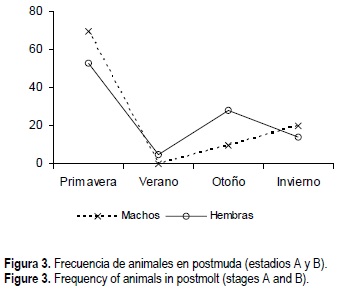
Durante el otoño, período en el que la frecuencia de muda comienza a alargarse, el 87% de los ejemplares se observaron en C y D (intermuda y premuda). En el invierno el 75% se encontraron en intermuda. En la primavera no predomina un estadio de muda único y la frecuencia de aparición de los estadios de postmuda (A y B) fue relativamente alta (16.5%). Esto se corrobora con los datos presentados en la figura 3, que muestra la frecuencia de animales en postmuda (A y B) a lo largo del año; en el verano la frecuencia de animales blandos declina (2.7%). En el verano el 48% de los animales estaban en intermuda.
Actividad reproductora
Se determinó la estación de desove mediante la frecuencia de animales maduros y el IG medio calculado para cada estación del año. El uso del IG para determinar el estadio de madurez gonadal presupone que este índice es independiente del peso. Para determinar si se cumple con esta condición se analizó la regresión IG y el peso total. El coeficiente de correlación r fue de 0.58, valor significativo a P < 0.05; por lo tanto, el análisis puede realizarse a partir del estadio de madurez gonadal.
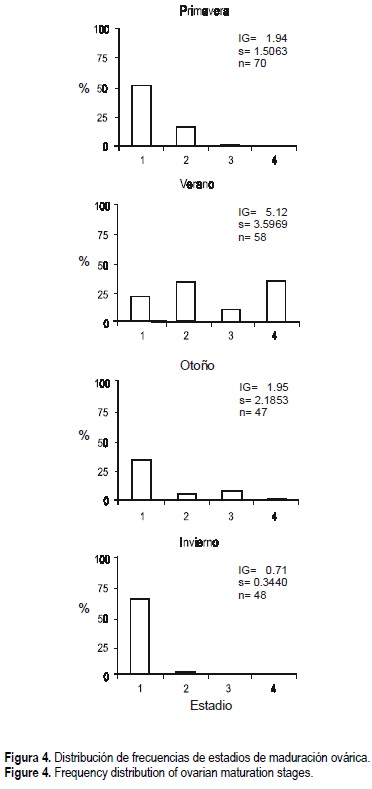
El porcentaje de hembras en los diferentes estadios de maduración gonadal para cada estación del año se muestra en la figura 4. Las variaciones en el porcentaje de estadios de madurez de las hembras se pueden relacionar con los cambios en los valores de IG; altos porcentajes de hembras maduras en las muestras corresponden a altos valores de IG. En todas las muestras se encuentran hembras en estadios I y II (inmaduras y en previtelogénesis). El estadio III (maduración incipiente) estuvo representado en las muestras de primavera a otoño. El estadio de maduración total (estadio IV) aparece, en cambio, sólo en las muestras de verano (35%) y otoño (2%).
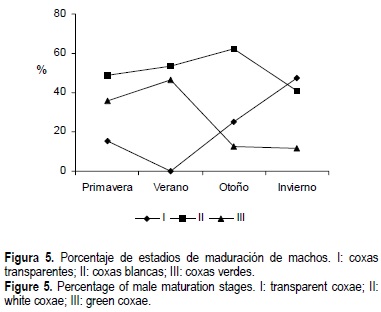
Con respecto a los machos, todos los ejemplares del muestreo de verano poseían espermatóforo (fig. 5).
La distribución de frecuencias de peso de todas las hembras y de las fecundadas se presenta en la figura 6, demostrando que la potencialidad de impregnación es independiente del peso. El peso mínimo de una hembra madura impregnada fue de 6 g; el peso al cual el 50% de las hembras están impregnadas fue estimado en 12 g. La elevada proporción de hembras impregnadas de distintos pesos indicaría que la cópula ocurre varias veces durante la fase adulta.

La ausencia de hembras maduras y fecundadas desde el otoño hasta el verano fue casi total. Los meses de primavera y otoño son de transición; en los primeros comienza la maduración y en los segundos tiene lugar la degeneración de los ovocitos residuales. Durante el verano existe una evidente actividad reproductora, coincidiendo con las altas temperaturas.
Se determinó la relación entre el peso del ovario maduro (estadio IV) y el peso del cuerpo en 24 hembras impregnadas con pesos de entre 6 y 30 g (fig. 7). Se encontró un ajuste lineal (r = 0.94) que indica que el peso del ovario incrementa a una tasa similar a la del peso corporal.

Ciclo de muda y maduración ovárica
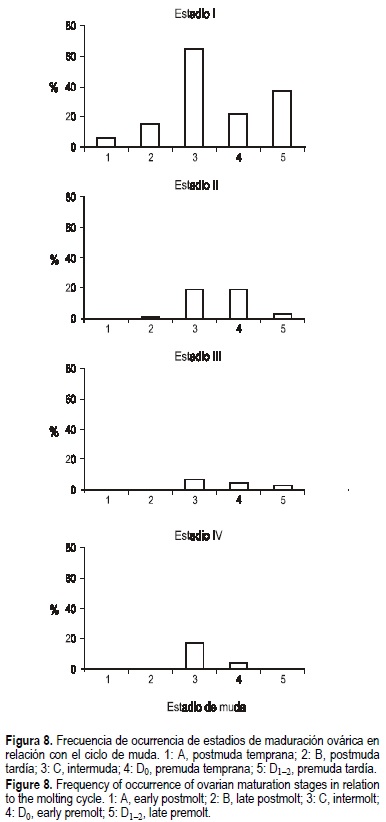
Los registros individuales revelaron que la vitelogénesis se produce durante la intermuda. El 80% de las hembras impregnadas estaban en intermuda y el 20% en D0. No se encontró ninguna hembra en postmuda con ovarios maduros, indicando que el desove ocurre antes de la ecdisis. Los registros individuales de animales salvajes y mantenidos en laboratorio revelaron que la vitelogénesis ocurre en la postmuda y a lo largo de la intermuda, y que los desoves ocurren en estadio C y premuda temprana (D0). Cuando los animales progresan hacia la premuda tardía (D1-2) los ovarios están desovados o en reabsorción (fig. 8).
Discusión
Los ritmos biológicos se describen generalmente como dirigidos por un reloj interno, con su propio período, independiente del ambiente; su periodicidad se adaptaría secundariamente a los factores físicos externos. Los ciclos individuales de muda están sincronizados en la población, pero no hay información acerca de cómo esos patrones están adaptados localmente: si se ajustan de manera especie específica con los cambios rítmicos del ambiente o si existe algún componente genético (Conan, 1985). Los factores externos que disparan el sincronismo de la muda no se conocen bien. Como causantes de ese proceso sería quizás más apropiado buscar otros factores, tales como ritmos biológicos endógenos o intercambios de señales químicas entre individuos que mudan.
El análisis de la actividad de muda en la población de P. muelleri revela patrones de actividad que varían notablemente con los cambios en el estatus reproductor de los langostinos y con la estación. Machos y hembras exhiben una sincronía en la muda que se refleja en un pico en el porcentaje de animales blandos después de la época de desove (otoño). Si bien este fenómeno es inusual en una población de desovantes libres, ha sido documentado en otras especies como por ejemplo en Sicyonia ingentis (Burkenroad) (Anderson et al., 1985): la frecuencia de muda fue especialmente alta en la primavera, antes del inicio de la temporada de desove, y en los meses de otoño e invierno cuando los animales maduros son difíciles de encontrar.
Durante el pico de la estación reproductora de P. muelleri, el verano, se observa que los estadios de muda C y D0 se prolongan, al igual que en otras especies de crustáceos decápodos (Aiken, 1973). No sólo varía la duración absoluta del ciclo de muda sino que también lo hace la duración de cada estadio con la época del año. Las hembras en estadios de muda C y D presentan ovarios maduros; en D2 y D3 los ovarios están en reabsorción. Esto concuerda con lo descrito para otras especies de penaeoideos, como Fenneropenaeus indicus (H. Milne Edwards) (Emmerson, 1980), S. ingentis (Anderson et al., 1985) y Artemesia longinaris Bate (Petriella y Bridi, 1992). La reproducción y la muda son procesos a menudo sincrónicos y antagónicos en los decápodos (Emmerson, 1980; Adiyodi, 1985). Para demostrar esa interrelación, en los estudios reproductivos es importante registrar el estadio de muda de cada hembra o la incidencia de hembras blandas en cada muestra. En el langostino argentino se concluye que todas las hembras maduras se encuentran en intermuda (estadio C) o premuda temprana (estadio D0).
A partir de los datos obtenidos no es posible aventurar una conclusión acerca del significado ecológico de la sincronía de muda de la población, pero se pueden discutir algunas hipótesis. De acuerdo con Reaka (1976), en estomatópodos la sincronía de muda provee un refugio temporal evitando el canibalismo; sin embargo, este comportamiento no es frecuente en las poblaciones de P. muelleri. También es posible que la sincronía proporcione mayores oportunidades para la cópula: el langostino es una especie de télico abierto y la cópula se produce durante un corto intervalo de tiempo durante el cual la hembra está madura y tanto el macho como la hembra están en el mismo estadio de muda (C, intermuda).
En latitudes tropicales y subtropicales las poblaciones de penaeoideos presentan un patrón bimodal de desove y reclutamiento (Unar y Naamin, 1984; Staples y Rothlisberg, 1990; Chu et al. , 1993). Fenneropenaeus merguiensis (De Man) en el Golfo de Carpentaria (Rothlisberg et al., 1985) tiene el principal reclutamiento en el otoño, con un pico de desove menor en primavera; una gran proporción de los nuevos reclutas madura y desova en el otoño. Sin embargo, debido a las condiciones desfavorables se produce una gran mortalidad de postlarvas y juveniles, y sobreviven muy pocos individuos de esta generación que contribuyen al stock reproductor de la primavera siguiente. Así, si bien hay dos períodos de desove, sólo una generación contribuye significativamente a la población adulta. Metapenaeus ensis (De Haan) exhibe una amplia estación de desove, de marzo a noviembre; los datos sugieren dos picos de desove, uno en marzo y otro en agosto y septiembre (Chu et al. , 1993). En latitudes templadas se observa un patrón de desove unimodal con un único período de reclutamiento bien definido. El tiempo de generación de los individuos es claramente un año; los camarones desovan durante el verano. Por ejemplo, Farfantepenaeus aztecus (Ives) desova en primavera y en otoño en Florida Bay, pero sólo en verano en la costa norte de Carolina (Pérez-Farfante, 1969; Cook y Lindner, 1970). Fenneropenaeus merguiensis exhibe un patrón bimodal a 25° S (Dredge, 1985), pero es unimodal en el sur de China (21-23° N) (Dall et al., 1990). El desove de S. ingentis ocurre entre junio y octubre, con la posibilidad de desoves múltiples durante el verano (Anderson et al., 1985). Kennedy et al. (1977), estudiando Sicyonia brevirostris Stimpson, encontraron que los desoves se producen durante todo el año, con picos de enero a marzo.
El langostino argentino tiene una amplia zona de distribución, con distintos patrones reproductivos. En el litoral patagónico (Chubut y norte del Golfo San Jorge) presenta un largo período de desove, con presencia de machos y hembras maduros sexualmente, que se extiende desde la primavera hasta el fin del verano (noviembre a marzo), con otro menos importante en invierno (agosto y septiembre) (Boschi, 1989). En la población de Mar del Plata, que muestra fluctuaciones anuales muy notorias en cuanto a numerosidad, la actividad reproductora se inicia en la primavera y se extiende hasta el otoño, con el máximo de hembras impregnadas en verano. Con respecto a la proporción de sexos, los resultados obtenidos en este trabajo muestran un predominio, casi general, de hembras en los meses de primavera, verano y otoño. Este fenómeno puede estar influido, entre otros factores, por un diferente grado de actividad, selectividad del arte de pesca, migraciones desiguales y/o una distribución diferencial de machos y hembras (Wenner, 1972). Para Melicertus kerathurus (Forskâl) se registró esta misma diferencia en la proporción de sexos, misma que se ha atribuido al crecimiento diferencial de los sexos y a una mayor vulnerabilidad de las hembras luego de la época de reproducción (Rodríguez, 1985).
El presente estudio muestra un incremento progresivo de la talla de las hembras durante la estación reproductora, coincidiendo con lo descrito para Metapenaeus ensis (Crocos y Kerr, 1983). Este fenómeno puede estar relacionado con los altos requerimientos energéticos de la reproducción. La gran cantidad de reservas y alimento que requiere el desarrollo ovocitario es evidente al observar el incremento del IG durante la maduración. La razón principal para usar el IG en los estudios de reproducción es poder interpretar la variación debida a la talla de los individuos. Los IG se han usado extensamente en estudios con camarones marinos (Anderson et al., 1985; Shlagman et al., 1986; Potter et al., 1989; El Hady et al., 1990). Sin embargo, los resultados del presente trabajo indican que en P. muelleri el IG depende de la talla, coincidiendo con lo encontrado en Melicertus plebejus (Hess) (Courtney et al., 1995). Los IH más altos de las hembras, comparados con los de los machos, podrían estar relacionados con las altas demandas energéticas ya que el hepatopáncreas es el principal órgano de almacenamiento de nutrientes de los crustáceos decápodos (Icely y Nott, 1992), e interviene en la movilización de lípidos hacia el ovario durante la maduración sexual de los peneidos (Teshima y Kanazawa, 1983; Mourente y Rodríguez, 1991).
En Penaeus monodon Fabricius (Primavera et al., 1998), el tamaño más grande de las hembras se debe al mayor incremento en peso por muda que representa una tasa de crecimiento más rápida (Hansford y Hewitt, 1994). Makinouchi e Hirata (1995) observaron diferencias en ganancia en peso, de 5.5 g mes-1 para machos y 10 g mes-1 para hembras. En P. muelleri se observa que las hembras presentan tallas significativamente más grandes que los machos.
En los individuos estudiados se observó un rápido desarrollo de los ovarios, desde inmadurez a madurez total, desde la primavera hasta el verano. Probablemente esta rápida maduración ovocitaria se deba al incremento de la temperatura y a la duración del fotoperíodo que tiene lugar en esos meses, tal como lo demostró Laubier-Bonichon (1978) estudiando la maduración sexual de los peneidos. En Melicertus kerathurus, las hembras de gran talla alcanzan la madurez total desde principios hasta finales de abril (primavera) (Rodríguez, 1985).
Al analizar la distribución de frecuencias de peso de todas las hembras con respecto a las fecundadas se comprobó que la potencialidad de impregnación es independiente de la talla en hembras de, como mínimo, 6 g de peso. La relación entre el porcentaje de inseminación y la clase de edad corresponde a una curva sigmoidea, como se ha comprobado en otros crustáceos penaeoideos (Crocos y Kerr, 1983; Crocos, 1987; Courtney y Dredge, 1988; Courtney et al., 1995).
Durante el período reproductor el desarrollo ovárico en P. muelleri es sincrónico; cada hembra tiene la capacidad de producir desoves múltiples, uno por ciclo de muda. Macchi et al. (1992) comprobaron que la capacidad de recuperación del ovario en esta especie explica la posibilidad de desoves múltiples. Iorio et al. (1996) constataron que más del 50% de las hembras de la zona de pesca de Bahía Blanca, con ovarios en maduración intermedia, presentaban indicios de un desove previo.
Agradecimientos
Este trabajo ha sido posible gracias al financiamiento de la Agencia Nacional de Promoción Científica y Tecnológica y la Universidad Nacional de Mar del Plata, Argentina, en el marco del proyecto PICT 2000-2001 N° 8-8615.
Referencias
Adiyodi, R.G. (1985). Reproduction and its control. In: D.E. Bliss and L.H. Mantel (eds.), The Biology of Crustacea. Vol. 9. Integuments, Pigments and Hormonal Processes. Academic Press, New York, pp. 147-215. [ Links ]
Adiyodi, K.G. and Adiyodi, R.G. (1970). Endocrine control of reproduction in decapod crustacea. Biol. Rev., 45: 121-165. [ Links ]
Aiken, D.E. (1973). Pro-ecdysis, setal development, and molt prediction in the American lobster (Homarus americanus). J. Fish. Res. Bd. Canada, 30(9): 1337-1344. [ Links ]
Anderson, S.L., Clark Jr., W.H. and Chang, E.S. (1985). Multiple spawning and molt synchrony in a free spawning shrimp (Sicyonia ingentis: Penaeoidea). Biol. Bull., 168: 377-394. [ Links ]
Angelescu, V. y Boschi, E.E. (1959). Estudio biológico pesquero del langostino de Mar del Plata en conexión con la Operación Nivel Medio. Ser. Hidrog. Naval, H1017 Público, 135 pp. [ Links ]
Bertuche, D., Fischbach, C., Roux, A., Fernández, M. y Piñero, R. (2000). Langostino (Pleoticus muelleri). En: S. Bezzi, R. Akselman y E. Boschi (eds.), Síntesis del Estado de las Pesquerías Marítimas Argentinas y de la Cuenca del Plata. Años 1997-1998 con una actualización de 1999. Instituto Nacional de Investigación y Desarrollo Pesquero, Mar del Plata, pp. 179-190. [ Links ]
Boschi, E.E. (1989). Biología pesquera del langostino del litoral patagónico de Argentina (Pleoticus muelleri). Contrib. INIDEP, 646: 1-71. [ Links ]
Boschi, E.E. y Mistakidis, M. (1966). Resultados preliminares de las campañas de pesca exploratoria del langostino y el camarón en Rawson, 1962-1963. CARPAS, Doc. Téc., 6: 1-15. [ Links ]
Browdy, C.L. (1992). A review of the reproductive biology of Penaeus species: Perspectives on controlled shrimp maturation systems for high quality nauplii production. In: G. Chamberlain, J. Villalon and J. Wyban (eds.), Proc. of the Special Session on Shrimp Farming. World Aquaculture Soc., pp. 22-51. [ Links ]
Chu, K.H., Tam, Y.K., Chung, C.K. and Ng, W.L. (1993). Morphometric relationships and reproductive maturation of the shrimp, Metapenaeus ensis, from commercial catches in Hong Kong. Fish. Res., 18: 187-197. [ Links ]
Conan, G.Y. (1985). Periodicity and phasing of molting. In: A.M. Wenner (ed.), Factors in Adult Growth. A.A. Balkema, Rotterdam/Boston, pp. 73-99. [ Links ]
Cook, H.L. and Lindner, M.J. (1970). Synopsis of biological data on the brown shrimp Penaeus aztecus aztecus Ives 1891. FAO Fish. Rep., 57: 1471-1497. [ Links ]
Courtney, A.J. and Dredge, M.C.L. (1988). Female reproductive biology and spawning periodicity of two species of king prawns, Penaeus longistylus and Penaeus latisulcatus, from Queensland's East Coast Fishery. Aust. J. Mar. Freshwater Res., 39: 729-741. [ Links ]
Courtney, A.J., Montgomery, S.S., Die, D.J., Andrew, N.L., Cosgrove, M.G. and Blount, C. (1995). Maturation in the female eastern king prawn Penaeus plebejus from coastal waters of eastern Australia, and considerations for quantifying egg production in penaeid prawns. Mar. Biol., 122: 547-556. [ Links ]
Crocos, P.J. (1987). Reproductive dynamics of the grooved tiger prawn Penaeus semisulcatus in the northwestern Gulf of Carpentaria, Australia. Aust. J. Mar. Freshwater Res., 38: 79-90. [ Links ]
Crocos, P.J. and Kerr, J.D. (1983). Maturation and spawning of the banana prawn Penaeus merguiensis de Man (Crustacea: Penaeidae) in the Gulf of Carpentaria, Australia. J. Exp. Mar. Biol. Ecol., 69: 37-59. [ Links ]
Dall, W., Hill, B.J., Rothlisberg, P.C. and Staples, D.J. (1990). The biology of the Penaeidae. Adv. Mar. Biol., 27: 1-189. [ Links ]
Díaz, A.C. (2001). Estudio sobre la fisiología de la muda y la maduración gonadal del langostino Pleoticus muelleri Bate. Tesis doctoral, Universidad Nacional de Mar del Plata, Argentina, 171 pp. [ Links ]
Díaz, A.C. and Petriella, A.M. (1990). Moult staging in the shrimp, Pleoticus muelleri Bate. J. Aquaculture in the Tropics, 5: 181-189. [ Links ]
Drach, P. (1944). Etude préliminaire sur le cycle d'intermue et son conditionnement hormonal chez Leander serratus (Pennant). Biol. Bull., 78: 40-60. [ Links ]
Dredge, M.C.L. (1985). Importance of estuarine overwintering in the life cycle of the banana prawn, Penaeus merguiensis. In: P.C. Rothlisberg, B.J. Hill and D.J. Staples (eds.), 2nd Australian National Prawn Seminar. Cleveland, pp. 115-123. [ Links ]
El Hady, H.A., Abdel Razek, F.A. and Ezzat, A. (1990). Reproduction of Penaeus semisulcatus de Haan in Damam Water (Arabian Gulf), Kingdom of Saudi Arabia. Arch. Hydrobiol., 118: 241-251. [ Links ]
Emmerson, W.D. (1980). Induced maturation of prawn Penaeus indicus. Mar. Ecol. Prog. Ser., 2: 121-131. [ Links ]
Hansford, S.W. and Hewitt, D.R. (1994). Growth and nutrient digestibility by male and female Penaeus monodon: Evidence of sexual dimorphism. Aquaculture, 125: 147-154. [ Links ]
Icely, J.D. and Nott, J.A. (1992). Digestion and absorption: Digestive system and associated organs. In: Microscopic Anatomy of Invertebrates, Vol. 10: 147-201. [ Links ]
Iorio, M.I., Macchi, G.J., Fischbach, C.E. y Christiansen, H.E. (1996). Estudios sobre la dinámica reproductiva del langostino Pleoticus muelleri en el área de Bahía Blanca (Pcia. de Buenos Aires, Argentina). Frente Marítimo, Vol. 16, Sec. A: 111-118. [ Links ]
Kennedy, F.S., Crane, J.J., Schlieder, R.A. and Barber, D.G. (1977). Studies of the rock shrimp, Sicyonia brevirostris, a new fishery resource on Florida's Atlantic shelf. Florida Maine Res. Publ., 27: 1-69. [ Links ]
King, J.E. (1948). A study of the reproductive organs of the common marine shrimp, Penaeus setiferus (Linnaeus). Biol. Bull., 94: 244-262. [ Links ]
Laubier-Bonichon, A. (1978). Ecophysiologie de la reproduction chez la crevette Penaeus japonicus. Trois années d'expérience en milieu contrôlé. Oceanol. Acta, 1: 135-150. [ Links ]
Macchi, G.J., Iorio, M.I. y Christiansen, H.E. (1992). Aspectos del desove y fecundidad del langostino Pleoticus muelleri (Bate, 1888) (Crustacea, Decapoda, Solenoceridae). Rev. Biol. Mar., Valparaíso, 27(1): 43-58. [ Links ]
Makinouchi, S. and Hirata, H. (1995). Studies on maturation and reproduction of pond-reared Penaeus monodon for developing a closed life-cycle system. Israeli J. Aquaculture, 47: 68-77. [ Links ]
Mourente, G. and Rodríguez, A. (1991). Variation in the lipid content of wild-caught females of the marine shrimp Penaeus kerathurus during sexual maturation. Mar. Biol., 110: 21-28. [ Links ]
Pérez-Farfante, I. (1969). Western Atlantic shrimps of the genus Penaeus. Fish. Bull., 67: 461-591. [ Links ]
Petriella, A.M. y Boschi, E.E. (1997). Crecimiento en crustáceos decápodos: Resultados de investigaciones realizadas en Argentina. Invest. Mar., Valparaíso, 25: 135-157. [ Links ]
Petriella, A.M. y Bridi, R.J. (1992). Variaciones estacionales del ciclo de muda y la maduración ovárica del camarón (Artemesia longinaris). Frente Marítimo, 11: 85-92. [ Links ]
Potter, I.C., Baronie, F.M., Manning, R.J.G. and Loneragan, N.R. (1989). Reproductive biology and growth of the western school prawn, Metapenaeus dalli, in a large Western Australian estuary. Aust. J. Mar. Freshwater Res., 40: 327-340. [ Links ]
Primavera, J.H., Parado-Estepa, F.D. and Lebata, J.L. (1998). Morphometric relationship of length and weight of giant tiger prawn Penaeus monodon according to life stage, sex and source. Aquaculture, 164: 67-75. [ Links ]
Reaka, M.L. (1976). Lunar and tidal periodicity of molting and reproduction in stomatopod Crustacea: A shellfish herd hypothesis. Biol. Bull., 150: 468-490. [ Links ]
Rodríguez, A. (1985). Biología del langostino Penaeus kerathurus (Forskål, 1775) del golfo de Cádiz. I. Reproducción. Inv. Pesq., 49(4): 581-595. [ Links ]
Rothlisberg, P.C., Staples, D.J. and Crocos, P.J. (1985). A review of the life history of the banana prawn, Penaeus merguiensis, in the Gulf of Carpentaria. In: P.C. Rothlisberg, B.J. Hill and D.J. Staples (eds.), 2nd Australian National Prawn Seminar. Cleveland, pp. 125-136. [ Links ]
Sastry, A.N. (1983). Ecological aspects of reproduction. In: F.J. Veernberg and W.B. Vernberg (eds.), The Biology of Crustacea. Vol. 8. Academic Press, New York, pp. 179-270. [ Links ]
Scheer, B.T. (1960). Aspects of the intermoult cycle in Natantians. Comp. Biochem. Physiol., 1: 3-18. [ Links ]
Shlagman, A., Lewinsohn, C. and Tom, M. (1986). Aspects of the reproductive activity of Penaeus semisulcatus de Haan along the southeastern coast of the Mediterranean. Mar. Ecol., 7: 15-22. [ Links ]
Sokal, R.R. and Rohlf, F.J. (1995). Biometry: The Principles and Practice of Statistics in Biological Research. W.H. Freeman, New York, 887 pp. [ Links ]
Staples, D.J. and Rothlisberg, P.C. (1990). Recruitment of penaeid prawns in the Indo-West Pacific. In: R. Hirano and I. Hanyu (eds.), The Second Asian Fisheries Forum. Asian Fisheries Soc., Manila, pp. 847-850. [ Links ]
Teshima, S. and Kanazawa, A. (1983). Variation in lipid compositions during ovarian maturation of the prawn. Bull. Jap. Soc. Sci. Fish., 49: 957-962. [ Links ]
Unar, M. and Naamin, N. (1984). A review of Indonesian shrimp fisheries and their management. In: J.A. Gulland and B.J. Rothschild (eds.), Penaeid Shrimps: Their Biology and Management. Fishing News Books, Surrey, pp. 104-110. [ Links ]
Wenner, A.M. (1972). Sex-ratio as a function of size on marine crustacea. Am. Nat., 106(949): 321-350. [ Links ]
Wyngaard, J.G. y Bertuche, D.A. (1982). Algunos aspectos de la biología pesquera del langostino (Pleoticus muelleri) de la Bahía Blanca y un análisis del desembarco comercial del periodo 1955-1979. Rev. Invest. Des. Pesq., 3: 59-76. [ Links ]
Yano, I., Kanna, R.A., Oyama, R.N. and Wyban, J.A. (1988). Mating behaviour in the penaeid shrimp Penaeus vannamei. Mar. Biol., 97: 171-175. [ Links ]














