Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Ciencias marinas
Print version ISSN 0185-3880
Cienc. mar vol.29 n.3 Ensenada Sep. 2003
Artículos
Microhábitat y biota asociada de juveniles de abulón Haliotis fulgens y H. corrugata en Bahía Tortugas, Baja California Sur, México
Microhabitat and associated biota of abalone juveniles, Haliotis fulgens and H. corrugata, in Bahía Tortugas, Baja California Sur, Mexico
Laura Carreón-Palau1, Sergio A. Guzmán-del Próo1*, Jorge Belmar-Pérez1, Jorge Carrillo-Laguna1 y Raúl Herrera-Fragoso1
1 Escuela Nacional de Ciencias Biológicas, IPN, Prol. Carpio y Plan de Ayala s/n, México 11340, D.F. *E-mail: sguzman@encb.ipn.mx
Recibido en noviembre de 2002;
aceptado en junio de 2003.
Resumen
El abulón es un importante recurso económico en la costa oeste de Baja California. Las especies más importantes en la pesquería son el abulón azul (Haliotis fulgens) y el abulón amarillo (H. corrugata). La declinación de la pesquería de abulón en México, se ha atribuido, entre otros factores, a la sobrepesca. Entre los parámetros ploblacionales, el reclutamiento es un evento altamente variable. Para lograr un mejor entendimiento de la ecología del reclutamiento de juveniles, se estudiaron las características del microhábitat de juveniles de abulón azul y amarillo en Bahía Tortugas, Baja California Sur, México, durante el otoño y primavera de 1996 a 1998. Se estudiaron dos bancos abuloneros con diferente profundidad, relieve y grado de exposición al oleaje: Clam Bay, con profundidades de 0.5 a 5 m, y el Morrro de Adentro, con profundidades de 6 a 12 m. Se identificaron cuatro tipos diferentes de fondo: (a) protegido y de bajo relieve, (b) semiexpuesto y de relieve moderado, (c) expuesto y de alto relieve, y (d) expuesto y de relieve moderado. Se encontraron juveniles de abulón azul y amarillo de 3 a 13 mm bajo pequeñas rocas planas de 15 a 20 cm de longitud, siempre cubiertas por algas coralinas costrosas. Pequeños juveniles de Stenoplax, Fisurella y Crepipatella de tamaños similares compartían el microhábitat. Se encontraron juveniles de abulón de 15 a 90 mm de longitud debajo de rocas rómbicas, aplanadas o de forma irregular (20 a 110 mm de longitud), la mayoría dispuesta en arreglos imbricados. Aquí, los juveniles de abulón compartían el microhábitat con briozoarios, esponjas, quitones, ascidias y anélidos. Los fondos con arreglo imbricado, escasa profundidad y baja exposición al oleaje en Clam Bay, favorecieron la ocurrencia de juveniles de H. fulgens. Los fondos expuestos y más profundos del Morro de Adentro favorecieron la presencia de juveniles de H. corrugata.
Palabras clave: juveniles de abulón, Haliotis fulgens, Haliotis corrugata, microhábitat, comunidad asociada.
Abstract
Abalone is an important economical resource on the west coast of Baja California. The most important species in this fishery are green and pink abalone (Haliotis fulgens and H. corrugata, respectively). Overfishing has been implicated in the decline of the Mexican abalone fishery. Among the population parameters, recruitment is a highly variable event. To obtain a better understanding of the ecology of abalone juvenile recruitment, the physical and biological characteristics of the microhabitat of juveniles of green and pink abalone were studied at Bahía Tortugas, Baja California Sur (Mexico), during autumn and spring from 1996 to 1998. Two abalone reefs with different depth, relief and wave exposure were surveyed: Clam Bay, with depths of 0.5 to 5 m, and Morro de Adentro, with depths of 6 to 12 m. Four different bottom types were recognized: (a) sheltered and low relief bottom, (b) semiexposed and moderate relief bottom, (c) exposed and high relief bottom, and (d) exposed and moderate relief bottom. Juveniles of green and pink abalone from 3 to 13 mm shell length were observed under small rocks, pebbles and flat stones no longer than 15-20 cm, always covered with crusts of coralline algae. Several tiny juveniles of Fisurella, Stenoplax, and Crepipatella of similar sizes (5-10 mm) shared the microhabitat. Juveniles between 15 and 90 mm shell length were found under flat, rhombic or irregular-shaped rocks (20-110 mm length), most of them deployed in imbricate arrangement. Abalone juveniles shared this microhabitat with bryozoans, sponges, ascidians, chitons, and annelids. Bottoms with imbricate arrangement, low wave exposure, and the low depth of Clam Bay were favorable for the high occurrence of juveniles of H. fulgens. Juveniles of H. corrugata showed a high occurrence in exposed and deeper zones of Morro de Adentro.
Key words: abalone juveniles, Haliotis fulgens, Haliotis corrugata, microhabitat, associated community.
Introducción
El abulón (Haliotis spp.) es un recurso pesquero de gran importancia económica en la costa occidental de la Península de Baja California. Su producción actual es de 285 t anuales con un valor de 26 millones de dólares (CONAPESCA, 2001). Las especies más importantes de esta pesquería son el abulón azul (Haliotis fulgens Philippi, 1845) y el amarillo (Haliotis corrugata Gray, 1828). Ambas especies desde hace varios años acusan signos severos de sobrepesca (Guzmán-del Proó, 1992).
Como la mayoría de los recursos bentónicos que se explotan comercialmente, los abulones son especies con muy escaso movimiento dentro de su hábitat. La sobrevivencia, el crecimiento y el reclutamiento son parámetros poblacionales críticos para su explotación y manejo, los cuales dependen en gran medida de los cambios en las condiciones ambientales que les rodean. La alta variabilidad detectada en el reclutamiento de estas especies se debe en gran medida a la interacción de las poblaciones con los factores físicos y biológicos de su hábitat (Crossland, 1991).
Se ha reportado que en la fase juvenil los abulones tienen hábitos crípticos (Cox, 1962), habitando generalmente la superficie inferior de las rocas (Edwards, 1913, citado en Cox, 1962; Kangas y Shepherd, 1984; Shepherd y Turner, 1985; McShane, 1994). El tipo de sustrato, la profundidad, la presencia de mantos de macroalgas y en una gran proporción los refugios y lugares poco expuestos al oleaje, son factores que favorecen mayores densidades de juveniles (Tegner y Butler, 1985; Searcy, 1986; McShane, 1994; McShane y Naylor, 1995; Shepherd y Partington, 1995). Sin embargo, no existe una descripción detallada del microhábitat para las especies mexicanas de Haliotis en esta fase de su ciclo de vida, información indispensable para entender la ecología de la fase juvenil y su reclutamiento a la pesquería.
El objetivo de este estudio fue describir el microhábitat de la fase juvenil de H. fulgens y H. corrugata y su biota asociada, así como la variación de esta comunidad en el tiempo.
Área de estudio
El estudio se realizó en dos arrecifes rocosos cercanos a Bahía Tortugas, Baja California Sur, con diferente relieve y grado de exposición al oleaje: (1) el Morro de Adentro, banco de abulón expuesto al oleaje y a vientos del noroeste, que se localiza en el extremo suroeste de la bahía y presenta una profundidad máxima de 15 m; y (2) el banco de Clam Bay, localizado en el sublitoral de una pequeña ensenada localizada 6 km al sureste de Bahía Tortugas, guarecida del oleaje y de los vientos del noroeste, con una profundidad máxima de 6 m (fig. 1).

Material y métodos
El estudio cubrió dos ciclos anuales y dos estaciones del año, desde el otoño de 1996 a la primavera de 1998. Las observaciones se realizaron en los meses de noviembre y abril de cada año, coincidiendo con los picos reproductivos de ambas especies (Cárdenas et al., 1971; García y Ortiz, 1992; Belmar-Pérez y Guzmán-del Próo, 1992).
Las observaciones se realizaron mediante buceo autónomo y semiautónomo. Se eligieron nueve estaciones en cada banco y se consideraron tres cotas de profundidad. Las estaciones se ubicaron a 0.5, 2.5 y 4.5 m de profunidad en el banco de Clam Bay, y a los 6, 9 y 12 m en el Morro de Adentro. Todos los muestreos fueron diurnos, en los períodos de marea más baja. La amplitud del régimen de mareas en este sitio, para los meses de abril y noviembre fluctuó entre -0.3 y 2.0 m (NOAA, 2000-2002).
La clasificación de los fondos donde se ubicó el micro-hábitat de los juveniles de abulón se basó en las características de relieve, arreglo de las rocas, exposición al oleaje y profundidad. Una vez establecidas las estaciones de muestreo, una pareja de buzos inició la búsqueda de juveniles volteando rocas de 10 cm a 1 m de longitud. A partir del punto en que se localizó el primer juvenil, se extendió un cabo de 15 m siguiendo los lechos de roca laja, buscando nuevos juveniles en las rocas ubicadas hasta 1 m de distancia de cada lado del cabo. En total se cubrió un área de 30 m2; los juveniles encontrados se midieron e identificaron in situ.
La caracterización del microhábitat se basó en la forma y tamaño de las rocas, la cobertura de macroalgas, y la presencia de organismos sésiles y vágiles en ambas caras de la roca. En cada estación, la primera roca con presencia de juveniles de abulón se recolectó subiéndola a bordo para fotografiarla y describir posteriormente la biota asociada. El resto de las rocas "positivas" se midieron y se describieron directamente en el fondo del mar, recolectando únicamente aquellas especies que no habían sido identificadas previamente. En el laboratorio, las rocas recolectadas se sumergieron por separado en una solución anestésica de sulfato de magnesio durante 6 h. Posteriormente, se cepilló la superficie de la roca para desprender la macrobiota, la cual se separó en un tamiz de 500 Hm. Los organismos se preservaron en una solución de formol al 10%.
La identificación de los diferentes taxa se basó en Caso (1943, 1961, 1978, 1980, 1983), Hartman (1944), Osburn (1952), Provenzano (1959), Gosner (1971), Keen (1971), Abbott (1974), Light (1975), Abbott y Hollenberg (1976), Dawson (1978), Godshall y Laurent (1979), Brusca (1973, 1980), Morris et al. (1980), Phillips y McRoy (1980), Salazar-Vallejo et al. (1988) y Bailey (1999).
Para conocer si existía alguna relación entre la talla de los juveniles de abulón y el tamaño de la roca donde se encontraron, se aplicó una prueba de chi cuadrada (Zar, 1999).
Se analizó la estructura de la comunidad (macroalgas, fauna vágil y fauna sésil) y su variación temporal mediante la riqueza especifica, el índice de valor de importancia (IVI) calculado a partir de la frecuencia y abundancia de cada especie, y los índices de diversidad y equidad de Simpson (Krebs, 1986). En el caso de la diversidad se utilizó la inversa de la dominancia de Simpson, expresada como:

donde ds = inversa de la dominancia de Simpson; N = número total de individuos; ni = número de individuos de la especie i; y s = número de especies (Brower y Zar, 1984).
Los análisis se realizaron con el paquete de análisis ecológico ANACOM ver. 3.0 (De la Cruz-Agüero, 1994).
Resultados
Tipos de fondo
Se identificaron cuatro tipos de fondo donde se localizó el microhábitat de los juveniles:
(a) Fondo de relieve bajo y poca exposición al oleaje. Caracterizado por presentar macizos rocosos de bajo relieve, acanalados por la erosión del oleaje. En los canales se depositan rocas lajas de tamaño menor, de 20 a 90 cm de longitud, en posición imbricada sobre la roca madre, de manera tal que la circulación del agua es fluida. Este tipo de sustrato es característico del intermareal de Clam Bay y resultó el más adecuado para la presencia de juveniles pues, aunque las rocas fueron volteadas durante las marejadas, los espacios intersticiales no se llenaron de arena permitiendo la permanencia de los juveniles (fig. 2a).
(b) Fondo de relieve medio y semiprotegido. Formado por canales que se ubican entre grandes peñascos de 2 a 3 m de altura, entre los cuales se acumulan lajas de 20 a 90 cm de longitud por 20 a 60 cm de ancho, con forma que puede ser plana y alargada; también se localizaron piedras pequeñas (7-15 cm) de forma irregular. Aquí, el 50% de las rocas yacen directamente sobre la arena y son enterradas fácilmente durante las marejadas. Esta zona se ubicó en el límite rocoso del banco de Clam Bay entre 4 y 5 m de profundidad (fig. 2b).
(c) Fondo de relieve alto y expuesto al oleaje. Este fondo es de morfología compleja, dominado por macizos rocosos de perfil alto que se extienden de forma continua favoreciendo un paisaje algal de cobertura alta. La complejidad del relieve da lugar a la formación de diversos ambientes crípticos. Entre los afloramientos rocosos pueden observarse canales cubiertos por guijarros y cantos rodados (10-30 cm de diámetro) con grava y arena en menor proporción. Este tipo de fondo se encontró en el submareal del Morro de Adentro, predominando en la cota de 6 m (fig. 2c).
(d) Fondo de relieve medio y expuesto al oleaje. El fondo es de roca mixta, caracterizado por la presencia de rocas de forma y tamaño variables (de 20 cm a 2 m), con dominancia de rocas de perfil bajo. Entre éstas hay presencia de canales de arena, grava y canto rodado. Pueden presentarse parches aislados de roca de forma compleja y perfil más alto, con o sin la presencia de sedimento arenoso en su superficie. Este tipo de fondo también se localizó en el submareal del Morro de Adentro, en las cotas de los 9 y 12 m (fig. 2d).
Microhábitat de juveniles de abulón
En general, a lo largo de todo el perfil batimétrico de ambos bancos se identificaron dos tipos de microhábitat, dependiendo del tamaño de los juveniles.
1. Microhábitat de juveniles entre 3 y 13 mm de longitud: Se localizó en la cara inferior de pequeñas rocas de 7 a 20 cm de longitud, cubiertas por algas coralinas costrosas en toda su superficie (Lithophyllum imitans Foslie, 1909; L. aff. frondossum Foslie, 1909; Titanoderma postulatum var. confine Crouan y Chamberline, 1991; Hydrolithon onkodes (Foslie) Keats y Chamberline, 1991; H. samoense (Foslie) Keats y Chamberline, 1991; y Spongites yendoi (Foslie) Chamberline, 1992). Las rocas son de forma irregular, con pequeñas oquedades o depresiones en donde se ocultan generalmente los juveniles, de manera tal que aunque la roca sea volteada por las olas, éstos se mantienen protegidos de la fricción o del contacto con otras rocas. Compartiendo este microhábitat se encontraron juveniles de quitones, fisurélidos y erizos, de 5 a 10 mm de longitud, (fig. 3a).
2. Microhábitat de juveniles de 14 a 100 mm: Se encontró también en la cara inferior de rocas imbricadas que permiten la libre circulación del agua. Las rocas más grandes de este tipo de microhábitat midieron entre 30 y 110 cm de longitud y de 20 a 60 cm de ancho, de forma plana, alargada, rómbica, cúbica e irregular. En la cara inferior, los juveniles de Haliotis comparten el sustrato con esponjas, briozoarios, anélidos tubícolas, ascidias, ofiuroideos y otros moluscos como Stenoplax magdalenensis Hinds, 1845 y Tegula eiseni Jordan, 1936 (fig. 3b). La cara superior de este tipo de rocas estuvo cubierta de rodofitas, feofitas y clorofitas (fig. 3c).
La prueba de contingencia de 2 x 2 entre la frecuencia de tallas de juveniles de abulón y el tamaño de la roca, permitió establecer que la aparición de cada grupo de talla está relacionada con el tamaño de la roca (Χ2 = 102.99, P = 0.001).
Comunidad biótica del microhábitat Riqueza específica
En las rocas que sirven de microhábitat a los juveniles de abulón, se identificó un total de 198 especies: 45 de macroalgas, 59 de fauna sésil, 93 de fauna vágil y 1 espermatofita (fig. 4).
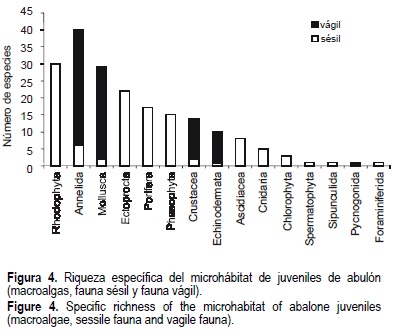
Como se observa en la tabla 1, la riqueza específica de las macroalgas fue muy semejante en el microhábitat de ambos bancos durante las cuatro temporadas. Por su parte, la fauna sésil del Morro de Adentro mostró mayor riqueza específica durante el otoño de 1996 y la primavera de 1997, con 31 especies, disminuyendo a 15 especies en la primavera de 1998. Un patrón semejante se observó en Clam Bay, salvo en la primavera de 1998 cuando, a diferencia del Morro de Adentro, la riqueza específica aumentó rápidamente de 9 a 23 especies.
En el caso del Morro de Adentro, la fauna vágil mostró un comportamiento similar al de la fauna sésil, disminuyendo de 40 especies en el otoño de 1996 hasta 20 en la primavera de 1998. Por el contrario en Clam Bay, después de que la riqueza disminuyó de 14 especies en otoño de 1996 a 10 en la primavera de 1997, ésta nuevamente se incrementó a 16 en otoño de 1997 y a 21 en la primavera de 1998 (tabla 1).
Diversidad
Durante todo el estudio las macroalgas mostraron una mayor diversidad en el microhábitat de Clam Bay, sin embargo, aunque al inicio de las observaciones (1996) las diferencias entre Clam Bay y el Morro de Adentro fueron máximas (9.7 y 3.7 respectivamente), hacia la primavera de 1998 la diversidad en ambos sitos tendió a converger en un valor cercano a 6 (tabla 1).
En relación a la fauna sésil, la diversidad siempre fue más alta en el Morro de Adentro, disminuyendo gradualmente de 16.9 en otoño de 1996, a 7.1 en primavera de 1998. Clam Bay mostró un comportamiento cíclico con valores mínimos en los otoños (3.9 y 2.2) y más altos en la primavera (tabla 1).
La fauna vágil mostró un patrón de diversidad distinto: valores divergentes entre Clam Bay y el Morro de Adentro en otoño de 1996 (2 y 13.8, respectivamente) y primavera de 1998 (5.5 y 14.3), y valores próximos entre sí en la primavera (4.4 y 3.7) y otoño de 1997 (8 y 6.1) (tabla 1).
Equidad
En general, la equidad de macroalgas en ambos bancos fue baja, fluctuando entre 0.07 y 0.11 en el Morro de Adentro y entre 0.11 y 0.25 en Clam Bay (tabla 1).
Con respecto a la fauna sésil, la equidad siempre fue mayor en el Morro de Adentro. En los otoños de 1996 y 1997, los valores fueron máximos (0.45 y 0.35, respectivamente) mientras que en las primaveras de 1997 y 1998, se tuvo un valor mínimo (0.26). Para el banco de Clam Bay la equidad se comportó de manera inversa, los máximos ocurrieron en las primaveras de 1997 y 1998 (0.15 y 0.20, respectivamente), y los mínimos en los otoño de 1996 y 1997 (0.1 y 0.08).
En relación con la fauna vágil, el microhábitat de Clam Bay presentó una equidad biológica muy baja (< 0.05), tanto en el otoño de 1996 como en la primavera de 1997; sin embargo, en el otoño de 1997 y primavera de 1998 aumentó a 0.15 y 0.13, respectivamente (tabla 1). Esta baja equidad coincidió con el hecho de que en el otoño de 1996 y la primavera de 1997 hubo una dominancia de los moluscos Haliotis fulgens y Tegula eiseni, mientras que en el otoño de 1997 y la primavera de 1998 el aumento de la equidad coincidió con un incremento en la dominancia de la ofiura Ophiactis simplex Le Conte, 1851 y del quitón Stenoplax magdalenensis, respectivamente, y una disminución del papel dominante de H. fulgens, sobretodo en el otoño de 1997 (tabla 4).
En primavera y otoño de 1997 la equidad en el Morro de Adentro disminuyó debido a un alto reclutamiento de Crepipatella lingulata Gould, 1846, en estas temporadas. Dicha abundancia se tradujo en la dominancia de esa especie, junto con el aumento del anélido Anaitides medipapillata Moore, 1909, que llegó a tener una abundancia de 20 organismos en una sola muestra de 30 anélidos errantes.
Índice de Valor de Importancia (IVI)
Del total de 198 especies identificadas se muestran únicamente aquellas cuyo IVI fue mayor al 5% al menos en una temporada (tablas 2, 3, 4). Un hecho que destaca es que el predominio de las especies cambia sin un patrón fijo entre estaciones del año en cada banco. Sin embargo, si nos referimos al valor de importancia promedio de cada especie entre las cuatro estaciones consideradas, se observa que en la mayoría de los casos existe un comportamiento inverso de este índice entre los dos bancos, i.e., cuando en un banco la dominancia de una especie es alta, en el otro disminuye.
Macroalgas
En este grupo, las especies dominantes, en orden de importancia jerárquica, fueron las coralinas costrosas (Lithophyllum imitans, L. aff. frondossum, Titanoderma postulatum var. confine, Hydrolithon onkodes, H. samoense y Spongites yendoi), las coralinas articuladas (Corallina officinalis Kützing, 1858, C. pinnatifolia Dawson, 1953, Bossiella orbigniana Decaisne, 1842, C. vancouveriensis Yendo, 1902), y otras rodofitas como Hypnea valentiae (Turner) Montagne, 1841 y Gelidiumpusillum (Sackh) Le Julis, 1863.
Las coralinas costrosas, cuyos valores de importancia fluctuaron de 48.9% a 70.5% en el Morro de Adentro y de 19.1% a 50.9% en Clam Bay (tabla 2), cubrieron gran parte de las rocas, en especial de aquellas de 7 a 20 cm, en donde se encontraron juveniles de Haliotis de 3 a 13 mm de longitud que posiblemente se asientan en ellas desde el estadio de postlarva.
En las rocas de mayor tamaño que sirven de microhábitat a los juveniles de abulón de 14 a 100 mm, la dominancia se repartió entre coralinas costrosas y articuladas, particularmente en el banco del Morro de Adentro, con la presencia de algunas rodofitas como H. valentiae, Chondracanthus canaliculata Harvey, 1841, Gigartina agardhii Setchell y Gardner 1933, y feofitas como Dictyota flabellata (Collins) Setchell y Gardner, 1901.
En el banco de Clam Bay se observó un cambio notable del otoño de 1996 a la primavera de 1997, cuando disminuyó la presencia de Chondracanthus canaliculata y Phyllospadix torreyi Watson y tomó su lugar Ulva californica Willie, 1899. El cambio más evidente en este banco sucedió en otoño de 1997, durante El Niño 1997-1998, cuando aumentó la presencia de especies de afinidad tropical como Chondria californica Kylin, 1941 y Sargassum agardhianum Agardh, 1889. Hacia la primavera de 1998, todavía durante la influencia de El Niño, la composición se vio modificada por la presencia de Ulva californica y Dictyota flabellata en ambos bancos (tabla 2). La intensidad de este fenómeno provocó la desaparición total de los mantos de Macrocystis pyrifera (L.) Agardh 1889 y de Eisenia arborea Areschoug, 1876, especies que normalmente presentan una gran dominancia en ambos bancos.
Fauna sésil
La fauna sésil mostró un grupo dominante formado por los anélidos Spirorbis marioni Caullery y Mesnil, 1897 y Pomatoceros sp. Philippi, 1844, la ascidia colonial Metandrocarpa taylori Huntsman, 1912 y los briozoarios Lyrula hipocreppis Hincks, 1882 y Rhyncozoon grandicella Canu y Bassler, 1923. Estas especies de hábitos costrosos estuvieron presentes la mayoría de las veces en ambos bancos, por lo cual se consideraron especies constantes del microhábitat de los juveniles de Haliotis fulgens y H. corrugata (tabla 3).
En Clam Bay, el anélido S. marioni tuvo el valor de importancia más alto (de 40% a 83.2 %) en todas las temporadas analizadas; en esta localidad suele ocupar toda la superficie inferior de las rocas, dejando espacios donde se encuentran los juveniles de abulón. Este anélido se encuentra también en el Morro de Adentro, sin embargo, su IVI (< 17) no fue tan alto como en Clam Bay, llegando incluso a desaparecer en la primavera de 1998 (tabla 3).
La esponja Axocielita originalis De Laubenfels, 1930, el foraminífero colonial Iridia serialis Le Calvez, 1935 y la ascidia colonial Trididemnum opacum Ritter, 1907, también fueron especies constantes del microhábitat de juveniles, excepto en el otoño de 1997 en Clam Bay, probablemente por el aumento de temperatura (28°C) que se registró en esa época como parte de El Niño 1997-1998. En abril de 1998 se registraron los briozoarios Tubulipora Lamarck 1816 y Lichenopora novae zelandiae (Busk) 1875, especies que se han reportado como organismos colonizadores (Herrera-Fragoso, 2000) (tabla 3).
En el Morro de Adentro la dominancia no se concentró en un solo grupo, sino que se repartió en un mayor número de especies (11) con alta jerarquía, principalmente de briozoarios, algunas esponjas y anélidos sedentarios cuyo IVI fluctuó de 5.9 a 21.2, en promedio (tabla 3).
Fauna vágil y Haliotis
Los juveniles de H. fulgens y H. corrugata se encontraron dentro de las especies con mayor valor de importancia de la fauna vágil. Junto con los moluscos Tegula eiseni y Crepipatella lingulata fueron las especies más constantes (tabla 4).
En Clam Bay, los juveniles de H. fulgens presentaron una dominancia mayor que en el Morro de Adentro, en donde dominaron los juveniles de H. corrugata. Es importante mencionar que aunque la dominancia de H. fulgens disminuyó a partir de la primavera de 1997, su valor de importancia en Clam Bay siempre estuvo por encima del resto de las especies de la fauna vágil (tabla 4).
En el Morro de Adentro H. corrugata fue dominante en otoño de 1996 (IVI = 28.8), pero en la primavera y otoño de 1997 Crepipatella lingulata fue la especie dominante (IVI = 58.3 y 38.1, respectivamente). En otoño de 1997, durante los efectos mas intensos de El Niño, el anélido Anaitides medipapillata mostró un alto valor de importancia (IVI = 31.1) en el Morro de Adentro, ocupando el segundo lugar después de C. lingulata.
Un hecho importante dentro de la fauna vágil fue la aparición, en la primavera y particularmente otoño de 1997, de diversas especies de anélidos errantes como Ceratonereis mirabilis Kingberg 1876 y A. medipapillata, especies que suelen estar relacionados con incrementos de sedimento en la superficie de la roca.
Discusión
En general, los juveniles de Haliotis fulgens y H. corrugata habitan la superficie inferior de rocas de tamaños y formas diversos, asimismo el tamaño de los juveniles guarda una estrecha relación con el tamaño de la roca que constituye su microhábitat. Al respecto, Cox (1962) señala que esta misma relación está en función con el grado de desarrollo de la rádula.
La presencia de juveniles muy pequeños (3 a 5 mm) en rocas cubiertas con algas coralinas costrosas es resultado de una relación simbionte, en la que los juveniles se benefician al mimetizarse con la coloración rosa de las algas costrosas, y éstas, a su vez, tienen mayor acceso a la luz gracias a la acción de herviboría del abulón (Shepherd y Turner, 1985; Shepherd y Daume, 1996). Por otra parte, el ocultamiento de los juveniles menores de 3 mm en las depresiones y rugosidades de la roca, y de las propias costrosas, fue un hecho frecuente a lo largo del estudio, semejante a lo observado por McShane y Naylor (1995) con Haliotis iris Gmelin, 1791. Esto parece ser una estrategia de sobrevivencia contra los efectos de abrasión, choque entre rocas y acción de depredadores.
Una vez que la rádula de los abulones es más fuerte, éstos cambian de dieta y se alimentan de macroalgas (Cox, 1962). La comunidad observada en las rocas que forman el microhábitat de juveniles de H. fulgens y H. corrugata con tallas de 14 a 100 mm, tuvo dos componentes. El primero, el de la parte superior de la roca, está dominado principalmente por algas coralinas costrosas y articuladas junto con algunas rodofitas de talo cartilaginoso como Chondrocanthus canaliculata, Hypnea valentiae y Gelidium pussillum, esta última y otras como Laurencia sp. Lamouroux, 1813 y Dictyota sp. Lamouroux, 1809, también presentes en la cara superior de las rocas, han sido identificadas en los estómagos de juveniles de ambas especies de Haliotis (Guzmán-del Próo et al., en prensa), lo que sugiere excursiones tróficas hacia esta parte de la roca, junto con el consumo de restos de macroalgas que fluyen a la deriva. El segundo componente de la comunidad se encuentra en la cara inferior de las rocas, generalmente lisa y carente de macroalgas, coincidiendo con observaciones de otros autores (Shepherd, 1973). En esta cara, además de los juveniles de abulón, en la mayoría de las muestras se encontraron briozoarios, esponjas, serpúlidos y pequeños gasterópodos como Tegula eiseni. Este tipo de asociación ha sido reportada como rara en otras especies de Haliotis (Shepherd y Turner, 1985; Ault y De Martini, 1987), pero en este caso fue algo común.
La amplia variabilidad del microhábitat de H. fulgens y H. corrugata fue un hecho frecuente, ya que en distancias muy cortas puede variar desde rocas muy pequeñas, no mayores de 15 a 20 cm, hasta grandes rocas de más de 1 m de largo. Como ocurre en la mayoría de los invertebrados bentónicos, esta heterogeneidad de hábitat genera variaciones en sus parámetros poblacionales y, por consiguiente, en la estructura de las comunidades que se desarrollan en cada hábitat (Pulliam, 1988).
La dominancia de los organismos coloniales de la fauna sésil (como esponjas, briozoarios, ascidias, hidrozoarios y cnidarios), observada en el submareal de los bancos estudiados, se explica por las ventajas que tienen estos grupos en la competencia por el espacio dada su reproducción asexual y crecimiento multidireccional (Jackson, 1977; Raffaelli y Hawkins, 1997). Por el contrario, en el intermareal dominan los juveniles de H. fulgens y la fauna vágil, cuya tolerancia a las altas temperaturas y a la desecación es superior a la de la fauna sésil (Jackson, 1977).
Aunque los organismos coloniales pueden ser competidores dominantes, su dominancia se ve disminuida por diversos factores físicos y biológicos, incluyendo la depredación. Un ejemplo de esto fue la presencia en el microhábitat estudiado, de las estrellas de mar Pisaster ochraceus Brandt, 1835, y Patiria miniata Brandt, 1835, y de peces como Semicossyphus pulcher Ayres 1854, especies que son depredadoras de organismos coloniales, principalmente briozoarios y esponjas (Foster, 1975).
En los bancos estudiados con frecuencia se encontraron esponjas, ascidias, briozoarios y serpúlidos coexistiendo con los juveniles de H. fulgens y H. corrugata. Algunos autores como Ault y De Martini (1987) y McShane y Smith (1989) reportan a estos grupos cómo organismos deletéreos para los juveniles de abulón; sin embargo, en nuestro caso no tenemos evidencias de tal efecto.
La abundancia de moluscos herbívoros en Clam Bay, entre los que se encuentran los juveniles de H. fulgens, T. eiseni y Stenoplax magdaleniensis, parece guardar relación con la mayor diversidad de macroalgas observada en este banco. Al respecto, Foster (1975), Jackson (1977), y Littler y Littler (1981) señalan que como resultado de la diversidad de macroalgas en las zonas intermareales de las playas rocosas templadas, la diversidad, abundancia y cobertura de los organismos solitarios herbívoros, principalmente moluscos y equinodermos, suele ser mayor como pudo observarse en la primavera de 1997, antes de la entrada del fenómeno de El Niño.
El análisis de la distribución espacial y disponibilidad del microhábitat que aquí se presenta tiene limitaciones porque refleja solamente las observaciones de dos estaciones (otoño y primavera) en años consecutivos. Este período de observación resulta insuficiente para mostrar cambios en el largo plazo, entre los cuales la dinámica de sedimentos parece ser de gran importancia en la expansión o reducción del microhábitat disponible para los juveniles de abulón. Al respecto, prospecciones de años anteriores (1986-1988) en la zona del Morro de Adentro mostraron que el fondo rocoso se extendía hasta los 20 m de profundidad (Guzmán-del Próo et al., 1991). En el presente trabajo (1996-1998) dicho fondo se redujo a los 15 m de profundidad, lo que implica una contracción del espacio habitable para la comunidad de fondos rocosos.
Por otra parte, estos procesos de sedimentación asociados con tormentas son también fuentes de mortalidad, como ocurre en Haliotis iris (Sainsbury, 1982; Schiel, 1993). Evidentemente estos procesos afectan la existencia del microhábitat, y por lo tanto el reclutamiento de juveniles, pero éstos son aspectos que no fueron medidos en este trabajo y que deberán ser estudiados en el futuro para lograr una mejor comprensión de la dinámica de las poblaciones de Haliotis y su entorno en Baja California.
Agradecimientos
Los autores agradecen a Patricia Gómez del Instituto de Ciencias del Mar y Limnología, UNAM, su colaboración en la identificación del material de esponjas; a Catalina Mendoza, Luz Elena Mateo Cid y Roberto Núñez su ayuda en la identificación de macroalgas; a Silvia Mille Pagaza su ayuda en la identificación de invertebrados; a Luis Gerardo López Lemus, director del Centro Regional de Investigaciones Pesqueras de La Paz y Bahía Tortugas, las facilidades otorgadas para el uso de las instalaciones del INP en Bahía Tortugas; y a la Sociedad Cooperativa de Producción Pesquera Bahía Tortugas su apoyo con personal y equipo en los trabajos de campo. El proyecto fue financiado por el CONACYT (2598PN) y el IPN (CGPI 990310).
Referencias
Abbott, R.T. (1974). American Sea Shells. The Marine Mollusca of the Atlantic and Pacific Coast of North America. 2nd ed. Van Nostrand Reinhold Co., New York, 663 pp. [ Links ]
Abbott, I.A. and Hollenberg, G.J. (1976). Marine Algae of California. Stanford Univ. Press, California, 827 pp. [ Links ]
Ault, J.S. and De Martini, J.D. (1987). Movement and dispersion of red abalone Haliotis rufescens, in northern California. Calif. Fish Game, 73: 196-213. [ Links ]
Bailey, J.G. (1999). Phylogenetic positions of Lithophyllum incrustans and Titanoderma pustulatum (Corallinaceae, Rhodophyta) based on 18S rRNA gene sequence analysis, with a revised classification of the Lithophylloideae. Phycologia, 38(3): 208-216. [ Links ]
Belmar-Pérez, J. y Guzmán-del Próo, S.A. (1992). Madurez sexual y ciclo gonádico de Haliotis fulgens y Astraea undosa en Bahía Tortugas, BCS, México. En: S.A. Guzmán-del Próo (ed.), Memorias del taller México-Australia sobre recursos bentónicos de Baja California, SEPESCA-IPN, pp 108-121. [ Links ]
Brower, J.E. and Zar, J.H. (1984). Field and Laboratory Methods for General Ecology. 2nd ed. Wm. C. Brown Publ., Iowa, 226 pp. [ Links ]
Brusca, R.C. (1973). A Handbook of the Common Intertidal Invertebrates of the Gulf of California. Univ. of Arizona Press, 427 pp. [ Links ]
Brusca, R.C. (1980). Common Intertidal Invertebrates of the Gulf of California. 2nd ed. Univ. of Arizona Press, 513 pp. [ Links ]
Cárdenas, B.R., Andrade P.M. y Villaseñor, A. (1971). Estudio gonadal del abulón commercial en el litoral occidental de la Península de Baja California. Fed. Reg. de Soc. Coop. de la Ind. Pesq. de Baja California. Informe mecanografiado, 24 pp. [ Links ]
Caso, M.E. (1943). Contribución al conocimiento de los asteroideos de México. Tesis de maestría, Fac. Ciencias, UNAM, México. 136 [ Links ]
Caso, M.E. (1961). Estado actual de los conocimientos acerca de los equinodermos de México. Tesis doctoral, Fac. Ciencias, UNAM, México, 388 pp. [ Links ]
Caso, M.E. ( 1978). Los equinoideos del Pacífico de México. Parte I. Ordenes Ciclasoidea y Aulodonta. Parte II: Ordenes Steridonta y Camarodonta. Centro Cienc. del Mar y Limnol. Univ. Nal. Auton. México. Publ. Esp., 4: 1-244. [ Links ]
Caso, M.E. (1980). Los equinoideos del Pacifico de México. Parte III. Orden Clypeasteroidea. Centro Cienc. del Mar y Limnol. Univ. Nal. Auton. México. Publ. Esp., 4: 1-252. [ Links ]
Caso, M.E. (1983). Los equinoideos del Pacífico de México. Parte IV. Ordenes Cassiduloidea y Spatangoidea. Inst. Cienc. del Mar y Limnol. Univ. Nal. Auton. México. Publ. Esp., 4: 1-200. [ Links ]
CONAPESCA (2001). Anuario Estadístico de Pesca. www.sagarpa.mx./pesca/, México. [ Links ]
Cox, K.W. (1962). California abalones, Family Haliotidae. The Resources Agency of California, Dept. of Fish and Game. Fish Bull., 118: 6-133. [ Links ]
Crossland, C.J. (1991). Sustainable development of benthic resources. Memorias del taller México-Australia sobre reclutamiento de recursos bentónicos de Baja California, SEPESCA-IPN, México, pp. 77-80. [ Links ]
Dawson, E.Y. (1978). How to Know the Seaweeds. Brown Co., Dubuque, Iowa, 197 pp. [ Links ]
De la Cruz-Agüero, G. (1994). Sistema para el ANAlisis de COMunidades, ver 3.0. [ Links ]
Foster, M.S. (1975). Regulation of algal community development in a Macrocystis pyrifera forest. Mar. Biol., 32: 331-342. [ Links ]
García, A.R. y Ortiz, Q.M. (1992). Desarrollo gonádico de Haliotis fulgens en la Isla de Cedros. En: Guzmán-del Próo, S.A. (ed.), Memorias del taller México-Australia sobre reclutamiento de recursos bentónicos de Baja California, SEPESCA-IPN, México, pp. 107-119. [ Links ]
Godshall, D.W. and Laurent, L.L. (1979). Pacific Coast Subtidal Marine Invertebrates. Sea Challengers, California, 107 pp. [ Links ]
Gosner, K.L. (1971). Guide to the Identification of Marine and Estuarine Invertebrates. John Wiley, New York, 663 pp. [ Links ]
Guzmán-del Próo, S.A. (1992). A review of the biology of abalone and its fishery in Mexico. In: S.A. Shepherd, M.J. Tegner, S.A. Guzmán-del Próo (eds.), Abalone of the World: Their Biology, Fisheries and Culture. Blackwell, Oxford, pp. 341-360. [ Links ]
Guzmán-del Próo, S.A., Mille-Pagaza, S., Guadarrama-Granados, R., De la Campa-de Guzmán, S., Carrillo-Laguna, J., Pereira-Corona, A., Belmar-Pérez, J., Parra-Alcocer, M.J. y Luque-Guerrero, A. (1991). La comunidad bentónica de los bancos de abulón (Haliotis spp. Mollusca: Gastropoda) en Bahía Tortugas, Baja California Sur, México. An. Esc. Nac. Cienc. Biol., México, 36: 27-59. [ Links ]
Guzmán-del Próo, S.A., Serviere-Zaragoza and Siqueiros, D. Natural diet of juvenile abalone, Haliotis fulgens and H. corrugata (Mollusca: Gastropoda) in Bahía Tortugas, Mexico. Pac. Sci. (in press).
Hartman, O. (1944). Polychaetous annelids. Part V. Eunicia. Allan Hancock Pacific Expeditions. Univ. of Southern California Press, 10(I): 1-523. [ Links ]
Herrera-Fragoso, R. (2000). Desarrollo estacional de una comunidad bentónica pionera sobre un sustrato artificial en Bahía Tortugas, Baja California Sur. Tesis de maestría, Escuela Nacional de Ciencias Biológicas, Instituto Politécnico Nacional, México, 60 pp. [ Links ]
Jackson, J.B. (1977). Competition on marine hard substrata: The adaptative significance of solitary and colonial strategies. Am. Nat., III(980): 743-767. [ Links ]
Kangas, M. and Shepherd, S.A. (1984). Distribution and feeding of chitons in a boulder habitat at west island, South Australia. J. Malac. Soc. Aust., 6: 101-111. [ Links ]
Keen, A.M. (1971). Seashells of Tropical West America. 2nd ed. Stanford Univ. Press, California, 1064 pp. [ Links ]
Krebs, C.J. (1986). Ecology: The Experimental Analysis of Distribution and Abundance. Harper & Row Publ., 678 pp. [ Links ]
Light, S.F. (1975). Light's Manual: Intertidal Invertebrates of Central California Coast. 3rd ed. Univ. California Press, 716 pp. [ Links ]
Littler, M.M. and Littler, D.S. (1981). Intertidal macrophyte communities from Pacific Baja California and the Upper Gulf of California: Relatively constant vs environmentally fluctuating systems. Mar. Ecol. Prog. Ser., 4: 145-158. [ Links ]
McShane, P.E. (1994). Survival strategies in early stages of marine resources. Recruit processes in abalone (Haliotis spp.). Proceedings of an international workshop, Yokohama, Japan, pp. 315-324. [ Links ]
McShane, P.E. and Smith, M.G. (1989). Direct measurement of fishing mortality in abalone (Haliotis rubra Leach) of southeastern Australia. Fish. Res., 8: 93-102. [ Links ]
McShane, P.E. and Naylor, J.R. (1995). Depth can affect postsettlement survival of Haliotis iris (Mollusca: Gastroeropoda). J. Exp. Mar. Biol. Ecol., 187: 1-12. [ Links ]
Morris, R.H., Abbott. D.P. and Haderlie, E.C. (1980). Intertidal Invertebrates of California. Stanford Univ. Press, California, 690 pp. [ Links ]
NOAA (2000-2002). Calendario de mareas. Los Angeles (Outer Harbor) Tides. Agencia Arjona, Ensenada, Mexico. [ Links ]
Osburn, R.C. (1952). Bryozoa of the Pacific coast of America. Allan Hancock Pacific Expeditions. Univ. of Southern California Press, 14(2): 271-841. [ Links ]
Phillips, R.C. and McRoy, C.P. (1980). Handbook of Seagrass Biology: An Ecosystem Perspective. Garland STPM Press, New York, 353 pp. [ Links ]
Provenzano, A.J. (1959). The shallow water hermit crabs of Florida. Bull. Mar. Sci. Caribbean, 9(4): 349-315. [ Links ]
Pulliam, H.R. (1988). Sources, sinks, and population regulation. Am. Nat., 132(5): 652-661. [ Links ]
Raffaelli, D. and Hawkins, S. (1997). Intertidal Ecology. 1st ed. 2nd reprinted. Chapman and Hall, UK, 356 pp. [ Links ]
Sainsbury, K.J. (1982). Population dynamics and fishery management of the paua Haliotis iris I. Population structure growth, reproduction and mortality. NZ J. Mar. Freshwater Res., 16: 147-161. [ Links ]
Salazar-Vallejo, S.I., Angel de León-González, J.A. y Salaices-Polanco, H. (1988). Poliquetos (Annellida: Polychaeta) de México. Univ. Autónoma de Baja California Sur, Libros Universitarios, México, 212 pp. [ Links ]
Schiel, P.R. (1993). Experimental evaluation of commercial scale enhacement of abalone Haliotis iris populations in New Zealand. Mar. Ecol. Prog. Ser., 97: 167-181. [ Links ]
Searcy, B.R. (1986). Abundancia de juveniles de abulón amarillo H. corrugata en relación a factores abióticos en la Bahía del Rosario, Baja California, México. Tesis de maestría, Centro de Investigación Científica y de Educación Superior de Ensenada, BC, México, 126 pp. [ Links ]
Shepherd, S.A. (1973). Studies on southern Australian abalone (genus Haliotis). I. Ecology of five sympatric species. Aust. J. Freshwater Res., 24: 217-257. [ Links ]
Shepherd, S.A. and Turner, J.A. (1985). Studies on southern Australian abalone (genus Haliotis). VI. Habitat preferences and abundance predators of juveniles. J. Exp. Mar. Biol. Ecol., 93: 285-98. [ Links ]
Shepherd, S.A. and Partington, P. (1995). Studies on southern Australian abalone (genus Haliotis). XVI. Recruitment, habitat and stock relations. Mar. Freshwater Res., 46: 669-80. [ Links ]
Shepherd, S.A. and Daume, S. (1996). Ecology and survival of juvenile abalone in a crustrose coralline habitat in South Australia. In: Y. Watanabe, Y. Yamashita and Y. Oozeki (eds.), Survival Strategies in Early Life History Stages of Marine Resources. Balkema, Rotterdam, pp. 297-313. [ Links ]
Tegner, M.J. and Butler, R.A. (1985). The survival and mortality of seeded and native red abalones, Haliotis rufescens, on the Palos Verdes Peninsula. Calif. Fish Game, 71(3): 150-163. [ Links ]
Zar, J.H. (1999). Biostatistical Analysis. Prentice-Hall, New Jersey, 663 pp. [ Links ]















