Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Salud mental
versão impressa ISSN 0185-3325
Salud Ment vol.37 supl.1 México Abr. 2014
Guía basada en la evidencia de la Asociación Psiquiátrica de América Latina y de la Asociación Psiquiátrica Mexicana para el tratamiento del paciente con esquizofrenia
Mensaje del Presidente de la Asociación Psiquiátrica Mexicana (APM)
Mensaje del Presidente de la Asociación Psiquiátrica de América Latina (APAL)
Niveles de evidencia de recomendaciones de la Asociación Psiquiátrica Mexicana (APM)
III. Intervenciones psicosociales
IV. Aspectos transculturales de la esquizofrenia
Consenso Nacional y Guía de Práctica Clínica de la Asociación Psiquiátrica Mexicana y de la Asociación Psiquiátrica de América Latina para el tratamiento de las personas con esquizofrenia
Objetivos
La carga de los trastornos mentales se ha incrementado en todas las sociedades prevaleciendo, al mismo tiempo, variaciones en su tratamiento en un mismo país y entre países. Por lo tanto, nos propusimos evaluar y adoptar una posición respecto al tratamiento de la esquizofrenia, utilizando como método para lograr esta meta "el consenso".
Presentación, desarrollo y metodología
Las Guías de Práctica Clínica (GPCs) son definidas como "recomendaciones desarrolladas sistemáticamente para apoyar a los clínicos y pacientes en la toma de decisiones apropiadas sobre cuidados de salud en circunstancias clínicas específicas" (Field 1992).
Las Guías de tratamiento proporcionan recomendaciones basadas en la evidencia para asistir a los clínicos en situaciones específicas, representan una herramienta mayor para asegurar e incrementar la calidad del tratamiento y superar las diferencias existentes; sin embargo, las principales dificultades para desarrollarlas e implementarlas son, entre otros factores, la carencia de recursos humanos y financieros y la necesidad de actualizarlas regularmente. Además, su calidad metodológica es variable, lo que determina su legitimidad y aplicabilidad.
Tomando en cuenta todo lo anterior, existen crecientes esfuerzos para desarrollar guías de mejor calidad. Asimismo, existe la necesidad de igualar y mejorar la calidad de los cuidados de salud en todos los países. Puesto que muchos contenidos son universales, el desarrollo de guías internacionales parece ser lo indicado. No obstante, las recomendaciones torales de las guías deberían ajustarse a las condiciones regionales utilizando los recursos disponibles para adaptarlas.
El desarrollo de las guías basadas en la evidencia conlleva un cambio en la fuente utilizada para la elaboración de las recomendaciones, pasando de las opiniones de los expertos a un examen exhaustivo de la información científica.
Para lograrlo, se debe traducir una colección de datos científicos en continuo desarrollo en recomendaciones clínicamente útiles, con la esperanza de informar con rapidez a los médicos sobre los descubrimientos de la investigación que impactan la atención a la salud.
Casi todas las guías intentan sugerir la atención recomendable, es decir, el tipo de atención adecuado para la mayoría de las personas. Sin embargo, dado que se basan en datos de grupos, solamente pueden proporcionar recomendaciones grupales.
Así, para definir la atención óptima para cada persona (Rush 1995), señalan que los profesionales deben adaptar las recomendaciones de la guía a cada paciente, transformando la atención recomendable (para un grupo) en atención óptima (para una persona).
Por lo anterior, la selección y la puesta en práctica de un plan específico de tratamiento debe ser hecho por el psiquiatra a la luz de los datos clínicos presentados por el paciente y de acuerdo con el diagnóstico y opciones de tratamiento disponibles, ya que los parámetros de cuidados propuestos en las guías son pautas y no pretenden ser estándares.
La OMS ha desarrollado Guías para el Diagnóstico y Manejo de los Trastornos Mentales en Atención Primaria (1996) utilizando un abordaje por Consenso; los consensos son idóneos porque poseen las siguientes virtudes:
• Son acuerdos conciliadores.
• Enriquecen las experiencias y los conocimientos de otros y con otros.
• Reconocen las diferencias regionales.
• Fomentan el desarrollo científico.
• Son el logro de un grupo de expertos y no de un solo individuo.
Permanece sin ser resuelto el problema de delinear recomendaciones universalmente válidas para la atención psiquiátrica en segundo y tercer nivel de atención que puedan sean usadas para desarrollar guías nacionales o regionales de salud mental, sin menospreciar los sistemas de salud o la cultura locales.
En esa línea, las Guías de Práctica Clínica de la Asociación Psiquiátrica Mexicana (APM) y de la Asociación Psiquiátrica de América Latina (APAL) para el tratamiento de los trastornos psiquiátricos han sido desarrolladas por los Consensos de psiquiatras hispanos y latinoamericanos, quienes están activos en la práctica clínica.
El presente documento es producto de la actualización de la "Guía de Práctica Clínica de la Asociación Psiquiátrica de América Latina para el tratamiento de las personas con esquizofrenia" publicada en 2007, que se desarrolló de tal forma que pudiese ser ajustada a la cultura y etnia de cada país, ya que las diferencias transculturales deben reflejar el uso de la medicación en Latinoamérica.
El objetivo fue concebir un plan de tratamiento racional y comprensible, acordado por los clínicos responsables, eligiéndose como método para la elaboración de la presente Guía el Consenso formal (Perry 1980) mediante el cual un grupo de expertos se reunió para realizar recomendaciones.
El consenso formal se efectuó metodológicamente como se refiere a continuación:
• Se reunió un grupo de expertos para realizar recomendaciones durante sesiones estructuradas de dos días y medio de duración.
• Los expertos presentaron y analizaron la evidencia disponible, asignándose tareas para el desarrollo de los contenidos de la GPC.
• En la última sesión de trabajo se generó una discusión plenaria abierta para elaborar los algoritmos de tratamiento.
• La segunda reunión se realizó 12 semanas después.
• En esta segunda reunión los expertos presentaron las tareas desarrolladas bajo la evidencia disponible y se procedió a su lectura crítica y análisis. En la última sesión se aprobaron los algoritmos en discusión plenaria.
• En ambas reuniones se nombró un moderador y un secretario en cada mesa. Por cada 120 minutos de trabajo se efectuó un receso de 30 minutos.
• Con los resultados se editó la Guía.
• Finalmente, otro grupo de expertos revisó el documento.
• La última etapa consistió en la impresión del material para así proceder a su difusión y posterior implementación.
Para ello, se identificó a especialistas con amplia experiencia clínica en el tema a quienes se les invitó a colaborar y que, además de manifestar su interés en este proyecto, cumplían con el siguiente perfil:
1. Ser profesionales con entrenamiento formal completo en el área de la salud mental en una institución nacional o extranjera reconocida.
2. Tener experiencia mayor a cinco años en la atención de enfermos que padecen esquizofrenia.
3. Tener práctica privada y/o institucional en el sistema de salud mexicano (IMSS, ISSSTE, SSA, etc.).
4. Aceptar participar en dos reuniones académicas de tres días de duración convocadas ex profeso para el desarrollo del Consenso.
5. No presentar conflicto de intereses.
En la siguiente etapa se llevaron a cabo las dos reuniones de trabajo.
En la primera reunión, celebrada en el Estado de México del 9 al 11 de marzo de 2012, el coordinador presentó los objetivos y metodología para el desarrollo del Consenso y de la GPC y, en sesión plenaria, se aprobaron los contenidos del documento.
La distribución de los profesionales participantes en equipos de trabajo se determinó con base en su experiencia profesional; a cada equipo le correspondió la elaboración de determinados contenidos del documento.
Durante la sesión final de esta primera reunión:
Se asignaron tareas por equipos de trabajo para la elaboración del borrador del documento final, el cual debía cumplir con las siguientes características:
a. Ser objetivo.
b. Ser claro y breve.
c. Proporcionar recomendaciones prácticas.
d. Basarse en información actualizada.
e. Ser flexible para permitir la aplicación del juicio médico.
f. Contemplar la posibilidad de su implementación en la práctica clínica cotidiana.
g. Ser pertinente.
h. Ser oportuno.
La segunda reunión de trabajo se efectuó en Cuernavaca, Morelos, del 31 de agosto al 2 de septiembre de 2012, trabajándose con el material desarrollado por cada equipo.
En cada mesa se nombró un moderador y se procedió a la lectura crítica y análisis del documento base, llevándose a cabo los cambios y/o adecuaciones al texto conforme los señalamientos de los participantes y el consenso de la mesa, para así concluir con el borrador final del documento.
La medicina basada en evidencia fue el sustento y marco de referencia para la elaboración del documento, recurriéndose a sistemas de información como Pubmed, OVID, Ebsco, Science direct, etc., incluyéndose artículos de ensayos clínicos aleatorizados doble ciego, meta-análisis, artículos de revisión y revisiones monográficas relacionados con el tratamiento de la esquizofrenia, así como las diferentes Guías de Práctica Clínica disponibles, continuando con la conformación de los dos grupos de expertos, desarrolladores y revisores, de acuerdo con los lineamientos metodológicos referidos.
Justificación
La esquizofrenia continúa siendo uno de los trastornos mentales más severos (Murray 1996, World Health Organization 2008) debido a su inicio en edad temprana, su cronicidad y curso discapacitante (Jobe 2005, Menezes 2006, Watt 1983). El tratamiento antipsicótico temprano y de mantenimiento (Birchwood 1998), así como las intervenciones psicosociales, han probado su efectividad (Tandon 2010). Consecuentemente, las Guías de Práctica Clínica para la esquizofrenia deben contribuir a mejorar el tratamiento y sus resultados y a reducir la carga individual y pública de la enfermedad.
Resultados
A partir del análisis del manuscrito se emitieron las recomendaciones y sugerencias de tratamiento de la esquizofrenia y con ello se elaboraron los algoritmos correspondientes.
Propósito y declaración de intenciones
La información contenida en el documento incluye experiencias personales y de grupos específicos de profesionales pertenecientes a diferentes instituciones de salud mexicanas.
Cada participante se comprometió a aportar su experiencia y opinión sin permitir sesgos por intereses diferentes a los científicos y a los que exigen las buenas prácticas clínicas.
Por su estructura, la guía debe manejarse con flexibilidad, por lo que las recomendaciones contenidas podrán ser, en todo caso, lineamientos generales para orientar a los profesionales que ejercen la práctica clínica tanto en instituciones públicas como privadas, o bien, en su consultorio, con la finalidad de favorecer la eficiente toma de decisiones que conlleve un óptimo desempeño profesional.
La Guía debe ser usada para el mejoramiento de los servicios de salud mental y como modelo para la revisión de otros grupos de medicamentos, así como para obtener consenso en aspectos claves de la práctica psiquiátrica.
La aplicación de cualquier guía o algoritmo requiere de su cumplimiento inteligente, incluyendo la educación del paciente y de sus familiares, así como de la referencia apropiada por parte de los clínicos.
Dr. Wázcar Verduzco Fragoso
Coordinador del Consenso y GPC
Secretario de Asuntos Académicos de la APM 2012-2013
Secretario de Publicaciones de la APAL 2011-2012
Agosto de 2013
MENSAJE DEL PRESIDENTE DE LA ASOCIACIÓN PSIQUIÁTRICA MEXICANA (APM)
La carga social de los trastornos mentales continúa incrementándose, prevaleciendo variaciones en el tratamiento de un país a otro y, aún, dentro del mismo. En el caso de la esquizofrenia, esto resulta ser particularmente evidente, tanto para la prescripción de antipsicóticos como para la disponibilidad de las intervenciones psicosociales.
El tratamiento farmacológico ha sido promovido y complicado por la llegada de numerosos agentes terapéuticos; durante los últimos 15 años, más de 10 nuevos antipsicóticos y antidepresivos, así como algunos estabilizadores del estado de ánimo han sido aprobados para su uso en los Estados Unidos. El perfil de seguridad y de eventos adversos de estos agentes, así como sus ventajas terapéuticas, han elevado las expectativas de mejorar los resultados del tratamiento.
La disponibilidad de estos medicamentos puede contribuir a una mayor prescripción de tratamientos combinados a fin de alcanzar resultados más ambiciosos, lo que aumenta la importancia y el desafío de definir e implementar prácticas psicofarmacológicas basadas en la evidencia científica.
Por su parte, las intervenciones psicoterapéuticas deben proveer el dominio de los procesos clave de compromiso, evaluación, normalización, educación y formulación a efecto de ayudar a los pacientes a contender con sus ideas delirantes y alucinaciones, trabajar en su desesperanza, suicidabilidad, baja energía e interés y pobre autoestima, esperando incidir positivamente en la prevención de la recaída, monitorizando síntomas y promoviendo la adherencia terapéutica. Es por esto que en diferentes regiones del mundo se han desarrollado guías prácticas para la atención de los pacientes con esquizofrenia, las cuales difieren considerablemente en metodología y contenidos.
El desarrollo de las guías basadas en la evidencia conlleva un cambio en la fuente utilizada para la elaboración de las recomendaciones, pasando de las opiniones de los expertos a un examen exhaustivo de la información científica. El Instituto Nacional para la Excelencia Clínica de Inglaterra las conceptualiza como "recomendaciones desarrolladas de forma sistemática sobre la atención, diagnóstico y tratamiento apropiado de determinadas enfermedades y/o condiciones de salud en la población", y son consideradas como un "instrumento que ayuda a los profesionales de la salud y al paciente en la toma de decisiones sobre la intervención en salud más adecuada en una situación clínica concreta", así como herramientas para la implementación de estrategias de educación continua, facilitando la comunicación entre el paciente y el profesional en salud.
Con el objetivo general de desarrollar una GPC para el tratamiento de la esquizofrenia dirigida al personal médico de los tres niveles de atención, en 2006 se reunió un grupo de expertos para realizar las recomendaciones, se eligió como método el consenso formal para establecer los criterios mínimos indispensables que garantizaran una atención médica integral, homogénea, con calidad, equidad y eficiencia. Esta GPC fue publicada en 2007, tras 5 años de revisión y cuya constancia queda plasmada en este documento. La aplicación de cualquier guía o algoritmo requiere de su cumplimiento inteligente, que incluya la educación del paciente y de sus familiares, así como la referencia apropiada por parte de los clínicos. La actualización de ésta debe ser útil para el mejoramiento de los servicios de salud mental:
• Evitar conductas inapropiadas en la práctica clínica.
• Disminuir la variabilidad en la práctica clínica.
• Disminuir la variabilidad en el acceso a intervenciones o tratamientos específicos.
• Servir como instrumento de educación continua para el profesional de salud.
• Mejorar la comunicación con el paciente.
• Mejorar la eficiencia del uso de los recursos.
• Servir de referente en la evaluación de la práctica médica y del desempeño de los profesionales ante casos de controversia o demanda legal.
Dr. Eduardo Madrigal de León
Presidente de la Asociación Psiquiátrica Mexicana 2012-2013
Agosto de 2013
MENSAJE DEL PRESIDENTE DE LA ASOCIACIÓN PSIQUIÁTRICA DE AMÉRICA LATINA (APAL)
Desde hace aproximadamente 40 años, la psiquiatría ha dado un giro hacia el conocimiento más profundo de la neurobiología del Sistema Nervioso Central; el entendimiento del tipo de receptores, neurotransmisores, neuromoduladores y funciones cerebrales específicas, ha crecido en forma exponencial, así como el avance y desarrollo en el campo de la psicofarmacología. A pesar de ser indudable su importancia, las dificultades para el ejercicio de la práctica clínica cotidiana obligan a contar con Guías de Práctica Clínica (GPC).
Actualmente, la experiencia enriquece y amplía la creación y desarrollo de las GPC mediante consensos, lo que enriquece tanto a las publicaciones de la Asociación Psiquiátrica de América Latina, como las de la Asociación Psiquiátrica Mexicana. El trabajo en este campo es efervescente, y se continuará con la tarea de contar con publicaciones en español, de calidad en contenido y profundidad, que estén a la par de las mejores del mundo.
Un reconocimiento a todos los profesionales que unieron sus esfuerzos concretar esta tarea.
Dr. Enrique Camarena Robles
Presidente de la Asociación Psiquiátrica de América Latina
Bienio 2011-2012
Niveles de evidencia de recomendaciones de la Asociación Psiquiátrica Mexicana (APM)
Los niveles y recomendaciones de evidencia de la APM se determinaron siguiendo los modelos de previamente propuestos por:
• Canadian Task Force.I
• U.S. Preventive Services Task Force (USPSTF).II,III
• Scottish Intercollegiate Guidelines Network (SIGN) Grading Review Group.IV
• Infectious Diseases Society of America-US Public Health Service.V
Calidad de la evidencia científica
Con base en la revisión anterior se construyó la siguiente clasificación de la calidad de la evidencia, la cual se presenta en el cuadro anexo:

Así mismo, se construyó la recomendación de la evidencia científica de la siguiente manera:

Metodología de Trabajo
Para el desarrollo de la actualización de la Guía de Tratamiento de Esquizofrenia basada en Evidencia de la APM, el presidente en funciones de la Asociación convocó a expertos en las diferentes disciplinas de esquizofrenia para coordinar las diversas secciones o capítulos de actualización de la guía.
Los coordinadores convocaron a su vez a miembros afiliados de la asociación de las diferentes instituciones públicas y privadas del sector salud para apoyar el desarrollo de las secciones correspondientes.
Se realizaron dos reuniones de trabajo general y el número necesario de reuniones específicas por parte de los subgrupos de trabajo.
Posterior a la revisión de la evidencia científica y la integración de los componentes de las secciones de la guía, se realizó una reunión con los coordinadores para revisar y discutir las diferentes propuestas publicadas de calidad de evidencia y sus recomendaciones. Pare esto, la APM convocó a un experto metodólogo que realizó una revisión y análisis de cada una de las escalas de evidencia y fuerza de recomendación de la evidencia científica, la cual fue presentada al presidente de la APM y coordinadores de las diferentes secciones de la guía, lo que permitió definir los lineamientos de calidad y fuerza de recomendación de la APM. Se llevó a cabo una capacitación de los cada subgrupos para que cada uno de los integrantes de los mismos estuvieran estandarizados en la forma de evaluar la calidad de la evidencia y la fuerza de recomendación. La definición de la calidad y fuerza de la recomendación de la evidencia se realizó mediante una evaluación en "pares" y, en los casos en que se presentaron desacuerdos, se solicitó el apoyo de expertos metodólogos para aclarar los puntos de desacuerdo y definir en consenso la calidad y fuerza de recomendación correspondientes.
Para reflejar el nivel de evidencia y recomendación, éste se colocará al final de cada intervención mediante el uso de itálicas y negrillas entre corchetes.
I. Canadian Task Force on the Periodic Health Examination. The periodic health examination. Can Med Assoc J. 1979;121:1193-1254.
II. U.S. Preventive Services Task Force (USPSTF). Consultar en la web de la Agency for Healthcare Research and Quality (www.ahrq.gov/clinic/uspstfix.htm).
III. Harris RP, Helfand M, Woolf SH, Lohr KN, Mulrow CD, Teutsch SM, Atkins D, for the Methods Work Group, Third U.S. Preventive Services Task Force. Current methods of the U.S. Preventive Services Task Force: a review of the process. Am J Prev Med 2001;20(3S):21-35.
IV. Harbour R, Miller J, for the Scottish Intercollegiate Guidelines Network Grading Review Group. BMJ 2001;323:334-336.
V. Infectious Diseases Society of America-US Public Health Service, en: Papas PG et al. CID 2004;38:161-189.
FACTORES GENÉTICOS
Respecto al papel de los factores genéticos en la etiología de la esquizofrenia, a pesar de que numerosos datos sugieren la importancia de este hecho, aún genera controversia debido a la existencia de una discordancia sustancial de su frecuencia en gemelos monocigóticos, lo que también indica la importancia de los factores ambientales a que se hace referencia.
En un meta-análisis, se determinó que el peso específico que tiene la herencia en la aparición del trastorno es de 81%, en tanto que se ha calculado, con menos evidencias, que el peso de los aspectos ambientales es de 11% (Sullivan 2003). El riesgo de padecer esquizofrenia se incrementa en un 50% cuando ambos padres la padecen y en 60 a 84% cuando se trata de gemelos monocigóticos. Se habla entonces de una herencia poligenética (Mueser 2004, Cannon 2002). En relación a este componente genético se ha reportado la existencia de múltiples anormalidades cromosómicas y no ha sido posible encontrar un gen candidato de alta confiabilidad. La susceptibilidad para padecerla se ha encontrado en varios cromosomas que incluyen el 1q21-22, 1q32 43, 6p24, 8p21, 10p14, 13q32, 18p11 y 22q11-13 (Berrettini 2000, Brzustowicz 2000, Straub 1995, Blouin 1998, Ekelund 2001). La existencia de múltiples loci asociados con la vulnerabilidad de la esquizofrenia sugiere que esta enfermedad es causada por la interacción entre diferentes componentes genéticos y factores ambientales.
En la actualidad los genes con mayor relevancia en la esquizofrenia son la Disbindina (dysbandin) localizada en el cromosoma 6, la Neuroregulina 1 en el cromosoma 8, el gen DAAO ubicado en el cromosoma 12 y finalmente, el gen G72 en el cromosoma 13 (Hyman 2003). Por supuesto existen otros genes que pudieran estar implicados y que en combinación con los factores no genéticos o ambientales contribuyan a un mayor riesgo para el desarrollo de la esquizofrenia.
En cuanto al fenotipo, se han reportado hallazgos que se clasifican como anormalidades físicas menores (circunferencia cefálica menor, implantación baja de orejas, altura anormal del paladar, anomalías de los dermatoglifos, menor diámetro binocular), conductuales (aislamiento social, expresividad afectiva disminuida, retardo en el desarrollo psicomotor, por ejemplo, en un estudio los niños que desarrollaron trastornos esquizofreniformes, caminaron de manera tardía, con una media de 14.9 meses de edad, mientras que la de los controles que fue de 13.6 meses) y neuropsicológicas (déficit cognoscitivo generalizado).
Por su parte, los familiares biológicos de primer grado de los sujetos con esquizofrenia presentan un riesgo para padecerla aproximadamente diez veces superior al de la población general. De esta manera, la mayor fertilidad, particularmente entre parientes de pacientes masculinos con carga genética familiar elevada, puede contribuir a la perpetuación del trastorno frente a aquellos pacientes con menor fertilidad.
FACTORES AMBIENTALES
Ya es sabido que las personas con esquizofrenia muestran una susceptibilidad genética (Gur 2007), sin embargo, este componente no es suficiente para que se exprese la enfermedad. Por tal razón, se han realizado investigaciones en busca de los factores que incrementan el riesgo para padecer el trastorno. Entre los posibles factores externos se incluyen; la exposición materna prenatal a ciertas condiciones infecciosas, tales como el virus de la influenza, la toxoplasmosis, el virus del herpes simple tipo 2, (Mednick 1988, Alan 2010, 2004), infecciones virales del sistema nervioso central, ya que las bacterianas no parecen asociarse, infecciones por citomegalovirus (Dalman 2008), desnutrición durante el embarazo (Susser 1996), el consumo de tabaco durante el embarazo y otras complicaciones obstétricas (Kinney 1994).
Se ha propuesto que la exposición al virus de la influenza en el segundo trimestre del embarazo genera mayor riesgo de padecer esquizofrenia que en quienes no estuvieron expuestos, posiblemente debido a que los anticuerpos maternos cruzan la barrera placentaria y reaccionan contra las proteínas neuronales fetales (Brown 2004).
Las complicaciones perinatales y alteraciones intrauterinas pueden potencialmente desordenar la organización neuronal (Volpe 2001). Basados en el incremento de su incidencia entre hijos de madres esquizofrénicas que tuvieron complicaciones intrauterinas o perinatales, se sustenta que la esquizofrenia puede incluir alteraciones en el neurodesarrollo (Murray 1987, Weinberger 1987, Hossein 2009).
Los hallazgos en cuanto a cuidados prenatales y antecedentes obstétricos son controversiales, siendo las complicaciones más frecuentemente asociadas sobre todo a hipoxia neonatal (posición fetal anormal, parto prolongado), así como la hemorragia previa o durante el parto, la incompatibilidad de grupo sanguíneo o del factor Rh, la preeclampsia, una cesárea de urgencia, la atonía uterina, así como el peso al nacer (menos de 2.5 kg o de más de 4 kg) (Mueser 2004, Cannon 2002, Sullivan 2003, Dalman 2001, McGrath 2003, Van 2002, Brown 2004, Cannon 2002, Singh 2004), aunque su presencia por sí sola no tiene un efecto específico sobre el desarrollo de la enfermedad, requiriéndose la presencia de otros factores para ello, quizá estos hallazgos sólo confieren vulnerabilidad a los sujetos, observándose que los pacientes con estos antecedentes tienen un inicio más temprano de la enfermedad, síntomas negativos más intensos y peor pronóstico.
Se propone que la incompatibilidad Rh actuaría como un cofactor etiológico del trastorno debido a la lesión cerebral secundaria a hiperbilirubinemia que sea el detonante de una serie de reacciones que culminen con la manifestación del padecimiento en la edad adulta.
Otro de los factores que se asocian con el riesgo de padecer esquizofrenia es el cuidado de la madre durante el embarazo. Se ha determinado que las madres de los pacientes acudían menos veces a consulta prenatal en comparación con las madres de controles sanos, con un promedio de 9.1 y 9.8, de manera respectiva. Como resultado, en estos últimos se manifiesta una reducción en 12% del riesgo de presentar esquizofrenia (Kawai 2004).
En otros estudios se pudo encontrar una asociación significativa del estrés, malestar y consumo de tabaco durante el embarazo, con la presencia de síntomas psicóticos en los hijos adolescentes (Cannon 2002, Spauwen 2004).
De igual forma se encontró que las madres de esquizofrénicos tienen índices de masa corporal (IMC) mayores, lo cual aumenta la tasa de esquizofrenia a 1.24 y significa el 24% de incremento en el riesgo de padecer el trastorno (Kawai 2004).
Un hallazgo constante en las investigaciones es que hay mayor probabilidad de que las personas con este trastorno hayan nacido a fines del invierno y a principios de la primavera, estimándose una proporción 10% mayor en ese período.
A partir de esos reportes se han formulado diferentes teorías para explicar el fenómeno. Una de ellas afirma que existe algún factor de riesgo asociado a algunas estaciones, como la presencia de un virus; otra sostiene que las personas con una predisposición genética para la esquizofrenia tienen menores ventajas biológicas para superar los riesgos específicos de cada estación. También se han argumentado hipótesis nutricionales y climáticas que impactan en el neurodesarrollo.
FACTORES FAMILIARES Y SOCIALES
Los factores familiares y sociales pueden alterar el curso de la enfermedad pero no hay evidencia de que la originen.
Algunos factores asociados a la estructura familiar se han sugerido como de riesgo para la esquizofrenia, tales como la edad de la madre en el momento del embarazo (joven aumenta el riesgo), edad del padre (joven lo disminuye), tamaño de la familia (aumenta en 11% por cada hermano y 12% por cada ocupante en la misma habitación (Wahlbeck, 2001), el lugar que ocupa entre los hermanos al nacimiento (primogénito), edad de los padres (madre joven, lo que podría asociarse a complicaciones obstétricas, padre mayor de 30 años, quizás por la presencia de mutaciones en las células germinales), y diferencia de edades entre los hermanos (menos de 5 años el riesgo aumenta, 10 años o más el riesgo disminuye), así como sexo de los hermanos afectados (mayor riesgo si el probando es mujer). Estas observaciones pueden ser de utilidad para comprender la naturaleza de los factores de riesgo ambientales y genéticos (Khashan 2008).
Al desarrollarse un estudio comparativo de la edad de los padres de pacientes con esquizofrenia y sujetos sanos, se encontró que a mayor edad de los padres al concebir se incrementaba el riesgo de los hijos de padecer esquizofrenia. Al ajustar el índice probabilístico con incrementos de 10 años de edad, el riesgo aumentaba 1.3%. El fenómeno anterior no se observó para los pacientes con otro tipo de psicosis (Zammit 2003, Byrne 2003, Malaspina 2001, Sipos 2004).
FISIOPATOLOGÍA
Una de las aportaciones más importantes relacionadas con la etiología de la esquizofrenia, ha sido la hipótesis dopaminérgica, la cual en sus inicios, postuló el incremento de la actividad dopaminérgica cerebral de la vía mesolímbica (Carlsson 1963, Seeman 1976, Farde 1988). Posteriormente con base en esta teoría se sugirió la existencia de una regulación diferencial en las proyecciones dopaminérgicas cerebrales, en donde se presentaba una disminución del tono cortical de la función dopaminérgica, especialmente en la corteza prefrontal, lo cual puede estar relacionado con una relativa hiperactividad en las estructuras subcorticales (Davis 1991). En el campo clínico, dicha actividad hiperdopaminérgica se ha asociado con la presencia de síntomas positivos (estructuras subcorticales, con un mayor involucramiento de la dopamina límbica que la dopamina estriatal), y la actividad hipodopaminérgica con la presencia de síntomas negativos (estructuras prefrontales), (Bannon 1983, Pycock 1980).
Anteriormente se pensaba que los receptores dopaminérgicos D2 tenían su más alta expresión en el estriado, sin embargo, estudios recientes en los que se ha utilizado tomografía por emisión de positrones (PET), no han podido demostrar cambios en las densidades de los D2 en el estriado de pacientes con esquizofrenia (Farde 1990, Hietala 1994, Martinot 1990, Nordström 1995), lo que sugiere que otros receptores pueden estar involucrados en la fisiopatología.
Se ha implicado a la corteza prefrontal y algunas estructuras límbicas como la corteza del cíngulo en la fisiopatología de la esquizofrenia, ya que se piensa que estas estructuras contribuyen particularmente con el empeoramiento de los síntomas negativos y cognoscitivos y en menor medida, con la presencia de los síntomas positivos (Nestler 1997). Particularmente los receptores DI, que normalmente se expresan en la corteza prefrontal (Hall 1994), se han implicado en el control de la memoria de trabajo (Williams 1995), y la disfunción de la misma constituye uno de los rasgos característicos de la esquizofrenia (Goldman 1994).
Actualmente se piensa que el receptor 5HT2 tiene implicación en su etiopatogenia, hecho que se fundamenta en el perfil farmacológico de la clozapina y su efectividad tanto en síntomas positivos como en síntomas negativos. Se ha observado una alta correlación entre la concentración de catabolitos de dopamina y 5-HT en líquido cefaloraquídeo (LCR) (Kahn 1995). Los síntomas negativos se han relacionado con una reducción en la transmisión dopaminérgica en la corteza prefrontal. Los antagonistas serotoninérgicos, como la clozapina, facilitan la liberación prefrontal de dopamina, disminuyendo los síntomas negativos.
Otro neuropéptido de gran importancia es el glutamato, específicamente, los receptores N-metil-D-aspartato (NMDA), ya que se ha observado que la fenciclidina actúa bloqueando estos receptores que son excitatorios para el glutamato, y se relacionan con conductas similares a las observadas en la esquizofrenia. El receptor NMDA tiene un sitio específico que reconoce a la glicina, así como al D-isómero de serina, sustancias que activan a este receptor. La teoría del glutamato proviene del tratamiento de los pacientes con glicina, D-serina o cicloserina, mostrando una mejoría en los síntomas negativos (Sawa 2002).
Existen múltiples evidencias de que la esquizofrenia es un trastorno del neurodesarrollo, entre ellas es el típico inicio durante la adolescencia, la presencia de alteraciones estructurales y neurofuncionales al inicio de la enfermedad y estas alteraciones no progresan en la mayoría de los casos con el tiempo (Murray 1987, Weinberger 1995). Los estudios epidemiológicos han aportado mayor soporte a esta hipótesis mostrando que se encuentran déficits intelectuales premórbidos, en etapas tempranas del desarrollo (Horan 2003) y los estudios neuropatológicos muestran una citoar-quitectura cerebral alterada, indicando un trastorno de esta naturaleza. Sin embargo, la alteración en el neurodesarrollo puede no asociarse a todos los individuos que sufren de esquizofrenia y algunos autores argumentan que hay subtipos de la enfermedad, relacionados o no con el neurodesarrollo, (Murray 1992) e incluso un subtipo neurodegenerativo de la enfermedad (DeLisi 1995).
Algunas lesiones durante el desarrollo temprano podrían llevar a una reducción de las conexiones en algunas regiones cerebrales (por ejemplo, corteza prefrontal) produciendo probablemente los síntomas negativos y la persistencia de ciertas conexiones en algunos sitios de proyección de estas estructuras cerebrales, como por ejemplo el cíngulo, la corteza temporolímbica y el estriado ventral, posiblemente conduzcan a los síntomas positivos. La visión actual es que la enfermedad podría estar asociada con alteraciones en múltiples regiones corticales y subcorticales.
Los modelos de circuitos neuronales que se encuentran alterados en la esquizofrenia incluyen circuitos que involucran una retroalimentación cortico-subcortical (Alexander 1988). Estos incluyen cinco circuitos basados en una región cortical primaria: motora, oculomotora, prefrontal dorsolateral, orbitofrontal lateral y cingulado. El circuito dorsolateral media las funciones "ejecutivas" (planeación y "memoria durante el trabajo"); el cingulado anterior media la motivación y el circuito lateral orbitofrontal las respuestas conductuales apropiadas para el contexto. Se ha considerado que estos circuitos están involucrados en la esquizofrenia, ya que se ha mencionado como características esenciales de la enfermedad las alteraciones en la función ejecutiva, la apatía y la desinhibición (Weinberger 1995, Goldman 1994).
La vulnerabilidad a la esquizofrenia es probablemente genética, de acuerdo a los hallazgos de estudios genéticos en gemelos y de adopción (Gottesman, 2003). Sin embargo, la vulnerabilidad puede estar influenciada por otros factores etiológicos adquiridos, tales como las complicaciones perinatales o el estrés familiar.
Así se consideran factores de riesgo probables: la consanguinidad con quiénes presentan trastornos psiquiátricos mayores, factores estresantes identificables perinatales y del desarrollo, y trastornos de personalidad premórbida de tipo paranoide, esquizoide o esquizotípico.
De tal forma, estos hallazgos y los más recientes sobre neuropatología y bioquímica indican que la esquizofrenia es un padecimiento con etiología multifactorial que condiciona alteraciones en el neurodesarrollo y predispone a un proceso neurodegenerativo al iniciar los síntomas psicóticos.
EPIDEMIOLOGÍA
Los trastornos mentales y del comportamiento se están convirtiendo en un problema de salud pública cada vez más grave, lo que representa un alto costo económico y social, directo e indirecto para el enfermo, la familia y la sociedad en general.
La esquizofrenia es el trastorno mental más grave e incapacitante en todo el mundo, representando el 40-50% de las hospitalizaciones psiquiátricas.
Dentro de las primeras seis causas de años de vida ajustados por discapacidad (AVAD) 4 son neuropsiquiátricas, una de ellas es la esquizofrenia, provocando el 1.1% del total de AVAD de todas las enfermedades (OMS 2001).
De acuerdo con la Organización Mundial de la Salud (OMS) en el año 2000, había en el mundo 45 millones de personas mayores de 15 años de edad, que en algún momento de su vida habían presentado un cuadro esquizofreniforme o un trastorno esquizofrénico franco (OMS 2001), calculándose en el año 2002 que quienes en ese momento tenían la enfermedad eran 25 millones de personas (OMS 2002).
Otro dato relevante es que: a pesar de que el tratamiento reduce sustancialmente los síntomas y puede retardar el deterioro, aproximadamente el 40% de los enfermos no reciben tratamiento (OMS 2001).
A pesar de que la esquizofrenia es la enfermedad, después de la depresión, con mayor demanda en los servicios de salud mental, en Latinoamérica la investigación de la esquizofrenia ha sido comparativamente menos numerosa en relación con otros países, especialmente los desarrollados. No se ha contado con los suficientes recursos humanos, materiales y financieros adecuados por lo que en nuestros países su desarrollo científico ha sido más lento que el de otras enfermedades mentales y otras ramas de la medicina.
Dentro de las investigaciones más importantes que se han realizado en México con respecto a la esquizofrenia, destacan las de validación de escalas, las ventajas del tratamiento psicosocial o de rehabilitación, los epidemiológicos, así como los estudios neuropsicológicos. Por otro lado, son pocos los análisis biológicos (neurofisiológicos, neuropatológicos, genéticos y moleculares) debido a que no son favorables para ello las condiciones económicas de la región.
Esta situación, por demás alarmante debe hacernos poner mayor interés en la comprensión de la enfermedad, por lo que debemos conocer los aspectos relacionados con su epidemiología y las circunstancias personales, sociales y demográficas que han sido identificadas como factores de riesgo.
En los últimos años se han producido avances importantes en el conocimiento de la esquizofrenia en tres áreas principales: los avances en técnicas de neuroimagen, la gran cantidad de investigaciones sobre antipsicóticos de segunda generación y el aumento del interés en los factores psicosociales que la afectan.
La historia de la investigación en esquizofrenia es una cronología de temas recurrentes, muchos de ellos pistas prometedoras que subsecuentemente han sido abandonadas así como una plétora de modelos explicativos de los cuales ninguno ha sido descartado categóricamente o comprobado inequívocamente.
Es notable que muchas de las ideas que se investigan actualmente sean, en los hechos, redescubrimientos de observaciones e hipótesis tempranas, muchas de ellas desde las primeras décadas posteriores a la adopción del esquema taxonómico Kraepeliniano.
Generalmente se acepta que no existe una prueba sencilla o una regla de procedimiento que establezca la validez de un concepto de enfermedad o de una clasificación diagnóstica en psiquiatría. La aceptación de un concepto diagnóstico particular o de un esquema de clasificación esta usualmente basado en la interpretación de la evidencia que converge de múltiples fuentes, incluyendo la psicopatología descriptiva, la neuropatología, la fisiopatología, la genética y la epidemiología. Este proceso lleva a similitudes en la manera en que los "paradigmas" se extienden en la ciencia.
Las siguientes líneas revisan la contribución de una de esas fuentes, la epidemiología psiquiátrica, a la comprensión de esta enfermedad.
La epidemiología psiquiátrica se originó en el siglo XIX con propósitos inicialmente administrativos. Para finales de ese siglo comienzan a ser postuladas las preguntas propiamente científicas. Probablemente la primera aplicación del método epidemiológico en un sentido moderno en la investigación de las psicosis fue el trabajo de Koller, quien en 1895 condujo un estudio que se anticipó en muchas formas al conocimiento que tenemos actualmente acerca de la epidemiología genética de las psicosis.
En la primera mitad del siglo XX la investigación epidemiológica de las psicosis tomó dos caminos relativamente distintos, mientras en Europa la investigación se enfocaba primariamente sobre los factores genéticos, en los Estados Unidos de Norteamérica había un mayor interés sobre la ecología social de la enfermedad mental.
Muchos de los resultados de esos estudios conservan su valor hoy en día. De hecho, ninguna de las contribuciones más recientes de la investigación epidemiológica ha cambiado sustancialmente las conclusiones de aquellos que se refieren a la incidencia y prevalencia en la población, la edad de inicio, el riesgo de morbilidad específico para edad y sexo, los riesgos de morbilidad para familiares biológicos de los probandos y los datos sobre fertilidad disminuida en los esquizofrénicos.
Dos temas han ganado prominencia recientemente en la literatura de la epidemiología de la esquizofrenia: una muy elevada incidencia en afrocaribeños nacidos en el Reino Unido y los datos estadísticos que sugieren que en las últimas décadas la incidencia de esquizofrenia puede estar declinando en poblaciones occidentales. Nuevamente, ninguno de estos hallazgos es verdaderamente novedoso, el nivel inusual de morbilidad entre los afrocaribeños fue descrito en 1967, y en el segundo caso se publicaron datos al respecto desde 1978.
En síntesis, no obstante las dificultades para llevar a cabo investigaciones epidemiológicas, como lo son las diferencias en los criterios diagnósticos, la ausencia de un marco conceptual definitivo y la falta de un factor relacionado y cuantificable (ej., un marcador genético), los estudios efectuados desde comienzos del siglo pasado en los que Kraepelin delineó a la demencia precoz como una entidad individual, se han obtenido estimaciones marcadamente consistentes sobre su prevalencia, incidencia y riesgo de padecerla a lo largo de la vida en distintas poblaciones y áreas geográficas.
Comprender las variaciones en la incidencia de la esquizofrenia es un paso crucial para desenmarañar la etiología de este trastorno, lo que explica los numerosos estudios al respecto.
En ese sentido, el proyecto piloto internacional para la esquizofrenia de la OMS (International Pilot Project for Schizophrenia) ofrece una confiabilidad del 80-90% con los criterios diagnósticos acordados con anterioridad, en tanto que el Programa de Área de Captación Epidemiológica (Epidemiologic Catchment Area Program, ECA), patrocinado por el Instituto Nacional de Salud Mental, es considerado la base estándar actual para la epidemiología psiquiátrica en los EUA.
Por otro lado, los hallazgos de una incidencia similar de esquizofrenia en diversas poblaciones y a través del tiempo son inusuales para una enfermedad multifactorial, y son compatibles con al menos dos interpretaciones alternativas que tienen diferentes implicaciones para la investigación de las causas genéticas y ambientales del trastorno.
Se deben conocer los aspectos relacionados con la epidemiología, como las circunstancias personales, sociales y demográficas que han sido identificadas como factores de riesgo, todo lo cual se presenta a continuación.
Prevalencia: Existen discrepancias sobre la prevalencia de la esquizofrenia en los diferentes estudios porque se han empleado metodologías diferentes (ej., medio rural versus medio urbano, población general versus población hospitalaria) y por las diferentes definiciones de la misma, es decir, con su precisión diagnóstica, incrementándose el diagnóstico de trastornos afectivos con el paso de los años, incluyendo el trastorno esquizoafectivo, y disminuyendo el diagnóstico de esquizofrenia, esto último se refleja en la diferencia entre la tasa de diagnóstico de esquizofrenia del 31% entre 1975 y 1979 y la de 11% entre 1994 y 1999.
No obstante, las tasas de prevalencia son similares en todo el mundo, pero se ha descrito la existencia de alta prevalencia en algunas áreas específicas, por lo que sus estimaciones han variado desde el 0.2 al 2.0% en muchos estudios extensos.
Teniendo en cuenta estas fuentes de información, la prevalencia de la esquizofrenia se considera actualmente entre el 0.5 y el 1%, y es la misma en hombres y mujeres, sin embargo, se observan diferencias respecto a la edad de inicio y su curso.
Incidencia: La esquizofrenia tiene una incidencia relativamente baja. Puesto que tiende a ser crónica, las tasas de incidencia son considerablemente inferiores a las tasas de prevalencia, y se estiman en aproximadamente 20-40/100,000 al año, aunque el rango puede ser tan amplio como entre 7.7 y 43x100,000. Así resulta claro que no existe un diseño "perfecto" para medir la incidencia de la esquizofrenia, teniendo cada uno de ellos diferentes fortalezas, la mayoría de los estudios proporcionan tasas que en realidad reflejan la "incidencia tratada", esto es, el número de individuos que son identificados por los servicios de salud y que, por consiguiente, reciben tratamiento. Los factores relacionados a la disponibilidad de los servicios y el cuidado de los pacientes varían considerablemente. Además, recientemente se ha demostrado que la educación de la comunidad acerca de la psicosis puede llevar a un incremento súbito en el número de casos "nuevos" que se presentan en los servicios de atención.
No obstante, basados en una definición restrictiva y precisa del diagnóstico y usando métodos de evaluación estandarizados en poblaciones amplias y representativas, la tasa de incidencia parece estable a través de los países y culturas a lo largo del tiempo, por lo menos en los últimos 50 años.
Edad: El principal grupo de edad en riesgo de padecer esquizofrenia es de 15-35 años. Es todavía incierto si la esquizofrenia, como las psicosis de inicio tardío, después de los 60 años podría ser clasificada como tal tanto etiológica como psicopatológicamente.
Cuando el inicio es a muy temprana edad esta se asocia a una evolución lenta de los síntomas, con predominio de los llamados síntomas negativos y alteraciones neuropsicológicas, aunado a una mayor disfunción en las actividades de la vida cotidiana y el establecimiento de relaciones interpersonales.
Un estudio al respecto arrojó los siguientes resultados: la proporción de esquizofrenia de inicio temprano con síntomas positivos y negativos es comparable a la de los grupos de edad mayores. Sin embargo, los trastornos emocionales y de conducta son más frecuentes en los pacientes más jóvenes, especialmente hombres.
En otro estudio, la proporción hombre/mujer fue 1.56:1 en el grupo de edad de 16-25 años, alcanzando a unificarse alrededor de los 30 años de edad y declinando a 0.38:1 en el grupo de 66-75 años. Contrariamente a las expectativas, una alta proporción de pacientes con inicio del padecimiento después de los 45 años llenaron los criterios del DSM III-R para esquizofrenia comparativamente con los pacientes que iniciaron más jóvenes (52% versus 38%). La distribución por edad al inicio fue la misma, independientemente de la severidad del trastorno. La tasa más elevada fue en el grupo de edad de 16-25 años, con un ligero segundo pico en el grupo de edad de 46-55 años, y un tercer pico (más evidente) en el grupo por arriba de 65 años. Un cuidadoso análisis de las variables demográficas y fenomenológicas reveló algunas diferencias entre los pacientes con inicio temprano y tardío (después de los 44 años) del padecimiento.
Finalmente, un inicio temprano de la esquizofrenia tiene consecuencias sociales más severas que la de inicio en adultos porque interrumpe el desarrollo cognoscitivo y social en un estadio temprano.
Sexo: De acuerdo con diversos estudios, el inicio en las mujeres suele ser más tardío y el curso más benigno en comparación con los hombres, por lo que la media de inicio de la enfermedad en ellos es de 15 años de edad, mientras que en las mujeres es de más de 20 años.
En promedio, las mujeres se enferman tres o cuatro años más tarde que los hombres y muestran un segundo pico de inicio alrededor de la menopausia. Consecuentemente, las esquizofrenias de inicio tardío son más frecuentes y más severas en las mujeres que en los hombres.
La edad significativamente mayor del inicio en las mujeres es explicada, sobre las bases de experimentos en animales y estudios clínicos, debido al efecto neuromodulador de las hormonas sobre los receptores D2.
El tipo de inicio y los síntomas cardinales no difieren entre los sexos, pero sí clara y sustancialmente en el comportamiento de la enfermedad. La diferencia más pronunciada en este rubro se manifiesta por la tendencia a un comportamiento social negativo en los hombres jóvenes.
La diferencia genérica en la edad de inicio es más pequeña en los casos con una elevada carga genética y mayor en los casos con una baja carga genética.
Curso: El mayor deterioro social de la esquizofrenia en hombres, comparado con mujeres no puede ser relacionado a una sintomatología más severa, sino a una edad temprana de inicio y al deterioro o estancamiento del ascenso social en un estadio temprano del desarrollo social y cognoscitivo. La discapacidad social en el sentido de una adaptación a las expectativas del medio ambiente social, así como la sintomatología durante el ulterior curso de la esquizofrenia, no muestran mayores diferencias entre los grupos de edad.
Aunque dos tercios de los pacientes esquizofrénicos tratados necesitan ser hospitalizados, sólo la mitad de ellos reciben tratamiento a pesar de la gravedad del trastorno.
Así, los pacientes esquizofrénicos ocupan un 50% de todas las camas disponibles en los hospitales psiquiátricos y constituyen el 16% de los enfermos mentales que reciben algún tipo de tratamiento.
En el 75% de los casos, la primera admisión hospitalaria es precedida por una fase prodrómica con una duración media de 5 años y una fase psicótica de un año de duración.
La probabilidad de ser readmitido en un hospital durante los dos años siguientes a la primera hospitalización es de un 40 a un 60%.
Distribución geográfica: La esquizofrenia no se distribuye geográficamente de forma equitativa en el mundo, puesto que en algunas áreas se registra una prevalencia inusualmente alta del trastorno. Para algunos investigadores esto apoya la hipótesis de una causa infecciosa de la esquizofrenia, ej., un virus.
Medio: La pequeña proporción de datos disponibles en áreas rurales no permite una comparación más precisa entre medio urbano versus el rural, aunque los hallazgos aportan apoyo a la hipótesis de que su incidencia es mayor en medios citadinos (McGrath 2004).
También se le ha correlacionado con la densidad de población local en ciudades de más de un millón de habitantes. Estas observaciones sugieren que los factores estresantes que suelen estar presentes en contextos urbanos pueden favorecer el desarrollo de esquizofrenia en personas de riesgo.
Consideraciones socioculturales y socioeconómicas: La esquizofrenia se ha descrito en todas las culturas y grupos socioeconómicos estudiados.
Las comparaciones étnicas sugieren tasas de prevalencia similares de esquizofrenia, sin mostrar diferencias importantes entre los diversos orígenes étnicos (Mueser 2004, Jim 2004, Harrison 2003), no obstante, cierto número de estudios puntualizan la influencia de la cultura y el grupo étnico sobre la presentación y curso del trastorno; se ha reportado que al comparar la incidencia en población oriunda de un lugar con la población inmigrante, éstos tienen tasas más altas, con una relación de 4.6 (McGrath 2004).
En general, una influencia relativamente poderosa de los factores ambientales está identificada, más aún, la cultura puede afectar varios aspectos del proceso del padecimiento, incluyendo su definición, la conducta de búsqueda de ayuda, respuesta al tratamiento, y readaptación postratamiento.
Así, en los países industrializados se registra un número desproporcionado de personas con esquizofrenia entre los grupos socioeconómicos más débiles. Se ha estimado que entre uno y dos tercios de las personas sin hogar pueden sufrir el trastorno.
Algunos estudios señalan una alta prevalencia de esquizofrenia entre inmigrantes recién llegados, y este hallazgo apunta hacia el abrupto cambio cultural como factor implicado en la aparición del trastorno, si bien es importante hacer notar que los resultados de estos estudios dependen de la metodología empleada.
En tal sentido, la reciente evidencia sugiere que las altas tasas de esquizofrenia en la primera y segunda generación de inmigrantes podrían ser consecutivas a factores ambientales, tales como infecciones virales en el país huésped, argumentándose que la interacción entre el agente ambiental y los factores constitucionales relacionados con el sistema inmune necesitan ser considerados.
Cuando los criterios diagnósticos se aplican con rigor clínico, las diferencias culturales y geográficas desaparecen casi en su totalidad, siendo un trastorno de presentación universal (Mueser 2004).
Comorbilidad y mortalidad: Las personas que padecen esquizofrenia presentan unas tasas de mortalidad por accidentes y por causas naturales mayores que las de la población general.
Diferentes estudios ponen de manifiesto que más del 80% de todos estos pacientes tienen otras enfermedades médicas concurrentes y más del 50% de todas estas enfermedades no están diagnosticadas.
El suicidio es una causa de muerte frecuente en estos pacientes. Un 50% de los pacientes intentan suicidarse por lo menos una vez en su vida, de un 10 a un 15% de estas personas mueren por esta causa en períodos de seguimiento a 20 años.
Abuso de sustancias asociado: La comorbilidad entre la esquizofrenia y los trastornos relacionados con sustancias es frecuente, aunque las implicaciones del abuso de sustancias en pacientes esquizofrénicos están poco claras.
En los EUA entre un 30 y un 50% de estos pacientes cumplen criterios para el abuso o la dependencia al alcohol; las otras dos sustancias más utilizadas son la marihuana, de un 15 a un 25%, y la cocaína de un 5 a un 10%, considerándose que las suelen consumir para reducir sus niveles de depresión y ansiedad.
En cuanto al tabaco, la mayoría de los sondeos realizados indican que más de las tres cuartas partes de los pacientes esquizofrénicos lo consumen, comparados con menos de la mitad del resto de los pacientes psiquiátricos valorados conjuntamente.
CRITERIOS DIAGNÓSTICOS
El concepto de esquizofrenia se encuentra contenido en las dos clasificaciones de los trastornos mentales vigentes actualmente, y permite sustentar esta afirmación: es un trastorno mental que involucra "un comportamiento o un grupo de síntomas identificables en la práctica clínica, que en la mayoría de los casos se acompañan de malestar o interfieren con la actividad del individuo".
El Manual Diagnóstico y Estadístico de los Trastornos Mentales de la Asociación Psiquiátrica Americana (DSM-IV-TR), en su cuarta edición (DSM IV 2000), propone que puede considerarse como un trastorno mental o "un síndrome psicológico o de conducta clínicamente significativo, o un patrón de comportamiento que se presenta en un individuo y que se asocia con molestias, incapacidad -o capacidad inadecuada-, que implican un riesgo significativamente mayor de sufrir muerte, dolor, insuficiencia, o una pérdida importante de su libertad". Considerando lo impreciso y relativo de estas definiciones, el DSM IV TR argumenta acerca de la dificultad para encontrar alguna otra definición operacional que cubra las diversas situaciones, los enfoques y los niveles de abstracción, tales como los anatomopatológicos, los sintomáticos, las desviaciones de una norma fisiológica, o los etiológicos.
Por otro lado, la clasificación internacional de las enfermedades (CIE-0) de la Organización Mundial de la Salud (WHO 2004) menciona que los trastornos esquizofrénicos se caracterizan, en general, por distorsiones características del pensamiento y la percepción, y presencia de afecto inapropiado o aplanado. La conciencia y la capacidad intelectual suelen mantenerse, aunque ciertos déficits cognitivos pueden evolucionar a lo largo del tiempo.
Los fenómenos psicopatológicos más importantes son el eco de pensamiento, robo del pensamiento, inserción del pensamiento, transmisión del pensamiento, ideas delirantes de control e influencia, alucinaciones auditivas manifestadas como voces que comentan o discuten con el paciente en tercera persona, trastornos del pensamiento y síntomas negativos.
Criterios diagnósticos DSM IV-TR
La clasificación de la Asociación Psiquiátrica Americana señala seis criterios o condiciones indispensables para establecer el diagnóstico de un trastorno esquizofrénico:
A. Síntomas característicos:* Dos (o más) de los siguientes, cada uno de ellos presente durante una parte significativa de un período de 1 mes (o menos si ha sido tratado con éxito):
1. Ideas delirantes
2. Alucinaciones
3. Lenguaje desorganizado (p. ej. descarrilamient frecuente o incoherencia)
4. Comportamiento catatónico o gravemente desorganizado
5. Síntomas negativos, por ejemplo, aplanamiento afectivo, alogia o abulia
B. Disfunción social y laboral: trabajo, relaciones interpersonales o cuidado de sí mismo claramente por debajo del nivel previo al inicio del trastorno.
C. Duración: signos continuos de las alteraciones durante al menos 6 meses, que pueden incluir un mes con los síntomas enunciados en 1 y los periodos prodrómicos y residuales caracterizados por la presencia de síntomas negativos.
D. Exclusión de trastornos esquizoafectivos y del estado de ánimo: o bien no han estado presentes episodios de manía o depresión durante la fase activa, o su duración ha sido breve o relacionada con las fases prodrómica o residual.
E. Exclusión del consumo de sustancias o enfermedad médica no psiquiátrica como causa del trastorno.
F. Relación con un trastorno generalizado del desarrollo: Si hay historia de trastorno autista o de otro trastorno generalizado del desarrollo, el diagnóstico adicional de esquizofrenia sólo se realizará si las ideas delirantes o las alucinaciones también se mantienen durante al menos 1 mes (o menos si se han tratado con éxito).
Clasificación del curso longitudinal
• Episódico con síntomas residuales interepisódicos (los episodios están determinados por la reaparición de síntomas psicóticos destacados): especificar también si tiene síntomas negativos acusados.
• Episódico sin síntomas residuales interepisódicos: continuo (existencia de claros síntomas psicóticos a lo largo del período de observación): especificar también si tiene síntomas negativos acusados.
• Episodio único en remisión parcial: especificar también si tiene síntomas negativos acusados.
• Episodio único en remisión total.
• Otro patrón o no especificado.
• Menos de 1 año desde el inicio de los primeros síntomas de fase activa.
El DSM IV-TR incluye a las variedades de esquizofrenia que aparecen en la CIE 10, a excepción de la forma simple, y modificando la denominación de "hebefrénica" a "desorganizada" para esta variedad.
Sustenta el diagnóstico de cada categoría en los siguientes elementos:
• Paranoide: una o más ideas delirantes o alucinaciones auditivas frecuentes.
• Desorganizada: lenguaje y comportamiento desorganizados, afecto aplanado.
• Catatónica: catalepsia, actividad motora excesiva carente de propósito, negativismo extremo, mutismo, posturas extrañas, movimientos peculiares, ecolalia o ecopraxia.
• Indiferenciada: no corresponde a ninguna de las variedades enunciadas.
• Residual: síntomas negativos y síntomas del criterio 1 presentes en forma atenuada.
Criterios diagnósticos de la CIE 10
Esta clasificación plantea que no han sido identificados, en sentido estricto, síntomas patognomónicos de la enfermedad, y que existen ciertos fenómenos psicopatológicos con un significado especial para el diagnóstico de Esquizofrenia. La evolución de los trastornos esquizofrénicos puede ser continua o episódica, con déficit progresivo o estable, o bien puede haber uno o más episodios, con remisión completa o incompleta. No debe hacerse diagnóstico de esquizofrenia cuando hay síntomas depresivos o maníacos extensos, a menos que haya quedado en claro que los síntomas esquizofrénicos antecedieron a la perturbación afectiva. Tampoco debe diagnosticarse esquizofrenia cuando existe una enfermedad cerebral manifiesta, ni durante los estados de intoxicación o de abstinencia de drogas. La clasificación hace énfasis en los subtipos de la esquizofrenia y los clasifica en:
• Esquizofrenia paranoide
• Esquizofrenia hebefrénica
• Esquizofrenia catatónica
• Esquizofrenia indiferenciada
• Depresión postesquizofrénica. Episodio depresivo que puede ser prolongado y que aparece como secuela de un mal esquizofrénico. Puede haber todavía algunos síntomas esquizofrénicos, tanto "positivos" como "negativos", pero éstos ya no son los que predominan en el cuadro clínico.
• Esquizofrenia residual
• Esquizofrenia simple. Trastorno en el cual se da un desarrollo insidioso pero progresivo de comportamiento extravagante, con incapacidad para cumplir con los requerimientos sociales y declinación del desempeño en general. Los rasgos negativos característicos de la esquizofrenia residual (por ejemplo, el aplanamiento del afecto, la pérdida de la volición, etc.) se desarrollan sin ser precedidos por ninguna sintomatología psicótica.
La forma de evolución de los trastornos esquizofrénicos se clasificará según las siguientes categorías de cinco caracteres:
• Continua
• Episódica con defecto progresivo
• Episódica con defecto estable
• Episódica con remisiones completas
• Remisión incompleta
• Remisión completa
• Otra forma de evolución
• Forma de evolución indeterminada, período de observación demasiado breve
Cambios a las clasificaciones
Del análisis de los dos sistemas más importantes de clasificación, así como de sus antecedentes históricos; vale la pena destacar la coherencia que tienen los conceptos que han servido de base para la descripción y el diagnóstico de la esquizofrenia, la consistencia con la que se han mantenido conforme ha evolucionado el conocimiento y la presencia en este momento, más que de un conjunto de elementos nosológicos difusos y poco precisos, de un síndrome clínico con límites claros y con una amplia variedad de formas de expresión, ordenadas y accesibles para el trabajo clínico, la vigilancia epidemiológica y la investigación científica.
A pesar de lo anterior, el concepto de la esquizofrenia tiene graves deficiencias. En primer lugar, no es una enfermedad única y tiene múltiples factores etiológicos y mecanismos fisiopatológicos. En segundo lugar, sus manifestaciones clínicas son tan diversas que su variabilidad extrema ha sido considerada por algunos como una característica central. En tercer lugar, sus características clínicas no están claramente delimitadas con respecto a otros padecimientos. Por lo tanto, en las revisiones actuales de ambos sistemas se han realizado propuestas para hacer frente a estas limitaciones. El proceso de revisión del CIE-11 apenas ha comenzado y se cuenta con algunos borradores, se espera su publicación definitiva en el 2015 (Organización WH 2012). El proceso del DSM-5 se ha cerrado y se espera su publicación en mayo de 2013 (Asociación AP 2012). Ambos sistemas buscan incorporar la nueva información sobre la esquizofrenia y la eliminación de los subtipos, además incluyen las dimensiones psicopatológicas, la eliminación de un tratamiento especial de los síntomas de Schneider "de primer rango", una mejor delimitación de los trastornos esquizoafectivos, y la adición de una nueva categoría denominada "síndrome de psicosis atenuada" (Tandon 2012).
Propuesta del DSM-5
Se proponen cinco cambios específicos (Barch 2003). Los cuatro primeros son principalmente con el propósito de mejorar la simplicidad y clarificación. El quinto cambio recomendado es más significativo, donde se propone la supresión de los subtipos de esquizofrenia clásicos. Todos los cambios recomendados mejorarán concordancia con la CIE-11 (Organización WH 2012).
1. Eliminación de un tratamiento especial de los delirios bizarros y las alucinaciones en el criterio A. En el DSM-IV, sólo un síntoma característico era necesario si se trataba de un delirio bizarro o de alucinaciones. Estos síntomas no tienen especificidad diagnóstica, por lo que estos "síntomas positivos" serán tratados como cualquier otro, y se requiere de la presencia de dos síntomas del criterio A para el diagnóstico de la esquizofrenia.
2. Clarificación de los síntomas negativos en el criterio A. El afecto restringido describe mejor la naturaleza de las alteraciones en el afecto y los síntomas negativos en la esquizofrenia en comparación con el afecto aplanado y abulia/aislamiento social. Por lo tanto, al enumerar los síntomas negativos, se especifican el afecto restringido o la abulia/aislamiento social.
3. Requisito de que al menos uno de los dos síntomas necesitados para satisfacer el criterio A incluya los delirios, alucinaciones o lenguaje desorganizado. Estos son los principales "síntomas positivos" que tienen una alta confiabilidad y deberán de considerarse necesarios para un diagnóstico confiable de la esquizofrenia.
4. Clarificación del criterio F (relación con un trastorno generalizado del desarrollo). Actualmente, si hay una historia de trastorno autista o trastorno generalizado del desarrollo, el diagnóstico adicional de esquizofrenia sólo se puede realizar si las ideas delirantes o las alucinaciones también están presentes. Hay otros problemas como los trastornos de la comunicación de inicio en la infancia, donde el lenguaje desorganizado y síntomas negativos pueden estar presentes. En consecuencia, el criterio F se actualiza como "Si hay una historia de trastorno autista, otro trastorno generalizado del desarrollo, u otro trastorno de comunicación de inicio en la infancia, el diagnóstico adicional de esquizofrenia sólo se realizará si las alucinaciones o delirios prominentes también están presentes por lo menos durante un mes (o menos si es tratado con éxito)".
5. La eliminación de los subtipos. Los subtipos actuales clásicos de la esquizofrenia proporcionan una descripción pobre de la heterogeneidad de la esquizofrenia, tienen una baja estabilidad diagnóstica, no exhiben patrones distintivos de la respuesta al tratamiento o curso longitudinal, y no son hereditarios. A excepción de los subtipos paranoide e indiferenciado, otros subtipos son raramente diagnosticados. Como resultado de ello, se propone que estos subtipos de esquizofrenia sean eliminados del DSM-5.
Criterios del DSM-5
A. Dos (o más) de los siguientes, cada uno presente durante una parte significativa de tiempo durante un período de 1 mes (o menos si es tratado con éxito). Al menos uno de éstos debe incluir 1, 2 o 3.
1. Ideas delirantes
2. Alucinaciones
3. Lenguaje desorganizado
4. Conductas psicomotoras anormales, incluyendo la catatonía
5. Síntomas negativos, por ejemplo, la expresión, la disminución emocional o abulia.
B. Por una parte significativa del tiempo desde el inicio de la alteración, una o más áreas importantes de funcionamiento, tales como la escuela, el trabajo, las relaciones interpersonales o el cuidado personal, están muy por debajo del nivel alcanzado antes de la aparición (o cuando el inicio es en la infancia o adolescencia, fracasó para alcanzar el nivel esperado de rendimiento interpersonal, académico o laboral).
C. Signos continuos de la perturbación persistentes durante al menos 6 meses. Este período de 6 meses debe incluir al menos 1 mes de síntomas (o menos, si es tratado con éxito) que cumplen el criterio A (es decir, los síntomas de la fase activa) y pueden incluir períodos de síntomas prodrómicos o residuales. Durante estos períodos prodrómicos o residuales, los signos de la alteración pueden manifestarse sólo por síntomas negativos o por una forma atenuada de dos o más de los síntomas enumerados en el Criterio A (por ejemplo, creencias percibidas como extrañas, experiencias perceptivas descritas como fuera de lo común).
D. Trastorno esquizoafectivo y trastorno depresivo o trastorno bipolar con síntomas psicóticos se han descartado, debido a cualquiera de los dos (DSM IV 2000) no se ha presentado un episodio depresivo mayor, maníaco, o episodios mixtos al mismo tiempo que los síntomas de la fase activa, o (WHO 2004) si los episodios afectivos han aparecido durante la fase activa, su duración total ha sido menos de la mitad de la duración total de los períodos de fase activa.
E. El trastorno no se debe a los efectos fisiológicos directos de una sustancia (por ejemplo, una droga de abuso, un medicamento) o una enfermedad médica.
F. Si hay una historia de trastorno autista, otro trastorno generalizado del desarrollo, u otro trastorno de comunicación de inicio en la infancia, el diagnóstico adicional de esquizofrenia sólo se realizará si las alucinaciones o delirios prominentes también están presentes por lo menos durante un mes (o menos si es tratado con éxito).
Especificador de las características catatónicas
El cuadro clínico está dominado por al menos dos de los siguientes:
1. Inmovilidad motora como se evidencia por catalepsia (incluida flexibilidad cérea) o estupor.
2. Actividad motora excesiva (que aparentemente carece de propósito y no está influida por estímulos externos).
3. Negativismo extremo (resistencia aparentemente inmotivada a todas las órdenes o mantenimiento de una postura rígida contra los intentos de ser movido) o mutismo.
4. Peculiaridades del movimiento voluntario según lo evidenciado por la postura (adopción voluntaria de posturas inapropiadas o extraños), movimientos estereotipados, manierismos marcados o muecas.
5. Ecolalia o ecopraxia
El trabajo sobre las causas y el tratamiento de la esquizofrenia y otros trastornos psicóticos ha reconocido desde hace tiempo la heterogeneidad de los síntomas que se pueden presentar en los pacientes con psicosis. Además, los investigadores han establecido cómo la gravedad de los diferentes síntomas de esta enfermedad pueden variar entre los individuos, y han proporcionado pruebas de que la gravedad de tales síntomas pueden predecir otros aspectos importantes de la enfermedad, tales como el grado de déficit cognitivo y/o neurobiológico (Barch 2003, Delawalla 2006, Perlstein 2003, Strauss 1993). Además, la investigación ha destacado cada vez que los límites entre entidades nosológicas pueden no ser tan categóricos como lo sugirió Kraepelin (Kraepelin 1971), y la comorbilidad de diversos trastornos puede reflejar alteraciones en las dimensiones comunes de la variación genética, el comportamiento humano y la función neurobiológica (Owen 2007). Por lo anterior, se decidió incluir las evaluaciones dimensionales de los síntomas principales de trastornos psicóticos que nos ayuden a identificar esta variabilidad, por lo que se propone incluir evaluaciones dimensionales de todos los síntomas que se incluyen como indicadores de diagnóstico del Criterio A de los criterios diagnósticos para la esquizofrenia. Adicionalmente se considera importante incluir también evaluaciones dimensionales de otros fenómenos clínicos que son relevantes para la planificación del tratamiento y el pronóstico, así que se incluye una evaluación dimensional de deterioro cognitivo y evaluaciones dimensionales de la depresión y la manía (Asociación AP 2012).
Las dimensiones serán evaluadas en una escala de 0-4 en sección transversal, con base en la evaluación de la severidad durante el mes pasado. La gravedad relativa de los síntomas a través de estos dominios varía en el curso de la enfermedad y entre los pacientes. La evaluación de las dimensiones es un cambio importante que será potencialmente de gran valor clínico y también será de utilidad en la investigación (cuadro 1).
Síndrome de psicosis atenuada
En los últimos años, el grupo de trabajo de trastornos psicóticos ha examinado exhaustivamente todos los datos disponibles de varios centros de todo el mundo, donde se han desarrollado programas de detección temprana de psicosis; además, consultó una serie de expertos y se consideraron cuidadosamente comentarios del público y de expertos sobre el tema con base en ese examen; el Grupo de Trabajo ha decidido recomendar la inclusión del Síndrome de Psicosis atenuada como una categoría en el anexo (sección 3) del DSM-5, como condición para su estudio posterior.
Criterios propuestos
A. Al menos uno de los siguientes síntomas están presentes en forma atenuada con la prueba de realidad relativamente intacta, pero de suficiente gravedad y/o frecuencia para justificar atención clínica:
1. Delirios / Ideas delirantes
2. Alucinaciones / Anormalidades perceptuales
3. Lenguaje desorganizado / Comunicación
B. Los síntomas del Criterio A deben estar presentes por lo menos una vez a la semana durante el último mes.
C. Los síntomas del Criterio A deben haber iniciado o empeorado en el último año.
D. Los síntomas del Criterio A son los suficientemente estresantes e incapacitantes para el individuo y/o tutor legal para solicitar ayuda.
E. Los síntomas del Criterio A no se explican mejor por cualquier otro diagnóstico DSM 5, incluyendo trastornos relacionados con sustancias.
F. Los criterios clínicos para un trastorno psicótico nunca se han cumplido.
MANIFESTACIONES CLÍNICAS Y EVOLUCIÓN
Fase prodrómica
Sujetos en alto riesgo de psicosis
Los últimos 15 años han sido testigos del cambio en la investigación en esquizofrenia, habiendo un interés creciente en las etapas tempranas de la enfermedad (McGorry 2009). Este interés fue desencadenado en gran medida por el descubrimiento de que a mayor tiempo de psicosis no tratada, existe un peor desenlace global, una peor respuesta a antipsicóticos, una mayor carga sintomática, una mayor prevalencia de síntomas afectivos y peores resultados en la funcionalidad general del paciente (Harrigan 2003, Marshall 2005, Perkins 2005). Los términos: "alto riesgo clínico de psicosis" (ARC), "riesgo clínico ultra alto" o "en riesgo", son utilizados para describir sujetos en riesgo inminente de desarrollar un trastorno psicótico (Yung 1996, Yung 2004, Cornblatt 2007). El criterio aplica para jóvenes que buscan atención médica y presentan alguna de las siguientes condiciones:
1. Síndrome psicótico breve intermitente
2. Síndrome con síntomas positivos atenuados
3. Síndrome de riesgo genético y disfunción global o personalidad esquizotípica previa (Yung 2008) (cuadro 2).
Actualmente existen distintos criterios para hacer el diagnóstico y evaluar la severidad de los síntomas en la fase prodrómica; una de las herramientas más utilizadas es la Entrevista Estructurada para Síndromes Prodrómicos (SIPS) (Miller 1999), que es empleada para la evaluación en el consorcio de Norteamérica. Esta es una entrevista semiestructurada, diseñada para diferenciar clínicamente entre los síntomas prodrómicos; incluye 4 componentes (síntomas positivos, síntomas negativos, síntomas de desorganización y síntomas generales), además de un apartado previo de resumen e historia demográfica, y un listado final para la síntesis de los hallazgos.
Los estudios iniciales de poblaciones en riesgo mostraron tasas variables de conversión a psicosis, oscilando en un rango del 10 al 70% dependiendo del tamaño de la muestra, los criterios de inclusión utilizados y el tiempo de seguimiento (Cannon 2008, Haroun 2006, Klosterkotter 2001, Miller 2003, Mason 2004). En estudios multicéntricos actuales, las tasas de conversión se encuentran alrededor del 30% en un periodo de 2 a 3 años (Yung 2008, Ruhrmann 2010, Riecher 2007, Woods 2009). En un meta-análisis reciente se estableció que el riesgo de transición de sujetos en riesgo, a una enfermedad psicótica florida, es del 29.2% (IC 95%, 27.331.1%), con una media de seguimiento de 31 meses (Fusar 2012).
Las variables clínicas y demográficas asociadas con un aumento en el riesgo de conversión a psicosis incluyen el estado funcional premórbido (Cannon 2008, Niendam 2009, Shim 2008, Cornblatt 2007), la historia familiar de psicosis, la severidad de síntomas psicóticos atenuados específicos (pensamientos desorganizados, suspicacia e ideas de referencia) (Cannon 2008, Yung 2006, Velthorst 2009), comorbilidad con depresión (Yung 2006, Yung 2007, Schultze 2007) y abuso de sustancias (Cannon 2008, Kristensen 2007). El consorcio de NAPLS (North American Prodrome Longitudinal Studies), encontró que el detrimento reciente del estado funcional es un factor de riesgo para una posterior conversión a psicosis; otros reportes muestran la persistencia de déficits funcionales aun en aquellos individuos que no desarrollan un episodio psicótico (Addington 2011).
Por otro lado, el grupo de no convertidores está integrado por sujetos que continúan cumpliendo criterios de riesgo, que convierten a otros trastornos no psicóticos o alcanzan remisión de los síntomas. Debido a que la mayoría de los estudios utilizan tratamientos naturalísticos, el efecto de la intervención en los distintos tipos de desenlace aún no está bien descrito. El hecho de que los sujetos en riesgo desarrollen otros síndromes no psicóticos, incluyendo trastornos del ánimo, ansiedad o uso de sustancias, habla de la necesidad de estudios longitudinales, con seguimiento prolongado y estrecho de todos los sujetos para determinar el riesgo específico en cada desenlace.
Recomendaciones generales
• La posibilidad de un trastorno psicótico debe ser considerada en cualquier persona joven que inicia con aislamiento social, disminución notoria de la funcionalidad escolar o laboral, que inicia con comportamientos inusuales o presenta agitación y ansiedad importantes, sin poder explicar por qué.
• Si se detectan síntomas psicóticos atenuados y disfunción global, el paciente debe ser evaluado por un especialista y seguirse de manera regular (cada 2 a 4 semanas).
• La presencia de síntomas ansiosos y depresivos, así como el abuso de sustancias de ben manejarse apropiadamente y de forma multidisciplinaria.
• Muchos pacientes jóvenes y sus familias se encuentran al tanto del riesgo de desarrollar trastornos serios como esquizofrenia o trastornos afectivos. Se debe proporcionar información de manera cuidadosa, tomando en cuenta factores sociales, culturales y educacionales. Esto debe realizarse en un ambiente de optimismo terapéutico, enfatizando que en la mayoría de los sujetos en riesgo los síntomas tienden a autolimitarse, y en caso de no hacerlo, actualmente existen tratamientos efectivos y bien tolerados.
¿Qué tratamientos están justificados, dado nuestro nivel actual de conocimiento sobre el estado de riesgo?
Cualquier recomendación de tratamiento necesita balancear dos factores: 1) La heterogeneidad de los resultados diagnósticos en una población en riesgo y 2) El hecho de que algunos individuos continuarán experimentando un déficit funcional, o están verdaderamente en un riesgo inminente de desarrollar un trastorno mental serio y crónico. Los tratamientos ideales deben cumplir los siguientes criterios:
1. Ser de amplio espectro; que puedan ser benéficos entre las categorías diagnósticas, en lugar de ser tratamientos para un síndrome específico.
2. Tener baja propensión para presentar efectos secundarios a largo plazo, ya que varios sujetos requerirán tratamientos por periodos prolongados y no necesariamente desarrollarán un trastorno mental.
3. Con un entendimiento creciente de la neuroanatomía funcional, la intervención específica sobre diferentes redes neurales puede ser considerada, con el fin de tratar las deficiencias en dominios funcionales específicos.
De esta forma, el uso de antipsicóticos debe ser evitado en esta población como una práctica común y rutinaria. La razón de riesgo-beneficio para el uso de antipsicóticos en el estado de riesgo, no será clara hasta que se realicen múltiples ensayos clínicos de metodología rigurosa. Por otro lado, los ácidos grasos omega 3 presentan una opción prometedora de tratamiento. En un estudio reciente, Amminger y cols. (Amminger 2010) [C2]. Siguieron a 81 sujetos en riesgo por 12 meses, habiendo una marcada disminución en la tasa de conversión en el grupo tratado versus el grupo placebo. El estudio también demostró reducción en síntomas positivos y negativos, y una mejoría en la función global en el grupo con tratamiento activo. Se presume que los ácidos grasos omega 3 producen un incremento de los niveles de glutatión, los cuales aumentan las defensas antioxidantes del cerebro y proveen neuroprotección. Cabe mencionar que los ácidos grasos omega 3 también han mostrado efectos positivos en la depresión mayor, trastorno bipolar, trastorno limítrofe de la personalidad, jóvenes encarcelados, niños con trastornos del desarrollo y trastornos del espectro autista (Saugstad 2006). Sin embargo, estos estudios deben ser replicados antes de considerar a los ácidos grasos omega 3 como un tratamiento farmacológico de primera línea en esta población. Otras intervenciones farmacológicas que se encuentran bajo investigación (en necesidad de estudios clínicos bien planeados) incluyen: Inhibidores de la acetilco-linesterasa (donepecilo, galantamina, rivastigmina), antagonistas del receptor NMDA y agentes antiinflamatorios, por su amplio espectro de efectos neuroprotectores.
Por otro lado, las intervenciones psicosociales varían desde una aproximación individual, hasta una familiar y uso de terapia cognitivo conductual (TCC); todas ellas han mostrado mejoría en síntomas de psicosis temprana (Gleeson 2003) [B2]. Estos son tratamientos de amplio espectro y cuentan con una razón favorable de riesgo-beneficio. Otra modalidad con beneficios positivos, incluye la terapia de rehabilitación cognitiva. En un meta-análisis de 26 estudios, McGurk y cols. (McGurk 2007) [A1], concluyeron que la terapia de rehabilitación cognitiva combinada con rehabilitación psiquiátrica, produce mejoría moderada en el desempeño cognitivo y mejora los resultados funcionales. En el cuadro 3, se resumen algunas de las intervenciones propuestas para cada etapa.
Integrando los conocimientos actuales sobre los mecanismos neurales y moleculares de la psicosis y el déficit funcional, los modelos de tratamiento deben centrarse en la rehabilitación del desorden de redes neurales utilizando abordajes no farmacológicos, que podrían ser facilitados por potenciadores neurocognitivos (Swerdlow 2011) [C3].
Primer episodio psicótico
El primer episodio de un trastorno psicótico, generalmente ocurre en la adolescencia tardía o en la adultez temprana. Más del 40% de los casos tienen su inicio entre los 15 y los 18 años (Ballageer 2005); esta es una etapa crítica en el desarrollo de la personalidad, del futuro rol social, la educación y la elección vocacional (Patel 2007, Redmond 2010). Los síntomas y por lo tanto, el diagnóstico en esta etapa, son muy inestables y pueden evolucionar a distintas patologías con el paso del tiempo. Por esta razón se prefiere el uso del término genérico "psicosis", que permite el inicio de un tratamiento efectivo antes de establecer un diagnóstico.
Los síntomas de psicosis pueden ser muy traumáticos en este momento de la vida, e incrementan el riesgo de desenlaces adversos, incluyendo el riesgo de suicidio (Jackson 2004, Mueser 2010, Payne 2006). El impacto máximo de los trastornos psicóticos ocurre en los primeros años posteriores al primer episodio (Robinson 1999). Estudios muestran que el desenlace observado en los primeros 2 años es un buen predictor del desenlace a largo plazo (Abdel 2011, Harrison 2001). Así, los primeros 2 a 5 años, desde el inicio del padecimiento, son críticos para la instauración de un tratamiento efectivo que evite la aparición de consecuencias severas (Birchwood 1998). En general, se reconoce que una intervención temprana especializada es la mejor práctica en este momento de la enfermedad (Marshall 2011, McGorry 2008).
La mayoría de los pacientes con un primer episodio de psicosis (82%), responden al tratamiento antipsicótico en los primeros 2 años (Malla 2006), con más de la mitad de los individuos experimentando remisión completa de los síntomas psicóticos en los primeros 3 meses de iniciado el tratamiento, el 75% a los 6 meses, y hasta el 80% después de 1 año de tratamiento (Addington 2003, Cassidy 2010, Lieberman 2003, Tohen 2000). Aunque las tasas de respuesta son muy buenas, los pacientes tienen un alto riesgo de recaída, especialmente cuando la atención se lleva a cabo fuera de programas o centros especializados en psicosis temprana; la causa se asocia principalmente a la falta de adherencia al medicamento (Robinson 1999) y al abuso de sustancias (Malla 2006). La intervención temprana tiene como objetivo prevenir el declive en el funcionamiento social y el desarrollo de resistencia al tratamiento, ofreciendo una amplia gama de intervenciones farmacológicas y psicosociales. Uno de los principales objetivos es la psicoeducación del paciente y sus familiares, enfatizando la importancia de la adherencia al tratamiento, como uno de los principales predictores de recaída (Gearing 2009, Malla 2010) [B2].
Objetivos principales del tratamiento
Se propone que los clínicos tengan 3 objetivos principales en el tratamiento de pacientes con un primer episodio de psicosis:
1) obtener una pronta remisión de los síntomas
2) prevenir las recaídas
3) lograr la recuperación funcional, promoviendo la rehabilitación social.
Mediante un manejo cuidadoso de las estrategias de tratamiento y la evaluación del progreso de los pacientes, los médicos pueden optimizar el tratamiento para alcanzar estas metas. Desde luego, esto puede ser más difícil en los pacientes adolescentes, en donde los síntomas tienden a ser más severos y menos específicos, y ocurren en un momento en donde el desarrollo de la personalidad se interrumpe o retrasa por la aparición de la enfermedad (Rabinovitch 2009, Masi 2011, Werry 1994). Para conseguir los objetivos, los clínicos tienen que impactar en los factores más maleables que influyen en la no adhesión, tales como los sociales, el apoyo familiar, la alianza terapéutica, la actitud hacia la medicación, el uso de sustancia, la eficacia de los fármacos, tomando en cuenta la accesibilidad a ellos y su perfil de efectos adversos.
La prevención de recaídas es un objetivo primordial después de obtener una respuesta inicial o una mejoría significativa de los síntomas psicóticos, pues además de ser muy problemático para el paciente y su familia, una recaída amenaza con interrumpir la recuperación psicosocial, aumenta el riesgo de resistencia al tratamiento, apresura el deterioro social y se asocia con el aumento en los costos de tratamiento (Gleeson 2010) [A1]. Desafortunadamente, la mayoría de los pacientes con un primer episodio de psicosis presentarán recaídas a 5 años de seguimiento, el 82% de los sujetos han presentado una recaída, 78% de los pacientes presentan una segunda recaída, y 86% tienen una tercera (Robinson 1999). La falta de adherencia después de un primer episodio de psicosis, en gran medida se debe a que lo sujetos jóvenes, en muchas ocasiones prefieren manejar su condición sin medicamentos una vez que han mejorado lo suficiente.
Características fisiológicas durante la adolescencia y su relevancia para el tratamiento de la psicosis
La mayor parte de los antipsicóticos utilizados para el tratamiento de un primer episodio de psicosis, no están estudiados ni aprobados específicamente para población adolescente (Mehler 2009). Esto puede implicar un riesgo inmediato de sub o sobre dosificación y un riesgo tardío de producir efectos adversos a largo plazo. Los factores que necesitan considerarse para elegir la dosis correcta de un fármaco son las características de absorción y su metabolismo en el paciente adolescente (van der Anker 2010). La absorción de los medicamentos, generalmente es más lenta en los adolescentes, por lo tanto, el tiempo para obtener los niveles plasmáticos máximos es mayor. La biodisponibilidad en los adolescentes puede ser muy distinta a la de los adultos debido a que existen diferencias asociadas al desarrollo, a la actividad enzimática intestinal y a la presencia de los transportadores involucrados en el metabolismo de medicamentos. En general, los pacientes nunca tratados pueden ser más sensibles a ciertos efectos adversos (Kwon 2009). Las diferencias fisiológicas entre adultos y adolescentes enfatizan la importancia de tener un cuidado especial en esta población, la conocida regla de "empezar con poco e ir despacio" aplica en esta condición; teniendo en cuenta que en algunos pacientes, cuando el medicamento se tolera bien y sólo se obtiene una respuesta parcial, las dosis pueden ser incrementadas, incluso a cantidades mayores de las que se utilizan en adultos del mismo peso.
Recomendaciones generales
• En los servicios de atención médica y, en especial, en los de salud mental, se deben de implementar programas educativos que mejoren el entendimiento de cómo un trastorno psicótico puede aparecer en una persona previamente sana, al igual que cómo y dónde obtener la ayuda más adecuada y el tratamiento más efectivo.
• Debe mantenerse un alto índice de sospecha y un sistema que permita un acceso rápido y eficiente de cualquier persona en la que se sospeche un cuadro psicótico de primera vez.
• Desde el ingreso debe implementarse un modelo de atención que minimice el estigma y ejecute efectivamente un proceso de retención activa de los pacientes, especialmente durante el intervalo de los primeros 2 a 5 años.
• De ser posible, el tratamiento debe iniciarse de manera ambulatoria y debe explicarse en el contexto cultural más apropiado. Esta medida usualmente disminuye la ansiedad y las preocupaciones de la familia y del paciente. La admisión hospitalaria se requiere claramente si existe: riesgo para el paciente y/o conducta agresiva, pobre red de apoyo o un cuadro severo que impida el manejo por parte de los familiares.
• La atención intrahospitalaria debe brindarse en el ambiente menos restrictivo posible, es deseable la atención en espacios reservados para jóvenes diagnosticados recientemente.
• En el primer episodio de psicosis la historia clínica y exploración neurológica completa son obligatorias. Se recomienda también la realización de exámenes básicos de laboratorio, perfil lipídico, resonancia magnética de encéfalo, electroencefalograma y perfil toxicológico que incluya las drogas de uso más común en la comunidad.
• Las intervenciones psicosociales, especialmente la terapia cognitivo conductual, tienen un lugar fundamental en el tratamiento inicial, proveyendo una mayor alianza terapéutica, prevención y resolución de consecuencias secundarias a la enfermedad, y promoviendo la recuperación. Esta terapia es muy útil para el manejo de la comorbilidad con abuso de sustancias, trastornos ansiosos y afectivos, y en general mejora el apego al tratamiento.
• Los familiares y, cuando sea posible y apropiado, otros miembros del entorno social del paciente deben ser informados y educados continuamente acerca de la naturaleza del problema, el tipo de tratamiento y los resultados esperados. Las familias necesitan una atención individualizada, pero también se recomienda brindar la oportunidad de conocer a otras familias en la misma situación. Si existen recaídas frecuentes o una recuperación muy lenta, se requiere de una intervención familiar más intensa y prolongada.
Elección del medicamento
Para la elección del medicamento más apropiado, el médico debe determinar cuidadosamente la razón riesgo/beneficio de cada molécula, y seleccionar aquella que tenga la menor probabilidad de generar efectos adversos en un paciente determinado. Debido a que ninguno de los antipsicóticos disponibles (excepto la clozapina en psicosis refractaria) ha demostrado una clara superioridad en términos de eficacia, los aspectos de seguridad deben determinar la elección de un antipsicótico (Lieberman 2003) [A1], (Asenjo 2010) [A1], (Gasquet 2009) [A2], (Jones 2006) [A1], (Rummel 2012) [A1]. El clínico debe evaluar el perfil de cada paciente y determinar el medicamento menos adverso.
La aparición de efectos extrapiramidales asociados al uso de antipsicóticos de primera generación, marcaron las primeras cuatro décadas del uso de estos medicamentos, y actualmente esta familia de fármacos es menos prescrita debido a su potencial de generar efectos dañinos indeseables en pacientes jóvenes. Se sugieren las dosis bajas de antipsicóticos de segunda generación como la primera línea de tratamiento en el primer episodio de psicosis (McGorry P 2005), aun cuando se sabe que el perfil de efectos adversos varía entre ellos, el aumento de peso y las alteraciones metabólicas son los más frecuentes, siendo además los más deletéreos a largo plazo.
Los medicamentos que menor impacto metabólico tengan, deben considerarse como la opción más razonable. A pesar de esto, actualmente no existen datos contundentes sobre los resultados obtenidos con diferentes fármacos. Existen algunas pruebas que demuestran que el aripiprazol, la amisulpririda y la ziprasidona, seguidas por la quetiapina, risperidona y la paliperidona, generan menos efectos adversos que la olanzapina y la clozapina (Allison 2001) [A3], (Chabroux 2009) [A3], (Leucht 2009) [A1], (Marder 2004) [A3], (Newcomer 2007) [A3], (Rummel 2010) [A3].
En general, se recomienda evitar la polifarmacia (que incrementa el riesgo de efectos adversos y las interacciones farmacocinéticas) y reducir lo más posible el número de tomas y dosis al día, ya que esto facilita el apego y la aceptación del tratamiento por parte de los pacientes. Si el paciente no responde al medicamento, lo hace parcialmente o no hay una adecuada adherencia al fármaco; el uso de antipsicóticos de depósito puede ser considerado (Stip 2011) [A3]. Para casos severos, en donde el uso de antipsicóticos de depósito falla, el tratamiento con clozapina está indicado (Masi 2011) [A3].
Intervenciones farmacológicas en el paciente con un primer episodio de psicosis
• Inicialmente se recomienda un periodo de 24 horas de observación (evitar el uso de antipsicóticos, utilizar benzodiacepinas para el manejo de ansiedad o alteraciones del sueño).
• Iniciar dosis bajas de antipsicótico atípico.
• Incrementar dentro de los primeros 7 días la dosis inicial recomendada de antipsicóticos atípicos y mantener por las siguientes 3 semanas.
• Si hay una respuesta pobre, incrementar lentamente la dosis en las siguientes 4 semanas (8 semanas en total), hasta la dosis máxima recomendada o hasta la aparición de los efectos adversos pronunciados.
• Si hay respuesta, continuar el tratamiento por 12 meses, y si hay remisión, suspender gradualmente en el transcurso de algunos otros meses. Dar seguimiento estrecho subsecuente.
• Si aparecen efectos adversos (ej. aumento de peso, síndrome metabólico, etc.), puede considerarse el cambio a un antipsicótico típico.
• Si hay respuesta pobre, evaluar la razón.
• La dosis puede incrementarse si no hay efectos adversos.
• Adherencia pobre al tratamiento: discutirlo, analizar las razones, optimizar la dosis y ofrecer programa de apego terapéutico.
• Respuesta pobre: cambiar a otro antipsicótico atípico y evaluar en 6-8 semanas.
• Si hay respuesta pobre, apego pobre o riesgo suicida persistente, ofrecer prueba con clozapina.
Si hay renuencia, el uso de antipsicóticos típicos y atípicos inyectables está justificado y pueden considerarse como una alternativa a la clozapina cuando no existe un buen apego.
RECAÍDA
Trastornos tan complejos y severos como lo son la esquizofrenia, la reaparición o el agravamiento de los síntomas psicóticos, son desafortunadamente una situación demasiado común (Haddock 1996). Más del 50% de estos pacientes sufren una recaída dentro de los primeros 18 meses después de su primer episodio (Parker 2007), y arriba del 80% la tendrán antes de los cinco años de evolución (Gumley 2009).
Una recaída psicótica es una emergencia médica seria que debe ser identificada de manera temprana por los clínicos (Masand 2009). Las consecuencias de una agudización pueden ser devastadoras para el pronóstico, la respuesta a tratamientos ulteriores, la comorbilidad médica y el número de reingresos hospitalarios, por lo que su detección y las estrategias de prevención son prioritarias y deben ser incluidas en cualquier esquema de tratamiento para este trastorno.
Liberman señala que las tres principales causas de recaída en un paciente con esquizofrenia son las fallas en la adherencia al tratamiento, el uso de sustancias psicoactivas (alcohol, marihuana, cocaína, etc.) y la experiencia de acontecimientos estresantes (ej. emotividad altamente expresada en la familia) (Lieberman 2006). Los problemas de adherencia (parciales o completos) a los esquemas de antipsicóticos son el factor predictivo modificable más poderoso para una recaída psicótica, por lo tanto, de las rehospitalizaciones (Masand PS 2009).
Es bien conocido que una parte sustancial de estos pacientes no toman la medicación como se les prescribe, la adherencia es más bien inusual; Valenstein opina que menos de una tercera parte de estos pacientes se pueden considerar con buena adherencia terapéutica (Valenstein 2001). Los rangos de descontinuación de los fármacos en esta población van del 50 al 75% después de dos años del egreso hospitalario.
De inicio, es vital para la prevención de las recaídas la identificación temprana de factores de riesgo para una mala adherencia a la medicación. Algunos autores los agrupan en aquellos relacionados al paciente (nivel de insight, creencias, estabilidad clínica, afección cognoscitiva, etc.) y los relacionados al fármaco (costo, tolerabilidad, posología, vía de administración, etc.). Sin embargo, en un sobresaliente meta-análisis, Compton es quien señala más ampliamente los factores predictivos principales (cuadro 4).

Aún así, la detección de los problemas de adherencia es algo difícil de identificar y, sobre todo, de cuantificar. Todos los métodos que se han empleado con este fin, han presentado problemas y deficiencias (Kane 1983). Generalmente los médicos sobrestiman los niveles de adherencia de sus pacientes con la consecuente falla en el reconocimiento de un problema de alta trascendencia en sus pautas de prescripción, respuesta terapéutica del paciente y costos finales de la atención en salud.
Debido al gran impacto de las recaídas, desde las etapas iniciales de la enfermedad es recomendable la utilización de estrategias específicas para su prevención, particularmente todas aquellas que garanticen el mantenimiento de la droga antipsicótica (NICE 2010) [A1].
Es indispensable establecer intervenciones inmediatas en aquellos pacientes con antecedentes de recaídas relacionadas por abandono del tratamiento, los gravemente afectados por el trastorno, y los que tengan comorbilidad con abuso de sustancias (Aronson 2007) [A3].
Aunque se identifiquen factores generales de peso para las recaídas, en cada paciente, en lo particular, intervienen una gran cantidad de factores que habrá que identificar para una estrategia individualizada y efectiva.
El monitoreo constante y sistemático de la adherencia al tratamiento, el reforzamiento de la alianza médico-paciente, intervenciones cognitivas positivas para el fármaco, modelos psicoeducativos para la familia (centrados en la prevención e identificación temprana de recaídas), uso de inyectables de larga duración, preponderancia de los atípicos sobre los tradicionales y esquemas farmacológicos de posología simple, son intervenciones que han demostrado diversos grados de eficacia (SIGN 2008) [A1].
ESQUIZOFRENIA Y FENÓMENO ESQUIZO-OBSESIVO
De acuerdo con el DSM IV, el trastorno obsesivo-compulsivo (TOC) es un trastorno caracterizado por la presencia de obsesiones (ideas, pensamientos, impulsos o imágenes recurrentes e intrusivas) y compulsiones (conductas o actos mentales repetitivos que tienen como objetivo prevenir o reducir la ansiedad) que afectan la funcionalidad del paciente o le generan malestar significativo. El paciente reconoce, en algún punto del curso de la enfermedad, que las obsesiones o compulsiones son excesivas e irracionales.
A pesar de que la esquizofrenia y el TOC son entidades diferentes, comparten similitudes desde el punto de vista clínico y patogénico por los circuitos cerebrales y los neurotransmisores involucrados en las dos patologías. Ambas son condiciones crónicas con fluctuaciones en la severidad de los síntomas; la prevalencia en la población general es de 1% para la esquizofrenia, y de 2 a 3% para el TOC (Saddock 2007). Ambas entidades afectan a hombres y mujeres en igual proporción y tienen una edad de inicio similar, aunque el TOC tiende a iniciar en la primera y segunda década de la vida, mientras que la esquizofrenia, sobre todo en mujeres, entre los 20 y 30 años (Poyurovsky 2004).
Algunos autores han reportado que de 1 a 16% de los pacientes inicialmente diagnosticados con trastorno obsesivo compulsivo, desarrollarán esquizofrenia (Eisen 1997). La prevalencia de TOC en esquizofrenia se ha encontrado en un rango que va de 7.8 a 25% (Eisen 1997, Hadi 2012, Kruger 2000), aunque la presencia de obsesiones y compulsiones se ha reportado hasta en el 60% de los pacientes (Berman 1995, Fabisch 2001).
Un sobresaliente estudio epidemiológico realizado en los E.U.A. (Karno 1988) reportó que la comorbilidad de esquizofrenia y TOC era de 12.2%, mientras que Fenton refiere una prevalencia entre 10 y 16% (Fenton 1986), siendo ésta la que se ha encontrado en estudios de pacientes mexicanos (Crail 2006, Lóyzaga 2002), esta comorbilidad, relativamente frecuente, ha llevado a la utilización de términos como esquizo-TOC y esquizo-obsesivo para referirse a la convergencia de ambas enfermedades (Hwang 2009).
Se ha definido el fenómeno esquizo-obsesivo (Lóyzaga 2002) como una entidad clínica ampliamente heterogénea, caracterizada por la coexistencia temporal de síntomas obsesivo-compulsivos y psicóticos.
Tradicionalmente se había considerado fundamental la capacidad de insight del paciente sobre sus obsesiones como fundamental para diagnosticar TOC. Sin embargo, algunos pacientes con TOC perciben las obsesiones como racionales y no se resisten a ellas. El DSM IV clasifica a estos pacientes como "con pobre insight", aunque hay estudios que los consideran en una dimensión psicótica (Tumkaya 2009). Hasta del 5 al 15% de los pacientes con TOC se caracterizan por tener un insight parcial o nulo. Además, un pequeño grupo de los pacientes experimenta una transformación delirante de las obsesiones (Fenton 1986). Se ha reportado que los pacientes con TOC y pobre insight presentan alteraciones neuropsicológicas similares a las observadas en pacientes con esquizofrenia (Kitis 2007), incluyendo alteraciones en las funciones ejecutivas que normalmente no se ven afectadas en el TOC con buen insight (Tumkaya 2009).
Etiopatogenia del fenómeno esquizo-TOC
Se han propuesto tres hipótesis para explicar la coexistencia de síntomas obsesivo-compulsivos y psicóticos, una de ellas explica el fenómeno en términos de comorbilidad entre el TOC y la esquizofrenia, otra propone que estos pacientes constituyen subgrupos de esquizofrenia, y la tercera hipótesis plantea que esta coexistencia de síntomas podría constituir una nueva entidad clínica (Hwang 2009).
A través de estudios de neuroimagen se ha reportado que varias estructuras podrían estar involucradas tanto en la esquizofrenia como en el TOC, incluyendo los ganglios basales, el tálamo, el cíngulo y la corteza prefrontal , siendo la disfunción de esta última la que parece estar más fuertemente ligada al desarrollo de ambos trastornos (Tumkaya 2009, Adler 2000, Carvallaro 2003, Tibbo 1999, Whitney 2004).
Se ha propuesto un circuito funcional en el TOC que nace de la corteza orbitofrontal, se proyecta al área ventro-medial del núcleo caudado, pasa al globo pálido y de ahí al área mediodorsal y ventral anterior del tálamo antes de regresar a la corteza (Cummings 1993). Mientras que en la esquizofrenia el circuito funcional propuesto nace de la corteza prefrontal dorsolateral, se proyecta al área dorsolateral del núcleo caudado, pasa al globo pálido y de ahí al área mediodorsal y ventral anterior del tálamo antes de regresar a la corteza prefrontal dorsolateral, aunque también existe evidencia de anormalidades orbitofrontales (Hadi 2012, Cummings 1993, Gross 2003). Tomando en cuenta estos circuitos, se ha sugerido con base en estudios de imagen, que en ambas patologías existe una disfunción en los circuitos que conectan la corteza prefrontal con los ganglios basales, así como en el papel de filtraje de la información del tálamo (Hadi 2012, Carvallaro 2003, Whitney 2004).
En cuanto a los neurotransmisores involucrados, se ha implicado principalmente a los sistemas serotoninérgicos y dopaminérgicos tanto en el TOC como en la esquizofrenia. El papel de estos neurotransmisores está sustentado en la respuesta farmacológica a los antipsicóticos, cuyo principal mecanismo de acción es el bloqueo de receptores D2, en la esquizofrenia y como estrategia farmacológica en el TOC, y la respuesta a los ISRS en el TOC y el efecto sobre receptores 5HT2A de los antipsicóticos atípicos (Tibbo 1999, Kapur 1996). Asimismo, se ha sugerido que las compulsiones son resultado de una sobreactividad dopaminérgica a nivel de los ganglios basales (Hadi 2012).
Efectos de los síntomas obsesivo-compulsivos en la esquizofrenia
Anteriormente, desde un enfoque psicoanalítico, se creía que las obsesiones y compulsiones protegían a los pacientes con esquizofrenia de la "desintegración de la personalidad" (Rosen 1957). Incluso se llegó a considerar que las obsesiones y compulsiones eran defensas ante la descompensación psicótica, y por lo tanto eran un indicador de buen pronóstico (Poyurovsky 1999). Sin embargo, la evidencia actual es que los pacientes con esquizofrenia con síntomas obsesivo-compulsivos se encuentran clínicamente más perturbados, socialmente más aislados y con mayor resistencia terapéutica (Fenton 1986, Berman 1998). Y aunque generalmente limitados por el diseño transversal y lo pequeño de las muestras, estos estudios son consistentes en demostrar que los pacientes con esquizofrenia con síntomas obsesivo-compulsivos tienen un pobre pronóstico, consiguen trabajo con más dificultad y tienen mayor disfunción social (Poyurovsky 2004, Berman 1995, Fenton 1986). Por si fuera poco, los pacientes con esquizofrenia y síntomas obsesivo-compulsivos tienen un peor desempeño en las pruebas de función ejecutiva, memoria visual y en la habilidad para cambiar de una tarea cognoscitiva a otra cuando se comparan con quienes padecen esquizofrenia sin síntomas del espectro OC (Tumkaya 2009, Berman 1998). Cabe mencionar que hay reportes contradictorios al respecto en donde los pacientes con esquizofrenia y TOC parecen tener menos alteraciones neuropsicológicas que los pacientes con esquizofrenia sin TOC (Lee 2009). Una posible explicación es que la presencia de obsesiones y compulsiones puede tener un papel protector en las primeras etapas de la esquizofrenia, mientras que en la esquizofrenia crónica tienen un efecto deletéreo (Bottas 2005).
Tratamiento de síntomas obsesivos en pacientes con esquizofrenia
En relación al tratamiento del trastorno esquizo-TOC, la información encontrada en la literatura es escasa y basada por lo general en reportes de casos. No obstante, existe consenso en que el manejo de los pacientes con esquizo-TOC es difícil y requiere de una aproximación distinta a la de la esquizofrenia sin TOC. Los antipsicóticos convencionales son por lo general inefectivos en estos pacientes, presumiblemente debido a su escasa actividad serotoninérgica. Agregar agentes antiobsesivos parece ser eficaz para controlar estos síntomas. El hecho de que una proporción substancial de pacientes con esquizofrenia y síntomas obsesivo-compulsivos no responden a los inhibidores selectivos de serotonina, sugiere que estos síntomas puede ser resultado de un estado patofisiológico diferente a lo hasta ahora conocido en pacientes puramente TOC. El papel de los antipsicóticos atípicos también es controversial con reportes iniciales que indican que la clozapina, olanzapina y risperidona pueden inducir de novo o agravar algunos síntomas obsesivo-compulsivos en los pacientes con esquizofrenia (Alevizos 2002) [C3], (Baker 1992) [C3], (Englisch 2010) [C3], (Glick 2008) [C3].
Hay evidencia de que los fármacos usados en el TOC (clomipramina, fluvoxamina, fluoxetina) pueden ser eficaces también para tratar las obsesiones y compulsiones en pacientes con esquizofrenia (Poyurovsky 1999) [C2], (Eisen 1997) [C2], (Hadi 2012) [B3], (Berman 1995) [B3], (Hwang 2009) [B3], (Glick 2008) [C3]. Se ha reportado también que el uso o cambio a amisulprida, junto con el ISRS, ha sido de utilidad en casos de TOC refractario en esquizofrenia, una explicación a este efecto positivo de la amisulprida es que, en comparación con otros antipsicóticos, su antagonismo sobre 5HT2A es mínimo (Kim 2008) [B2].
Finalmente, existen reportes de caso (Chávez 2005 [C3], Lavin 1996) [C3] sobre el uso exitoso de terapia electroconvulsiva (TEC) en pacientes con refractariedad al tratamiento farmacológico. La experiencia con cirugía estereotáxica para pacientes con esquizo-TOC, es escasa.
En resumen, una vez descartado que el antipsicótico no está exacerbando o provocando la aparición de los síntomas obsesivo-compulsivos, la primera estrategia será el inicio de un ISRS o clomipramina, a las dosis que se usa en el TOC. Si el primer medicamento antiobsesivo falla, se sugiere el cambio a otro ISRS (o clomipramina). Si no hay respuesta se puede intentar cambiar el antipsicótico a uno típico o amisulprida. La TEC puede considerarse si las estrategias mencionadas han fallado.
Conclusión
La coexistencia de esquizofrenia y síntomas OC constituye un fenómeno clínico heterogéneo en su forma clínica y abordaje terapéutico, enfrentándonos a posibilidades de comorbilidad clínica o coexistencia sintomática. Representa un reto de vital importancia desde el punto de vista diagnóstico y terapéutico, pero quizás el reto más apasionante y trascendente para su comprensión está en el entramado psicopatológico y los factores neurobiológicos subyacentes, objetivos de los siguientes estudios, basados en la utilización de definiciones psicopatológicamente precisas, evaluaciones clínicas prospectivas y sistemáticas, y desde luego, abordajes que permitan evaluar estructuras y funciones cerebrales.
PATOLOGÍA DUAL (ADICCIONES)
El estudio del Diagnóstico Dual ha permitido evidenciar la asociación entre la comorbilidad de la psicopatología y el consumo de sustancias psicoactivas, así como una más amplia comprensión de las bases comunes etiopatogénicas entre ambas entidades nosológicas.
La tendencia mundial actual de la incorporación de los enfermos mentales graves a la comunidad, ha incrementado el número de usuarios de sustancias en la población general. Se estima que en los pacientes con esquizofrenia, el riesgo de presentar un trastorno por uso de sustancias a lo largo de la vida es 4.6 veces mayor que el de la población general, con una probabilidad de 3.6 veces para el alcohol, 5 veces para cannabis, 6.5 veces para el consumo de opiáceos, y 13 veces para cocaína. Las sustancias más consumidas son la nicotina (70-90%), el alcohol y el cannabis, seguidas por la cocaína en Estados Unidos, y las anfetaminas en Australia, observándose en los últimos años un aumento en la utilización de sustancias por vía intravenosa en los pacientes con esquizofrenia. La probabilidad de que un paciente con esquizofrenia presente un trastorno por uso de sustancias se asocia con los mismos factores que en la población general: adultos jóvenes, sexo masculino, desempleo, bajo nivel educativo, historia de personalidad A principalmente, trastornos de conducta y problemas familiares.
Diagnóstico dual
Las hipótesis más sólidas desde la perspectiva neurobiológica de la asociación de esquizofrenia y trastorno por uso de sustancias son dos: la hipótesis de la automedicación y una segunda, en la que el consumo de sustancias sería la causa o un factor predisponente o detonante para la aparición de psicosis.
Hasta hace relativamente poco tiempo, las razones sobre el incremento del uso de sustancias en pacientes con esquizofrenia se basaban en la hipótesis de la automedicación. Si bien la mayoría de los usuarios no utiliza las sustancias para aliviar los síntomas positivos, sí lo hacen para tratar de mitigar los síntomas negativos, los problemas de sueño, la disforia y otros efectos adversos de los antipsicóticos, incluyendo los efectos extrapiramidales. Así pues, la preferencia por psicoestimulantes que potencian los mecanismos dopaminérgicos puede deberse a un intento de disminuir los efectos sedantes y extrapiramidales de los fármacos antipsicóticos. La segunda teoría postula que la sustancia es la causa o factor predisponente de la psicosis. En este caso pueden presentarse tres situaciones:
a) pacientes con carga genética predisponente, que en presencia de la sustancia se manifestaría fenotípicamente como una psicosis
b) pacientes sin carga genética predisponente, en los que las sustancias per se podrían inducir psicosis
c) personas vulnerables que sometidas a una o varias sustancias repetidamente, pueden desarrollar una psicosis por un fenómeno de sensibilización progresiva.
El consumo de alucinógenos y psicoestimulantes como factores predisponentes de la psicosis está cada vez más documentado, sin embargo, el consumo de cannabis como factor de riesgo para la esquizofrenia es aún motivo de controversia, pero no como factor de riesgo para presentar el primer episodio psicótico. Sin embargo, está aceptada la relación entre el consumo de cannabis, la psicosis y la depresión (cuadro 5), pudiendo el consumo de cannabis precipitar cuadros psicóticos agudos e incrementar el riesgo de esquizofrenia crónica en personas vulnerables, exacerbando por lo general, los síntomas. Si bien algunos estudios muestran que el uso de cannabis durante la adolescencia incrementa el riesgo de padecer esquizofrenia, es difícil establecer una causalidad directa del cannabis con la esquizofrenia.

La baja incidencia de la esquizofrenia, el hecho de que la mayoría de los pacientes adictos consuman otras sustancias además de cannabis, y que los síntomas prodrómicos podrían ser previos al consumo de cannabis, crean problemas metodológicos y explican la ausencia de evidencias claras. Además, si bien algunos autores han observado mayor utilización de cannabis en pacientes con menos síntomas negativos, especialmente en menores de 35 años, la menor gravedad de los pacientes con esquizofrenia con trastorno por uso de sustancias es controvertida.
El estudio CATIE (Lieberman 2005) que incluyó una población de 1,432 pacientes diagnosticados con esquizofrenia crónica, encontró que al menos el 60% de la muestra presentaba abuso de al menos de una sustancia, y de éstos, un 37% cumplía criterios de dependencia a alguna sustancia ilegal o al alcohol. El tipo de población resultó ser predominantemente masculina, jóvenes, solteros en situación de calle, de etnia afroamericana, con bajo nivel educativo, problemas durante la infancia, además de una alta asociación con síntomas afectivos de tipo depresivo y antecedentes de exacerbación de síntomas psicóticos, predominantemente síntomas positivos de la enfermedad. Otros estudios estiman la comorbilidad entre esquizofrenia y uso patológico de sustancias entre un 45 y 70% de acuerdo a la muestra estudiada. Se estima que quienes padecen esta enfermedad presentan un riesgo relativo mayor de desarrollar abuso o dependencia a alcohol del 3.3 y, sobre todo, un riesgo relativo de 6.2 de presentar abuso o dependencia a cualquier otra sustancia. Asimismo, ha sido reportado que el porcentaje de abuso de alcohol en pacientes con esquizofrenia varía del 12 al 50% a lo largo de la vida; de igual forma el porcentaje de abuso o dependencia estimado para cannabis se estima entre el 12 y 35%; el consumo de estimulantes oscila entre el 11 y 31%, mientras que para alucinógenos se encuentra entre el 5 y 15%; así como entre 3 y 11% lo hace en relación a sedantes del tipo benzodiacepínico.
En un estudio realizado en Australia (Buchanan 2002), se encontró que los pacientes con esquizofrenia que consumían alguna sustancia presentaban tasas de suicido más elevadas que los que no consumían, así como un comportamiento agresivo, con una mayor tasa de recaídas y una mayor severidad de síntomas psicóticos y un incremento en la frecuencia de disquinesia tardía con aumentada resistencia a neurolépticos. Igualmente, reportaron que aquellos que abusan de alcohol son pacientes mas disruptivos y desinhibidos, pero no necesariamente mas psicóticos que el resto, y hallaron que entre la población estudiada de pacientes con esquizofrenia quienes consumían cannabis se presentaban síntomas psicóticos más severos con un incremento en el número de hospitalizaciones, y un aumento en la presencia de disquinesia tardía. Por otra parte, en aquellos que consumían cocaína, se presentaban más síntomas depresivos.
En términos generales, la asociación de esquizofrenia con el uso de sustancias, tiene implicaciones negativas en cuanto a los síntomas, mostrando un incremento importante en la presentación de síntomas psicóticos, mala adherencia a tratamiento farmacológico y un aumento en la frecuencia y duración de hospitalizaciones requeridas, intentos suicidas, comportamiento impulsivo y violento, desempleo, además de presentar mayores y más severos problemas legales y de salud. Igualmente, entre quienes padecen patología dual se presentan con mayor frecuencia síntomas neurológicos y psiquiátricos en comparación con pacientes con esquizofrenia no consumidores.
Se sabe que pacientes duales presentan con mayor frecuencia parkinsonismo por uso de antipsicóticos; igualmente, una vez que la acatisia se presenta es mucho más fácil de manejar en quienes no presentan un consumo de sustancias comórbido. Lo anterior se puede explicar debido a que el consumo de cocaína y anfetaminas estimulan directamente la neurotransmisión dopaminérgica mediante bloqueo y revirtiendo el transporte dopaminérgico. Dentro de las manifestaciones psiquiátricas, mediante la utilización de la escala de PANSS, los pacientes con diagnóstico dual presentan resultados más elevados, particularmente de síntomas negativos comparados con pacientes con esquizofrenia no consumidores. Además, pacientes con diagnóstico dual presentan mayores índices de depresión que quienes no consumen sustancias ilegales en una proporción cercana al 2:1. Entre quienes presentaron mayor predominio de síntomas positivos, la respuesta al tratamiento farmacológico fue mucho mejor entre quienes no presentan abuso comórbido de sustancias (Buchanan 2002). Además, se tiene reporte de mayores problemas sociales y de adaptación que incluyen problemas legales, inestabilidad familiar y dificultad en el manejo de los recursos económicos, resumiendo que la severidad del abuso de sustancias es un factor predictor con un pronóstico desfavorable (cuadro 6).

Ha sido reportado un peor funcionamiento cognitivo durante la intoxicación y la exacerbación de la impulsividad, parecen coincidir con el incremento de riesgo de accidentes, victimización, agresiones y enfermedades de transmisión sexual, incluyendo el VIH. Asimismo, los trastornos por uso de sustancias explican la mayoría de las diferencias observadas en actos violentos, tasas de problemática legal y encarcelamientos entre las personas con esquizofrenia y aquellas sin psicosis. Los individuos con esquizofrenia con trastorno por uso de sustancias se benefician menos del tratamiento y presentan menor tasa de remisión, mayor número de ingresos hospitalarios, peor historia laboral, mayor inestabilidad en sus patrones de vida y de vivienda, mayor necesidad de ayudas de bienestar social y mayor frecuencia de atención en los servicios de urgencia. Las familias de estos pacientes soportan mayor carga económica y emocional, y las relaciones familiares pueden llegar a desaparecer. Todo esto ocurre en el contexto de un menor cumplimiento del tratamiento y de las consultas programadas, así como menor vinculación con los recursos de salud mental comunitarios.
El uso de sustancias con fines recreativos interacciona con los antipsicóticos y potencia los efectos adversos y el incumplimiento terapéutico. Así, el alcohol incrementa la sedación de los antipsicóticos y algunos pacientes interrumpen por ello la medicación. Se ha descrito también un incremento del riesgo de disquinesia tardía en los pacientes consumidores de cannabis o alcohol. La nicotina disminuye las concentraciones séricas de algunos antipsicóticos (haloperidol, clorpromazina, flufenazina, tiotixeno, olanzapina, clozapina) hasta en un 50%, debiendo incrementar la dosis en fumadores para que sea efectiva, así como ajustar las dosis ante la supresión o disminución del hábito tabáquico. Sin embargo, si bien el consumo de nicotina puede reducir los efectos extrapiramidales de los antipsicóticos a corto plazo, la interrupción o reducción del consumo de nicotina puede producir un aumento de los efectos extrapiramidales por dos mecanismos: a) mayor dosis efectiva del fármaco y b) reducción de la actividad dopaminérgica. La nicotina podría mejorar el rendimiento cognitivo, incluyendo la atención selectiva, la habituación a estímulos repetidos y los déficits de memoria inducidos por el haloperidol, así como los efectos extrapiramidales. Existen estudios que comentan que a menudo los pacientes con uso concomitante de sustancias muestran igual o mejor ajuste premórbido y mayor número de contactos sociales que aquellos con únicamente esquizofrenia.
Abordaje
En el manejo de los pacientes con esquizofrenia con trastorno por uso de sustancias debemos seguir los principios generales del tratamiento de pacientes con diagnóstico dual. Los pacientes con esquizofrenia pueden utilizar sustancias de forma recreativa como la mayoría de la población, y aun sabiendo que pequeños consumos de sustancias pueden ser problemáticos para algunos individuos, a menudo se requiere ser flexible en los objetivos del tratamiento. Es necesario tomar como objetivo prioritario aquellas sustancias que puedan desestabilizar al paciente y ser motivo de exacerbaciones clínicas o de abandonos de tratamiento.
Se ha observado que las intervenciones tendentes al incremento motivacional son efectivas para ayudar a los pacientes en el control del consumo de sustancias. Se estimula y refuerza a los pacientes para que examinen los costos y beneficios del abuso de sustancias, y para que modifiquen sus creencias erróneas sobre los efectos de las sustancias. Los episodios psicóticos agudos inducidos por sustancias dan la oportunidad al clínico y al paciente de evidenciar el impacto del uso de la sustancia y valorar conjuntamente los costos, riesgos y beneficios. La esquizofrenia y el abuso de sustancias son interdependientes, por lo que los métodos de tratamiento en paralelo o secuenciales no son tan efectivos como el tratamiento integrado, entendido como el abordaje terapéutico de ambos trastornos realizado por el mismo equipo, de ahí la relevancia de la Adictología Psiquiátrica. Sin embargo, esto no es posible en muchas ocasiones por la dicotomía establecida en los sistemas de salud, entre los dispositivos de salud mental y los de abuso de sustancias, además por la baja disponibilidad de personal especializado en esta área conjunta.
Intervenciones farmacológicas generales
El tratamiento farmacológico es, en general, similar al que se realiza en los pacientes con esquizofrenia sin trastorno por uso de sustancias. Se deben tener en cuenta una serie de consideraciones, como son la alta sensibilidad a los antipsicóticos que presentan estos pacientes, las interacciones farmacológicas entre los antipsicóticos y las sustancias de abuso, y por último, las altas tasas de incumplimiento terapéutico. El objetivo inicial del tratamiento de los pacientes agudos en régimen de hospitalización es el manejo de la hostilidad y la agitación, así como la rápida estabilización de los síntomas psicóticos, sin perder de vista objetivos a largo plazo, como intentar minimizar los efectos adversos, asegurar en lo posible el cumplimiento terapéutico al alta y mejorar la calidad de vida a través de la intervención bajo el concepto del diagnóstico dual.
Antipsicóticos atípicos
Dada la dificultad de tratamiento de los pacientes con esquizofrenia con trastorno por uso de sustancias y su consideración como esquizofrenias resistentes, los antipsicóticos atípicos han sido los fármacos más evaluados en estos pacientes. La clozapina ha sido ampliamente estudiada y muestra gran eficacia clínica y aproximadamente la misma efectividad en pacientes psicóticos resistentes con y sin trastorno por uso de sustancias. Sin embargo, el riesgo de agranulocitosis y la obligación de un control hemático semanal durante las primeras 18 semanas hace que los clínicos inicien el tratamiento agudo con otros antipsicóticos atípicos como la risperidona o la olanzapina.
Existen cada vez más evidencias del impacto positivo de los antipsicóticos atípicos en la reducción del consumo de alcohol, cocaína y opiáceos. Los principales estudios se enumeran en el cuadro 7. Estos estudios muestran que a pesar de la escasez de estudios controlados, cada vez existen más datos que evidencian que los pacientes psicóticos con trastorno por uso de sustancias obtienen mejores resultados en el uso de éstas cuando reciben los nuevos antipsicóticos.
Para una correcta dosificación, seguiremos las Recomendaciones Terapéuticas en los Trastornos Mentales (RTM-II) y en Diagnóstico Dual. Las pautas de dosificación de los episodios psicóticos agudos y del trastorno por uso de sustancias se describen en el cuadro 8.

Intervenciones farmacológicas específicas de los trastornos por uso de sustancias
Dependencia a la nicotina
La tasa de tabaquismo en la esquizofrenia es mayor en pacientes crónicos hospitalizados y se asocia a un mayor grado de psicopatología.
A pesar de no existir demasiados estudios de tratamiento en sujetos con esquizofrenia dependientes de nicotina, algunos datos sugieren que la utilización combinada de sustitutivos de nicotina a dosis altas podría ser eficaz y segura en la deshabituación tabáquica en pacientes con psicosis crónicas. También se puede emplear de forma segura el Bupropion.
Existen datos controversiales sobre el uso del Vareniclina, por el riesgo de exacerbar la sintomatología psicótica en el paciente.
Estas dosis sugeridas son solamente orientadoras, y en algunos casos pueden aumentarse según las necesidades del paciente. Lo anterior no excluye el uso de antipsicóticos típicos, lo cual dependerá de cada caso en particular. Se recomienda el tratamiento farmacológico hasta que desaparezcan los síntomas psicóticos.
Por consenso mundial, se recomienda un mínimo de tres a seis meses de empleo de los antipsicóticos, debiendo particularizar el caso en la situación de necesidad de ameritar ampliar el tiempo de manejo. En los pacientes con escasa mejoría se puede intentar la administración de dosis de clozapina de 300-450 mg/día. Sin embargo, estos fármacos no están exentos de efectos adversos (cuadro 9).

El riesgo de agranulocitosis con el tratamiento por clozapina requiere la monitorización regular. La clozapina también se ha asociado en algunos casos con miocardiopatía y miocarditis fatal, por lo que es conveniente monitorizar a los pacientes.
Antipsicóticos típicos
Estos fármacos están siendo relegados por los antipsicóticos atípicos en los pacientes con diagnóstico dual, principalmente por el aumento de los efectos extrapiramidales, la escasa eficacia y la menor capacidad de retención. Los pocos estudios realizados con haloperidol, flufenazina y perfenazina no aportan datos sobre la disminución del consumo de sustancias de abuso en pacientes con esquizofrenia, a excepción de un estudio realizado con flupentixol, que refiere una disminución del consumo de cocaína. También se ha descrito en pacientes consumidores de cocaína la necesidad de mayores dosis de antipsicóticos clásicos, observándose mayor riesgo de disquinesia tardía. En tratamientos a largo plazo, estos fármacos parecen incrementar el efecto reforzador de la cocaína. Por estas razones, si bien se trataría de una segunda opción de tratamiento, en los episodios agudos se recomienda principalmente haloperidol, perfenazina y zuclopentixol (cuadro 10). Si por excesiva agitación o imposibilidad de utilizar la vía oral es necesario usar la vía intramuscular, se recomienda la mitad de la dosis por vía oral y se administra cada 6-8 horas.

Diversos estudios sugieren que el uso de bupropión en pacientes con esquizofrenia puede ser beneficioso para reducir el hábito tabáquico. Ahora bien, el bupropión se ha relacionado con la aparición de convulsiones y psicosis en tasas mayores que otros antidepresivos, pudiendo también inducir psicosis. El riesgo de convulsiones es dependiente de la dosis, estando aumentado por factores predisponentes (historia de convulsiones previas, trastornos de la conducta alimentaria, dependencia de alcohol, diabetes mellitus inestable, traumatismo craneoencefálico, tumores del sistema nervioso central). En aquellos pacientes con historia de psicosis o manía se requiere una monitorización más estrecha, por lo que algunos autores recomiendan reducir la dosis a 150 mg/día. Con adecuado control puede ser una buena opción farmacológica (Bond 2001).
Dependencia al alcohol
No existen estudios controlados de acamprosato en la dependencia de alcohol en pacientes con esquizofrenia, y la naltrexona todavía no ha mostrado mayor efectividad en el tratamiento del abuso de alcohol en pacientes con esquizofrenia. Por otra parte, aunque el disulfiram es un fármaco clásico para el tratamiento de la dependencia de alcohol, existen sólo evidencias moderadas de su beneficio.
Estudios de casos muestran que el disulfiram puede ser de utilidad en pacientes con esquizofrenia y dependencia de alcohol sin un incremento de los síntomas positivos. Las indicaciones para el uso del disulfiram en pacientes con esquizofrenia son similares a su uso en pacientes con dependencia a alcohol. Los pacientes requieren firmar un consentimiento informado para la utilización de este fármaco, presentar suficiente motivación y no presentar trastornos orgánicos cerebrales ni cardíacos que puedan exacerbarse por la reacción alcohol-disulfiram, e idealmente debería de ser prescrito bajo supervisión. Algunos estudios muestran que el disulfiram a dosis elevadas (1 mg/ día) podría exacerbar o desencadenar síntomas psicóticos debido a la mayor acumulación de dopamina, por la capacidad del disulfiram de inhibir la dopamina beta-hidroxilasa. Sin embargo, dosis de 250 mg/día no parecen inducir complicaciones significativas en pacientes con dependencia a alcohol y trastornos psicóticos (Pilling 2002).
Dependencia a los opiáceos
No existen estudios controlados sobre el uso de metadona en pacientes con psicosis y dependencia a opiáceos. Sin embargo, existe un gran número de pacientes con esquizofrenia en tratamiento de mantenimiento con metadona que presentan los mismos efectos adversos que los pacientes sin esquizofrenia. En la actualidad, algunos autores indican programas de metadona para el tratamiento de primera elección en pacientes dependientes de opiáceos con psicosis, principalmente por su mayor capacidad de retención y el efecto antipsicótico del clorhidrato de metadona, con disminución de la agresividad y de la ideación paranoide. En general, la dosis inicial de metadona no debe exceder los 20 mg/día, incrementándose 5 mg/día, con una dosis máxima al final de la primera semana de 50 mg/día. La dosis máxima varía con los diversos autores entre 60 y 120 mg/día, mientras que otros recomiendan dosis superiores a 200 mg/día. La naltrexona no parece empeorar la sintomatología psicótica, pudiendo ser de utilidad moderada (Pilling 2002). Si hay que realizar una desintoxicación de opiáceos en pacientes con esquizofrenia, es preferible utilizar antipsicóticos y benzodiacepinas antes que los fármacos agonistas dopaminérgicos, dada la posibilidad de que aumente la inquietud y se induzcan recidivas psicóticas al retirar estos últimos.
Dependencia a los psicoestimulantes
Si bien no existen estudios controlados para el tratamiento de la dependencia de anfetaminas o cocaína en pacientes con esquizofrenia, estudios de casos sugieren que la olanzapina y la risperidona pueden ser eficaces en la disminución del consumo de estas sustancias en dichos pacientes. De igual forma, algunos autores han relacionado a los antipsicóticos atípicos con una disminución del número de recaídas y de la apetencia por el consumo (craving) en pacientes con esquizofrenia y dependencia de cocaína (Turkington 2002). Asimismo, se ha descrito que los pacientes psicóticos consumidores de cocaína requieren mayores dosis de antipsicóticos y, a menudo, anticolinérgicos.
Intervenciones psicosociales
El abordaje del Diagnóstico Dual a través de intervenciones psicosociales específicas, es reciente. Dichas intervenciones deberían incluir los siguientes objetivos: a) establecimiento y mantenimiento de la alianza terapéutica; b) vigilancia del estado clínico del paciente; c) tratamiento de los estados de intoxicación y abstinencia; d) desarrollo y facilitación del cumplimiento de un programa terapéutico individualizado; e) prevención de las recaídas; f) educación sanitaria individual y familiar; g) reducción de la comorbilidad y de las secuelas del consumo; h) integración de las intervenciones realizadas con la coordinación de profesionales de otras disciplinas, organizaciones no gubernamentales, etc. Según diversos autores (Sellwood 2001), los tratamientos psicológicos en pacientes con esquizofrenia deberían valorarse de acuerdo con las necesidades del paciente, diferenciando al menos tres grupos: los pacientes con problemas leves relacionados con sustancias que se beneficiarían de breves intervenciones motivacionales, aquellos que se beneficiarían de intervenciones más amplias con entrenamiento en habilidades y soporte social, y un tercer grupo con graves déficits cognitivos que requerirán un entorno estructurado continuo y soporte social por un período indefinido.
El abordaje terapéutico de estos pacientes debe realizarse mediante las técnicas específicas utilizadas en el tratamiento de las adicciones (terapias cognitivo/conductuales, prevención de recaídas, entrevistas motivacionales, grupos de ayuda mutua, intervenciones familiares, resolución de conflictos, modificaciones del estilo de vida, estrategias de refuerzo comunitario, estrategias de asertividad), modificadas específicamente para pacientes con psicosis. Además de lo anterior, deben incluirse intervenciones psicosociales dirigidas a mejorar las relaciones interpersonales, las habilidades sociales y la adaptación familiar y laboral si es posible. Dichos programas han de ser flexibles tanto en sus objetivos como en su duración, siendo desaconsejables grandes cambios de vida y fomentando principalmente la alianza terapéutica (Lieberman 2003).
Los grupos de ayuda mutua -basados en los 12 pasos-, principalmente utilizados escasamente en pacientes comórbidos, tienen una efectividad limitada porque no ofrecen una aproximación integrada de estos trastornos, presentan objetivos inflexibles y, en ocasiones, son contrarios a la administración de pautas farmacológicas. Estos pacientes pueden sentirse incómodos, con sentimientos de ser vigilados, diferentes y fuera de lugar en grupos de personas sin psicosis. Su inquietud y, a veces, la imposibilidad de permanecer sentados largo tiempo dificultan su permanencia en reuniones largas. La mayoría no se identifica con las pérdidas sociales (pareja, trabajo o propiedades) de otros miembros del grupo. Cabe señalar que el modelo de ayuda mutua muestra efectividad en otros casos, aun de patología dual (trastornos de personalidad, sobre todo). A la inversa, cuando estos grupos son realizados entre pares y la vivencia de enfermedad mental es parte del trabajo grupal, se observan beneficios. Estudios muestran la efectividad de asociar al tratamiento de rutina (manejo clínico por el equipo de tratamiento, incluyendo mantenimiento con antipsicóticos, seguimiento ambulatorio y acceso a las actividades de rehabilitación comunitaria) un programa integrado por entrevistas motivacionales, terapia cognitivo/ conductual e intervenciones familiares, observándose que el porcentaje de días de no consumo fue superior en el grupo de tratamiento intensivo integrado que en el de rutina. Concretamente, los pacientes psicóticos con trastorno por uso de sustancias responden mejor en un programa integrado que ofrezca en el mismo servicio terapias para ambos trastornos.
Los elementos esenciales de un programa de terapia integrado son: continuidad de cuidados, tratamiento de la adicción (incluyendo farmacoterapia especializada), psicoterapia que tenga en cuenta la comorbilidad, vivienda segura con supervisión y rehabilitación ocupacional y laboral (Olfson 2003). Todo ello repercutirá en una mayor participación y apego al tratamiento, menor uso de alcohol y otras sustancias, alojamientos más estables y mayores niveles de funcionamiento y calidad de vida.
En este apartado se han expuesto sólo algunas generalidades que tratan sobre la implícita complejidad que entraña el manejo de este tipo de pacientes, y se espera generar interés para ahondar en el conocimiento del diagnóstico dual.
POBLACIONES ESPECIALES
Ancianos
Tradicionalmente se ha considerado a la esquizofrenia y otros trastornos psicóticos como un problema propio del comienzo de la edad adulta, y se le ha dado poca o escasa atención a los trastornos psicóticos del anciano (Jeste 1991). Por otra parte, se ha visto un incremento en la longevidad de los pacientes con esquizofrenia, poniendo de relieve los problemas clínicos, asistenciales y terapéuticos de estos trastornos. En el plano terapéutico, la eficacia de los fármacos antipsicóticos está plenamente aceptada; sin embargo, su empleo en ancianos expone a riesgos iatrogénicos notables, entre ellos, la disquinesia tardía. Es importante resaltar que la FDA en los Estados Unidos ha lanzado advertencias sobre los riesgos metabólicos, cardiacos, cerebrovasculares, y la mortalidad asociados al uso de antipsicóticos atípicos en esta población (Karim 2005) [B3]. En lo asistencial, la discapacidad atribuible a los trastornos psicóticos en el anciano, se potencia si coincide con otras causas de incapacidad, como enfermedades neurológicas y/o cardiopatías, y ante la falta de una red social de apoyo, con frecuencia se da la reclusión institucional del paciente, generando ésta problemas por sí misma, como el aumento en costos sociales y el tratamiento psiquiátrico obligado en instituciones y residencias.
La esquizofrenia en los ancianos se encuentra entre los trastornos cuyo tratamiento resulta más caro si se consideran los costos totales por persona. Además, siendo una patología discapacitante en cualquier edad, importa explorar el papel que tiene en el adulto mayor, tanto en su inicio tardío, como las consecuencias médicas, cognoscitivas y sociales de su inicio temprano.
Esquizofrenia de inicio tardío
"Esquizofrenia de Inicio Tardío" fue un término acuñado por Manfred Bleuler en 1943 para describir una forma de esquizofrenia iniciada entre los 40 y 60 años de edad (Riecher 1995).
A pesar de la aceptación histórica de este concepto, las dos escuelas psiquiátricas de mayor influencia en la clínica actual (británica y americana), tienen una postura ambivalente atribuida sobre todo a factores como la rareza del trastorno, la mala definición conceptual o simples diferencias en sus términos. Krassoievitch (Krassoievitch 2004) refiere que el término tardío es impreciso, ya que un trastorno que empieza a los 40 años es tardío, y otro de inicio a los 60 es muy tardío. Este autor continúa mencionando que el límite de edad es totalmente arbitrario para tipificar un padecimiento, cualquiera que sea éste. Aunque también reconoce que los efectos patoplásticos relacionados con la situación existencial en el ámbito psicológico, biológico y social en esta época histórica difieren considerablemente entre la edad madura y la vejez.
Los escasos estudios epidemiológicos sobre la esquizofrenia en el anciano (o de inicio tardío), reportan prevalencias del 0.2 al 0.6%, lo que contrasta con cifras en torno al 1% de los sujetos más jóvenes (Keith 1991).
Los datos de estos estudios se muestran en el cuadro 11. El estudio epidemiológico Catchments Area (ECA) ha sido criticado, porque la muestra poblacional no es representativa, ya que se excluyeron los lugares donde este tipo de enfermos tienden a concentrarse (Karim 2005).
Estudios sobre la edad de aparición de la esquizofrenia revelan que, aunque la mayoría de los casos tienen un inicio precoz (menos de 45 años), hay un porcentaje alrededor del 12% que presentan síntomas psicóticos de un comienzo tardío. De esta manera, aunque se trata de una patología rara, el problema planteado por esta enfermedad es importante en cifras absolutas, dadas las tendencias demográficas mundiales (Keith 1991).
Debido a que la mayoría de los sujetos con esquizofrenia de inicio tardío cumplen los criterios diagnósticos del DSM-IV-TR para ésta, no puede hablarse propiamente de tipos clínicos diferentes. Sin embargo, la esquizofrenia de inicio tardío tiene rasgos que las distinguen de la de inicio temprano, por ejemplo: predomina en el sexo femenino, con frecuencia exhibe ideas delirantes paranoides y persecutorias, la frecuencia del trastorno formal del pensamiento es menor o hay menos síntomas negativos (aislamiento social y aplanamiento emocional), está caracterizada por una mejor adaptación premórbida y tienen mejor rendimiento neuropsicológico (sobre todo en aprendizaje y en abstracción/flexibilidad cognoscitivas). Se han hallado también diferencias en algunas de las estructuras cerebrales (mayor tamaño del tálamo en comparación con los de inicio en edades tempranas), o en los efectos terapéuticos (respuesta con dosis menores de antipsicóticos) en los casos de inicio tardío (Kulhara 1999).
En el año 2000, un grupo internacional de consenso propuso dividir las psicosis no afectivas ni orgánicas del anciano en dos categorías diagnósticas según la edad de comienzo: esquizofrenia de inicio a edades intermedias (posterior a los 44 años) y psicosis pseudoesquizofrénica de inicio muy tardío (posterior a los 60 años) (Howard 2000).
Las causas de la esquizofrenia tardía no son claras. Una mayor frecuencia de esquizofrenia en familias de primer grado, apunta hacia factores genéticos comunes a las formas precoces y tardías, aunque existe una carga genética menor en las tardías. Éstas pueden consistir en un subtipo neurobiológico de esquizofrenia.
Muchos autores destacan la importancia de la afectación sensorial como factor asociado al desarrollo de la esquizofrenia tardía. Se encuentra un déficit auditivo hasta en un 30% de los casos, seguido de déficit visual. Otros investigadores han destacado la importancia de factores como la personalidad premórbida de tipo paranoide o esquizoide (Vahia 2010).
La esquizofrenia tardía suele ser crónica, pero sin el deterioro característico de la esquizofrenia precoz. A pesar de que algunos estudios señalan cierta progresión de la esquizofrenia hacia un síndrome demencial, es probable que dichos estudios hayan incluido muestras de sujetos con síntomas psicóticos correspondientes a demencias incipientes (Vahia 2010).
Consecuencias de la esquizofrenia de inicio temprano en el adulto mayor
La esquizofrenia de inicio temprano representa el 90% de los casos. Existen datos que sugieren que con la edad se produce una atenuación de los síntomas, especialmente de los positivos y comportamentales, lo que permitiría una rehabilitación social de los pacientes (Bankole 2008). Sin embargo, a esto se opone la comorbilidad con otras enfermedades médicas y psiquiátricas, así como los problemas sociales inherentes a estos casos (Kirkpatrik 2008).
Los pacientes con esquizofrenia tienen una disminución aproximada de un 20% en la expectativa de vida, comparada con la de la población general. Hay factores asociados a este fenómeno que no deben ignorarse en su tratamiento: la farmacoterapia, el estrés crónico, los hábitos de vida y un incremento del riesgo suicida. Otra complicación es el deterioro cognoscitivo que altera la esperanza y calidad de vida del paciente geriátrico con esquizofrenia (Rown 1997, Karim 2005).
Existe la hipótesis de que la esquizofrenia acelera el envejecimiento, pero algunos hallazgos sugieren mayor prevalencia de las condiciones asociadas a dicho proceso (Kirkpatrik 2008):
• Incremento de la resistencia a la insulina
• Hiperlipidemia
• Incremento de la presión arterial
• Disminución de la densidad ósea
• Engrosamiento del cristalino
• Piel arrugada y adelgazada
• Adelgazamiento del pelo
• Disminución de la masa muscular
A pesar de los hallazgos citados, la hipótesis del envejecimiento acelerado puede ser refutada mientras estos hallazgos no sean corroborados en muestras comparadas con sujetos control sin esquizofrenia. Otros medios para detectar la influencia de la esquizofrenia en el envejecimiento, son estudios moleculares que incluyan la hormona de crecimiento, la vía de señalización, el telómero y la molécula reparadora de ADN. Los conocimientos actuales no confirman la asociación entre la esquizofrenia y el envejecimiento (Kirkpatrik 2008).
Deterioro cognoscitivo
Kreapelin fue el primero en conceptualizar la esquizofrenia como un trastorno que cursaba con un deterioro cognoscitivo progresivo. Reconoció que la orientación, la memoria y percepción estaban relativamente conservadas, mientras que otras funciones como la eficiencia intelectual y la atención, estaban disminuidas, de ahí partió su concepto de dementia praecox. En los últimos años, con el desarrollo de las neuro-ciencias, se han documentado plenamente alteraciones en las funciones ejecutivas desde el primer brote psicótico, alteraciones en la memoria y atención; éstas condicionan cambios en el contenido (ideas delirantes) y curso del pensamiento (pensamiento desorganizado) que deterioran el lenguaje e impiden la comunicación e interacción social. Las alteraciones cognoscitivas que presenta la esquizofrenia hacen que el rendimiento intelectual de los pacientes con esquizofrenia sea menor al de los sujetos sanos (Cohen 2006, Karim 2005).
Los cambios cognoscitivos observados en la esquizofrenia que aparecen incluso en el primer brote psicótico, se traslapan con los relacionados al envejecimiento. Sin embargo, los pacientes ancianos con esquizofrenia tienen un rendimiento menor a sus controles sanos. Además, los cambios cognoscitivos de estos pacientes envejecidos, son más rápidos que en la población sana. Los cambios en las habilidades cognoscitivas en la esquizofrenia, comparados con el proceso simple de envejecimiento, muestran diferencias en los mecanismos subyacentes (Rajji 2009).
La posible presencia de circuitos neurológicos vulnerables al deterioro, en pacientes con esquizofrenia que presentan cambios en el envejecimiento, es tema de futuras investigaciones, ya que actualmente hay pocos estudios que comparen el rendimiento cognoscitivo entre ancianos sanos y ancianos con esquizofrenia; además de que su metodología transversal y no longitudinal, impide hacer observaciones concluyentes (Rajji 2009).
En resumen, a pesar de la reticencia de los clínicos, se acepta la esquizofrenia de inicio tardío a nivel internacional. Dicho trastorno presenta diferencias epidemiológicas, clínicas y de pronóstico, comparado con la esquizofrenia de inicio temprano. Por último, el paciente anciano con esquizofrenia de inicio temprano tiene una menor sobrevida y mayor deterioro cognoscitivo que el paciente con esquizofrenia de inicio tardío y que sus controles sanos (Rajji 2009).
Niños y adolescentes
La esquizofrenia de inicio en la niñez o la adolescencia es un trastorno psicótico muy severo y devastador. Los criterios para llegar a este diagnóstico no cambian con la edad, según el DSM-IV-TR, excepto en los menores.
Más que deterioro en el funcionamiento, no se satisfacen las expectativas interpersonales, académicas u ocupacionales propias del nivel de desarrollo. Hasta antes de los años 70 también se aplicaba este diagnóstico a niños que ahora se considera sufren más bien de autismo. En la niñez, la aparición de la esquizofrenia se caracteriza por un desarrollo muy desigual y de inicio gradual. El lenguaje y el comportamiento social no sólo muestran retraso, sino son cualitativamente diferentes de lo observado en niños en cualquier etapa del desarrollo (American Psychiatric Association 2000, Dulcan 2003). Hay variaciones fenomenológicas dependientes de la edad de inicio de este trastorno: en la edad pediátrica, la esquizofrenia se caracteriza por un inicio más insidioso, síntomas negativos, mayor desorganización del pensamiento, alucinaciones en diferentes modalidades y menos ideas delirantes sistematizadas o persecutorias (Green 1992).
Datos clínicos
En la niñez y la adolescencia, el surgimiento de la esquizofrenia se relaciona con pobre funcionamiento premórbido y retrasos en el desarrollo temprano, tal como se ha reportado en el adulto, pero en la niñez y la adolescencia estos problemas son más comunes y severos (Alaghband 1995). Cabe añadir que estas dificultades premórbidas no son exclusivas de la esquizofrenia, y ocurren también en otras psicosis.
La presencia en edades tempranas de síntomas psicóticos aislados o atenuados, en combinación con alteraciones diversas en el desarrollo, constituyen un fenotipo premórbido de alto riesgo para llegar a sufrir esquizofrenia (Cannon 1998). Frecuentemente, al inicio de la esquizofrenia el funcionamiento cognitivo se encuentra alterado. En promedio, los cocientes de inteligencia se encuentran en los 80, con déficit particular en la comprensión verbal, lenguaje y memoria de corto plazo, además de atención y funcionamiento ejecutivo deficientes.
Etiología
Hay una proporción de 10% de anormalidades citogenéticas en pacientes con inicio del trastorno antes de los 13 años (Addington 2009). Al igual que en adultos, en menores se han identificado varios genes de susceptibilidad a la esquizofrenia, tales como los siguientes: DAOA, NRG1, DTNBP1 y GAD 1 (Addington 2005).
Se han descrito complicaciones durante embarazo y parto en adultos que posteriormente desarrollan esquizofrenia. La combinación de riesgo genético con daño adquirido ha sugerido una teoría del neurodesarrollo con anormalidades tempranas del SNC que contribuyen después a aumentar la vulnerabilidad a la esquizofrenia (Loth 2012).
El estudio de un grupo de adolescentes con esquizofrenia ha mostrado disminución significativa en la materia gris temporal y frontal, en comparación con los controles, así como volumen cerebral y materia gris reducidos en hermanos sanos de pacientes con esquizofrenia de inicio en la niñez (Weinberger 2002, Rapoport 1999).
En cuanto al papel del consumo de cannabis, hasta el momento éste no se ha implicado directamente en el inicio de esquizofrenia en la niñez y la adolescencia, debido posiblemente a la relativa baja prevalencia del uso de cannabis en adolescentes más jóvenes y a la corta duración entre la exposición y la presentación de la psicosis. Sin embargo, el uso de cannabis se asocia con un inicio más temprano de la psicosis en adultos (Arendt 2005).
Respecto a los riesgos psicosociales, no se ha comprobado que exista una relación causal entre emoción expresada y desencadenamiento de esquizofrenia en la adolescencia. Parece que los padres de niños con esquizofrenia, generalmente, expresan menores niveles de criticismo y hostilidad que los padres de pacientes de inicio en la adultez, debido a la mayor tendencia a atribuir el comportamiento de sus hijos a una enfermedad que está fuera de su control (Hooley 1987). Los traumas en la niñez temprana se han correlacionado con la generación de síntomas psicóticos. Los niños que experimentaron maltrato por un adulto o acoso por los padres, tendían a reportar más síntomas psicóticos a los 12 años en un estudio hecho con gemelos (Arseneault 2011). Y en otro estudio, niños que habían sido víctimas de acoso por los padres entre los 8 y 10 años, tenían doble posibilidad de presentar síntomas psicóticos posteriormente (Schreier 2009).
Epidemiología
La esquizofrenia de inicio muy temprano (antes de los 13 años) es muy rara, aun menos común que el trastorno autista. La prevalencia antes de la adolescencia es menor de 0.1%, después de la pubertad aumenta y se acerca a los niveles de los adultos al final de la adolescencia. Es más frecuente en varones, y típicamente tiene un principio insidioso y un curso crónico. Síntomas premórbidos comunes son: retrasos en el desarrollo motriz y del lenguaje, problemas académicos, poca atención, hiperactividad, comportamiento disruptivo y aislamiento social. En la esquizofrenia de inicio en la adolescencia, frecuentemente han existido deficiencias premórbidas sociales, motoras y del lenguaje. Algunos adolescentes presentan episodios y remisiones similares a los encontrados en adultos. Los adolescentes con esquizofrenia se encuentran en riesgo aumentado de morir por suicidio o en accidentes (Dulcan 2003).
Diagnóstico diferencial
Los síntomas psicóticos en niños y adolescentes son inespecíficos en términos de diagnóstico, y ocurren en varios trastornos psiquiátricos funcionales y orgánicos cerebrales (Alaghband 1995). El diagnóstico de esquizofrenia requiere la exclusión de trastornos del ánimo con síntomas psicóticos (trastorno bipolar), trastorno inducido por sustancias y psicosis debida a condiciones médicas. Se debe considerar a las siguientes entidades cuando se evalúa a un niño o adolescente en quien se sospecha esquizofrenia: psicosis secundaria a epilepsia y psicosis de episodio único; trastornos neurodegenerativos; tumor del SNC; trastorno orgánico progresivo del SNC; trastorno esquizoafectivo; trastorno cromosómico (síndrome de deleción del 22q11). También hay que diferenciar los síntomas de la esquizofrenia de: déficit cognitivos, depresión pediátrica, trastorno obsesivo compulsivo, trastorno límite de personalidad, trastorno generalizado del desarrollo, porfiria aguda y enfermedad de Wilson.
La evaluación de un niño o adolescente con posible esquizofrenia debe constar de una historia detallada, examen mental y físico. El grado de extensión de exámenes médicos y neurológicos, y la realización de estudios de neuroimagen y electroencefalografía deben ser guiados por la historia clínica y el examen neurológico.
Tratamiento
La hospitalización es necesaria para aquellos cuyo comportamiento puede ser peligroso para ellos mismos o para quienes les rodean. La terapia farmacológica es esencial en el tratamiento de individuos con esquizofrenia. La terapia electro-convulsiva también puede estar indicada en los casos raros que no respondan a los medicamentos (Loth 2012) [C3].
Debido al escaso número de estudios de antipsicóticos conducidos en niños y adolescentes, es necesario extrapolar la mayor parte de la evidencia sobre su eficacia de estudios en adultos. Hay que tener en cuenta que niños y adolescentes muestran mayor sensibilidad que los adultos a un rango de eventos adversos relacionados con antipsicóticos tales como efectos extrapiramidales colaterales y resistencia al tratamiento con los antipsicóticos tradicionales. También tienden más a presentar aumento de peso, obesidad, elevación de prolactina, sedación y síndrome metabólico con los antipsicóticos atípicos más nuevos (Kumra 1998, Ratzoni 2002, Corell 2006).
Al comparar en adolescentes con esquizofrenia, la eficacia de los antipsicóticos atípicos (risperidona y olanzapina) vs. los típicos (haloperidol), se ha reportado eficacia similar contra síntomas psicóticos (con una tendencia no significativa a favor de los atípicos), pero un perfil diferente de efectos adversos (Gothelf 2003) [B2]. Los síntomas extrapiramidales son más comunes con haloperidol y risperidona en dosis altas, que con olanzapina. La ganancia de peso y la obesidad son más comunes con olanzapina, en segundo lugar con risperidona y, por último, con haloperidol. La sedación es mayor con olanzapina y haloperidol que con risperidona (Toren 2004) [B3]. El UK National Institute for Heath and Clinical Excelence (NICE), ha recomendado el uso de atípicos (risperidona, olanzapina, quetiapina, amisulpride y zotapina) en pacientes con primer episodio y en aquéllos con terapia ya establecida que muestran resistencia a los antipsicóticos típicos. La evidencia clínica sugiere que la clozapina es el antipsicótico más efectivo en la esquizofrenia de inicio en la niñez y la adolescencia, aunque su uso está restringido a los casos con resistencia al tratamiento debido al riesgo de producir discrasias sanguíneas (NICE). Cabe mencionar que, aunque asociada primariamente a la clozapina, la agranulocitosis puede ocurrir con cualquier agente antipsicótico.
Aunque los atípicos reducen el riesgo de síntomas extrapiramidales, pueden producir otros efectos problemáticos (generalmente relacionados con la dosis), que incluyen la ganancia de peso (olanzapina, clozapina, risperidona), sedación, hipersalivación y convulsiones (clozapina, olanzapina, quetiapina), e hiperprolactinemia (risperidona, amisulpride). Olanzapina y quetiapina aumentan significativamente el colesterol total y los triglicéridos. La risperidona también aumenta significativamente los triglicéridos (AACAP 2001).
Es necesario supervisar cuidadosamente peso, presión arterial y niveles de glucosa y lípidos antes de iniciar el tratamiento farmacológico; posteriormente, dos veces al año después de los primeros 3 meses de tratamiento (Correll 2009) [A2].
En abril de 2011, los siguientes antipsicóticos atípicos fueron aprobados por la FDA para su uso en el tratamiento de la esquizofrenia pediátrica: aripiprazol, olanzapina, quetiapina, risperidona y paliperidona. La eficacia de estos medicamentos ha sido investigada en diversos estudios (Correll 2011) [A2]. Específicamente, un estudio internacional multicéntrico de 6 semanas y con control de placebo mostró que aripiprazol (10 a 30 mg) (Findling 2008) [A2], olanzapina (2.5-20 mg) (Kryzhanovskaya 2009) [A2], quetiapina (400 u 800 mg) (Findling 2008) [A2], paliperidona (1.5 mg, 3 mg o 6 mg; 6 mg o 12 mg) (Singh 2010) [A2] y risperidona (1.3 mg o 4-6 mg) (Haas 2009) [A2] fueron superiores a placebo en mejorar el puntaje de síntomas positivos y negativos en la escala de PANSS en adolescentes de 13 a 17 años de edad.
Atípicos como olanzapina y risperidona deben ser los medicamentos de primera línea, dado que la esquizofrenia en niños y adolescentes se caracteriza por síntomas negativos, deficiencias cognitivas y sensibilidad a los efectos extra-piramidales, además de resistencia relativa a los antipsicóticos tradicionales. El orden de tratamiento recomendado para niños con primer episodio de esquizofrenia es como sigue: primero un atípico, si la respuesta es inadecuada, cambiar a un atípico diferente o a un antipsicótico convencional; si la respuesta es aún inadecuada o los efectos secundarios son intolerables, entonces iniciar clozapina (Alaghband 1995) [B3], (Correll 2009) [Al].
Las intervenciones psicosociales pueden incluir terapia cognitivo-conductual dirigida a los síntomas, habilidades para resolver problemas y reducir el estrés, psicoeducación para el paciente y su familia, terapia familiar y de apoyo, y educación remedial.
En la edad pediátrica, sólo una minoría de casos de esquizofrenia logra una recuperación sintomática completa después del primer episodio psicótico. Los estudios de seguimiento a largo plazo muestran que el curso de la esquizofrenia de inicio en la niñez o la adolescencia, es típicamente crónico, sin remisión y con funcionamiento severamente deteriorado en la edad adulta (Alaghband 1995) [B3].
GÉNERO
Diferencias de género en esquizofrenia
Las diversas teorías acerca de las diferencias de género no necesariamente son incompatibles, dado que operan en distintos niveles y tiempos, y es probable que sean acumulativas.
Las razones del interés en las diferencias de género en el cerebro, son las siguientes:
• Entender cómo difieren la estructura y la función cerebral entre hombres y mujeres.
• El conocimiento de las diferencias en la morfología cerebral entre hombres y mujeres es crucial para controlar los efectos del sexo cuando se estudia la estructura y función cerebrales afectadas en un trastorno en particular. Por ejemplo, las alteraciones cerebrales identificadas en la esquizofrenia, las cuales tienden a ser más marcadas en hombres que en mujeres.
• La necesidad de entender cómo las diferencias de género interactúan con los diversos trastornos psiquiátricos en su fenomenología: presentación, curso, severidad, respuesta a tratamiento.
Dimorfismo sexual
En los seres humanos, el dimorfismo sexual se manifiesta en los siguientes niveles: genital, cerebral, neurobioquímico y conductual.
A nivel cerebral, los efectos del género sobre el mismo se deben estudiar desde una perspectiva del desarrollo a lo largo del ciclo vital.
Los síntomas psicóticos prolongados pueden tener efectos patológicos perdurables sobre el sustrato neuronal, lo cual lleva a empeorar los resultados en el largo plazo (Hoffman 1993).
En las teorías al respecto, los estrógenos tienen un papel prominente, sea estructural, influenciando el dimorfismo sexual de las estructuras cerebrales, como la proliferación y poda neuronal, lateralización cerebral; o bien, funcional, modificando el funcionamiento de los neurotransmisores y el mejoramiento de la sintomatología psicótica.
A nivel neurobioquímico, los estrógenos ejercen efectos múltiples en sitios específicos sobre distintos sistemas de neurotransmisión:
• Aumentan la destrucción de la monoaminooxidasa, y de esa manera aumenta disponibilidad en el cerebro de serotonina y demás catecolaminas, incluida la noradrenalina.
• En la amígdala aumentan el recambio de serotonina.
• Sobre la dopamina modifican los receptores pre y post-sinápticos.
• Inducen a la acetilcolintransferasa con un efecto benéfico sobre la memoria.
• Tienen acción potenciadora sobre los aminoácidos excitadores como el glutamato y el aspartato.
Efecto estrogénico
Debido a su efecto predominantemente excitatorio, los estrógenos tienen un efecto proconvulsivante.
Además de sus efectos sobre los neurotransmisores, los estrógenos también aumentan el flujo sanguíneo cerebral, lo cual acelera el metabolismo y aumenta la eficiencia neuronal, estimulan el transporte y el metabolismo de la glucosa, por lo que existe una correlación positiva entre el nivel circulante de estrógenos con el aumento del estado de alerta, menor distractibilidad y disminución de tiempos de reacción en animales de laboratorio.
También se ha propuesto que influyen sobre los genes neurotróficos responsables del desarrollo: la migración, el crecimiento y la supervivencia neuronales; sobre la actividad antioxidante: la plasticidad sináptica, la neurodegeneración y la apoptosis secundaria a la falta de glucosa u otras causas tóxicas.
No solamente puede el sustrato estructural cerebral y su desarrollo diferencial ser más protector en las mujeres, sino que los estrógenos por sí mismos tienen efecto neuroprotector, habiendo sido demostrado que promueven la neurogénesis y la sinaptogénesis (Naftolin 1990), así como protegen contra la muerte neuronal (Chan 1996).
Ayudan a aumentar las conexiones neuronales. Si se produce una alteración en un nervio, reparan, retrasan o previenen la atrofia.
Ya que la mayoría de los enfermos con esquizofrenia se manifiestan después de la adolescencia, los procesos neuronales que ocurren durante la pubertad, incluyendo la poda sináptica intensiva, pueden jugar un papel significativo.
Los estrógenos afectan la poda sináptica de una manera sexualmente específica, y pueden contribuir a una poda menos aberrante en mujeres comparada contra los hombres.
Efecto progestágeno
En cuanto a la progesterona, las neuronas que responden a ella lo hacen a través del GABA y producen un efecto ansiolítico, aumentando también el umbral convulsivo. En síntesis, la influencia global de la progesterona sobre los neurotransmisores es disminución de la ansiedad, pero probablemente incrementa la depresión.
Ambas hormonas mantienen un balance, cuando éste se altera, contribuye (en personas vulnerables) al desarrollo de ansiedad o depresión.
Asociación entre estrógenos y trastornos psiquiátricos
Las hipótesis que tratan de explicar la asociación entre los estrógenos y los trastornos psiquiátricos han sido propuestas por Seeman:
• Trastornos relacionados al neurodesarrollo. Las mujeres están relativamente protegidas por los efectos organizacionales y activantes de las hormonas, hasta el inicio de la menopausia.
• Trastornos neurodegenerativos. La declinación en la producción de estrógenos durante la menopausia hace más susceptibles a las mujeres a los efectos del alcohol o de otras sustancias, y para desarrollar trastornos neurodegenerativos como la Enfermedad de Alzheimer o la Enfermedad de Parkinson.
• Trastornos inducidos por eventos estresantes. Las mujeres son más susceptibles que los hombres en los años entre la pubertad y la menopausia, cuando los niveles hormonales fluctúan. Se encuentran protegidas durante el embarazo cuando los niveles se encuentran elevados.
• Trastornos afectivos. Las diferencias están determinadas por la forma en que se utilizan los servicios de salud, sesgo en las respuestas dadas en las entrevistas, sesgo en el diagnóstico y en el recuerdo, equivalentes depresivos, genéticas, endocrinas-hormonales, estatus social, exposición y vulnerabilidad a eventos adversos de la vida, apoyo social, cognoscitivos, desesperanza aprendida, cognoscitivos, estilos de respuesta.
Modelo del neurodesarrollo y esquizofrenia
Plantea la hipótesis de que la esquizofrenia tiene su origen durante el neurodesarrollo fetal, por lo que las diferencias de género en el desarrollo y la organización cerebral normal pueden ser relevantes para las diferencias de género descritas en la expresión de la esquizofrenia.
Estructura y esquizofrenia
Se ha identificado que las anormalidades estructurales cerebrales, como el aumento en el tamaño de los ventrículos y la disminución del volumen del hipocampo, parecen ser menos frecuentes en las mujeres que en los hombres (Castle).
Función y esquizofrenia
Se ha propuesto la hipótesis de que los estrógenos pueden jugar un papel protector. La presencia de estrógenos en la premenopausia aumenta el umbral de vulnerabilidad, mientras que su disminución después de la menopausia puede relacionarse a un aumento del riesgo de desarrollarla o de que el cuadro empeore. La evidencia de esta relación inversa parte de los estudios realizados sobre las fluctuaciones de los síntomas a lo largo del ciclo menstrual y de la vida reproductiva de las pacientes con esquizofrenia. La vulnerabilidad a la recaída aumenta en la fase del ciclo menstrual en que los estrógenos son bajos como en la fase premenstrual, el período postparto y la menopausia.
Tanto los síntomas positivos como los negativos empeoran cuando el nivel de estrógenos es bajo. Cuando son altos, como en el embarazo, los síntomas psicóticos son leves.
Neurodesarrollo y mielinización
Puesto que la mielinización en ciertas vías corticolímbicas no se completa hasta la adolescencia tardía (Benes 1989), la mielinización anormal puede ser otra fuente de defecto del neurodesarrollo que lleva a la esquizofrenia y sus diferencias de género.
Modelo evolutivo y esquizofrenia
Crow plantea una hipótesis general sobre la esquizofrenia recurriendo al modelo evolutivo, sugiriendo al gen que da origen al lenguaje, proponiendo una fisiopatología de los síntomas esquizofrénicos. Este gen sería responsable de las asimetrías hemisféricas y estaría igualmente relacionado con la diferenciación cerebral y las habilidades cognitivas según el género (McGlone 1980), y con las diferencias en el momento de la presentación de la enfermedad en el momento de presentación de la enfermedad entre hombres y mujeres (Hafner 1993).
Para Crow, este gen estaría ligado al cromosoma X. Diferentes estudios han encontrado una débil pero sugestiva evidencia de esta posible asociación (De Lisi 1994, Kim 1999). La elección del cromosoma X parte de la evidencia de que las translocaciones en este cromosoma constituyen uno de los principales cambios en la evolución genética de los primates, y más en concreto de nuestra diferencia con los chimpancés (Lambson 1992)
Medio ambiente y esquizofrenia
El cerebro es completamente plástico y responde tanto estructural como funcionalmente a las influencias del medio ambiente. De tal manera que una dificultad adicional para estudiar las diferencias de género en el cerebro humano, son las influencias del medio ambiente.
Los estresores psicosociales a lo largo de la vida pueden contribuir a la emergencia o al curso de la esquizofrenia. Los factores ambientales pueden alterar la estructura neuronal y funcional en cualquier momento.
El término "neurodinámico" se refiere al concepto de que en el corto plazo las redes neuronales procesan información de entrada proveniente del medio ambiente, produciendo salidas adaptativas, usando esta información en el largo plazo para modificar su propia organización (Hoffman 1993).
Género y manifestaciones clínicas en la esquizofrenia
Entre hombres y mujeres hay diferencias en la expresión de los síntomas y en el curso de la enfermedad.
Dado que no existen claras diferencias de género en la historia familiar, complicaciones obstétricas, anomalías físicas menores y discretos síntomas neurológicos, el modelo del neurodesarrollo de la esquizofrenia tiene un valor más prometedor para la mayoría de la esquizofrenia en ambos sexos.
Los hombres tienen un inicio consistentemente más temprano, un funcionamiento premórbido más pobre y diferentes predictores de comportamiento premórbido. Los síntomas negativos como el aislamiento social y el afecto aplanado son más comunes. Asimismo, muestran mayor déficit en síntomas cognitivos, con mayores anormalidades estructurales y neurofisiológicas en el cerebro. Sus familias son más críticas y las emociones expresadas tienen un mayor impacto negativo que en las mujeres.
En contraste, las mujeres tienen un curso más favorable que los hombres en el corto y mediano plazo, con menor abuso de sustancias y tabaco, menor tiempo de internamiento, menores rehospitalizaciones, mayor tiempo sin recaídas y, por lo tanto, mejor ajuste social. Tiende a ser más benigna, con síntomas más leves en los primeros años de la enfermedad, pero al pasar los años los síntomas psicóticos se tornan más severos en las mujeres, y en los hombres tienden a disminuir.
Las mujeres despliegan más síntomas afectivos, alucinaciones auditivas e ideas delirantes de persecución con una mayor y más rápida respuesta a los antipsicóticos en el período premenopáusico, pero con incremento de los efectos adversos.
El que la esquizofrenia inicie en las mujeres casi diez años después que en los hombres, les permite a ellas un mejor funcionamiento premórbido, con la posibilidad de estudiar, trabajar, casarse y tener hijos, antes del inicio de la enfermedad.
La evolución de la esquizofrenia con hospitalizaciones más frecuentes y prolongadas puede explicar la aparente mayor prevalencia en los hombres, inicia más temprano, entre los 18 y 25 años; en las mujeres, entre los 25 y 35 años. 15% de las mujeres presentan otro pico en la edad de inicio a los 40 años. La de inicio tardío, que empieza después de los 45 años, es más frecuente en las mujeres.
Diferencias de género y tratamiento
En cuanto al tratamiento, las mujeres necesitan dosis menores de antipsicóticos y responden más rápido y mejor que los hombres. Esta diferencia va desapareciendo o revierte con la edad.
Se ha propuesto que los estrógenos pueden tener un efecto parecido a los antipsicóticos. Las mujeres hospitalizadas con esquizofrenia requieren dosis menores de antipsicóticos cuando sus niveles de estrógenos son altos, de lo que se concluye que un aumento en los niveles de estrógenos aumenta la respuesta terapéutica.
Los antipsicóticos aumentan los niveles de prolactina, la que a su vez inhibe la liberación de estrógenos.
Conclusiones
Aunque pareciera como si la investigación y la teoría con respecto a las diferencias de género en la esquizofrenia divergen, es importante considerar su último potencial de convergencia.
El grado de confluencia en la presentación de la esquizofrenia en los géneros es mayor que las diferencias, lo cual aumenta la dificultad de examinar las diferencias de género, lo que explica los resultados controversiales de muchos estudios.
No obstante, la evidencia disponible apoya diferencias significativas de género en la esquizofrenia, y éstas podrían ser consideradas tanto en el diagnóstico como en el manejo de los pacientes.
Es probable que la combinación de hormonas sexuales y las diferencias psicosociales de género finalmente medien la expresión de las diferencias de género en la esquizofrenia (Hafner 1988, 1998).
Son necesarios más estudios en esta área, con la esperanza de desarrollar estrategias individualizadas de mejoría, prevención y tratamiento para un trastorno que permanece sin dilucidar en su causa, y devastador en sus manifestaciones, tanto en hombres como en mujeres (Leung y Chue 2000). Por lo pronto, es clara la importancia de la optimización del tratamiento, tanto farmacológico como psicosocial.
IMAGENOLOGÍA
Las técnicas de imagenología cerebral desarrolladas a finales del siglo XX se han convertido en una de las avenidas científicas más importantes en el estudio de la esquizofrenia. Éstas incluyen técnicas de medicina nuclear que permiten medir el metabolismo y/o el flujo sanguíneo cerebral (por ejemplo, PET y SPECT), así como técnicas de resonancia magnética nuclear que permiten medir:
1. La actividad cerebral relacionada a eventos cognoscitivos, emocionales y conductuales (resonancia magnética funcional).
2. La concentración de metabolitos cerebrales (espectroscopia por resonancia magnética).
3. La integridad de la sustancia blanca cerebral (imagenología mediante la técnica conocida como tensor de difusión).
Por citar las empleadas con mayor frecuencia y que cuentan con mayor validez científica. Estas técnicas han permitido explorar las posibles respuestas a diversos problemas científicos en el campo de la esquizofrenia, por ejemplo:
1. Las anormalidades estructurales en la esquizofrenia.
2. Los cambios cerebrales que anteceden el diagnóstico de esquizofrenia.
3. Los cambios cerebrales progresivos en sujetos con diagnóstico de esquizofrenia.
4. La relación entre anormalidades cerebrales y el pronóstico de la esquizofrenia.
5. La relación entre anormalidades de la función cerebral, el funcionamiento cognoscitivo y la presencia de síntomas característicos de la esquizofrenia.
6. Los cambios estructurales, bioquímicos y funcionales que ocurren durante el tratamiento médico.
En el presente capítulo no se abordarán todos los temas a profundidad, por limitaciones del espacio editorial; solamente se citarán algunos de los estudios más importantes en el campo que permiten explorar, ante todo, el problema de las alteraciones estructurales de la esquizofrenia.
Imágenes estructurales del sistema nervioso en pacientes con diagnóstico de esquizofrenia
Anormalidades estructurales en la sustancia gris en pacientes con diagnóstico de esquizofrenia
Los estudios de imágenes estructurales del sistema nervioso han confirmado algunos de los hallazgos neuroanatómicos previamente planteados por estudios de neuropatología, incluyendo un mayor tamaño de los ventrículos cerebrales y un menor tamaño del volumen cerebral global (Wright IC 2000), así como la hipótesis de una falla en los procesos de especialización hemisférica que se relacionan con la lateralidad manual y la asimetría anatómica entre hemisferios cerebrales (Sommer 2001). Esta asimetría entre hemisferios es particularmente notable en la región del planum temporale, donde se puede observar desde las semanas 29-31 de gestación, por lo cual su anormalidad se considera indicativa de una alteración prenatal en el neurodesarrollo. Otro hallazgo comúnmente reportado en pacientes con esquizofrenia, presente hasta en el 92% de los estudios de neuroimagen, es la presencia de cavum septi pellucidum. El septum pellucidum es una membrana con forma triangular que separa los dos cuerpos frontales de los ventrículos laterales. La formación de una cavidad o espacio en esta membrana generalmente refleja anormalidades en el desarrollo de estructuras que rodean al septum pellucidum, por ejemplo, el cuerpo calloso o los hipocampos (Shenton 2001) (cuadro 12).
En relación con regiones específicas de la corteza cerebral, un estudio de meta-analisis (Honea 2005) revisó 15 estudios de imagenología por resonancia magnética, publicados entre 1999 y 2004, los cuales emplearon la técnica conocida como morfometría basada en voxeles, la cual permite detectar diferencias entre grupos en relación a volumen o la densidad de la masa cerebral. Las regiones cerebrales encontradas con deficiencias de volumen cerebral al menos el 50% de los estudios, fueron las siguientes:
1. Lóbulo temporal medial izquierdo
2. Giro temporal superior izquierdo
3. Giro frontal medial izquierdo
4. Giro frontal medial izquierdo
5. Giro parahipocampal izquierdo
6. Giro temporal superior derecho
En general, estos estudios apoyan la hipótesis previamente sugerida (Crow 1997) de una falla en los mecanismos de lateralización hemisférica como una base neurobiológica relevante en el génesis de la esquizofrenia, si bien hay evidencia consistente acerca de una deficiencia bilateral de volumen en el giro temporal superior. Por otra parte, hay que enfatizar que este meta-análisis no descarta la existencia de deficiencias en otras regiones, simplemente enfatiza las regiones donde los hallazgos de anormalidad estructural han sido más consistentes. Por ejemplo, hay un moderado acuerdo con respecto a deficiencias de volumen en el estriado y el tálamo (Honea 2005), y un bajo acuerdo con respecto a la existencia de anormalidades en el cerebelo (Honea 2005). La heterogeneidad de los resultados parece deberse a diferencias metodológicas, así como a la heterogeneidad propia de la esquizofrenia, los diferentes estadios del trastorno, y el empleo o no de medicamentos antipsicóticos.
Anormalidades estructurales en la sustancia blanca en pacientes con diagnóstico de esquizofrenia
Otro tema cardinal relacionado con anormalidades neuroanatómicas en sujetos con diagnóstico de esquizofrenia, se refiere a la conectividad cerebral, es decir, los tractos de sustancia blanca que comunican y permiten la integración de módulos cerebrales. Algunos autores plantean que los síntomas cardinales de la esquizofrenia, según la descripción de Kurt Schneider (experiencias de control y reemplazo de la voluntad, alucinaciones audioverbales de voces que comentan entre sí, etc.) pueden ser explicados en base a fenómenos de desconexión (Stephan). Estudios clásicos ya habían mostrado una reducción en el volumen del cuerpo calloso en pacientes con diagnóstico de esquizofrenia (Woodruff 1995), lo cual teóricamente puede significar una limitación en la comunicación interhemisférica. Una técnica especialmente útil para estudiar este problema es la imagenología por resonancia magnética mediante tensor de difusión, la cual permite obtener una medida de integridad de la sustancia blanca, conocida como fracción de anisotropía. Una revisión de los estudios de resonancia magnética por tensor de difusión en años recientes reunió 18 estudios, los cuales muestran alteraciones consistentes en los siguientes tractos (Kubicki 2007) (cuadro 12):
1. Fascículo uncinado, el cual conecta estructuras ventrales del lóbulo frontal y el lóbulo temporal. Hay evidencia de que este fascículo se encuentra alterado desde las etapas tempranas de la esquizofrenia (Kawashima 2009). Asimismo, la deficiencia en la integridad de esta estructura de sustancia blanca se ha asociado con deficiencias en la memoria episódica (Nestor 2008).
2. El fascículo del cíngulo, el cual conecta estructuras del lóbulo frontal en sus porciones ventromediales y del prosencéfalo basal, con las cortezas anterior, media y posterior del giro del cíngulo, y así mismo con el giro parahipocampal y la formación del hipocampo. Este fascículo ha sido encontrado con deficiencias estructurales en el hemisferio izquierdo de pacientes con esquizofrenia de larga evolución, lo cual se asocia a su vez con alteraciones en redes atencionales (Nestor 2007). Así mismo, las deficiencias en la integridad del fascículo del cíngulo se asocian con fallas en la función ejecutiva (Nestor 2008).
3. El fascículo arcuato, que conecta estructuras corticales de los lóbulos temporal y parietal, dedicadas a la recepción e interpretación del lenguaje (área de Wernicke), con las regiones frontales relacionadas con la expresión del lenguaje (área de Broca). Este fascículo ha sido encontrado con reducción en la fracción de anisotropía en el lóbulo frontal izquierdo, lo cual podría afectar la descarga corolaria de señales neurales, desde regiones frontales de iniciación del discurso hacia regiones de la corteza auditiva. Esta falla en la descarga corolaria podría asociarse a su vez con la generación de alucinaciones auditivas (Abdul-Rahma 2012).
Los hallazgos previamente mencionados apoyan la hipótesis de una extensa desconexión de módulos cerebrales en las cortezas frontal y temporal que podrían ocasionar fallas en la transmisión de información, y que podrían estar relacionadas con deficiencias en el monitoreo de las fuentes de información (Stephan), lo cual a su vez se asociaría con una pérdida subjetiva de la sensación de agencia o autoría (agency) y de la sensación de pertenencia o propiedad (ownership); estas fallas podrían explicar al menos parcialmente algunos de los síntomas de primer rango de Kurt Schneider para el diagnóstico de esquizofrenia:
a) Las alucinaciones auditivas podrían resultar de fallas en la transmisión de información desde el área de Broca hacia regiones de automonitoreo en cortezas posteriores (por ejemplo a nivel del cíngulo posterior); es decir, actividad verbal autogenerada (tal y como sucede en procesos de discurso encubierto o pensamiento verbal), es reconocida erróneamente como generada por una fuente externa.
b) Las experiencias de control y remplazo de la voluntad podrían resultar así mismo de fallas en la transmisión de la información desde regiones frontales y del giro del cíngulo hacia regiones de automonitoreo en cortezas posteriores (por ejemplo, en la corteza del cíngulo posterior); es decir, actividad intencional autogenerada para la activación de programas motores es reconocida erróneamente como generada por una fuente externa.
Imágenes funcionales en pacientes con diagnóstico de esquizofrenia
Resonancia magnética funcional (cuadro 13)
La resonancia magnética funcional se basa principalmente en la técnica conocida como BOLD (por sus siglas en inglés: Blood Oxigen Level Dependent), la cual permite medir la activación cerebral regional relacionada con tareas cognoscitivas, emocionales o conductuales de diversa índole, a partir de las propiedades magnéticas de la hemoglobina y la desoxihemoglobina. Durante la activación neuronal que hace posible la realización de las tareas, los cambios en la perfusión cerebral provocan un aumento en las concentraciones de desoxihemoglobina, lo cual a vez provoca cambios magnéticos asociados específicamente con la región cerebral activada. Estos cambios magnéticos regionales pueden registrarse mediante el equipo de la resonancia magnética y formar imágenes mediante procedimientos de cómputo. Ahora bien, esta herramienta se ha convertido en una aliada fundamental de la investigación neurocientífica de la esquizofrenia, debido a que pueden establecerse correlaciones con funciones cognoscitivas, procesos emocionales y estados mentales patológicos como las alucinaciones o los delirios. Es imposible realizar un resumen breve de los avances en este campo, pero al menos deben destacarse algunos resultados consistentes y con alto valor heurístico:
a) Alucinaciones audioverbales: se ha encontrado una menor activación en el giro temporal superior en respuesta a los estímulos auditivos durante el acontecimiento de alucinaciones auditivas (Kindermann 1997). Por otra parte, un estudio mostró que los pacientes que experimentan alucinaciones audioverbales generan mayor actividad cerebral en el área de Broca (Raji 2009) lo cual se relaciona con investigaciones previas que muestran sub-vocalizaciones producidas por el propio paciente mientras "percibe" voces que considera ajenas. El estudio de Raji mostró también que los pacientes consideraban "real" la experiencia de la alucinación audioverbal cuando se activaba el núcleo accumbens, y se desactivaba la corteza del cíngulo posterior. Durante el acontecimiento de alucinaciones auditivas se ha observado un aumento de activación de la corteza insular (Nagai 2007).
b) Función ejecutiva: se ha observado una menor activación de la corteza prefrontal dorsolateral durante tareas cognitivas complejas como la fluidez verbal (Kindermann 1997), en paradigmas como el SET test, en el cual el sujeto debe generar listas de palabras relacionadas con una categoría semántica (por ejemplo, una lista de ciudades) o fonológica (por ejemplo, palabras que inician con la letra T). Estas tareas implican memoria de trabajo, resistencia a la interferencia, memoria semántica, acceso lexical y en general el hallazgo de hipofrontalidad durante tareas cognoscitivas, se considera uno de los más consistentes en la investigación de la esquizofrenia (Ramirez 2004). Asimismo, se ha observado que el tálamo presenta una reducción en la activación durante tareas ejecutivas que requieren memoria de trabajo y atención selectiva (Byne 2009). Un meta-análisis acerca de la función ejecutiva en pacientes con diagnóstico de esquizofrenia analizó 41 estudios, y concluyó que en estudios de resonancia magnética funcional que la función ejecutiva se relaciona con la activación de la corteza prefrontal dorsolateral, la corteza prefrontal ventrolateral, la corteza del cíngulo anterior y el tálamo. Con respecto a la esquizofrenia, el meta-análisis concluyó que los pacientes con este diagnóstico muestran una activación reducida en la corteza prefrontal dorso-lateral izquierda, la corteza rostral/dorsal del cíngulo anterior y el tálamo izquierdo (Minzenberg 2009).
c) Ideación delirante y percepción distorsionada del ambiente externo: alteraciones en la conectividad entre la corteza prefrontal derecha y otras áreas frontales (Salgado-Pineda 2007). Asimismo se ha observado mayor activación de la amígdala del lóbulo temporal en pacientes con sintomatología psicótica positiva (Aleman 2005).
d) Procesamiento emocional: Se ha observado que ante la presentación de estímulos emocionales, la amígdala presenta una reducción en la activación en pacientes con diagnóstico de esquizofrenia (Aleman 2005).
Tomografía por emisión de positrones (cuadro 13)
Las investigaciones realizadas con tomografía por emisión de positrones (PET) y la tomografía por emisión de fotón único (SPECT) permiten evaluar el metabolismo cerebral y los patrones de flujo sanguíneo cerebral regional, ya sea en reposo o durante tareas cognoscitivas, así como los patrones de distribución de radiofármacos en el cerebro, y su interacción con receptores y proteínas transportadoras de diferentes sistemas de neurotransmisión.
Estudios clásicos realizados con PET (Liddle 1992), mostraron una correlación interesante entre patrones sindromáticos y patrones de flujo sanguíneo cerebral regional en la siguiente forma:
a) El patrón sindromático de pobreza psicomotora, que incluye síntomas negativos afectivos y cognoscitivos, se relacionó con una perfusión cerebral alterada en la corteza prefrontal.
b) El patrón sindromático de desorganización, que incluye síntomas como la desorganización conceptual, se asoció asimismo con una perfusión cerebral alterada en la corteza prefrontal.
c) El patrón sindromático de distorsión de la realidad, que incluye síntomas positivos como las alucinaciones y los delirios, se asoció con una perfusión cerebral alterada en el lóbulo temporal medial.
Un estudio de revisión (Patel 2010) relacionado con pacientes con diagnóstico de esquizofrenia se concentró en el uso de trazadores de PET y en el modelamiento cinético para identificar anormalidades cerebrales regionales. La revisión concluyó:
a) Diversos trazadores han sido usados, incluyendo 11C, 15O-agua, 18F-fallypride, y L-3,4-dihidroxi-6-18F-fluorofenilalanina (18F-FDOPA).
b) Los hallazgos más consistentes muestran diferencias entre controles y pacientes con diagnóstico de esquizofrenia con respecto al contenido de dopamina en la corteza prefrontal, el giro anterior del cíngulo, y el hipocampo. Asimismo, se confirma un incremento en la densidad de receptores D2 en el estriado.
CLINIMETRÍA
La evaluación del diagnóstico o de la psicopatología mediante instrumentos estandarizados, hoy en día es imprescindible. En la mayor parte de situaciones clínicas, la evaluación estandarizada es conveniente y de gran utilidad. No obstante, en ningún caso debe sustituir a la exploración clínica, al contrario, complementarla (Lara 1995).
Aun cuando el empleo de escalas de evaluación no es indispensable, para una buena valoración, su empleo es de creciente utilidad y proporciona un tipo de información que otros profesionales pueden seguir fácilmente. Las escalas de evaluación son un instrumento útil para transmitir la información psicopatológica y para estandarizar un lenguaje clínico común. Los principales objetivos de la cuantificación de síntomas son:
1) Evaluar la intensidad de los síntomas
2) Ayudar en la administración de tratamientos específicos/diferenciales
3) Controlar el grado de respuesta al tratamiento
4) Evaluar con más detalle y precisión cierto tipo de síntomas
5) Ayudar en la clarificación del diagnóstico
6) Monitorizar la evolución natural de la enfermedad
Existe una gran variedad de escalas que se han empleado en la esquizofrenia, desde las que hacen mención a la psicopatología general, o aquellas que siguen a listas de síntomas específicos (Vázquez 1993).
Desde la descripción de Demencia precoz por Kraepelin, considerado el punto de partida de la psiquiatría moderna, se han intentado identificar un grupo de síntomas que diagnostiquen de forma fiable este trastorno. Existen numerosos instrumentos diagnósticos (entrevistas estructuradas) para disminuir las variaciones en el reporte clínico y reducir el sesgo del entrevistador (confiabilidad), así como instrumentos o escalas que evalúan síntomas o situaciones específicas.
Instrumentos de evaluación en esquizofrenia
El empleo de una escala determinada dependerá de los objetivos clínicos relevantes. Las que se describen más adelante han sido elegidas en función de la importancia científica y frecuencia de empleo:
Instrumentos diagnósticos (cuadro 14)
El diagnóstico de esquizofrenia mediante entrevistas estructuradas tiene una limitada aplicación en la práctica clínica debido al tiempo que requieren para su administración. Herramientas de aprendizaje sobre cómo explorar los síntomas pueden ser utilizadas como apoyo diagnóstico, y algunas de ellas para la evaluación psicopatológica. Su principal ventaja es que reducen la varianza de información diagnóstica, ya que uniforman tanto las fuentes de información como el tipo y número de síntomas evaluados (Rubinson 1991). Las entrevistas estructuradas para el diagnóstico se pueden clasificar en generales, de psicosis y de esquizofrenia. En el cuadro siguiente se describen las principales entrevistas, acompañadas del autor, las características de la misma y su validación al castellano (García 2011).
Escalas de síntomas específicos y otros aspectos relacionados con la enfermedad
Por su propia especificidad, estas escalas no son de utilidad general. Sin embargo, cuando se emplean en pacientes en los que nos interese evaluar más específicamente un grupo de síntomas, son muy útiles al aumentar el poder descriptivo. Seguidamente se describen aquellas escalas que más se emplean en la evaluación de un determinado síntoma o grupo de síntomas, así como aquellos instrumentos que aporten concepciones originales en la evaluación psicopatológica.
Síntomas prodrómicos
La esquizofrenia, al ser una enfermedad devastadora, requiere un diagnóstico oportuno con el propósito de hacer una intervención temprana y efectiva desde el primer brote psicótico o, incluso, antes. Por este motivo, los esfuerzos recientes van encaminados a la evaluación de los síntomas prodrómicos mediante instrumentos estandarizados dirigidos a detectar la presencia de síntomas específicos tempranos o los síndromes prodrómicos en sí.
Dos escalas que evalúan síntomas prodrómicos específicos son: el Thinking and Perceptual Style Questionnaire (TPSQ), diseñado por Linscott en 2004 y validado por Fonseca-Pedrero y cols., en el 2007; fue diseñadopara evaluar la esquizotipia, característica de personalidad que formaría parte del espectro esquizofrénico (Linscott 2004); y la Launay-Slade Hallucination Scale-Revised, LSHS-R fue desarrollada por Bentall y Slade en 1985, basándose en la presunción de que las experiencias alucinatorias son parte del continuo funcionamiento normal-psicosis; fue validada por Fonseca-Pedrero en el 2010 (Fonseca 2007, 2010).
Las escalas que evalúan el síndrome prodrómico en sí mismo son: Structures Interview for Prodromal Status (SIPS), desarrollada por Miller y McGlashan en el 2001. Se trata de una entrevista semiestructurada que sirve para diferenciar entre los síndromes prodrómicos y la psicosis u otros fenómenos clínicos, y así detectar a los sujetos con riesgo inminente de desarrollar psicosis; y la Scale of Prodromal Symptons (SOPS), de los mismos autores, fue desarrollada para evaluar la presencia e intensidad de signos y síntomas prodrómicos de la esquizofrenia (García 2011, Miller 2003).
Ideas delirantes
Existen numerosas escalas de evaluación de los delirios que se basan en la descripción más o menos extensa de las experiencias delirantes con base en su contenido. Estas escalas no aportan ventajas substanciales con respecto a la SAPS (cuadro mostrado anteriomente), en la que los delirios están relativamente bien recogidos por su contenido.
Una aproximación distinta de la evaluación de las experiencias delirantes por su contenido, está representada por la evaluación de dimensiones de la experiencia delirante. Kendler y cols., en 1983 elaboraron un instrumento para la evaluación de 5 dimensiones de los delirios (extensión, carácter extraño, sistematización e implicación) (Kendler 1983). En la misma línea de pensamiento, Garety y Hemsley en 1987 diseñaron una escala con 11 características o dimensiones de la experiencia delirante que son evaluadas por el propio paciente (Garety 1987). La concepción multidimensional tiene implicaciones para la conceptualización de la estructura de la idea delirante, el curso temporal y la resolución de la experiencia psicótica.
Alucinaciones
Al igual que lo que ocurre con las ideas delirantes, la sola descripción de los trastornos de la percepción atendiendo a la modalidad sensorial afectada, es insuficiente para capturar la complejidad de las alucinaciones. Se han desarrollado diversos procedimientos para la evaluación de los trastornos perceptivos a un nivel más fino y multidimensional como el Mental Health Research Institute Unusual Perceptions Schedule (MUPS) de Carter y cols. (1995); o el estudio Oulis y cols., de 1995.
Uno de los ejemplos más interesantes de esta aproximación está representado por la escala de alucinaciones de Chen y Berrios (1996). Estos autores han elaborado una escala, que además del tipo de modalidad sensorial, evalúa 11 características de las alucinaciones. La estructura de los síntomas se evalúa de forma complementaria a la del contenido, configurando un modelo multidimensional que puede variar de síntoma a síntoma.
Trastornos formales del pensamiento
Existen varias escalas para la evaluación de este tipo de síntomas, pero la más empleada y estudiada es la escala T.L.C. (Thought, Language, and Communication Scale) de Andreasen. Esta escala consta de 18 ítems que corresponden con descripciones clásicas de los trastornos formales del pensamiento (Andersen 1979). Existen tanto una traducción al español realizada por Obiols en 1985, así como un estudio de validación en España realizada por Peralta en 1992 (Obiols 1985, Peralta 1992).
Síntomas negativos
Como consecuencia del interés por este tipo de síntomas, se han desarrollado varias escalas para su evaluación. Con mucho, la SANS es la más empleada, habiéndose convertido en la de referencia (Andreasen 1984). Otras escalasson la Scale for Emotional Blunting (SEB) de Abrams y Taylor, diseñada en 1978 (Lewine 1983), la Negative Symptom Rating Scale (NSRS), de Iager y cols. (1985) y la Negative Symptoms Assessment (NSA) de Raskin y cols. (1993). Existen escalas de síntomas negativos derivadas del CPRS (Lindstróm 1996), del Arbeitsgemeinschaft für Methodik und Dokumentation in der Psychiatrie (AMDP), y del Present State Examination (PSE) (Häfner 2006). Un enfoque distinto en la evaluación y diagnóstico del síndrome negativo ha sido desarrollado por Carpenter al diferenciar entre síntomas negativos primarios y secundarios, y entre transitorios y persistentes (Carpenter 1988). Cuando los síntomas negativos son primarios (no debidos a depresión, acinesia por neurolépticos o deprivación social) y persistentes (presentes durante al menos un año) conforman un síndrome deficitario. Este síndrome es definido de manera categorial (presente vs ausente), e independiente de la presencia de síntomas positivos. Con el objeto de valorar con más precisión y fiabilidad los síntomas negativos del síndrome deficitario, han desarrollado el Schedule for the Deficit Syndrome (SDS); sin embargo, la diferenciación entre síntomas negativos primarios y secundarios aún no ha sido definida de forma satisfactoria (Kirkpatrick 1989).
Síntomas catatónicos
Hasta muy recientemente no se disponía de instrumentos estandarizados para la evaluación específica de estos síntomas. Rosebush y cols., operaron los síntomas motores descritos por Kahlbaum, y elaboraron criterios para el diagnóstico categorial del síndrome catatónico (Rosebush 1990). A finales del siglo XX, Bush en 1996 y Bráuning en 1998, desarrollaron dos escalas que contienen, respectivamente; 23 y 21 síntomas catatónicos (Bush 1996, Bráuning 1998). Probablemente la escala más completa de síntomas catatónicos es la escala modificada de Rogers que evalúa 36 síntomas catatónicos. Consta de dos subescalas que tienen por objeto la diferenciación entre síntomas motores secundarios a los neurolépticos y síntomas catatónicos primarios. De esta última escala existe una traducción al español. Hasta la fecha, y dado que las escalas disponibles no han sido extensivamente utilizadas, no existen datos comparativos sobre qué escala es la más apropiada para la evaluación de los síntomas catatónicos.
Síntomas depresivos
Los síntomas depresivos son evaluados con diferente grado de amplitud por las escalas BPRS, PANSS y de Krawiecka. En la esquizofrenia se ha utilizado con relativa frecuencia la escala de Hamilton para la depresión, y en menor medida la de Montgomery-Asberg. Estas escalas, sin embargo, tienen el inconveniente de que se componen de síntomas como inhibición motora, apatía, anhedonia y disminución de las relaciones sociales, todos los cuales se solapan con los síntomas negativos. Por esta razón, Addington y cols., en 1992 desarrollaron la escala de Calgary, siendo hasta ahora la única escala de depresión específicamente diseñada para su empleo en pacientes con esquizofrenia. Esta escala se compone fundamentalmente de síntomas cognitivos de la depresión, y ha demostrado la ausencia de solapamiento con los síntomas negativos. Existen varias traducciones de esta escala al español. Probablemente esta escala es la más apropiada para la evaluación de los síntomas depresivos en la esquizofrenia (Addington 1992).
Experiencias subjetivas
Además de los delirios y alucinaciones, en la esquizofrenia existe gran variedad de síntomas subjetivos o trastornos de la experiencia que son frecuentes en las diferentes fases de la enfermedad. La mayoría de estos síntomas son experiencias de tipo cognitivo de áreas tales como la pérdida de control, de percepción, de lenguaje, de pensamiento, motricidad, de automatismo y la sobreestimulación sensorial. Si no son explorados activamente, estos síntomas raramente son referidos por los pacientes de forma espontánea, por lo que deben ser evaluados mediante instrumentos estandarizados. Existen numerosas escalas para la evaluación de estos síntomas, como la Brief Assesment of cognition in schizophrenia BACS (Peralta 1994). Por su valor descriptivo destaca el Inventario Psicopatológico de Frankfurt, que ha sido empleado con relativa frecuencia en países hispanoparlantes (Jimeno 1996).
Falta de conciencia de enfermedad
Los tres principales componentes de la falta de conciencia de enfermedad (falta de conciencia de enfermedad propiamente dicha, la falta de conciencia de síntomas individuales, y el rechazo al tratamiento), se pueden evaluar mediante los tres ítems correspondientes del AMDP. Davis en 1990 desarrolló una escala semiestructurada para la evaluación específica de estos tres aspectos de la conciencia de enfermedad (David 1990). En la década de los noventa se elaboraron numerosas escalas, entre las que destaca por su amplitud la Scale to Assess Unawareness of Mental Disorder (SUMD). Esta escala tiene la ventaja de ofrecer una detallada descripción de la falta de conciencia, tanto de la enfermedad como de síntomas individuales. Su principal inconveniente es que requiere un elevado tiempo de aplicación (Amador 1993).
Otro instrumento útil y específico para evaluar el rechazo al tratamiento es el Drug Attitude Inventory (DAI), de Hogan, el cual evalúa la respuesta subjetiva a los neurolépticos. Fue validado en español por Robles-García en el 2004 (Hogan 1983).
Por último, existe una escala para valorar la funcionalidad en el paciente con esquizofrenia: Personal and Social Performance Scale (PSP), diseñada por Morosini y cols., en el 2000, la cual permite valorar niveles bajos de funcionamiento social, su calificación está basada en el juicio clínico con puntuaciones de 0 a 100, evalúa actividades socialmente útiles, las relaciones personales y sociales, cuidado de sí mismo y el comportamiento perturbador y agresivo (Morosini 2000).
* Sólo se requiere un síntoma del criterio A si las ideas delirantes son extrañas, o si las ideas delirantes consisten en una voz que comenta continuamente los pensamientos o el comportamiento del sujeto, o si dos o más voces conversan entre ellas.
TRATAMIENTO DE LA FASE AGUDA
Fase aguda: primer brote
Antes de iniciar esta sección es importante precisar varias consideraciones: el objetivo principal del tratamiento del paciente con esquizofrenia es mejorar la calidad de vida buscando la reintegración familiar, laboral y social de la persona que sufre este trastorno; se debe indicar el mejor tratamiento disponible y evaluar el costo-beneficio de la intervención farmacológica que se va a realizar, valorando la eficacia contra los efectos secundarios (Lehman et al 2004) (NICE 2010) [A1].
A pesar de que la prevalencia de la esquizofrenia es baja en comparación con otras enfermedades, el impacto que tiene en la vida del que la padece, al ser un trastorno crónico de larga evolución y que afecta tanto a la familia como a la gente que los rodea, incrementa los costos para los sistemas de salud. Por lo tanto, debe recibir atención lo más rápido posible y de la mejor calidad, por lo que se tratará de describir la mejor atención que se puede proporcionar a pesar de existir un abismo entre lo que se debe hacer y lo que se hace en realidad. De acuerdo con las estadísticas del Instituto de Salud Mental de Estados Unidos, 40% de los individuos que padecen esquizofrenia no reciben tratamiento, y en Baltimore, al 50% no se le realiza ninguna intervención; si estos datos son semejantes en todas las regiones del planeta, podemos concluir que la atención psiquiátrica adecuada y oportuna para los pacientes es sólo una ilusión. Sin embargo, debemos realizar las intervenciones que nos sean posibles, y esto será una mejoría del tratamiento (NICE 2010) [A1].
Es claramente evidente que desde la segunda mitad del siglo pasado, con el descubrimiento de la clorpromazina y su eficacia para mejorar los síntomas psicóticos, los antipsicóticos llegaron a establecerse como la piedra angular del tratamiento de la esquizofrenia. Estos medicamentos proporcionan una plataforma en la cual se pueden usar tratamientos adjuntos para aumentar los efectos de los mismos y tratar los síntomas residuales de la enfermedad; de tal manera que con el uso de antipsicóticos, el paciente debe alcanzar una mejoría importante para estar listo para su inclusión en programas de rehabilitación.
Al tratarse de una enfermedad crónica que afecta todos los aspectos de la vida del sujeto, el tratamiento deberá buscar tres metas: 1) reducir o eliminar los síntomas, 2) maximizar la calidad de vida y la función adaptativa del sujeto, y 3) promover y mantener la recuperación el mayor tiempo posible (NICE 2010) [A1].
El tratamiento del paciente con esquizofrenia se puede dividir en cuatro etapas: tratamiento en urgencias, de la fase aguda, fase de estabilización y mantenimiento a largo plazo.
Tratamiento en urgencias
La urgencia psiquiátrica puede presentarse en cualquier servicio, como un hospital psiquiátrico, un hospital general o en el consultorio; entonces el médico debe decidir, en ocasiones con información limitada o incompleta, la intervención que va a realizar.
La agitación y la violencia siempre han sido conductas de difícil manejo para nuestra sociedad, llegan a provocar trastornos y daños en los demás. Cuando dichas conductas se presentan en pacientes médicos o psiquiátricos, algunas intervenciones especiales deben tomarse en consideración. En el consultorio, las salas de emergencia o en las unidades de internamiento, pueden poner a los pacientes o a los miembros del equipo en riesgo (Currier 2006) [A2], (Binder 1999) [C3].
La agitación puede ser definida como una excesiva conducta motora y verbal, desorganizada, puede exacerbarse hasta convertirse en agresividad verbal o física en contra de objetos o personas. Técnicamente la violencia se define como agresión física en contra de personas. La clave para la seguridad es la intervención temprana para prevenir la progresión de la agitación a agresividad y violencia (Allen 2005, NICE 2012) [A1].
Si es posible, se deben ofrecer al paciente alternativas para la elección del tratamiento y, si es viable, tratar de calmarlo por medios verbales, estableciendo así una relación de confianza y colaboración para reducir la tensión y prevenir un incremento de la agitación, evitando con esto métodos más invasivos. Si estas estrategias no son suficientes, el uso de medicación es lo indicado. Los objetivos del tratamiento serán: prevenir posibles daños, controlar la conducta alterada, mejorar la sintomatología, lograr la tranquilización del paciente rápidamente, establecer una alianza terapéutica e iniciar el tratamiento a largo plazo. Por esto, se deben considerar los medicamentos que provocan efectos secundarios mínimos y que no afectan esta alianza. El uso de la restricción física debe ser el último recurso y se aplica solo por tiempo limitado, en tanto la medicación utilizada hace su efecto (Lehman et al 2004, NICE 2002) [A1].
Se considerará la posibilidad, según las circunstancias de cada caso, de ingreso en la unidad de hospitalización total u hospitalización parcial (hospital de día), en función de la evaluación del estado del paciente, la necesidad de tratamientos concretos, la función familiar, los apoyos sociales y las preferencias del paciente y su familia.
En este momento también se inicia la educación de los usuarios, el paciente y su familia. Ellos deberán ser informados sobre la naturaleza de su enfermedad y el tratamiento recibido, así como del pronóstico y de las diversas posibilidades de tratamiento tras el alta. Entre los aspectos importantes que deben evaluarse en el paciente están la agitación y las causas que la provocan; éstas pueden ser la conducta desorganizada, la agresividad y la acatisia (Buchanan 2009) [A3].
La conducta desorganizada, propia del subtipo de esquizofrenia del mismo nombre, se caracteriza por un comportamiento primitivo y desinhibido. Puede observarse a los pacientes con una actividad excesiva, pero sin una finalidad evidente.
Otra causa importante de agitación es la agresividad; se ha reportado que la frecuencia con la que se encuentran involucrados los pacientes con esquizofrenia en actos violentos es 4 veces mayor que la reportada para la población general, y que el 8% de las personas que cometen homicidio son diagnosticadas como esquizofrénicas. Los factores que provocan la conducta violenta en los pacientes son diversos y, generalmente, están relacionados con la sintomatología (habitualmente las alucinaciones y las ideas delirantes). Cuando la agresividad está bien planeada y dirigida específicamente a un objetivo, generalmente es secundaria a ideas delirantes que provocan respuestas afectivas negativas, como sucede en el caso de la esquizofrenia paranoide. La conducta puede ser excesivamente peligrosa, las ideas delirantes de control o religiosas provocan más frecuentemente actos violentos que las de ideas de persecución. La agresividad secundaria a la conducta desorganizada es indefinida y menos peligrosa. En ocasiones, los actos agresivos pueden ser desencadenados, aunque con una frecuencia menor de lo que se cree, por alucinaciones auditivas de tipo imperativo. Por otro lado, los pacientes con esquizofrenia que abusan de drogas y alcohol, y aquellos que sufren acatisia secundaria al tratamiento AP, tienen un riesgo alto de presentar conductas agresivas.
Por todo lo anterior, debe valorarse en forma acuciosa al paciente con el fin de intentar predecir el riesgo de agresividad en este tipo de sujetos. Así, deberán tomarse en cuenta al realizar la historia clínica los siguientes antecedentes:
a. la relación mostrada previamente entre la sintomatología y los actos violentos;
b. el grado de respuesta que el paciente ha tenido con los tratamientos; se observa una mayor frecuencia de agresividad en los pacientes con una respuesta deficiente a los AP;
c. factores de riesgo tales como los trastornos de personalidad antes del inicio del padecimiento o el abuso de sustancias;
d. la conciencia de la enfermedad o el nivel de introspección del paciente;
e. el cumplimiento con el tratamiento;
f. el juicio que hace de los actos violentos previos;
g. el grado en el cual el medio ambiente ha contribuido a la conducta violenta;
h. la relación del paciente con la víctima.
Cuando uno se encuentra ante un paciente agresivo, debe ser muy cuidadoso y definir rápidamente la situación; si la agresividad es inminente, el personal debe intentar hablar con el paciente para tranquilizarlo y explicarle, sin confrontarlo, que su actitud es inadecuada. Cuando se trata de controlar la agresividad, el objetivo terapéutico es tranquilizar al paciente para proteger tanto al enfermo como a su entorno; la restricción física podría ser necesaria, pero ésta deberá ser lo más breve posible.
La acatisia, que consiste en una sensación extremadamente desagradable de inquietud en el enfermo y que es secundaria a la administración de gran parte de los AP, incrementa la actividad motora sin finalidad evidente, ocasionando agitación en el sujeto. Es necesario evaluar cuidadosamente al paciente, ya que este efecto secundario puede confundirse con la sintomatología propia de la enfermedad y llevar al médico a prescribir una dosis mayor de AP, lo que en lugar de resolver el problema, lo agrava.
Antes de iniciar el tratamiento se debe considerar que la biodisponibilidad de cada medicamento es diferente, dependiendo de la vía de administración; los medicamentos parenterales presentan mayor biodisponibilidad que los orales.
Debido a ello, antes de iniciar el tratamiento se debe realizar una intervención verbal para valorar si es posible iniciar por vía oral. Se ha demostrado en diferentes estudios que la administración de olanzapina o risperidona reduce la agitación en forma importante (Villari 2008) [A2].
Cuando no es posible usar la vía oral, se recomienda la aplicación de formulaciones parenterales. Los más recomendados o utilizados en la práctica clínica son haloperidol, la olanzapina o zuclopentixol (Villari 2008) [A2].
Pueden utilizarse otras benzodiacepinas parenterales como diazepam, pero su absorción intramuscular es errática. Existen riesgos con el uso de benzodiacepinas como la sedación excesiva, agitación paradójica y paro respiratorio [B3]. Estos efectos secundarios limitan su uso, pero son mejor toleradas que los antipsicóticos de primera generación. De acuerdo con las Guías de Práctica Clínica, Diagnóstico y Tratamiento de la Esquizofrenia en el Primer y Segundo Nivel de Atención, específicamente en relación al manejo de la agitación, el lorazepam es el medicamento de primera elección; sin embargo, en México no se cuenta con presentaciones para administración intramuscular o sublingual en el Cuadro Básico y Catálogo de Medicamentos, Edición 2012 (Diario Oficial de la Federación, México, 21 de mayo 2013), por lo que generalmente se utilizan antipsicóticos.
Entre los antipsicóticos tenemos al haloperidol, disponible en presentación parenteral; tiene una eficacia muy importante, logrando el control de los síntomas rápidamente pero con el riesgo de efectos secundarios como la distonía de torsión, síntomas extrapiramidales, acatisia, disforia, además de lesión y dolor en el sitio de la inyección que pueden provocar molestias en el paciente, disminuir su cumplimiento con el tratamiento y la falta de cooperación del paciente durante la fase aguda de la psicosis. (Villari 2008) [A2]. Otro antipsicótico de primera generación disponible es zuclopentixol, también eficaz para el control de la agitación; sin embargo, se recomienda su uso con precaución. Aunque no se ha demostrado que su eficacia sea mayor o menor que haloperidol, su uso puede requerir menor aplicación de inyecciones. Las dosis altas parecen tener la misma eficacia que las dosis bajas, pero con el riesgo de producir efectos extrapiramidales y distonía de torsión muy severos (Jayakody 2012).
Otra formulación parenteral es olanzapina, que viene en presentación de 10 mg y se recomienda su uso hasta 30 mg/día. En los estudios realizados, su eficacia fue comparable a haloperidol y lorazepam, controlando rápidamente la agitación, respondiendo 80% de los pacientes con la primera administración. Se recomienda la aplicación con un intervalo de dos horas. Los efectos secundarios fueron menos frecuentes que con haloperidol y lorazepam, y fueron: náusea, vómito, ambliopía y somnolencia. Se evaluó la presencia de alteraciones del QTc y no tuvieron incrementos significativos; no obstante, debe evitarse su combinación con otros antipsicóticos y benzodiacepinas por el riesgo de muerte súbita. Los síntomas extrapiramidales y la distonía de torsión no se presentaron. Entonces demostró su eficacia, una buena tolerabilidad y un perfil de seguridad adecuado. (Wright 2001) [A1], (Breier 2002) [A1]. En el estudio de transición a formulación oral se mantuvo el control de la agitación y se incrementó la mejoría de la sintomatología (Wright 2003). Aripiprazol es otro antipsicótico de nueva generación que ha producido una presentación para uso parenteral, pero dicha presentación no está disponible en México; además, es un producto de liberación prolongada por lo que no se recomienda su uso en la fase de agitación (Kane 2012).
Tratamiento durante la fase aguda
Ya controlada la situación de emergencia se debe realizar un diagnóstico más preciso de las causas de la agitación para tratarlas en forma adecuada y realizar un diagnóstico diferencial, ya que la agitación puede ser ocasionada por uso concomitante de drogas de abuso o acatisia, y merece un tratamiento adecuado.
Un episodio psicótico agudo o una recaída están caracterizados por síntomas psicóticos severos que incluyen alucinaciones, ideas delirantes, pensamiento y lenguaje desorganizados. La meta específica de esta fase es resolver o disminuir los síntomas psicóticos y mejorar la función psicosocial.
Durante la fase aguda, el primer paso es la realización de un diagnóstico correcto para iniciar en forma adecuada el tratamiento farmacológico, psicoterapéutico y psicosocial, lo que permitirá una mejor adherencia al tratamiento. Esta valoración ayudará al médico a determinar los síntomas basales y excluir enfermedades médicas o neurológicas que puedan causar los síntomas psicóticos. Ya realizado el diagnóstico se deciden los objetivos del tratamiento, los cuales deberán ser claros y realistas, incluyendo las diferentes alternativas de tratamiento para incidir sobre los síntomas positivos, negativos, cognoscitivos, otros problemas médicos y problemas psicosociales (Kreyenbuhl J et al. 2010) [A1].
Para iniciar el tratamiento es necesario tomar en cuenta la fase en la que se encuentra la enfermedad, las características del paciente, la relación y disposición de sus familiares, el deterioro que ha provocado el trastorno y las redes de apoyo. Es muy importante establecer una alianza terapéutica con el paciente, ya que esto permitirá al médico obtener mayor información acerca del padecimiento del sujeto y, al paciente, confianza, con lo que se logrará una mayor adherencia al tratamiento. Para esto es necesario involucrar al paciente en la decisión del tratamiento, considerar sus preferencias, deseos y esperanzas en el mismo. Asimismo, es muy importante el compromiso hacia el tratamiento por parte de los familiares, ya que de su participación depende en gran medida la evolución del paciente.
Después de la evaluación inicial se decide el lugar en el cual se comenzará el tratamiento, que en estos casos puede ser en la comunidad, el hogar del sujeto o en un recinto hospitalario. Acerca de este último, el internamiento puede realizarse en forma voluntaria, involuntaria o por orden judicial. Las causas de un internamiento pueden ser: riesgo provocado por la enfermedad para el paciente o para la gente que le rodea. El riesgo puede ser la agresividad dirigida contra sí mismo o hacia los demás, aunque también el riesgo puede ser provocado por los síntomas negativos que lleven al sujeto a descuidar su autocuidado, a dejar de comer o cuidar su salud y poner con esto en riesgo su vida. También es necesario considerar que el paciente pueda ingresar a un hospital para un cambio de antipsicótico y que, al realizarlo, se corre el riesgo de una exacerbación de la sintomatología. Otra causa podría ser social, como protección contra el medio que lo rodea.
En la fase aguda de la psicosis, los objetivos del tratamiento son: evitar el daño para el paciente y los demás, disminuir los síntomas psicóticos y los síntomas asociados (como la ansiedad, depresión, agitación), evaluar y modificar los factores que precipitaron la exacerbación, alcanzar un mejor funcionamiento, elaborar un plan de tratamiento a corto y largo plazo, asegurar un tratamiento posterior y reinsertarlo en su comunidad.
Inicialmente deberá realizarse una evaluación completa tanto psiquiátrica como física, conocer las manifestaciones psiquiátricas del paciente, los antecedentes, las respuestas a los tratamientos previos, el cumplimiento con los mismos, efectos secundarios y las preferencias del paciente, lo que proporcionará una mejor oportunidad de tratamiento. Deberá realizarse una exploración física integral, una valoración de movimientos anormales preexistentes, tomar un electrocardiograma y un análisis de laboratorio como mínimo, biometría hemática completa, química sanguínea con perfil de lípidos y examen general de orina, búsqueda de drogas en orina, pruebas de función hepática, renal y tiroidea. El electroencefalograma, la resonancia magnética o las pruebas neuropsicológicas se deben realizar si son pertinentes de acuerdo con la evaluación inicial.
Al iniciar la evaluación deben observarse los factores que pudieron contribuir a la recaída, determinar si el paciente cumple con el tratamiento o si se rehúsa a tomar la medicación; entonces se buscará otra opción terapéutica.
También se debe trabajar con la familia, explicarles el motivo de la recaída, disminuir su estrés y pedirle apoyo para el paciente. Es frecuente que los familiares experimenten conflictos al enterarse de la enfermedad del paciente. Esto puede disminuirse con la psicoeducación respecto a los síntomas y conductas presentes durante la enfermedad, la vulnerabilidad del paciente al estrés y la forma de afrontar la conducta alterada del paciente, que puede provocar alteraciones entre los miembros de la familia. Esta educación le permitirá a la familia obtener un grado de funcionamiento mayor, apoyar al paciente en la evolución de su enfermedad y resolver con mayor facilidad los conflictos y problemas que se vayan presentando.
Es muy importante evaluar la presencia de ideación suicida y de alucinaciones auditivas imperativas, a través de intentos previos y ánimo depresivo que pueda predecir una conducta suicida, tomando precauciones en caso de su existencia. También es necesario considerar el riesgo de agresividad tanto verbal como física contra las personas que le rodean. A pesar de que la mayoría de los pacientes con esquizofrenia no son violentos, una pequeña parte de ellos sí lo son; esto limita la continuidad del trabajo e incrementa la preocupación de las familias. Las madres que viven con hijos con esquizofrenia que abusan de sustancias tienen un riesgo mayor de ser agredidas. Los pacientes con un nivel bajo de funcionamiento y frecuentes contactos con familiares y amigos tienen una probabilidad mayor de volverse violentos.
La mayoría de los pacientes que tienen conducta violenta presentan disminución de la misma a las pocas semanas del inicio del tratamiento con antipsicóticos y, cuando es aplicable, después de suspender el consumo de sustancias. En dichos pacientes, asegurarse de la continuidad del tratamiento y la abstinencia de sustancias constituye la prevención a largo plazo de la violencia. Además, existe un grupo de pacientes que tiene una conducta agresiva persistente a pesar del tratamiento y de la abstinencia de sustancias. Estos pacientes contribuyen en forma exagerada al número de actos violentos observados en los hospitales psiquiátricos; en algunas revisiones se ha encontrado que el 5% de los pacientes con esquizofrenia son responsables del 53% de los incidentes violentos (Convit 1990) [B2], (Owen 1998) [B2].
En los pacientes con violencia ocasional es necesario determinar la causa de la misma. En algunos pacientes la causa de la no adherencia es la presencia de síntomas extrapiramidales, por lo que se recomienda cambiar por un antipsicótico atípico. Otros pacientes no cumplen con su tratamiento porque lo olvidan; en ellos es necesario considerar la aplicación de antipsicóticos de depósito (Popovic 2011) [B2].
Sin embargo, se detectan problemas que están más relacionados con la prescripción médica, asociados con el manejo de dosis inapropiadas (sobredosificaciones que causan efectos secundarios importantes en el enfermo e impiden gravemente el desarrollo de una vida en límites de normalidad), de prescripción de neurolépticos no adecuados en función de una estrategia de prevención de recaídas, de recomendar tratamientos excesivamente cortos en el tiempo, etc. Por otra parte, un cierto número de psiquiatras desconocen la magnitud del riesgo de recaída en esta enfermedad, detectándose una tendencia a minimizarlo y, paralelamente, a sobrevalorar el riesgo de efectos secundarios. En este sentido se destaca la importancia del acceso a información actualizada sobre el tema por parte del psiquiatra general y del establecimiento de protocolos farmacológicos dirigidos a la prevención de recaídas, con especial referencia a la duración de los tratamientos y a las posologías mínimas eficaces.
La selección de un antipsicótico debe estar basada en la respuesta terapéutica previa, la tolerabilidad, el perfil de efectos secundarios, la posible ruta de administración, las preferencias del paciente y los objetivos a largo plazo. Los antipsicóticos de segunda generación pueden ser considerados de primera línea (Davis 2003) [B1], incluso, o principalmente, en pacientes con primer episodio. La única limitante sería el costo del tratamiento.
Es importante al iniciar el tratamiento elegir la dosis adecuada para maximizar los beneficios y disminuir los efectos secundarios.
Con base en la evidencia publicada, todos los antipsicóticos de primera generación o típicos son igualmente efectivos; lo que varía es la potencia o el perfil de efectos secundarios. El rango de dosis efectiva va de 100 mg de equivalentes de clorpromazina (que equivale aproximadamente a 2 mg de haloperidol), hasta 700 mg de equivalentes de clorpromazina (14 mg de haloperidol) (Woods 2003) [B1].
Los antipsicóticos atípicos deben iniciarse con dosis bajas dependiendo de la sintomatología, realizando incrementos de acuerdo con la evolución de los pacientes. Si un paciente tolera adecuadamente la dosis dentro del margen terapéutico, debe mantenerse al menos durante tres semanas ya que el tiempo para alcanzar una respuesta es gradual (Agrid 2006) [B2].
Si después de estas tres semanas el paciente no responde al tratamiento y éste se encuentra en una dosis adecuada, se deben evaluar varios factores para determinar la causa de la falla, tales como el incumplimiento de la administración, la farmacocinética y la no respuesta al fármaco establecido. Si es por falta de cumplimiento habría que pensar en utilizar medicamentos antipsicóticos de acción prolongada (ver sección de medicamentos de acción prolongada). Si es por la farmacocinética habría que utilizar estrategias como la disminución del tabaco, la administración con los alimentos (ziprasidona) o la potencialización con otros fármacos como la fluoxetina con olanzapina y clozapina, así como evitar medicamentos como la carbamazepina, entre otros (Chan 2007; de León 2012; Citrome 2009; Jiang 2013). Y si es por no respuesta, habría que empezar a tratarlo como un paciente resistente (sección de resistencia).
Cuando un paciente es un respondedor parcial puede pensarse en un incremento de la dosis y, con esto, observar la respuesta. Debe vigilarse la presencia de efectos secundarios, sobre todo con los antipsicóticos convencionales en los cuales se ha demostrado la relación con la dosis del medicamento (Buckley 2008) [A2].
Otra alternativa es el cambio a otro antipsicótico. En lo que respecta a los antipsicóticos de primera generación, esta decisión aún es controversial ya que la falta de respuesta de un convencional predice la pobre respuesta cuando se utiliza otro convencional. La elección debe inclinarse por un antipsicótico de segunda generación (Stahl 2013) [A1].
ANTIPSICÓTICOS
El avance de la farmacoterapia en las enfermedades mentales desde la introducción de los medicamentos psicotrópicos al comienzo de los años 50 del siglo XX, junto con las neurociencias y la aplicación de la biotecnología en la psicofarmacología, han abierto una vía de investigación para los nuevos fármacos con base en su afinidad por receptores específicos, además de diferentes vías metabólicas de los fármacos, lo que proporciona tratamientos eficaces, seguros, con el fin de mejorar la calidad de vida de quienes padecen una enfermedad mental. Son medicamentos, principalmente, utilizados para los síntomas psicóticos de diversas enfermedades, como la esquizofrenia, el trastorno bipolar, la depresión psicótica, entre otras.
Los antipsicóticos de baja potencia precisan ser administrados a dosis altas para lograr el efecto terapéutico deseado, por lo que predomina su acción sedante (clorpromazina y levomepromazina). Los de alta potencia, en cambio, precisan dosis inferiores y muestran mayores efectos neurológicos (haloperidol, trifluoperazina). Existen diferencias en su perfil de acción clínica. El perfil de efectos adversos puede determinar la elección de un antipsicótico con un efecto predominantemente anticolinérgico (por ejemplo, perfenazina) o extrapiramidal (por ejemplo, haloperidol), según las características del paciente (edad, deterioro intelectual, estado físico) (Royal australian guidelines 2005).
El efecto sedativo de los antipsicóticos de primera generación puede ser interesante para otras indicaciones; así, en pacientes agitados o de elevado nivel de ansiedad, los antipsicóticos de alto poder sedativo (clorpromazina, levomepromazina, zuclopentixol) son los fármacos de elección (Groleger 2007).
Antipsicóticos típicos
Los antipsicóticos han sido componente esencial en el tratamiento de la esquizofrenia por más de 50 años. Pese a que hay muchas áreas de la enfermedad que no se ven impactadas por los fármacos, y pese a que producen diferentes tipos de efectos secundarios, no hay duda respecto a la utilidad que tienen (Leucht 2008) [A1], (Prien 1968) [B3], (Gilbert 1995) [A3], (Lewis 2000) [B3], (Miyamoto 2004) [A3].
Los antipsicóticos de primera generación se caracterizan por ser antagonistas competitivos de los receptores dopaminérgicos, aunque también actúan sobre receptores de otros neurotransmisores (adrenérgicos, muscarínicos, serotoninérgicos, etc.). Además, son más eficaces frente a los síntomas positivos, y menos en los síntomas negativos; producen muchos efectos adversos y, en general, no son muy bien aceptados por los pacientes (McEvoy 2009).
Los antipsicóticos típicos (APTIs) son un grupo farmacológico heterogéneo cuya acción más importante es el bloqueo de los receptores tipo 2 de dopamina D2 (McEvoy 2009). El bloqueo de los receptores D2 en el circuito mesolímbico tiene un poderoso efecto sobre algunas manifestaciones psicóticas agudas, especialmente sobre sus repercusiones conductuales, pero con beneficios menos considerables cuando se usan a largo plazo (Lieberman 2005), ya que la mayor parte de las personas que los toman presentan síntomas residuales. Algunas de estas sustancias son relativamente selectivas en su unión a los receptores D2, como la perfenazina y otros (por ejemplo, la tioridazina), tienen un perfil muy amplio de unión a diferentes tipos de receptores cerebrales, como son los muscarínicos, histamínicos y alfa-adrenérgicos, entre otros, lo cual no se traduce en beneficio clínico y sí en una gran cantidad de efectos secundarios. Entre estos, los más comunes y severos son los extrapiramidales, la disfunción sexual, la hipotensión ortostática y, cuando son usados por periodos prolongados, la disquinesia tardía (Arana 2000).
Los antipsicóticos de primera generación son poco eficaces sobre la sintomatología negativa al carecer la vía dopaminérgica mesocorticoprefrontal de autorreceptores dopaminérgicos; estos fármacos no actuarían sobre ella y prácticamente no tendrían eficacia terapéutica sobre los síntomas negativos primarios (Worrel 2000).
Los síntomas negativos de la enfermedad también responden bien (Goldberg 1985) [B3], (Leucht 1999) [A1]); sin embargo, en muchos casos provocan síntomas negativos "secundarios" con su uso, lo cual impide evaluar adecuadamente los beneficios versus los riesgos, y el resultado final en la clínica es insatisfactorio. Se había supuesto que los AP-Tls contribuían al deterioro cognitivo en las personas con esquizofrenia (Cleghorn 1990 Sweeney 1991); sin embargo, datos recientes indican que pueden tener efectos benéficos sobre la cognición (Mishara 2004) [A1]. También se les asoció con el empeoramiento o inducción de manifestaciones afectivas en el curso de la enfermedad.
Los efectos clínicos a corto plazo, tanto de los "típicos" como de los "atípicos", que comienzan en cuestión de minutos cuando son aplicados por vía parenteral y de minutos a horas cuando se administran por vía oral, se hacen evidentes tranquilizando al paciente y controlando su conducta, y no necesariamente mediante la disminución de la actividad psicótica. Una vez que se aplican, el paciente disminuye su actividad motriz, se tranquiliza y deja de transformar sus vivencias patológicas en conductas patológicas, sin que esto se deba invariablemente a los efectos motores que pueden provocar severa rigidez muscular. Más bien se debe a una desconexión entre el pensamiento o la emoción y la acción motora; esto es evidente cuando al entrevistar al paciente una vez que los fármacos han hecho efecto, el enfermo nos sigue relatando las mismas vivencias mórbidas, pero deja de actuarlas, obteniéndose como resultado el control de la conducta disruptiva.
Cuando se usan los APTIs, se provoca bloqueo de los receptores D2 del circuito mesolímbico con un mecanismo de bloqueo por despolarización, mismo que explica sus efectos terapéuticos. Este mecanismo es de todo o nada, no es un proceso paulatino, una vez alcanzado el umbral no es necesario, ni clínicamente útil, aumentar la dosis ya que no se obtendrá beneficio alguno (McEvoy 1991) [B1]. Por el contrario, al aumentar la dosis sin la monitorización adecuada, se ocasiona un considerable aumento en los efectos indeseables. La relación dosis/respuesta no es lineal en términos de la acción antipsicótica, pero sí lo es con relación a los efectos indeseables. Este conocimiento no estaba generalizado cuando se usaron con mayor frecuencia los APTIs hace más de 20 años, y muchos clínicos los usaban en dosis crecientes esperando infructuosamente mejores efectos antipsicóticos.
No solo no se obtenía beneficio clínico sino que se aumentaban notablemente los efectos indeseables por alteración en el balance entre la dopamina y la acetilcolina. Los efectos secundarios a corto plazo son: parkinsonismo, sialorrea, visión borrosa, estreñimiento y fallas cognitivas. Para contrarrestar estos efectos se requería el uso de fármacos que los disminuyeran, cerrando con ello un ciclo pernicioso de aumento de dosis del medicamento antipsicótico, atenuación de sus efectos indeseables con anticolinérgicos y posterior incremento del primero, dejando vulnerables a los pacientes para el desarrollo de complicaciones muy severas y difíciles de manejar, como la disquinesia tardía.
Para obtener resultados terapéuticos se deben administrar dosis que ocupen el 60-70% de los receptores D2. El nivel de ocupación puede evaluarse con facilidad realizando examen neurológico al paciente para determinar el tono muscular y los reflejos antes de iniciar los APTIs, y monitorizarlos conforme se incrementan las dosis. Cuando aparecen manifestaciones leves de bradiquinesia y rigidez es altamente probable que se haya ocupado la cifra de receptores que es necesaria para obtener como resultado los efectos terapéuticos con un mínimo de efectos indeseables. El porcentaje de ocupación de receptores también puede evaluarse mediante una prueba clinimétrica sencilla, la prueba de Haase, que evalúa la bradiquinesia y la rigidez de acuerdo con el tamaño de la letra con la que el paciente escribe una frase predeterminada, igualmente antes y después de iniciado el tratamiento, ya que el paciente comenzará a disminuir el tamaño de las letras. En caso de que el paciente no responda adecuadamente y ya hayan aparecido las manifestaciones secundarias, es decir, que no presente desde los 2-3 días de iniciado el tratamiento indicios de modificación de las variables clínicas y ya tenga datos de bradiquinesia y rigidez, en lugar de aumentar innecesariamente la dosis, será mejor considerar el cambio de medicamento por uno de una familia farmacológica diferente (de Haan 2004, Seeman 2002).
Los rangos de dosificación de los APTIs permiten al médico diseñar una intervención adecuada para cada paciente, tomando en consideración dos elementos básicos: los indicios de respuesta en la evaluación de las variables del padecimiento y la aparición de efectos indeseables; desafortunadamente, este principio básico frecuentemente fue, y sigue siendo, pasado por alto, con lo cual se ocasiona una considerable cantidad de efectos indeseables que podrían ser fácilmente evitados.
Un buen ejemplo de lo que se debe hacer lo representa el uso de carbonato de litio: la dosis se ajusta de acuerdo con la condición clínica del paciente y se monitoriza mediante la litemia. Aun cuando el paciente tuviera una concentración de litio en suero dentro del rango terapéutico, pero presentara efectos secundarios neurológicos, a ningún clínico se le ocurriría incrementar la dosis debido a que el umbral de respuesta para ese paciente está en esos niveles. A nadie se le ocurrió diseñar un medicamento "corrector" para disminuir las manifestaciones neurológicas del litio una vez que comienzan los efectos indeseables. ¿Por qué sí se hizo esto con los antipsicóticos? Es un misterio. Probablemente fue bajo la lógica de la "camisa de fuerza farmacológica", es decir, para valerse de los efectos secundarios y los efectos neurolépticos de los fármacos con el propósito de controlar conductualmente a los pacientes, aun cuando no hubiera control psicopatológico.
Antipsicóticos atípicos
La introducción de los antipsicóticos atípicos (APATs) ofrece un perfil farmacológico diferente al bloqueo D2 ya que tienen, además, capacidad para bloquear receptores 5HT2, con lo cual se presenta una disminución y no un enmascaramiento de los efectos indeseables que se ocasionaban con los APTIs, especialmente en relación con las alteraciones motoras. Desgraciadamente los APATs tienen un perfil de impacto metabólico más acentuado que los que tienen los APTIs (Seeman 2002).
Los antipsicóticos de segunda generación, llamados atípicos, han cambiado el perfil de riesgo/beneficio de este grupo terapéutico.
Un criterio clínico importante para determinar si un antipsicótico es atípico es que debe tener menor probabilidad de producir síntomas extrapiramidales. Otro criterio, esta vez bioquímico, es el antagonismo dopaminérgico/ seroto-ninérgico (Seeman 2002).
Otra propuesta de menor incidencia de efectos extrapiramidales de los antipsicóticos atípicos es su baja ocupación de los receptores D2, o bien, la llamada constante de disociación, en donde se habla de un fenómeno de disociación rápida del neurotransmisor en los receptores dopaminérgicos. Estudios con PET muestran que la ocupación del receptor D2 por la risperidona es similar a la de antipsicóticos típicos, presentándose, a dosis altas, síntomas extrapiramidales. Se observa que risperidona a dosis bajas (entre 2 y 4 mg/día), debido a su baja unión a receptores D2, produce menos efectos secundarios al igual que amisulpride; olanzapina también tiene una alta afinidad para D2 en el estriado mayor que la clozapina y quetiapina; aripiprazol es un agonista parcial de los D2 y presenta una baja afinidad por los receptores D4 (Seeman 2002).
Otra de las teorías por las cuales se explica la menor incidencia de efectos colaterales es aquella que postula que los antipsicóticos atípicos producen un bloqueo de los 5HT2A de estos fármacos, mitigando los efectos de su antagonismo D2 en el estriado (Lieberman y cols., 1998). Por lo tanto, una de las propiedades farmacológicas que parece estar relacionada con la acción de los atípicos es la proporción entre el antagonismo de los receptores D2 y 5HT2A. Algunos antipsicóticos atípicos muestran una baja afinidad por los receptores alfa 1 y 2, por lo que presentan menos efectos secundarios anticolinérgicos como sequedad de boca y trastornos de la acomodación (Worrel 2000).
En conclusión, los efectos clínicos de la medicación antipsicótica están directamente relacionados con sus propiedades farmacológicas y reflejan sus afinidades por varios receptores neurotransmisores (Leysen y cols 1993, Remington y Kapur, 1999) Las interacciones con los receptores D1, D2, D3, D4 y 5HT2A (así como el antagonismo funcional de los receptores de glutamato), las interacciones con adrenorreceptores, receptores histamínicos, muscarínicos y colinérgicos son relevantes para los efectos secundarios. Los fármacos atípicos no son homogéneos, son farmacológicamente diversos (Worrel 2000).
Actualmente se deben considerar como la primera opción de tratamiento para la esquizofrenia (Davis 2003) [A1], ya que tienen un mejor control de los síntomas negativos, además de la seguridad y la tolerabilidad al presentar menor riesgo de producir síntomas extrapiramidales. Dentro de las desventajas que pueden tener los antipsicóticos atípicos se encuentran las alteraciones en el metabolismo de los carbohidratos y lípidos, produciendo alteraciones en el metabolismo de la glucosa, dislipidemias y alteraciones cardiovasculares. En el caso particular de la clozapina, pueden producir disfunciones sexuales y agranulocitosis.
Hoy día existen antipsicóticos de segunda generación en presentación parenteral para el manejo de agitación psicomotriz, como son olanzapina y ziprasidona.
Se cuenta recientemente con otros dos antipsicóticos atípicos: paliperidona, la cual es un metabolito activo de la risperidona que bloquea los receptores serotoninérgicos 5HT2A, dopaminérgicos D2 y adrenérgicos al (Chue 2012). Asimismo, con comprimidos de liberación prolongada y el sertindol, el cual presenta afinidad por los receptores 5HT2C, 5HT2A, D2, αl y α2, sin afinidad por receptores histaminérgicos, por lo que es probable que produzca menos sedación. Los efectos adversos más frecuentes de sertindol son congestión nasal, hipotensión postural (generalmente durante el escalado de dosis), sedación, taquicardia, disminución del volumen eyaculatorio en el 20% de varones tratados (sin asociarse con disminución de la libido ni alteraciones de la función eréctil) y aumento de peso. Otros fenómenos menos frecuentes son edema periférico, sequedad de boca, rinitis, disnea, parestesias; rara vez, convulsiones e hiperglucemia. Cabe mencionar la presencia en el 3% de pacientes tratados con sertindol de una prolongación en el QT del electrocardiograma mayor o igual a 500 mseg, sin taquiarritmia ventricular asociada pero con posibilidad de vulnerabilidad para desarrollar arritmia ventricular (Karamatskos 2012).
Comparación de antipsicóticos típicos vs. atípicos
Se han realizado múltiples estudios que comparan la eficacia, tolerabilidad y efectividad de los APTIs versus los APATs, con resultados controversiales ya que las ventajas atribuidas a los APATs se obtuvieron de estudios en donde el comparador era generalmente haloperidol usado en dosis muy elevadas, con los predecibles resultados a favor de los APATs (Leucht 2009, Jones 2006). Por otro lado, y prácticamente usando una estrategia de investigación opuesta a la citada anteriormente, en el estudio CATIE se compara un típico, la perfenazina, versus varios atípicos en un diseño que favorecerá en gran medida los resultados a favor de la primera (Stroup 2007) [B1].
Si bien es cierto que debemos considerar los resultados de 2 grandes estudios de efectividad (Lieberman 2005) [B1] (Jones 2006) [A2], en varios meta-análisis (Martin 2006) [A1] recientes se han demostrado los beneficios de los APATs versus los APTIs con relación a los abandonos, mejora en la cognición y disminución en los efectos motores indeseables (Davis 2005) [B3]. También hay evidencia de que los APATs son superiores a los APTIs frente al mejoramiento de la cognición, y son claramente mejores respecto a la disminución de la aparición de disquinesia tardía; la cifra de esta grave complicación es de menos de 1% con los APATs contra el 3-5% de los APTIs (Correl 2004, Margolese 2005).
Algunos autores, por ejemplo McEvoy en 1995, han sugerido que el uso de dosis adecuadas de los fármacos típicos disminuiría las diferencias que tienen con los APTIs.
Por otro lado, las desventajas respecto a la ganancia de peso ocasionada por los APATs durante las primeras semanas de tratamiento se desvanecen cuando las comparaciones se hacen en tratamiento por tiempo prolongado. En un estudio con asignación al azar, controlado, a un año de tratamiento, en pacientes vírgenes a tratamiento, tratados con haloperidol, olanzapina y risperidona, la ganancia promedio de peso de todos los grupos fue de 10.4 kg (Perez 2008). En consecuencia, los efectos metabólicos de los fármacos típicos usados por tiempo prolongado son similares en algunos aspectos a sus contrapartes atípicas. También se sabe que los efectos extrapiramidales contribuyen a incrementar el estigma y éste ocasiona mayor abandono del tratamiento (Adams 2003).
Que los APATs sean en verdad clínicamente superiores a los APTIs es aún materia de discusión, pero en la actualidad los primeros se han convertido en las sustancias de primera elección en el tratamiento de la esquizofrenia, según se confirma al revisar la mayoría de las guías de tratamiento para esta entidad.
Un reporte (Heres 2006) analiza 42 estudios patrocinados por la industria farmacéutica en el que se comparan los APTIs versus los APATs, encontrando que diferentes comparaciones entre las mismas dos sustancias reportan resultados diferentes, dependiendo de quien haya patrocinado el estudio. Sabemos que los estudios patrocinados por la industria farmacéutica, llamados estudios de eficacia, responden a la pregunta "¿funcionará este tratamiento en condiciones ideales?", mientras que los estudios de efectividad se diseñan para responder a la pregunta "¿funcionará este tratamiento en las condiciones clínicas ordinarias?" (March 2005; Keefe 2007).
Los hallazgos del CATIE (Keefe 2007) sugieren que en la fase de mantenimiento, el abandono o el cambio del tratamiento es más bien la regla que la excepción, independientemente del tipo de antipsicótico que se use, lo cual indica que ni el paciente ni el médico están satisfechos con los resultados. En el mismo CATIE se evaluó la dimensión cognitiva; a los dos meses la mejoría era muy pobre independientemente del tipo de fármaco usado y no se encontraron diferencias neurocognitivas entre la perfenazina y los APATs. Pero a 18 meses de tratamiento se encontró mejor desempeño cognitivo en los que recibieron perfenazina en comparación con los demás (Keefe 2007).
Los resultados del CUtLASS (Jones PB 2006) [A2] y del CATIE indican que no hay ventajas en la eficacia de los APATs versus los APTIs. La diferencia básica radica en el perfil de efectos secundarios, y es esto lo que determina la elección del fármaco más apropiado para cada paciente.
Otro estudio, el Estudio Europeo sobre el Primer Episodio de Esquizofrenia (EUFEST) (Fleischhacker WW, 2005), fue un estudio abierto, con asignación de tratamientos al azar, que se enfocó en la comparación de la efectividad de los antipsicóticos en el tratamiento del primer episodio de la enfermedad. Las razones para elegir pacientes en su primer episodio fueron debidas al posible efecto sobre la respuesta en aquellos pacientes que previamente ya habían recibido algún tipo de antipsicótico por tiempo prolongado. Se comparó el haloperidol con amisulprida, olanzapina quetiapina y ziprasidona, siendo la variable principal la causa de abandono por cualquier motivo. La reducción de síntomas no fue significativa entre unos y otros.
Sin duda, las opciones de tratamiento farmacológico para las personas con esquizofrenia son mejores ahora que hace un cuarto de siglo; sin embargo, prácticamente todos los antipsicóticos son, en términos generales, igualmente efectivos en el manejo del primer episodio y de los casos de esquizofrenia crónica.
La diferencia esencial en este estudio, y en muchos más, que tiene considerable relevancia clínica, es el perfil de efectos secundarios, siendo los extrapiramidales más frecuentes con el haloperidol y los APTIs en general, y los de ganancia de peso y metabólicos, en general, con los APATs.
MANTENIMIENTO DEL TRATAMIENTO
(cuadro 1)
La duración del tratamiento está determinada por las características clínicas del paciente, en primer episodio o con la remisión completa de su sintomatología; el tiempo que deben ser administrados al paciente oscilará entre 12 y 24 meses. Los pacientes que han tenido varios episodios o no tienen la remisión completa de la sintomatología, tendrán que tomar el medicamento de manera indefinida (Freudenreich 2007).
La dosis del medicamento debe mantenerse de 6 meses a un año, con la cual los síntomas pueden remitir, para posteriormente dejar una dosis que hemos llamado "mínima (prevención de recaídas) necesaria (efectos adversos)", que en la mayoría de los casos equivale al cincuenta por ciento de la dosis usada en la fase aguda. Los incrementos o disminuciones del medicamento dependerán básicamente de la evolución del cuadro clínico (Schooler 1997).
Los ajustes al tratamiento se deberán hacer con intervalos de dos semanas. Si el paciente no tiene una buena adherencia terapéutica, la cual puede presentarse debido a los efectos colaterales del medicamento, por la falta de conciencia de enfermedad o por no tener supervisión por parte de la familia de la toma de medicamentos, se deberá recurrir a los antipsicóticos de depósito y a las intervenciones psicosociales (Gardner 2010) [A3].
En algunos casos se llega a tener al paciente, por periodos cortos, con un antipsicótico oral y otro de depósito, hasta su estabilización, utilizando posteriormente el medicamento de depósito.
Para elegir el mejor tratamiento del paciente se deben tomar en cuenta la tolerabilidad y el perfil de seguridad de los antipsicóticos, los efectos colaterales, la administración, el número de tomas de medicamento durante el día, la supervisión de la toma del mismo y el costo, ya que así se podrá asegurar la adherencia terapéutica del paciente.
Existen las presentaciones de antipsicóticos intramusculares, como la olanzapina y la ziprasidona, para el control de la agitación psicomotriz del paciente con esquizofrenia.
En cuanto a olanzapina para control de agitación psicomotriz, se utiliza una aplicación inicial de 10 mg vía intramuscular que se puede repetir a las 2 horas sin riesgo de hipotensión (efecto adverso más importante), sin sobrepasar los 30 mg/día (Frampton 2013) [A1].
Ziprasidona intramuscular se utiliza con dosis recomendada de 10 a 20 mg administrándose según se requiera, hasta una dosis máxima de 40 mg al día. La dosis de 10 mg puede administrarse cada 2 horas y la dosis de 20 mg cada 4 horas. No se ha estudiado la administración intramuscular de ziprasidona por más de 3 días consecutivos (Sciarretta 2012) [B2].
Fase de mantenimiento
Si un paciente ha mejorado con un medicamento antipsicótico, éste debe continuarse con la dosis a la que respondió durante los siguientes seis meses, ya que una disminución o descontinuación prematura conllevan un alto riesgo de recaída. Si los pacientes continúan estables durante seis meses, se puede considerar una reducción de la dosis que nunca debe ser menor del 20% de la dosis con que respondió durante la fase aguda (Takeuchi 2012).
En un aspecto discutible se considera que si un paciente evolucionó a la mejoría y así continuó durante un año de tratamiento, se puede considerar la suspensión del medicamento, misma que deberá realizarse en forma paulatina con constante supervisión, buscando datos de recaída y enseñando al paciente a detectar cualquier manifestación de exacerbación de los síntomas. Si los pacientes son violentos, o presentan datos constantes de enfermedad o recaen con frecuencia, el tratamiento debe continuarse por cinco años o, probablemente, durante toda la vida.
Antipsicóticos atípicos inyectables de liberación prolongada
Para tratamiento de mantenimiento se cuenta también con la opción de antipsicóticos atípicos inyectables de liberación prolongada. En México únicamente se encuentra risperidona y paliperidona.
Risperidona se inicia con una dosis recomendada de 25 mg cada dos semanas por vía intramuscular, siempre y cuando se encuentre el paciente con dosis oral de hasta 4 mg; en pacientes con dosis superiores se debe considerar el inicio con la presentación de 37.5 mg. En ambos casos, cuando se inicia la administración de risperidona inyectable de liberación prolongada, el antipsicótico oral se debe mantener durante tres semanas y, al término de éstas, suspenderlo y continuar con la forma inyectable cada 15 días. Para pacientes que no utilizan risperidona oral, se recomienda la aplicación de la risperidona de acción prolongada de 25 mg/ dosis, cada 15 días, y la administración de risperidona vía oral entre 2 y 4 mg/día durante tres semanas, al término de las cuales se debe suspender la medicación oral y continuar la aplicación de risperidona inyectable de liberación prolongada cada quince días. No se recomiendan dosis superiores a 50 mg cada dos semanas (Móller 2007) [A1].
Por otra parte, el palmitato de paliperidona (metabolito activo de risperidona) inyectable de liberación prolongada se utiliza en dosis inicial de 150 mg de aplicación IM el día uno y 100 mg IM el día ocho, ambos casos en deltoides. Para la fase de mantenimiento se recomienda seguir con una dosis promedio de 75 mg (en un rango de 50-150 mg según la respuesta clínica y tolerabilidad) IM en deltoides o glúteo cada 30 días. Las dos primeras aplicaciones se utilizan con una semana de diferencia y las dosis recomendadas son de 150 mg el día 1 y 100 mg el día 8, indistintamente de la gravedad de los síntomas. La dosificación para la fase de mantenimiento se basa en la gravedad del cuadro y la mejoría del paciente. No debe utilizarse sin antes haber comprobado en el paciente la tolerabilidad previa del tratamiento oral, ya sea con paliperidona o con risperidona (Carter 2012) [A1].
Las dosis bajas de antipsicóticos de segunda generación aumentan el riesgo de una recaída, aunque estos pacientes presentan menos riesgos de disquinesia tardía y sus recaídas suelen ser de moderada intensidad; otros autores recalcan lo mismo, consideran que la reducción de la medicación comporta un excesivo riesgo de recaída en este tipo de pacientes. En otro estudio encontraron una mayor tasa de recaídas en el grupo tratado con dosis bajas; sin embargo, considera que este grupo presentó mejor ajuste social que el tratado con dosis altas o estándar (Lin 2010) [B2].
De la misma manera, los tratamientos intermitentes parecen conllevar excesivos riesgos de recaídas (Sampson 2013) y se han fundamentado habitualmente en el abordaje precoz de síntomas que se interpretan como prodrómicos de recaída. Por otra parte, algunos autores señalan mayores riesgos de disquinesia tardía en los tratamientos intermitentes. Se ha observado también que pacientes con esquizofrenia estables que han sufrido una recaída tras la interrupción de la medicación pueden tener muchas dificultades para recuperar los niveles previos de estabilización que presentaban antes de la recaída. En lo que se refiere específicamente a la eficacia de los antipsicóticos, cabría sintetizar la información actualmente existente de la siguiente manera:
En episodios agudos la respuesta es del 70 al 75%, mientras que solo responden un 25% con placebo; en el tratamiento de mantenimiento las recaídas son de un 20 a un 25%, en aquellos pacientes que están bajo tratamiento antipsicótico, y de un 55% con placebo (National Collaborating Centre for Mental Health 2009, Case 2011). La mayoría de los pacientes deben seguir tratamiento con antipsicóticos durante largos periodos de tiempo. El perfil típico de los pacientes con alto riesgo de recaída se caracteriza por la baja conciencia de enfermedad, gran inquietud al tomar medicación, ánimo expansivo en las recaídas y familias de alta expresividad emocional (Amaresha 2012, Butzlaff 1998); en todo caso, a la hora de considerar si un tratamiento antipsicótico es eficaz, debemos establecer las siguientes consideraciones (NICE 2009, Nyhuis 2010):
• En 6 a 8 semanas se sabe si un paciente es un verdadero no respondedor.
• Se necesitan entre 3 a 6 meses para determinar la eficacia global en un respondedor.
• Los niveles plasmáticos de los antipsicóticos permiten identificar a los no cumplidores o metabolizadores rápidos, a los pacientes con niveles altos y efectos indeseables que se confunden con la psicopatología, pero ello solo es posible para algunos antipsicóticos.
Efectos indeseables de los antipsicóticos típicos (Arana 2000) [A1]:
• Sedación (cuando no se busca)
• Hipotensión
• Sequedad de boca
• Estreñimiento
• Visión borrosa
• Retención urinaria
• Alteraciones cardíacas (básicamente arritmias)
• Reacciones alérgicas
• Alteraciones hormonales
• Disminución de hormonas sexuales femeninas: alteración del ciclo menstrual
• Aumento de la prolactina: galactorrea y ginecomastia
• Disminución de la hormona del crecimiento
• Alteraciones neurológicas:
- Extrapiramidalismo farmacológico
- Acatisia
- Reacciones disquinéticas agudas (distonía de torsión)
- Disquinesia tardía
- Síndrome neuroléptico maligno
Antipsicóticos inyectables de liberación prolongada y adherencia terapéutica
El tratamiento de mantenimiento con fármacos antipsicóticos en la esquizofrenia es muy efectivo en la reducción de las tasas de recaída (Kirk 2013) [A1], (Lang 2010) [B2]. Sin embargo, los pacientes con esquizofrenia tienen una alta tasa de recaídas. En los estudios de primer episodio psicótico se ha observado una remisión de los síntomas psicóticos en el 80% de los pacientes tratados con antipsicóticos (Lieberman 1992) [B2], (Robins 1999) [B2]. A pesar de esta excelente respuesta al tratamiento, se ha documentado que el 80% de los pacientes diagnosticados con un primer episodio de esquizofrenia o trastorno esquizoafectivo presentan aproximadamente dos recaídas en los primeros 5 años de evolución (Robinson 1999) y la remisión de los síntomas es menos probable después de cada recaída (Wiersma 1998). Además, un mayor número de recaídas se ha correlacionado con un mayor deterioro funcional y una disminución en la respuesta al tratamiento (Lieberman 1996, Shepherd 1989).
FACTORES ASOCIADOS A LA RECAÍDA
Los datos de un estudio de cohorte de 2,588 pacientes con primer episodio de esquizofrenia revelaron que solo el 58% de los pacientes recogió su receta durante los primeros 30 días del alta hospitalaria, y solo 46% continuaron con su tratamiento inicial por 30 días o más (Tiihonen 2011). De hecho, los estudios han demostrado que más del 40% de los pacientes con primer episodio no presentan una adherencia adecuada y suspenden sus medicamentos durante los primeros nueve meses de tratamiento, incrementando la probabilidad de una recaída (Miller 2008). En México, se realizó un estudio de seguimiento a 18 meses en un grupo de pacientes con esquizofrenia tras haber sido dados de alta de una hospitalización; a los 6 meses del egreso, solo el 62% tomaba sus medicamentos; a los 18 meses del egreso, el porcentaje de los que tomaban la medicación descendió al 59%, y a los 6 meses del egreso, el 10% de los pacientes había reingresado al hospital (Valencia 1994).
El principal factor que se asocia con la recaída es la suspensión del tratamiento por la falta de adherencia, evidencia documentada en México mediante un estudio de seguimiento de pacientes con primer episodio psicótico, que registró una tasa de recaída de 47% en una muestra de 66 pacientes que se siguieron durante un año, donde la principal variable asociada con la recaída fue la suspensión del tratamiento, ya que el 42% de los pacientes abandonaron el tratamiento sin indicación médica (Apiquian 2006), hallazgo que concuerda con otros estudios de seguimiento (Geddes 1995).
Otros factores asociados son un bajo funcionamiento premórbido, una duración de la psicosis no tratada prolongada (> 1 año) y la presencia de síntomas depresivos severos (Robinson 1999).
La alta tasa de incumplimiento puede ser explicada por poca conciencia de enfermedad, déficits cognitivos y elevado abuso de sustancias asociados con la esquizofrenia y, por otro lado, efectos secundarios asociados con los antipsicóticos tales como anhedonia y síntomas extrapiramidales (Tandon 2009).
La introducción de antipsicóticos de segunda generación trajo consigo la enorme esperanza de que la adherencia mejorara debido a la presencia de menos efectos secundarios extrapiramidales (Borison 1997). Sin embargo, una serie de estudios han demostrado que la falta de adherencia a los antipsicóticos de segunda generación no es muy diferente a la de los antipsicóticos convencionales (Dolder 2002, Valenstein 2004).
Concepto y medición de la adherencia terapéutica
La adherencia se define como el grado en el que la conducta de una persona coincide con las recomendaciones que hace el médico (Haynes 2000).
El criterio para considerar a un paciente con falta de adherencia es que no tome ninguna de las dosis prescritas o interrumpa su tratamiento posterior a un periodo adecuado de adherencia. El término de adherencia parcial describe a los pacientes que tienen periodos donde fallan en la toma de sus medicamentos, incluidas las pérdidas ocasionales de dosis (Oehl 2000). Un criterio que actualmente se considera adecuado para clasificar a los pacientes con adherencia parcial es la toma menor al 70% de la dosis prescrita en la última semana (Keith 2003).
Es recomendable realizar una evaluación objetiva de la adherencia al tratamiento; existen distintas mediciones como la determinación de niveles plasmáticos del medicamento, monitoreo con frascos electrónicos y el interrogatorio directo al paciente. Esta última opción es la menos confiable. Algunos métodos son sofisticados y poco factibles de implementar, por lo que se recomienda utilizar el Test Morisky-Green, además de aplicar la fórmula de Haynes-Sackett para determinar el grado de adherencia. Sin embargo, los métodos actuales para evaluar adherencia son complejos y no efectivos, de acuerdo con el meta-análisis de estudios controlados realizado por Haynes (2000) [A1].

Test de Morisky-Green:
• ¿Se olvida alguna vez de tomar los medicamentos?
• ¿Toma los fármacos a la hora indicada?
• Cuando se encuentra bien, ¿deja alguna vez de tomarlos?
• Si alguna vez le sientan mal, ¿deja de tomar la medicación?
Una vez realizados los cálculos, se considera no adherencia al paciente cuyo PC sea menor a 70%. Se ha estimado de acuerdo con estas definiciones que un tercio de los pacientes cumple con su tratamiento, otro tercio se clasifica con adherencia parcial y el tercio restante no cumple con su tratamiento (Wright 1993) [B3].
Factores asociados con la no adherencia
Los factores de riesgo para la falta de adherencia han sido conceptualizados en tres elementos: los relacionados con el paciente, con el tratamiento y con el medio ambiente (Fleischhacker 2003).
La escala de actitudes hacia el medicamento (Robles 2004) ayuda a identificar algunos de los factores de riesgo de no adherencia enlistados en el cuadro 2. Actualmente no se cuenta con una escala validada para determinar signos de alarma de una recaída, pero es importante que sean evaluados en cada visita (cuadro 3) ya que junto con los factores de riesgo de no adherencia, ayudan a establecer el grado de riesgo de una recaída.

Antipsicóticos inyectables de liberación prolongada en la prevención de la recaída
Los antipsicóticos inyectables de liberación prolongada surgen como respuesta para disminuir la tasa de recaídas al incrementar la adherencia al tratamiento. Se han realizado varios estudios aleatorizados, controlados, comparando los índices de recaídas de los antipsicóticos orales o de liberación prolongada. Los hallazgos de estos estudios favorecen a los antipsicóticos de liberación prolongada (Davis 2012) [B2], (Hasan 2013) [A1]. Sin embargo, hay una subutilización de los antipsicóticos inyectables de liberación prolongada debido a ciertas creencias de los médicos. En una encuesta, los médicos consideraron como la mayor preocupación la presencia de síntomas extrapiramidales asociados, el riesgo de complicaciones con el síndrome neuroléptico maligno o la disquinesia tardía. En general, los médicos percibieron la indicación de formulaciones inyectables de larga duración solo para pacientes graves y con problemas de adherencia (Lambert 2003).
Se ha establecido que los antipsicóticos atípicos inyectables de liberación prolongada se asocian con menos síntomas extrapiramidales al compararlos con los antipsicóticos típicos (Adams 2001) [A1], (Farah 2005) [A1]. Tampoco hay una evidencia de mayor frecuencia de disquinesia tardía y no es una contraindicación el antecedente previo de síndrome neuroléptico maligno para la prescripción de los antipsicóticos típicos inyectables de liberación prolongada (Kane 2006) [B3].
También existe la opinión arraigada entre los clínicos de que los pacientes presentan una actitud negativa hacia las formulaciones inyectables, limitando su prescripción. Lo anterior ha sido descartado en encuestas dirigidas a pacientes ambulatorios tratados con antipsicóticos típicos inyectables de liberación prolongada, ya que el 87% reporta que prefiere continuar con esta presentación (Pereira 1997).
En general, varias de las barreras para la prescripción de los antipsicóticos inyectables de liberación prolongada se relacionan con la falta de conocimiento sobre la utilización de estas presentaciones y la idea concebida de que solo están indicados para un grupo específico de pacientes, generalmente los pacientes severos y con mala adherencia. La opinión actual es que los antipsicóticos atípicos inyectables de liberación prolongada representan una solución prometedora ya que se asocian con menos efectos adversos (Hasan 2013) [A1]. Un reciente meta-análisis de estudios de largo plazo comparando antipsicóticos orales con antipsicóticos inyectables de liberación prolongada reporta una reducción de las tasas de recaída de los pacientes ambulatorios con esquizofrenia, en promedio, de 33.2 a 21.5%. Esta diferencia significa una reducción del 10% del riesgo absoluto y de un 30% del riesgo relativo para la presencia de una recaída con los antipsicóticos inyectables de larga duración, hallazgo corroborado al disminuir el número de abandonos del tratamiento por falta de eficacia (Leucht 2011) [A1].
En el cuadro 4 se muestran los antipsicóticos inyectables de liberación prolongada disponibles en México.

Los antipsicóticos inyectables de liberación prolongada de primera generación están constituidos mediante la formación de un éster con un ácido graso como el ácido decanoico, y se inyectan en una solución aceitosa de aceite de semilla de sésamo (decanoato de haloperidol) o de un aceite vegetal de baja viscosidad (decanoato de flupentixol y decanoato de zuclopentixol), maximizando así su lipofilia y afinidad para el tejido graso. Estas formulaciones deben ser inyectadas lentamente y, por lo general, en el punto de inyección puede haber dolor agudo y reacciones en piel que pueden durar hasta tres meses. Además, pueden inducir síntomas extra-piramidales el día de la inyección debido a una liberación inmediata de una pequeña cantidad libre del fármaco. También pueden ser detectables en plasma hasta por seis meses después de la inyección, aumentando la posibilidad de interacción con otros fármacos. Estos eventos han disminuido con los antipsicóticos inyectables de liberación prolongada de segunda generación, que están constituidos por soluciones acuosas con nanopartículas como el palmitato de paliperidona, con microcristales como el pamoato de olanzapina y microesferas como la risperidona (Zhornitsky 2012).
Evidencias y recomendaciones generales de los antipsicóticos inyectables de liberación prolongada
Los antipsicóticos inyectables de liberación prolongada de primera generación como el decanoato de haloperidol, decanoato de flupentixol y el decanoato de zuclopentixol, están constituidos para ser aplicados con solución aceitosa y requieren del uso de una aguja de tamaño 21G, empleando generalmente la técnica de inyección en Z; no necesitan refrigeración o reconstitución y tampoco demandan terapia antipsicótica oral suplementaria (Taylor 2009) [A2]. La evidencia actual establece que la eficacia y la frecuencia de síntomas extrapiramidales de este grupo de antipsicóticos es similar al tratamiento con antipsicóticos orales de primera generación, por lo que requieren de una evaluación rutinaria de efectos secundarios. Han demostrado su utilidad en los pacientes con problemas de adherencia terapéutica (Haddad 2009) [C2].
Para minimizar los efectos secundarios con decanoato de haloperidol se realizaron dos estudios con el siguiente esquema:
• La dosis total inicial (DTI) calculada con base en la dosis efectiva del último neuroléptico recibido. Se considera una dosis como efectiva aquella asociada con una respuesta antipsicótica detectable y/o con la presencia de síntomas extrapiramidales. Las dosis de los antipsicóticos se convierten a equivalentes de mg de HLP/día según los valores convencionales (Woods 2003) [B1] y se multiplican por 20 para determinar la DTI.
• En los pacientes sin tratamiento previo se calcula la DTI tomando en cuenta una dosis estándar de 10 mg de haloperidol. La DTI se divide en 2 partes iguales y se aplican con un intervalo entre ellas de 4 a 7 días. En caso de que la respuesta antipsicótica fuera nula o los síntomas extrapiramidales no se presenten 15 días después de la primera aplicación, se aplica una dosis adicional del 50% de la DTI. En estos casos, se considera como la DTI la cantidad total de D-HLP administrada en el primer mes. En la cuarta semana de tratamiento se aplica el 75% de la DTI, y en la octava semana el 50%; esta última dosis es la que se considera de mantenimiento y se aplica cada 4 semanas (Ortega 1995) [B2].
La risperidona inyectable de liberación prolongada requiere estar refrigerada, necesita ser reconstituida y se aplica de forma intramuscular en región glútea con aguja de tamaño 21G cada 2 semanas. En el inicio del tratamiento se recomienda durante las primeras tres semanas continuar con terapia antipsicótica oral suplementaria, y posteriormente suspender la terapia oral (Taylor 2009) [A2].
La risperidona inyectable de liberación prolongada no se ha asociado con la presencia del síndrome post-inyección de delirium/sedación (Alphs 2011). Este síndrome se ha reportado solo con el pamoato de olanzapina, restringiendo su uso únicamente para clínicas con un equipo médico capacitado, ya que requiere un período de observación posterior a la inyección de 3 horas (Detke 2010). En México no se cuenta por lo pronto con pamoato de olanzapina.
Recientemente contamos en México con palmitato de paliperidona, que ofrece la ventaja de una aplicación cada 4 semanas, no requiere refrigeración ni reconstituirse o terapia antipsicótica suplementaria. Se aplica de forma intramuscular en región deltoidea o glútea con aguja de tamaño 22 G (Taylor 2009). En estudios a corto plazo, el palmitato de paliperidona ha mostrado una adecuada eficacia con efectos secundarios similares a los observados con paliperidona oral (Nussbaum 2012). La dosis de 50 mg, 75 mg y 100 mg cada cuatro semanas de palmitato de paliperidona es comparable en eficacia y tolerabilidad a la dosis de 25 mg, 37.5 mg y 50 mg (no disponible en México) cada dos semanas de risperidona inyectable de liberación prolongada (Información para prescribir Inveda Sustenna). La ventaja es que el palmitato de paliperidona se puede iniciar el día después de suspender el tratamiento previo con antipsicóticos orales. Después de la dosificación de iniciación, palmitato de paliperidona se administra en la fase aguda y posteriormente en la fase de mantenimiento sobre una base mensual, siendo el primero de los antipsicóticos de segunda generación en estar disponible y aprobado con este régimen de dosificación (Samtani 2011). La eficacia y tolerabilidad en corto y largo plazo se encuentra establecida en diversos estudios (Kramer 2010, Gopal 2011, Nasrallah 2010, Gopal 2010, Hough 2010, Kramer 2010).
El consenso actual es que por las ventajas que ofrece el palmitato de paliperidona en términos de tolerabilidad, aplicación cada 4 semanas y el esquema de dosis inicial que se utiliza para evitar terapia antipsicótica suplementaria (figura 1), debería ser indicado en pacientes con primer episodio para prevenir las recaídas y promover la adherencia (Newton 2012) (Algoritmo 1).
Recomendaciones finales
Los antipsicóticos inyectables de liberación prolongada permiten incrementar la adherencia al mantener niveles plasmáticos estables, aumentar la confiabilidad de la evaluación del cumplimiento del tratamiento y asociarse con menos efectos secundarios (Hasan 2013) [A1].
Los principales criterios para iniciar el manejo con antipsicóticos de larga duración inyectables son los siguientes (Emsley 2008, Parellada 2006):
• Pacientes sin adherencia o con adherencia parcial
• Respuesta subóptima al tratamiento (eficacia parcial)
• Falta de conciencia de enfermedad (insight)
• Pacientes con antecedentes de abuso de sustancias o conductas agresivas
• Pacientes con efectos colaterales producidos por otros antipsicóticos
• Pacientes con primer episodio psicótico
EVENTOS ADVERSOS
Metabólicos
Desde que se describieron los primeros antipsicóticos típicos (o convencionales), la cloropromazina y el haloperidol, al finalizar la sexta década del siglo XX, se hizo latente que con su uso surgían algunas alteraciones metabólicas o se exacerbaban otras ya existentes en los pacientes que los recibían. Se reportó, en particular, ganancia de peso, aunque también se encontraron otras alteraciones metabólicas tales como cambios en el metabolismo de los carbohidratos (intolerancia a carbohidratos, o bien, franca diabetes mellitus) y de los lípidos (cambios en los niveles de colesterol y triglicéridos).
Los cambios metabólicos fueron asociados, sobre todo, con la administración de algunas clases de antipsicóticos; más notablemente las fenotiazinas alifáticas (v.g. levomepromazina y la propia cloropromazina) y las fenotiazinas piperidínicas (v.g. tioridazina). Sin embargo, todo el grupo de los antipsicóticos fue relacionado en mayor o menor grado con estos cambios, aunque con el paso del tiempo se dejó de poner interés en estas consecuencias (O'Donoghue 2013; Papanastasiou E 2013).
Con la aparición de los nuevos antipsicóticos, denominados atípicos (o de segunda generación), ha resurgido un interés creciente por la detección, estudio y manejo de los cambios metabólicos relacionados con el uso de estos medicamentos, dadas las altas tasas de prevalencia e incidencia con las que se han encontrado alteraciones metabólicas en pacientes que reciben este tipo de fármacos, particularmente relacionados con la administración de algunos de ellos (Papanastasiou E 2013).
En 1988, Reaven acuñó el concepto del llamado síndrome metabólico, también conocido como síndrome X, conjunto de alteraciones del metabolismo orgánico que representa de manera general los efectos metabólicos que se han relacionado con el uso de antipsicóticos (tal vez con excepción de la hipertensión arterial) y que para ser diagnosticado requiere de al menos 3 de los 5 criterios siguientes:
A. Obesidad abdominal: Circunferencia abdominal > 102 cm [40 pg] (varones) > 88 cm [35 pg] (mujeres)
B. Niveles séricos de triglicéridos (en ayunas) > 150 mg/ dL
C. Niveles séricos de colesterol-HDL < 40 mg/dl (varones) < 50 mg/dL (mujeres)
D. Presión sanguínea > 130/85 mmHg
E. Niveles séricos de glucosa (en ayunas) > 110 mg/dL
La fisiopatogenia de este síndrome se ha relacionado con resistencia a la captación de glucosa estimulada por insulina a nivel celular (mecanismo que pudiera también estar involucrado con los efectos metabólicos de al menos algunos de los antipsicóticos atípicos). Su prevalencia se ha reportado en un rango entre 20 a 30% de la población general, con una relación directa entre ésta y una mayor edad.
La relevancia clínica de este síndrome se sustenta en que establece para quien lo padece una tendencia incrementada para la aparición de diabetes mellitus, hipertensión arterial y trastornos del metabolismo de los lípidos, todas estas alteraciones asociadas con ateroesclerosis, principal responsable de enfermedad vascular cardiaca (cardiopatía isquémica) y cerebral (enfermedad isquémica y hemorrágica), condiciones que generan la mayor morbilidad, incapacidad y muerte en el ser humano (O'Donoghue 2013; Papanastasiou E 2013).
Es pertinente señalar que los efectos metabólicos descritos suelen presentar un impacto mayor en los pacientes tratados con antipsicóticos (v.g. pacientes psicóticos crónicos como los esquizofrénicos), comparado con el que se esperaría en la población general, ya que los primeros están predispuestos a estas consecuencias metabólicas tanto por factores biológicos (v.g. herencia) como por factores relacionados con el estilo de vida (v.g. sedentarismo), incluso antes de que se les inicie la administración de este tipo de fármacos. En esquizofrénicos se han reportado prevalencias de alrededor de 40-50% para el síndrome metabólico.
Se analizará a continuación cada efecto metabólico por separado.
Ganancia de peso
El uso de antipsicóticos se asocia con frecuencia a ganancia de peso secundaria, efecto que se ha vinculado sobre todo con las acciones que los antipsicóticos tienen sobre distintos receptores cerebrales; destacan el antagonismo de receptores de histamina tipo 1 (H1) y los efectos sobre receptores serotoninérgicos (5-HT1a, 5-HT2c) y adrenérgicos (-1), todos ellos vinculados con la regulación del apetito.
En los últimos años se han reportado algunos estudios que han comparado los efectos sobre el peso corporal de diferentes antipsicóticos, entre los más destacados se encuentran los siguientes:
• En 1999 Allison y cols. evaluaron los cambios ponderales de 81 pacientes esquizofrénicos después de 10 semanas de tratamiento con diferentes antipsicóticos; se reportó una mayor ganancia de peso (promedio) en pacientes que recibieron clozapina (4.4 kg) y olanzapina (4.15 kg); les siguió tioridazina (3.19 kg), sertindol (2.92 kg) y risperidona (2.1 kg) y, finalmente, ziprasidona (0.04 kg), molindona (-0.39 kg) y el placebo (-0.74 kg).
• En un estudio retrospectivo que incluyó 121 pacientes bajo tratamiento con antipsicóticos atípicos, la ganancia semanal de peso (promedio) reportada fue de 0.76 kg/ semana para olanzapina, 0.22 kg/semana para clozapina y 0.15 kg/semana para risperidona; los resultados fueron similares para individuos obesos y no obesos al inicio del tratamiento.
• En un estudio doble ciego con 152 pacientes se reportó una asociación entre la ganancia de peso y la respuesta terapéutica al antipsicótico para olanzapina y clozapina, pero no se encontró tal relación con risperidona y haloperidol (Chue 2003).
• En otro estudio de pacientes con esquizofrenia tratados por al menos 4 semanas con olanzapina, risperidona, quetiapina o haloperidol, se reportó la mayor ganancia de peso con olanzapina; en este estudio la ganancia de peso fue considerada como un efecto adverso en 74.5% de los pacientes tratados con olanzapina, 53.4% de aquellos tratados con risperidona, 40% de los que recibieron haloperidol y 13 .5% de los que recibieron quetiapina; una "ganancia de peso clínicamente relevante" (definida como un incremento >7% del peso basal) estuvo presente en 45.7% de los pacientes que recibieron olanzapina, 30.6% de los que recibieron risperidona, 22 .4% de aquellos con haloperidol y 0% de quienes recibieron quetiapina. Los resultados de este estudio con quetiapina no fueron comparables ya que la duración del tratamiento fue más corta con este medicamento (Volavka 2002).
De los datos anteriores se puede concluir que la vigilancia del peso corporal es un punto importante a observar cuando se prescriben antipsicóticos. En esta intención, se ha considerado al acumulo de grasa abdominal como un parámetro de mayor impacto en la salud del individuo, por ello la importancia de la medición de la circunferencia abdominal. Otro parámetro útil en la evaluación y seguimiento del peso corporal es el índice de masa corporal (IMC), cociente de la fórmula: peso (kg)/estatura (m/2), con el cual se pueden establecer los siguientes rangos aproximados:
• 21 -24 IMC Peso normal
• 25-29 IMC Sobrepeso
• > 30 IMC Obesidad
Resultaría apropiado además promover medidas higienicodietéticas convenientes y un régimen de actividad física regular en los pacientes que reciben estos medicamentos, de la mano del seguimiento clínico de los parámetros arriba mencionados.
Trastornos del metabolismo de la glucosa
Los trastornos en el metabolismo de la glucosa que se han asociado con la administración del antipsicóticos incluyen:
A. Aparición de niveles de glucosa en sangre elevados, tanto en rangos de intolerancia a la glucosa (> 11 0 mg/ dL < 12 5 mg/dL de glucosa en sangre en ayuno) como en franca diabetes mellitus (> 12 5 mg/dL de glucosa en sangre en ayuno).
B. Aumento en los niveles de glucosa, o bien, mayor nivel de desequilibrio metabólico, o dificultad para lograr su control en pacientes con diabetes mellitus diagnosticada antes de la administración de antipsicóticos.
C. Reporte de casos de descontrol metabólico agudo (v.g. cetoacidosis diabética o estado hiperosmolar) que eventualmente han llevado a la muerte a los individuos afectados sin diagnóstico previo de trastorno en el metabolismo de los hidratos de carbono.
Dentro de los antipsicóticos típicos, las fenotiazinas de baja potencia antipsicótica (i.e., fenotiazinas alifáticas y fenotiazinas piperidínicas) han sido consideradas como promotoras de cambios en el metabolismo de la glucosa; algunos reportes involucran a la cloropromazina como causante de hiperglucemia, aun en voluntarios sanos.
En el caso de antipsicóticos típicos de mayor potencia como el haloperidol, la relación de su uso con trastornos del metabolismo de la glucosa es incierta. Incluso un reporte de Mukherjee y cols. (1996), encontró una menor predisposición a padecer diabetes mellitus en pacientes esquizofrénicos que recibieron antipsicóticos típicos comparado con aquellos que no los recibieron.
Los antipsicóticos atípicos han sido vinculados de forma mucho más habitual con los cambios en el metabolismo de los hidratos de carbono. Los reportes que han evaluado los efectos en los niveles de glucosa en sangre de este grupo de antipsicóticos son cada vez más numerosos, y algunos de ellos destacan que existen diferencias notables respecto a la frecuencia y severidad con las que se presentan dichos efectos, dependiendo del antipsicótico involucrado.
Algunos de los estudios más representativos al respecto incluyen los siguientes reportes: en el 2001, Koller y cols, reportaron 384 casos de asociación entre la administración de clozapina y aumento en el nivel de glucosa; 242 casos correspondieron a diabetes de novo y 54 casos a exacerbación de diabetes prexistente. Además se reportaron 80 casos de cetoacidosis diabética aparentemente inducida por este fármaco, la mayoría de ellos aparecidos durante los primeros 6 meses de tratamiento, relacionados con 25 muertes. En el 2002 este mismo autor, junto con Doraiswamy, reportaron 289 casos de asociación entre la administración de olanzapina y el diagnóstico de diabetes mellitus; 225 casos correspondieron a diabetes mellitus de nueva aparición; se reportaron además 100 casos de cetoacidosis diabética y 25 muertes relacionadas.
En 1997, en otro tipo de reporte, Popli y cols reportaron 4 casos de pacientes con esquizofrenia quienes al recibir clozapina presentaron diabetes de novo o exacerbación de una diabetes preexistente, ambas condiciones independientes de la presencia de ganancia de peso en los pacientes. En correspondencia, Wirshing y cols. reportaron en 1998 4 casos de diabetes mellitus asociados a clozapina y 2 casos de diabetes mellitus asociados a olanzapina, con ganancia de peso durante el tratamiento farmacológico presente solo en el 50% de los casos.
A través de otros medios de evaluación, en 1998 Hagg y cols se valieron de la prueba de tolerancia a la glucosa y encontraron que 12% de los individuos tratados con clozapina cumplieron con criterios clínicos para el diagnóstico de diabetes mellitus y 10% de los sujetos evaluados cumplieron con los criterios para intolerancia a la glucosa. Al considerar en esta evaluación a individuos que recibieron manejo con antipsicóticos típicos de depósito, la casuística reportada para diabetes mellitus y para intolerancia a carbohidratos fue del 6 y 3%, respectivamente. En 1999, Melkersson y cols. utilizaron como medio de evaluación la medición de insulina en ayunas y llevaron a cabo un estudio comparativo que incluyó 28 pacientes esquizofrénicos tratados con antipsicóticos típicos, contrastados con 13 pacientes con tratamiento con clozapina. Los niveles de insulina se reportaron más elevados en los sujetos tratados con clozapina respecto al grupo de comparación que recibió antipsicóticos típicos.
Cuando otros antipsicóticos atípicos han sido considerados respecto a la relación entre su administración y la presencia de trastornos del metabolismo de la glucosa, los estudios hasta ahora realizados han dado lugar solo a algunos reportes aislados que asocian a la risperidona y a la quetiapina con la aparición de diabetes mellitus e intolerancia a la glucosa, siempre en menor proporción y severidad que los reportes que han involucrado a las tienobenzodiacepinas. En 2001, Griffiths y Springuel reportaron 37 casos diferentes de trastornos en el metabolismo de la glucosa asociados con la administración de diferentes tipos de antipsicóticos atípicos: 8 casos de diabetes mellitus, 5 casos de cetoacidosis y 3 casos de hiperglucemia relacionados a clozapina; 2 casos de diabetes mellitus, 3 casos de cetoacidosis, 3 casos de hiperglucemia y 2 casos de coma por estado hiperosmolar relacionados a olanzapina; 1 caso de diabetes mellitus y 2 de cetoacidosis relacionados a quetiapina; 1 caso de diabetes mellitus, 3 casos de hiperglucemia sin criterios para diabetes mellitus y ningún caso de cetoacidosis relacionados con risperidona. Finalmente, no se ha reportado hasta la actualidad una relación significativa entre la administración de ziprasidona y aripiprazol y trastornos del metabolismo de la glucosa, aunque hay que considerar que se trata de productos de reciente aparición. De acuerdo con los datos hasta ahora conocidos, en los pacientes en quienes se prescriban antipsicóticos, sobre todo si se trata de antipsicóticos atípicos como clozapina y olanzapina, deberá tenerse un monitoreo cercano de los parámetros que evalúan el metabolismo de la glucosa, particularmente en aquellos individuos que cuenten con factores de riesgo que los predispongan a estos trastornos (como obesidad), sobre todo si es de larga evolución, tienen familiares de primer grado diabéticos, diabetes gestacional e hijos macrosómicos.
Trastornos del metabolismo de los lípidos
Los lípidos son elementos biológicos importantes en el funcionamiento orgánico y los trastornos en su metabolismo son comunes en los humanos; destacan por sus consecuencias en la salud aquellos que involucran al colesterol y a los triglicéridos:
1) Elevación de colesterol total.
2) Elevación de colesterol ligado a lipoproteínas de baja densidad (LDL).
3) Disminución de colesterol ligado a lipoproteínas de alta densidad (HDL).
4) Elevación de triglicéridos.
Estos trastornos suelen presentarse acompañando a condiciones como la obesidad y la diabetes mellitus, aunque también se presentan de manera independiente. El paciente esquizofrénico presenta una mayor prevalencia de estos trastornos respecto a la población general, situación que puede ser influida por factores biológicos y psicosociales tales como el sedentarismo y la inatención del cuidado de la salud.
Algunos estudios han vinculado la administración de antipsicóticos y la aparición de trastornos en el metabolismo de los lípidos: diferentes trastornos en el metabolismo de los lípidos fueron evaluados en un estudio retrospectivo que incluyó 215 pacientes; los individuos que fueron tratados con clozapina y olanzapina desarrollaron aumento significativo en los niveles séricos de triglicéridos, comparado a individuos que fueron manejados con haloperidol. Atmaca y cols. estudiaron 56 pacientes esquizofrénicos manejados con diferentes antipsicóticos atípicos; los sujetos tratados con clozapina y olanzapina desarrollaron un aumento evidente en los niveles séricos de triglicéridos, no así en otros parámetros del metabolismo de los lípidos; además presentaron incremento en los niveles de leptina. Los sujetos que recibieron quetiapina y risperidona solo desarrollaron cambios mínimos en los mismos parámetros. Por último, los estudios hasta ahora llevados a cabo con aripiprazol y ziprasidona sugieren que estos fármacos parecen no influir negativamente en el metabolismo de los lípidos.
Conclusiones
Después de todos los datos consignados, se vuelve obligada la vigilancia y seguimiento de los efectos metabólicos derivados del uso de antipsicóticos. Con este propósito será conveniente llevar a cabo tanto una evaluación basal como evaluaciones de seguimiento de los distintos parámetros metabólicos, con la frecuencia que cada caso en particular requiera. En este sentido es pertinente reconocer que la población de América Latina representa, en su conjunto, un grupo humano que por factores étnicos y de hábitos de alimentación se encuentra predispuesto al desarrollo de trastornos metabólicos, situación que exige mantener una vigilancia y seguimiento más cercanos de los pacientes que sean manejados con antipsicóticos.
Extrapiramidales
Los fármacos más frecuentemente asociados con la aparición de síntomas extrapiramidales son los antipsicóticos, particularmente los que son de primera generación de alta potencia (haloperidol, trifluoperazina, perfenazina) (Tandon 2011). Sin embargo, existen otros fármacos implicados como los antieméticos, antidopaminérgicos (metoclopramida y domperidona) (Pinder 1976), antivertiginosos bloqueadores de los canales de calcio (cinnarizina y flunarizina) (Fabiani 2004) y antidepresivos (tricíclicos, inhibidores selectivos de la recaptación de serotonina y duales) (Madhusoodanan 2010).
Se ha propuesto que los síntomas extrapiramidales ocasionados por antipsicóticos se producen por bloqueo de los receptores dopaminérgicos D2 a nivel de la vía nigroestriada, lo que origina un desbalance entre la dopamina y la acetilcolina. Los síntomas extrapiramidales aparecen cuando existe un 80% o más de ocupación de los receptores mencionados a nivel nigroestriado (Uchida 2011; Nord 2011).
Los efectos extrapiramidales (EPS) ocasionados por los antipsicóticos se dividen en agudos y crónicos (tardíos). Los síntomas extrapiramidales agudos son aquellos que ocurren en los primeros días o semanas posteriores a la administración del antipsicótico, son dosis dependientes y son reversibles una vez que se haya reducido o suspendido el fármaco. Dentro de estos síntomas tenemos: distonía aguda, parkinsonismo inducido por antipsicóticos y acatisia. Por otro lado, los síntomas extrapiramidales crónicos (tardíos) son aquellos que ocurren después de meses o años de la administración de los antipsicóticos y no están claramente asociados a dosis-dependencia, además de persistir aun después de haber suspendido el medicamento. Los síntomas tardíos que han sido reportados son la distonía, corea o disquinesia, acatisia, temblor, mioclonías y tics tardíos (Bakker 2011; Caroff 2012).
Más del 60% de los pacientes que reciben antipsicóticos de primera generación llegan a presentar efectos extrapiramidales, algunos en más de una forma (parkinsonismo y acatisia, por ejemplo). Los antipsicóticos de segunda generación tienen menos riesgo de producir este efecto; sin embargo, estudios recientes han observado que dosis altas terapéuticas también pueden llegar a producir estos efectos (Kluge 2012; Leucht 2009).
a) Distonía aguda. Está caracterizada por contracciones espásticas de un grupo pequeño de músculos, principalmente de la cara y el cuello. Se presenta entre el 2 y 5% de los pacientes que inician con un antipsicótico incisivo de primera generación, como el haloperidol, trifluoperazina, perfenazina (Ripniak 1986); ocurre en las primeras aplicaciones, generalmente dentro de los tres primeros días (van Harten 1999). Se observa con mayor frecuencia en hombres jóvenes y con enfermedad afectiva (Tarsy 1983). La distonía aguda responde a la administración de anticolinérgicos (biperideno, trihexifenidilo), así como de difenhidramina en niños (Derinoz 2012) [B2]. Lo indicado, si es posible, una vez que el paciente haya presentado una distonía aguda, es considerar el cambio de De Hert antipsicótico a uno de segunda generación, o bien, la disminución de la dosis.
b) Parkinsonismo secundario a antipsicóticos. Los síntomas típicos son hipocinesia, rigidez muscular y temblor. Clínicamente puede ser indistinguible de la enfermedad de Parkinson. La hipocinesia se manifiesta con lentitud generalizada del movimiento voluntario y facies inexpresiva ("de máscara") que pueden confundirse con síntomas negativos o con síntomas depresivos. La rigidez muscular puede ser continua ("tubo de plomo") o discontinua ("rueda dentada"). El temblor es de reposo, rítmico y suele afectar extremidades (unilateral o bilateralmente), cabeza, mandíbula, lengua o labios ("síndrome del conejo"). Puede haber hipersalivación y seborrea. Suele presentarse dentro de los primeros días o semanas de iniciado el antipsicótico o de haberse incrementado la dosis del mismo (Guitton 2011). El manejo del parkinsonismo secundario a antipsicóticos debe hacerse en primer lugar, si es posible, disminuyendo o suspendiendo el fármaco y manejar temporalmente anticolinérgicos como trihexifenidilo o biperideno. En algunas instituciones se tiene como protocolo de manejo, una vez que se ha iniciado un antipsicótico de primera generación, el uso concomitante (profiláctico) de los medicamentos anticolinérgicos, lo que no es aceptado por ninguna de las guías de manejo de efectos secundarios por antipsicóticos (2007) [B2].
c) Acatisia. Se describe como una sensación subjetiva de intranquilidad o malestar difícil de describir, acompañado de la necesidad de estar en continuo movimiento, con incapacidad para relajarse o quedarse quieto en una posición. Los casos severos pueden llegar a la agitación o al intento suicida. Puede ser confundida con exacerbación de la sintomatología psicótica, lo cual conlleva al riesgo de un incremento en la dosis del antipsicótico con el consecuente empeoramiento. Suele presentarse dentro de los primeros días o semanas de iniciado el antipsicótico o de haberse incrementado la dosis del mismo. Se ha inferido una vía noradrenérgica en su fisiopatología. El tratamiento de primera elección para el manejo de la acatisia aguda es disminuir o suspender el medicamento asociado y administrar un bloqueador B adrenérgico, como propanolol o metoprolol (Miller 2000) [B2]. De segunda elección pueden manejarse benzodiacepinas, o bien, recientemente se está estudiando con evidencia positiva el uso de mirtazapina (Sachdev 1995) [A3].
d) Síndromes tardíos. El síndrome tardío es un grupo de trastornos del movimiento inducido por el uso de fármacos, principalmente antipsicóticos, que puede presentarse de diversas maneras clínicas, meses o años después de haber iniciado el tratamiento, y que no desaparecen con la suspensión del medicamento. Se han reportado trastornos tales como corea, acatisia, tics, temblor, mioclonía y distonía. En la literatura suele utilizarse el término de disquinesia tardía para referirse a este grupo de síntomas en general; sin embargo, cada uno de ellos implica una condición clínica y fisiopatológica diferente, al igual que su tratamiento y pronóstico. La prevalencia de la disquinesia o corea tardía se relaciona con el tiempo (años) de tratamiento, llegando a una prevalencia de 50% a diez años de manejo con antipsicóticos de primera generación (Woods 2010; Morgenstem 1987). Se presenta con mayor frecuencia en mujeres y en personas de mayor edad (Aichhron 2006). La forma más usual es la corea bucolingual, llamada también disquinesia bucolingual, o disquinesia tardía, propiamente. Se caracteriza por movimientos de la lengua involuntarios, no coordinados y sin una finalidad aparente, pudiendo variar desde un exceso discreto de movimientos hasta una hiperquinesia que interfiere en el habla, masticación y deglución. Usualmente, la disquinesia bucolingual incluye también movimientos de los labios que recuerdan reflejos de chupeteo u otras formas, siendo también estereotipados y predecibles. Una forma especial es el movimiento rítmico del orbicular de los labios, de excepcional aparición, el síndrome del conejo. La disquinesia bucolingual incluye movimientos de apertura y cierre de mandíbula, movimientos de protrusión y laterales, de masticación y otros, pudiendo ser tan severos que llegan a lesionar las piezas dentales (Kane 1995).
La distonía tardía, frecuentemente, es la segunda forma de presentación de los síndromes tardíos, entre el 1 y 4% de los pacientes tratados con antipsicóticos (Dayalu 2008); es más frecuente observarla en personas del sexo masculino y en jóvenes (De Hert 2007). Puede adquirir cualquier patrón clínico, aunque se ven afectados con mayor frecuencia los segmentos corporales axiales y de predominio cérvico-cefálico. Las distonías tardías también pueden afectar a segmentos de tronco, con inclinación lateral (síndrome de Pisa) y alteraciones de la marcha por posturas anómalas. Cabe mencionar la "marcha de dromedario", forma peculiar donde el paciente presenta un balanceo arriba-abajo sobre su eje axial. Los trastornos de la marcha pueden afectar solo a ciertos patrones motores, de manera tal que un severo trastorno de la marcha hacia delante, secundaria a una distonía axial, puede disminuir notablemente o hasta desaparecer al caminar hacia atrás o el trotar, hecho que se puede llegar a confundir con movimientos propios de la enfermedad de base como los movimientos estereotipados. El mejor tratamiento para los síndromes tardíos es la prevención. En primer lugar, el uso de antipsicóticos debe tener una adecuada justificación. Es común observar disquinesias tardías en gente mayor en la cual se utilizó el antipsicótico (perfenazina, risperidona) para el manejo de síntomas ansiosos. Por otro lado, es preferible la utilización de antipsicóticos de segunda generación para disminuir el riesgo de la aparición de estos síntomas. Una práctica común es dar como profiláctico medicamentos anticolinérgicos cuando se inicia un antipsicótico, principalmente de primera generación, lo que aumenta hasta cinco veces el riesgo de síndrome tardío (De Hert 2007). Una vez detectado el síndrome tardío, se debe considerar la posibilidad de cambiar el antipsicótico por uno de segunda generación, y en particular la clozapina, que tiene la mayor evidencia de no generar estos movimientos. El tratamiento de la disquinesia tardía, al igual que su fisiopatología, es diferente que la distonía tardía. Sin embargo, el común denominador es la pobre respuesta a los diferentes tratamientos que se han intentado para ambos fenómenos clínicos. La resolución completa espontánea al suspender el medicamento es rara, menos del 3% (Glazer 1984; Glazer 1990), por lo que no se recomienda el dejar sin tratamiento antipsicótico al paciente con esquizofrenia y movimientos anormales por el alto riesgo de recaída y la falta de evidencia de mejoría al suspender el antipsicótico (Gilbert 1995). A la fecha, no se tiene un manejo efectivo contundente para la disquinesia tardía en sus diferentes modalidades. La utilización de clozapina en este tipo de pacientes ha dado resultados controvertidos; aun así es el tratamiento más utilizado y con el que se ha visto una mayor tasa de respuesta (Spivak 1997). Por otro lado, se habla en la literatura de la tetrabenacina, que es un potente depletor de la terminal dopaminérgica, como medicamento coadyuvante en el tratamiento de la disquinesia tardía en esquizofrenia (Kimiagar 2012), No obstante, hasta fechas recientes no se ha incorporado al mercado en el país, por lo que no existe experiencia en América Latina sobre este fármaco. Los anticolinérgicos se utilizan frecuentemente en la distonía tardía; sin embargo, los pocos estudios controlados que se tienen comparados con placebo no demuestran efectividad, e incluso podrían agravar el componente disquinético (De Hert 2007). Por otro lado, existen muchos estudios sobre el uso de agentes inhibidores de la acetilcolinesterasa con resultados no concluyentes, hipótesis que se basa en la observación de que los medicamentos anticolinérgicos empeoran la disquinesia tardía, por lo que nuevas investigaciones tendrán que realizarse sobre vía colinérgica (Caroff 2007). La vitamina E, vitamina B6, benzodiacepinas y gabaérgicos se han propuesto como alternativas de manejo, sin que haya resultados contundentes al respecto (Macédo 2011; Bishnoi 2007; Howland 2011) Los betabloqueadores que funcionan para la acatisia aguda tampoco han resuelto el problema de la acatisia tardía. Existen casos anecdóticos de cirugía funcional de los ganglios basales, sin que haya una evidencia sólida sobre efectividad y sin el riesgo de efectos secundarios que comprometerían más la calidad de vida del paciente (Woijtecki 2012). Los otros fenómenos tardíos como los tics y mioclonías son poco frecuentes y aún no existe evidencia de tratamientos efectivos.
Síndrome neuroléptico maligno
El síndrome neuroléptico maligno está caracterizado por fiebre, distonía, rigidez generalizada (tubo de plomo), temblor y otros movimientos anormales (mioclonías), disartria, disfagia, mutismo, inestabilidad autonómica (taquicardia, taquipnea, hipertensión arterial), alteración del estado de conciencia (delirium), en ocasiones estado catatónico, así como un estado hipermetabólico que se traduce en elevación de la creatincinasa (CPK), mioglobulinuria, leucocitosis, acidosis metabólica, hipoxia, elevación de catecolaminas en sangre y disminución de los niveles séricos de hierro (Stanley 2011). La prevalencia del SNM es menor al 1% con antipsicóticos de primera generación y mucho menor con los de segunda generación. Existen factores de riesgo como el género masculino, jóvenes, enfermedad neurológica de base, deshidratación, estados catatónicos, dosis altas de antipsicóticos de primera generación, agitación psicomotora, preparaciones intramusculares y medicamentos de depósito (Keck 1989). Por lo general, se llega a presentar en los primeros días de haber iniciado el tratamiento con antipsicóticos. El diagnóstico diferencial debe realizarse con catatonia maligna, infecciones del sistema nervioso, síndrome serotoninérgico, síndrome anticolinérgico. En la mayoría de los casos ocurre en las dos primeras semanas de haber iniciado el antipsicótico. El síndrome neuroléptico maligno es potencialmente fatal debido a sus complicaciones como la falla renal, el paro cardiorrespiratorio, la coagulación intrínseca diseminada (CID), la embolia pulmonar y la neumonía. El tratamiento del SNM inicia con la detección temprana cuando se tiene el conocimiento del mismo; una vez hecho el diagnóstico, lo primero que debe hacerse es suspender el neuroléptico y canalizar al paciente a la terapia intensiva, ya que el riesgo de mortalidad es alto, entre 20 a 50% de acuerdo con diversos estudios. En la terapia intensiva, el primer objetivo es la hidratación agresiva para cuidar la función renal ya que la falla renal es la complicación más severa que puede llevar a la muerte al paciente. El dantrolene, las benzodiacepinas, agonistas dopaminérgicos como bromocriptina y amantadina, así como la terapia electroconvulsiva, han sido tratamientos propuestos para el síndrome neuroléptico maligno sin que haya una evidencia contundente de su efectividad. El mejor tratamiento es el soporte médico integral en una terapia de cuidados intensivos (Stanley 2011).
Efectos cardiovasculares
Padecimientos cardiovasculares en pacientes con diagnóstico de esquizofrenia
Se ha estimado que la esperanza de vida de las personas con diagnóstico de esquizofrenia es 15 años menor que la de la población general (Crump 2013). El médico psiquiatra debe diagnosticar e intervenir en los riesgos cardiovasculares que incluyen el sedentarismo, tabaquismo, alimentación rica en grasa saturada y el efecto de los medicamentos antipsicóticos.
Problemas cardiovasculares asociados con el tratamiento de la esquizofrenia: hipotensión arterial y taquicardia
La hipotensión arterial y la taquicardia son los efectos adversos cardiovasculares más comunes inducidos por los antipsicóticos. Ambos efectos parecen estar relacionados con la dosis y obligan a revisar el esquema de escalamiento de los antipsicóticos.
La hipotensión ortostática se presenta más comúnmente con clozapina y quetiapina, típicamente acompañada de mareo. El ajuste de la dosis y el tiempo suelen resolver este efecto (Fan 2013).
QT prolongado
El síndrome de QT largo se caracteriza por la prolongación del intervalo QT corregido (QTc) en el electrocardiograma y se asocia con la precipitación de la arritmia helicoidal, una taquicardia polimórfica ventricular que puede causar muerte súbita. El síndrome de QT largo adquirido es una alteración secundaria a un estrés ambiental con reversión a la normalidad cuando el factor productor de estrés es retirado. Los factores más comunes son los fármacos. Se considera un QTc prolongado cuando el intervalo es mayor de 440 ms, pero el riesgo de arritmia es mayor cuando el intervalo se encuentra por encima de 500 ms (Glassman 2001).
Factores de riesgo para la arritmia helicoidal inducida por fármacos (Guan 2003)
• Sexo femenino
• Hipocaliemia
• Bradicardia
• Conversión reciente de una fibrilación auricular
• Insuficiencia cardíaca congestiva
• Hipertrofia ventricular izquierda
• Concentraciones altas de fármacos
• Infusiones intravenosas rápidas con una sustancia que prolonga el QT
• Prolongación del QT basal
• Síndrome QT prolongado subclínico
• Polimorfismo de canal iónico
• Hipomagnesemia severa
Fármacos implicados en la arritmia helicoidal (Guan 2003)
Antiarrítmicos
Clase IA (quinidina, procainamida y disopiramida)
Clase III (dofetilida, ibutilida, sotalol y amiodarona)
Clase IV (verapamilo)
Medicamentos promotilidad
Cisaprida
Antimicrobianos
Macrólidos
Eritromicina
Claritromicina
Fluoroquinolonas
Antiprotozoarios
Pentamidina
Antimalaria
Cloroquina
Antipsicóticos
Fenotiazinas
Tioridazina
Cloropromazina
Butirofenonas
Haloperidol
Otros: Ziprasidona, Sertindol
Misceláneos
Trióxido arsénico
Metadona
Muerte súbita
La OMS define la muerte súbita como la muerte inesperada que ocurre dentro de la primera hora posterior al inicio de síntomas si existe un observador, o dentro de las 24 horas siguientes en personas aparentemente asintomáticas si no existe un observador.
La enfermedad coronaria es responsable de aproximadamente el 70% de los casos de muerte súbita y puede ser su primera manifestación. Sin embargo, establecer la causa puede ser difícil debido a la multiplicidad de posibilidades: sobredosis, suicidio, accidentes cerebrovasculares, convulsiones, etc. En el caso de ausencia de lesión estructural, la arritmia es la etiología más probable.
Se ha estimado que el paciente con esquizofrenia tiene una probabilidad de muerte súbita 4.9 veces superior a la población general. La exposición a antipsicóticos incrementa el riesgo de muerte súbita 2.4 veces comparado con los no usuarios.
La arritmia cardíaca de una enfermedad coronaria no diagnosticada y el riesgo por exposición a antipsicóticos son las dos causas más importantes de muerte súbita; sin embargo, otras explicaciones son posibles como la disquinesia respiratoria, la distonía faringolaríngea, la vasodilatación periférica y la sedación como causas del colapso cardiovascular (Ray 2009; Glassman 2001).
Cómo calcular el QTc
Existen dos fórmulas frecuentemente usadas para calcular el QTc: la fórmula QTcB (Bazett) y la QTcF (Fridericia); la segunda se considera más apropiada para casos de bradi o taquicardia. En ambas se utiliza el QT como dividendo, solo que en QTcB el divisor es la raíz cuadrada del RR y en QTcF es la raíz cúbica de RR. Esto es:
QTcB=QT/2√RR y QTcF=QT/3√RR
Clozapina
La clozapina sigue siendo el medicamento de elección en pacientes con esquizofrenia resistente a tratamiento y en pacientes con ideación suicida. Sin embargo, se cree que el riesgo cardiovascular rebasa el riesgo por alteraciones hematológicas. La clozapina se ha asociado con miocarditis y miocardiopatía.
La incidencia de miocarditis se calcula que es de 1/500 con una fatalidad del 50%. El cuadro clínico de la miocarditis incluye síntomas de catarro, fiebre, disnea, taquicardia sinusal, palpitaciones, fatiga, dolor al respirar y malestar en el pecho.
Se presenta dolor si está involucrado el pericardio. Los hallazgos primarios en el EKG son elevaciones del ST e inversiones de la T. Las alteraciones del laboratorio incluyen: elevación de creatincinasa sérica, leucocitosis y eosinofilia. La forma óptima de diagnosticar miocarditis es la medición de los niveles séricos de troponina ya que esta proteína refleja daño miocárdico. Por otra parte, es importante recordar que hasta 20% de los pacientes con clozapina presentan hipertermia en las primeras tres semanas de tratamiento.
La cardiomiopatía dilatada puede presentarse en pacientes que reciben clozapina. Esta inicia usualmente en el ventrículo izquierdo. Se ha calculado un riesgo de 51.5 por 100,000 pacientes al año, cinco veces más que la observada en la población general.
Más del 65% de los casos ocurren después de 6 meses de tratamiento, con una mortalidad aproximada de 20%. Aparentemente ni la miocarditis ni la cardiomiopatía están relacionadas con la dosis. Los síntomas de la cardiomiopatía son aquellos relacionados con la insuficiencia cardíaca: disnea de esfuerzo, fatiga, edema periférico, ortopnea y dolor torácico.
Los hallazgos electrocardiográficos incluyen taquicardia sinusal, arritmias atriales y ventriculares, cambios en el ST, T y P. El examen más sensible en la detección de la miocardiopatía es el ecocardiograma.
El análisis de mortalidad de Tiihonen sugiere que la clozapina, en forma global, representa el menor riesgo de muerte, incluidas las muertes por suicidio y enfermedad cardiovascular, en comparación con el resto de los antipsicóticos y a la no exposición a antipsicóticos en pacientes con esquizofrenia; este resultado puede obedecer a la efectividad del fármaco, a la vigilancia y manejo asociado a su uso, o a una combinación de factores.
Recomendaciones
(Ray 2009; Glassman 2001; Haddad 2002)
• Realizar EKG antes de iniciar el tratamiento y en condiciones de estado estable.
• Escalamiento lento de dosis y ajuste de la misma en caso de alteraciones de la eliminación o uso concurrente de medicamentos con la misma vía metabólica.
• Monitoreo regular de EKG en pacientes de alto riesgo y en aquellos que toman medicamentos adicionales que prolongan el intervalo QTc.
• Monitoreo de la concentración sérica de potasio (que debe mantenerse en el límite normal alto en pacientes con alto riesgo).
• Atención cuidadosa de la pérdida potencial de electrolitos por diarrea, vómito, sudoración profusa, desnutrición, tratamiento con diuréticos, uso de alcohol o drogas y trastornos de la alimentación.
• Administración de sulfato de magnesio (oral o IV) si el QTc está marcadamente prolongado.
• Suspender los medicamentos si el QTc es mayor que 500 ms, la concentración de potasio es normal y el QRS es de duración normal, aun si el paciente no tiene síntomas, y considerar la posibilidad de arritmia cardíaca como posible causa de cualquier caso de palpitaciones, mareo, síncope o convulsiones.
• No combinar medicamentos que prolongan el QT, por ejemplo, no utilizar antidepresivos tricíclicos asociados con haloperidol en pacientes con QTc prolongado.
MANEJO DE LOS EVENTOS SECUNDARIOS
Una cuestión interesante es el manejo de los eventos secundarios de los medicamentos antipsicóticos y, de esta manera, siempre en el supuesto de que se estuvieran utilizando fármacos adecuados y dosis adecuadas, se recomienda el cambio de la medicación y utilizar antipsicóticos atípicos en casos de bradicinesia persistente y rigidez muscular. En acatisia persistente, se prescribirán benzodiacepinas, propranolol o antipsicóticos atípicos; ante efectos sexuales o amenorrea, reducir dosis o cambiar el antipsicótico. La aparición de disquinesia tardía justificaría el cambio a clozapina u otro atípico, al igual que el desarrollo de un síndrome neuroléptico maligno (Meltzer 2010) [B2], (Novick 2010) [A2].
La utilización profiláctica de antiparkinsonianos solo debe considerarse en aquellos pacientes que toman antipsicóticos típicos de alta potencia y que presenten antecedentes de cuadros extrapiramidales agudos, de manera que pudieran afectar no solo a la seguridad del paciente sino también el cumplimiento del tratamiento (Burgyone 2004) [A2].
Ante las faltas de cumplimiento de medicación debidas a efectos extrapiramidales, está recomendado el cambio de medicación eligiendo fármacos tipo risperidona, olanzapina u otros atípicos; cuando las faltas de cumplimiento obedecen a otras causas, parece razonable pensar en formas de depósito de los medicamentos antipsicóticos (Meltzer 2010) [A2], (Novick 2010) [B2].
La elección del antipsicótico debe hacerse siguiendo criterios de eficiencia y seguridad.
Para una mejor prescripción de los mismos, se deben considerar los siguientes aspectos:
1. Relacionados con el paciente: historia médica y psiquiátrica, historia familiar, tratamientos previos y cumplimiento.
2. Relacionados con las propiedades farmacocinéticas y farmacodinámicas de la medicación: efectos secundarios, reacciones adversas medicamentosas y metabolismo.
3. Relacionados con aspectos socioeconómicos: costos directos e indirectos.
OTROS FÁRMACOS
Litio: su uso es controversial en pacientes resistentes a tratamiento. Es necesario tener precaución por los efectos secundarios (Leucht 2004) [A1].
Carbamacepina y ácido valproico: pueden ser eficaces como coadyuvantes de los antipsicóticos en pacientes con anomalías del electroencefalograma indicativas de una actividad convulsiva y en pacientes con conducta agitada o violenta.
No se recomienda el uso de carbamazepina con clozapina por el potencial de ambos fármacos de producir agranulocitosis (Daughton 2006) [A2].
Carbamazepina y valproato reducen las concentraciones hemáticas de los antipsicóticos como consecuencia de la inducción de las enzimas hepáticas, y han sido de utilidad en pacientes que presentan conducta agresiva. También se han utilizado en pacientes resistentes al tratamiento, pero los resultados son controvertidos (Schwarz 2008) [A1], Leucht 2007) [A1].
Benzodiacepinas: muy utilizadas en el manejo del paciente con esquizofrenia ya que sufren de ansiedad e insomnio. También se les utiliza para controlar la agitación aunque con resultados discutibles. Se ha agregado al tratamiento antipsicótico en pacientes resistentes a tratamiento con resultados dudosos. En general, se debe aceptar que estos fármacos, frecuentemente asociados con antipsicóticos en casos de deficiente respuesta terapéutica, no se han mostrado más eficaces que la clozapina; por ello, debe reservarse su uso para aquellos casos en que los tratamientos con clozapina o con antipsicóticos atípicos no sean eficaces (Volz 2007) [A1].
ESQUIZOFRENIA REFRACTARIA
Desde la definición de Kane de esquizofrenia refractaria en 1988 (Kane 88), ha habido mucha controversia sobre el concepto de respuesta. ¿Qué se entiende por respuesta a los antipsicóticos en la esquizofrenia? ¿El objetivo del tratamiento es la disminución de los síntomas positivos (psicosis) o buscar el buen funcionamiento del paciente en la sociedad? (Andreasen 2006). Entre estas dos metas existe una gran diferencia. Si nos basamos en la primera, la disminución de los síntomas positivos, podríamos considerar que existe al menos un 20 a 30% de pacientes refractarios, pero si basamos la meta en la funcionalidad del paciente, podríamos considerar que existe más de 80% de pacientes refractarios, por lo que tendríamos que replantear el tratamiento de la esquizofrenia hacia un manejo integral y no solo hacia la administración de antipsicóticos (McGlashan 2005) como se hace en la mayoría de las instituciones de salud mental de América Latina. Por otro lado, el principal tratamiento de la esquizofrenia en la actualidad sigue siendo con antipsicóticos (primera y segunda generación); sin embargo, el buen funcionamiento del paciente no solo depende de la disminución de los síntomas positivos sino también de la disminución de los síntomas negativos y cognitivos, para los cuales, a la fecha, no existen tratamientos óptimos (farmacológicos y no farmacológicos) que presenten una alta evidencia (Whittington 2010). Ante este panorama no nos queda más que seguir contemplando la respuesta al tratamiento en términos de los síntomas positivos y proponer la definición de la Asociación Psiquiátrica Americana, que establece como refractario a un paciente que no ha respondido a 2 antipsicóticos diferentes en monoterapia de 4 a 6 semanas de duración (de primera o segunda generación) a dosis adecuadas (equivalente a 400 mg/día de clorpromazina). En este concepto, la respuesta está basada en la disminución de manera significativa de los síntomas positivos, valorada por escalas de psicopatologia como la PANSS y la BPRS, con una disminución de al menos 30% en los ítems relacionados (American Psychiatric Association 2004).
En la actualidad, a nivel de intervención farmacológica, una vez que el paciente cumple los criterios para esquizofrenia refractaria, el siguiente paso es la utilización de clozapina antes, inclusive, que la combinación de antipsicóticos, que no ha demostrado eficacia y sí mayores efectos secundarios (Marian 2010) [B3], Hill 2013) [A2].
Utilización de la clozapina
La clozapina es el antipsicótico, prototipo, de segunda generación (atipico), aprobado por la FDA en el tratamiento de la esquizofrenia refractaria o con alto riesgo suicida (Meltzer 1997; American Psychiatric Association practice guidelines 2003, Kerwin 2003). Fue utilizado como antipsicótico desde 1972 y retirado del mercado en 1975 por haber producido muertes, en ese entonces de origen desconocido.
Reintroducido en 1989, cuando después de muchos estudios se llegó a la conclusión de que era el antipsicótico más efectivo y de haber encontrado el mecanismo de la causa de muerte, es decir, la agranulocitosis y, en menor grado, las miocardiopatías, fue aprobado por la FDA solo para el tratamiento de la esquizofrenia refractaria y con muchas advertencias sobre los efectos secundarios, probablemente letales (Crilly 2007) (cuadro 5).

Farmacocinética
La absorción de clozapina es compleja, la biodisponibilidad es de 60 a 70% después del primer paso metabólico. El pico de concentración después de una dosis oral se observa a las dos horas y media, y la comida no parece afectar la biodisponibilidad del medicamento. La vida media de la clozapina es de 14 horas; sin embargo, está comprobado que una sola dosis al día es suficiente; se excreta en orina. El mayor metabolito de la clozapina es la norclozapina (desmetil-clozapina), que es un metabolito activo. El sistema P450 isoenzima 1A2 es el principal responsable del metabolismo: no obstante, las isoenzimas 2C, 2D6, 2E1 y 3A3/4 también tienen un rol importante en el metabolismo. Agentes que inducen (fumar cigarros) o inhiben (teofilina, ciprofloxacina, fluvoxamina) dichas enzimas, incrementan o disminuyen el metabolismo de la clozapina (Trevor 2003).
Indicaciones
Las únicas indicaciones en la actualidad aprobadas por la FDA son: esquizofrenia refractaria, pacientes con esquizofrenia y alto riesgo suicida (American Psychiatric Association practice guidelines 2003) [A2]. Existen otras condiciones, aún no aprobadas por la FDA, en las que se ha llegado a utilizar la clozapina, como en la enfermedad de Huntington, en los síndromes tardíos, en el trastorno bipolar y en la psicosis del paciente con enfermedad de Parkinson; algunos autores la están proponiendo como primera elección en el primer episodio psicótico (Girgis 2011) [B1].
Contraindicaciones
Pacientes con problemas mieloproliferativos, epilepsia descontrolada, pacientes con neutropenia, alergia a la clozapina y en pacientes con antecedentes de haber presentado agranulocitosis y miocardiopatías en el tratamiento con clozapina. No está contraindicado, pero debe utilizarse con precaución en pacientes que experimentaron neutropenia y síndrome neuroléptico maligno con el uso de clozapina, en pacientes con epilepsia con buen control, pacientes con cardiopatía en control (Manu P. 2012).
Dosis
La dosis que regularmente se utiliza para el paciente con esquizofrenia refractaria va de los 200 mg/ día hasta los 900 mg/ día, aunque se ha observado pacientes que han respondido con dosis de 50 mg/día. Los niveles séricos de clozapina no se han asociado con la respuesta terapéutica (Stark 2012; González 2011).
La forma de instalación varía de acuerdo con las condiciones del paciente; sin embargo, se recomienda iniciarlo en un proceso lento de trituración para evitar los efectos secundarios dependientes de la dosis como la sedación, la hipotensión ortostática y las crisis convulsivas. En pacientes menores de 50 años se recomienda una dosis inicial de 25 mg/día e ir aumentando 25 mg cada tercer día, hasta llegar a la dosis de 200 a 300 mg/día, que es la dosis mínima promedio. Como en la mayoría de las ocasiones el paciente está con otros antipsicóticos, se recomienda no suspender el mismo hasta que la dosis de clozapina esté por arriba de 200 mg/día. Es recomendable tener al paciente hospitalizado durante este proceso de inicio de la clozapina para llevar una vigilancia estrecha de los efectos secundarios y de la combinación temporal de dos antipsicóticos (Nielsen 2011).
Efectos secundarios
A pesar de que es el antipsicótico que más efectos secundarios tiene (incluyendo típicos y atípicos), la clozapina es el antipsicótico más seguro y con mayor adherencia terapéutica (McEvoy 2006). Estudios recientes lo han asociado con menor mortalidad en los pacientes con esquizofrenia (Tilhoen 2009). Por otro lado, el hecho de que su uso conlleva a un monitoreo estrecho favorece el apego al tratamiento.
Los principales efectos secundarios, no por frecuencia, sino por ser potencialmente letales, son la agranulocitosis y la miocarditis. Ambos tienen un alto riesgo de mortalidad y es por ello que se tienen que conocer e identificar tempranamente (Cohen 2012).
La agranulocitosis ocurre entre el 1 y 2% de los pacientes tratados con clozapina (Alvir 1993), es un efecto que no depende de la dosis (Alvir 1993) y se piensa que pudiese haber una vulnerabilidad genética (Athanasiou 2011; Reznik 2006); el 85% de los casos ocurre dentro de las primeras 18 semanas de iniciado el tratamiento, el 95% (Young 1998) dentro de los primeros seis meses, con reportes esporádicos de que llega a ocurrir posterior a los seis meses e incluso años después, y en la mayoría de las ocasiones asociada con el inicio de un nuevo medicamento como valproato, lamotrigina, carbamacepina (Delmer 2011). Ante esta condición es requisito la monitorización de la cuenta de leucocitos y neutrófilos, semanalmente las primeras 18 semanas y mensualmente durante el resto del tratamiento.
El pródromo de la agranulocitosis es por lo general mayor a una semana, lo que fundamenta la prevención a través del monitoreo semanal. Sin embargo, en pocas ocasiones se llega a presentar en menos de cinco días, por lo que conocer que los síntomas que se presentan son la fiebre, odinofagia y malestar general que podrían observarse en otras condiciones en pacientes que están tomando clozapina, nos llevan a tomar una biometría hemática para evaluar la situación y decidir sobre la continuación o suspensión del medicamento. La agranulocitosis, neutrófilos por debajo de 500, es una condición médica grave que requiere de manejo por el servicio de urgencias (Alvir 1993).
La miocarditis asociada a clozapina es un evento poco frecuente pero con alto riesgo de letalidad, por lo que es necesario tenerlo en cuenta. El riesgo absoluto de miocarditis asociado a clozapina es del 0.01 al 0.08% (Committee on Safety of Medicines 1993; La Grenade 2001). El tiempo de presentación es de 14 a 22 días de haber iniciado el tratamiento en más del 90% de los casos. Los signos y síntomas principales son: fiebre, taquicardia y dolor torácico. Los estudios de laboratorio pueden indicar eosinofilia (que puede ser el primer marcador), aumento de la proteína C reactiva, aumento de la CPK mb y aumento de la troponina i, siendo ésta la más sensible de las pruebas de laboratorio para hacer el diagnóstico (Kathlyn). Es necesario, cuando se sospecha de miocarditis asociada a clozapina, la valoración por cardiología, que se deberá apoyar con estudios de gabinete como la placa de tórax, el EKG y el ecocardiograma. Al igual que en la agranulocitosis, si se llegase a sospechar de esta entidad, lo primero que hay que hacer es suspender súbitamente el medicamento (Alvir 1993).
Existen otros efectos secundarios más frecuentes pero menos peligrosos que la agranulocitosis y la miocarditis. Estos efectos como la sedación, crisis convulsivas, hipotensión y taquicardia, son efectos dependientes de la dosis; el aumento gradual de la misma es un factor importante para disminuir estos efectos (Carl 1998). En el caso de las crisis convulsivas, dosis por arriba de 600 mg/ día aumentan un 5% el riesgo de las mismas (Sandoz 1995); en este caso se podría disminuir la dosis o bien agregar un antiepiléptico para la protección del paciente. Al igual que con otros antipsicóticos, la clozapina tiene efectos severos sobre el metabolismo, mismos se manejan en el capítulo de efectos metabólicos (Volavka 2002).
En un estudio (Tiihoen, 2009) realizado en Finlandia se analizaron los registros de casos de pacientes con esquizofrenia (cohorte de 66,881) con tratamiento antipsicótico desde 1996 a 2006, para comparar la mortalidad de estos pacientes contra la población general y correlacionar estos datos con el uso de antipsicóticos.
Contrario a lo esperado se comprobó algo muy importante: la sobrevida se incrementó con el uso de antipsicóticos respecto a la población general. De igual forma, la sobrevida también fue mayor en los pacientes con tratamiento antipsicótico respecto a los pacientes con esquizofrenia que no recibieron tratamiento. Durante el tiempo del estudio, el uso de antipsicóticos atípicos se incrementó de 13 a 64%.
En conclusión, la clozapina ha demostrado superioridad sobre varios fármacos estándar en un gran número de comparaciones en cuanto a adherencia al tratamiento y en la disminución de las tasas de recaída, asociadas a un tratamiento prolongado con otros antipsicóticos.
Según un meta-análisis, ha mostrado eficacia superior en pacientes con esquizofrenia resistente a tratamiento, siendo considerada el antipsicótico más efectivo en el control de síntomas en pacientes con una inadecuada respuesta a tratamiento con neurolépticos convencionales, por lo que sigue siendo el fármaco de elección para esquizofrenia refractaria, reportándose menos efectos adversos extrapiramidales, razón por la cual es bien tolerada (Wahlbeck 2000).
En contraste con los antipsicóticos típicos y muchos otros atípicos, clozapina no solo reduce los síntomas positivos sino que también puede mejorar los síntomas negativos y cognitivos de la esquizofrenia, así como disminuir la agresividad. Además, se ha asociado con la reducción de las conductas suicidas, por lo que ha sido aprobada para este fin. Desafortunadamente, su uso ha sido limitado por sus efectos adversos, raros pero fatales, siendo el más importante la agranulocitosis, aun cuando se presenta con una incidencia relativamente baja debido a la vigilancia médica cercana necesaria para su uso seguro; en consecuencia, es indispensable un monitoreo adecuado del tratamiento.
En general, los pacientes parecen responder mejor a clozapina que a los antipsicóticos típicos cuando se evalúan las puntuaciones de síntomas y la mejoría clínica global, además de ser más tolerable en el tratamiento a largo plazo.
TERAPIA ELECTROCONVULSIVA (TEC)
En 1934, Ladislas Von Meduna, médico del Instituto Psiquiátrico de Praga, observó que 38% de los pacientes con esquizofrenia que presentaban convulsiones tenían una dramática disminución de los síntomas de aquella enfermedad y, por otra parte, no encontró ningún paciente con epilepsia y esquizofrenia. Consideró entonces que podría existir un mecanismo por el cual las crisis convulsivas confieren un factor protector contra la psicosis; por lo tanto, el siguiente paso de Meduna fue desarrollar un método (el cual ya había probado antes en modelos animales) de inducción de convulsiones por métodos químicos en humanos. De esta búsqueda nace el Cardiazol (Fink 1984). De esta forma, inició la historia del uso de la Terapia Electroconvulsiva (TEC) en las enfermedades mentales, específicamente orientada al tratamiento de la esquizofrenia. Posteriormente, dos médicos italianos, Lucino Bini, Cerletti (Endler NS 1988), inspirados en el trabajo de Meduna, buscaron inducir crisis convulsivas por medio de estímulos eléctricos, y fueron ellos quienes por vez primera utilizaron un equipo capaz de generar estas crisis a través de una corriente eléctrica. Su primer paciente fue un joven a quien se le había diagnosticado esquizofrenia; en su reporte, dichos autores comentaron que el desenlace de ese paciente fue la recuperación ad integrum. Por muchos años, la TEC fue el tratamiento para pacientes con enfermedades psiquiátricas. Hasta los años cincuenta, con el advenimiento de los psicofármacos, el uso de la TEC entró en una fase de relegación ante la expectativa de control de la enfermedad mental con estas nuevas herramientas terapéuticas; sin embargo, como se discute en la presente guía en los capítulos de tratamiento farmacológico, dichas intervenciones tienen limitaciones en las tasas de remisión y respuesta de los síntomas de la esquizofrenia, por lo que en los últimos años se ha regresado a un antiguo conocido: el tratamiento con TEC, con nuevos equipos electro-médicos que restringen de manera importante la dosis total de energía que el cerebro recibe para provocar una crisis generalizada y con el uso de anestésicos y relajantes musculares que limitan de manera importante efectos no deseados, primordialmente los osteomusculares (Max Fink 1996).
Con la finalidad de orientar el uso clínico de la terapia electroconvulsiva en pacientes con diagnóstico de esquizofrenia, se analizó la información disponible con respecto a este tema en la literatura médica, siguiendo las recomendaciones para el desarrollo de guías clínicas basadas en la evidencia. Es importante resaltar que esta metodología adolece de sesgo metodológico toda vez que en el uso de la TEC existe la dificultad ética de efectuar ensayos clínicos empleando la terapia electroconvulsiva "sham" (TEC simulada en donde solo se anestesia al paciente, se colocan los electrodos de descarga del estímulo eléctrico y se efectúan todos los demás procedimientos con excepción de no permitir la descarga del estímulo de ondas cuadradas bifásicas), por lo que de antemano se consideró que al final de estas recomendaciones de uso de la TEC en esquizofrenia, se revisarán algunas otras para el diseño de dichos estudios, los cuales son necesarios para incrementar la evidencia científica de los hallazgos hasta el momento encontrados.
Metodología
Se efectuó una revisión de las bases de datos de PubMed, Psycoinfo, HighWire, Ovid, COCHRANE, considerando los siguientes aspectos de interés para la presente revisión:
Artículos que reportaron el uso de la TEC en pacientes esquizofrénicos resistentes a tratamiento, reportes del uso de la TEC con la consiguiente evaluación de los cambios cognitivos resultantes, reporte de uso de TEC de mantenimiento en pacientes con el subtipo catatónico, evaluaciones costo-beneficio de la TEC en este grupo de pacientes, resultados obtenidos en el tratamiento coadyuvante de antipsi-cóticos más la TEC, desenlaces obtenidos en el tratamiento de los episodios psicótico-agudos en pacientes con el diagnóstico de esquizofrenia, estudios con criterios de remisión para esquizofrenia, reportes del uso de este tratamiento en pacientes con esquizofrenia y problemas secundarios por el uso de antipsicóticos de tipo disquinéticos tanto agudos como tardíos, aspectos del uso en el síndrome neuroléptico maligno, indicación en pacientes con esquizofrenia y comorbilidades con depresión, así como publicaciones de reportes de efectos adversos.
Indicaciones de la TEC en esquizofrenia
En esquizofrenia la TEC parece más efectiva cuanto más agudo sea el cuadro, menor sea la duración de éste y mayor sea el componente afectivo. En las formas catatónicas, la eficacia de la TEC es claramente superior (alrededor del 80%) al tratamiento farmacológico. En los cuadros agudos los resultados son similares a los de los antipsicóticos. En la esquizofrenia crónica, estudios controlados han demostrado menor eficacia de la TEC (Sociedad Española de Psiquiatría 1999) [A3].
Indicación primaria de TEC en esquizofrenia
a) Pacientes con grave agitación psicomotriz o en estupor catatónico.
b) Pacientes en condiciones de grave desorganización conductual.
c) Pacientes que hubiesen tenido tratamientos previos con TEC y se reporte una buena respuesta.
d) Resistencia (6-8 semanas sin respuesta) al tratamiento farmacológico antipsicótico.
e) Imposibilidad de administrar la medicación antipsicótica por negativa persistente del paciente.
f) Existencia de efectos adversos graves de los antipsicóticos.
g) Existencia de clínica afectiva predominante y resistente (esquizoafectivos o depresión secundaria) (Sociedad Española de Psiquiatría 1999) [A3].
h) Preferencia de los pacientes por este tipo de terapia sobre otras.
Recomendaciones generales para la administración de la TEC
En el área clínica de aplicación de la TEC se debe mantener una estricta observación de los parámetros de cuidados clínicos en el proceso de evaluación y tratamiento de la TEC. Se debe documentar cuidadosamente cada sesión de TEC anotando los parámetros de impedancia, dosis administrada, tiempo total de crisis, índice de concordancia e índice de supresión posictal; asimismo, los signos vitales previos y posteriores a cada tratamiento. Se recomienda un estrecho seguimiento por medio de escalas clínicas; éstas pueden ser divididas en dos tipos: aquellas que miden el estado actual del paciente en relación con la esquizofrenia y las escalas clínicas que miden las variables de seguridad de los pacientes, tales como el funcionamiento cognitivo, primordialmente orientadas a observar cambios negativos y/o positivos, orientación en tiempo, lugar, personas y circunstancia. (Anexo 1. Formato de registro del INNN MVS) (Anexo 2. Algoritmo de seguimiento del paciente con esquizofrenia y TEC).
La guía de la Asociación Psiquiátrica Americana (APA) y otras más consideran la obligación y necesidad de monitoreo de parámetros vitales en cada sesión de TEC. En nuestro centro se utilizan presión arterial pre, trans, post TEC a los 5, 10 y 15 minutos, así como al momento de la reincorporación del paciente a las actividades de la sala; saturación de oxígeno durante todo el evento anestésico y durante la crisis convulsiva, frecuencia cardiaca, frecuencia respiratoria, monitoreo electroencefalográfico de la crisis convulsiva, monitoreo visual de la crisis motora (se recomienda ligar en el tercio medio de la pierna más próxima al observador) reportando el tiempo de duración.
La crisis convulsiva generalizada se considera terapéutica desde los 25 hasta los 120 segundos; después de esto no se observan mayores beneficios terapéuticos pero sí se incrementa el riesgo de confusión posictal prolongada y las fallas en la memoria reciente. Un adecuado entrenamiento y conocimiento de los procedimientos de la TEC deben prevalecer en el grupo encargado de proporcionar los tratamientos, un amplio conocimiento de los algoritmos para yugular crisis convulsivas es fundamental, así como la disponibilidad de un carro rojo.
El personal recomendado para la administración de este tratamiento es: 1 médico neuroanestesiólogo cuando sea posible e indispensable; 1 anestesiólogo, 1 médico psiquiatra con entrenamiento en TEC y 1 enfermero(a), quien monitorea las constantes vitales y la crisis motora.
El tipo de equipo que debe ser usado para proporcionar el tratamiento debe tener la posibilidad de dar pulsos ultra-breves de trenes de onda cuadrada; el empleo de equipos con ondas sinusoidales debería desestimarse dada la importante frecuencia de complicaciones físicas y cognitivas que se han reportado con su uso; el equipo debe tener disponible la posibilidad de monitoreo electroencefalográfico y electromiográfico, así como la posibilidad de conteo automatizado de los segundos de duración de las crisis convulsivas; es deseable el monitoreo audible de la crisis convulsiva.
Cada una de las sesiones de TEC deberá efectuarse bajo la técnica anestésica más actual. Las recomendaciones de todas las guías de manejo indican usar anestesia y relajación muscular; en algunos centros aún se encuentra en controversia el empleo de atropina.
Revisión y comentarios de la información publicada
Desde el momento en que se ha decidido hacer uso de la TEC como parte del tratamiento que recibe un paciente con esquizofrenia, se deberán considerar previamente las recomendaciones de la presente guía clínica en lo relacionado con aspectos de tratamientos farmacológicos, debiendo el clínico estar familiarizado con los criterios de esquizofrenia resistente y criterios de remisión en esquizofrenia. Además, deberá estar al tanto de posibles comorbilidades con sustancias, con trastornos del estado de ánimo, de ansiedad, etc., conforme cada caso particular, ya que cada situación clínica comórbida hará la diferencia en la tasa de reducción de síntomas. En lo posible, el médico psiquiatra tratante deberá — previo al consentimiento del paciente (cuando es posible), de los familiares y/o de los responsables legales— precisar los objetivos clínicos que se persiguen en el paciente con esquizofrenia que será sometido a tratamiento con TEC; p. ej.: disminución del riesgo suicida secundario a depresión grave, romper con un estado catatónico, etc.
Los criterios de remisión en esquizofrenia reportados por Andreasen (2005, 2006) se han basado en la evolución de los síntomas longitudinales, en combinación con el tiempo de aparición del primer episodio y de los cuadros de agudización; sin embargo, cuando se aplicó este criterio como medida de desenlace en pacientes esquizofrénicos tratados con TEC, la mayoría de los estudios fueron diseñados con el objeto de observar respuestas globales. Pocos reportes han considerado síntomas particulares como medidas de desenlace. También se han usado criterios diagnósticos del DSM-IV y del CIE-10 por igual; asimismo, los instrumentos clínicos han sido variados, solo existen pocos reportes en los cuales se usa la PANSS como medida de efectividad. El uso de dicho instrumento es deseable en el caso de nuestros pacientes; de manera general, BPRS y CGI deberán ser contemplados para el seguimiento del paciente durante su tratamiento.
Estudios clínicos
Tharyan y Adams realizaron una revisión sistemática de TEC para esquizofrenia, mencionando dentro de sus conclusiones: "Los ensayos incluidos en esta revisión abarcan 5 décadas y no es sorprendente que haya una considerable variación en el diseño de la investigación, en la calidad de los ensayos, calidad de la información y los métodos de administración de la TEC". La revisión contiene algunas pruebas que apoyan la impresión de que se produce una mejoría sintomática más rápida y mayor en el estado mental de los pacientes con esquizofrenia cuando la TEC se agrega a la medicación antipsicótica. Por otro lado, en un resultado de cómo había mejorado el estado mental, se observó una diferencia que sugiere un posible beneficio agregado para la combinación de TEC con antipsicóticos. No obstante, estos datos son limitados, primordialmente en la metodología empleada en los diversos estudios, por lo que las anteriores conclusiones solo deberían considerarse como base de hipótesis para futuros trabajos de investigación. Los resultados de los ensayos que favorecen más firmemente la TEC en el corto plazo (Abraham 1987) [B1] sí sugieren una función clara en el algoritmo de tratamiento del paciente con esquizofrenia al indicar el uso de TEC para las personas que muestran una respuesta limitada a la medicación antipsicótica. Otras revisiones llegan a la misma conclusión (cuadro 5).
Considerando la controversia anterior, también existe además la dificultad de que se dispone de pocos datos sobre los efectos adversos de la TEC en general; aquí se presentan algunos reportes de efectos cognitivos; sin embargo, los resultados también tienen la dificultad de que los estudios no fueron diseñados específicamente para medir estos efectos adversos, especialmente sobre la pérdida de la memoria; de igual manera, existe controversia sobre cuáles son los instrumentos adecuados para medir las fallas cognitivas en la esquizofrenia. A pesar de lo anterior, se puede considerar que la observación clínica reportada en estos estudios es que el deterioro de la memoria no es importante, siendo transitorio, aunque algunos informes cuestionan la validez y perspectivas de estas impresiones. No existen pruebas claras que apoyen o rechacen el uso de la TEC para subgrupos específicos de esquizofrenia. Los autores de ensayos sugieren a partir del análisis primario de los datos continuos, limitados y asimétricos (Fink 2001) [A3], que las personas con esquizofrenia catatónica que no muestran una mejoría rápida después de un ensayo inicial de benzodiacepinas mejoran más rápido con un ciclo de TEC que con la risperidona. Sin embargo, la resolución de los síntomas en algunas personas en este subgrupo puede requerir más de seis aplicaciones de TEC. Los datos limitados sugieren que la TEC no proporciona beneficios adicionales sobre los fármacos antipsicóticos para las personas con esquizofrenia cuya enfermedad es de muy corta duración — menos de 2 meses— (Sarkar 1994) [B1] o en aquellas personas hospitalizadas con enfermedad crónica (10 años o más). Ahora bien, los datos de algunos de los ensayos incluidos en esta revisión sugieren que las personas con exacerbaciones de los síntomas de esquizofrenia pueden responder a la TEC independientemente de la duración de la enfermedad (Chanpattana 2000) [B1]. Ninguno de los ensayos incluidos tomó en consideración directamente la aceptabilidad de los tratamientos para las personas con esquizofrenia. Los datos podrían utilizarse para apoyar el uso de ciclos de hasta 12 sesiones de TEC y, para algunas personas, hasta 20 tratamientos. No existen pruebas para sugerir que solo aquellas personas con esquizofrenia que experimentan características depresivas o catatónicas se beneficiarán de este tratamiento.
Ucok (2006) [B2], en un estudio comparativo, concluye que la eficacia de la TEC fue satisfactoria en un primer episodio a corto plazo, pero la misma eficacia no fue continua a lo largo de un año de seguimiento.
Braga RJ (2005) [A2] refiere en su estudio que la información de datos proporcionada aún es insuficiente para dar conclusiones definitivas sobre la combinación de TEC y antipsicóticos, pero es una estrategia de tratamiento segura y eficiente para pacientes con esquizofrenia resistentes al tratamiento.
Recomendaciones de TEC en esquizofrenia
1. Esquizofrenia catatónica.
2. Pacientes esquizofrénicos resistentes a tratamiento farmacológico.
3. Estado de agitación psicomotriz que no cede ante el uso de antipsicóticos.
4. Esquizofrenia más trastorno depresivo mayor severo con alta intencionalidad suicida.
5. Puede ser usada en adolescentes, pacientes ancianos, mujeres embarazadas con esquizofrenia.
6. Recabar en todo momento el consentimiento informado.
7. Deben darse de 6 a 12 sesiones de TEC con monitorización clínica continua.
8. Medición de la respuesta con PANSS, BPRS, CGI y CALGARY son necesarios.
9. Un esquema de aplicación cada tercer día es recomendable con la finalidad de reducir el riesgo de alteraciones en la memoria.
10. La recomendación de aplicación de TEC es bajo sedación con relajación muscular y apoyo ventilatorio, monitoreo de crisis convulsivas y de signos vitales constantes; en el centro debe existir un protocolo para yugular crisis convulsivas prolongadas (más de 120 segundos).
ESTIMULACIÓN MAGNÉTICA TRANSCRANEAL REPETITIVA (RTMS)
La rTMS de baja frecuencia (1 Hz) sobre la corteza parieto-temporal izquierda es recomendada por este autor al efectuar su revisión en el tratamiento de alucinaciones auditivas que no respondieron adecuadamente al tratamiento farmacológico. Buchan revisó 12 estudios encontrando una ventaja significativa a favor del uso de la rTMS activa comparada con la rTMS "sham" para el tratamiento de alucinaciones auditivas refractarias (Cohen d = 0.76). Encontró una gran diversidad en los estudios. En los primeros estudios efectuados se describen pausas entre las sesiones de estimulación. Actualmente es sabido que la aplicación en la fase aguda de esta terapia es de manera cotidiana; excluyendo este trabajo, el valor de Cohen se incrementó a 0.88. De dos estudios que no se incluyeron en meta-análisis, uno tuvo datos insuficientes para calcular el tamaño del efecto. En conclusión, este meta-análisis demuestra que la rTMS es efectiva y segura al ser usada para reducir las alucinaciones auditivas refractarias. El impacto en la funcionalidad global en el curso natural de la enfermedad con el uso de esta modalidad de tratamiento en pacientes con esquizofrenia, aún está por definirse (Buchan 2010) [B2].
En una revisión efectuada por Stanford AD 2008, se consideró que la rTMS ofrecía además la oportunidad de entender y probar algunos aspectos fisiopatológicos de la esquizofrenia y que, posiblemente, a partir de estudios de la rTMS se podrían desarrollar algunos objetivos terapéuticos. En consecuencia, los estudios que correlacionen las mediciones psicopatológicas que, a su vez, se correlacionen con la excitabilidad cortical, también plantean la necesidad de optimizar los parámetros de la TMS tales como la frecuencia, intensidad y estimulación, y áreas anatómicas. Por lo tanto, actualmente la recomendación para el uso de TMS en esquizofrenia es para estudios experimentales.
III. Intervenciones psicosociales
PSICOTERAPIA
Históricamente, la psicoterapia precedió al descubrimiento de los psicofármacos para el tratamiento de los trastornos psicóticos, demostrándose actualmente que tanto la psicoterapia individual como la familiar, así como las intervenciones de rehabilitación psicosocial, mejoran el resultado del tratamiento farmacológico de la esquizofrenia toda vez que la discapacidad que causa a quien la padece, y la disfunción familiar resultante, no pueden ser solucionadas únicamente con medicamentos. No obstante, no todas las modalidades de psicoterapia son recomendables para la esquizofrenia; incluso algunas, como la psicoterapia psicodinámica orientada al insight (introspección), han mostrado ser ineficaces.
Inicialmente, el interés en el tratamiento psicoterapéutico de las personas que presentan el diagnóstico de esquizofrenia se ha centrado en los síntomas positivos de la enfermedad, con lo que se reduce la frecuencia de recaídas y rehospitalizaciones; esto ha sido particularmente cierto en el caso de la Terapia Cognitivo Conductual. El enfoque puntual sobre los síntomas residuales como las alucinaciones o las ideas delirantes, el apego al tratamiento y algunas habilidades sociales y de autocuidado, ha sido característico. La necesidad de desarrollar modelos de tratamiento cognitivo conductual sobre los síntomas negativos como la alogia, la desmotivación y déficits cognitivos, como la pobre atención que genera fallas en la memoria reciente, son imprescindibles ya que representan la mayor queja de familiares y cuidadores encargados de estas personas. (Turington 2011) [C2].
Recientemente, un estudio clínico controlado llevado a cabo por Grant y colaboradores (Grant 2012) [C2], perteneciente al grupo del Dr. Aaron Beck, quien también participó en el ensayo, estudió el efecto de un modelo cognitivo orientado hacia la recuperación en un grupo de 60 pacientes, por un periodo de 18 meses; demostraron la utilidad de un tratamiento basado en la presencia de Esquemas de Fracaso en estas personas (patrones cognitivos que afectan la emotividad y conducta de los sujetos), el cual estaría presente desde el momento en que han sido diagnosticadas y que genera evitación y aislamiento de su interacción social y laboral. Evidencia como la anterior pone de manifiesto la posibilidad de mejorar los síntomas de bajo funcionamiento que caracteriza a las personas que sufren de síntomas residuales de esta enfermedad.
Muchos investigadores piensan que la disfunción cognoscitiva, es decir, la distractibilidad, las alteraciones de memoria y las limitaciones en la planificación y la toma de decisiones, puede ser la clave de las dificultades que los pacientes enfrentan para restaurar sus niveles de funcionamiento pre-mórbido personal, social y vocacional, o bien, para el retorno a las actividades escolares que desarrollaban al momento de su primer brote psicótico. Sin una cognición conservada (atención, memoria verbal, habilidades visoespaciales, destreza motora y funciones ejecutivas), es difícil alcanzar una vida productiva e independiente, pero afortunadamente los déficits cognoscitivos pueden responder a estrategias de rehabilitación que permiten aumentar la capacidad de los pacientes de aprovechar otros enfoques de tratamiento y mejorar los aspectos de funcionamiento social.
Por otro lado, el entrenamiento en habilidades sociales es un procedimiento educativo estructurado que favorece el desarrollo de las conductas necesarias para establecer y mantener relaciones interpersonales cotidianas funcionales mediante el uso de modelaje, juego de roles y reforzamiento social. El entrenamiento en habilidades sociales imita más la experiencia de un salón de clases que una sesión de psicoterapia convencional.
En este sentido, para muchos pacientes la piscoterapia de grupo puede ser tan efectiva como la individual; algunas de sus ventajas incluyen la interacción social y el apoyo de sus pares, proporcionando redes de apoyo social que resultan especialmente útiles para enseñar competencias interpersonales y de afrontamiento.
En cuanto a las intervenciones familiares, se ha demostrado que éstas disminuyen el riesgo de recaída y mejoran el funcionamiento psicosocial por el beneficio de los programas psicoeducativos y su enfoque en proporcionar esperanza, competencia y expectativas realistas sobre el futuro del paciente.
TRATAMIENTO PSICOSOCIAL
El tratamiento psicosocial surge a partir de la evidencia de que además de la sintomatología psicótica los pacientes con esquizofrenia presentan un sinnúmero de incapacidades psicosociales que afectan su funcionamiento psicosocial, el cual no puede ser mejorado con los medicamentos antipsicóticos más allá de que han demostrado su efectividad para controlar de una manera considerable la sintomatología psicótica, pero no le permiten al paciente adquirir las habilidades psicosociales necesarias para tener un funcionamiento comunitario satisfactorio. De todas las enfermedades que aquejan a la humanidad, la esquizofrenia ocupa el séptimo lugar en cuanto a que incapacita a las personas que la padecen (OMS 1998). Las incapacidades psicosociales de la esquizofrenia ya han sido plenamente identificadas y afectan diversas áreas del funcionamiento psicosocial como la ocupacional/laboral, las relaciones interpersonales, la económica, las vinculaciones de pareja con su componente sexual, así como las relaciones familiares. Las personas con esquizofrenia, en un alto porcentaje, tienen dificultades para tener y mantener una ocupación; en consecuencia, no tienen ingresos y dependen económicamente de su familia. Su problemática psicosocial se agudiza ya que debido al aislamiento social que los caracteriza, generalmente no tienen amigos y su red de apoyo social es muy reducida, afectando la búsqueda de una relación de pareja. De igual forma, las relaciones familiares son un elemento que afecta su funcionamiento psicosocial (sobre todo si existe un ambiente en que la emoción expresada es alta) y que puede generar en crisis familiares y derivar en recaídas del paciente hasta en el 58% de los casos (Brown 1972) [C2], 85% (Leff 1985) [C2] y 62% (Hogarty 1998) [C2] e inclusive a dos rehospitalizaciones en el 77% (Rascón 1998) [C2].
La presencia de estas incapacidades puede ocurrir desde la fase previa al inicio de la enfermedad ya que, aunque todavía no aparezcan los síntomas positivos, el paciente puede percatarse de la ocurrencia de algunos problemas psicosociales como: haber abandonado sus estudios, dejar de trabajar o mantenerse en un estado de aislamiento social, sin salir de su casa, sin relacionarse con nadie, ni siquiera con la familia. La presencia de los síntomas negativos como: la apatía, la falta de energía, la disminución y pérdida de motivación, la pasividad, el aplanamiento afectivo, la empatía limitada, etc., pueden contribuir a complicar esta problemática, por lo que el funcionamiento psicosocial se ve afectado ubicando al paciente en una situación de incapacidad psicosocial.
Inicio de los tratamientos psicosociales
Estos tuvieron lugar en países de primer mundo como Inglaterra y Estados Unidos, y ocurrieron de manera simultánea al tratamiento farmacológico que se inició en los años cincuenta con la aparición de la cloropromacina. Malm 1990 [C2] y Wykes 1998 [C2] han reportado su existencia desde hace 60 años, e inclusive, antes de la aparición de los neurolépticos, y refieren intentos de estas modalidades terapéuticas cuando los pacientes se encontraban recluidos e institucionalizados en los hospitales psiquiátricos de antaño. Sus objetivos han consistido en proveer a los pacientes de habilidades para reducir las incapacidades y, en consecuencia, mejorar su funcionamiento psicosocial, prevenir recaídas y rehospitalizaciones, así como promover el cumplimiento con los medicamentos antipsicóticos. Estas intervenciones se han implementado a nivel individual, grupal o familiar y se han llevado a cabo en hospitales, clínicas, centros de salud, consultorios privados y en servicios de atención comunitaria (Liberman 1994) [C2].
Las primeras publicaciones de los tratamientos psicosociales ocurrieron en la década de los cincuentas y empezaron a incrementarse y a aparecer en las revistas científicas de todo el mundo a tal grado que desde los años ochenta se han publicado:
1. revisiones
2. meta-análisis
3. guías de tratamiento
4. tratamientos basados en la evidencia
Su implementación ha sido recomendada tomando en cuenta su efectividad terapéutica respecto a la cual se pueden mencionar las siguientes:
1. Revisiones: Smith 1980 [C2], Liberman 1990 [C2], Bellack y Mueser 1993 [C2], Penn y Mueser 1996 [C2], Rossler 2000 [C2], Munksgaard y Marder 2000 [C2], Huxley 2000 [C2], Heinssen 2000 [C2], The Harvard Mental Health Letter 2001 [C2], Kopelowicz 2006 [C2].
2. Meta-análisis: Benton & Schroeder 1990 [A1], Mari & Streiner 1994 [A1], Dilk y Bond 1996 [A1], Mojtabai 1998 [A1], Pilling I y II 2002 [A1], Pfammatter 2006 [A1], Kurtz y Mueser 2008 [A1].
3. Guías de tratamiento: Lehman 2003 [A2]; Asociación Psiquiátrica Americana 2004 [A2]; Dixon 2009 [A2]; Dixon 2010 [A2].
4. Utilización de tratamientos basados en la evidencia: Brenner y Pfammatter 2000 [C2], Thornicroft y Susser 2001 [C2], Lehman 2003 [C2], Falloon 2004 [C2], Moser 2004 [C2], Drake 2009 [C2], Shean 2009 [C2].
Un alto porcentaje de los meta-análisis efectuados incluyeron grupos experimentales en los que se combinaba alguna forma de tratamiento psicosocial con tratamiento farmacológico y que se comparaban con grupos controles, los cuales recibían únicamente el tratamiento farmacológico. De todos estos meta-análisis y revisiones se pueden mencionar las siguientes conclusiones:
1. La mayoría de los tratamientos psicosociales en cualquiera de sus modalidades, ya sea individual, grupal o familiar, son efectivos.
2. No es posible ni conveniente aplicar alguna forma de tratamiento psicosocial de manera independiente al uso de los medicamentos antipsicóticos, dada la incurabilidad de la enfermedad y a que cuando ésta tiene un curso crónico, los pacientes necesitarán tomarlos de por vida.
3. Tampoco es posible considerar que los tratamientos psicosociales pueden ser aplicados en sustitución del tratamiento farmacológico. Lo recomendado y conveniente es utilizar en estos pacientes la combinación del tratamiento farmacológico con alguna forma de intervención psicosocial, debido a que mientras los medicamentos controlan los síntomas, los tratamientos psicosociales se encargan de abordar las dificultades psicosociales y las incapacidades ocasionadas por la enfermedad. Finalmente, cuando los pacientes son tratados únicamente con los medicamentos antipsicóticos sin tener ninguna forma de tratamiento psicosocial, el logro básico se traduce en controlar y mantener estable la sintomatología psicótica, pero sin la posibilidad a través del tratamiento psicosocial de adquirir un amplio repertorio de habilidades psicosociales que les permitan tener un mejor funcionamiento psicosocial comunitario. Por lo tanto se concluye de todas estas investigaciones: que los tratamientos farmacológicos y psicosociales son necesarios, imprescindibles y complementarios (Herz 1990) [C2], (Liberman 1994) [C2], (Marder 2000) [C2], (Mojtabai 1998) [C2], (Hogarty 1998) [C2], (Liberman 1998) [C2], (Huxley 2000) [C2], (Valencia 2004) [C2], (Ortega 2001) [C2], (Kopelowicz 2003) [C2], (Dixon 2009) [C2], (Valencia 2012) [C2], (Álvarez 2011) [C2].
En los tratamientos psicosociales se han planteado diversos objetivos con el uso de varias modalidades terapéuticas que permitan adquirir habilidades para tener un mejor conocimiento de la enfermedad, realizar un manejo conveniente de los síntomas, mejorar la adherencia terapéutica, promover la prevención de recaídas así como la adquisición de habilidades psicosociales para mejorar el funcionamiento comunitario respecto a las relaciones sociales, el trabajo, la escuela, la familia, actividades recreativas, el uso más eficiente de los servicios de salud mental o tener una vida más independiente en la comunidad.
En los últimos cincuenta años se han diseñado una gran cantidad de tratamientos psicosociales entre los que se encuentran: el aprendizaje de habilidades sociales (Bellack 2004) [C2], (Glynn 2002) [C2], (Liberman 2007) [C2], (Valencia 2010) [C2], (Valencia 2012) [C2], (Moriana 2012) [C2]), el apoyo para el trabajo (McGurk 2009) [C2], (Mueser 2001) [C2], (Tsang 2001) [C2], (García 2012) [C2]), el aprendizaje del manejo de la enfermedad (Atkinson 1996) [C2], (Birchwood 1989) [C2], (Mueser 2002) [C2]), la terapia psicológica integrada (Brian 2006, Roder 2006), el tratamiento asertivo en la comunidad (Bond 2001) [C2], (Burns 1999) [C2] (Thornicroft 1998) [C2]), la rehabilitación cognitiva (Bell 2009) [C2] (Velligan 2006) [C2], (Vesterager 2011) [C2]), el abordaje cuando existe comorbilidad con el abuso de sustancias (Bellack 2006) [C2], (Ridgely 1990) [C2], (Shaner 2003) [C2]), la psicoeducación a la familia (Bauml 2006) [C2], (Murray 2004) [C2], (Xia 2011) [C2]), el apoyo para la vivienda (McCrone 1994) [C2], (The Harvard Mental Health Letter Part II 2001) [C2], (Trainor 1993) [C2], la prevención de recaídas (Herz 2000) [C2], (Leucht 2003) [C2], (Schooler 2006) [C2], (Kane 2007) [C2], (Godoy 2012) [C2].
El contexto en Latinoamérica
Su existencia es muy reducida ya que, en general, ha prevalecido el manejo exclusivo con los medicamentos antipsicóticos. Sin embargo, se tiene conocimiento por comunicaciones personales realizadas en congresos y eventos científicos por colegas latinoamericanos, que en algunos países latinoamericanos se están llevando a cabo intervenciones psicosociales, siendo el problema principal la no publicación de sus resultados. Hasta donde se tiene conocimiento, solamente en cuatro países de Latinoamérica se han llevado a cabo intervenciones psicosociales, citados por orden alfabético: en Brasil (Zimmer 2003, 2006) [C2], en Chile (Pérez 2009), en Perú (Sotillo 1989) [C2] y en México (Valencia 1987, 1991, 1998, 1999, 2001, 2002, 2004) [C2]. En California, Estados Unidos, se están llevando a cabo intervenciones psicosociales en pacientes latinos con esquizofrenia y sus familiares (Kopelowicz 2003) [C2], así como en pacientes latinos con esquizofrenia de la tercera edad (Patterson 2005) [C2]. El país con mayores contribuciones es México, en donde diversos programas de tratamiento psicosocial se han llevado a cabo en pacientes psicóticos agudos hospitalizados (Anexo 1, pág. 83), en pacientes con esquizofrenia crónicos hospitalizados (Anexo 2, pág. 83), así como en pacientes crónicos no-hospitalizados. Por cuestiones de espacio se describe a continuación un modelo de intervención psicosocial que ilustra una estrategia terapéutica con estas características en pacientes crónicos que viven en la comunidad.
TRATAMIENTO PARA PACIENTES CRÓNICOS DE CONSULTA EXTERNA
Se llevó a cabo en la Dirección de Servicios Clínicos del Instituto Nacional de Psiquiatría Ramón de la Fuente, México, D.F. Una evaluación previa del funcionamiento psicosocial de los pacientes permitió delimitar las áreas que conformarían el tratamiento, el cual fue diseñado por Valencia (1994) [C2], implementado en cinco ocasiones entre 1994 y 2004, y cuya efectividad ya ha sido demostrada (Valencia 1996, 1998, 1999, 2000, 2001, 2002, 2004, 2006, 2007, 2010, 2012) [C2].
El tratamiento psicosocial tiene como objetivos principales que los pacientes adquieran habilidades psicosociales para mejorar su funcionamiento psicosocial comunitario, prevenir recaídas, rehospitalizaciones y mejorar el apego a los antipsicóticos. El tratamiento está conformado por cinco áreas y algunas de las habilidades que se adquieren aparecen entre paréntesis:
1. Área ocupacional/laboral (conseguir trabajo, mantenerlo, ayudar en tareas de la casa)
2. Área social (tomar la iniciativa para empezar una conversación, ser capaz de tener amigos, asistir a eventos sociales)
3. Área económica (manejo y distribución del dinero)
4. Área de pareja/sexual (tener citas, enamorarse, casarse)
5. Área familiar (comunicación, convivencia y resolución de conflictos familiares)
Al inicio del tratamiento se manejan algunos aspectos importantes relacionados con el manejo de la esquizofrenia, entre los que se incluyen las características de la enfermedad (síntomas positivos y negativos), la conciencia de la enfermedad, el uso y cumplimiento de los medicamentos antipsicóticos, sus efectos secundarios, la evitación de recaídas y rehospitalizaciones, así como la adherencia terapéutica. Estos tratamientos se llevaron a cabo por dos terapeutas previamente entrenados; se trabajó en coterapia y bajo la modalidad de terapia grupal, con una frecuencia de una sesión semanal, durante todo un año. Estos tratamientos psicosociales se implementaron como complemento del uso de medicamentos antipsicóticos que estuvieron a cargo de dos psiquiatras.
Para evaluar el tratamiento se utilizaron grupos experimentales que recibieron la combinación de medicamentos antipsicóticos y el tratamiento psicosocial comparados con grupos controles que recibieron únicamente los medicamentos antipsicóticos. Se empleó la modalidad de terapia grupal, con una sesión semanal y un total de 48 sesiones. Se evaluó a los pacientes al inicio y al final del año de tratamiento y se encontró que los pacientes que recibieron el tratamiento farmacológico y el tratamiento psicosocial mejoraron de una manera considerable y estadísticamente significativa su sintomatología (p < 0.001), funcionamiento psicosocial, (p < 0.001) y actividad global (síntomas y actividad psicológica, social y laboral), (p < 0.001). Asimismo, tuvieron un menor porcentaje de recaídas (11.3%) y rehospitalizaciones (4.5%), un mayor cumplimiento con el uso de los medicamentos antipsicóticos (88.3%), una mayor asistencia a las consultas del tratamiento farmacológico (83.3%), un bajo nivel de abandono del tratamiento psicosocial (17.2%), un alto porcentaje de asistencia a las sesiones terapéuticas (83.3%) y un alto grado de adherencia terapéutica al tratamiento psicosocial (82.8%). Por su parte, los pacientes que recibieron únicamente el tratamiento farmacológico se mantuvieron estables en cuanto a sintomatología y actividad global, en donde no se encontraron diferencias estadísticamente significativas. No presentaron mejorías significativas en su funcionamiento psicosocial ni se hallaron diferencias estadísticamente significativas; reportaron un mayor número de recaídas (32.8%) y rehospitalizaciones (10.6%), su cumplimiento con el uso de los medicamentos antipsicóticos (80%) así como su asistencia a las consultas psiquiátricas (70%) fue menor que los pacientes que recibieron de manera integrada el tratamiento farmacológico y el tratamiento psicosocial, corroborando con estas investigaciones lo que se ha encontrado a nivel internacional respecto a que la forma más efectiva y conveniente de tratar a pacientes con esquizofrenia es combinando los tratamientos farmacológico y psicosocial. La posibilidad que tuvieron los pacientes de asistir a consultas psiquiátricas para el manejo farmacológico y contar con un espacio terapéutico para hablar de manera detallada sobre sus problemas psicosociales, sobre la enfermedad, sus características, síntomas, cómo evitar recaídas y rehospitalizaciones, de la importancia del cumplimiento con los medicamentos antipsicóticos, del manejo de los efectos secundarios, de cómo afrontar ciertas crisis, de adquirir conciencia de la enfermedad, etcétera, les permitieron adquirir habilidades para funcionar de una manera más satisfactoria e integral a nivel biopsicosocial.
La revisión de los resultados de las investigaciones en esta área de estudio indica que en más de cincuenta años de investigación los tratamientos psicosociales han demostrado su utilidad y efectividad, a tal grado que en cualquier hospital o servicio de salud mental de países desarrollados existe alguna forma de tratamiento psicosocial para pacientes con esquizofrenia, siempre como complemento del tratamiento farmacológico. Es imposible e inconcebible que un paciente con esquizofrenia reciba alguna forma de tratamiento psicosocial sin que esté tomando medicamentos antipsicóticos. Marder 2000 [C2] resume la efectividad de los tratamientos psicosociales y su relación con los medicamentos antipsicóticos en cinco puntos importantes:
1. Los pacientes que reciben un tratamiento psicosocial efectivo pueden requerir dosis bajas de antipsicóticos.
2. Los pacientes que reciben las dosis convenientes de antipsicóticos pueden tolerar formas más intrusivas y estimulantes de tratamiento psicosocial que aquellos que están manejados con antipsicóticos de manera inconveniente.
3. Los pacientes que reciben tratamiento psicosocial pueden cumplir de una manera más efectiva con los antipsicóticos.
4. La combinación de las dos intervenciones puede tener un efecto que no sea solo sumatorio o aditivo, pues cada tratamiento incrementa la efectividad del otro.
5. Los antipsicóticos y los tratamientos psicosociales pueden afectar diferentes campos o aspectos de la intervención. Por ejemplo, los medicamentos antipsicóticos pueden ayudar o disminuir la sintomatología psicótica y los niveles de recaídas mientras que los tratamientos psicosociales pueden ayudar a incrementar las habilidades sociales, ocupacionales, vocacionales, etcétera, de los pacientes.
CALIDAD DE VIDA
En este contexto es importante mencionar que una de las áreas más afectadas en pacientes con esquizofrenia es la calidad de vida, variable que permite evaluar aspectos objetivos y subjetivos de la vida del paciente relacionados con su bienestar en general y la satisfacción con su calidad de vida en la comunidad. Aunque todavía no existe un consenso internacional respecto a la definición precisa de este componente, su evaluación ha sido recomendada (Malm 1981) [C2], (Young 1998) [C2], (Melle 2005) [C2], (Malla 2006) [C2], (MacBeth 2007) [C2], (Wehmeier 2008) [C2], (Deveci 2008) [C2], (Rocca 2010) [C2] debido al impacto que la enfermedad puede tener precisamente en su calidad de vida. El instrumento más recomendado para evaluar esta variable es la Escala de Calidad de Vida desarrollada por Lehman 1996, diseñada específicamente para pacientes con esquizofrenia. La calidad de vida es un elemento importante en el contexto psicosocial ya que es considerada como un componente relevante en el proceso de recuperación funcional de pacientes con esquizofrenia.
COGNICIÓN
Otro aspecto que afecta de manera considerable a las personas con esquizofrenia es el área cognitiva, que incluye problemas en la atención, concentración y en el aprendizaje de habilidades cognitivas que, básicamente, significan pensar con claridad. En ocasiones, los pacientes tienen dificultades para concentrarse en una actividad por un periodo determinado de tiempo, o prestar atención a detalles específicos que pueden pasar desapercibidos por el déficit cognitivo que con el transcurso de la enfermedad se puede incrementar con dificultades como: poder concentrarse en la lectura, resolver un problema adecuadamente, hacer cálculos mentales o aprender nueva información. Con el fin de mejorar el funcionamiento cognitivo se han desarrollado diversas intervenciones cognitivas como la terapia cognitiva conductual (Tai 2009) [C2]); entrenamiento cognitivo (Hayes 2000) [C2]; cognitive remediation (McGurk 2007) [C2]. Sin embargo, el grupo de trabajo que en el 2009 hizo una revisión de los tratamiento psicosociales para la esquizofrenia, y más específicamente en el área del tratamiento cognitivo, concluyó la necesidad de hacer más investigación en esta área de estudio antes de hacer recomendaciones acerca de su implementación (Dixon 2009) [C2].
PSICOEDUCACIÓN
Actualmente existe una gran necesidad de información sobre las enfermedades mentales en todos los sectores de la sociedad, y en la familia en particular, lo cual dificulta la búsqueda de atención oportuna, trayendo como consecuencia el deterioro de las personas con esquizofrenia. Además, dado el desconocimiento sobre las instituciones y los servicios hospitalarios donde se atienden los diferentes trastornos mentales, las personas y sus familiares no saben a dónde acudir para obtener un diagnóstico y acceder al tratamiento adecuado.
La falta de información promueve el estigma y la discriminación hacia los pacientes y sus familias, razón por la cual se crea una barrera para el proceso de entendimiento, comprensión y aceptación de la enfermedad, dificultando la integración social (Rascón 2010) [C2]. Por tales necesidades es imperioso el desarrollo de la psicoeducación.
El modelo psicoeducativo tiene como finalidad educar e informar, desde una perspectiva bio-psico-social, sobre los conocimientos y aspectos esenciales de la enfermedad mental. Desde esta perspectiva se facilita un enfoque cuya modalidad permite hacer una medicina integral, en la cual diversas disciplinas convergen en el abordaje de las distintas problemáticas que tienen lugar en el ámbito de la salud mental. Sin embargo, hay que señalar que la medicina integral propuesta involucra no sólo a especialistas profesionales sino también a la familia, al paciente y a la colectividad, quienes resultan elementos cardinales que intervienen directamente en los procesos de evolución o deterioro de la persona que presenta esquizofrenia.
La psicoeducación es uno de los componentes principales que han sido propuestos de manera repetida en la literatura para llevar a cabo un programa de rehabilitación integral. La intervención psicoeducativa se brinda tanto a los familiares cuidadores informales como a los pacientes con esquizofrenia. La evidencia disponible de estudios en instituciones (Lincoln 2007) [C1], (Glynn 2007) [A2], (Magliano 2007) [A2], (Pekkala 2002) [A2], (Rummel 2008) [C2], (Satoko 2008) [C2], (De la Higuera 2005) [C2], (Kulhara 2009) [B2]. La mayoría de los estudios revisados han venido utilizando dos formatos principales: el modelo psicoeducativo de Anderson (1983, 1986) [C2].
Justificación de la aplicación
• Importancia de los conocimientos sobre la enfermedad al ser una herramienta potencialmente efectiva para desempeñar habilidades y competencias de cuidado.
• Mayor efecto sobre los factores emocionales en las familias de alta emoción expresada (Yamaguchi 2006) [C2].
• Prevención de recaídas evitables (Satoko 2008) [C2].
• Mejoría de las relaciones familiares ya que pueden estar influenciadas por el tipo de información que estigmatiza al trastorno (Rascón 2009) [C2].
• Decrece el sufrimiento que la enfermedad produce al paciente y a sus familiares.
• Ayuda a liberar la preocupación; su efecto sobre la prevención de suicidios ayuda a detectar y evitar intentos suicidas.
• Genera un cambio significativo en los sentimientos y actitudes de sobreinvolucramiento de los familiares (Rascón 2009) [C2].
• Disminuye el nivel de sobrecarga de los cuidadores, por lo que enseñarles cómo deben atender al enfermo mental mejora considerablemente su calidad de vida y, por extensión, la eficacia de su trabajo en la rehabilitación del paciente (Leal 2008) [A3].
La experiencia en el estudio de la psicoeducación ha permitido reconocer la importancia de la familia informada para brindar mejor apoyo en los siguientes aspectos:
• Decidir qué hacer y qué evitar con la enfermedad y/o con la persona enferma.
• Acudir a la consulta en un servicio determinado.
• Mantener la toma del medicamento.
• Determinar la carrera del enfermo y el uso de los servicios de salud.
• Comprensión del padecimiento y aceptación en la comunidad.
En este orden de ideas, informar a los pacientes, familiares, amigos y a la población sensible es fundamental para que se puedan detectar tempranamente a los individuos con riesgo de desarrollar el padecimiento, no solo a quienes ya presentan síntomas prodrómicos, psicóticos o cualquier otro trastorno dentro del espectro de la esquizofrenia, como el trastorno de personalidad esquizoide, el esquizotípico o el paranoide, haciendo énfasis en los síntomas prodrómicos en la consulta periódica de control del paciente con el fin de evitarle recaídas y reforzarle la necesidad de apego al tratamiento permanente.
La guía psicoeducativa para familiares y/o para personas con esquizofrenia puede ser diversa tanto por el objetivo, el contenido, como por la duración.
Se sugieren los siguientes temas básicos del modelo bio-psico-social:
• Información y conocimiento de la enfermedad.
• Información sobre factores de causalidad.
• Información sobre el tratamiento médico.
• Utilidad del medicamento y sus efectos.
• Definición de recaída o situación de crisis.
• Atención a situaciones de crisis.
• Reacciones emocionales en el proceso de la aceptación de la enfermedad.
• Comprensión del familiar enfermo.
• Identificación y solución de problemas.
• Evolución y crecimiento considerando la enfermedad como una condición de vida.
• Alternativas de red social, de apoyo para las personas con esquizofrenia y para los familiares.
• Directorio de instituciones o asociaciones a los que pueda acudir en busca de ayuda.
Considerando que el personal de salud mental generalmente está muy ocupado con la atención directa de los pacientes y sus familiares, y que por ello no tienen el tiempo necesario para involucrarse en el diseño e implementación de programas psicoeducativos, recientemente se ha desarrollado una modalidad psicoeducativa que se conoce como "psicoeducación de paciente a paciente en esquizofrenia", la cual incluye a pacientes que han demostrado tener "recuperación funcional" y que, previamente capacitados en un programa psicoeducativo que incluye 5 pasos, pueden servir como "moderadores de otros pacientes" con los que pueden trabajar durante 8 sesiones, dos veces por semana, cada sesión con una hora de duración, en grupos de 6 a 10 pacientes. Generalmente, un doctor puede estar presente durante las sesiones para intervenir y aclarar dudas si fuera requerido por los moderadores. En un estudio con estas características realizado por Rummel 2005 [C2], se evaluó el incremento en el conocimiento y concepto de la enfermedad en un periodo de 6 meses, y se demostró que los pacientes (N = 49) que participaron en esta modalidad psicoeducativa mejoraron su conocimiento de la enfermedad de una manera significativa; además, el concepto que tenían de la enfermedad cambió significativamente en 3 escalas: mayor confianza en su doctor (N = 40, p = 0.001), mayor confianza en los medicamentos (N = 40, p = 0.001) y disminución considerable de las expectativas negativas acerca del tratamiento (N = 40, p = 0.001). La evaluación subjetiva de los pacientes respecto a los "moderadores" fue positiva, sobre todo por la credibilidad que encontraron al considerarlos como personas que previamente tuvieron que lidiar con la enfermedad.
INTERVENCIÓN CON LA FAMILIA
El proceso de cambio en las instituciones de salud mental en las últimas dos décadas ha dado lugar a la participación de la familia de una manera diferente: por un lado se le precisa como un agente comunitario que requiere capacitación por el importante papel que se le encomienda; por otro, se reconoce que necesitan apoyo por la carga que llevan al ser cuidadores primarios informales de una persona con esquizofrenia.
En México, al igual que en otras partes del mundo, la familia es y será el agente responsable de cuidado comunitario para la mayoría de los pacientes con esquizofrenia. Entre 60 y 85% de los pacientes vive con su familia (Valencia, 2003) [C2]. Sin embargo, se le brinda poca orientación y ayuda profesional a la familia, es decir, ésta tiene que manejar la problemática que manifiesta el paciente sin conocimiento de la enfermedad, ni entendimiento de la naturaleza bio-psico-social, ni de la importancia del tratamiento integral de la esquizofrenia.
El creciente reconocimiento del estrés experimentado por las familias al enfrentarse con la enfermedad, y su influencia sobre el funcionamiento del paciente, ha sido determinante para que fueran consideradas aliadas en el proceso terapéutico de la esquizofrenia.
Desde la década de los años 70s se han venido realizado estudios sobre la importancia de integrar a los familiares cuidadores, evaluando los efectos de la combinación de los tratamientos farmacológicos con las intervenciones psicosociales, fundamentalmente sobre la relación de la recaída y la expresividad emocional (EE) de los familiares. En la década de los 90s se hizo énfasis en la medición de la eficacia de distintas alternativas terapéuticas y la mejor evolución de la enfermedad, además de observar los efectos en las diferentes expresiones familiares (baja y alta EE), así como una inclusión de variables clínicas relevantes (carga familiar, calidad de vida, estilos de afrontamiento, necesidades familiares, apoyo social) (Perlick 2006) [C2], (Jungbauer 2004) [C2], (Goldstein 1995) [C2], (Leff 2000) [A2], (Falloon 1985) [C2], (Kuipers 1992) [C2], (Tarrier 1988, 1995) [C2], (Vaughn 1992) [C2], (Rascón 2001) [C2], (Valencia 2003) [C2] (De La Higuera 2005) [C2], (Pfammatter 2006) [A2], (Pilling 2006) [B1], (Magliano 2006) [B1], (Caqueo 2009) [A2], (Leff 2012) [A2]. Más recientemente, se han incorporado temas como el efecto de la discriminación y el estigma en la reinserción social, los derechos humanos y la participación social activa de la familia (Magaña 2007, Pedersen 2005) [C2], (Rascón 2012) [C2].
El estudio sobre el impacto en los familiares por la experiencia sin conocimiento del trastorno demostró que de dos familiares cuidadores primarios informales, uno está en riesgo de presentar algún trastorno emocional o físico relacionado con la experiencia de ser el cuidador (Rascón 2010 [C2]). A su vez, los familiares juegan un papel importante en la prevención del suicidio del paciente con esquizofrenia (Rascón 2004) [C2].
La intervención familiar es rentable económicamente para los servicios sanitarios y ha mostrado su eficacia en entornos clínicos asistenciales naturales y en distintas realidades culturales (Dixon 2000) [C2], (Weisman 2012) [C2].
El modelo de las intervenciones familiares
La diversidad de las intervenciones familiares y de los enfoques terapéuticos en la esquizofrenia han permitido destacar rasgos comunes, mismos que Lam 1991 planteó en los siguientes puntos:
1. Aproximación positiva y relación de trabajo genuina con las familias. Se ha evitado culpabilizar a las familias. Trabajo de las emociones.
2. Proporcionar estructura y estabilidad al facilitar un ambiente terapéutico con contactos regulares y de apoyo estabilizador.
3. Centrarse en el «aquí y ahora» al trabajar con los problemas e identificar sus formas de afrontamiento, sus puntos fuertes y débiles.
4. La organización familiar. Se pretende establecer límites interpersonales y jerárquicos, apoyando a la pareja paterna y promoviendo la separación e independencia del hijo enfermo cuando sea posible. Se establece una visión de la familia como un todo.
5. Reestructuración cognitiva. Con los componentes educativos e informativos de las intervenciones, se pone especial atención en exculpar al paciente de su sintomatología y en quitarle cualquier intencionalidad sobre la misma, especialmente sobre la negativa.
6. Aproximación conductual. El trabajo clínico se centra en evaluar los recursos y necesidades de la familia, en establecer metas realistas, fijar prioridades, descomponer las metas en pequeños pasos conductuales. Lo anterior generalmente bajo una estructura de solución de problemas.
7. Mejorar la comunicación. Se pone especial cuidado en entrenar a las familias en corregir las formas de expresión verbal y no verbal para favorecer el apoyo, la relación y la integración.
Los principales modelos terapéuticos de intervención familiar en la esquizofrenia sobre los que se han basado la mayoría de los estudios empíricos de seguimiento, destacan las cuatro siguientes modalidades de tratamiento familiar con mayor soporte experimental:
1. El modelo psicoeducativo (Anderson 1986) [C2].
2. Las intervenciones sociales (Kuipers 1992) [C2], (Leff 1982) [B1].
3. Las intervenciones cognitivo-conductuales (Barrowclough 1992) [B1], (Tarrier 1995) [B1].
4. La terapia conductual familiar (Falloon 1983, 1985, 1993) [C2].
La duración de las intervenciones es variable. Existen formatos de 6 a 15 sesiones (Solomon 1998) [B2], (Szmukler 1996) [B2], (Vaughn 1992) [B2], formatos prolongados de 2 o 3 años (Hogarty 1997) [B1], (McFarlane 1995) [C2] y formatos intermedios entre 9 y 18 meses (Leff 1985) [C2], (Randolph 1994) [C2], (Tarrier 1988) [B1]. Los resultados confirman lo inadecuado de las intervenciones breves frente a las intervenciones de duración intermedia, que mantienen sus efectos durante un período de tiempo y luego remiten, y frente a las intervenciones a largo plazo e incluso indefinidas. En todo caso, existe consenso respecto a la duración mínima de 9 meses a 1 año, y la duración óptima de 2 años, con un apoyo posterior permanente, aunque sea a cierta distancia, de modo que la familia pueda sentir y tener siempre accesible el recurso.
Modalidad de la intervención
La mayoría de los estudios revisados han venido utilizando dos formatos principales: el modelo psicoeducativo de Anderson o el modelo de intervención conductual sugerido por Falloon.
Los resultados indican que ambos son formatos igualmente válidos frente a los cuales no se han encontrado diferencias (Schooler 1997) [A2]. Recientemente se han considerado otras modalidades que incluyen aspectos como la información cultural y la aculturación en la salud mental de los pacientes con esquizofrenia y sus familiares (Koneru 2012) [C2], (Weisman 2012) [C2].
En cuanto a la forma de administración de la intervención, bien sea unifamiliar o multifamiliar en grupo, los resultados indican que ambas modalidades son igualmente eficaces (Leff 1990) [C2], (McFarlane 1995) [C2], lo cual anima al uso de formatos multifamiliares por sus beneficios sobre la socialización y extensión de redes de apoyo natural de las familias, por su menor costo y mayor facilidad de aplicación en entornos clínicos asistenciales.
Vallina 2000 [A2] menciona que un obstáculo para la aplicación de la intervención familiar es que los profesionales continúan ignorando a las familias como objetivo y recurso asistencial. La evidencia recopilada puede contribuir a la modificación de las creencias de los clínicos y de las políticas sanitarias y a que, gradualmente, se vayan imponiendo procedimientos terapéuticos que han probado su eficacia, de los que familias y pacientes tienen derecho a beneficiarse y nosotros la obligación de proporcionar.
Una contribución que resulta de las intervenciones familiares es la formación de asociaciones civiles que se encargan de promover la educación y comprensión social hacia las personas con este tipo de padecimientos, de tal manera que reciban una atención digna, humanitaria, equitativa y eficaz, expresada con la plena inclusión social y legal en el ejercicio de sus derechos, avocados a mejorar la calidad de vida de las personas que padecen una enfermedad mental y la de sus familiares, formando redes sociales de apoyo.
REHABILITACIÓN
Clásicamente, la esquizofrenia ha sido considerada grave y deteriorante, por lo que el enfermo ha sido visto como desahuciado, sufriendo una estigmatización y discriminación severa. En épocas pasadas, padecer esquizofrenia condenaba al enfermo al confinamiento, ya fuera doméstico o institucional, que lejos de aminorar el daño y la incapacidad global del paciente, empeoraba su situación hasta convertirlo en un individuo sin voluntad, carente de toda intensión e iniciativa, prácticamente arrumbado en algún rincón de una institución o de su propia casa.
Para la psiquiatría, la esquizofrenia ha sido el reto por excelencia, el desafío más importante por lo devastadora que resulta ser. En la historia de esta rama médica se encuentra un progresivo avance en el tratamiento de los enfermos, aunque fue hasta el año de 1950 cuando el descubrimiento de fármacos que lograban disminuir los síntomas psicóticos dio paso a un nuevo enfoque terapéutico y aumentó la esperanza de encontrar una curación a tan doloroso padecimiento y de sacar al enfermo de esa penumbra a la que era condenado. Desde entonces fueron apareciendo diversas moléculas que dieron como resultado un vertiginoso progreso en la mejoría de los síntomas actualmente llamados positivos; sin embargo, estos medicamentos no mejoraban los síntomas negativos e inducían una gran cantidad de efectos indeseables y eventos adversos. Este balance clínico fue disminuyendo el estigma de los enfermos, permitía que los pacientes permanecieran más tiempo en casa que en los hospitales de psiquiatría, podían ser mejor manejados en sus domicilios y tratados en forma ambulatoria. En consecuencia, el reto cambió: el nuevo postulado era mejorar los síntomas negativos y promover la reincorporación del enfermo a una vida más activa.
En forma paralela al desarrollo de psicofármacos, otros aspectos de las neurociencias permitieron conocer más profundamente las alteraciones neurofisiológicas y neuroanatómicas que subyacen en la esquizofrenia, así como los conocimientos neurobioquímicos, neuroeléctricos, la investigación en genética, en inmunología, en neuroendocrinología, los avances tecnológicos que han permitido el estudio estructural y fisiológico en vivo de los pacientes a través de la imagenología estructural y funcional, y dieron paso a una comprensión más integral de la enfermedad. Aunque esto no ha sido suficiente para identificar la etiología de la esquizofrenia, sí abrió la posibilidad de que los enfermos fueran vistos como personas susceptibles de mejorar su rendimiento global, recuperar en alguna medida su funcionamiento social y su reincorporación a la vida comunitaria, adoptar una actitud más participativa en su tratamiento y, consecuentemente, lograr que la reinserción psicosocial fuera relativamente posible.
Con base en estos principios, el tratamiento de los pacientes con esquizofrenia fue adoptando no solo mejores alternativas farmacológicas, sino también modelos de rehabilitación. De estos últimos se debe tener presente los principios básicos y un esquema general de abordaje del paciente, ya que si bien no existe un modelo que se pueda considerar único ni que haya mostrado ser el mejor, sí es factible —después de la aplicación y evaluación de las formas de tratamiento— identificar las mejores prácticas que den como resultado una mejor calidad de vida del enfermo, de su familia en general y de los cuidadores principales y del entorno, generando un balance adecuado costo-efectividad en la atención médica de los pacientes con esquizofrenia.
Básicamente, los modelos de rehabilitación aplicados en el mundo a partir de la primera y segunda guerra mundial han desarrollado sus enfoques bajo dos líneas de trabajo: la orientación a la limitación de las discapacidades y la estimulación de las capacidades residuales de los pacientes. Asimismo, el desarrollo de los modelos se ha enfocado en los aspectos del ambiente como lo la familia, la comunidad y la sociedad en general (Watts FN 1990).
En medicina la cronicidad está íntimamente relacionada con la duración de los trastornos, considerándose como agudos aquellos de inicio y evolución más o menos rápida y de duración relativamente corta, hasta lograr la resolución del problema en forma definitiva, lo que puede suceder por curación o por fallecimiento del paciente. Por otra parte, los padecimientos crónicos suelen ser de evolución progresiva y larga, bien sea con inicio insidioso o abrupto, que se prolongan por muchos años o por toda la vida.
En psiquiatría la presentación, evolución e historia natural de los trastornos es compleja. Hay padecimientos que pueden iniciar bruscamente o insidiosamente, evolucionar con persistencia clínica o ausencia de síntomas, presentar brotes del trastorno intercalados con episodios de aparente bienestar; en conclusión, la diferenciación de los trastornos en agudos o crónicos es poco precisa. Se oye decir "esquizofrenia aguda" o "esquizofrenia crónica", "hospital para agudos" "hospital para crónicos", "fase aguda de la esquizofrenia", entre otros.
Para ser congruentes con la terminología médica, se considerará a las enfermedades crónicas como aquellas de inicio y evolución prolongada, con tratamientos de control o paliativos no curativos que generan cierto grado de discapacidad. Tal es el caso de la esquizofrenia.
Bajo este enfoque, y como se mencionó previamente, la esquizofrenia es un trastorno mental severo, con tendencia al deterioro, que afecta las relaciones interpersonales, individuales, familiares y sociales, de evolución crónica y fluctuante, que requiere de diversos manejos según la fase en la que se encuentre y de la cual no se ha identificado la causa específica que la produce. Ante este padecimiento no se ha encontrado una curación, por lo que los tratamientos están encaminados hacia el control de los síntomas y la disminución de la discapacidad que produce, cumpliendo con los criterios de cronicidad generales.
Los esquemas terapéuticos integrales deben incluir las estrategias de rehabilitación, componente que ha sido incluido y enfatizado en todas las propuestas, convenios y consensos internacionales, así como en los esquemas normativos y regulatorios de cada país, sin ser México la excepción.
Dada su evolución, la rehabilitación en sí misma se ha convertido en un abordaje clínico estratégico en la recuperación de la funcionalidad de los pacientes con trastornos esquizofrénicos. Por la trascendencia que este padecimiento tiene para el paciente, la familia y los sectores de salud, la rehabilitación debe estar incluida como un abordaje indispensable para reducir los costos e incrementar los beneficios que conlleva la planificación de estos servicios, desde la institución hacia la comunidad. No obstante, existen condiciones que han influido en el desarrollo de los abordajes de rehabilitación psicosocial y que son de vital importancia considerar en el diseño y planificación de los programas de atención en este campo clínico, como son:

Conceptos generales
Dentro del modelo médico existen tres conceptualizaciones fundamentales para entender lo que significa la rehabilitación psiquiátrica del paciente con esquizofrenia.
La primera de ellas está relacionada con el concepto de Historia Natural de la Enfermedad, el cual nos propone que las patologías, y dentro de éstas las enfermedades mentales, son fenómenos de tipo natural que se caracterizan por tener una evolución determinada. A este respecto se plantea que los trastornos mentales tienen tres periodos evolutivos distintos (cuadro 1):
1. Periodo prepatogénico
2. Periodo patogénico temprano
3. Periodo patogénico tardío
La segunda de las conceptualizaciones, retomadas del modelo médico, corresponde al esquema de niveles de prevención, que se entiende como la serie de medidas que se pueden tomar dentro de cada uno de los periodos de la historia natural de la enfermedad con la finalidad de modificar la evolución de las mismas a través de la prevención, diagnóstico, tratamiento y, en su caso, rehabilitación de los fenómenos ocasionados por la patología. En este esquema se cuenta con tres niveles de prevención, los cuales corresponden a cada una de las etapas evolutivas de la historia natural de la enfermedad (cuadro 2).
Otro aspecto relevante a considerar en las estrategias de rehabilitación son los factores de riesgo que tendrán una influencia directa en la evolución del paciente; sumar dichos factores a las condicionantes de rehabilitación hará más complejo el diseño de estos abordajes. En el cuadro 3, se muestran algunos de los factores de riesgo a considerar.
La tercera conceptualización se refiere al entendimiento de las distintas funciones que realiza el ser humano. En este sentido, la psiquiatría y la psicología se han visto afectadas por la concepción cartesiana de la dualidad mente-cuerpo. Superada esta dualidad a través del entendimiento bio-psico-social, este concepto es el más completo y útil dentro de las ciencias de la salud mental. El significado de esta conceptualización se apoya en la Teoría General de los Sistemas, la cual plantea que el universo está organizado en una serie de subsistemas que, a su vez, están integrados por una serie de elementos interrelacionados, interactuantes e inter-dependientes, motivo por el cual la modificación de un elemento necesariamente afectará a todo el sistema. Con base en lo anterior, el ser humano tiene funciones y capacidades en tres áreas: 1. Biológicas, que dependen de la estructura física y orgánica que posee, constituyéndose por funciones típicamente objetivas; 2. Psicológicas, que son el resultado del funcionamiento mental, siendo estas subjetivas y profundamente individualizadas; y 3. Sociales, que se originan de la ineludible situación de formar parte de un grupo y ser gregarios.
Las tres conceptualizaciones anteriormente mencionadas llevan a las siguientes conclusiones dentro del campo de la salud mental, y en especial dentro del campo de la Rehabilitación Psiquiátrica:
1. La evolución natural de muchos de los cuadros psicóticos no necesariamente tiene que llevar a la cronificación y a inadecuados estilos adaptativos de vida.
2. La rehabilitación en psiquiatría está formada por una serie de medidas obligadas dentro de la actual concepción de la enfermedad mental.
3. Las acciones a realizar tienen que contemplar un enfoque integral de atención para permitir un restablecimiento homeostático sano del sistema humano.
Ahora bien, las enfermedades mentales producen una gran cantidad de consecuencias en el paciente, más no todas inciden de la misma manera en el sujeto. En este sentido, existen tres términos que se prestan a confusión y que en ocasiones se manejan como sinónimos:
• Daño: lesión orgánica y/o funcional de una estructura o función psicológica o fisiológica, consecuencia directa del proceso patológico.
• Incapacidad: lesión o pérdida de la capacidad operativa o de la aptitud funcional que se presenta como consecuencia directa del daño.
• Minusvalía: desventaja que limita o impide el cumplimiento de los distintos roles sociales y que se presenta como consecuencia directa de la incapacidad y del daño.
De esta manera se establece el entendimiento de estos tres términos como pasos evolutivos del deterioro causado por la enfermedad mental, en donde la secuencia daño-incapacidad-minusvalía explica el estado del paciente.
Una vez puntualizadas estas concepciones, es necesario plantear la definición de lo que la rehabilitación significa en psiquiatría, por lo que se citan al menos las más relevantes:
La OMS la define como un término que se aplica a los impedidos mentales y que consiste en el uso racional de procedimientos de validismo, tales como medidas médicas, sociales, educativas y vocacionales, que tienen por objeto adiestrar o readiestrar al individuo para tratar de llevarlo, de acuerdo con sus posibilidades reales, a los niveles más altos de capacidad funcional.
Los autores cubanos la definen como el conjunto de procedimientos biológicos y sociopsicológicos utilizados en aquellos pacientes en que han aparecido como producto de alguna afección mental, incapacidades que les imposibilitan un adecuado ajuste social, y persigue reincorporar al enfermo a la sociedad una vez atenuadas sus manifestaciones psicopatológicas, posibilitando la utilización de sus capacidades remanentes.
Benedetto Saraceno, autor italiano, la define como el conjunto de todas las actividades tendientes a la maximización de las oportunidades del individuo para su recuperación y a la minimización de los efectos discapacitantes de la cronicidad.
David Goldberg, autor inglés, sostiene que es el proceso de restaurar a la persona incapacitada, si no al nivel de funcionamiento y posición social que se había logrado antes del inicio de la enfermedad, por lo menos a una situación en la cual pueda hacer el mejor uso de sus capacidades residuales dentro de un contexto social tan normal como sea posible.
La Norma Oficial Mexicana NOM 025-SSA2-1995 la define como el conjunto de acciones y programas dirigidos a la utilización del potencial máximo de crecimiento personal de un individuo, que le permita superar o disminuir desventajas adquiridas a causa de su enfermedad en los principales aspectos de su vida diaria; tiene el objeto de promover en el paciente el reaprendizaje de sus habilidades para la vida cotidiana cuando las ha perdido y la obtención y conservación de un ambiente de vida satisfactorio, así como la participación en actividades productivas y en la vida socio-cultural.
De estas definiciones se concluye que existen varios puntos coincidentes entre ellas y que constituyen los lineamientos fundamentales de la rehabilitación en psiquiatría.
1. La rehabilitación psiquiátrica encuentra su momento de aplicación cuando aparecen las manifestaciones de las secuelas; por lo tanto, se requiere que exista una cierta disminución de las manifestaciones psicopatológicas más disruptivas. Esto no necesariamente implica esperar el esarrollo de las mismas, sino evitar su aparición.
2. Está constituida por un conjunto de actividades múltiples y variadas en los ejes biológico, psicológico y social.
3. Debe contar con objetivos claros que constituyan la directriz para el desarrollo de las actividades anteriormente mencionadas.
4. Se sustenta en una metodología de aprendizaje o reaprendizaje.
5. Se debe realizar sobre dos aspectos fundamentales:
a) Disminuir al máximo la incapacidad y el impedimento de los pacientes, o sea minimizar la parte enferma, y
b) Aumentar al máximo la capacidad, habilidad y funcionalidad del paciente, o sea, maximizar la parte sana.
6. Debe contar con distintos niveles de aprendizaje ya que no todos los pacientes tendrán las mismas capacidades y posibilidades de reinserción laboral, social, familiar y recreacional.
7. Implica estimular cambios en el paciente así como lograr que tales cambios no se extingan dentro del medio social del mismo, para alcanzar una mayor funcionalidad.
8. Plantea actividades que tengan una utilidad práctica y real para el paciente, y así favorecer su desempeño significativo dentro de su medio social.
9. Distingue entre la rehabilitación propiamente dicha y la reubicación laboral. Esto justifica el intento de rehabilitar a pacientes sin posibilidad de reinserción laboral.
10. La concepción de las actividades no implica un carácter caritativo y basado en la incapacidad del paciente sino en la estimulación y la exigencia de objetivos acordes al mismo.
11. No solamente debe centrarse en promover cambios en el paciente sino también en estimular cambios sociales que posibiliten su reinserción (Herrera 98).
BASES BIOLÓGICAS DE LA DISCAPACIDAD
Los factores biológicos son los de mayor impacto en la presentación de la enfermedad.
Si bien la correlación de las anomalías estructurales y fisiológicas del cerebro con los síntomas es poco clara, se han podido definir fallas en los circuitos neurológicos que explicarían las disfunciones y discapacidades condicionadas por los fenómenos clínicos y darían así mismo fundamento a los procesos de rehabilitación.
Los trastornos en la sensopercepción se asocian con fallas en el lóbulo temporal, los trastornos del pensamiento con fallas en el hipocampo y los síntomas negativos con las perturbaciones de la corteza prefrontal.
Por otro lado, los síntomas cognoscitivos se relacionan con disfunción en el tálamo, estructuras de la línea media y atrofia de los lóbulos frontales y temporales, fallas que predominan en el hemisferio izquierdo.
Finalmente, las alteraciones afectivas que condicionan síntomas depresivos, apatía, desmotivación y anhedonia parecen estar relacionados con una hipofunción de las estructuras que conforman el sistema límbico.
BASES PSICOSOCIALES DE LA DISCAPACIDAD
Los pacientes con esquizofrenia también presentan una disfunción importante en los procesos de adaptación social, lo cual está relacionado con las reacciones del entorno hacia estos pacientes.
La discriminación por parte de la familia y del grupo social al que pertenece el paciente que padece esquizofrenia agrava las circunstancias del enfermo; a su vez, las personas más cercanas también sufren al ser marcados por la estigmatización asociada al trastorno, cerrándose un círculo vicioso que conduce al rechazo y falta de apoyo hacia el paciente.
Las alteraciones clínicas y la estigmatización contribuyen a que los pacientes no logren sus objetivos vitales y formen parte de la comunidad.
PROGRAMAS DE REHABILITACIÓN PARA EL PACIENTE CON ESQUIZOFRENIA
La esquizofrenia es un problema grave de salud pública. Se calcula que más de 25 millones de personas en el mundo la padecen. Estos enfermos sufren de una discapacidad importante que provoca una reducción en su rendimiento global y disminuye su calidad de vida, siendo la tercer causa más discapacitante, ocasionando el 1.1% del total de años de vida ajustados por discapacidad y del 2.8% de los años de vida perdidos por discapacidad.
Esta situación es más grave por el retardo en el diagnóstico y en el inicio del tratamiento. La OMS ha demostrado que hasta el 40% de los enfermos no reciben tratamiento, básicamente por la estigmatización y la ignorancia, mismas que provocan una reacción de evasión y ocultamiento por parte del paciente.
Solo la tercera parte de pacientes logra mantenerse asintomático y con un proceso adaptativo aceptable; sin embargo, el resto de los pacientes presentan persistentemente síntomas clínicos con cierto grado de discapacidad.
Se ha demostrado que las estrategias de tratamiento basadas en programas de reinserción y rehabilitación social, como componente de los recursos asistenciales para los enfermos con esquizofrenia, reduce sustancialmente la discapacidad. Por ejemplo, en una población de pacientes con esquizofrenia no tratados en la India se redujo el puntaje de discapacidad poco más de 75% en año y medio. Asimismo, se ha podido ponderar la participación del efecto psicosocial en la mejoría clínica de los pacientes con esquizofrenia, encontrándose que es de aproximadamente 23%.
Necesidades de rehabilitación
Para efectos prácticos, en lo concerniente a un programa de rehabilitación, la clasificación de esquizofrenia que resulta de mayor utilidad es la de Crow, quien subdivide los síntomas en positivos y negativos.
Clásicamente, los síntomas positivos suelen ser muy floridos y prácticamente incapacitantes en forma total; sin embargo, los pacientes responden a los antipsicóticos de manera notoria, reduciéndose en forma sustancial y, frecuentemente, en su totalidad. No así los síntomas negativos que aunque suelen ser menos evidentes y alarmantes, condicionan también una discapacidad severa y, a diferencia de los positivos, no tienen una respuesta adecuada al uso de psicofármacos.
Con base en lo anterior, los programas de rehabilitación deben estructurarse como una estrategia asistencial que se incorpore al abordaje integral de los pacientes con trastornos esquizofrénicos, centrando la atención en la integración de la conciencia de enfermedad, la aceptación del tratamiento farmacológico y la continuación del mismo (a lo que se denomina en conjunto alianza o adherencia terapéutica) y, por otro lado, en las disfunciones cognoscitivas, afectivas y volitivas que dificultan la integración del enfermo a la vida familiar y comunitaria.
Objetivos de la rehabilitación
"Se podría decir que el objetivo principal de la rehabilitación es lograr la mejor recuperación funcional del paciente con miras a la reintegración familiar, social y laboral de acuerdo con sus intereses y capacidades, en función del entorno al que se pretende reintegrar." Por lo tanto, la rehabilitación tendrá que ser un dispositivo que favorezca el mejor desarrollo de sus capacidades y un espacio que fomente su interés por asumir un nivel de actividad que le permita vincularse a su vida de acuerdo con los roles que el paciente elija y el desarrollo de habilidades que le permita desempeñar los mismos (Herrera 98).
Objetivos directos
Los objetivos deberán ser planteados por niveles, es decir, por el grado de posibilidades de acuerdo con las capacidades remanentes y funcionalidad que la misma enfermedad les permita.
El primer objetivo fundamental para la consecución de un tratamiento global es lograr la alianza terapéutica entre los profesionales de la salud mental, el enfermo y su familia, lo que permitirá que el paciente continúe su tratamiento integral incluyendo el uso de los psicofármacos, ya que estos serán los que garantizarán la estabilidad clínica.
En segundo término debemos considerar la posibilidad de lograr que el paciente reaprenda un esquema de hábitos de autocuidado y mantenimiento de supervivencia básica.
El siguiente objetivo es lograr que el paciente se incorpore a la organización familiar, asimilando e integrándose a las disciplinas, actividades y colaboración.
Otro punto importante es que el enfermo pueda desarrollar las actividades de la vida cotidiana como, por ejemplo, lograr que tenga un manejo consciente de sus experiencias emocionales y mantenga una comunicación fluida y espontánea con su entorno familiar.
El siguiente objetivo es que el enfermo reinicie sus actividades dentro del entorno social general, incorporándose a actividades con amistades, uso del tiempo libre y esparcimiento.
Finalmente se debe lograr la incorporación del enfermo a alguna actividad productiva en términos de desarrollo o remuneración, esto es, la escuela o algún trabajo.
Es fácil notar que estos objetivos no están siempre escalonados en el orden presentado; deben abordarse en forma conjunta para obtener avances de diferente magnitud en cada área trabajada, logrando mejoría en algunos aspectos y en otros no.
Sin embargo, el eje central de todas estas actividades es la procuración de una calidad de vida cada vez mayor. Esto significa que el sujeto y su familia deberán desarrollar su potencial en la mejor forma posible, alcanzando metas y cumpliendo las expectativas personales y grupales que conduzcan a la sensación de tener una vida satisfactoria en la medida en que el trastorno y el apoyo familiar lo permitan.
Objetivos indirectos
• Reducir las tasas de recaída de los pacientes.
• Disminuir el número de internamientos hospitalarios anuales.
• Disminuir la carga económica y afectiva que representa la enfermedad para el paciente, su familia y la sociedad.
En resumen, lo que se pretende es que el enfermo logre un grado aceptable de autonomía, mantenga una integración del concepto de sí mismo y del entorno para que consiga una vida integral con satisfacción de sus necesidades básicas, desarrolle una actividad productiva y se enriquezca a través de actividades recreativas y de desarrollo humano.
Modelo general
Usaremos como guía un modelo que ya ha probado sus bondades terapéuticas. Este modelo, diseñado por Liberman, se basa en la visión de cuatro dimensiones de la incapacidad que genera la esquizofrenia.
La primera dimensión es la Patología en sí misma, que se refiere a las lesiones o anormalidades cerebrales generadas por algún agente etiológico que delimitará el sustrato o equipo biológico con que se cuenta.
La segunda es el Deterioro provocado por la patología, y se refiere a las alteraciones en la funcionalidad física y mental.
La tercera dimensión es la Discapacidad, que se reflejará en la restricción, limitación y falta de habilidad para desarrollar las actividades de la vida cotidiana.
La última dimensión es la Minusvalía, determinada por las discapacidades que el paciente tiene y por la existencia y características de una red de apoyo familiar y social que le permitan adquirir, asumir y desempeñar un rol específico individual en el medio familiar y el entorno social.
Características de un programa
Las enfermedades mentales tienen como particularidad que son de origen multifactorial, lo que obliga a que los pacientes que las padecen sean atendidos desde diferentes puntos de acción. Un programa de rehabilitación debe encuadrar en este principio, por lo que sus características generales son:
• Debe ser general e incluyente.
• Siempre debe formar parte de un sistema integral de atención.
• Debe iniciar tempranamente, es decir, desde la hospitalización misma.
• Debe existir continuidad de manera ambulatoria en programas de hospital de día o servicios de rehabilitación específicos.
• Debe contar con la posibilidad de particularizarse.
• Se debe basar en la evaluación integral del enfermo y del grado de discapacidad en las diversas áreas.
• Debe evaluarse el potencial de la red social de apoyo para contener y fortalecer al enfermo y su proceso de rehabilitación.
• Debe tenerse un enfoque de atención al daño, la incapacidad y minusvalías.
• Debe estar sustentado en los conocimientos científicos, médicos y administrativos que permitan el desarrollo de programas de atención en salud.
• Las actitudes personales del personal de salud, del paciente y de la familia son importantes, pero deben situarse como estratégicas.
• Debe incluir al cuidador primario en programas de psicoeducación.
Aspectos a evaluar
Considerando que un programa de rehabilitación tiene que ser integral para cumplir con los objetivos planteados, deben evaluarse las características globales del enfermo. En consecuencia, es necesario definir las circunstancias en las que se encuentra desde todos los enfoques clínicos, abordando los siguientes rubros:
• Síntomas psiquiátricos.
• Síntomas neurológicos.
• Disfunción física.
• Disfunción psicológica.
• Disfunción social.
La evaluación integral exige que se siga un método que tenga aspectos indispensables y aspectos opcionales, mismos que pueden ser definidos por el equipo de salud.
Indispensables:
• Historia clínica completa.
• Evaluación ocupacional.
• Examen físico.
• Exámenes paraclínicos necesarios (de rutina y específicos).
Opcionales:
• Escala breve de Evaluación Psiquiátrica.
• Escala de Impresión Clínica Global.
• Inventario de Discapacidad de Sheehan.
• Inventario de Actitudes hacia la Medicación.
• Lista para evaluar la calidad de vida del paciente con esquizofrenia de Malm.
• Entrevista para evaluar la calidad de vida de Lehman.
• Evaluación del déficit esquizofrénico de Heinrichs.
• Evaluación de la calidad de vida de Bigelow.
• Evaluación del funcionamiento global del DSM.
• Escala de Observación de tareas enTerapia Ocupacional (OTTOS) de Russell, Sharon A. Harrison, Hilary J. Robinson, Gretha Jayaram.
• Entrevista Histórica del Funcionamiento Ocupacional (OPHI-II), Henry A. y Walens D.
Una guía general para el diseño de estos programas puede basarse en las aportaciones de la Asociación Americana de Terapia Ocupacional "Marco de trabajo para la práctica de terapia ocupacional (2008)", resumido en el siguiente esquema:
Propuesta general de actividades
Se han propuesto diversos modelos de abordaje rehabilitatorio; éstos consideran el ámbito asistencial donde se desarrollen pudiendo ser el medio hospitalario, un programa de casa de medio camino, un esquema de hospitalización parcial o en algún ambiente comunitario diferente. En cualquiera de los casos se deberá diseñar el programa específico para los pacientes, teniendo aquí algunas alternativas propuestas de acuerdo con el momento en que se encuentre el paciente (cuadro 4).

Todas estas actividades deberán estar enmarcadas dentro un horario regular que permita mantener una estructura general de la vida cotidiana del enfermo.
Asimismo, deberán contar con una extensión dentro del medio familiar, donde se refuerce y amplíe la conformación de hábitos, la estimulación adecuada de expresiones emocionales e intereses y la inducción al medio social.
MANEJO COMUNITARIO
Programas comunitarios para la atención de la esquizofrenia
Los equipos de salud mental comunitarios han sido el modelo básico para el desarrollo de otros equipos más especializados. Se trata de equipos multidisciplinarios integrados por enfermeros, trabajadores sociales, psicólogos y psiquiatras ubicados en los centros de salud mental comunitarios o, como en el caso de México, en los hospitales psiquiátricos. El tamaño de los equipos puede variar entre 6-10 personas hasta 20, dependiendo de la inclusión de programas de intervención precoz, de intervención en crisis, atención domiciliaria, etc. Estos equipos presentan amplias diferencias en función de la organización sanitaria del contexto en el que actúan, aunque son consistentes a nivel internacional en cuanto a su función y objetivos.
La esquizofrenia es un paradigma de los trastornos multifactoriales; en consecuencia, su valoración y manejo requieren atención y respuesta en todas las áreas y, por lo tanto, una buena calidad de los cuidados de salud mental que se caracteriza por la valoración detallada y amplia de los problemas y necesidades de los pacientes.
En este sentido, en el Reino Unido y en otros países europeos se desarrolla desde 1990 un programa de cuidados, el Care Programme Approach (CPA), diseñado para que personas con necesidades especiales o de manejo complejo tengan un plan de cuidados protocolizado (Department of Health 2006).
En nuestro medio, los programas de atención al paciente con esquizofrenia son realizados desde 1993 en los institutos y centros hospitalarios, (Villamil 2006) donde se encargan de realizar una valoración integral de las necesidades de los pacientes y una revisión periódica del plan de cuidados para poder ofrecer una respuesta integral, así como un seguimiento y apoyo continuo de los cuidados.
Gestión de casos (GC) y tratamiento asertivo comunitario (TAC)
Existe un tipo de pacientes con trastorno mental severo caracterizado por la gravedad, persistencia del trastorno y discapacidad, que no pueden recibir una adecuada atención psiquiátrica por la dificultad para acceder a los equipos comunitarios o para permanecer en ellos (Guía de Práctica Clínica 2012).
La GC o el TAC, diseñados para este tipo de pacientes, no son tratamientos en sí mismos sino modelos de aproximación al paciente y de estructuración y gestión de los recursos que éste precisa. Estos se diferencian fundamentalmente en que la GC es llevada a cabo por un profesional, el gestor de casos, mientras que el TAC lo realiza un equipo específico.
Inicialmente, la GC tenía una función administrativa que consistía en poner en contacto al paciente con los servicios requeridos y coordinar a los distintos proveedores, es decir, la evaluación, planificación, contacto con los servicios, seguimiento y defensa de los derechos de los pacientes. Pronto evolucionó hacia el manejo clínico de caso, que combina los cuidados de la salud con los de gestión y coordinación de servicios. Ofrece servicios en cuatro áreas:
1. En la fase inicial: compromiso, evaluación y planificación.
2. Intervenciones dirigidas al entorno: contacto con recursos comunitarios, con la red social del paciente, incluidos la familia y otros apoyos.
3. Intervenciones dirigidas al paciente y su entorno, intervenciones en crisis y seguimiento.
Dentro de la GC hay algunas variantes que se enmarcan según la orientación del énfasis, es decir, se considera si éste se sitúa en las capacidades personales y la relación con el gestor de casos, en aspectos rehabilitadores, entre otros.
1. Modelo de fortalecimiento personal.
2. Modelo de rehabilitación.
3. Gestión intensiva de casos.
4. Tratamiento Asertivo Comunitario
Existe una influencia de la cultura del país en la incorporación del servicio de GC así como en el enfoque de la investigación que habría que llevar a cabo. Se hace necesario conocer las intervenciones que debería tener este servicio, sus componentes principales y la manera como la cultura influye sobre los resultados de éste en cada zona (Burns 2001) [C2].
El TAC es el modelo más establecido de los equipos especializados en el Reino Unido, EEUU y Australia. Su historia se inicia con el desarrollo del manejo de caso en EEUU en respuesta a la desinstitucionalización, y aparece en diferentes regiones de España, Singapur y Chile en épocas más recientes (López 2007) [C2], (Sepúlveda 2001).
El TAC es ofrecido por un equipo multidisciplinario con una baja proporción de pacientes/profesional, que brinda un tratamiento individualizado centrado en el paciente y su entorno natural y en la provisión directa de servicios, incluyendo apoyo para la vida diaria.
El TAC es un modelo claramente definido (Burns 2005) [C2]:
1. Seguimiento asertivo.
2. Número reducido de casos (10-15 casos por equipo).
3. Incremento en la frecuencia de contacto (entre diario y semanal).
4. Realizado en el medio del paciente.
5. Énfasis en la medicación.
6. Soporte a los familiares y cuidadores.
7. Provisión de todo tipo de servicios (médicos, asesoría legal, trámites, etc.).
8. Coordinación con otros servicios cuando es necesario.
9. Estabilización de las crisis y disponibilidad 24 h/día, 7 días a la semana.
Ambas modalidades de atención, la GC y el TAC, van dirigidas a un perfil de pacientes con esquizofrenia que presentan sintomatología deficitaria o negativa (Burns 01) dificultades en la vinculación, hospitalizaciones repetidas (Thorup 2005) [C2], mal cumplimiento terapéutico y, a menudo, otros problemas añadidos (marginalidad, drogas, problemas legales) (Killaspy 2006) [C2], (Commander 2005) [C2]).
Recomendaciones basadas en evidencia científica
Las guías clínicas españolas ofrecen una serie de recomendaciones basadas en la evidencia que han sido muy útiles en la implementación de los programas para la atención de la esquizofrenia en la comunidad, por lo que se decidió integrarlas al presente documento.
Se recomienda:
1. Asistencia ambulatoria en un centro comunitario de salud mental que ofrezca tratamiento farmacológico, terapia individual, de grupo y/o familiar, intervenciones psicoeducativas y un tratamiento individualizado de intensidad variable para los pacientes estables con cierta discapacidad (McEvoy 1999).
2. Atención comunitaria con un plan integral de cuidados a pacientes con trastorno mental grave, incluyendo al paciente en la toma de decisiones y haciendo énfasis en su capacitación para que mejore su grado de satisfacción y su recuperación social (Malm 2003) [C2].
3. Programas de GC y de TAC para pacientes de alto riesgo, con historia de reingresos hospitalarios, difícil vinculación a los servicios habituales o en condición de calle (Lehman 2004) [C2].
4. TAC a personas con trastornos esquizofrénicos graves entre 18 y 65 años que requieren hospitalizaciones frecuentes para reducir sustancialmente los costos hospitalarios, mejorando el resultado y la satisfacción del paciente (Marshall 1998).
5. TAC para pacientes con alto riesgo de reingreso hospitalario y que no pueden continuar el tratamiento comunitario convencional (Practice guideline 2004).
6. GC para la atención comunitaria en pacientes con trastornos esquizofrénicos graves, con miras a incrementar su vinculación a los servicios y el cumplimiento terapéutico (Marshall 1998).
7. Los programas de TAC y de gestión intensiva de casos en pacientes con esquizofrenia que frecuentan habitualmente los diferentes servicios institucionales (Mueser 1998) [C2].
8. La gestión intensiva de casos en pacientes con trastorno mental grave cuando éstos hacen uso de los servicios hospitalarios, con la finalidad de reducir este consumo (Burns 2007) [C2].
9. La gestión intensiva de casos y los servicios de apoyo comunitarios, además de la administración de psico-fármacos y psicoterapia, para pacientes que presentan esquizofrenia de inicio precoz (American Academy of Child 2001) (5).
No existen estudios comparativos que permitan decidir la superioridad de un modelo sobre otro, GC versus TAC; su función y objetivos son los mismos ya que la implantación de un modelo u otro está condicionado fundamentalmente por la organización sanitaria y el apoyo del gobierno en turno, y del lugar en el que se implementan (Burns 2001) [C2]. La presencia de una red de atención psiquiátrica con buena dotación de los equipos comunitarios y programas específicos hace recomendable la gestión de casos que permita la articulación de servicios que ya ofrece la red y la continuidad de cuidados, mientras que la ausencia de ella obliga a equipos específicos como el TAC a ofrecer una atención integral. Sin embargo, en algunos estados de la República Mexicana, como Sonora, se han adoptado estos dos modelos con éxito para atender al siguiente tipo de usuarios:
1. Egresados del Hospital Cruz del Norte con esquizofrenia con más de cuatro hospitalizaciones por año o falta de adherencia al tratamiento en pacientes de este Estado.
2. Usuarios psicóticos en condición de calle de la ciudad de Hermosillo.
3. Intervención en crisis por temblores, incendios, inundaciones, etc.
4. Pacientes de diferentes regiones del Estado con difícil acceso a los centros de salud mental, a través de telepsiquiatría.
IV. Aspectos transculturales de la esquizofrenia
¿Cuál es el concepto de psiquiatría transcultural? Esta disciplina fue organizada por Eric Wittkower en 1950. Henry Murphy definió los principales objetivos de la disciplina: identificar, verificar y explicar las relaciones entre la enfermedad mental y las amplias características psicosociales que diferencian las naciones, personas y culturas. La variación cultural es más pronunciada en desórdenes reactivos y neuróticos, pero la influencia de la cultura es algo muy importante en las psicosis mayores y puede ser reconocido también en los síndromes cerebrales orgánicos (Jilek 2001).
Kroeber y Kluchohn definen así el concepto de cultura: <<La cultura consiste en modelos explícitos o implícitos, de y para el comportamiento, adquiridos y transmitidos mediante símbolos, que constituyen las realizaciones distintivas de los grupos humanos, incluyendo su encarnación en instrumentos; el núcleo esencial de la cultura lo constituyen ideas tradicionales y, especialmente, los valores adscritos a ellas; los sistemas culturales pueden ser considerados, en un aspecto, como productos de la acción, y en otro como elementos condicionantes de acciones futuras>>. La clase de conducta exhibida por el grupo, es llamada su cultura (Balbo 2004).
Ramón de la Fuente destaca: "No hay nada en el pensamiento biológico moderno que excluya o subestime la importancia de la cultura o de los sistemas sociales en el desarrollo de los seres humanos, incluyendo sus patrones de salud y enfermedad" (De la Fuente 1992).
En un estudio, Loewenthal y Cinnirella (1999) entrevistaron a mujeres de diferentes religiones que radicaban en Gran Bretaña, para obtener sus comentarios sobre cuáles eran las opciones que consideraban para obtener ayuda frente a los padecimientos psiquiátricos, teniendo como resultado que hacían oración para pedir alivio a su padecimiento, o acudían con su guía espiritual, dependiendo de su religión, entre otras cosas. Las tres formas de intervención que consideraban para el tratamiento de la esquizofrenia fueron: medicamentos (vistos como el tratamiento más importante ofrecido por médicos generales o por psiquiatras), psicoterapia y oración, que es la intervención religiosa más usual que refieren las entrevistadas ("Si tú sabes que existe un Dios que está escuchando tus plegarias, está bien, pero sólo al hablarle pienso que puede ayudar, sí..." Cristiana negra). Ellos concluyeron que para las entrevistadas era igual de útil, o incluso más, el hacer oración que los medicamentos ofrecidos por el profesional.
Neimeyer y Mahoney (1995) dicen que la perspectiva narrativa-constructivista se enfoca en que ciertas formas de malestar surgen de las historias que la gente cuenta entre ellos mismos; entonces, si esas historias se rescribieran, los síntomas y el malestar se aliviarían (Kirmayer 1999).
En nuestra cultura, y en general en toda América Latina, existe la difusión de un paradigma no clínico, que es la hibridación que hacen muchos dolientes de la locura entre un conocimiento "médico" e ideas de corte religioso Judeo-cristiano, viejas prácticas chamánicas amerindias, nociones de brujerías, maleficios y agresiones mágicas, y aún elementos trasplantados de sistemas religiosos del Oriente; es una comprensión de la locura que se sustenta en creencias y lógicas culturales peculiares de nuestra población. No se habla de comunidades científicas reunidas, sino de un conjunto heterogéneo de sanadores, curanderos, chamanes, sacerdotes y especialistas religiosos de variados credos y confesiones, y sus seguidores (Uribe 1998).
En el servicio de psiquiatría del Hospital Civil "Fray Antonio Alcalde" de la ciudad de Guadalajara aplicamos una serie de entrevistas semiestructuradas a 41 familiares de pacientes psiquiátricos con diferentes diagnósticos. Respecto a la concepción etiológica de la enfermedad, el 27% consideró que el padecimiento se debía a la ingestión de drogas; el 22% respondió que era por "nervios"; el 20% señaló un traumatismo craneoencefálico, y el 12% pensó en la brujería. Suponemos que el porcentaje debe ser mayor, pero sólo éstos se atrevieron a manifestarlo (Villaseñor 2003). Queda claro que una parte importante de nuestros pacientes comparten estos conceptos etiológicos vinculados a la hechicería.
Los Aymaras y Quechuas (andinos) creen que el cuerpo humano es vulnerable a la penetración de espíritus malignos que se apoderan del cuerpo ocupando el lugar del alma. Estos son los presuntos causantes de muchas enfermedades a través de emanaciones invisibles que afectan a las personas (Hollweg 2001).
La originalidad del avance de Witzum y Goodman radica en su atención sistemática al fondo cultural de los pacientes, para comprender las expresiones sintomáticas de malestar y como una manera de tener intervenciones culturalmente apropiadas (Kirmayer 1996, Rousseau 1999). La noción de trabajar dentro del mito del paciente o la metáfora tiene una larga historia en terapia estratégica y hace un sentido intuitivo a los psiquiatras culturales. Simplemente se involucran usando el propio lenguaje del paciente; mientras que la psicoterapia psicodinámica ofrece a los pacientes maneras de ver el mundo que tienen implicaciones lejanas en torno al problema presente, las intervenciones enfocadas en el síntoma y contextualizadas en el idioma personal y cultural propios del paciente tienen mayor alcance para brindar alivio (Kirmayer 1999).
Es un error pensar que sólo la gente del pueblo mantiene estas formas de conceptualización y tratamiento ritual de enfermedad mental. Hay situaciones que demuestran que pacientes provenientes de todos los estratos sociales y condiciones culturales recurren a estos rituales de curación o aflicción cuando su salud mental y su vida en general se ven seriamente afectados (Uribe 1998).
La presencia del llamado neochamanismo en América Latina ha sido destacado por Eduardo Medina (2012), quien en su conferencia magistral durante el 3er Congreso Internacional de GLADET en Tuxtla Gutiérrez, Chiapas, subrayó la creciente influencia de estas estrategias terapéuticas ante la enfermedad mental en nuestros días.
PERSPECTIVA TRANSCULTURAL
Desde la perspectiva de la psiquiatría transcultural, la metodología de estudio está basada por lo general en:
1. Definir una entidad por consenso entre expertos a través de criterios, lo más operativos posibles.
2. Diseñar un instrumento capaz de medir dicha entidad (cuestionario, entrevista semiestructurada u otros).
3. Traducir y contratraducir dicho instrumento al idioma y cultura locales por personal procedente de cada una de las dos culturas.
4. Adaptación cultural del instrumento.
5. Administración a una muestra no sesgada y representativa de dicha cultura.
6. Comparación transcultural de los datos obtenidos en diferentes países.
Desde esta perspectiva se han desarrollado los diferentes estudios piloto de carácter internacional impulsados por la Organización Mundial de la Salud y la mayoría de estudios publicados en las revistas especializadas de psiquiatría. La entrevista semiestructurada PSE (Psychiatric State Examination), con corrección informatizada a través del programa CATEGO, sería el instrumento más conocido y utilizado para este tipo de estudios. Prácticamente la totalidad de los cuestionarios utilizados en la actualidad por profesionales de salud mental han sido traducidos y/o validados transculturalmente, y existen datos de procedencia diversa comparando valores normativos, en lo que anteriormente denominaban estudios ético-forzados.
A nivel general puede considerarse que en las culturas no occidentales:
1. Hay una tendencia a la aparición de cuadros psicóticos breves con una menor tendencia a la cronificación.
2. Los síntomas psiquiátricos pueden ser más dramáticos y espectaculares para un observador occidental.
3. La expresión psicológica de los síntomas suele ser global, abigarrada o atípica, y la diferenciación entre las diversas categorías psiquiátricas, incluso entre neurosis y psicosis, es difícil.
4. Lo somático y psicológico se presenta desde una visión unificada. Hay una gran expresión somática de las emociones o estados de ánimo, con frecuencia predominante sobre la puramente cognitiva.
5. Las reacciones de miedo y pánico son muy frecuentes, adoptando formas de presentación culturalmente específicas.
Es importante destacar que con mucha facilidad estas reacciones de miedo/pánico adquieren un matiz paranoide. Analizándolo según las principales categorías de las clasificaciones occidentales, puede considerarse el siguiente apartado.
SÍNTOMAS PSICÓTICOS: RELATIVISMO CULTURAL DE LOS DELIRIOS Y LAS ALUCINACIONES
Delirios. Los delirios o delusiones —como Honorio Delgado prefería llamarles— deben lógicamente reflejar el tiempo y el espacio en el que se producen. Un paciente paranoide en una ciudad occidental se quejará de que la policía lo controla y persigue, o de que recibe radiaciones de la pantalla del ordenador mientras que un paciente de idénticas características de un poblado africano identificará probablemente a sus agresores con personas de otras comunidades.
Hablamos de un delirio como de una creencia irracional que la persona defiende de manera firme a pesar de los argumentos o pruebas que existen en sentido contrario. Este proceso es en realidad bastante más complejo y hay diversos manuales específicamente sobre la validación transcultural de instrumentos psicométricos que se pueden consultar. (Wig 1984, Mezzich, Kleinman, Fabrega, Parron 1996).
ESQUIZOFRENIA
Los reportes de la World Psychiatric Association (WHO) sobre el curso y la mejoría de los pacientes con esquizofrenia, investigados en Japón, Hong Kong y Singapur, demostraron un curso más favorable y mejor resultado en la evolución de la enfermedad que en Europa y Norteamérica (Jilek 2001). En su consideración de las realidades clínicas de la esquizofrenia, el DSM-IV advierte a los lectores que la evaluación de los síntomas de esta enfermedad mental "en situaciones culturales o socioeconómicas diferentes de las propias, debe tomar en cuenta tales diferencias culturales". Más aún, que "ideas que pueden parecer delirantes en una cultura (por ejemplo, la magia y la brujería) bien pueden ser comunes en otra. En algunas sociedades, las alucinaciones visuales o auditivas con contenido religioso pueden ser parte normal de la experiencia religiosa (por ejemplo, ver a la Virgen María u oír la voz de Dios)". Estas advertencias aparecen en una sección específica de la discusión en torno a los síntomas de la esquizofrenia: "Rasgos específicos de la cultura, la edad y el género" (Uribe 2000).
En el examen psiquiátrico, los síntomas universales de la esquizofrenia se deben contrastar con las particularidades culturales y personales que exhibe el enfermo. En términos generales los síntomas son: delirios, alucinaciones de varios tipos, lenguaje desorganizado e incoherente, comportamiento catatónico o arrevesado, y síntomas negativos (aplanamiento afectivo, alogia y abulia), acompañados por disfunción social y ocupacional del enfermo en el tiempo mínimo ya establecido (Uribe 2000).
Según Sartorius y Jablensky (1986, 1992), los pacientes con esquizofrenia de los países occidentales desarrollados muestran una mayor frecuencia de síntomas depresivos, alucinaciones primarias, inserción del pensamiento y retransmisión del pensamiento, mientras que en los países no occidentales y menos desarrollados las alucinaciones visuales y auditivas fueron más frecuentes (Jilek 2001).
Katz (1988) encontraron que hay diferencias importantes en las manifestaciones de la esquizofrenia, en las cuales, su equipo concluyó que el contenido de los síntomas psicóticos tendía a identificar los problemas críticos existentes en una cultura particular. Ndetei y Vadher (1984) observaron que la predominancia de delirios de persecución y alucinaciones auditivas en desórdenes no esquizofrénicos sugería que no eran necesariamente indicativos de esquizofrenia en personas con antecedentes culturales africanos (Jilek 2001).
De acuerdo a Torrey (1974), las sociedades que tienen mayor exposición a la influencia occidental tienen más número de casos. Murphy (1982) notó cuatro diferencias en la incidencia de casos entre las culturas. Sin embargo, concluyó que "las formas de vida no occidentales no ofrecen protección contra la enfermedad mental como punto para hacer una marcada diferencia en la frecuencia". De acuerdo con Wittkower y Rin (1965), la prevalencia de esquizofrenia se encontraba entre 0.9/1000 pobladores en Taiwán, en comparación de 9.5 en Suecia.
Aspectos transculturales del síndrome esquizofrénico
Hay ligeras variaciones en la incidencia de las diferentes culturas, atribuible probablemente a las diferencias en la patogénesis (del mismo modo en que hay diferencias en la prevalencia de hipertensión, diabetes o cáncer de colon en función de factores ambientales).
En el caso de la esquizofrenia podrían influir variaciones en la distribución de infecciones perinatales, deficiencias nutricionales, traumatismos craneoencefálicos, trastornos endocrinos o abuso de sustancias. Esto por si sólo no explica, por el momento, las cifras notablemente más elevadas de prevalencia en ciertas áreas geográficas (v.g. Irlanda, Croacia, norte de los países escandinavos o inmigrantes caribeños de segunda generación en Inglaterra), por lo que deberían aceptarse quizás algunos determinantes genéticos.
Respecto a la patoplastia en las culturas no occidentales, la esquizofrenia se presentaría coloreada por los elementos culturales (aunque manteniendo el síndrome nuclear). Así, por ejemplo, en la esquizofrenia en Japón hay un aumento de la frecuencia de síntomas fóbicos y de culpa, y aparecen con frecuencia formas exageradas de autoacusación. En China, en la presentación se da gran relevancia a los síntomas somáticos.
Pero en una cultura u otra habría un núcleo (delirio/pseudoalucinaciones) reconocible. En cuanto a los subtipos y las formas de presentación en los países occidentales, los estudios señalan que se hizo el giro de las esquizofrenias con fondo afectivo o las catatonías a las formas de esquizofrenia paranoide que son actualmente la abrumadora mayoría.
Cada vez aparecen con mayor frecuencia personas con esquizofrenias de tipo paranoides, en detrimento de las agudas o las de fondo afectivo. Este fenómeno no es tan sorprendente si se tienen en cuenta al menos 3 factores:
1. Los estudios clásicos que describían cuadros catatónicos no tenían bien perfilado el terreno en que solapan los trastornos afectivos y esquizofrénicos. Hoy en día se sabe que la mayoría de cuadros catatónicos corresponden a síndromes afectivos y no esquizofrénicos. Habría pues un problema de variación de los criterios diagnósticos.
2. La segunda causa de catatonía son los síndromes orgánicos cerebrales (neoplasias, encefalitis, cuadros degenerativos), mejor diagnosticados y tratados hoy por hoy en los países occidentales.
3. Los síntomas catatónicos desaparecen rápidamente en la actualidad con la administración de neurolépticos o TEC y ya no reaparecen.
Todas estas reflexiones fueron las que llevaron a la formulación del modelo de la "Alta" y "Baja Emoción Expresada" como un intento para explicar los determinantes familiares y sociales de las recaídas en la esquizofrenia. Según este modelo, una exigencia excesiva o una sobreestimulación son tan negativos para el pronóstico como la falta de estimulación ambiental.
En cuanto al curso clínico, en culturas no complejas las esquizofrenias se describen como cuadros de inicio agudo y fulminante y remisión completa, frente a los cuadros más solapados y con evolución con tendencia a la cronicidad de los países occidentales. El estudio internacional de la OMS de 1986 sobre factores determinantes del pronóstico en diferentes culturas muestra que incluso utilizando sólo primeros brotes psicóticos (para evitar los sesgos por las diferencias en los sistemas de atención sanitaria) y aplicando criterios homogéneos, el pronóstico es notablemente peor en los pacientes que viven en el medio occidental.
Estos resultados han sido reproducidos con diferentes modelos y contextos, y son consistentes y universales. No hay todavía una explicación plausible para el proceso de cronificación de la esquizofrenia que se asocia al medio euroamericano. Las diferencias en la forma de presentación, el curso y el pronóstico, unido a que los términos esquizofrenia simple, hebefrénica, latente etc., son de difícil aplicación en muchos países no euroamericanos, ha hecho que Wig y otros autores postulen que la única distinción que parece útil en las personas no occidentales sea entre formas agudas y crónicas de esquizofrenia. En este sentido, para entender las psicosis en el sur habría que rescatar, para Wig, el diagnóstico de psicosis histérica. En la India son muy frecuentes, en su experiencia, los cuadros psicóticos que asientan sobre personalidades marcadamente histéricas.
En todos estos casos, como en los referidos en África por múltiples autores, acostumbra haber un precipitante en forma de estrés agudo. Si intentáramos rescatar el concepto evitando el término histeria, podría decirse que se trata de psicosis transitorias mal diferenciadas, fácilmente producidas por desencadenantes ambientales y de aparición recurrente. No hay datos de seguimiento longitudinal de estas psicosis como para situarlas en la familia de las esquizofrenias o no (Leff 1988, Bulbena, Berrios, Fernández 2000).
Algunos reportes tempranos de estudios clásicos de diferencias transculturales en cosas sobresalientes consideradas típicas de esquizofrenia, son los siguientes:
• India. Rigidez catatónica, negativismo y estereotipia han sido reportados como más comunes en India (Wittkower 1965). Por lo tanto son síntomas somáticos, uso de lenguaje corporal, comportamiento callado, control de enojo o agresión. La confusión y perplejidad son más comunes; casi nunca se observa intensa ansiedad emocional. Hoch (1961) comentó una retirada emocional como un mecanismo sancionado socialmente.
• África. Gordon [citado en Wittkower (1971) habló sobre las alucinaciones francas, bizarras y sociales en las esquizofrenias en África, y las llamó una "pobre imitación de las formas europeas". También notó una identificación grandiosa con Dios.
• Japoneses. Enright y Jaeckle (1963) reportaron que tienen más ideas de referencia y disturbio del pensamiento que los filipinos. Los cambios en el contenido de los delirios también han sido reportados en japoneses, antes y después de la segunda guerra mundial; el enfoque de delirios grandiosos estaba relacionado con la retirada de los americanos y la CIA por el emperador.
• Americanos. Schooler y Caudill (1964) reconocieron en un reporte una interrupción generalmente mayor del examen de realidad, alucinaciones e ideas bizarras en americanos que en japoneses.
• Italianos vs. Irlandeses. En comparación, los italianos mostraron mayor hostilidad, actuar hacia fuera, euforia y manierismos bizarros, sin sentimiento de culpa y pecado, y expresión más directa en el área de la sexualidad; homosexualidad latente, culpa sobre la sexualidad, ansiedad ambivalente, miedo y hostilidad en los irlandeses (Opler 1959).
• Cristianos y musulmanes. Delirios de destrucción y religiosos han sido más referidos entre cristianos y musulmanes (Murphy 1971).
Los investigadores de la WHO concluyeron que el resultado puede ser más favorable en situaciones caracterizadas por la economía agrícola, poca movilidad vertical, familias grandes, servicios psiquiátricos que incluyen la participación activa de la familia y la ausencia de estereotipos específicos comunes de la enfermedad mental (Varma 2000).
Al adentrarnos más al estudio de las sociedades occidentales, encontramos estas manifestaciones, estudiadas personalmente y con resultados impresionantes, veamos algunas expresiones de la enfermedad mental propias de los pueblos latinoamericanos:
Cultura maya
La traducción más sencilla de Moxrik es "locura"; el Imox es uno de los 20 días del calendario maya que significa locura. En el Moxrik están agrupadas, principalmente, una serie de conductas que en la vida del ser humano se deben evitar para vivir en armonía con los demás, tales como la envidia, el rencor, la desconfianza, la venganza, el autoritarismo, la discriminación, los celos, la violencia, la irresponsabilidad, el robo, la mentira, la deuda, los chismes, la ambición, el orgullo, la cólera, la rabia, etc. Como se puede apreciar, en su mayoría son actitudes irreflexivas, impulsivas y que se oponen a valores como la honradez, la verdad, la modestia, la humildad, el perdón, el respeto, la equidad, etc.
Cuando varias de estas conductas se presentan sistemáticamente en los individuos, se tiene como consecuencia un Moxrik, ya que son conductas que no son consideradas normales en los individuos. Algunas de estas conductas estarían tipificadas como delitos por occidente, delitos que se castigan, que se sancionan. En la cosmovisión maya, estas conductas son consideradas una enfermedad que puede ser corregida con el debido tratamiento, el cual incluye desde la psicoterapia hasta la reparación de daños causados por el enfermo y la reconciliación con los afectados.
Este caos en la vida trae consigo manifestaciones físicas como dolor de cabeza constante, síncope, convulsiones, desmayos, entre los más frecuentes. Las personas con Moxrik pierden las nociones culturales de orden, por ejemplo, "se desnudan en las calles, se quitan la ropa y gritan", hay una pronunciada agresividad física y verbal consigo mismo y con los demás, "pelean o rematan con cualquiera", "amenaza con suicidarse", "están muy irritables o histéricos, coléricos", "reaccionan como rabiosos: k'lu'm"; pareciera que quieren desahogarse amenazando a los demás. Asimismo, tienen síntomas paranoides tales como (en caso de los hombres) dudas de que sus hijos son suyos; si es mujer piensa que el marido la engaña con otra mujer, constantes celos injustificados o celopatía, por lo que desconfían de su pareja y siempre piensan o toman mal las cosas; tienen alucinaciones visuales de que objetos o animales los persiguen y huyen.
Este desorden, confusión o caos también lleva a las personas con Moxrik a tomar actitudes muy violentas, "pegan y maltratan sin razón a sus hijos", se vuelven delincuentes, roban, violan, se endeudan y luego se niegan a pagar, pueden volverse asesinos; son en general muy agresivos, "peleoneros y chismosos, hablan mal de los demás", discriminan.
La frontera entre causas y consecuencias es, en este caso, muy difusa, es un círculo vicioso que está en constante movimiento, en el que lo único claro es que es un problema que no proviene únicamente del individuo, proviene de su entorno, y éste también sufre las consecuencias. Este problema se presenta principalmente en las personas mayores de 15 años, puede afectar a familiares o personas muy cercanas del enfermo; se puede transmitir de padres a hijos si durante la concepción o el embarazo los padres padecían Moxrik (Chávez 2005).
Cultura nahua
Mirando al pasado prehispánico, recordaremos que a las personas que estaban locas las llamaban cuatlahueliloc o yollotlahueliloc (Molina 1970). Ambos términos hacían referencia a la disminución de las funciones orgánicas.
Podríamos decir, a grosso modo, que había tres tipos de médicos:
a) Los sacerdotes de los diferentes dioses, que debían conocer y tratar las enfermedades enviadas por el dios al cual servían (por ejemplo, Tezcatlipoca), enviaban las enfermedades epidémicas y, quizás, la locura. Aquí podría incluirse a un grupo especial de sacerdotes quienes, aunque no realizaban acciones de tipo curativo, tenían una función que podría asimilarse a la del psicoanalista moderno. Se trata de los tonalpouhque o tonalpouhqui (aquel que cuenta el destino), que eran los adivinos más importantes. Gracias a sus interpretaciones la gente podía sentirse aliviada o no. También se les llamaba temiciximatini o temicnamictiani (intérprete de los sueños).
b) Los médicos o brujos marcados por su fecha de nacimiento.
c) El grupo de los titici, quizás el más numeroso, que cultivaba, aplicaba y transmitía los conocimientos empíricos. Sus miembros eran los más técnicos. Parres y Wasserman consideran que los tlamatini (médicos aztecas) eran verdaderos psiquiatras que poseían una "verdadera psicoterapia". Opinión que toma con mucha reserva Pérez-Rincón (1994).
Algunos tipos de locura se debían a enfermedades por posesión. Las cihualpipiltin o cihuateteo, es decir, el espíritu de las mujeres muertas durante el parto, que se volvían diosas así llamadas, poseían a los enfermos y les robaban su belleza. La locura y diversos tipos de parálisis eran causados por ellas. Una enfermedad muy típica, provocada por los dioses menores de la lluvia que enviaban rayos a sus víctimas, era una especie de locura confundida con una clase de maldad o de mala intención como único proceso psicopatológico.
Esto puede explicar por qué a algunos locos furiosos les llamaban aacquiau, aquel que sufre de intrusión. Curiosamente, en la actualidad les llamamos alienados.
Las "limpias" eran muy utilizadas para curar a las personas poseídas por las cihualpipiltin, por otros dioses o por los malos aires. Se hacían figurillas de papel o de maíz para transferirles los malos espíritus, y luego se colocaban en los cruceros de los caminos para que quien pasara se los llevara (Villaseñor 1995).
BOUFFÉE DÉLIRANTE
Una variedad de etiquetas diagnósticas han sido aplicadas por autores anglófonos para designar algunos desórdenes psicóticos transitorios, como el término Bouffée délirante, introducido por Magnan en 1886, usado para designar reacciones psicóticas transitorias. Ataques repentinos de breve duración con delirios paranoides y alucinaciones concomitantes, precipitadas típicamente por un miedo intenso o persecución mágica a través de algún hechizo o embrujo. Se caracterizan por estado confuso y comportamiento altamente emotivo y, después del ataque, amnesia. En esta sintomatología, la Bouffée délirante recuerda las reacciones psicóticas durante las primeras fases de industrialización y urbanización en masa en Europa del siglo XIX, descritos bajo los nombres de folie hystérique en París, y amentia transitoria en Viena (Morel 1860, Meynert 1889).
Los temas delirantes son variables y múltiples, pudiendo combinar ideas de persecución, grandeza, transformación de sí mismo o del mundo, así como ideas de influencia o posesión (Villaseñor 1993). Bajo esta definición podemos observar variadas presentaciones de Bouffée delirante entre las diversas culturas que se han estudiado. El diagnóstico se funda principalmente en carácter brutal de inicio, aspecto polimorfo y variable de la experiencia, la adhesión inmediata al delirio intensamente vivido y la evolución en algunas semanas, sin dejar secuelas, aunque las recaídas sean posibles (Villaseñor 1992).
La Organización Mundial de la Salud, ha incluido en su clasificación internacional de enfermedades (CIE-10) el grupo de las Psicosis cicloides, juntamente con la Bouffée délirante, bajo el rótulo de trastorno psicótico agudo polimorfo (F23.0 y F23.1).
TERAPÉUTICAS EMPLEADAS
En las culturas occidentales, particularmente en el México prehispánico, encontramos estos datos rescatados de los códices encontrados, donde la herbolaria era la herramienta curativa más poderosa; se encuentran las semillas y hojas de epazote (Teloxys ambrosioides) empleadas para el espanto, y los frutos de la granadilla (Passiflora spp.) se usaron para padecimientos del corazón, nervios, presión arterial. Entre las plantas que "alteran la mente" se encuentran las flores de tabaco (Nicotiana tabacum), el ololiuhqui (Turbina corymbosa), el sinicuichi (Heimia salicifolia) y la flor de cacao (Quararibea funebris). A la llegada de los españoles, algunas plantas se sustituyeron por otras de origen europeo; tal es el caso del pericón o yauhtli (Tapetes lucida), utilizado para el espanto, que vino a remplazarse por la ruda (Ruta chalepensis). Del mismo modo, el estafiate o iztáuhyatl (Artemisia mexicana) utilizado para el susto, remplazado por el romero (Rosmarinus officinalis) (Bye 1999).
El grupo de alucinógenos que la antropología moderna ha relacionado con procedimientos chamánicos y ha asociado a situaciones de curación religiosa, era considerado por las culturas prehispánicas como celeste y de naturaleza caliente, a pesar de que algunos de ellos fueran plantas acuáticas. Por ello, además que por sus efectos sobre la mente, eran ampliamente utilizados en el tratamiento de las enfermedades febriles y para aliviar problemas reumáticos (Viesca 1999).
Psicoterapia metacultural
Explica Devereux, fundador de la Etnopsiquiatría (Devereux 1970, Villaseñor 1999), que los orígenes del término psicoterapia "metacultural" se remontan al momento en que él trataba de distinguir este tipo de psicoterapia como una útil herramienta que permitiera al psiquiatra tratar sin limitaciones lo mismo a un marqués francés, que a un esquimal, que a un africano, y que esta actitud terapéuticamente neutra con respecto a la cultura del paciente era una psicoterapia neutra, por la actitud y la aceptación del terapeuta, que se basa para su trabajo en los principios de la cultura en sí y de sus categorías culturales universales, y esto la hace una psicoterapia "metacultural", distinguiéndola de una psicoterapia "intercultural" que es la que se realiza cuando el terapeuta trabaja con pacientes de una cultura tribal determinada (Colli).
Devereux considera que es imposible disociar el estudio del psiquismo y de la cultura; ninguna puede ser considerada como derivada de la otra, ya que ambas son "co-emergentes". Es imposible concebir una cultura que no sea vivida por un psiquismo (la primera sólo existe en la segunda) (Villaseñor 1994).
Distintas creencias míticas influyen en los contenidos del pensamiento de personas con trastornos mentales referidos desde su sistema cultural. La falta de conocimiento sobre las mismas, crea dificultades al psiquiatra monocultural para determinar si es un síntoma de un trastorno mental, considerado desde la patología mental de la psiquiatría académica, o si se trata de una creencia cultural (patoplastía). El desconocimiento de la cultura trae consigo otra percepción mental de la realidad (Rousseau 1999).
El terapeuta intercultural tiene la importante misión de servir de intermediario entre varias culturas, y por tanto, de atender pacientes que responden a las psicopatologías de estas culturas: es de su trabajo el conocer la cultura de estos pacientes, con su religión, sus costumbres, con su idiosincrasia.
La terapia intercultural capacitará al terapeuta para atender con éxito y prevenir enfermedades psiquiátricas en individuos de otras culturas. El equipo perfecto de terapia intercultural sería una pareja: el psicoterapeuta con el terapeuta folklórico o tradicional, así podrían complementarse.
Errores comunes que se cometen por los terapeutas que no comparten la psicoterapia intercultural (Colli):
1. Ignorar la queja del paciente, no aceptan el mal que el paciente refiere, sino que lo caracterizan como psicótico.
2. No oír la opinión de los oficiantes sincréticos, no tener en cuenta las referencias de la cultura del paciente.
3. Por prejuicios racistas y culturales antirreligiosos, no querer atender al paciente con estos síntomas.
4. No hacer trabajo de terreno o de campo, todo terapeuta que trabaje dentro de una comunidad religiosa debe conocer su cultura y religión.
Condiciones para acceder a los pacientes con características culturales diferentes a la nuestra (Rousseau 1999):
1. Superar nuestra visión occidental.
2. Ubicarse en el sistema de referencia cultural del paciente.
3. La psicoterapia intercultural funciona más eficazmente con la contribución participativa del coterapeuta: persona procedente de la misma cultura del paciente (conocedor del idioma, del sistema de valores, mitos etc.), que puede ser un familiar o religioso.
La formación del terapeuta en etnografía y psicología transcultural o intercultural para poder abordar el contexto de realidad del mundo de valores y significantes culturales de estos casos, que depende mucho de la experiencia antropológica y flexibilidad del terapeuta.
Los padecimientos psiquiátricos son trastornos crónicos que afectan la calidad de vida del paciente y su familia, se acompañan de diferentes grados de incapacidad funcional que producen repercusiones económicas y sociales, ya que afectan a población en edad productiva y consumen gran cantidad de recursos para la salud tanto en el tratamiento ambulatorio como en la atención intrahospitalaria (McCue 2006, Polsky 2006).
En conjunto, las enfermedades mentales demandan la utilización de servicios a relativamente grandes niveles. Los costos económicos provenientes de los servicios de salud pueden variar ampliamente entre los pacientes, en base al género, número de contactos sociales, tiempo que permanecen en los hospitales, edad, desempeño social y síntomas negativos. Algunas investigaciones han descubierto que el estado civil, las habilidades para la vida diaria, la salud física y las actitudes del paciente justifican el 50% de los costos de tratamiento (Chwastiak 2009).
Por lo tanto, para evaluar el costo de trastornos mentales y del comportamiento deben considerarse tres tipos de costo (Rosenheck 2008, Freedman 2005):
1) Directos. Son los que realiza el estado o la institución para la organización y operación del servicio hospitalario o de consulta externa como salarios, traslado del paciente, transportes, insumos, conservación, administración, infraestructura y servicios; también se incluyen los gastos que realizan los pacientes y sus familiares en su transporte y alimentación (gastos de bolsillo).
2) Indirectos. Son ocasionados por la falta de productividad del paciente al solicitar y esperar consulta, por la muerte prematura del paciente, es decir, lo que dejó de producir por el padecimiento y/o por el tiempo que emplean sus familiares al acompañarlo a consulta
3) Intangibles. Hacen referencia a la pérdida de bienestar debido al dolor físico y psicológico del paciente y su familia por el padecimiento y la estigmatización de que son objeto.
Un hospital de psiquiatría es un escenario estructurado, terapéutico que simultáneamente provee cuidados, protección y control mientras se lleva al paciente de un estado de gran tensión a uno de tranquilidad. Sin embargo, al paso del tiempo el sistema de atención tradicional ha tenido cambios sustanciales reflejados básicamente en la reducción del número de camas para atención psiquiátrica y del tiempo de estancia hospitalaria, por ejemplo de 35 días de promedio de estancia en 1985 se pasó a 13 días en un hospital universitario (Verduzco). En EEUU de 1970 a 1992 las camas con que contaban las organizaciones de salud mental con servicios de hospitalización o residencial pasaron de 524,878 a 270,867 debido a la reducción de hospitales del estado y por el incremento del número de hospitales privados (Verduzco). En contraste, de 1955 a 1992 el reporte de episodios de trastornos mentales que requirieron hospitalización pasó de 1.7 a 2.3 millones (Verduzco).
Los costos del padecimiento psiquiátrico se han incrementado en forma muy importante en las últimas décadas de tal forma que se deben de evaluar muy bien las características de severidad del padecimiento en cada paciente y el impacto en su entorno para poder determinar qué tipo de atención intrahospitalaria requiere: hospitalización tradicional u hospitalización parcial (Hospital parcial, Clínica de esquizofrenia, Clínica de adicciones) (Verduzco).
Para garantizar el cumplimiento de las funciones básicas de un "Hospital tradicional" (dar protección al paciente y a su entorno, así como proveerle cuidados, contacto personal, oportunidades de expresión y consulta psiquiátrica), se ha recurrido al establecimiento de programas alternos como el Hospital de día. Es así que surge el concepto de Hospitalización parcial (virtual) donde se puede incluir un gran número de padecimientos que no impliquen un riesgo de suicidio o conductas muy disruptivas que tradicionalmente eran tratados en hospitalización sin considerar los costos que se generarán.
Desde la década de los 70's se señala que los resultados de hospitalización no son mejores que las alternativas de atención psiquiátrica como son las de estancia intrahospitalaria breve, programas de hospitalización parcial (virtual) como hospital de día y de rehabilitación psicosocial, que incluyan diversas actividades diarias como talleres de oficios y manualidades, actividades físicas (natación, acondicionamiento físico), actividades recreativas, asambleas con grupos de pacientes y familiares, manejo psico-terapéutico individual o grupal, intervención en crisis con manejo mixto intensivo (psicoterapéutico y farmacológico) (Verduzco).
Una comparación más, radica en el equipo de salud mental que interviene en cada programa. En la Hospitalización tradicional se requiere al menos una asistente médica por turno de 8 horas diarias incluyendo sábado y domingo; una trabajadora social en dos turnos (matutino y vespertino) de lunes a sábado; un equipo de enfermería integrado por una auxiliar de enfermería, una enfermera general, una enfermera especialista y un técnico en salud mental, las 24 horas de los 7 días de la semana; un psicólogo en turno matutino y vespertino de lunes a viernes; y un médico psiquiatra las 24 horas del día de lunes a domingo. (Verduzco, Rosenheck 2006).
Por su parte, los programas de hospitalización parcial (Hospital de día virtual) tienen como elementos esenciales la terapia ocupacional, las terapias de socialización y familiar-grupal. Son diferentes programas de atención con 8 horas de cobertura semanal o más, diseñados para incluir a 6 o más pacientes ambulatorios, atendidos por un equipo interdisciplinario y proveedores de un plan coordinado, multimodal e interconectado de terapias dentro de un medio terapéutico (Hospital de psiquiatría), con una continuidad en el trabajo terapéutico de al menos dos días por semana, con una asistencia diaria de al menos 3 horas y menos de 24. Esto se traduce en un tratamiento limitado en el tiempo, activo intensivo, que promueve la estabilización en las crisis y el tratamiento a mediano plazo, según la Asociación Americana de Hospital parcial (Jones 2006).
El equipo de salud mental que se requiere para este tipo de programas está conformado por al menos una enfermera en turno matutino, un técnico en salud mental, una trabajadora social, un médico psiquiatra y un profesor por cada taller o actividad especial programada (como un profesor de educación física, uno para taller de piel y cuero, otro para pintura, etc.) todos de lunes a viernes en un turno de 8 horas; y, de acuerdo a los objetivos que se establezcan en cada paciente en forma particular, se podrá dar atención a pacientes agudos, subagudos y crónicos.
En términos generales, la determinación del esquema de tratamiento de los pacientes psiquiátricos es de forma discrecional por parte de los médicos, ya que aún al seguir criterios clínicos generales, la indicación terapéutica depende en gran medida de la apreciación de los mismos.
CONCEPTO DE FARMACOECONOMÍA
La Farmacoeconomía es una disciplina surgida en los años 80's del siglo pasado, habitualmente se utiliza como sinónimo de "Evaluación Económica de Medicamentos", inmersa dentro de una disciplina más amplia llamada "Evaluación de Tecnología Sanitaria".
La OMS considera Tecnología sanitaria a aquellos equipos, medicamentos, técnicas y procedimientos que intervienen en el campo de la salud y constituye una herramienta importante para la toma de decisiones y para mejorar los niveles de eficiencia en el sistema de salud.
Las técnicas de evaluación farmacoeconómica son:
• Análisis costo-beneficio.
• Análisis costo-efectividad.
• Análisis de minimización de costos.
• Análisis de costo-utilidad.
• Análisis de costo-oportunidad.
Los medicamentos actualmente disponibles, en lo general, son productos de alta tecnología cada vez más eficaces y selectivos, pero, en ocasiones, de elevado costo, por lo que su comparación es necesaria, tanto en términos económicos como de calidad de vida, en una época caracterizada por la escasez de recursos y la demanda de atención.
Los factores demográficos, la cobertura de los servicios, el envejecimiento de la población, la disponibilidad de alta tecnología sanitaria y otros, hacen que los gastos en salud crezcan en porcentaje dentro del PIB de muchos países, dentro de este gasto se presta cada vez más atención al farmacéutico.
FARMACOECONOMÍA Y ESQUIZOFRENIA
La esquizofrenia es el trastorno mental más grave e incapacitante en todo el mundo, representa el 40-50% de las hospitalizaciones psiquiátricas, es una enfermedad crónica, incurable, generalmente controlable, cuyo pronóstico varía mucho en relación con el diagnóstico temprano, el tratamiento oportuno, el abordaje multidisciplinario, los esfuerzos que se hagan en el campo de la rehabilitación psicosocial y la red de apoyo familiar.
El hecho de que sea una enfermedad crónica, alimenta los servicios de consulta externa por tiempo prolongado, además, el 80% de los pacientes con esquizofrenia con falta de apego al tratamiento recaerán en el 1er año de haber iniciado su tratamiento y el 52% tendrá recaídas múltiples en un año y tendrán una recuperación parcial después de cada episodio.
Debido a todo lo anterior y por su impacto económico, se considera a la esquizofrenia como un problema de salud pública, en el que la familia entera y la sociedad sufren las consecuencias tanto médicas como económicas del padecimiento debido a la necesidad de asistencia de los enfermos.
Implica el uso de grandes cantidades de recursos humanos y económicos, llegando a requerir mayores inversiones que el tratamiento para todos los tipos de cáncer en los EUA, incluso aún después de la desinstitucionalización de este padecimiento (Hoch 2007).
Se ha estimado que en el Reino Unido el costo anual de tratamiento de una persona con diagnóstico de esquizofrenia es de £2,138, con 185,400 pacientes; combinando estas cifras se tiene un costo total anual de £396 millones o un 1.6% del presupuesto total en salud de ese país (Arango 2007).
Así, la estimación de los costos económicos de la esquizofrenia constituye un aspecto fundamental para la mejor comprensión de la magnitud de este problema de salud pública.
Las evaluaciones económicas en la salud mental se han venido incrementando y esto se debe parcialmente al hecho de que es necesario justificar lo costos extras asociados con el beneficio adicional provisto por los tratamientos nuevos (Hoch 2007, Rosenheck 2008).
En la actualidad, las evaluaciones publicadas sobre costo-efectividad de los antipsicóticos han sido desarrolladas a través de modelos económicos analíticos (Pauker 1978).
Estos modelos forman una metodología relativamente rápida para estimar las consecuencias económicas de un medicamento y proveen la flexibilidad de incorporar al análisis diferentes tratamientos, perspectivas y duración de los tratamientos (Palmer 2002, Bobes 2004).
Sin embargo tienen como limitante la necesidad de emplear estudios prospectivos para validar la información recopilada dentro de un estudio de modelaje, lo que impide que se puedan generalizar fácilmente a otras poblaciones (Drummond 2005, Stroup 2008).
No obstante lo anterior, este tipo de evaluaciones es prioritario para las instituciones de seguridad social de los países en vías de desarrollo (Muñoz 2005).
En México, los estudios que estiman los costos de las enfermedades son pocos y en una enfermedad como la esquizofrenia aún son más escasos, de aquí la necesidad de realizarlos para de esta manera poder calcular objetivamente el impacto económico de la enfermedad en nuestro país y optimizar así los escasos recursos de que disponemos.
Uno de estos estudios (Verduzco), se realizó en el Hospital de Psiquiatría "Dr. Héctor H. Tovar Acosta", IMSS, teniendo como objetivo evaluar los costos de hospitalización, para lo que se efectuó un análisis documental de una cohorte retrospectiva de pacientes con diagnóstico de esquizofrenia como causa de ingreso en el periodos de 2003-2007; se definió recaída como la agudización de los síntomas que llevan a la rehospitalización, período durante el cual se cuantificó la cantidad de recursos utilizados.
El tamaño de la muestra fue de 74 pacientes con un seguimiento promedio de 3.56 años, siendo la estancia media hospitalaria de 20.75 días, con un lapso de tiempo entre recaídas de 11.4 meses en promedio. El tiempo promedio entre recaídas fue de 3.58 años (IC 95%; 1.25-5.9). Asimismo es importante enfatizar que el 95% de las recaídas fueron a causa de la falta de apego al tratamiento prescrito.
Los medicamentos representaron el 1.02% del total del costo de una recaída. Se observó que el costo más representativo fue la estancia hospitalaria, presenta el 96.61% del costo total de una recaída.
De los resultados se desprende que en realidad el costo directo que representan los medicamentos es bajo en comparación con los altos costos que representa la rehospitalización en sí, por el gasto en recursos humanos.
Otro estudio realizado en el mismo hospital estimó, a través de un estudio de simulación y por un periodo de un año, los costos y la efectividad de cinco tratamientos antipsicóticos (ziprasidona, olanzapina, risperidona, haloperidol y clozapina) que se encuentran dentro del cuadro básico del Instituto Mexicano del Seguro Social (IMSS) (Mould 2009).
El modelo se limitó a pacientes en un entorno hospitalario en el que la medida de efectividad fue el número de meses libres de síntomas psicóticos; los resultados mostraron diferencias mínimas.
No obstante, en diferentes estudios se empleó el mismo horizonte temporal de 1 año (Bobes 2004, Obradovic 2007, Geitona 2008, Edwards 2008), sin incluir consecuencias a largo plazo, cambios en la calidad de vida y sobre todo los dominios referentes a su actividad física, laboral, de interrelación interpersonal con sus familiares y otros miembros de la sociedad (Carr 2004).
El tercer estudio reportado en México evaluó el costo-efectividad comparando tres tratamientos antipsicóticos (olanzapina, haloperidol y risperidona) durante un periodo de 5 años (Palmer 2002).
CONCLUSIONES
Se debe considerar a los trastornos mentales como enfermedades crónicas con derecho a tratamiento y asegurar disponibilidad de fármacos para así tener acceso al mejor tratamiento.
Se ha considerado que en la elección del mejor medicamento para la esquizofrenia se debería tener en cuenta tres aspectos: el que sea más efectivo, tenga menos efectos colaterales y conlleve un menor costo tanto para el paciente como para las instituciones de salud (Hoch 2007, Freedman 2005).
Los medicamentos antipsicóticos que prevengan o reduzcan las recaídas y otros servicios médicos pueden ser útiles en mejorar la calidad de vida de los pacientes y reducir los costos médicos directos del tratamiento (Arango 2007, Bernardo 2006).
Se debe incidir en el problema de la adherencia, que es fundamental puesto que las tasas de abandono son elevadas debido a:
• Nula advertencia de la enfermedad por parte del paciente.
• Ausencia de toma de decisiones por él mismo.
• A los efectos colaterales de los medicamentos.
• Al propio costo de los medicamentos.
Se debe tomar en cuenta el incremento de los costos de tratamiento debido al manejo de los efectos adversos secundarios al uso de medicamentos y la comorbilidad médica, con tasas más elevadas en los pacientes con trastornos mentales (Villamil 2005).
Por lo tanto, el control de los eventos adversos es uno de los factores que se consideran más relevantes para evitar el abandono del tratamiento (Obradovic 2005, Heinze 2005).
La obesidad secundaria al tratamiento de la esquizofrenia actualmente se considera que es uno de los factores que mayormente contribuye al incremento de los costes de la atención médica de estos pacientes (Chwastiak 2009).
Finalmente, aún es controversial que los antipsicóticos atípicos sean mejores que los típicos (Rosenheck 2006, Jones 2006); en algunas publicaciones no se han encontrado mayores beneficios con los antipsicóticos atípicos (Rosenheck 2008, Joones 2006, McCue 2006, Polsky 2006), aunque en algunos de esos estudios no se han usado las dosis óptimas (Tandon 2006, Leucht 2009, Davis 2009) o el periodo de seguimiento de los pacientes no ha sido el apropiado para evaluar la presencia de efectos secundarios (Freedman 2006); un meta-análisis reciente muestra que no hay diferencias importantes entre estos dos grupos de medicamentos (Leucht 2009).
No existe el medicamento perfecto para el tratamiento de la esquizofrenia (Agid 2007, Gründer 2009) seguirá siendo necesario mejorar los tratamientos, y mientras se pueda, tomar una decisión costo-efectiva (IMSS).
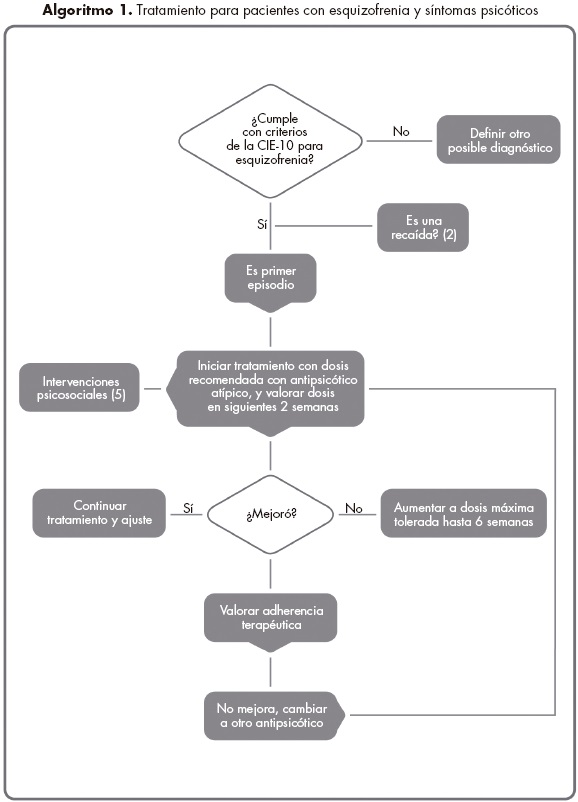




Abdel-Baki A, Lesage A, Nicole L, Cossette M, Salvat E, Lalonde P. Schizophrenia, an illness with bad outcome: myth or reality? Can J Psychiatry 2011;56:92-101.
Abdul-Rahman MF, Qiu A, Woon PS, Kuswanto C, Collinson SL, Sim K. Arcuate fasciculus abnormalities and their relationship with psychotic symptoms in schizophrenia. PLoS One 2012;7:e29315.
Abraham KR, Kulhara P. The efficacy of electroconvulsive therapy in the treatment of schizophrenia. A comparative study. Br J Psychiatry 1987;151:152-155.
Abrams R, Swartz, CM. Electroconvulsive therapy apparatus and method for automatic monitoring of patient seizures. US. Patent 1989;4878898.
Abrams R. Electroconvulsive Therapy. 2nd ed. New York, Oxford University Press, 1992.
Abrams R, Colin R. Aplicación clínica del monitoreo convulsivo electroencefalográfico durante Terapia Electroconvulsiva Salud Mental 1995;18:(3)235-249.
Adams CE, Coutinho E, Duggan L, Gilbody S, Leucht S, Wahlbeck K. Cochrane schizophrenia group. Cochrane2 Database Syst Rev 2003 (4):CDD51334
Adams CE, Fenton MK, Quraishi S, David AS. Systematic meta-review of depot antipsychotic drugs for people with schizophrenia. Br J Psychiatry 2001;179:290-299.
Addington AM, Gornick M, Duckworth J. GAD1 (2q31.1), which encodes glutamic acid decarboxilase (GAD67), is associated with childhood-onset schizophrenia and cortical gray matter volume loss. Mol Psychiatry 2005;10:581-588.
Addington AM, Rapoport JL. The genetics of childhood-onset schizophrenia: When madness strikes the pubescent. Curr Psychiatry Rep 2009;11:156-161.
Addington D, Addington J, Maticka-Tyndale E, Joyce J. Reliability and validity of a depression rating scale for schizophrenics. Schizophr Res 1992;6:201-208.
Addington DJ, Patten S. Depression in people with first-episode schizophrenia. Br J Psychiatry 1998;172:90-92.
Addington J, Cornblatt BA, Cadenhead KS, Cannon TD, McGlashan TH, Perkins DO et al. At clinical high risk for psychosis: outcome for nonconverters. Am J Psychiatry 2011;168:800-805.
Addington J, Leriger E, Addington D. Symptom outcome 1 year after admission to an early psychosis program. Can J Psychiatry 2003;48:204-207.
Adler CM, McDonough-Ryan P, Sax KW, Holland SK, Arndt S, Strakowski SM. MRI of neuronal activation with symptom provocation in unmedicated patients with obsessive compulsive disorder. J Psychiatr Res 2000;34:317-324.
Agid O, Seeman P, Kapur A. The "delayed onset" of antipsychotic action - an idea whose time has come and gone. J Psychiatry Neurosci 2006;31:93-100.
Agid Y, Buzsáki G, Diamond DM, Frackowiak R, Giedd J, Girault JA et al. How can drug discovery for psychiatric disorders be improved? Nat Rev Drug Discov 2007;6:189-201.
Aichhorn W, Whitworth AB, Weiss EM, Marksteiner J. Second-generation antipsychotics: is there evidence for sex differences in pharmacokinetic and adverse effect profiles. Drug Saf 2006;29:587-598.
Alaghband-Rad J, McKenna K, Gordon CT, Albus KE, Hamburger SD, Rumsey JM. Childhood-onset schizophrenia: The severity of premorbid course. J Am Acad Child Adolesc Psychiatry 1995;34:1273-1283.
Albanese MJ, Khantzian EJ, Murphy SL. Decreased substance use in chronically psychotic patients treatment with clozapine. Am J Psychiatry 1994;151:780-781.
Aleman A, Kahn RS. Strange feelings: do amygdala abnormalities dysregulate the emotional brain in schizophrenia? Prog Neurobiol 2005;77:283-298.
Alevizos B, Lykouras L, Zervas IM, Christodoulou GN. Risperidone-induced obsessive-compulsive symptoms: a series of six cases. J Clin Psychopharmacol 2002;22:461-467.
Alexander MP, Naeser MA. Cortical-subcortical differences in aphasia. Res Publ Assoc Res Nerv Ment Dis. 1988;66:215-228.
Allison DB, Casey DE. Antipsychotic-induced weight gain: a review of the literature. J Clin Psychiatry 2001;62:22-31.
Alphs L, Gopal S, Karcher K, Kent J, Sliwa JK, Kushner S et al. Are the long-acting intramuscular formulations of risperidone or paliperidone palmitate associated with post-injection delirium/sedation syndrome? An assessment of safety databases. Curr Drug Saf 2011;6:43-45.
Alvarez JM, Parker AG, Hetrick SE, McGorry PD, Gleeson JF. A systematic review and meta-analysis of psychosocial and pharmacological trials in first-episode psychosis. Schizophr Bull 2011;37:610-630.
Alvarez PA, Pahissa J. QT Alterations in psychopharmacology: proven candidates and suspects. Curr Drug Saf 2010;5:97-104.
Alvir JM, Lieberman JA, Safferman AZ, Schwimmer JL, Schaaf JA. Clozapine-induced agranulocytosis: Incidense and risk factors in the United States. N Engl J Med 1993;329:162-167.
Amador XF, Strauss DH, Yale S, Gorman JM, Endicott J. The assessment of insight in psychosis. Am J Psychiatry 1993;150:873-879.
Amaresha AC, Venkatasubramanian G. Expressed emotion in schizophrenia: an overview. Indian J Psychol Med 2012;34:12-20.
American Academy of Child and Adolescent Psychiatry (AACAP). Practice parameter for the assessment and treatment of child and adolescent schizophrenia. J Am Acad Child Adolesc Psychiatry 2001;40:4S-23S.
American Psychiatric Association practice guidelines for the assessment and treatment of patients with suicidal behaviors. Am J Psychiatry 2003;160:1-60.
American Psychiatric Association. (1980). Diagnostic and statistical manual of mental disorders (3rd ed.). Washington, DC: Author.
American Psychiatric Association. (1987). Diagnostic and statistical manual of mental disorders (3rd ed., rev.). Washington, DC: Author.
American Psychiatric Association. (1994). Diagnostic and statistical manual of mental disorders (4th ed.). Washington, DC: Author.
American Psychiatric Association. (2000). Diagnostic and statistical manual of mental disorders (4th-TR ed.). Washington, DC: Author.
American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders (DSM-5). Arlington, Va. 2012 [29-Sep-2012] http://www.dsm5.org/Pages/Default.aspx.
American Psychiatric Association. Practice guideline for the treatment of patients with schizophrenia. 2nd ed. Am J Psychiatry 2004;161:111-114.
American Psychiatric Association. The practice of Electroconvulsive Therapy: Recommendations for Treatment, Trainning and Privileging. A Task Force report. Washington, DC: APA Press 1990.
Amminger GP, Schafer MR, Papageorgiou K, Klier CM, Cotton SM, Harrigan SM et al. Long-chain omega-3 fatty acids for indicated prevention of psychotic disorders: a randomized, placebo-controlled trial. Arch Gen Psychiatry 2010;67:146-154.
Anderson CM, Griffin S, Rossi A, Pagonis I, Holder D, Trieber R. A comparative study of the impact of education vs. process groups for families of patients with affective disorders. Fam Process 1986;25:185-205.
Anderson CM, Hogarty G, Bayer G, Needleman R. Expressed emotion and the social networks of parents of schizophrenic patients. Br J Psychiatry 1984;144:247-255.
Anderson CM. A psychoeducational program for families of patients with schizophrenia. In W. R. McFarlane (Ed.), Family therapy in schizophrenia. New York: Guilford Press 1983;99-116.
Andreasen N. Standardized remission criteria in schizophrenia. Acta Psychiatr Scand 2006;113:181.
Andreasen NC, Arndt S, Alliger R, Miller D, Flaum M. Symptoms of schizophrenia. Methods, meanings and mechanisms. Arch Gen Psychiatry 1995;52:341-351.
Andreasen NC, Carpenter WT Jr, Kane JM, Lasser RA, Marder SR, Weinberger DR. Remission in schizophrenia: proposed criteria and rationale for consensus. Am J Psychiatry 2005;162:441-449.
Andreasen NC, Grove WM. Thought, language, and communication in schizophrenia: diagnosis and prognosis. Schizophr Bull 1986;12:348-359.
Andreasen NC. Standardized remission criteria in schizophrenia. Acta Psychiatr Scand 2006;113:181.
Andreasen NC. The Scale for the Assessment of Negative Symptoms (SAPS). University of Iowa, Iowa City. 1984.
Andreasen NC. Thought, Language and Communication disorders. I. Clinical assessment, definition of termsand evaluation of their reliability. Arch Gen Psychiatry 1979;36:1315-1321.
Andreasson S, Allebeck P, Engstrom A, Rydberg U. Cannabis and schizophrenia. A longitudinal study of Swedish conscripts. Lancet 1987;2:1483-1486.
Apiquian R, Cordoba R, Louza M. Clinical outcomes of long-acting injectable risperidone in patients with schizophrenia: six-month follow-up from the Electronic Schizophrenia Treatment Adherence Registry in Latin America. Neuropsychiatr Dis Treat 2010;7:19-26.
Apiquian R, Fresan A, García-Anaya M, Loyzaga C, Nicolini H. Impacto de la duración de la psicosis no tratada en pacientes con primer episodio psicòtico: Estudio de seguimiento a un año. Gac Med Mex 2006;142(2):113-120.
Apiquian R, Fresán A, Ulloa RE, García-Anaya M, Loyzaga C, Nicolini H, Ortega-Soto HA. Comparative study of schizophrenic patients with and without depression. Salud Mental 2001;24:25-29.
Apiquian R, Fresán A, Ulloa RE. Diagnosis and treatment of patients with first psychotic episode. Salud Mental 1999;22:79-87.
Apiquian R, Ulloa RE, Paez F. The Mexican first-episode psychotic study: clinical characteristics and premorbid adjustment. Schizophr Res 2002;53:161-163.
Apiquian R. Escalas de evaluación de Movimientos Anormal. En: Apiquian R, Fresán A, Nicolini H. Evaluación de la Psicopatología. Escalas en español, JGH editores. 2000;89-95.
Arana GW. An overview of side effects caused by typical antipsychotics. J Clin Psychiatry 2000;61(Suppl)8:5-11.
Arango C, Gómez-Beneyto M, Brenlla J, Gastó C, Sarrameacrespo F, Chamorro L et al. A 6-month prospective, observational, naturalistic, uncontrolled study to evaluate the effectiveness and tolerability of oral ziprasidone in patients with schizophrenia. Eur Neuropsychopharmacol 2007;17:456-463.
Arendt M, Rosenberg M, Foldager L, Perto G, Munk-Jorgensen P. Cannabis-induced psychosis and subsequent schizophrenia-spectrum disorders: follow-up study of 535 incident cases. Br J Psychiatry 2005;187:510-515.
Aronson JK. Editors' view. Compliance, concordance, adherence. Br J Clin Pharmacol 2007;63:383-384.
Arsenault L, Cannon M, Poulton R, Murray R, Caspi A, Moffit TE. Cannabis use in adolescent and risk for adult psychosis: longitudinal prospective study. BMJ 2002;325:1212-1213.
Arseneault L, Cannon M, Fischer HL, Polanczyc G, Moffit TE, Caspi A. Childhood trauma and children's emerging psychotic symptoms: A genetically sensitive longitudinal cohort study. Am J Psychiatry 2011;168:65-72.
Arseneault L, Moffitt TE, Caspi A, Taylor PJ, Silva PA. Mental disorders and violence in a total birth cohort: results from the Dunedin Study. Arch Gen Psychiatry 2000;57:979-986.
Asenjo Lobos C, Komossa K, Rummel-Kluge C, Hunger H, Schmid F, Schwarz S et al. Clozapine versus other atypical antipsychotics for schizophrenia. Cochrane Database Syst Rev 2010;11:CD006633.
Astrom-Lilja C, Odeberg JM, Ekman E, Hägg S. Drug-induced torsades de pointes: a review of the Swedish pharmacovigilance database. Pharmacoepidemiology and Drug Safety 2008;17:587-592.
Athanasiou MC, Dettling M, Cascorbi I, Mosyagin I, Salisbury BA, Pierz KA et al. Candidate gene analysis identifies a polymorphism in HLA-DQB1 associated with clozapine-induced agranulocytosis. J Clin Psychiatry 2011;72:458-463.
Atkinson JM, Coia DA, Gilmu WH, Harper JM. The impact of education groups for people with schizophrenia on social functioning and quality of life. Br J Psychiatry 1966;168:199-204.
Ayala H, Chism K, Cárdenas G. Una alternativa al tratamiento y rehabilitación de enfermos mentales crónicos. Salud Mental 1982;5:1-10.
Bachrach L. Psychosocial rehabilitation and psychiatry in the treatment of schisophrenia. Acta Psychiatrica Scand 2000;102:6-10.
Bae SW, Brekke J, Bola J. Ethnicity and treatment outcome variation in schizophrenia: a longitudinal study of community - based psychiosocial rehabilitation interventions. J Nerv Ment Dis 2004;192:623-628.
Baeza I, Flamarique I, Garrido JM, Horga G, Pons A, Bernardo M et al. Clinical experience using electroconvulsive therapy in adolescents with schizophrenia spectrum disorders. J Child Adolesc Psychopharmacol 2010;20:205-209.
Baker RW, Chengappa KN, Baird JW, Steingard S, Christ MA, Schooler NR. Emergence of obsessive compulsive symptoms during treatment with clozapine. Journal Clin Psychiatry 1992;53:439-442.
Bakker PR, de Groot IW, van Os J, van Harten PN. Long-stay psychiatric patients: a prospective study revealing persistent antipsychotic-induced movement disorder. PLoS One 2011;6.
Balbo E. Salud mental e inmigración magrebí. Salud Global 2004;4:2-7.
Ballageer T, Malla A, Manchanda R, Takhar J, Haricharan R. Is adolescent-onset first-episode psychosis different from adult onset? J Am Acad Child Adol Psychiatry 2005;44:782-789.
Ballus C, Llovet JM, Boada JC. La orientación terapéutica familiar en la esquizofrenia: Un modelo psicoeducativo sistèmico. Reflexiones tras un año de seguimiento. Rev Psiquiatría Fac Med Barna 1991;18:71-78.
Bankole A, Cohen CI, Vahia I, Diwan Spelekar N, Pelekar N, Reyes P et al. Symptomatic remission in a multi-racial urban population of older adults with schizophrenia. Am J Geriatr Psychiatry 2008;16:966-973.
Bannon MJ, Roth R. Pharmacology of mesocortical dopamine neurons. Pharmacol Rev 1983;35:63-68.
Barch DM, Carter CS, MacDonald AW 3rd, Braver TS, Cohen JD. Context-processing deficits in schizophrenia: diagnostic specificity, 4-week course, and relationships to clinical symptoms. J Abnorm Psychol 2003;112:132-143.
Barrowclough C, Tarrier N. Families of schizophrenic patients: Cognitive behavioral intervention 1992. London: Chapman & Hall.
Bauml J, Frobose T, Sibylle K, Rentrop M. Psychoeducation: a basic psychotherapeutic intervention for patients with schizophrenia and their families. Schizophr Bull 2006;32: S1-S9.
Bell M, Tsang H, Tamasine G, Bryson GJ. Neurocognition, social cognition, perceived social discomfort, and vocational outcomes in schizophrenia. Schizophr Bull 2009;35:738-747.
Bellack A, Mueser KT. Psychosocial Treatment for Schizophrenia. Schizophr Bull 1993;19:317-336.
Bellack AS, Bennett ME, Gearson JS, Brown CH, Yang Y. A randomized clinical trial of a new behavioural treatment for drug abuse in people with severe persistent mental illness. Arch Gen Psychiatry 2006;63:426-432.
Bellack AS, Mueser KT, Gingerch S, Agresta J. Social skills training for schizophrenia. A step by step guide. New York: Guildford Press; 2004.
Bellack AS, Mueser KT. A comprehensive treatment program for schizophrenia and chronic mental illness. Community Mental Health J 1993;22:175-189.
Benítez CE, Chávez LE, Ontiveros UM. Crianza y esquizofrenia. Salud Mental 2005;28:59-72.
Berman I, Kalinowski A, Berman SM, Lengua J, Green AI. Obsessive and compulsive symptoms in chronic schizophrenia. Compr Psychiatry 1995;36:6-10.
Berman I, Merson A, Viegner B, Losonczy MF, Pappas D, Green AI. Obsessions and compulsions as a distinct cluster of symptoms in schizophrenia: a neuropsychological study. J Nerv Ment Dis 1998;186:150-156.
Berman I, Sapers B, Chang H, Losonzy M, Schmilder J, Green A. Treatment of obsessive-compulsive symptoms in schizophrenic patients with clomipramine. J Clin Psycho-pharmacol 1995;15:206-210.
Bermanzohn P. Prevalence and prognosis of obsessive-compulsive phenomena in schizophrenia: A critical view. Psychiatric Ann 1999;29:5508-512.
Bermanzohn PC, Porto L, Arlow PB. Are some neuroleptic refractory symptoms in schizophrenia really obsessions? CNS spectrum 1997;2:51-57.
Bernardo M, Azanza JR, Rubio TC, Rejas J. Cost-effectiveness analysis of schizophrenia relapse prevention. An economic evaluation of the ZEUS (Ziprasidone-extended-use in schizophrenia) Study in Spain. Clin Drug Invest 2006;26:447-457.
Berrettini WH. Are schizophrenic and bipolar disorders related? A review of family and molecular studies. Biol Psychiatry 2000;15;48:531-538.
Berrios GE. Obsessive compulsive disorder: Its Conceptual History in France during the 19th century, Comprehensive Psychiatry 1989;30:283-295.
Berrios GE. The History of Mental Symptoms. First edition. Great Britain Cambridge University Press. 1996.
Bhana N, Foster RH, Olney R, Plosker GL. Olanzapine: an updated review of its use in the management of schizophrenia. Drugs 2001;61:111-161.
Binder RL. Are the mentally ill dangerous? J Am Acad Psychiatry Law 1999;27:189-201.
Birchwood M, Smith J, MacMillan F. Predicting relapse in schizophrenia; the Development and implementation of an early signs monitoring system using patients and family as observers, a preliminary investigation. Psychol Med 1989;19:649-656.
Birchwood M, Todd P, Jackson C. Early intervention in psychosis. The critical period hypothesis. Br J Psychiatry Suppl 1998;172:53-59.
Bishnoi M, Chopra K, Kulkarni SK. Possible anti-oxidant and neuroprotective mechanisms of zolpidem in attenuating typical anti-psychotic-induced orofacial dyskinesia: a biochemical and neurochemical study. Prog Neuropsychopharmacol Biol Psychiatry 2007;31:1130-1138.
Blaschke D, Parwani AS, Huemer M, Rolf S, Boldt LH, Dietz R et al. Torsade de pointes during combined treatment with risperidone and citalopram. Pharmacopsychiatry 2007;40:294-295.
Blouin JL, Dombroski BA, Nath SK, Lasseter VK, Wolyniec PS, Nestadt G et al. Schizophrenia susceptibility loci on chromosomes 13q32 and 8p21. Nat Genet 1998;20:70-73.
Bobes J, Cañas F, Rejas J, Mackell J. Economic consequences of the adverse reactions related with antipsychotics: an economic model comparing tolerability of ziprasidone, olanzapine, risperidone and haloperidol in Spain. Prog Neuropsychopharmacol Biol Psychiatry 2004;28:1287-1297.
Bobes J, Rejas J, García GM, Rico VF, García PM, Fernández I et al. Weight gain in schizophrenic patients treated with risperidone, olanzapine, quetiepine or haloperidol: results of the EIRE study. Schizophr Res 2003;62:77-88.
Bond GR, Becker DR, Drake RE. Implementing supported employment as an evidence-based practice. Psychiatr Serv 2001;52:313-322.
Borison RL. Recent advances in the pharmacotherapy of schizophrenia. Harv Rev Psychiatry 1997;4:255-271.
Bottas A, Cooke RG, Richter MA. Comorbidity and pathophysiology of obsessive-compulsive disorder in schizophrenia: is there evidence for a schizo-obsessive subtype of schizophrenia? J Psychiatry Neurosc 2005;30:187-193.
Bovasso GB. Cannabis abuse as a risk factor for depressive symptoms. Am J Psychiatry 2001;158:2033-2037.
Bradford DW, Chakos MH, Sheitman BB, Lieberman JA. Atypical antispsychotic drugs in treatment-refractory schizophrenia. Psychiatric Ann 1998;28:618-626.
Brady K, Anton R, Ballenger JC, Lydiard RB, Adinoff B, Selander J. Cocaine abuse among schizophrenic patients. Am J Psychiatry 1990;147:1164-1167.
Braga RJ, Petrides G. Psychiatry Research Department, The combined use of electroconvulsive therapy and antipsychotics in patients with schizophrenia. J ECT 2005;21:75-83.
Bräuning P, Krüger S, Shugar G. Prevalence and clinical significance of catatonic symptoms in mania. Compr Psychiatry 1998;39:35-46.
Brennan PA, Mednick SA, Hodgins S. Major mental disorders and criminal violence in a Danish birth cohort. Arch Gen Psychiatry 2000;57:494-500.
Brenner HD, Pfammatter M. Psychological Therapy in schizophrenia: What is the evidence? Acta Psychiatr Scand 2000;102:74-77.
Briand C, Vasiliadis HM, Lesage A, Lalonde P, Stip E, Nicole L. Including integrated psychological treatment as part of standard medical therapy for patients with schizophrenia: Clinical outcomes. J Nerv Ment Dis 2005;194:463-470.
Brown AS, Begg MD, Gravenstein S, Schaefer CA, Wyatt RJ, Bresnahan M et al. Serologic Evidence of Prenatal Influenza in the Etiology of Schizophrenia. Arch Gen Psychiatry 2004;61:774-780.
Brown AS, Derkits EJ. Prenatal Infection and Schizophrenia: A Review of Epidemiologic and Translational Studies. Am J Psychiatry 2010;167:261-280.
Brown GW. The mental hospital as an institution. Br J Psychiatry 1977;130:1-18.
Brown S, Inskip H, Barraclough B. Causes of the excess mortality of schizophrenia. Br J Psychiatry 2000;177:212-217.
Brunette M, Drake R. Gender Differences in patients with schizophrenia and substance abuse. Compr Psychiatry 1997;38:109-116.
Brunner E, Ortega HA, Apiquian R. Utilidad de la Escala para Acatisia de Barnes en población mexicana. Comunicación personal 1995.
Brzustowicz LM, Hodgkinson KA, Chow EW, Honer WG, Bassett AS. Location of a major susceptibility locus for familial schizophrenia on chromosome 1q21 - q22. Science 2000 28;288:678-682.
Buchanan RW, Kreyenbuhl J, Zito JM, Lehman A. The schizophrenia PORT pharmacological treatment recommendations: conformance and implications for symptoms and functional outcome. Schizophr Bull 2002;28:63-74.
Buchanan RW, Kreyenbuhl J, Kelly DL, Noel JM, Boggs DL et al. The 2009 Schizophrenia PORT Psychopharmacological Treatment Recommendations and Summary Statement. Schizophr Bull 2010;36:71-93.
Buchanan RW, Kreyenbuhl J, Kelly DL, Noel JM, Boggs DL, Fischer BA et al. Quality of life after electroconvulsive therapy in persons with treatment resistant schizophrenia. Indian J Med Res 2011;133:641-644.
Buckiey P, Thompson PA, Way L, Meitzer HY. Substance abuse among patients with treatment-resistant schizophrenia: characteristics and implications for clozapine. Am J Psychiatry 1994;151:385-389.
Buckley P, Miller A, Olsen J, Garver D, Miller DD, Csernansky J. When Symptoms Persist: Clozapine Augmentation Strategies. Schizophr Bull 2001;27(4):615-628.
Buckley PF. Novel antipsychotic medications and the treatment of comorbid substance abuse in schizophrenia. J Subst Abuse Treat 1998;15:113-116.
Buckley PF, Correll CU. Strategies for dosing and switching antipsychotics for optimal clinical management. J Clin Psychiatry 2008;69(Suppl)1:4-17.
Bulbena A, Berrios G, Fernández P. Medición clínica en psiquiatría y psicología. Masson. Barcelona.2000.
Burgyone K, Aduri K, Ananth J, Parameswaran S. The use of antiparkinsonian agents in the management of drug-induced extrapyramidal symptoms. Curr Pharm Des 2004;10:2239-2248.
Burns T, Catty J, Dash M, Roberts C, Lockwood A, Marshall M. Use of intensive case management to reduce time in hospital in people with severe mental illness: systematic review and meta-regression. BMJ 2007;335:336.
Burns T, Creed F, Fahy T, Thompson S, Tyrer P, White I. Intensive versus standard case management for severe psychotic: a randomized trial. Lancet 1999;353:2158-2189.
Burns T, Fioritti A, Holloway F, Malm U, Rossler W. Case management and assertive community treatment in Europe. Psychiatr Serv 2001;52:631-636.
Burns T. Community mental health teams. A guide to current practices. New York: Oxford University Press; 2005. Encontrado en http://www.thecommunityguide.org/library/pubstopic.htm. Consultado el 5 de junio de 2012.
Bush G, Fink M, Petrides G, Dowling F, Francis A. Catatonia. I Rating scale and standardized examination. Acta Psychiatr Scand 1996;93:129-136.
Butzlaff RL, Hooley JM. Expressed emotion and psychiatric relapse: a meta-analysis. Arch Gen Psychiatry 1998;55:547-552.
Bye R, Linares E. Plantas medicinales del México prehispánico. Arqueología mexicana 1999;7:4-11.
Byne W, Hazlett EA, Buchsbaum MS, Kemether E. The thalamus and schizophrenia: current status of research. Acta Neuropathol 2009;117:347-368.
Byrne P. Managing the acute psychotic episode. BMJ 2007;334:686-692.
Caldwell CB, Gottesman II. Schizophrenia-a high risk factor for suicide: clues to risk reduction. Suicide Life Threatment Behaviour 1992;22:479-493.
Cannon M, Jones P, Murria R. Obstetric complications and schizophrenia: Historical and meta-analytic review. Am J Psychiatry 2002;159:1080-1092.
Cannon TD, Cadenhead K, Cornblatt B, Woods SW, Addington J, Walker E et al. Prediction of psychosis in youth at high clinical risk: a multisite longitudinal study in North America. Arch Gen Psychiatry 2008;65:28-37.
Cannon TD, Kaprio J, Longqvist J, Huttunen M, Koskenvuo M. The genetic epidemiology of schizophrenia in a Finnish twin cohort: A population based modeling study. Arch Gen Psychiatry 1998;55:67-74.
Cantor-Graae E, Nordstrom LG, McNeil TF. Substance abuse in schizophrenia: a review of the literature and a study of correlates in Sweden. Schizophr Res 2001;48:69-82.
Caqueo UA, Gutiérrez MJ, Miranda CC. Quality of life in caregivers of patients with schizophrenia: a literature review. Health Qual Life Outcomes 2009;7:84.
Carlsson A, Lindquist M. Effect of chlorpromazine or haloperidol on formation of 3-methoxytyramine and normetanephrine in mouse brain. Acta Pharmacol Toxicol 1963;20:140-144.
Caroff S, Hurford I, Lybrand J, Campbell C. Movement Disorders Induced by Antipsychotic Drugs: Implications of the CATIE Schizophrenia Trial Neurol Clin 2011;29:127.
Caroff SN, Walker P, Campbell C. Treatment of tardive dyskinesia with galantamine: a randomized controlled crossover trial. J Clin Psychiatry 2007;68:410-415.
Caroff SN. Review: extrapyramidal side effects vary between different second-generation antipsychotic drugs. Evid Based Ment Health 2012;15:47.
Carone BJ, Harrow M, Westermeyer JF. Posthospital course and outcome in schizophrenia. Arch Gen Psychiatry 1991;48:247-253.
Carpenter WT, Heinrichs DW, Wagman DW. Deficit and non-deficit forms of schizophrenia: the concept. Am J Psychiatry 1988;145:578-583.
Carr V, Lewin T, Neil A, Halpin S, Colmes S. Premorbid, psychosocial and clinical predictors of the cost of schizophrenia and other psychoses. Br J Psychiatry 2004;184:517-525.
Carr VI, Lewin T, Neil AL, Halpin SA, Holmes S. Premorbid, psychosocial and clinical predictors of the costs of schizophrenia and other psychoses. Br J Psychiatry 2004;184:517-525.
Carter DM, Nackinnon A, Howard S, Zeegers T, Copolov DL. The development and reliability of the Mental Health Research Institute Unusual Perceptions Schedule (MUPS): an instrument to record auditory hallucinatory experience. Schizophr Res 1995;16:157-165.
Carter NJ. Extended-release intramuscular paliperidone palmitate: a review of its use in the treatment of schizophrenia. Drugs 2012;72:1137-1160.
Casas M, Gutiérrez M, Gibert J, Bobes J, Roncero C, Octavio I. Risperidona en el tratamiento de pacientes psicóticos con abuso y dependencia de opiáceos. Actas Esp Psiquiatr 2001;29:380-385.
Casas M. Utilidad de la risperidona en patología dual. III Congreso Nacional de la Sociedad Española de Psiquiatría. Platja d'Aro, España, 20-24 de Octubre, 1998.
Case M, Stauffer S, Ascher-Svanum H, Conley R, Kapur S, Kane J et al. The heterogeneity of antipsychotic response in the treatment of schizophrenia. Psychol Med 2011;41:1291-1300.
Cassano G, Pini S, Rucci P, Dell'Osso L. Occurrence and clinical correlates of psychiatric co-morbidity in patients with psychotic disorders. J Clin Psychiatry 1998;59:60-68.
Cassidy CM, Norman R, Manchanda R, Schmitz N, Malla A. Testing definitions of symptom remission in first-episode psychosis for prediction of functional outcome at 2 years. Schizophr Bull 2010;36:1001-1008.
Castle DJ, Murray RM. The epidemiology of late onset schizophrenia. Schizophr Bull 1993;19:691-700.
Cavallaro R, Cavedini P, Mistretta P, Bassi T, Angelone SM, Ubbiali A. Basal-corticofrontal circuits in schizophrenia and obsessive-compulsive disorder: a controlled, double dissociation study. Biol Psychiatry 2003;54:437-443.
Chabroux S, Haffen E, Penfornis A. Diabetes and second-generation (atypical) anti-psychotics. Annales d'endocrinologie 2009;70:202-210.
Chakos MH, Mayerhoff DI, Loebel AD, Alvir JMJ, Lieberman JA. Incidence and correlates of acute extrapyramidal symptoms in first episode of schicophrenia. Psychopharmacol Bull 1992;28:81-86.
Chan J, Sweeting M. Review: Combination therapy with non-clozapine atypical antipsychotic medication: a review of current evidence. J Psychopharmacol 2007;21:657-664.
Chanpattana W, Chakrabhand ML, Buppanharun W, Sackeim HA. Effects of stimulus intensity on the efficacy of bilateral ECT in schizophrenia: a preliminary study. Biol Psychiatry 2000;48:222-228.
Chanpattana W, Chakrabhand ML. Combined ECT and neuroleptic therapy in treatment-refractory schizophrenia: prediction of outcome. Psychiatry Res 2001;105:107-115.
Chaves MP, Crippa JA, Morais SL, Zuardi AW. Electroconvulsive therapy for coexistent schizophrenia and obsessive-compulsive disorder. J Clin Psychiatry 2005;66:542-543.
Chávez-Alvarado C, Pol-Morales F, Villaseñor-Bayardo SJ. Otros conceptos de enfermedad mental. Investigación en salud 2005;7:128-134.
Chen E, Berrios GE. Recognition of hallucinations: a new multidimensional model and methodology. Psychopathol 1996;29:54-63.
Chong SA, Remington G. Clozapine Augmentation: Safety and Efficacy. Schizophr Bull 2000;26:421-440.
Chue P, Chue J. A review of paliperidone palmitate. Expert Rev Neurother 2012;12:1383-1397.
Chue P, Welch R, Lind J. Investigation of the metabolic effects of antipsychotics in patients with schizophrenia. J Eur Coll Neuropsychopharmacol 2003;13(suppl 4):S300.
Chue PS, Heeg B, Buskens E, van Hout BA. Modelling the impact of compliance on the costs and effects of long-acting risperidone in Canada. Pharmacoeconomics 2005;23(Suppl 1):62-74.
Chung AKK, Chua SE. Torsade de pointes with low-dose amisulpride: a case report. J Psychopharmacol 2010;24:433-435.
Chwastiak LA, Rosenheck RA, McEvoy JP, Stroup TS, Swartz MS, Davis SM et al. The impact of obesity on health care costs among persons with schizophrenia. Gen Hosp Psychiatry 2009;31:1-7.
CIE-10. The ICD-10 Classification of Mental and Behavioral Disorders: Diagnostic Criteria for Research, OMS, 1992.
Citrome L. Using oral ziprasidone effectively: the food effect and dose-response. Adv Ther 2009;26:739-48.
Cleghorn JM, Kaplan RD, Szechtman B, Szechtman H, Brown GM. Neuroleptic drug effects on cognitive function in schizophrenia. Schizophr Res 1990;3:211-219.
Cohen AS, Saperstien AM, Gold JM, Kirkpatrich B, Carpenter WT, Buchanan RW. Neuropsychology of the deficit syndrome: New data and meta-analysis of findings to date. Schizophr Bull 2006;33:1201-1212.
Cohen D, Bogers JP, van Dijk D, Bakker B, Schulte PF. Beyond white blood cell monitoring: screening in the initial phase of clozapine therapy. J Clin Psychiatry 2012;73:1307-1312.
Coldham EL, Addington J, Addington D. Medication adherence of individuals with a first episode of psychosis. Acta Psychiatr Scand 2002;106:286-290.
Colli AM. Psicoterapia intercultural con los espiritistas y practicantes de religiones de origen africano: los aportes de la psicología transpersonal, la etnopsiquiatría y la antropología cultural para su práctica. Ponencia al I Evento Franco-Cubano de Psiquiatría y Psicología, Seminario de Transculturación, Academia de Ciencias de Cuba. Consultado el 13-12-05 en: http://www.click.vi.it/sistemieculture/Mario_Colli_Alonso.html
Commander M, Sashidharan S, Rana T, Ratnayake T. North Birmingham assertive outreach evaluation. Patient characteristics and clinical outcomes. Soc Psychiatry Psychiatr Epidemiol 2005;40:988-993.
Committee on Safety of Medicines Myocarditis with antipsychotics: recent cases with clozapine (Clozaril). Curr Prob Pharmacovigilance 1993;19:9.
Conley R, Gale E, Hirsch K. Olanzapine response in therapy-refractory schizophrenia with substance abuse. Schizophr Res 1998;33:95-101.
Contopoulos-Loannidis D, Phil S, Trikalinos T, Churchill R, Wahlbeck K, Loannidis J. Comparison of large versus smaller randomized trials for mental health-related interventions. Am J Psychiatry 2005;162:578-584.
Convit A, Isay D, Otis D, Volavka J. Characteristics of repeatedly assaultive psychiatric inpatients. Hosp Community Psychiatry 1990;41:1112-1115.
Cornblatt BA, Auther AM, Niendam T, Smith CW, Zinberg J, Bearden CE et al. Preliminary findings for two new measures of social and role functioning in the prodromal phase of schizophrenia. Schizophr Bull 2007;33:688-702.
Cornblatt BA, Lencz T, Smith CW, Olsen R, Auther AM, Nakayama E et al. Can antide-pressants be used to treat the schizophrenia prodrome? Results of a prospective, naturalistic treatment study of adolescents. J Clin Psychiatry 2007;68:546-557.
Correll CU, Kratochvil CJ, March JS. Developments in pediatric psychopharmacology: focus on stimulants, antidepressants, and antipsychotics. J Clin Psychiatry 2011;72:655-670.
Correll CU, Leucht S, Kane JM. Lower risk for tardive dyskinesia associated with second-generation antipsychotics: a systematic review of 1-year studies. Am J Psychiatry 2004;161:414-425.
Correll CU, Manu P, Olshanskiy V, Napolitano B, Kane JM, Malhotra AK. Cardiometabolic risk of second-generation antipsychotic medications during first-time use in children and adolescents. JAMA 2009;302:1765-1773.
Correll CU, Penzner JB, Parikh UH. Recognizing and monitoring adverse events of second-generation antipsychotics in children and adolescents. Child Adolesc Psychiatric Clin N Am 2006;15:177-206.
Crail-Meléndez D. Síntomas Obsesivo-Compulsivos en Pacientes con Diagnóstico de Esquizofrenia: prevalencia, características clínicas y sociodemográficas. México D.F.: Universidad Nacional Autónoma de México; 2006.
Crilly J. The history of clozapine and its emergence in the US market: a review and analysis. Hist Psychiatry 2007;18:39-60.
Crow TJ. Schizophrenia as failure of hemispheric dominance for language. Trends Neurosci 1997;20:339-343.
Crump C, Winkleby M, Sundquist K, MD, Sundquist J. Comorbidities and Mortality in Persons with Schizophrenia: A Swedish National Cohort Study. Am J Psychiatry 2013;10.1176/appi.ajp.2012.12050599.
Cummings JL. Frontal-subcortical circuits and human behavior. Arch Neurol 1993;50:873-880.
Cunningham Owens DG. A Guide to the Extrapiramidal Side-Effects of Antipsychotic Drugs. Cambridge University Press 1999;18-238.
Currier GW, Trenton AJ, Walsh PG, van Wijngaarden E. A pilot, open-label safety study of quetiapine for treatment of moderate psychotic agitation in the emergency setting. J Psychiatr Pract 2006;12:223-228.
Dalman C, Allebeck P, Gunnell D, Harrison G, Kristensson K, Lewis G et al. Infections in the CNS During Childhood and the Risk of Subsequent Psychotic Illness: A Cohort Study of More Than One Million Swedish Subjects. Am J Psychiatry 2008;165:59-65.
Das S, Saravanan B, Karunakaran KP, Manoranjitham S, Ezhilarasu P, Jacob KS. Effect of a structured educational intervention on explanatory models of relatives of patients with schizophrenia. Randomised controlled trial. Br J Psychiatry 2006;188:286-287.
Dassori AM, Miller AL, Saldaña D. Squizophrenia among Hispanics: epidemiology, phenomenology, course and outcome. Squizophr Bull 1995;21:303-312.
Daughton J, Padala P, Gabel T. Careful Monitoring for Agranulocytosis During Carbama-zepine Treatment. Prim Care Companion J Clin Psychiatry 2006;8:310-311.
David AS. Insight and psychosis. Br J Psychiatry 1990;156:798-808.
Davies LM, Drummond MF. Economics and schizophrenia: the real cost. Br J Psychiatry 1994;165:18-21.
Davis JM, Chen N, Glick ID. A meta-analysis of the efficacy of second-generation antipsychotics. Arch Gen Psychiatry 2003;60:553-564.
Davis JM, Chen N. Dose response and dose equivalence of antipsychotics. J Clin Psychopharmacol 2004;24:192-208.
Davis JM, Chen N. Old versus new: weighing the evidence between the first- and second-generation antipsychotics. Eur Psychiatry 2005;20:7-14.
Davis JM, Leucht S, Glick ID. CATIE findings revisited. Psychiatr Serv 2009;60:125-126.
Davis JM, Schaffer CB, Killian GA, Kinard C, Chan C. Important issues in the drug treatment of schizophrenia. Schizophr Bull 1980;6:70-87.
Davis JM. The choice of drugs for schizophrenia. N Engl J Med 2006;354:518-520.
Davis JM. The use of depot medications in the treatment of schizophrenia. Am J Psychiatry 2010;167:125-126.
Davis KL, Kahn RS, Ko G, Davidson M. Dopamine in schizophrenia: a review and reconceptualization. Am J Psychiatry 1991;148:1474-1486.
Dawkins K, Lieberman JA, Lebowitz BD, Hsiao JK. Antipsychotics: Past and Future. Schizophrenia Bull 1999;25:395-405.
Dayalu P, Chou KL. Antipsychotic-induced extrapyramidal symptoms and their management. Expert Opin Pharmacother 2008;9:1451-1462.
De Gregorio C, Morabito G, Cerrito M, Dattilo G, Oreto G. Citalopram-induced long QT syndrome and torsade de pointes: Role for committant therapies and illnesses. Int J Cardiol 2011;148:226-228.
De Haan L, Lavalaye J, van Bruggen M, van Nimwegen L, Booij J, van Amelsvoort T. Subjective experience and dopamine D2 receptor occupancy in patients treated with antipsychotics: clinical implications. Can J Psychiatry 2004;49:290-296.
De Hert M, Wampers M, van WR, Peuskens J. Anticholinergic use in hospitalised schizophrenic patients in hospitalised schizophrenic patients in Belgium. Psychiatry Res 2007;152:165-172.
De la Fuente JR. Los fundamentos biológicos de la psiquiatría en perspectiva. Rev Residente de Psiquiatría 1992;3:7.
De la Higuera RJ. Psicoeducación familiar en la esquizofrenia: de los datos empíricos a la realidad clínica. Apunt Psicol;2005:275-292.
De Leo D, Spahonis K. Do psychosocial and pharmacological interventions reduce suicide in schizophrenia and schizophrenia spectrum disorders? Arch Suicide Res 2003;7:353-374.
De Leon J, Santoro V, D'Arrigo C, Spina E. Interactions between antiepileptics and second-generation antipsychotics. Expert Opin Drug Metab Toxicol. 2012;8:311-334.
Delawalla Z, Barch DM, Fisher Eastep JL, Thomason ES, Hanewinkel MJ, Thompson PA et al. Factors mediating cognitive deficits and psychopathology among siblings of individuals with schizophrenia. Schizophr Bull 2006;32:525-537.
Delisi LE. First-episode schizophrenia and depression. Am J Psychiatry 1995;152:476-477.
Demler TL, Trigoboff E. Are clozapine blood dyscrasias associated with concomitant medications? Innov Clin Neurosci 2011;8:35-41.
Deniker P. Discovery of the clinical use of neurleptics. In: Parnham MJ, Bruinvels J, editors. Discoveries in pharmacology, Vol. I. Psycho- and neuropharmacology. Amsterdam: Elsevier 1983:163-180.
Department of Health. Care services improvement partnership. Reviewing the care program approach 2006. A consultation document. London (United Kingdom) 2006, consultado en http://www.bipsolutions.com/docstore/pdf/14895.pdf el 26 de junio del 2012.
Derinoz O, Caglar AA. Drug-induced movement disorders in children at paediatric emergency department: 'dystonia'. Emerg Med J 2012.
Detke HC, McDonnell DP, Brunner E, Zhao F, Sorsaburu S, Stefaniak VJ et al. Post-injection delirium/sedation syndrome in patients with schizophrenia treated with olan-zapine long-acting injection, I: analysis of cases. BMC Psychiatry 2010;10:43.
Deveci A, Esen-Danaci A, Yurtseven F. The effects of psychosocial skills training on symptomatology, insight, quality of life, and suicide probability in schizophrenia. Turk Psikyatri Derg 2008;19:1-8.
Devereux G. Les facteurs culturels en therapeutique psychanalityque. En Essais d'Etnopsychiatrie. París: Ed. Gallimard; 1970.
Diaz M, Ortega S, Rodríguez V. El tratamiento integral del paciente esquizofrénico. Salud Mental 2005;06:35-70.
Diaz MR, Ortega SH, Rascón ML. La Rehabilitación Integral del paciente esquizofrénico en México. El Modelo del Instituto Nacional de Psiquiatría Ramón de la Fuente. Grupo III. Salud Mental 2005;28:9-19.
Díaz R, López JL, Reyes RC. Necesidad de dar atención a los familiares responsables del cuidado de pacientes esquizofrénicos. Suplemento de la Revista Salud Mental 1997;2:55-64.
Díaz R, Rascón ML, Ortega H, Murow E, Valencia M, Ramírez I. Evaluación de un programa de rehabilitación del paciente esquizofrénico. Rev. Fac Med UNAM 1998;41:51-59.
Díaz R, Ramos L. La violencia doméstica en familiares de pacientes con esquizofrenia. Gaceta Médica de México 2003;139:371-376.
Díaz R, Rascon ML, Valencia M, Unikel C, Murow E, Rascon D, Leaños C, Ortega H. El programa de rehabilitación integral del paciente esquizofrénico del Instituto Mexicano de Psiquiatría. Seguimiento a dos años. Salud Mental 1999;22:104-113.
Díaz, R, Murow E, Ortega H, Valencia M, Rascón ML, Ramírez I. El manejo integral del paciente esquizofrénico. Un modelo del Instituto Mexicano de Psiquiatría. Salud Mental 1996;19:1-7.
Dickey B, Azeni H, Weiss R, Sederer L. Schizophrenia, substance use disorders and medical co-morbidity. J Ment Health Policy Econ 2000;3:27-33.
Dilk MN, Bond GR. Meta-analytic evaluation of skills training research for individuals with severe mental illness. J Consult Clin Psychol 1996;64:1337-1346.
Dixon L, Dickerson F, Bellack A. The 2009 Schizophrenia PORT Psychosocial Treatment Recommendations and Summary Statements. Schizophr Bull 2010;36:48-70.
Dixon L, Adams C, Lucksted A. Update of family psychoeducation for schizophrenia. Schizophr Bull 2000;26:5-20.
Dixon R, Job S, Oliver R, Tompson D, Wright JG, Maltby K et al. Lamotrigine does not prolong QTc in a thorough QT/QTc study in healthy subjects. Br J Clin Pharmacol 2008;66:396-404.
Dolder CR, Lacro JP, Dunn LB, Jeste DV. Antipsychotic medication adherence: is there a difference between typical and atypical agents? Am J Psychiatry 2002;159:103-108.
Dorsey ST, Biblo LA. Prolonged QT interval and torsades de pointes caused by the combination of fluconazole and amitriptyline. Am J Emerg Med 2000;18:227-229.
Drake R, Bond G, Essock S. Implementing Evidence Based Practices for People With Schizophrenia. Schizophr Bull 2009;35:704-713.
Drake RE, Osher FC, Wallach MA. Alcohol use and abuse in schizophrenia. A prospective community study. J Nerv Ment Dis 1989;177:408-414.
Drake RE, Xie H, McHugo GJ, Green AL. The effects of clozapine on alcohol and drug use disorders among schizophenic patients. Schizophr Bull 2000;26:441-449.
Drake RE. Suicide attempts and completted suicides among schizophrenia patients. In: Tatarelli R. PompiliM, Girardi P (eds). Suicide in Schizophrenia. New York: Nova Science Publishers; 77-81.
Drummond MF, Sculpher MJ, Torrance GW, O'Brien B, Stoddart GL. Economic evaluation using decision analytic modelling. En Methods for the economic evaluation of health care programmes. New York: Oxford University Press;2005:278-322.
DSM-IV-TR: Diagnostic and statistical manual of mental disorders: 4th ed., text revision. ed. Washington, DC: American Psychiatric Association;2000.
DSM-IV-TR. Manual diagnóstico y estadístico de los trastornos mentales. Barcelona, Masson, 1998.
Dulcan MK, Martini DR, Lake M. Child and Adolescent Psychiatry. Third edition. United States of America 2003.
Dutt A, Grover S, Chakrabarti S, Avasthi A, Kumar S. Phenomenology and treatment of Catatonia: A descriptive study from north India. Indian J Psychiatry 2011;53:36-40.
Edwards J, Maude D, McGorry PD, Harrigan SM, Cocks JT. Prolonged recovery in firstepisode psychosis. Br J Psychiatry Suppl 1998;172:107-116.
Edwards NC, Pesa J, Meletiche DM, Engelhart L, Thompson AK, Sherr J et al. One-year clinical and economic consequences of oral atypical antipsychotics in the treatment of schizophrenia. Curr Med Res Opin 2008;24:3341-3355.
Eisen JL, Beer DA, Pato MT, Venditto TA, Rasmussen SA. Obsessive-compulsive disorder in patients with schizophrenia or schizoaffective disorder. Am J Psychiatry 1997;154:271-273.
Ekelund J, Hovatta I, Parker A, Paunio T, Varilo T, Martin R et al. Chromosome 1 loci in Finnish schizophrenia families. Hum Mol Genet 2001;10:1611-1617.
Emsley R, Oosthuizen P, Koen L, Niehaus DJ, Medori R, Rabinowitz J. Remission in patients with first-episode schizophrenia receiving assured antipsychotic medication: a study with risperidone long-acting injection. Int Clin Psychopharmacol 2008;23:325-331.
Endler NS. The Origins of Electroconvulsive Therapy (ECT). Convuls Ther 1988;4:5-23.
Englisch S, Esser A, Zink M. Bupropion for depression in schizophrenia: a case report. Pharmacopsychiatry 2010;43:38-39.
Enright JB, Jaeckle WR. Psychiatric symptoms and diagnosis in two sub-cultures. International J Soc Psychiatry 1963;9:12-17.
Escobar A, Weidenheim K. Esquizofrenia. Circuitos nerviosos anormales. Rev Mex Neuroci 2004;5:50-55.
Fabiani G, Pastro PC, Froehner C Parkinsonism and other movement disorders in outpatients in chronic use of cinnarizine and flunarizine. Arq Neuropsiquiatr 2004;62:784-788.
Fabisch K, Fabisch H, Langs G, Huber HP, Zapotoczky HG. Incidence of obsessive-compulsive phenomena in the course of acute schizophrenia and schizoaffective disorder. Eur Psychiatry 2001;16:336-341.
Falloon I, Montero I, Sungur M, Mastroeni A. Implementation of evidence-based treatment for schizophrenic disorders: two-year outcome of an international field trial of optimal treatment. World Psychiatry 2004;3:104-109.
Falloon IR, Boyd JL, McGill CW, Williamson M, Razani J, Moss HB et al. Family management in the prevention of morbidity of schizophrenia: Clinical outcome of a two-year longitudinal study. Arch Gen Psychiatry 1985;42:887-896.
Falloon IR, Boyd JL, Mcgill C. Family care of schizophrenia. Nueva York: Guilfford Press; 1984.
Falloon IR, Laporta M, Fadden G, Graham-Hole V. Managing stress in families: Cognitive and behavioural strategies for en hancing coping skills. London: Routledge; 1993.
Falloon IR, Liberman RP. Behavioral family interventions in the management of chronic schizophrenia. In: McFarlane WR (ed). Family therapy in schizophrenia. New York: Guilford Press; 1983;117-137.
Fan Z, Wu Y, Shen J, Ji T, Zhan R. Schizophrenia and the risk of cardiovascular diseases: A meta-analysis of thirteen cohort studies. J Psychiatr Res. 2013 Aug 14. Doi:pii:S0022-3956(13)00223-9. 10.1016/j.jpsychires.2013.07.011. [Epubahead of print].
Farah A. Atypicality of Atypical Antipsychotics Prim Care Companion. J Clin Psychiatry 2005;7:268-274.
Farde L, Wiesel FA, Halldin C, Sedvall G. Central D2 dopamine receptor occupancy in schizophrenic patients treated with antipsychotic drugs. Arch Gen Psychiatry 1988;45:71-76.
Farde L, Stone-Elander S, Halldin C, Nordström AL, Hall H, Sedvall G. D2 dopamine receptors in neuroleptic-naive schizophrenic patients: a positron emission tomography stud with [11C] reclopride. Arch Gen Psychiatry 1990;47:213-219.
Farde L, Nordstrom AL, Wiesel FA, Pauli S, Halldin C, Sedvall G. Positron emission to-mographic analysis of central D1 and D2 dopamine receptor occupancy in patients treated with classical neuroleptics and clozapine: Relation to extrapyramidal side effects. Arch Gen Psychiatry 1992;49:538-544. FDA. Information for Healthcare Professionals: Haloperidol.
FDA ALERT 9/2007. http://www.fda.gov/Drugs/DrugSafety/PostmarketDrugSafetyInformationforPatientsandProviders/DrugSafetyInformationforHeathcareProfessionals/ucm085203.htm.
Fenton WS. Depression, suicide, and suicide prevention in schizophrenia. Suicide Life Threatment Behaviour 2000;30:34-49.
Fenton WS, McGlashan TH. Prognostic scale for chronic schizophrenia. Schizophr Bull 1987;13:277-286.
Fenton WS, McGlashan TH. The prognostic significance of obsessive-compulsive symptoms in schizophrenia. Am J Psychiatry 1986;143:437-441.
Findling RL, Kline K, Mckenna K. Efficacy and safety of quetiapine in adolescents with schizophrenia: a 6-week, double-bind, randomized, placebo-controlled trial. Presented at: 55th Annual Meeting of the American Academy of Child and Adolescent Psychiatry, Chicago, IL: October 28 to November 2, 2008.
Findling RL, Robb A, Nyilas M. A multiple-center, randomized, double-bind, placebo-controlled study of oral aripiprazole for treatment of adolescents with schizophrenia. Am J Psychiatry 2008;165:1432-1441.
Fink M, Sackeim HA. Convulsive Therapy in Schizophrenia? Schizophr Bull 1996;22:27-39.
Fink M. Catatonia: syndrome or schizophrenia subtype? Recognition and treatment. J Neural Transm 2001;108:637-644.
Fink M. Indications for the use of ECT. Psychopharmacol Bull 1994;30:269-280.
Fink M. Meduna and the Origins of Convulsive Therapy. Am J Psychiatry 1984;141:1034-1041.
Fitton A, Heel R. Clozapine: A review of its pharmacological properties and therapeutic use in schizophrenia. Drugs 1990;40:722-747.
Fleischhacker W. Clozapine: A comparison with other novel antipsychotics. J Clin Psychiatry 1999;60:30-34.
Fleischhacker W. Negative symptoms in patients with schizophrenia with special reference to the primary versus secondary distinction. Encephale 2000;26:12-14.
Fleischhacker WW, Hummer M, Kurz M, Kurzuthaler I, Lieberman J, Pollack S et al. Clozapine dose in the US and Europe: Implications for therapeutic and adverse effects. J Clin Psychiatry 1994;55:78-81.
Fleischhacker WW, Keet IP, Kahn RS. EUFEST Steering Committee. The European First Episode Schizophrenia Trial (EUFEST): rationale and design of the trial. Schizophr Res 2005;78:147-156.
Fleischhacker WW, Oehl MA, Hummer M. Factors influencing compliance in schizophrenia patients. J Clin Psychiatry 2003;16:10-13.
Fleischhacker WW, Roth SD, Kane JM. The pharmacologic treatment of neuroleptic-induced akathisia. J Clin psychopharmacol 1990;10:12.
Fonseca PE, Campillo AA, Muñiz J, Lemos GS, García CE. Adaptación española del Thinking and Perceptual Style Questionnaire. Libro de Actas del X Congreso de Metodología de las Ciencias Sociales y del Comportamiento. Barcelona 2007.
Fonseca PE, Lemos GS, Paino M, Sierra BS, Villazón GU, García PM et al. Dimensionality of hallucinatory predisposition: Confirmatory factor analysis of the Launay-Slade Hallucination Scale-revised in college students. Anales de Psicología 2010;26:41-48.
Frampton JE. Olanzapine long-acting injection: a review of its use in the treatment of schizophrenia. Drugs 2010;70:2289-2313.
Freedman R, Carpenter WT Jr, Davis JM, Goldman HH, Tamminga CA, Thomas M. The costs of drugs for schizophrenia. Am J Psychiatry 2006;163:2029-2031.
Freedman R. The choice of antipsychotic drugs for schizophrenia. N Engl J Med 2005;353: 1286-1288.
Fresán A, Apiquian R, Loyzaga C, García-Anaya M, Ulloa RE, Nicolini H. Functional recovery in first-episode psychosis. Psiquiatría y Salud Integral 2002;2:40-44.
Freudenreich O. The evaluation and management of patients with first-episode schizophrenia: a selective, clinical review of diagnosis, treatment, and prognosis. Harv Rev Psychiatry 2007;15:189-211.
Fusar-Poli P, Bonoldi I, Yung AR, Borgwardt S, Kempton MJ, Valmaggia L et al. Predicting psychosis: meta-analysis of transition outcomes in individuals at high clinical risk. Arch Gen Psychiatry. 2012;69(3):220-229. Epub 2012/03/07.
Gaebel W, Janner M, Frommann N, Pietzcker A, Kopcke W, Linden M et al. First vs. multiple episode schizophrenia: two-year outcome of intermittent and maintenance medication strategies. Schizophr Res 2002;53:145-159.
Gajwani P, Pozuelo L, Tesar GE. QT interval prolongation associated with quetiapine (Se-roquel) overdose. Psychosomatics 2000;41:63-65.
García M. Capítulo 9. Rehabilitación e inserción laboral de personas con esquizofrenia. En: Valencia M (Compilador). Alternativas terapéuticas para la esquizofrenia. Editorial Herder (En Prensa); 2012.
García P, Bascarán F, Sáiz M, Bousoño GM, Bobes GJ. Instrumentos de evaluación para los trastornos esquizofrénicos. En: Banco de instrumentos básicos para la práctica de la psiquiatría clínica, Tomo 1, España, CYESAN, 2011:57-87.
Gardner D, Murphy A, O'Donnell H, Centorrino F, Baldessarini R. International Consensus Study of Antipsychotic Dosing. Am J Psychiatry 2010;167:686-693.
Garety PA, Hemsley DR. Characteristics of delusional experience. Eur Arch Psychiatry Neurol Sci 1987;236:294-298.
Gasquet I, Flandre P, Heurtebize N, Deal C, Perrin E, Chartier F et al. Pattern and evolution of the prescription of olanzapine during one year: Results of the cohort study ECOL. L'Encephale 2009;35:25-31.
Gearing RE, Mian I, Sholonsky A, Barber J, Nicholas D, Lewis R et al. Developing a risk-model of time to first-relapse for children and adolescents with a psychotic disorder. J N Mental Dis 2009;197:6-14.
Gearon JS, Bellak AS. Sex differences in illness presentation, course and level of functioning in substance-abusing schizophrenia patients. Schizophr Res 2000;43:65-70.
Geddes JR, Kendell RE. Schizophrenic subjects with no history of admission to hospital. Psychol Med 1995;25:859-868.
Geitona M, Kousoulakou H, Ollandezos M, Athanasakis K, Papanicolaou S, Kyriopoulos I. Costs and effects of paliperidone extended release compared with alternative oral antipsychotic agents in patients with schizophrenia in Greece: A cost effectiveness study. Ann Gen Psychiatry 2008;7:16.
Gilbert PL, Harris MJ, Mcadams LA, Jeste DV. Neuroleptic withdrawal in schizophrenic patients: a review of the literature. Arch Gen Psychiatry 1995;52:173-187.
Girgis RR, Phillips MR, Li X, Li K, Jiang H, Wu C et al. Clozapine vs. chlorpromazine in treatment-naive, first-episode schizophrenia: 9-year outcomes of a randomised clinical trial. Br J Psychiatry 2011;199:281-288.
Girón M, Gómez-Beneyto M. Relationship between family attitudes and social function in schizophrenia: a nine-month follow-up prospective study in spain. J Nerv Ment Dis 2004;192:414-420.
Glassman AH, Bigger JT Jr. Antipsychotic drugs: prolonged QTc interval, torsade de pointes, and sudden death. Am J Psychiatry 2001;158:1774-1782.
Glazer WM, Moore DC, Schooler NR, Brenner LM, Morgenstern H. Tardive dyskinesia. A discontinuation study. Arch Gen Psychiatry 1984;41:623-627.
Glazer WM, Morgenstern H, Schooler N, Berkman CS, Moore DC. Predictors of improvement in tardive dyskinesia following discontinuation of neuroleptic medication. Br J Psychiatry 1990;157:585-592.
Gleeson J, Larsen TK, McGorry P. Psychological treatment in pre- and early psychosis. J Am Acad Psychoanal Dyn Psychiatry 2003;31:229-245.
Gleeson JF, Alvarez-Jimenez M, Cotton SM, Parker AG, Hetrick S. A systematic review of relapse measurement in randomized controlled trials of relapse prevention in firstepisode psychosis. Schizophr Res 2010;119:79-88.
Glick ID, Siris SG, Davis JM. Treating schizophrenia with comorbid depressive or demoralization symptoms. Journal Clin Psychiatry 2008;69:501.
Glynn S, Marder S, Liberman P, Blair K, Wirshing W, Wirshing C et al. Supplementing clinic-based skills training with manual-based community support sessions: effects on social adjustment of patients with schizophrenia. Am J Psychiatry 2002;159:829-837.
Glynn SM, Cohen AN, Niv N. New challenges in family interventions for schizophrenia. Expert Rev Neurother 2007;7:33-43.
Glynn SM, Marder SR, Liberman RP, Blair K, Wirshing DA, Mintz J. Supplementing clinic based skills training for schizophrenia with manualized community support: effects on social adjustment. Am J Psychiatry 2002;159:829-837.
Godoy JF, Muela JA, Godoy D. Capítulo 2. La prevención de recaídas en la esquizofrenia. En: Valencia M (Compilador). Alternativas terapéuticas para la esquizofrenia. Editorial Herder (En Prensa); 2012.
Goldberg SC. Negative and deficit symptoms in schizophrenia do respond to neuroleptics. Schizophr Bull 1985;11:453-456.
Goldman-Rakic PS. Working memory dysfunction in schizophrenia. J Neuropsychiatry Clin Neurosci 1994;6:348-357.
Goldstein M. Family Intervention Programs. En: BellacK A. Schizophrenia, Treatment, Management and rehabilitation. Orlando, FI: Grunes & Stratton, Inc. Cap. 10; 1984;281-305.
Goldstein MJ. Psychoeducation and relapse prevention. Int Clin Psychopharmacol 1995;9:59-70.
González E, Castro N, Ramírez B, Custodio V, Rojas T, Castro R et al. Plasma levels of clozapine and norclozapine in Mexican schizophrenia patients. Arzneimittelforschung 2011;61:335-339.
Goodnick PJ, Jerry J, Parra F. Psychotropic drugs and the ECG: focus on the QTc interval. Expert Opin Pharmacother 2002;3:479-498.
Goodwin RD, Amador XF, Malaspina D, Yale SA, Goetz RR, Gorman JM. Anxiety and substance use comorbidity among inpatients with schizophrenia. Schizophr Res 2003;61:89-95.
Gopal S, Hough DW, Xu H, Lull JM, Gassmann-Mayer C, Remmerie BM et al. Efficacy and safety of paliperidone palmitate in adult patients with acutely symptomatic schizophrenia: a randomized, double-blind, placebo-controlled, dose-response study. Int Clin Psychopharmacol 2010;25:247-256.
Gopal S, Vijapurkar U, Lim P, Morozova M, Eerdekens M, Hough D. A 52-week open-label study of the safety and tolerability of paliperidone palmitate in patients with schizophrenia. J Psychopharmacol 2011;25:685-697.
Goswani U, Kumar U, Singh B. Efficacy of Electroconvulsive Therapy in Treatment Resistant Schizophrenia: A double-blind study. Indian J Psychiatry 2003;45:26-29.
Gothelf D, Apter A, Reidman J, Brand-Gothhelf A, Bloch Y, Gal G. Olanzapine, risperi-done and haloperidol in the treatment of adolescents patients with schizophrenia. J Neural Transm 2003;110:545-560.
Gottesman II, Gould TD. The endophenotype concept in psychiatry: etymology and strategic intentions. Am J Psychiatry 2003;160:636-645.
Grant PM, Hud GA, Perivoliotis D, Stolar NM, Beck A. Randomized Trial to Evaluate the Efficacy of Cognitive Therapy for Low-Functioning Patients Whit Schizophrenia. Arch Gen Psychiatry 2012;69:121-127.
Grant S, Fitton A. Risperidone. A review of its pharmacology and therapeutic potential in the treatment of schizophrenia. Drugs. 1994;48:253-273.
Green MF, Kern RS, Heaton RK. Longitudinal studies of cognition and functional outcome in schizophrenia: implications for MATRICS. Schizophr Res 2004;72:41-51.
Green W, Padron-Gayol M, Hardesty A, Bassiri M. Schizophrenia with childhood onset: a phenomenological study of 38 cases. J Am Acad Child Adolesc Psychiatry 1992;31:968-976.
Greenblatt SH. The development of Hughlings Jackson's approach to diseases of the nervous system 1863-1866: unilateral seizures, hemiplegia and aphasia. Bull Hist Med 1977;51:412-430.
Greenhalgh J, Knight C, Hind D, Beverley C, Walters S. Clinical and cost-effectiveness of electroconvulsive therapy for depressive illness, schizophrenia, catatonia and mania: systematic reviews and economic modeling studies. Health Technol Assessm 2005;9(9):1-156.
Groleger U. Off-label use of antipsychotics: rethinking "off-label". Psychiatr Danub 2007;19:350-353.
Gross-Isseroff R, Hermesh H, Zohar J, Weizman A. Neuroimaging communality between schizophrenia and obsessive compulsive disorder: a putative basis for schizo-obsessive disorder? W J Biol Psychiatry 2003;4:129-134.
Gründer G, Hippius H, Carlsson A. The 'atypical' of antipsychotics: a concept re-examined and re-defined. Nat Rev Drug Discov 2009;8:197-202.
Guan Y, Camm J. Drug induced QT prolongation and torsades de pointes. Heart 2003;89:1363-1372.
Guía de Práctica clínica sobre la esquizofrenia y el trastorno psicótico incipiente http://www.guiasalud.es/egpc/esquizofrenia/completa/apartado06/tipos4.html. Consultado el 2 de julio 2012.
Guitton B, Perez Ll, Bagheri H, Brefel C, Rascol O, Montastruc JL. Drug-induced par-kinsonism: a review of 17 years' experience in a regional pharmacovigilance center in France. Mov Disord 2011;26:2226-2231.
Gumley A. Park Relapse Prevention in Early Psychosis in Promoting Recovery in Early Psychosis: A practice Manual. Wiley-Blacwell, Chichester; 2009.
Gunasekara NS, Spencer CM, Keating GM. Ziprasidone: a review of its use in schizophrenia and schizoaffective disorder. Drugs 2002;62:1217-1251.
Gupta A, Lawrence AT, Krishnan K, Kavinsky CJ, Trohmann RG. Current concepts in the mechanisms and management of drug-induced QT prolongation and torsade de pointes. Am Heart J. 2007;153:891-899.
Gupta S, Hendricks S, Kenkel AM, Bhatia SC, Haffke EA. Relapse in schizophrenia: is there a relationship to substance abuse? Schizophr Res 1996;20:153-156.
Gur RE, Calkins ME, Gur RC, Horan WP, Nuechterlein KH, Seidman LJ et al. The Consortium on the Genetics of Schizophrenia: Neurocognitive Endophenotypes. Schizophr Bull 2007;33:49-68.
Gutiérrez L, Valencia CM, Leaños GR, Soledad V. Percepción de los familiares del intento y la ideación suicida en sus parientes con esquizofrenia. Rev. Salud Mental 2004;27(5).
Gutierrez RP, Chisholm D, Haro JM, Salvador-Carulla L, Ayuso-Mateos JL. Cost-effectiveness of different clinical interventions for reducing the burden of schizophrenia in Spain. Acta Psychiatr Scand Suppl 2006;432:29-38.
Haas M, Unis AS, Armenteros J, Copenhaver MD, Quiroz JA, Kushner SF. A 6-week, randomized, double-bind, placebo-controlled study of the efficacy and safety of risperidone in adolescents with schizophrenia. J ChildAdolesc Psychopharmacol 2009;19:611-621.
Haddad PM, Anderson IM. Antipsychotic-related QTc prolongation, torsade de pointes and sudden death. Drugs 2002;62:1649-1671.
Haddad PM, Taylor M, Niaz OS. First-generation antipsychotic long-acting injections vs. oral antipsychotics in schizophrenia: systematic review of randomised controlled trials and observational studies. Br J Psychiatry 2009;52(Suppl):S20-S28.
Haddock G, Lewis S. New Psychological Treatments for Schizophrenia. Adv Psychiatric Treat 1996;2:110-116.
Hadi E, Greenberg Y, Sirota P. Obsessive-compulsive symptoms in schizophrenia: prevalence, clinical features and treatment. A literature review. W J Biol Psychiatry 2012;13:2-13.
Hafner H, Heiden W. Epidemiology of squizophrenia. Can J Psychiatry 1997;42:139-151.
Hâfner H, Maurer K, Lôffler W, Fâtkenheuer B, an der Heiden W, Riecher-Rôssler A et al. The epidemiology of early schizophrenia. Influence of age and gender on onset and early course. Br J Psychiatry 1994;23(Suppl):29-38.
Häfner H, Maurer K. Detección temprana de la esquizofrenia: datos actuales y perspectivas futuras. World Psychiatry (ed Esp) 2006;4:130-138.
Hafner H, Nowotny B. Epidemiology of early onset shizophrenia. Eur Arch Psychiatry Clin Neurosci 1995;245:80-92.
Hall J, Harris J, Sprengelmeyer R, Sprengelmeyer A, Young A, Santos I et al. Social cognition and FACE processing in schizophrenia. Br J Psychiatry 2004;185:169-170.
Hall W, Degenhardt L. Cannabis and psychosis. Aust NZ J Psychiatry 2000;34:26-34.
Haroun N, Dunn L, Haroun A, Cadenhead KS. Risk and protection in prodromal schizophrenia: ethical implications for clinical practice and future research. Schizophr Bull 2006;32:166-178.
Harrigan EP, Miceli JJ, Anziano R, Watsky E, Reeves KR, Cutler NR et al. A randomized evaluation of the effects of six antipsychotic agents on QTc, in the absence and presence of metabolic inhibition. J Clin Psychopharmacology 2004;24:62-69.
Harrigan SM, McGorry PD, Krstev H. Does treatment delay in first-episode psychosis really matter? Psychol Med 2003;33:97-110.
Harrison G, Hopper K, Craig T, Laska E, Siegel C, Wanderling J et al. Recovery from psychotic illness: a 15- and 25-year international follow-up study. Br J Psychiatry 2001;178:506-517.
Harvard Medical School. Harvard Mental Health Letter. The psychosocial treatment of Harvey PD, Geyer MA, Robbins TW, Krystal JH. Cognition in schizophrenia: from basic science to clinical treatment. Psychopharmacol 2003;169:213-214.
Harvey PD. Introduction to special issue 4th biennial mt. Sinai conference on cognition in schizophrenia. Schizophr Res 2000;43:1-2.
Hasan A, Falkai P, Wobrock T, Lieberman J, Glenthoj B, Gattaz WF et al. World Federation of Societies of Biological Psychiatry (WFSBP) Guidelines for Biological Treatment of Schizophrenia, Part 2: Update 2013 on the long-term treatment of schizophrenia and management of antipsychotic-induced side effects. W J Biol Psychiatr 2013;14:2-44.
Haug HJ, Wirz JA, Rossler W. Actigraphy to measure day structure as a therapeutic variable in the treatment of schizophrenic patients. Acta Psychiatr Scand 2000;102:91-95.
Haukka JK, Suvisaari J, Lönnqvist J. Family structure and risk factors for schizophrenia: case-sibling study. BMC Psychiatry 2004;4:41.
Hayes RL, McGrath JJ. Cognitive rehabilitation for people with schizophrenia and related conditions. Cochrane Database Syst Rev 2000;CD000968.
Haynes RB, Montague P, Oliver T, McKibbon KA, Brouwers MC, Kanani R. Interventions for helping patients to follow prescriptions for medications. Cochrane Database Syst Rev 2000;(2):CD000011.
Hegarty JD, Baldessarini RJ, Tohen M, Waternaux C, Oepen G. One hundred years of schizophrenia: a metaanalysis of the outcome literature. Am J Psychiatry 1994;151:1409-1416.
Heinrichs RW. The primacy of cognition in schizophrenia. Am Psychol 2005;60:229-242.
Heinssen R, Liberman RP, Kopelowicz A. Psychosocial Skills Training for Schizophrenia: Lessons from the Laboratory. Schizophr Bull 2000;26:26-46.
Heinz A, Knable MB, Weinberger DR. Dopamine D2 receptor maging and neuroleptic drug response. J Clin Psychiatry 1998;57:84-88.
Heinze G, Cortés JF. Treatment preference and attiutde toward pharmacotherapy and psychotherapy in Latin America. ULAD task force. Salud Mental 2005;28:10-17.
Heres S, Davis J, Maino K, Jetzinger E, Kissling W, Leucht S. Why olanzapine beats risperi-done, risperidone beats quetiapine, and quetiapine beats olanzapine: an exploratory analysis of head-to-head comparison studies of second-generation antipsychotics. Am J Psychiatry 2006;163:185-194.
Herrera MA, García AJ, Gamiochipi CJ, de la Llera VM. Rehabilitación temprana en pacientes hospitalizados en unidades psiquiátricas. Rev Psiquis México1998;7:128-141.
Herrerra-Estrella MA, Viveros-Erosa MA, Castanedo de Alba L, Castillo-Ruíz J, Pérez-Hernández M, López-Renteria A et al. La eficacia del cambio de terapia a risperidona en microesferas de acción prolongada. Psiquis 2005;14:51-58.
Herz M. Prodromal symptoms and prevention of relapse in schizophrenia. J Clin Psychiatry 1985;46:22-25.
Herz MI, Lamberti JS, Mintz J, Scott R, O'Dell SP, McCartan L, Nix G. A program for relapse prevention in schizophrenia: A controlled study. Arch Gen Psychiatry 2000;57:277-283.
Herz MI. Early interventions in schizophrenia. En: Herz MI, Keith SJ, Docherty JP (eds). Psychosocial treatment of schizophrenia Vol 4. Amsterdam: Elsevier Science Publishers; 1990;25-44.
Hietala J, Syvalahti E, Vuorio K, Nagren K, Lehikoinen P, Ruotsalainen U et al. Striatal D2 dopamine receptor characteristics in neuroleptic-naive schizophrenic patients studied with positron emission tomography. Arch Gen Psychiatry 1994;51:116-123.
Hill M, Crumlish N, Whitty P, Clarke M, Browne S, Kamali M et al. Nonadherence to medication four years after a first episode of psychosis and associated risk factors. Psychiatr Serv 2010;61:189-192.
Hill M, Freudenreich O. Clozapine: key discussion points for prescribers. Clin Schizophr Relat Psychoses. 2013;6:177-185.
Hoch EM. Comments of special issue on schizophrenia. Transcult Res Ment Health Probl 1961;11:6571.
Hoch JS, Dewa CS. Lessons from trial-based cost-effectiveness analyses of mental health interventions. Why uncertainty about the outcome, estimate and willingness to pay matters. Pharmacoeconomics. 2007;25:807-816.
Hogan TP, Awad AG, Eastwood MR. A self-report scale predictive of drug compliance in schizophrenics: Reliability and discriminative validity. Psychol Med 1983;13:177-183.
Hogarty G, Kornblith S, Greenwald D, Dibarry A, Cooley S, Ulrich R et al. Three-year trials of personal therapy among schizophrenic patients living with or independent of family. I: Description of a study and effects on relapse rates. Am J Psychiatry 1997;154:1504-1513.
Hogarty G, Ulrich R. The Limitations of antipsychotic medication on schizophrenia relapse and adjustment and the contributions of psychosocial treatment. J Psychiatr Res 1998;32:243-250.
Hoge SK, Appelbaum PS, Lawlor T, Beck JC, Litman R, Greer A et al. A prospective, multi-centre study of patients refusal of antipsychotic medication. Arch G en Psychiatry 1990;47:949-956.
Hollweg MG. Técnicas del manejo psiquiátrico en una región policultural (Bolivia). Rev Neuro-Psiq 2001;64:165-171.
Honea R, Crow TJ, Passingham D, Mackay CE. Regional deficits in brain volume in schizophrenia: A meta-analysis of voxel-based morphometry studies. Am J Psychiatry 2005;162:2233-2245.
Hooley JM. The nature and origins of expressed emotion. En: Hahlweg K, Goldstein MJ (eds). Understanding major mental disorder: the contribution of family interaction research. New York: Family Process; 1987:176-194.
Hossein F, Folsom TD. The Neurodevelopmental Hypothesis of Schizophrenia, Revisited. Schizophr Bull 2009;35:528-548.
Hough D, Gopal S, Vijapurkar U, Lim P, Morozova M, Eerdekens M. Paliperidone palmitate maintenance treatment in delaying the time-to-relapse in patients with schizophrenia: a randomized, double-blind, placebo-controlled study. Schizophr Res 2010;116:107-117.
Howard R, Rabins PV, Seeman MV, Jeste DV. The International Late-Onset Schizophrenia Group. Late-onset schizophrenia and very-late-onset schizophrenia like psychosis: an international Consensus. Am J Psychiatry 2000;157:172-178.
Howland RH. Drug therapies for tardive dyskinesia: part 2. J Psychosoc Nurs Ment Health Serv 2011;49:17-20.
Huang CC. Risperdal reduces alcohol use in dual disabled schizophrenia patients. Eur Neuropsychopharmacol 1996;6:43.
Huxley N, Rendall M, Sederer LL. Psychosocial Treatments in Schizophrenia. A Review of the Past 20 years. J Nerv Ment Dis 2000;188:187-201.
Hwang MY, Kim SW, Yum SY, Opler LA. Management of schizophrenia with obsessive-compulsive features. Psychiatric Clin N Am 2009;32:835-851.
Hwang MY, Opler LA. Schizophrenia with obsessive-compulsive features: assessment and Hyman S. Diagnosing Disorders. Scientific American 2003;2893:76-83.
Iager AC, Kirch DG, Wyatt, RJ. The negative Symptom Rating Scale. Psychiatry Res 1985;16:27-36.
Información para prescribir Inveda Sustenna.
Insel TR, Akiskal HS. Obsessive-compulsive disorder with psychotic features a phenomenological analysis. Am J Psychiatry 1986;143:1527-1533.
Inskip HM, Harris EC, Barraclough B. Lifetime risk of suicide for affective disorder, alcoholism and schizophrenia. Br J Psychiatry 1998;172:35-37.
Instituto Mexicano del Seguro Social [citado Mar 2006]. Disponible en: www.imss.gob.mx
Instituto Mexicano del Seguro Social. Secretaria General. Aviso: Costes unitarios de la atención médica. Diario Oficial de la Federación. Martes 9 de marzo de 2004, Primera Sección pp. 106-107 [citado Mar 2004]. Disponible en: http://dof.gob.mx/index.php
Instituto Nacional de Estadística, Geografía e Informática, México. INEGI, 2000.
International Statistical Classification of Diseases, 10th Revision (ICD-10), Second Edition, WHO.
Jablensky A, Sartorius N, Ernberg G, Anker M, Korten A, Cooper JE et al. Schizophrenia: The 100 year epidemiology of squizophrenia. Schizphr Res 1997;28:111-125.
Jackson C, Knott C, Skeate A, Birchwood M. The trauma of first episode psychosis: the role of cognitive mediation. Aust N Z J Psychiatry 2004;38 (5):327-333.
Jahrreis W. Obsessions during schizophrenia. Arch Psychiatric Nevenkr 1926;77:740-788.
Jarbin H, Von Knorring AL. Suicide and suicide attempts in adolescent-onset psychotic disorders. Nordic Journal Psychiatry 2004;58:115-123
Jarskog L, Selinger E, Lieberman J, Gilmore J. Apoptotic proteins in the temporal cortex in schizophrenia: high Bax/Bcl-2 ratio without caspase-3 activation. Am J Psychiatry 2004;161:108-115.
Jayakody K, Gibson RC, Kumar A, Gunadasa S. Zuclopenthixol acetate for acute schizophrenia and similar serious mental illnesses. Cochrane Database Syst Rev. 2012 Apr 18;4:CD000525. Doi:10.1002/14651858.CD000525.
Jeste DV, Caligiuri MP. Biological research in Geriatrics Psychiatry. Biol Psychiat 1991;30:855-856.
Jiang J, See YM, Subramaniam M, Lee J. Investigation of Cigarette Smoking among Male Schizophrenia Patients. PLoS One 2013;8:e71343.
Jilek W. Cultural factors in psychiatric disorders. Presented at the 26th Congress of the World Federation for Mental Health, July 2001. Consultado el 10-12-05, en: www.mentalhealth.com/mag1/wolfgang.html
Jimeno N, Jimeno A, Vargas, ML. El síndrome psicótico y el inventario de Frankfurt: Conceptos y resultados. España: Springer-Verlag Ibérica; 1996.
Johns CA, Thompson JW. Adjunctive Treatments in Schizophrenia: Pharmacotherapies and Electroconvulsive Therapy. Schizophr Bull 1995;21:607-619.
Johnstone E, Ebmeier K, Millar P, Owens D, Lawrie S. Predicting schizophrenia: findings from the Edinburgh high-risk study. Br J Psychiatry 2005;186:18-25.
Jones PB, Barnes TR, Davies L, Dunn G, Lloyd H, Hayhurst KP et al. Randomized controlled trial of the effect on Quality of Life of second- vs. first-generation antipsychotic drugs in schizophrenia: Cost Utility of the Latest Antipsychotic Drugs in Schizophrenia Study (CUtLASS 1). Arch Gen Psychiatry 2006;63:1079-1087.
Jorgensen P. Early signs of psychotic relapse in schizophrenia. Br J Psychiatry 1998;172:327-330.
Jungbauer J, Wittmund B, Dietrich S, Angermeyer MC. The Disregarded Caregivers: Subjective Burden in Spouses of Schizophrenia Patients. Schizophr Bull 2004;30:665-675.
Kahn RS, Davis KL. New development in dopamine and schizophrenia. En: Bloom FF, Kupfer DJ (eds). Psychopharmacology: The Fourth Generation of Progress. Cuarta edición. Nueva York: Raven Press; 1995.
Kallergis EM, Goudis ChA, Simantirakis EM, Kochiadakis GE, Panos EV. Mechanisms, Risk Factors, and Management of Acquired Long QT Syndrome: A Comprehensive Review. The Scientific World Journal 2012;1:1-8.
Kamali M, Kelly BD, Clarke M, Browne S, Gervin M, Kinsella A et al. A prospective evaluation of adherence to medication in first episode schizophrenia. Eur Psychiatry 2006;21:29-33.
Kane J. Treatment Strategies to Prevent Relapse and Encourage Remission. J Clin Psychiatry 2007;14:27-30.
Kane JM, Honigfeld G, Singer J, Meltzer J, Meltzer HY and the Clozaril Collaborative Study Group. Clozapine for the treatment - resistant schizophrenic. Arch Gen Psychiatry 1988;45:789-796.
Kane JM, Marder SR, Schooler NR, Wirshing WC, Umbricht D, Baker RW et al. Clozapine and haloperidol in moderately refractory schizophrenia: A six month double-blind comparison. Arch Gen Psychiatry 1999 in press.
Kane JM, Sanchez R, Perry PP, Jin N, Johnson BR, Forbes RA. Aripiprazole intramuscular depot as maintenance treatment in patients with schizophrenia: a 52-week, multicenter, randomized, double-blind, placebo-controlled study. J Clin Psychiatry 2012;73:617-624.
Kane JM. Problems of compliance in the outpatiens treatment of schizophrenia. J Clin Psychiatry 1983;44:3-6.
Kane JM. Utilization of long-acting antipsychotic medication in patient care. CNS Spectr 2006;11:1-7.
Kane, JM. Tardive dyskinesia: epidemiological and clinical presentation. In: Bloom FE, Kupfer DJ (eds). Psychopharmacology: the Fourth Generation of Progress. New York: Raven Press; 1995;1485-1495.
Kang UG, Kwon JS, Ahn YM, Chung SJ, Ha JH, Koo YJ et al. Electrocardiographic abnormalities in patients treated with clozapine. J Clin Psychiatry 2000;61:441-446.
Kaplan HI, Sadock BJ, Grebb JA. Sinopsis de Psiquiatría. 7a. ed. Buenos Aires: Panamericana; 1996;1272.
Kapur S, Remington G, Zipursky RB, Wilson AA, Houle S. The D-2 dopamine receptor occupancy of risperidone and its relationship to extrapyramidal symptoms: A PET study. Life Sci 1995;57:103-107.
Kapur S, Remington G. Serotonin-dopamine interaction and its relevance to schizophrenia. Am J Psychiatry 1996;153:466-476.
Karamatskos E, Lambert M, Mulert C, Naber D. Drug safety and efficacy evaluation of sertindole for schizophrenia. Expert Opin Drug Saf 2012;11:1047-1062.
Karim S, Overshott R, Burns A. Older people with chronic schizophrenia. Aging & Mental Health 2005;9:315-324.
Karno M, Golding JM, Sorenson SB, Burnam MA. The epidemiology of obsessive-compulsive disorder in five US communities. Arch Gen Psychiatry 1988;45:1094-1099.
Karno M, Golding JM, Soreson SP, Burnam MA. The epidemiology of obsessive-compulsive disorder in five U.S. communities. Arch Gen Psychiatry 1988;45:1094-1099.
Karvonen K, Sammela HL, Rahikkala H. Sex, timing, and depression among suicide victims with schizophrenia. Comprensive Psychiatry 2007;48:319-322.
Katschnig H, Freeman H, Sartorius N (eds). Quality of life in mental disorders. John Wiley & Sons; 1997.
Katz MM, Marsella A, Dube KC, Olatawura M, Takahashi R, Nakane Y et al. On the expression of psychosis in different cultures: Schizophrenia in an Indian and in a Nigerian community. Cult Med Psychiatry 1988;12:331-355.
Kavanagh D, McGrath J, Saunders J, Dore G, Clark D. Substance Misuse in patients with schizophrenia. Drugs 2002;62:743-755.
Kawashima T, Nakamura M, Bouix S, Kubicki M, Salisbury DF, Westin CF, McCarley RW, Shenton ME. Uncinate fasciculus abnormalities in recent onset schizophrenia and affective psychosis: a diffusion tensor imaging study. Schizophr Res 2009;110:119-126.
Keck PE, Pope HG, Cohen BM. Risk factors for neuroleptic malignant syndrome. Arch Gen Psychiatry 1989;46:914-918.
Keck PI, Strakowski SM, Celroy SL. The efficacy of atypical antipsychotics in The treatment of depressive symptoms hostility, and suicidality in patients with schizophrenia J Clin Psychiatry 2000;61:4-9.
Keefe RSE, Bilder RM, Davis SM. Neurocognitive effects of antipsychotic medications in patients with chronic schizophrenia in the Catie trial. Arch Gen Psychiatry 2007;64:633-647.
Keith SJ, Kane JM. Partial compliance and patient consequences in schizophrenia: our patients can do better. J Clin Psychiatry 2003;64:1308-1315.
Keith SJ, Regier DA, Rae DS. Schizophrenic disorders. En: Robins LN, Regier DA. Psychiatric Disorders in America. USA: The Free Press; 1991:33-52.
Kendler KL, Glazer WM, Morgenstern H. Dimensions of delusional experience. Am J Psychiatry 1983;140:466-469.
Kern R, Green M, Mitchell S, Kopelowicz A, Mintz J, Liberman P. Extensions of errorless learning for social problem-solving deficits in schizophrenia. Am J Psychiatry 2005;162:513-519.
Kern S, Liberman P, Kopelowicz A, Mint J, Green F. Applications of errorless learning for improving work performance in persons with schizophrenia. Am J Psychiatry 2002;159:1921-1926.
Kerwin R. Preventing suicide [letter]. Br J Psychiatry 2003;182:366.
Keshavan M, Duggal H, Veeragandham G, McLaughlin N, Montrose D, Haas L et al. Personality dimensions in first episode psychoses. Am J Psychiatry 2005;162:102-109.
Khashan MS, Abel M, McNamee R, Pedersen MG, Webb RT, Baker PN et al. Higher Risk of Offspring Schizophrenia Following Antenatal Maternal Exposure to Severe Adverse Life Events. Arch Gen Psychiatry 2008;65:146-152.
Killaspy H, Bebbington P, Blizard R, Johnson S, Nolan F, Pilling S et al. The REACT study: randomised evaluation of assertive community treatment in north London. BMJ 2006;332:815-820,
Kim J, Mohamed S, Andreasen N, O'Leary D, Watkins L, Boles Ponto L et al. Regional neural dysfunctions in chronic schizophrenia studied with positron emission tomography. Am J Psychiatry 2000;157:542-548.
Kim SW, Shin IS, Kim JM, Yang SJ, Hwang MY, Yoon JS. Amisulpride improves obsessive-compulsive symptoms in schizophrenia patients taking atypical antipsychotics: an open-label switch study. J Clin Psychopharmacol 2008;28:349-352.
Kimiagar I, Dobronevsky E, Prokhorov T, Miniovitz A, Rabey JM. Rapid improvement of tardive dyskinesia with tetrabenazine, clonazepam and clozapine combined: a naturalistic long-term follow-up study. J Neurol 2012;259:660-664.
Kindermann SS, Karimi A, Symonds L, Brown GG, Jeste DV. Review of functional magnetic resonance imaging in schizophrenia. Schizophr Res 1997;27:143-156.
Kinney DK, Levy DL, Yurgelun-Todd DA, Medoff D, LaJonchere CM, Radford-Paregol M. Season of birth and obstetrical complications in schizophrenics. J Psychiatr Res 1994;28:499-509.
Kirk Morton N, Zubek D. Adherence challenges and long-acting injectable antipsychotic treatment in patients with schizophrenia. J Psychosoc Nurs Ment Health Serv 2013;51:13-18.
Kirkpatrick B, Buchanan RW, McKenney PD, Alphs L, Carpenter WT. The schedule for the deficit syndrome an instrument for research in schizophrenia. Psychiatry Res 1989;30:119-123.
Kirkpatrik B, Messias E, Harvey PDE, Fernandez-Egea E, Bowie CR. Is schizophrenia a syndrome of accelerated anging. Schizophr Bull 2008;34:1024-1032.
Kirmayer L. Myth and ritual in psychotherapy. Transcult Psychiatry 1999;36:451-460.
Kitis A, Akdede BB, Alptekin K, Akvardar Y, Arkar H, Erol A et al. Cognitive dysfunctions in patients with obsessive-compulsive disorder compared to the patients with schizophrenia patients: relation to overvalued ideas. Prog Neuropsychopharmacol Biol Psychiatry 2007;31:254-261.
Klosterkotter J, Hellmich M, Steinmeyer EM, Schultze-Lutter F. Diagnosing schizophrenia in the initial prodromal phase. Arch Gen Psychiatry 2001;58:158-164.
Kluge R, Schwarz S, Hunger H, Schmid F, Kissling W, Leucht S. Second-generation anti-psychotic drugs and extrapyramidal side effects: A systematic review and meta-analysis of head to head comparisons. Schizophrenia Bull 2012;38:167-177.
Knapp M, Mangalore R. The trouble with QALYs... Epidemiol Psichiatr Soc 2007;16:289-293.
Koneru V, Weisman de Mamani A, Wasserman S, Duarte E, Dunham R, Valencia M. Capítulo 10. Aculturación y la salud mental en los pacientes con esquizofrenia y sus familiares. En Valencia M (Compilador). Alternativas terapéuticas para la esquizofrenia. Editorial Herder. México 2012.
Kopala LC, Good KP, Honer WG. Extrapyramidal signs and clinical symptoms in firstepisode schizophrenia: Response to low-dose riesperidone. J Clin Psychopharmacol 1997;17:308-313.
Kopelowicz A, Liberman RP. Integrating Treatment with Rehabilitation for persons With Major Mental Illnesses. Psychiatr Serv 2003;54:1491-1498.
Kopelowicz A, Liberman RP, Zarate R. Recent Advances in Social Skills Training for Schizophrenia. Schizophr Bull 2006;32:S12-S23.
Kopelowicz A, Zarate R, Gonzalez V, Mintz J, Liberman RP. Disease management in latinos with schizophrenia: A family-assisted skills training approach. Schizophr Bull 2003;29:211-227.
Koreen AR, Siris SG, Chakos M, Alvir J, Mayerhoff D, Lieberman J. Depression in firstepisode schizophrenia. Am J Psychiatry 1993;150:1643-1648.
Korf J. Imaging of receptorts in clinical neuroscienses. Acta Neurol Belg 1997:200-205.
Kraepelin E, Robertson GM. Dementia praecox and paraphrenia. Huntington, New York: Krieger; 1971.
Kramer M, Litman R, Hough D, Lane R, Lim P, Liu Y et al. Paliperidone palmitate, a potential long-acting treatment for patients with schizophrenia. Results of a randomized, double-blind, placebo-controlled efficacy and safety study. Int J Neuropsychopharmacol 2010;13:635-647.
Kramer M, Simpson G, Maciulis V, Kushner S, Liu Y, Lim P et al. One-year open-label safety and efficacy study of paliperidone extended-release tablets in patients with schizophrenia. CNS Spectr 2010;15:506-514.
Kramer, BA. Maintenance electroconvulsive therapy in clinical practice. Convulsive Ther 1990;6:279-286.
Krassoievitch M. Trastornos delirantes en la vejez. Editorial Desclée De Brouwer, S.A. Bilbao, España. 2004;15-40.
Krausz M, Muller T, Hassen C. Suicide among schizophrenic adolescents in the long-term course of illness Psychopatology 1995;28:95-103.
Kristensen D, Bauer J, Hageman I, Jorgensen MB. Electroconvulsive therapy for treating schizophrenia: a chart review of patients from two catchment areas. Eur Arch Psychiatry Clin Neurosci 2011;261:425-432.
Kristensen K, Cadenhead KS. Cannabis abuse and risk for psychosis in a prodromal sample. Psychiatry Res 2007;151:151-154.
Kruger S, Braunig P, Hoffler J, Shugar G, Borner I, Langkrar J. Prevalence of obsessive-compulsive disorder in schizophrenia and significance of motor symptoms. J Neuro-psychiatry Clin Neurosci 2000;12:16-24.
Kryzhanovskaya L, Schulz SC, McDougle C. Olanzapine versus placebo in adolescents with schizophrenia: a 6-week, randomized, doublé-bind, placebo-controlled trial. J Am Acad Child Adolesc Psychiatry 2009;48:60-70.
Kubicki M, McCarley R, Westin CF, Park HJ, Maier S, Kikinis R et al. A review of diffusion tensor imaging studies in schizophrenia. J Psychiatr Res 2007;41:15-30.
Kufferle B, Tasucher J, Asenbaum S. IB2M SPECT imaging of striatal D2 receptors in psychotic patients treated with quetiapine in comparison to clozapine and haloperidol. Psychopharmacol 1997;133:323-328.
Kuipers L, Leff J, Lam D. Family work for schizophrenia: A practical guide. London: Gaskell; 1992.
Kuipers L. Family burden in schizophrenia: implications for services. Soc Psychiatry Psychiatr Epidemiol 1993;28:207-210.
Kulhara P, Avasthi A, Sharan P, Gupta N, Raq AS. Late onset schizophrenia versus onset schizophrenia: a comparison of clinical features. Indian J Psychiatry 1999;41:333-335.
Kulhara P, Chakrabarti S, Avasthi A, Sharma A, Sharma S. Psychoeducational intervention for caregivers of Indian patients with schizophrenia: a randomised-controlled trial. Acta Psychiatr Scand 2009;119:472-483.
Kumra S, Jacobsen IK, Lenane M, Zahn TP, Wigs E, Alaghband-Rad J. Multidimensionally impaired disorder. Is it a variant of very early-onset schizophrenia? J Am Acad Child Adolesc Psychiatry 1998;37:91-99.
Kurtz M, Mueser KT. A Meta-Analysis of Controlled Research on Social Skills Training. J Consult Clin Psychol 2008;76:491-504.
Kurz M, Hummer M, Oberbauer H, Fleischhacker WW. Extrapyramidal side effects of clozapine and haloperidol. Psychopharmacol 1995;118:52-56.
Kwon JS, Jang JH, Kang DH, Yoo SY, Kim YK, Cho SJ. Long-term efficacy and safety of aripi-prazole in patients with schizophrenia, schizophreniform disorder, or schizoaffective disorder: 26-week prospective study. Psychiat Clin Neurosciences 2009;63:73-81.
La Grenade L, Graham D, Trontell A. Myocarditis and cardiomyopathy associated with clozapine use in the United States. N Engl J Med 2001;345:224-225.
Lam DH. Psychosocial family intervention in schizophrenia: A review of empirical studies. Psychol Med 1991;21:423-441.
Lambert T, Brennan A, Castle D, Kelly DL, Conley RR. Perception of depot antipsychotics by mental health professionals. J Psychiatr Pract 2003;9:252-260.
Landy DA. Combined use of Clozapine and electroconvulsive therapy (Case Report). Convulsive Ther 1991;7:218-221.
Lang K, Meyers JL, Korn JR, Lee S, Sikirica M, Crivera C. Medication adherence and hospitalization among patients with schizophrenia treated with antipsychotics. Psychiatr Serv 2010;61:1239-1247.
Lara MC, Ortega SH. ¿La clinimetría o psicometría? Medición en la práctica psiquiátrica. Salud Mental 1995;18:32-40.
Larsen TK, McGlashan TH, Johannessen JO, Vibe-Hansen L. First-episode schizophrenia: II. Premorbid patterns by gender. Schizophr Bull 1996;22:257-269.
Lavin MR, Halligan P. ECT for comorbid obsessive-compulsive disorder and schizophrenia. Am J Psychiatry 1996;153:1652-1653.
Leal MI, Sales R, Ibáñez E, Giner J, Leal C. Valoración de la sobrecarga en cuidadores informales de pacientes con esquizofrenia antes y después de un programa psicoeducativo. Acta Española Psiquiátrica 2008;36:63-69.
Lebell M, Marder Re, Mintz J, Mintz IL. Tompson M, Wishing W et al. Patients, perceptions family emotional climate and outcome in schizophrenia. Br J Psychiatry 1993;162:751-754.
Lee MJ, Shin YB, Sunwoo YK, Jung SH, Kim WH, Kang MH et al. Comparative Analysis of Cognitive Function in Schizophrenia with and without Obsessive Compulsive Disorder. Psychiatr Inv 2009;6:286-293.
Leff J, Ballús-Creus C. Capítulo 3. Orientación familiar en las psicosis. En: Valencia, M (Compilador). Alternativas terapéuticas para la esquizofrenia. Editorial Herder (En Prensa); 2012.
Leff J, Berkowitz R, Shavit N, Strachan A, Glass I, Vaughn C. A trial of family therapy versus relatives' group for schizophrenia: Two-year follow-up. Br J Psychiatry 1990;157:571-577.
Leff J, Kuipers L, Berkowitz R, Sturgeon D. A controlled trial of social intervention in the families of schizophrenic patients. Br J Psychiatry 1985;146:594-600.
Leff J. Family work for schizophrenia: practical application. Acta Psychiatr Scand 2000;407:78-82.
Leff J. Psychiatry around the globe. A transcultural View. Gaskell. Londres. 1988.
Leff JP, Kuipers L, Berkowitz R, Eberlein-Vries R, Surgeon D. A controlled trial of social intervention in the families of schizophrenic patients. Br J Psychiatry 1982;141:121-124.
Lehman A, Buchanan R, Dickerson F, Dixon L. Evidence-based treatment for schizophrenia. Psychiatr Clin N Am 2003;26:939-954.
Lehman AF, Kreyenbuhl J, Buchanan RW, Dickerson FB, Dixon LB, Goldberg R et al. The Schizophrenia Patient Outcomes Research Team (PORT): updated treatment recommendations 2003. Schizophr Bull 2004;30:193-217.
Lehman AF, Lieberman JA, Dixon LB, McGlashan TH, Miller AL, Perkins DO et al. Practice guideline for the treatment of patients with schizophrenia, second edition. Am J Psychiatry 2004;161:1-56.
Lehman AF, Steinwachs DM. Evidence-based psychosocial treatment practices in schizophrenia: lessons from the Patient Outcomes Research Team (PORT) project. 2003;31:141-154.
Lehman AF. Overview of best practices: current treatment guidelines and protocols for schizophrenia. Program and abstracts of the American Psychiatric Association 156th Annual Meeting; May 17-22, 2003; San Francisco, California. Abstract S28A.
Leucht C, Heres S, Kane JM, Kissling W, Davis JM, Leucht S. Oral versus depot anti-psychotic drugs for schizophrenia-a critical systematic review and meta-analysis of randomised long-term trials. Schizophr Res 2011;127:83-92.
Leucht S, Arbter D, Engel RR, Kissling W, Davis JM. How effective are second-generation antipsychotic drugs? a meta-analysis of placebo-controlled trials. Mol Psychiatry 2008;13:1-19.
Leucht S, Barnes T, Kissling W. Relapse Prevention in Schizophrenia with New-Generation Antipsychotics: A Systematic Review and Exploratory Meta-Analysis of Randomized, Controlled Trials. Am J Psychiatry 2003;160:1209-1222.
Leucht S, Burkard T, Henderson J. Physical illness and schizophrenia: a review of the literature. Acta Psychiatr Scand 2007;116:317-333.
Leucht S, Corves C, Arbter D, Engel RR, Li C, Davis JM. Second-generation versus first-generation antipsychotic drugs for schizophrenia: a meta-analysis. Lancet 2009;373:31-41.
Leucht S, Kissling W, McGrath J, White P. Carbamazepine for schizophrenia. Cochrane Database Syst Rev. 2007 Jul 18;(3):CD001258.
Leucht S, Kissling W, McGrath J. Lithium for schizophrenia revisited: a systematic review and meta-analysis of randomized controlled trials. J Clin Psychiatry 2004;65:177-186.
Leucht S, Komossa K, Rummel-Kluge C, Corves C, Hunger H, Schmid F et al. Meta-analysis of head-to-head comparisons of second-generation antipsychotics in the treatment of schizophrenia. Am J Psychiatry 2009;166:152-163.
Leucht S, Pitschel-Walz G, Abraham D, Kissling W. Efficacy and extrapyramidal side-effects of the new antipsychotics olanzapine, quetiapine, risperidone, and sertindole compared to conventional antipsychotics and placebo. A meta-analysis of randomized controlled trials. Schizophr Res 1999;35:51-68.
Lewine RR, Fogg L, Meltzer HY. Assessment of negative and positive symptoms in schizophrenia. Schizophr Bull 1983;9:368-976.
Lewis DA, Lieberman JA. Catching up on schizophrenia: natural history and neurobiology. Neuron 2000;28:325-334.
Leysen JE, Gommeren W, Eens A, de Chaffoy de Courcelles D, Stoof JC, Janssen PA. Biochemical profile of risperidone, a new antipsychotic. J Pharmacol Exp Ther. 1988;247:661-670.
Leysen JE, Janssen PMF, Schotte A. Interaction of antipsychotic drugs with neurotrans-mitter receptor siles in vitro and in vivo in relation to pharmacological and clinical effects: Role of 5HT2 receptors. Psychopharmacol 1993;112:S40-S54.
Liddle PF, Friston KJ, Frith CD, Hirsch SR, Jones T, Frackowiak RS. Patterns of cerebral blood flow in schizophrenia. Br J Psychiatry 1992;160:179-186.
Liberman R, Wallace Ch, Blackwell G. Skills Training Versus Psychosocial Occupational Therapy for Person with Persistent Schizophrenia. Am J Psychiatry 1998;155:1087-1091.
Liberman RP, Kopelowicz A. Recovery from schizophrenia: a concept in search of research. Psychiatr Serv 2005;56:735-742.
Liberman RP. Biobehavioral therapy: Interactions between pharmacotherapy and behavior therapy in schizophrenia. En: Wykes T, Tarrier N, Lewis S. Outcome and Innovation in Psychological Treatment of Schizophrenia. Chichester: Edit.Wiley; 1998;179-199.
Liberman RP. Psychosocial Treatments for Schizophrenia. Psychiatry 1994;57:104-114.
Lieberman J, Lehman A. Guía Clínica para el Tratamiento de la Esquizofrenia, Asociación Psiquiátrica Americana. 2006, Ars Médica.
Lieberman JA, Alvir JM, Woerner M, Degreef G, Bilder RM, Ashtari M et al. Prospective study of psychobiology in first-episode schizophrenia at Hillside Hospital. Schizophr Bull 1992;18:351-371.
Lieberman JA, Kane JM, Johns CA. Clozapine: guidelines for clinical management. J Clin Psychiatry 1989;50:329-338.
Lieberman JA, Koreen AR, Chakos M, Sheitman B, Woerner M, Alvir J et al. Factors influencing treatment response and outcome of first-episode schizophrenia: Implications for understanding the pathophysiology of schizophrenia. Journal of Clinical Psychiatry 1996;57:5-9.
Lieberman JA, Mailman RB, Duncan G, Sikich L, Chakos MH, Nichols DE, Kraus J. Serotonergic basos of antipsychotic drug effects in schizophrenia. Biol Psychiatry 1998;44:1099-1117.
Lieberman JA, Perkins D, Belger A, Chakos M, Jarskog F, Boteva K et al. The early stages of schizophrenia: speculations on pathogenesis, pathophysiology, and therapeutic approaches. Biol Psychiatry 2001;50:884-897.
Lieberman JA, Phillips M, Gu H, Stroup S, Zhang P, Kong L et al. Atypical and conventional antipsychotic drugs in treatment-naive first-episode schizophrenia: a 52-week randomized trial of clozapine vs. chlorpromazine. Neuropsychopharmacol 2003;28:995-1003.
Lieberman JA, Safferman AZ, Pollack S, Szymanski S, Johns C, Howard A et al. Clinical effects of clozapina in chronic schizophrenia: response to treatment and predictors of outcome. Am J Psychiatry. 1994;151:1744-1752.
Lieberman JA, Stroup S. Effectiveness of Antipsychotic Drugs in Patients with Chronic Schizophrenia. N Engl J Med 2005;353:1209-1223.
Lieberman JA, Stroup S. Research gaps and current research initiatives to improve the treatment of schizophrenia. Program and abstracts of the American Psychiatric Association 156th Annual Meeting; May 17-22, 2003; San Francisco, California. Abstract S28B.
Lieberman JA, Stroup TS, Mcevoy JP, Swartz MS, Rosenheck RA, Perkins DO et al. Effectiveness of antipsychotic drugs in patients with chronic schizophrenia. N Engl J Med 2005;353:1209-1223.
Lieberman JA. Atypical antipsychotic drugs as a first-line treatment of schizophrenia: A rationale and hypothesis. J Clin Psychiatry 1996;57:68-71.
Lin CH, Kuo CC, Chou LS, Chen YH, Chen CC, Huang KH et al. A randomized, doubleblind comparison of risperidone versus low-dose risperidone plus low-dose haloperidol in treating schizophrenia. J Clin Psychopharmacol 2010;30:518-525.
Lincoln TM, Wilhelm K, Nestoriuc Y. Effectiveness of psychoeducation for relapse, symptoms, knowledge, adherence and functioning in psychotic disorders: a meta-analysis. Schizophr Res 2007;96:232-245.
Linden M, Godemann F, Gaebel W, Kopke W, Muller P, Muller-Spahn F et al. A prospective study of factors influencing adherence to a continuous neuroleptic treatment program in schizophrenia patients during 2 years. Schizophr Bull 2001;27:585-596.
Lindström E, Lindström LH. A subscale for negative symptoms from the CPRS: a comparison with the SANS. Eur Arch Psychiatry Clin Neurol 1996;246:219-223.
Linscott RJ, Knight RG. Potentiated automatic memory in schizotypy. Personality and Individual Differences 2004;37:1503-1517.
Loebel AD, Lieberman JA, Alvir JM, Mayerhoff DI, Geisler SH, Szymanski SR. Duration of psychosis and outcome in first-episode schizophrenia. Am J Psychiatry 1992;149:83-88.
Loewenthal KM, Cinnirella M. Beliefs about the efficacy of religious, medical and psycho-therapeutic interventions for depression and schizophrenia among women from different cultural-religious groups in Great Britain. Transcult Psychiatry 1999;36:491-504.
Lopez M, Laviana M. Rehabilitación, apoyo social y atención comunitaria a personas con trastorno mental grave. Propuesta desde Andalucía. Rev Asoc Esp Neuropsiq 2007;27:187-223.
Loth AK, Pataky C. Childhood-onset schizophrenia. http://emedicine.medscape.com/article/914840-overview
Lóyzaga C, Nicolini H, Apiquián R, Fresán A. Fenómeno Esquizo-obsesivo en pacientes con diagnóstico de esquizofrenia: prevalencia y variables sociodemográficas. Psiquiatría y Salud Integral 2003;3:48-55.
Lóyzaga C, Nicolini H, Apiquián R, Fresán A. Una aproximación al fenómeno esquizo-obsesivo. Salud Mental 2002;25:12-18.
Lóyzaga C. Evaluación del Fenómeno esquizo-obsesivo en pacientes con diagnósticos de esquizofrenia y trastorno obsesivo-compulsivo. Tesis para obtener el grado de Maestra en Ciencias. UNAM. INP. Noviembre 2001.
MacBeth A, Gumley A. Premorbid adjustment, symptom development and quality of life in first episode psychosis: a systematic review and critical reappraisal. Acta Psychiatr Scand 2008;117:85-99.
Macêdo DS, Oliveira GV, Gomes PX, Araújo FY, Souza CM, Vasconcelos SM et al. Vitamins attenuate haloperidol-induced orofacial dyskinesia in rats: possible involvement of antioxidant mechanisms. Behav Pharmacol 2011;22:674-680.
Madhusoodanan S, Alexeenko L, Sanders R, Brenner R. Extrapyramidal symptoms associated with antidepressants: a review of the literature and an analysis of spontaneous reports. Ann Clin Psychiatry 2010;22:148-156.
Magaña S, García J, Hernández M, Cortez R. Psychological distress among Latino family caregivers of adult with Schizophrenia: The roles of burden and stigma. Psychiatr Serv 2007;58:378-384.
Magliano L, Fiorillo A, De Rosa C, Maj M and the National Mental Health Project Working Group. Family burden and social network in schizophrenia vs. physical diseases: preliminary results from an Italian national Study. Acta Psychiatr Scand 2006;113:60-63.
Magliano L, Fiorillo A, Malangone C. Patient functioning and family burden in a controlled, real-world trial of family. Psychiatr Serv 2006;57:1784-1791.
Magliano L, Fiorillo A. Psychoeducational family interventions for schizophrenia in the last decade: from explanatory to pragmatic trials. Epidemiol Psichiatr Soc 2007;16:22-34.
Malaspina D, Harlap S, Fennig S, Herman D, Nahon D, Feldman D et al. Advancing paternal age and the risk of schizophrenia. Arch Gen Psychiatry 2001;58:361-367.
Malla A, Lal S, Vracotas NC, Goldberg K, Joober R. Early intervention in psychosis: specialized intervention and early case identification. L'Encephale 2010;36:S38-S45.
Malla A, Norman R, Schmitz N, Manchanda R, Bechard-Evans L, Takhar J et al. Predictors of rate and time to remission in first-episode psychosis: a two-year outcome study. Psychol Med 2006;36:649-658.
Malla A, Williams R, Kopala L. Outcome on quality of life in a Canadian national sample of patients with schizophrenia and related psychotic disorders. Acta Psychiatr Scand 2006;113:22-28.
Malla AK, Norman RM, Manchanda R, Townsend L. Symptoms, cognition, treatment adherence and functional outcome in first-episode psychosis. Psychol Med 2002;32:1109-1119.
Malm U, Dencker S. Evaluation of the Quality of Life the Schizophrenic Outpatient: A Checklist. Schizophr Bull 1981;7:477-486.
Malm U, Ivarsson B, Allebeck P, Falloon IR. Integrated care in schizophrenia: a 2-year randomized controlled study of two community-based treatment programs. Acta Psychiatr Scand 2003;107:415-423.
Malm U. Group therapy. En: Herz MI, Keith SJ, Docherty JP (eds). Handbook of Schizophrenia, Vol 4 Psychosocial treatment of Schizophrenia. Amsterdam: Elsevier;1990;191-211.
Mandel MR, Welch CA, Mieske M. Prediction of response to ECT in tricyclic-intolerant of tricyclicresistant depressed patients. Mc Lean Hosp J 1977;2:203-209.
Mann JJ. The medical management of depression. N Engl J Med 2005;353:1819-1834.
Manu P, Sarpal D, Muir O, Kane JM, Correll CU. When can patients with potentially life-threatening adverse effects be rechallenged with clozapine? A systematic review of the published literature. Schizophr Res 2012;134(2-3):180-186.
March JS, Silva SG, Compton S, Shapiro M, Califf R, Krishnan R. The case for practical clinical trials in psychiatry. Am J Psychiatry 2005;162:836-846.
Marcus P, Snyder R. Reduction of comorbid substance abuse with clozapine. Am J Psychiatry 1995;152:959.
Marder SR. Integrating pharmacological and psychosocial treatments for schizophrenia. Acta Psychiatr Scand 2000;102(s407):87-90.
Marder SR, Essock SM, Miller AL, Buchanan RW, Casey DE, Davis JM et al. Physical health monitoring of patients with schizophrenia. Am J Psychiatry 2004;161:1334-1349.
Marder SR, Meibach RC. Risperidone in the treatment of schizophrenia. Am J Psychiatric 1994;151:825-835.
Margolese HC, Chouinard G, Kolivakis TT. Tardive dyskinesia in the era of typical and atypical antipsychotics. Part 1: pathophysiology and mechanisms of induction. Can J Psychiatry 2005;50:541-547.
Mari JJ, Streiner DL. An overview of family interventions and relapse on schizophrenia: meta-analysis of research findings: Psychol Med 1994;24:565-578.
Marian S, Peterson K, Carson S, Fu R, Thakurta S. Drug Class Review Atypical Anti-psychotic Drugs: Final Update 3 Report July 2010.
Marshall M, Gray A, Lockwood A, Green R. Case management for people with severe mental disorders. Cochrane Database of Systematic Reviews 1998, Issue 2. Art. No.: CD000050. DOI:10.1002/14651858.CD000050.
Marshall M, Lewis S, Lockwood A, Drake R, Jones P, Croudace T. Association between duration of untreated psychosis and outcome in cohorts of first-episode patients: a systematic review. Arch Gen Psychiatry 2005;62:975-983.
Marshall M, Lockwood A. Assertive community treatment for people with severe mental disorders. Cochrane Database of Systematic Reviews 1998 (2):CD001089.
Marshall M, Rathbone J. Early intervention for psychosis. Schizophr Bull 2011;37:1111-1114.
Martin JL, Pérez V, Sacristán M et al. Meta-analysis of drop-out rates in randomized clinical trials, comparing typical and atypical antipsychotics in the treatment of schizophrenia. Eur Psychiatry 2006;21:11-20.
Martinot JL, Huret JD, Mazoyer B. Striatal D2 dopaminergic receptors assessed with Positron Emission Tomography and (76 Br) bromospiperone in untreated schizophrenic patients. Am J Psychiatry 1990;147:44-50.
Martinot JL, Paillere-Martinot ML, Poirier MF, Dao-Castellana MH, Loc'h C, Maziere B. In vivo characteristics of dopamine D2 receptor occupancy by amisulpride in schizophrenia. Psychopharmacol 1996;124:154-158.
Martins C, de Lemos AI, Bebbington PB. A Portuguese/Brazilian study of Expressed Emotion. Soc Psychiatr Epidemiol 1992;27:22-27.
Masand PS, Roca M, Turner MS, Kane JM. Partial adherence to antipsychotic medication impacts the course of illness in patients with schizophrenia: a review. Prim Care Companion J Clin Psychiatry 2009;11:147-154.
Masi G, Liboni F. Management of schizophrenia in children and adolescents: focus on pharmacotherapy. Drugs 2011;71:179-208.
Mason O, Startup M, Halpin S, Schall U, Conrad A, Carr V. Risk factors for transition to first episode psychosis among individuals with 'at-risk mental states'. Schizophr Res 2004;71:227-237.
Mathalon D, Sullivan E, Lim K, Pfefferbaum A. Progressive brain volume changes and the clinical course of schizophrenia in men: A longitudinal magnetic resonance imaging study. Arch Gen Psychiatry 2001;58:148-157.
McCabe C, Dixon S. Testing the validity of cost effectiveness models. Pharmacoeconomics 2000;17:501-513.
McCarthy B. The role of relatives. In: Lavender A, Holloway F (eds). Community care in practice. Wiley, Chichester 1988.
McCrone P, Strathdee G. Needs not diagnosis: towards a more rational approach to community mental health resourcing in Britain. Int J Soc Psychiatry 1994;40:79-86.
McCue RE, Waheed R, Urcuyo L, Orendain G, Joseph MD, Charles R et al. Comparative effectiveness of second-generation antipsychotics and haloperidol in acute schizophrenia. Br J Psychiatry 2006;189:433-440.
McDonald A, Carter C, Kerns J, Ursu S, Barch D, Holmes A, Stenger V, Cohen J. Specificity of prefrontal dysfunction and context processing deficits to schizophrenia in never-medicated patients with first-episode psicosis. Am J Psychiatry 2005;162:475-484.
McEvoy J, Freudenreich O, McGree M. Clozapine decreases smoking in patients with chronic schizophrenia. Biol Psychiatry 1995;37:550-552.
McEvoy JP, Hogarty GE, Steingard S. Optimal dose of neuroleptic in acute schizophrenia: a controlled study of the neuroleptic threshold and higher haloperidol dose. Arch Gen Psychiatry 1991;48:739-745.
McEvoy JP, Lieberman JA, Stroup TS, Davis SM, Meltzer HY, Rosenheck RA et al. Effectiveness of clozapine versus olanzapine, quetiapine, and risperidone in patients with chronic schizophrenia who did not respond to prior atypical antipsychotic treatment. Am J Psychiatry 2006;163:600-610.
McEvoy JP, Scheifler PL, Frances A. Treatment of schizophrenia 1999. The expert consensus guideline series. J Clin Psychiatry 1999;60:3-80.
McEvoy JP. Antipsychotic drugs. In: Squire LR (ed). Encyclopedia of neuroscience Vol 1. Oxford (GB): Academic Press; 2009;487-492.
McFarlane W, Link B, Dushay R, Marchal J, Crilly J. Psychoeducational multiple family groups: Four-year relapse outcome in schizophrenia. Fam Process 1995;34:127-144.
McGlashan TH, Fenton WS. The positive-negative distinction in schizophrenia. Review of natural history validators. Arch Gen Psychiatry 1992;49:63-72.
McGlashan TH. A selective review of recent North American long-term follow up studies of schizophrenia. Schizophr Bull 1988;14:515-542.
McGlashan TH. Duration of untreated psychosis in first-episode schizophrenia: marker or determinant of course? Biol Psychiatry 1999;46:899-907.
McGlashan TH. Early detection and intervention in psychosis: An ethical paradigm shift. Br J Psychiatry 2005;48:s113-s115.
McGorry P. International clinical practice guidelines for early psychosis. Br J Psychiatry 2005;187(Suppl):s120-s124. Doi:10.1192/bjp.187.48.s120.
McGorry PD, Killackey E, Yung A. Early intervention in psychosis: concepts, evidence and future directions. World Psychiatry 2008;7:148-156.
McGorry PD, Nelson B, Amminger GP, Bechdolf A, Francey SM, Berger G et al. Intervention in individuals at ultra-high risk for psychosis: a review and future directions. J Clin Psychiatry 2009;70:1206-1212.
McGorry PD. Evaluating the importance of reducing the duration of untreated psychosis. Aust N Z J Psychiatry 2000;34:S145-S977.
McGrath J, Saha S, Welham J, El Saadi O, MacCauley C, Chant D. A systematic review of the incidence of schizophrenia: the distribution of rates and the influence of sex, urbanicity, migrant status and methodology. BMC Medicine 2004;2:13.
McGurk R, Mueser KT, DeRosa TJ, Wolfe R. Work, recovery, and comorbidity in schizophrenia: a randomized controlled trial of cognitive remediation. Schizophr Bull 2009;35:319-335.
McGurk SR, Twamley EW, Sitzer DI, McHugo GJ, Mueser KT. A meta-analysis of cognitive remediation in schizophrenia. Am J Psychiatry 2007;164:1791-1802.
McKay DR, Tennant CC. Is de grass greener? The link between cannabis and psychosis. Med J Aust 2000;172:284-286.
McKenna PJ, Lund CE, Mortimer AM, Bíggins CA. Motor, volitional and behavioral disorders in schizophrenia 2: The "conflict of paradigms" hypothesis. Br J Psychiatry 1991;1:328-336.
McNulty S, Duncan L, Semple M, Jackson G, Pelosi A. Care needs of elderly people with schizophrenia. Assessment of an epidemiologically defined cohort in Scotland. Br J Psychiatry 2003;182:241-247.
Meats P. Quatiapine: an effective and well tolerated atypical antipsychotic. Int J Psychiatric Clin Prac 1997;1:231-239.
Medina E. Aproximaciones al chamanismo y neochamanismo latinoamericano: presencia actual de algunas manifestaciones. Memorias del 3er congreso internacional de GLADET. Tuxtla Gutiérrez, Chiapas. 2012.
Medina MA, Borges G, Lara MC. Prevalencia de trastornos mentales y uso de servicios: Resultados de la encuesta nacional de epidemiología psiquiátrica en México. Salud Mental 2003;26:1-16.
Mednick SA, Machon RA, Huttunen MO, Bonnett D. Adult schizophrenia following prenatal exposure to an influenza epidemic. Arch Gen Psychiatry 1988;5:189-192.
Meehan K, Zhang F, David S, Tohen M, Janicak P, Small J et al. A double-blind, randomized comparison of the efficacy and safety of intramuscular injections of olanzapine, lorazepam, or placebo in treating acutely agitated patients diagnosed with bipolar mania. J Clin Psychopharmacol 2001;21:389-397.
Mehler-Wex C, Kolch M, Kirchheiner J, Antony G, Fegert JM, Gerlach M. Drug monitoring in child and adolescent psychiatry for improved efficacy and safety of psychopharmacotherapy. J Child Adol Psychiatry Mental Health 2009;3:14.
Melle I, Haahr U, Friis S. Reducing the duration of untreated first-episode psychosis-effects on baseline social functioning and quality of life. Acta Psychiatr Scand 2005;112:469-473.
Meltzer HY. Decreasing suicide in schizophrenia. Psychiatric Times 2001;18:1-5.
Meltzer HY, Baldessarini RJ. Reducing high risk for suicide in schizophrenia and affective disorders. J Clin Psychiatry 2003;64:1122-1129.
Meltzer HY, Bobo WV, Lee MA, Cola P, Jayathilake K. A randomized trial comparing clozapine and typical neuroleptic drugs in non-treatment-resistant schizophrenia. Psychiatry Res 2010;177:286-293.
Meltzer HY. Duration of a clozapine trial on neuroleptic-resistant schizophrenia. Arch Gen Psychiatry 1989;46:672.
Meltzer HY. Suicidality in schizophrenia: a review of the evidence for risk factors and treatment options. Curr Psychiatry Rep 2002;4:279-283.
Meltzer HY. Treatment-resistant schizophrenia: the role of clozapine. Curr Med Res Opin 1997;14:1-20.
Meltzer JY, Cola P, Way L, Thompson PA, Bastani B, Davies MA et al. Cost-effectiveness of clozapine in neuroleptic-resistant schizophrenia. Am J Psychiatry 1993;150:1630-1638.
Meltzer MI. Introduction of Health Economics for physicians. Health Economics Quintet. Lancet 2001;358:993-998.
Merrill DB, Ahmari SE, Bradford JM et al. Myocarditis during clozapine treatment. Am J Psychiatry 2006;163:204-208.
Meynert T. Amentia, die VerwirrtheK. Jahrbuch der Psychiatrie (Vienna) 1889;9:1-112.
Mezzich JE, Kleinman A, Fabrega H, Parron DL. Culture and Psychiatric Diagnosis. A DSM-IV Perspective. Am Psych Press 1996.
Miles CP. Conditions Predisposing to suicide: a review. J Nervous Mental Disorders 1977;164:231-246.
Miles P, Ho B-C, Arndt S, Andreasen N. Predictive values of neurocognition and negative symptoms on functional outcome in schizophrenia: a longitudinal first episode study with 7-year follow-up. Am J Psychiatry 2005;162:495-506.
Miller AL, Crismon L, Rush J, Chiles J, Kashner M, Toprac M et al. The Texas Medication Algorithm Project: Clinical Results for Schizophrenia. Schizophr Bull 2004;30:627-647.
Miller BJ. A review of second-generation antipsychotic discontinuation in first-episode psychosis. J Psychiatr Pract 2008;14:289-300.
Miller CH, Fleischhacker WW. Managing antipsychotic-induced acute and chronic akathisia. Drug Saf 2000;22:73-81.
Miller CH, Mohr F, Umbricht D, Woerner M, Fleischhacker WW, Lieberman JA. The prevalence of acute extrapyramidal signs and symptoms in patients treated with cloza-pine, risperidone and conventional antipsychotics. J Clin Psychiatry 1998;59:69-75.
Miller TJ, McGlashan TH, Rosen JL, Cadenhead K, Ventura J, McFarlane W et al. Prodromal Assessment with the Structured Interview for Prodromal Syndromes and the Scale of Prodromal Symptoms: Predictive Validity, Interrater Reliability, and Training to Reliability. Schizoph Bull 2003;29:703-715.
Miller TJ, McGlashan TH, Woods SW, Stein K, Driesen N, Corcoran CM et al. Symptom assessment in schizophrenic prodromal states. Psychiatr Q 1999;70:273-287.
Minzenberg MJ, Laird AR, Thelen S, Carter CS, Glahn DC. Meta-analysis of 41 Functional Neuroimaging Studies of Executive Function in Schizophrenia. Arch Gen Psychiatry 2009;66:811-822.
Mishara AL, Goldberg TE. A meta-analysis and critical review of the effects of conventional neuroleptic treatment on cognition in schizophrenia: opening a closed book. Biol Psychiatry 2004;55:1013-1022.
Misra L, Kofoed L. Risperidone treatment of methanphetamine psychosis. Am J Psychiatry 1997;154:1170.
Misra LK, Erpenbach JE, Hamlyn H, Fuller WC. Quetiapine: a new atypical antipsychotic. D J Med 1998;51:189-193.
Miyamoto S, Duncan GE, Marx CE, Lieberman JA. Treatments for schizophrenia: a critical review of pharmacology and mechanisms of action of antipsychotic drugs. Mol Psychiatry 2004;10:79-104.
Mojtabai R, Lavelle J, Gibson PJ, Sohler NL, Craig TJ, Carlson GA et al. Gaps in use of antipsychotics after discharge by first-admission patients with schizophrenia, 1989 to 1996. Psychiatr Serv 2002;53:337-339.
Mojtabai R, Nicholson R, Carpenter B. Role of Psychosocial Treatments in Management of Schizophrenia: A Meta-Analytic Review of Controlled Outcome Studies. Schizophr Bull 1998;24:569-587.
Molina Fray Alonso. Vocabulario en lengua castellana y mexicana y mexicana castellana. Edición Facsímile. México: Ed. Porrúa; 1970.
Möller HJ. Long-acting injectable risperidone for the treatment of schizophrenia: clinical perspectives. Drugs 2007;67:1541-1566.
Möller HJ. The negative component in schizophrenia. Acta Psychiatr Scand 1995;388:11-14.
Montout C, Casadebaig F, Lagnaoui R. Neuroleptics and mortality in Schizophrenia, prospective analysis of deaths in french cohort of schizophrenic patients. Schizophr Res 2002;57:147-157.
Morel BA. Traité des maladies menfales. Masson: Paris. 1860.
Morgenstern H, Glazer WM, Gibowski LD. Predictors of tardive dyskinesia: Results of a cross sectional study in an outpatient population. J Chron Dis. 1987;40:319-327.
Moriana JA, Alarcón E, Herruzo J. Capítulo 4. Rehabilitación psicosocial para esquizofrenia y trastornos mentales graves en contextos domiciliarios. En: Valencia M (Compilador). Alternativas terapéuticas para la esquizofrenia. Editorial Herder (En Prensa); 2012.
Morosini PL, Magliano L, Brambilla L, Ugolini S, Pioli R. Development, reliability and acceptability of a new version of the DSM-IV Social and Occupational Functioning Assessment Scale (SOFAS) to assess routine social functioning. Acta Psychiatr Scand 2000;101:323-329.
Moser LL, Deluca NL, Bond GR, Rollins AL. Implementing evidence-based psychosocial practices: lessons learned from statewide implementation of two practices. CNS Spectr 2004;9:926-936.
Mould QJ, Contreras HI, Verduzco W, Mejía AJ, Garduño EJ. Análisis de simulación de costo-efectividad en el tratamiento de la esquizofrenia en el Instituto Mexicano del Seguro Social. Evaluación de antipsicóticos típicos y atípicos. Rev Psiquiatr Salud Ment (Barc) 2009;2:108-118.
Mueser KT, Bond GR, Drake RE, Resnick SG. Models of community care for severe mental illness: a review of research on case management. Schizophr Bull 1998;24:37-74.
Mueser KT, Corrigan PW, Hilton D, Tanzman B, Schaub A, Gingeric S. Illness management and recovery: a review of the research. Psychiatr Serv 2002;53:1272-1284.
Mueser KT, Lu W, Rosenberg SD, Wolfe R. The trauma of psychosis: posttraumatic stress disorder and recent onset psychosis. Schizophr Res 2010;116:217-227.
Mueser KT, Salyers MP, Mueser PR. A prospective analysis of work in schizophrenia. Schizophr Bull 2001;27:281-296.
Muñoz HO, Garduño EJ, Pérez CR. Higia y Panacea en la salud y la sociedad. Los sistemas de salud, un producto de la evolución social. Rev Med IMSS 2005;43:411-417.
Murphy HBM, Raman AC. The chronicity of schizophrenia in indigenous tropical people. Br J Psychiatry 1971;118:489-497.
Murphy HBM. Comparative Psychiatry: The International and Intercultural Distribution of Mental Illness. Berlin: Springer, 1982.
Murray RM, Lewis SW. Is schizophrenia a neurodevelopmental disorder? BMJ 1987;295:681.
Murray RM, O'Callaghan E, Castle DJ, Lewis SW. A neurodevelopmental approach to the classification of schizophrenia. Schizophr Bull 1992;18:319-332.
Nagai M, Kishi K, Kato S. Insular cortex and neuropsychiatric disorders: a review of recent literature. Eur Psychiatry 2007;22:387-394.
Nasrallah HA, Gopal S, Gassmann-Mayer C, Quiroz JA, Lim P, Eerdekens M et al. A controlled, evidence-based trial of paliperidone palmitate, a long-acting injectable anti-psychotic, in schizophrenia. Neuropsychopharmacology 2010;35:2072-2082.
National Collaborating Centre for Mental Health (UK). Schizophrenia: Core Interventions in the Treatment and Management of Schizophrenia in Primary and Secondary Care (Update) [Internet]. Leicester (UK): British Psychological Society; 2009 Mar. (NICE Clinical Guidelines, No. 82.) 6, Pharmacological interventions in the treatment and management of schizophrenia. Available from: http://www.ncbi.nlm.nih.gov/books/NBK11670
Ndetei DM, Vadher A. Frequency and clinical significance of delusions across cultures. Acta Psychiatrica Scand 1984;70:73-76.
Neimeyer RA, Mahoney MJ. Constructivism in Psychotherapy. Am Psychol Press, Washington, DC. 1995.
Nestler EJ. An emerging pathophysiology.Nature 1997;358:578-579.
Nestor PG, Kubicki M, Niznikiewicz M, Gurrera RJ, McCarley RW, Shenton ME. Neuro-psychological disturbance in schizophrenia: a diffusion tensor imaging study. Neuro-psychology 2008;22:246-254.
Nestor PG, Kubicki M, Spencer KM, Niznikiewicz M, McCarley RW, Shenton ME. Attentional networks and cingulum bundle in chronic schizophrenia. Schizophr Res 2007;90:308-315.
Newcomer JW. Metabolic considerations in the use of antipsychotic medications: a review of recent evidence. J Clin Psychiatry 2007;68:20-27.
Newton R, Hustig H, Lakshmana R, Lee J, Motamarri B, Norrie P et al. Practical guidelines on the use of paliperidone palmitate in schizophrenia. Curr Med Res Opin 2012;28:559-567.
Niaz OS, Haddad PM. Thirty-five months experience of risperidone long-acting injection in a UK psychiatric service including a mirror-image analysis of in-patient care. Acta Psychiatr Scand 2007;116:36-46.
NICE. Guidelines for antipsychotic medication switches. NHS 2009.
NICE. National Institute for Clinical Excellence. Guidance on the use of newer (atypical) antipsychotic drugs for the treatment of schizophrenia. Nice Technology Appraisal Guidance No. 43. 2012 London.
Nielsen J, Damkier P, Lublin H, Taylor D. Optimizing clozapine treatment. Acta Psychiatr Scand 2011;123:411-422.
Nielsen J, Toft E. The spectrum of cardiovascular disease in patients with schizophrenia. En: Meyer JM, Nasrallah HA (eds). Medical Illness and Schizophrenia 2nd edition. American Psychiatric Publishing; 2009;169-202.
Niendam TA, Jalbrzikowski M, Bearden CE. Exploring predictors of outcome in the psychosis prodrome: implications for early identification and intervention. Neuropsychol Rev 2009;19:280-293.
Niznikiewicz M, Sentón M, Voglmaier M, Nestor P, Dickey Ch, Frumin M et al. Semantic dysfunction in women with schizotypical personality disorder. Am J Psychiatry 2002;159:1767-1774.
Nobler MS, Sackeim HA, Solomou M, Luber B, Devanand DP, Prudic J. EEG manifestations during ECT: Effects of electrode placement and stimulus intensity. Biol Psychiatry 1993;34:321-330.
Nord M, Farde L. Antipsychotic occupancy of dopamine receptors in schizophrenia. CNS Neurosci Ther 2011;17:97-103.
Nordström AL, Nyberg S, Olsson H, Farde L. Positron emission tomography finding of a high striatal D2 occupancy in olanzapine-treated patients. Arch Gen 1998;55:283-284.
Nordström AL, Farde L, Eriksson L, Halldin C. No elevated D2 dopamine receptors in neuroleptic-näïve schizophrenic patients revealed by Positron Emission Tomography and (11 C) N-methylspiperone. Psychiat Res Neuroimag 1995;61:67-83.
Nordström AL, Farde L, Nyberg S. D1, D2 and 5HT2 receptor occupancy in relation to clozapine serum concentration: A PET study schizophrenic patients. Am J Psychiatr 1995;152:1444-1449.
Norman RM, Malla AK. Duration of untreated psychosis: a critical examination of the concept and its importance. Psychol Med 2001;31:381-400.
Novak-Grubic V, Tavcar R. Predictors of noncompliance in males with first-episode schizophrenia, schizophreniform and schizoaffective disorder. Eur Psychiatry 2002;17:148-154.
Novick D, Haro JM, Bertsch J, Haddad PM. Incidence of extrapyramidal symptoms and tardive dyskinesia in schizophrenia: thirty-six-month results from the European schizophrenia outpatient health outcomes study. J Clin Psychopharmacol. 2010;30:531-540.
Nuechterlein KH, Robbins TW, Einat H. Distinguishing separable domains of cognition in human and animal studies: what separations are optimal for targeting interventions? A summary of recommendations from breakout group 2 at the measurement and treatment research to improve cognition in schizophrenia new approaches conference. Schizophr Bull 2005;31(4):870-874.
Nussbaum AM, Stroup TS. Paliperidone for treatment of schizophrenia. Schizophr Bull. 2008;34:419-422.
Nussbaum AM, Stroup TS. Paliperidone palmitate for schizophrenia. Cochrane Database Syst Rev 2012;6:CD008296.
Nyhuis A, Faries D, Ascher-Svanum H, Stauffer V, Kinon B. Predictors of switching antipsy-chotic medications in the treatment of schizophrenia BMC Psychiatry 2010;10:75.
O'Donoghue B, Schäfer MR, Becker J, Papageorgiou K, Amminger GP. Metabolic changes in first-episode early-onset schizophrenia with second-generation antipsychotics. Early Interv Psychiatry. 2013 Aug 22. Doi:10.1111/eip.12083. [Epub ahead of print].
O'Leary DS, Flaum M, Kesler ML, Flashman LA, Arndt S, Andreasen NC. Cognitive correlates of the negative, disorganized, and psychotic symptom dimensions of schizophrenia. J Neuropsychiatry Clin Neurosci 2000;12:4-15.
Obiols JE, Salvador L, Humbert M, Obiols J. Escala para la evaluación del Pensamiento, Lenguaje y Comunicación, Universidad de Barcelona, 1985.
Obradovic M, Mrhar A, Kos M. Cost-effectiveness of antipsychotics for outpatients with chronic schophrenia. Int J Clin Pract 2007;61:1979-1988.
Oehl M, Hummer M, Fleischhacker WW. Compliance with antipsychotic treatment. Acta Psychiatr Scand 2000;(Suppl):83-86.
Oka M, Otsuka K, Yokohama N, Mint J, Hocino K, Niwa S, Liberman P. An evaluation of a Irbid occupational therapy and supported employment program in Japan for persons with schizophrenia. American Journal of Occupational Therapy 2004;58:466-475.
Olfson M, West JC, Wilk JE, Marcus S. Factors affecting the effectiveness of clinical decisions in treating schizophrenia. Program and abstracts of the American Psychiatric Association 156th Annual Meeting, May 17-22, 2003; San Francisco, California. Abstract S28C.
Olin SC, Mednick SA. Risk factors of psychosis: identifying vulnerable populations pre-morbidly. Schizophr Bull 1996;22(2):223-240.
OMS http://www5.who.int/mental_health/main
OMS: Informe sobre la salud en el mundo 2001, Salud mental: nuevos conocimientos nuevas esperanzas. Ginebra Suiza.
OMS: CIE 10. Trastornos mentales y del comportamiento. Descripción clínica y pautas para el diagnóstico. OMS, España; 1992.
Oosthuizen P, Emsley RA, Keyter N, Niehaus DJ, Koen L. Duration of untreated psychosis and outcome in first-episode psychosis. Perspective from a developing country. Acta Psychiatr Scand 2005;111:214-219.
Opler M. Culture and Mental Health. New York: Macmillan, 1959.
Organization WH. The International Classification of Diseases 11th Revision. Geneva 2012 [29-Sep-2012] http://www.who.int/classifications/icd/revision/en/index.html
Ortega-Soto HA, Valencia CM. El tratamiento farmacológico de la esquizofrenia. En: de Ortega H, Valencia M (eds). Esquizofrenia: Estado actual y perspectivas. Colección de libros del Instituto Nacional de Psiquiatría Ramón de la Fuente Muñiz, México, D.F; 2001;349-398.
Ortega Soto HA, Brunner E, de la Torre MP, García Marín J. Inicio de tratamiento con de-canoato de haloperidol en pacientes con esquizofrenia. Psiquiatría y Salud Integral 1995;11:79-83.
Ortega-Soto HA, Gracia S, Imaz B, Pacheco J, Brunner E, Apiquian R, De la Torre M. Validez y Reproductibilidad de una escala para evaluar la depresión en pacientes esquizofrénicos. Salud Mental 1994;17:7-14.
Ortega-Soto HA, Rodríguez MS. Diagnóstico y Clasificación. En: Ortega-Soto HA, Valencia CM (eds). Esquizofrenia. Estado actual y perspectivas. Publicaciones del Instituto Nacional de Psiquiatría Ramón de la Fuente. 2001;33-60.
Ortega-Soto HA. Clozapina. Estado actual del conocimiento. Salud Mental 1993;16:1-2.
Ortega-Soto HA. El síndrome extrapiramidal con el uso de psicofármacos. Psiquiatría (Méx) 1985;1:141-150.
Ortega-Soto HA. Mecanismos de acción de los Neurolépticos. Psiquiatría (Méx) 1986;2:150-160.
Ortega-Soto HA. Niveles séricos de Neurolépticos. Salud Mental 1986;9:30-42.
Ortega-Soto HA. Tratamiento farmacológicode la esquizofrenia. Psicología Iberoamericana 1998;6:4-17.
Ortega-Soto HA, Jasso A, Ceceña G, Hernández CA. La validez y reproducibilidad de dos escalas para evaluar los síntomas extrapiramidales inducidos por neurolépticos. Salud Mental 1991;14:1-5.
Ortega-Soto HA, Paéz AF, Fernández SA et al. El efecto terapéutico de las dosis umbrales de haloperidol: Resultados preliminares. Anales del Instituto Mexicana de Psiquiatría. 1991;2:30-34.
Ortega-Soto HA, Valencia CM (eds). Esquizofrenia. Estado actual y perspectivas. Publicaciones del Instituto Nacional de Psiquiatría Ramón de la Fuente 2001;358-377.
Otani K, Kondo T, Kaneko S. Steady-state serum kinetics of zotepine. Human Psychopharmacol 1992;7:331-336.
Oulis PG, Mavreas VG, Mamounas JM, Stefanis CN. Clinical characteristics of auditory hallucinations. Acta Psychiatr Scand 1995;92:97-102.
Owen C, Tarantello C, Jones M, Tennant C. Repetitively violent patients in psychiatric units. Psychiatr Serv 1998;49:1458-1461.
Owen MJ, Craddock N, Jablensky A. The genetic deconstruction of psychosis. Schizophr Bull 2007;33:905-911.
Ozeki Y, Fujii K, Kurimoto N, Yamada N, Okawa M, Aoki T et al. QTc prolongation and antipsychotic medications in a sample of 1017 patients with schizophrenia. Prog Neuropsychopharmacol Biol Psychiatry 2010;34:401-405.
Pallanti S, Quercioli L, Hollander E. Social anxiety in outpatients with schizophrenia: a relevant cause of disability. Am J Psychiatry 2004;161:53-58.
Palmer BA, Pankratz VS, Bostwick JM. The lifetime risk of suicide in schizophrenia: a reexamination. Arch Gen Psychiatry 2005;62(3):247-253.
Palmer CS, Brunner E, Ruiz-Flores LG, Paez-Agraz F, Revicki DA. A cost-effectiveness clinical decision analysis model for treatment of schizophrenia. Arch Med Res 2002;33:572-580.
Pandina G, Lane R, Gopal S, Gassmann-Mayer C, Hough D, Remmerie B et al. A double-blind study of paliperidone palmitate and risperidone long-acting injectable in adults with schizophrenia. Prog Neuropsychopharmacol Biol Psychiatry 2011;35:218-226.
Papanastasiou E. The prevalence and mechanisms of metabolic syndrome in schizophrenia: a review. Ther Adv Psychopharmacol 2013;3:33-51.
Parellada E. Clinical experience and management considerations with long-acting risperidone. Curr Med Res Opin 2006;22:241-255.
Parker S, French P. Report on Early Detection and Intervention for Young People at Risk of Psychosis. 2007 Http://tinyurl.com/worzyh
Patel NH, Vyas NS, Puri BK, Nijran KS, Al-Nahhas A. Positron emission tomography in schizophrenia: a new perspective. J Nucl Med 2010;51:511-520.
Patel V, Flisher AJ, Hetrick S, McGorry P. Mental health of young people: a global public-health challenge. Lancet 2007;369:1302-1313.
Patterson TL, Bucardo J, McKibbin CL. Development and pilot testing of a new psychosocial intervention for older Latinos with chronic psychosis. Schizophr Bull 2005;31:922-930.
Pauker SG, Kassirer JP. Medical progress-decision analysis. N Engl J Med 1978; 316:250-258.
Paul SM, Extein I, Calil HM et al. Use of ECT with treatment resistant depressed patients at the National Institute of Mental Heath. Am J Psychiatry 1981;138:486-489.
Payne J, Malla A, Norman R, Windell D, Nicole B. Status of first-episode psychosis patients presenting for routine care in a defined catchment area. Can J Psychiatry 2006;51:42-47.
Paz CR, Amarilla AC. Las psicosis cicloides: una propuesta terapéutica. Psicomundo. Consultado el: 24-12-05, en: http://www.herreros.com.ar/melanco/paz.htm
Pedersen D. Estigma y exclusión social en la enfermedad mental: apuntes para el análisis e investigación. Revista de Psiquiatría y Salud Mental "Hermilio Valdizán" 2005;6:3-14.
Pekkala E, Merinder L. Psychoeducation for schizophrenia. Cochrane Database Syst Rev 2002;2: Doi:10.1002/14651858. CD002831.
Penn DL, Mueser KT. Research update on the psychosocial treatment of schizophrenia. Am J Psychiatry 1996;153:607-617.
Peralta V, Cuesta MJ. Subjective experiences in schizophrenia: a critical review. Compr Psychiatry 1994;35:198-204.
Peralta V, Cuesta MJ, de León J. Formal Thought Disorder in Schizophrenia: A Factor Analytic Study. Comprehensive Psychiatry 1992;33:105-110.
Peralta V, Cuesta MJ, Martinez-Larrea A, Serrano JF. Differentiating primary from secondary negative symptoms in schizophrenia: a study of neuroleptic-naive patients before and after treatment. Am J Psychiatry 2000;157(9):1461-1466.
Pereira S, Pinto R. A survey of the attitudes of chronic psychiatric patients living in the community toward their medication. Acta Psychiatr Scand 1997;95:464-468.
Pérez DA. Funcionamiento Psicosocial de personas con esquizofrenia que participan en Programas de Rehabilitación Psicosocial ejecutados por COSAM (Centros Comunitarios de Salud Mental) de la Zona Occidente (Región Metropolitana). Investigación presentada a la Escuela de Psicología de la Pontificia Universidad Católica de Chile para optar al grado académico de Magíster en Psicología Mención Psicología Social-Comunitaria. Informe devolutivo. Ministerio de Salud de Chile. Departamento de Salud Mental. Julio, 2009.
Perez I, Crespo F, Martinez G. Weight gain induced by haloperidol, risperidone and olan-zapine after 1 year: findings of a randomized clinical trial in a drug-naive population. Schizophr Res 2008;99:13-22.
Pérez-Rincón H. Le Mexique. pp. 563-572. En: Postel & Quetel. Histoire de la Psychiatrie. 1994;647.
Perkins DO, Gu H, Boteva K, Lieberman JA. Relationship between duration of untreated psychosis and outcome in first-episode schizophrenia: a critical review and meta-analysis. Am J Psychiatry 2005;162:1785-1804.
Perkins DO, Gu H, Weiden PJ, McEvoy JP, Hamer RM, Lieberman JA. Predictors of treatment discontinuation and medication nonadherence in patients recovering from a first episode of schizophrenia, schizophreniform disorder, or schizoaffective disorder: a randomized, double-blind, flexible-dose, multicenter study. J Clin Psychiatry 2008;69:106-113.
Perlick DA, Rosenheck RA, Kaczynski R, Swartz M, Cañivae JM, Lieberman J. Components and Correlates of Family Burden in Schizophrenia. Psychiatr Serv 2006;57:1117-1125.
Perlstein WM, Dixit NK, Carter CS, Noll DC, Cohen JD. Prefrontal cortex dysfunction mediates deficits in working memory and prepotent responding in schizophrenia. Biol Psychiatry 2003;53:25-38.
Perrault GH, Depoortere R, Morel E, Sanger OJ, Scatton B. Psychopharmacological profile amisulpride: An antipsychotic drug with presynaptic D2/D3 dopamien receptor antagonist activity and limbic selectivity. J. Pharmac Exp Therap 1997;280:73-82.
Pfammatter M, Junghan U, Brenner H. Efficacy of Psychological Therapy in Schizophrenia: Conclusions from Meta-analyses. Schizophr Bull 2006;32:S64-S80.
Phutane VH, Thirthalli J, Muralidharan K, Naveen Kumar C, Keshav Kumar J, Gangadhar BN. Double-blind randomized controlled study showing symptomatic and cognitive superiority of bifrontal over bitemporal electrode placement during electro-convulsive therapy for schizophrenia. Brain Stimul 2013;6(2):210-217. Doi:10.1016/j.brs.2012.04.002. Epub 2012 Apr 23.
Pickar D, Owen RR, Litman RE, Konicki E, Gutierrez R, Rapoport M. Clinical and biologic response to clozapine in patients with schizophrenia. Archives of General Psychiatry 1992;49:345-353.
Pilling S, Bebbington P, Kuipers E, Garety E, Geddes J, Orbach G et al. Psychological treatments in schizophrenia: I. Meta-analysis of family intervention and cognitive behaviour therapy. Psychol Med 2002;32:763-782.
Pilling S, Bebbington P, Kuipers E, Garety E, Geddes J, Orbach G et al. Psychological treatments in schizophrenia: II. Meta-analyses of randomized controlled trials of social skills training and cognitive remediation. Psychol Med 2002;32:783-791.
Pinder RM, Brogden RN, Sawyer PR, Speight TM, Avery GS. Metoclopramide: a review of its pharmacological properties and clinical use. Drugs 1976;12:81-131.
Platt S. Weyman A, Hirsh S, Hewett S. The Social Behaviour Assessment Schedule (Sbas): Ratinale Contents, Soring And Reliability of A New Inteterview Schedule. Social Psychiatry 1980;15:43-55.
Polsky D, Doshi JA, Bauer MS, Glick HA. Clinical trial-based cost-effectiveness analyses of antipsychotic use. Am J Psychiatry 2006;163:2047-2056.
Poluzzi E, Raschi E, Moretti U, De Ponti F. Drug-induced torsades de pointes: data mining of the public version of the FDA Adverse Event Reporting System (AERS). Pharmacoepidemiol Drug Saf 2009;18:512-518.
Pompilli M, Tondo l, Baldessarini RJ. Suicidal risk energing during antidepressant treatment recognition and intervention. Clin Neuropsychiatratry 2005;2:66-72.
Pompilli M, Lester D, Innamorati M, Tatarelli R, Girardi P. Assessment and treatment of suicide risk in schizophrenia. Exp Rev Neurother 2008;8:51-74.
Popovic I, Ravanic D, Popovic V, Vladejic S, Stanojevic A, Stojanovic M. First generation antipsychotics switch with Risperidone in the treatment of chronic schizophrenic patients. Psychiatr Danub 2011;23:384-388.
Portwich P, Barocka A. The concept of negative and positive symptoms in a historical perspective. Fortschr Neurol Psychiatr 1999;67(10):448-455.
Potkin SG, Alphs L, Hsu C, Krishnan KR, Anand R, Young FK, Meltzer H, Green A. Predicting suicidal risk in schizophrenic and schizoaffective patients in a prospective two-year trial. Biol Psychiatry 2003;54:444-452.
Poyurovsky M, Fuchs C, Weizman A. Obsessive-Compulsive disorder in patients with first episode schizophrenia. American Journal Psychiatry. 1999;156:1998-2000.
Poyurovsky M, Isakov V, Hromnikov S. Fluvoxamine treatment of obsessive-compulsive symptoms in schizophrenic patients: an add-on open study. International Clinical Psychopharmacology 1999;14(2):95-100.
Poyurovsky M, Weizman A, Weizman R. Obsessive-compulsive disorder in schizophrenia: Clinical characteristics and treatment. CNS Drugs 2004;18:989-1010.
Practice guideline for the treatment of patients with schizophrenia. American Psychiatric Association 2004. Disponible en: http://www.psych.org/psych_pract/treatg/pg/SchizPG-Complete- Feb04.pdf
Prien RF, Cole JO. High dose chlorpromazine therapy in chronic schizophrenia. Report of national institute of Mental Health - psychopharmacology research branch collaborative study group. Arch Gen Psychiatry 1968;18:482-495.
Prior T, Baker G. Interactions between the cytochrome P450 system and the second-generation antipsychotics. J Psychiatry Neurosci 2003;28:99-112.
Prudic J, Devanand DP, Sackeim HA, Decina P, Kerr B. Relative response of endogenous and non-endogenous symptoms to electroconvulsive therapy. J. Affective Disord. 1989;16:59-64.
Pycock CJ, Kerwin RW, Carter CJ. Effect of lesion of cortical dopamine terminals on sub-sortical dopamine receptors in rats. Nature 1980;286:74-77.
Quiroga H, Rodríguez M, Cardenas G, Vite A, Mata A, Molina J et al. Programas de tratamiento psicosocial para la rehabilitación del paciente mental crónico hospitalizado en México: Descripción, resultados y perspectivas. Rev Mex Psicolog 1986;3(1):44-58.
Quiroga H. La rehabilitación del paciente mental crónico hospitalizado. I Reunión sobre Investigación y Enseñanza. Instituto Mexicano de Psiquiatría 1982;203:21-25.
Rabinovitch M, Bechard-Evans L, Schmitz N, Joober R, Malla A. Early predictors of non-adherence to antipsychotic therapy in first-episode psychosis. Can J Psychiatry 2009;54:28-35.
Raguram R, Raghu T, Vounatsou P, Weiss M. Schizophrenia and the cultural epidemiology of stigma in Bangalore, India. J Nerv Ment Dis 2004;192:734-744.
Raij TT, Valkonen-Korhonen M, Holi M, Therman S, Lehtonen J, Hari R. Reality of auditory verbal hallucinations. Brain 2009;132:2994-3001.
Rajji TK, Ismail Z, Mulsant BH. Age at onset and cognition in schizophrenia: meta-analysis. Br J Psychiatry 2009;195:286-293.
Rami L, Bernardo M, Valdes M, Boget T, Portella MJ et al. Absence of Additional Cognitive Impairment in Schizophrenia Patients During Maintenance Electroconvulsive Therapy. Schizophr Bull 2004;30(1)185-189.
Ramirez J, Garnica R, Boll MC, Montes S, Rios C. Low concentration of nitrite and nitrate in the cerebrospinal fluid from schizophrenic patients: a pilot study. Schizophr Res 2004;68:357-361.
Randolph E, Spencer E, Glynn S, Paz G, Shaner A, Strachan A et al. Behavioral family management in schizophrenia: Outcome of a clinic-based intervention. Br J Psychiatry 1994;164:501-506.
Rapoport JL, Giedd JN, Blumenthal J, Hamburger S, Jeffries N, Fernandez T. Progressive cortical change during adolescence in childhood-onset schizophrenia. A longitudinal magnetic resonance imaging study. Arch Gen Psychiatry 1999;56:649-654.
Rascón D, Valencia M. Los Factores Familiares en la Esquizofrenia Cap. VIII. En: Esquizofrenia estado actual y perspectivas. Colección del Instituto Nacional de Psiquiatría Ramón de la Fuente. 2001;pp 301-348.
Rascón D, Díaz M LR, López J JL. Consecuencias familiares por el cuidado del paciente esquizofrénico. En: Jiménez Guillén R. (Compilador). Familia: una construcción social. Universidad Autónoma de Tlaxcala, Depto de Educación Especializada, Centro Universitario de Estudios para la Familia, 1998;pp 413-429.
Rascón GD, Díaz ML Rosa, Valencia M. Relación entre la emoción expresada y la opinión afectiva de familiares y pacientes esquizofrénicos. Rev Psicología Iberoamericana Nueva Epoca 1998;6(4)56-65.
Rascón G ML. Estudio de familias de pacientes con esquizofrenia. Tesis de doctorado en psicología por investigación; Facultad de Psicología. Universidad Nacional Autónoma de México, Abril 2001.
Rascón ML, Alcántara H, Domínguez T, Casanova L. Las necesidades clínicas y sociales de familiares de personas con esquizofrenia. En: Peña Saint Martin F, León Parra B (Coord.). Medicina Social en México 1. Experiencias, subjetividad y salud.; Ed. EON; ISBN: 978-607-7519-87-4; 2010;pp. 89-104.
Rascón ML, Alcántara H. La familia como instrumento para reducir riesgos en la esquizofrenia Cap. 7. En: Valencia, M (Compilador). Alternativas terapéuticas para la esquizofrenia. Editorial Herder (En prensa); 2012.
Rascón ML, Cámara G, Garcia S, Alcantara H, Sampedro A, Casanova L. Beneficios del Curso Familia a Familia, NAMI (Cartel). Voz Pro Salud Mental y National Alliance on Mental Illnes. Congreso APM, Acapulco Gro. 2009.
Rascón ML, Caraveo J, Valencia M. Trastornos emocionales, físicos y psiquiátricos en los familiares de pacientes con esquizofrenia en México. Rev Invest Clin 2010;62:509-515.
Rascón ML, Gutiérrez LM, Valencia CM, Rodríguez VS. Percepción de los familiares del intento y la ideación suicida en sus parientes con esquizofrenia. Rev Salud Mental 2004;27:44-52.
Rascón-Gasca ML, Díaz-Martínez RL, Ramos-Lira L. La violencia doméstica en familiares de pacientes con esquizofrenia. Gac Méd Méx 2003;139 (4):371-376.
Raskin A, Pelchat R, Sood R, Alphs LD, Levine J. Negative Symptom Assessment of Chronic Schizophrenia Patients. Schizophr Bull 1993;19:627-635.
Ratzoni G, Gothelf D, Brand-Gothhelfld A, Reidman J, Kikinzon I, Gal G. Weight gain associated with olanzapine and risperidona in adolescent patients: a comparative prospective study. J Am Acad Child Adolesc Psychiatry 2002;41:337-343.
Ravanic DB, Pantovic MM, Milovanovic DR, Dukic-Dejanovic S, Janjic V, Ignjatovic DR et al. Long-term efficacy of electroconvulsive therapy combined with different antipsychotic drugs in previously resistant schizophrenia. Psychiatria Danubina 2009;21:179-186.
Ray W, Chung C, Murray K, Hall K, Stein M. Atypical Antipsychotic Drugs and the Risk of Sudden Cardiac Death. N Engl J Med 2009;360:225-235.
Readler TJ, Knable MB, Lafargue T et al. In voto determination of strial dopamine D2 receptor occupancy in patients treated with olanzapine. Psychiatr Res 1999;90:81-90.
Redmond C, Larkin M, Harrop C. The personal meaning of romantic relationships for young people with psychosis. Clin Child Psychol Psychiatry 2010;15:151-170.
Reed R, Harrow M, Herbecer E, Martin E. Executive function in schizophrenia: is it linked to psicosis and poor life function? J Nerv Ment Dis 2002;190 (11):725-732.
Reilly JG, Ayes SA, Ferrier IN. QTc interval abnormalities and psychotropic drug therapy in psychiatric patients. Lancet 2000;335:1048-1052.
Remington G, Chong SA, Kapur S. Distinguishing change in primary and secondary negative symptoms. Am J Psychiatry 1999;156(6):974-975.
Remington GS, Kapur S. D2 and 5HT2 receptor effects on antipsychotics: Bridging basic and clinical findings using PET. J Clin Psychiatry 1999;60(Suppl10):15-19.
Rey J. Cannabis and mental health. Br Med J 2002;325:1183-1184.
Reznik I, Mester R. Genetic factors in clozapine-induced agranulocytosis. Isr Med Assoc J 2000;2:857-858.
Ridgely MS, Goldman HH, Willenbring M. Barriers to the care of persons with dual diagnosis: organizational and financing issues. Schizophr Bull 1990;16:123-132.
Riecher-Rossler A, Gschwandtner U, Aston J, Borgwardt S, Drewe M, Fuhr P et al. The Basel early-detection-of-psychosis (FEPSY)-study-design and preliminary results. Acta Psychiatr Scand 2007;115:114-125.
Riecher-Rössler A, Rössler W, Forstl H, Meise U. Late-onset schizophrenia and late paraphrenia. Schizophren Bulletin 1995;21:345-354.
Ritsner M. The attribution of somatization in schizophrenia patients: a naturalistic follow-up study. J Clin Psychiatry 2003;64(11):1370-1378.
Robinson D, Woerner MG, Alvir JM, Bilder R, Goldman R, Geisler S et al. Predictors of relapse following response from a first episode of schizophrenia or schizoaffective disorder. Arch Gen Psychiatry 1999;56:241-247.
Robinson DG, Woerner MG, Alvir JM, Bilder R, Goldman R, Geisler S, Koreen A, Sheitman B, Chakos M, Mayerhoff D, Lieberman JA. Predictors of relapse following response from a first episode of schizophrenia or schizoaffective disorder. Arch Gen Psychiatry 1999;56(3):241-247.
Robinson DG, Woerner MG, Alvir JM, Geisler S, Koreen A, Sheitman B et al. Predictors of treatment response from a first episode of schizophrenia or schizoaffective disorder. Am J Psychiatry 1999;156:544-549.
Robinson DG, Woerner MG, Alvir JM, Bilder RM, Hinrichsen GA, Lieberman JA. Predictors of medication discontinuation by patients with first-episode schizophrenia and schizoaffective disorder. Schizophr Res 2002;57(2-3):209-219.
Robinson DG, Woerner MG, Delman HM, Kane JM. Pharmacological Treatments for FirstEpisode Schizophrenia. Schizophr Bull 2005;31:705-722.
Robinson DG, Woerner MG, McMeniman M, Mendelowitz A, Bilder RM. Symptomatic and functional recovery from a first episode of schizophrenia or schizoaffective disorder. Am J Psychiatry 2004;161(3):473-479.
Robles Garcia R, Salazar Alvarado V, Paez Agraz F, Ramirez Barreto F. Assessment of drug attitudes in patients with schizophrenia: psychometric properties of the DAI Spanish version. Actas Esp Psiquiatr 2004;32:138-142.
Robles GR, Salazar AV, Páez AF, Ramírez BF. Evaluación de actitudes al medicamento en pacientes con esquizofrenia: propiedades psicométricas de la versión en español del DAI. Actas Español Psiquiatria 2004;32:138-142.
Rocca P, Castagna F, Mongini T. Relative contributions of psychotic symptoms and insight to quality of life in stable schizophrenia. Psychiatry Res 2010;177:71-76.
Roder V, Mueller D, Mueser KT, Brenner H. Integrated psychological therapy (IPT) for schizophrenia. Is it effective? Schizophr Bull 2006;32:S1-S93.
Rodríguez V MS, Brunner RE, Ortega-Soto HA. La percepción de los síntomas extrapi-ramidales por el paciente y sus familiares. Tesis de especialidad. Departamento de Psicología y Salud Mental, Facultad de medicina 1999;UNAM-IMP:4-24
Ronaldson K, Taylor A, Fitzgerald P, McNeil J. Diagnostic characteristics of clozapine-induced myocarditis identified by analysis of 38 cases and 47 controls. J Clin Psychiatr 2010;71(8):976-981.
Rosebush PI, Hildebrand AM, Furlong BG, Mazurek MF. Catatonic syndrome in a general psychiatric inpatient population: Frequency, clinical presentation, and response to lorazepam. J Clin Psychiatry 1990;51:357-362.
Rosen I. The clinical significance of obsessions in schizophrenia. J Ment Sci 1957;103:773-785.
Rosenheck RA, Leslie DL, Doshi JA. Second-generation antipsychotics: cost-effectiveness, policy options, and political decision making. Psychiatr Serv 2008;59:515-520.
Rosenheck RA, Leslie DL, Sindelar J, Miller EA, Lin H, Stroup TS et al. Cost-effectiveness of second-generation antipsychotics and perphenazine in a randomized trial of treatment for chronic schizophrenia. Am J Psychiatry. 2006;163:2080-2089.
Rosenthal D. Genetic theory and abnormal behavior. New York: McGraw Hill; 1970.
Rossi A, Bustini M, Prosperini P, Marinangeli M, Splendiani A, Daneluzzo E, Stratta P. Neuromorphological abnormalities in schizophrenic patients with good and poor outcome. A Psychiatric Scandinav 2000;101(2):161-166.
Rössler W, Salize HJ, Cucchiaro G, Reinhard I, Kerning C. Does the place of treatment influence the quality of life of schizophrenics?. Acta Psychiatrica Scandinav 1999;100(2):142-148.
Roth BL, Craigo SC, Choudhary MS. Binding of typical and atypical antipsychotic agents-to 5-hydroxytryptamine-6 and 5-hydroxytryptamine-7 receptors. J Pharmacol Exp Ther 1992;268:1403-1410.
Roth R, Flashman L, Saykin A, McAllister TH, Vidaver R. Apathy in schizophrenia: reduced frontal lobe volume and neuropsychological deficits. Am J Psychiatry 2004;161:157-159.
Rousseau C. Playing around with a story. Transcult Psychiatry 1999;36(4):447-450.
Rown S. Excess mortality of schizophrenia. A metanalysis. Br J Psychiatry 1997;171:502-508.
Royal Australian and New Zealand College of Psychiatrists Clinical Practice Guidelines for the Treatment of Schizophrenia and Related Disorders. Aust N Z J Psychiatry 2005;39:1-30.
Royal College of Psychiatrists. CR176. The ECT Handbook. (3rd. edition). London: RCP-sych Publications.
Rubinson EP, Asnis GM. Utilización de entrevistas estructuradas para el diagnóstico. En: Wetzler S (ed). Medición de las enfermedades mentales: Evaluación psicométrica para los clínicos. Ancora. Barcelona; 1991:41-63.
Ruhrmann S, Schultze-Lutter F, Salokangas RK, Heinimaa M, Linszen D, Dingemans P et al. Prediction of psychosis in adolescents and young adults at high risk: results from the prospective European prediction of psychosis study. Arch Gen Psychiatry 2010;67:241-251.
Rummel C, Hansen WP, Helbig A, Pitschel-Walz GP, Kissling W. Peer-to-peer psychoeduca-tion in Schizophrenia: A new approach. J Clin Psychiatry 2005;66:1580-1585.
Rummel-Kluge C, Kissling W. Psychoeducation in schizophrenia: new developments and approaches in the field. Curr Opin Psychiatry 2008;21:168-172.
Rummel-Kluge C, Komossa K, Schwarz S, Hunger H, Schmid F, Kissling W et al. Second-generation antipsychotic drugs and extrapyramidal side effects: a systematic review and meta-analysis of head-to-head comparisons. Schizophr Bull 2012;38:167-177.
Rummel-Kluge C, Komossa K, Schwarz S, Hunger H, Schmid F, Lobos CA et al. Head-to-head comparisons of metabolic side effects of second generation antipsychotics in the treatment of schizophrenia: a systematic review and meta-analysis. Schizophr Res 2010;123:225-233.
Rupniak NM, Jenner P, Marsden CD. Acute dystonia induced by neuroleptic drugs. Psychopharmacology (Berl) 1986;88:403-419.
Ryan P. Un programa experimental psicosocial para pacientes agudos hospitalizados. I Reunión sobre Investigación y Enseñanza. Instituto Mexicano de Psiquiatría 1982;196-202.
Ryan P, Valencia M, Otero BR, Núñez M, González N, Rascón ML. Alternativas para el hospitalismo. Salud Mental 1982;5(3):8-15.
Sachdev P. The development of the concept of akathisia: A historical overview. Schizophr Res 1995;161:33-45.
Sackeim HA. Central issues regarding the mechanisms of action of electroconvulsive therapy: Directions for future research. Psychopharmacol Bull. 1994;30 (3):281-308.
Sackeim HA, Prudic J, Devanand DP, Decina P, Kerr B, Malitz S. The impact of medication resistance and continuation pharmacotherapy on relapse following response to elec-troconvulsive therapy in major depression. J Clin Psychopharmacol 1990;10:96-104.
Sadock BJ, Sadock VA. Kaplan and Sadock's Synopsis of Psychiatry. 10th ed. Philadelphia: Lippincott, Williams & Wilkins; 2007.
Sainfort F, Becker M, Diamond R. Judgments of quality of life of individuals with severe mental disorders: patients self-report versus provider perspectivas. Am J Psychiatry 1996;153:497-502.
Sajatovic M, Meltzer HY. The effect of short-term electroconvulsive treatment plus neuro-leptics in treatment resistant schizophrenia and schizoaffective disorder. Convuls Ther 1993;9:167-175.
Sala M, Vicentini A, Brambilla P, Montomoli C, Jogia JR, Caverzasi E et al. QT interval prolongation related to psychoactive drug treatment: a comparison of monotherapy versus polytherapy. Ann Gen Psychiatry 2005;4:1-6.
Salgado-Pineda P, Caclin A, Baeza I, Junque C, Bernardo M, Blin O et al. Schizophrenia and frontal cortex: where does it fail? Schizophr Res 2007;91:73-81.
Sampson S, Mansour M, Maayan N, Soares-Weiser K, Adams CE. Intermittent drug techniques for schizophrenia. Cochrane Database Syst Rev 2013 Jul 20;7:CD006196.
Samtani MN, Gopal S, Gassmann-Mayer C, Alphs L, Palumbo JM. Dosing and switching strategies for paliperidone palmitate: based on population pharmacokinetic modelling and clinical trial data. CNS Drugs 2011;25:829-845.
Sanchez MA, Mares ML. Modelo de intervención multifamiliar y unifamiliar con pacientes esquizofrénicos. Psicología Iberoamericana 1998;6:34-39.
Sandoz Pharmaceuticals Company. Clozaril (Clozapine) Treatment Trends 1995;4:1-4.
Sarkar P, Andrade C, Kapur B, Das P, Sivaramakrishna Y, Harihar C et al. An exploratory evaluation of ECT in haloperidol-treated DSM-IIIR schizophreniform disorder. Convuls Ther 1994;10:271-278.
Sartorius N, Jablensky A, Korten A, Ernberg G, Anker M, Cooper JE, Day R. Early manifestations and first-contact incidence of schizophrenia in different cultures. Psychological Medicine 1986;16:909-928.
Saugstad LF. Are neurodegenerative disorder and psychotic manifestations avoidable brain dysfunctions with adequate dietary omega-3? Nutr Health 2006;18:203-215.
Sawa A, Snyder SH. Schizophrenia. Diverse Approaches to a Complex Disease. Science 2002;296:692-695.
Scott AIF. College guidelines on electroconvulsive therapy: an update for prescribers. Adv Psychiatric Treat 2005;11:150-156.
Scharfetter C. Dissociation and schizophrenia. Schizophrenias - a dissociative nosopoietic construct? Fortschr Neurol Psychiatr 1998;66(11 ):520-523.
Schmauss M, Sacchetti E, Kahn JP, Medori R. Efficacy and safety of risperidone long-acting injectable in stable psychotic patients previously treated with oral risperidone. Int Clin Psychopharmacol 2007;22:85-92.
Schooler E, Caudill W. Symptomatology in Japanese and American schizophrenics. Ethnology 1964;3:172-178.
Schooler N, Keith S, Severe J, Matthews S, Bellack A, Glick I et al. Relapse and rehospitalization during maintenance treatment of schizophrenia: The effects of dose reduction and family treatment. Arch Gen Psychiatry 1997;54:453-463.
Schooler N. Relapse Prevention and Recovery in the Treatment of Schizophrenia. J Clin Psychiatry 2006;67:19-23.
Schreier A, Wolke D, Thomas K. Prospective study of peer victimization in childhood and psychotic symptoms in a non clinical population at age 12 years. Arch Gen Psychiatry 2009;66:527-536.
Schultze-Lutter F, Ruhrmann S, Hoyer C, Klosterkotter J, Leweke FM. The initial prodrome of schizophrenia: different duration, different underlying deficits? Compr Psychiatry 2007;48:479-488.
Schwarz C, Volz A, Li C, Leucht S. Valproate for schizophrenia. Cochrane Database Syst Rev. 2008 Jul 16;(3):CD004028. Doi:10.1002/14651858.CD004028.pub3.
Sciarretta A, Piazzi G. Long-term safety of ziprasidone in schizophrenic patients: an open trial. Eur Rev Med Pharmacol Sci 2012;16:2113-2119.
Seeman P, Lee T, Chau-Wong M, Wong K. Antipsychotic drug doses and neuroleptic/do-pamine receptors. Nature 1976;261:717-719.
Seeman P. Atypical Antipsychotics: Mechanism of Action. Can J Psychiatr 2002;47:27-38.
Sellwood W, Barrowclough C, Tarrier N, Quinn J, Mainwaring J, Lewis S. Needs-based cognitive-behavioural family intervention for careers of patients suffering from schizophrenia: 12-month follow-up. Acta Psychiatr Scand 2001;104:346-355.
Sendi PP, Craig BA, Pfluger D, Gafni A, Bucher HC. Systematic validation of disease models for pharmacoeconomic evaluations. Swiss HIV Cohort Study. J Eval Clin Pract 1999;5:283-295.
Sepúlveda J, Torres RR. Experiencias de Psiquiatría comunitaria en Chile. Monografía del Curso de Gestión en Psiquiatría y salud mental. Dirección de Posgrado de la Universidad de Santiago de Chile; 2001.
Shaner A, Eckman T, Roberts LJ, Fuller T. Feasibility of a skills training approach to reduce substance dependence among individuals with schizophrenia. Psychiatr Serv 2003;54:1287-1289.
Sharma ND, Rosmann HS, Padhi ID, Tisdale JE. Torsades de pointes associated with intravenous haloperidol in critically ill patients. Am J Cardiol 1998;81:238-240.
Shean G. Evidence-Based Psychosocial Practices and Recovery from Schizophrenia. Psychiatry 2009;72:307-320.
Sheitman BB, Lieberman JA. The natural history and patholophysiology of treatment resistant schizophrenia. J Psychiatr Research 1998;32, 143-150.
Shenton ME, Dickey CC, Frumin M, McCarley RW. A review of MRI findings in schizophrenia. Schizophrenia Res 2001;49:1-52.
Shepherd M, Watt D, Falloon I, Smeeton N. The natural history of schizophrenia: a five-year follow-up study of outcome and prediction in a representative sample of schizophrenics. Psychol Med Monogr 1989;15(Suppl):1-46.
Shern D, Tsemberis S, Anthony W, Novell A, Richmond L, Felton Ch, Winarski J, Cohen M. Serving street-dwelling individuals with psychiatric disabilities: outcomes of a psychiatric rehabilitation clinical trial. Am J Public Health 2000;90:1873-1878.
Shim G, Kang DH, Choi JS, Jung MH, Kwon SJ, Jang GE et al. Prospective outcome of early intervention for individuals at ultra-high-risk for psychosis. Early Interv Psychiatry 2008;2:277-284.
Siever L, Davis K. The pathophysiology of schizophrenia disorders: perspectives from the spectrum. Am J Psychiatry 2004;161:398-413.
SIGN. Scotish Intercollegiate Guidelines Network (SIGN) 2008.
Silver H, Feldman P, Bilker W, Gur R. Working memory déficit as a core neuropsychological dysfunction in schizophrenia. Am J Psychiatry 2003;160:1809-1816.
Singh V, Vijapurkar U, Robb A. Efficacy, safety and tolerability of paliperidone ER in adolescent patients with schizophrenia. Poster presented at: 65th Annual Meeting of the Society of Biological Psychiatry. New Orleans, LA. May 20-22, 2010.
Sipos A, Rasmussen F, Harrison G, Tynelius P, Lewis G, Leon DA et al. Paternal age and schizophrenia: a population based cohort study. BMJ 2004;32:1070-1075.
Siris SG, Addington D, Azorin JM, Falloon IR, Gerlach J, Hirsch SR. Depression in schizophrenia: recognition and management in the USA. Schizophr Res 2001;47:185-197.
Skarsfeldt T. Differential effects of repeated administration of novel antipssychotic drugs on the activity of midbrain dopamine neurons in the rat. Eur J Pharmacol 1995;281:289-294.
Small JG, Klapper MH, Kellams JJ, Miller MJ, Milstein V, Sharpley PH et al. Electrocon-vulsive treatment compared with lithium in the management of manic states. Arch Gen Psychiatry 1988;45:727-732.
Small JG. Efficacy of electroconvulsive therapy in schizophrenia, mania and other disorders. I Schizophrenia. Convulsive Ther 1985;1:263-270.
Smith ML, Gene V, Miller, TI. The Benefits of Psychotherapy. The Johns Hopkins University Press 1980.
Sociedad Española de Psiquiatría. Consejo español sobre la terapia electroconvulsiva (TEC) 1999.
Solomon P, Draine J, Mannion E, Meisel M. Increased contact with community mental health resources as a potential benefit of family education. Psychiatr Serv 1998;49:333-339.
Sommer I, Ramsey N, Kahn R, Aleman A, Bouma A. Handedness, language lateralisation and anatomical asymmetry in schizophrenia: meta-analysis. Br J Psychiatry 2001;178:344-351.
Sorensen SV. Technical appendix for "The health and economic benefits of treating schizophrenia model". Technical Appendix prepared for Pfizer. MEDTAP International 2003;A2:1875.
Sota S, Shimodera S, Kii M, Okamura K, Suto K, Suwaki M et al. Effect of a family psycho-educational program on relatives of schizophrenia patients. Psychiatry Clin Neurosci 2008;62:379-385.
Soyka M, Wegner U, Moeller HJ. Risperidone in treatment-refractary chronic alcohol hallucinosis. Pharmacopsychiatry 1997;30:135-136.
Spivak B, Mester R, Abesgaus J, Wittenberg N, Adlersberg S, Gonen N et al. Clozapine treatment for neuroleptic-induced tardive dyskinesia, parkinsonism, and chronic akathisia in schizophrenic patients. J Clin Psychiatry 1997;58:318-322.
Sramek JJ, Mack RJ, Awni W, Hourani J, Jhee SS, Barto S et al. Two rapid-dose titrations of sertindole in patients with schizophrenia. J Clin Psychopharmacol 1997;17:419-422.
Stahl SM, Morrissette DA, Citrome L, Saklad SR, Cummings MA, Meyer JM et al. Meta-guidelines for the management of patients with schizophrenia. CNS Spectr 2013;18:150-162.
Stanford AD, Sharif Z, Corcoran C, Urban N, Malaspina D, Lisanby SH. rTMS strategies for the study and treatment of schizophrenia: a review. Int J Neuropsychopharmacol 2008;11:563-576.
Stark A, Scott J. A review of the use of clozapine levels to guide treatment and determine cause of death. Aust N Z J Psychiatry 2012;46:816-825.
Stip E, Abdel-Baki A, Bloom D, Grignon S, Roy MA. Long-acting injectable antipsychotics: an expert opinion from the Association des medecins psychiatres du Quebec. Can J Psychiatry 2011;56:367-376.
Stöllberger C, Huber JO, Finsterer J. Antipsychotic drugs and QT prolongation. Int Clin Psychopharmacology 2005;20:243-251.
Straub RE, MacLean CJ, O'Neill FA, Burke J, Murphy B, Duke F et al. A potential vulnerability locus for schizophrenia on chromosome 6p24-22: evidence for genetic heterogeneity. Nat Genet 1995;11:287-293.
Strauss ME, Buchanan RW, Hale J. Relations between attentional deficits and clinical symptoms in schizophrenic outpatients. Psychiatry Res 1993;47:205-213.
Stroup TS, Geddes JR. Randomized controlled trials for schizophrenia: study designs targeted to distinct goals. Schizophr Bull 2008;34:266-274.
Stroup TS, Lieberman JA, McEvoy JP, Swartz MS, Davis SM et al. Effectiveness of olanzapine, quetiapine, risperidone, and ziprasidone in patients with chronic schizophrenia following discontinuation of a previous atypical antipsychotic. Am J Psychiatry 2006;163:611-622.
Stroup TS, Lieberman JA, McEvoy JP. Effectiveness of olanzapine, quetiapine, and rispe-ridone in patients with chronic schizophrenia after discontinuing perphenazine: a CATIE study. Am J Psychiatry 2007;164:415-427.
Susser E, Neugebauer R, Hoek HW, Brown AS, Lin S, Labovitz D et al. Schizophrenia after prenatal famine. Arch Gen Psychiatry 1996;53:25-31.
Swainston Harrison T, Perry CM. Aripiprazole: a review of its use in schizophrenia and schizoaffective disorder. Drugs 2004;64:1715-1736.
Swank M, Dixon L. Family psychoeducation as an evidence-base practice. CNS Spectr 2004;9:905-912.
Swartz MS, Stroup TS, McEvoy JP, Davis SM, Rosenheck RA, Keefe RS et al. What CATIE found: results from the schizophrenia trial. Psychiatr Serv 2008;59:500-506.
Sweeney JA, Haas GL, Keilp JG, Long M. Evaluation of the stability of neuropsychological functioning after acute episodes of schizophrenia: one-year followup study. Psychiatry Res 1991;38:63-76.
Swerdlow NR. Are we studying and treating schizophrenia correctly?. Schizophr Res 2011;130:1-10.
Szmukler G, Herrman H, Colusa S, Benson A, Bloch S. A controlled trial of a counseling intervention for caregivers of relatives with schizophrenia. Soc Psychiatry Psychiatr Epidemiol 1996;31:149-155.
Szmukler Gi, Burgers P. Caring for relatives with serious mental illness: The Experiences of caregiving inventory. Soc Psychiatry Psychiatr Epidemiol 1996;31:137-148.
Tai S, Turkington D. The evolution of cognitive behavior therapy for schizophrenia: Current practice and recent developments. Schizophr Bull 2009;35:865-873.
Takeuchi H, Suzuki T, Uchida H, Watanabe K, Mimura M. Antipsychotic treatment for schizophrenia in the maintenance phase: a systematic review of the guidelines and algorithms. Schizophr Res. 2012;134:219-225.
Tandon R, Nasrallah HA, Keshavan MS. Schizophrenia, "just the facts" 4. Clinical features and conceptualization. Schizophr Res 2009;110:1-23.
Tandon R, Nasrallah HA. Subjecting meta-analyses to closer scrutiny: Little support for differential efficacy among secondgeneration antipsychotics at equivalent doses. Arch Gen Psychiatry 2006;63:935-937.
Tandon R. Antipsychotics in the treatment of schizophrenia: an overview. J Clin Psychiatry 2011;72:4-8.
Tandon R. The Nosology of Schizophrenia: Toward DSM-5 and ICD-11. Psychiatr Clin N Am 2012;35:557-569.
Tarabar AF, Hoffman RS, Nelson L. Citalopram overdose: late presentation of torsades de pointes (TdP) with cardiac arrest. J Med Toxicol 2008;4:101-105.
Tarrier N, Barrowclough C, Vaughn C, Bamrah JS, Porceddu K, Watts W et al. The community management of schizophrenia: A controlled trial of a behavioural intervention with families to reduce relapse. Br J Psychiatry 1988;153:532-542.
Tarrier N, Barrowclough C. Family intervention in schizophrenia and their long-term outcomes. Internat J Ment Health 1995;24:38-53.
Tarrier N, Haddock G, Barrowclough C. Training and dissemination: Research to practice in innovative psychosocial treatments for schizophrenia. Cap. 12. In: Wylkes T, Tarrier N, Lewis S (eds). Outcome and innovation in psychological treatment of schizophrenia. John Wiley & Sons; 1998.
Tarsy D. Neuroleptic-induced extrapyramidal reactions: classification, description, and diagnosis. Clin Neuropharmacol 1983;6:S9-S26.
Taylor D. Psychopharmacology and adverse effects of antipsychotic long-acting injections: a review. Br J Psychiatry 2009;52(Suppl):S13-S19.
Tharyan P, Adams CE. Electroconvulsive therapy for schizophrenia. Cochrane Database Syst Rev. 2005 Apr 18;(2):CD000076.
Thirthalli J, Vivek H, Muralidharan K, Channaveerachari NK, Bharat M, Prashant B et al. Does catatonic schizophrenia improve faster with electroconvulsivetherapy than other subtypes of schizophrenia? W J Biol Psychiatry 2009;10:772-777.
Thomas H, Dalman C, David A, Gentz J, Lewis G, Allebeck P. Obstetric complications and risk of schizophernia. Effect of gender, age at diagnosis and maternal history of psychosis. Br J Psychiatry 2001;179:409-414.
Thornicroft G, Sttathdee G, Phelan M. Rationale and design: PRISM psychosis study I. Br J Psychiatry 1998;173:363-370.
Thornicroft G, Susser E. Evidence-based psychotherapeutic interventions in the community care of schizophrenia. Br J Psychiatry 2001;176:2-4.
Thorup A, Petersen L, Jeppesen P, Ohlenschlaeger J, Christensen T, Krarup G et al. Integrated treatment ameliorates negative symptoms in first episode psychosis-results from the Danish OPUS trial. Schizophr Res 2005;79:95-105.
Tibbo P, Warneke L. Obsessive-compulsive disorder in schizophrenia: epidemiologic and biologic overlap. J Psychiatry Neurosc 1999;24:15-24.
Tiihonen J, Haukka J, Taylor M, Haddad PM, Patel MX, Korhonen P. A nationwide cohort study of oral and depot antipsychotics after first hospitalization for schizophrenia. Am J Psychiatry 2011;168:603-609.
Tiihonen J, LönnqvistJ, Wahlbeck K. 11-year follow-up of mortality in patient with schizophrenia: a population-based cohort study (FIN1 study). Lancet 2009;374:620-627.
Tiihonen J, Walhbeck K, Lönnqvist J, Klaukka T, Ioannidis JP, Volavka J et al. Effectiveness of antipsychotic treatments in a nationwide cohort of patients in community care after first hospitalisation due to schizophrenia and schizoaffective disorder: observational follow-up study. BMJ 2006;333:224.
Tohen M, Strakowski SM, Zarate C Jr, Hennen J, Stoll AL, Suppes T et al. The McLean-Harvard first-episode project: 6-month symptomatic and functional outcome in affective and nonaffective psychosis. Biol Psychiatry 2000;48:467-476.
Tollefson GD, Beasley CM, Tran PV, Street JS, Krueger JA, Tamura RN et al. Olanzapine versus haloperidol in the treatment of schizophrenia and schizoaffective and schi-zophreniform disorders: results of an international collaborative. Am J Psychiatry 1997;154:457-465.
Toren P, Tatner S, Laor N, Weizman A. Benefit-risk assessment of atypical antipsychotics in the treatment of schizophrenia and comorbid disorders in children and adolescents. Drug Saf 2004;27:1155-1156.
Torrey EF, Torrey BB, Burton-Bradley BG. The epidemiology of schizophrenia in Papua New Guinea. Am J Psychiatry 1974;131:576-578.
Trainor JN, Morell-Bellai TL, Ballantyne R, Boydell KM. Housing for people with mental illnesses: a comparison of models and an examination of the growth of alternating housing in Canada. Can J Psychiatry 1993;38:494-501.
Tran PV, Dellva MA, Tollefson GD, Beasley CM, Potvin JH, Kiesler GM. Extrapyramidal symptoms and tolerability of olanzapine versus haloperidol in the acute treatment of schizophrenia. J Clin Psychiatry 1997;58:205-211.
Tran PV, Hamilton SH, Kuntz AJ, Potvin JH, Andersen SW, Beasley CM. Double-blind comparison of olanzapine versus risperidone in the treatment of schizophrenia and other psychotic disorders. J Clin Psychopharmacol 1997;17:407-418.
Tsang WH. Social skills training to help mentally ill persons find and keep a job. Psychiatr Serv 2001;52:891-894.
Tsuang J, Fong TW. Treatment of patients with schizophrenia and substance abuse disorders. Curr Pharm Des 2004;10:2249-2261.
Tsuang M, Stone W, Faraone S. Genes, environment and schizophrenia. Br J Psychiatry 2001;178:18-24.
Tumkaya S, Karadag F, Oguzhanoglu NK, Tekkanat C, Varma G, Ozdel O et al. Schizophrenia with obsessive-compulsive disorder and obsessive-compulsive disorder with poor insight: a neuropsychological comparison. Psychiatry Res 2009;165:38-46.
Turkington D, Kingdon D, Turner T. Effectiveness of a brief cognitive-behavioural therapy intervention in the treatment of schizophrenia. Br J Psychiatry 2002;180:523-527.
Turkington D, Morrison AP. Cognitive Therapy for Negative Symptoms of Schizophrenia. Arch Gen Psychiatry 2012;69:119-120.
Twamley E, Jeste D, Lehman A. Vocational rehabilitation in schizophrenia and other psychotic disorders: a literature review and meta-analysis of randomized controlled trials. J Nerv Ment Dis 2003;191:515-523.
Uchida H, Takeuchi H, Graff-Guerrero A, Suzuki T, Watanabe K, Mamo DC. Dopamine D2 receptor occupancy and clinical effects: a systematic review and pooled analysis. J Clin Psychopharmacol 2011;31:497-502.
Uçok A, Cakr S. Electroconvulsive therapy in first-episode schizophrenia. J ECT 2006;22:38-42.
Uribe CA. El ritual y la "locura": Psiquiatría y cultura en Colombia. Rev Col Psiquiatría 1998;27:40.
Uribe CA. La controversia por la cultura en el DSMIV. Rev Col Psiquiatría 2000;29:345-365.
Uzun O, Cansever A, Basoglu C, Ozsahin A. Smoking and substance abuse in outpatients with schizophrenia: a 2-year follow-up study in Turkey. Drug Alcohol Depend 2003;70:187-192.
Vahia IV, Palmer BW, Depp C, Fellows I, Golshan S, Kraemer HC et al. Is late-onset schizophrenia a subtype of schizophrenia? Acta Psychiatrica Scand 2010;22:414-426.
Valencia CM. Trastornos mentales y problemas de salud mental: Día mundial de la salud mental 2007. Salud Mental 2007;30:75-80.
Valencia M, Diaz A, Juárez F. Integration of pharmacological and psychosocial treatment for schizophrenia: the case of a developing country proposal. En: Zhu H, Markowitz JS (eds). Pharmacotherapy. InTech Publishers (En Prensa); 2012.
Valencia M, Lara MC, Rascón ML, Ortega H. La importancia de los tratamientos farmacológico y psicosocial de los pacientes con esquizofrenia. Rev Latinoam Psiquiat 2002;2:6-21.
Valencia M, Liberman RP, Rascón ML, Juárez F. Capítulo 1. Habilidades psicosociales para la esquizofrenia. En: Valencia M (Compilador). Alternativas terapéuticas para la esquizofrenia. Editorial Herder (En Prensa); 2012.
Valencia M, Ortega H, Rascón ML, Gómez L. Evaluación de la combinación de los tratamientos psicosocial y farmacológico en pacientes con esquizofrenia. Actas Espan Psiquiat 2002;30:358-369.
Valencia M, Ortega H. El tratamiento psicosocial en los pacientes con esquizofrenia. En: Ortega H, Valencia M (eds). Esquizofrenia: Estado Actual y Perspectivas. Colección de libros del Instituto Nacional de Psiquiatría Ramón de la Fuente Muñiz, México, D.F. 2001;399-454.
Valencia M, Ortega-Soto H, Rodríguez M, Gómez L. Estudio comparativo de consideraciones clínicas y psicoterapéuticas en el tratamiento biopsicosocial de la esquizofrenia. Primera parte. Salud Mental 2004;27:47-53.
Valencia M, Otero BR, Rascón ML. Un modelo de intervención clínica en un hospital mental. Acta Psiquiatr Psicol Am Lat 1986;32:41-51.
Valencia M, Rascón ML, Juárez F, Escamilla R, Saracco R, Liberman RP. Application in Mexico of psychosocial rehabilitation with schizophrenia patients. Psychiatry 2010;73:248-263.
Valencia M, Rascón ML, Juárez F, Murow E. A psychosocial skills training approach in Mexican out-patients with schizophrenia. Psychol Med 2007;37:1393-1402.
Valencia M, Rascón ML, Otero R, Ryan P. Descripción de la conducta de pacientes Psiquiátricos hospitalizados. Salud mental 1987;10:81-89.
Valencia M, Rascón ML, Quiroga H. Aportaciones de la investigación respecto al tratamiento psicosocial y familiar de pacientes con esquizofrenia. Salud mental 2003;26:1-18.
Valencia M, Rascón ML. Abordaje psicoterapéutico de la esquizofrenia en pacientes agudos y crónicos. Rev Iberoamerican Psicol 1998;8:18-33.
Valencia M, Rojas E, González C, Ramos L, Villatoro J. Evaluación del funcionamiento psicosocial en pacientes de un centro de salud. Rev Sal Púb Méx 1989;31:674-687.
Valencia M, Saldivar H, Rivera G. 18-month follow-up of patients with schizophrenia. Salud Pública Mex 1994;36:662-669.
Valencia M. El hospital mental como instrumento terapéutico: El rol del psicólogo en la práctica clínica institucional. Rev Mex Psicol 1991;8:99-107.
Valencia M. El manejo comunitario de la esquizofrenia. En: Ortega H, Valencia M (eds). Esquizofrenia: Estado actual y perspectivas. Colección de libros del Instituto Nacional de Psiquiatría Ramón de la Fuente Muñiz. México, D.F. 2001;547-607.
Valencia M. Formulación de principios de tratamiento y rehabilitación del paciente psicótico. Rev Mex Psicol 1986;3:37-43.
Valencia M. Funcionamiento psicosocial en pacientes con esquizofrenia: treinta meses de seguimiento comunitario. Rev Salud Mental 1997;20:28-37.
Valencia M. Manejo psicosocial del paciente esquizofrénico. Rev Psiquiatría 1996;12:72-86.
Valencia M. Programa de intervención psicosocial para pacientes esquizofrénicos crónicos. Rev Salud Mental 1999;22:128-137.
Valencia M. Tratamiento psicosocial en pacientes esquizofrénicos del Instituto Mexicano de Psiquiatría. Salud Mental 1999;2:31-40.
Valencia M. Un programa de tratamiento psicosocial para pacientes psicóticos agudos. Rev Psiquiatría 1988;12:72-86.
Valenstein M, Blow FC, Copeland LA, McCarthy JF, Zeber JE, Gillon L et al. Poor anti-psychotic adherence among patients with schizophrenia: medication and patient factors. Schizophr Bull 2004;30:255-264.
Valenstein M, Copeland LA, Owen R et al. Adherence assessments and the use of depot antipsychotics in patients with schizophrenia. J Clin Psychiatry 2001;62:545-561.
Vallina FO, Lemos GS. Dos décadas de intervenciones familiares en la esquizofrenia. Psicothema 2000;12:671-681.
Van den Anker JN. Developmental pharmacology. Dev Dis Res Rev. 2010;16:233-238.
Van der Stelt O, Frye J, Lieberman J, Belger A. Impaired P3 generation reflects high-level and progressive neurocognitive dysfunction in schizophrenia. Arch Gen Psychiatry 2004;61:237-248.
Van Harten PN, Hoek HW, Kahn RS. Acute dystonia induced by drug treatment. BMJ 1999;319:623-626.
Van Noord C, Straus S, Sturkenboom M, Hofman A, Aarnoudse AJ, Bagnardi V et al. Psychotropic drugs associated with corrected QT interval prolongation. J Clin Psychopharmacology 2009;29:9-15.
Van Os J, Bak M, Hanssen M, Biji RV, de Graaf R, Verdoux H. Cannabis use and psychosis: A longitudinal population-based study. Am J Epidemiol 2002;156:319-327.
Van Putten T, May PR, Marder SR, Wittmann LA. Subjective response to antipsychotic drugs. Arch Gen Psychiatry 1981;38:187-190.
Varma VK. Transcultural perspective on schizophrenia: Epidemiology, manifestations and outcome. Transcultural Psychiatry Section. World Psychiat Assoc 2000;18(1).
Vaughn C, Doyle M, McConaghy N, Blascynski A, Fox A, Tarrier N. The Sidney intervention trial: A controlled trial of relatives counselling to reduce schizophrenic relapse. Soc Psychiatry Psychiatr Epidemiol 1992;27:16-21.
Vaughn CE, Snyder KS, Jones S, Freeman WB, Faloon IR. Family Factors In Schizophrenic Relapse: Replication In California of British Research in E.E. Arch Gen Psychiatry 1984;41:1169-1177.
Vázquez B, Herrero CS, Gaite L. La entrevista estructurada en Psiquiatria. Rev. Asoc. Esp. Neuropsiq 1993;13:29-37.
Vella D. Comorbidity in Psychiatry. Psycopathol 2000;1:46-52.
Velligan DI, Kern R, Gold JM. Cognitive rehabilitation for schizophrenia and the putative role of motivation and expectancies. Schizophr Bull 2006;32:474-485.
Velthorst E, Nieman DH, Becker HE, van de Fliert R, Dingemans PM, Klaassen R et al. Baseline differences in clinical symptomatology between ultra high risk subjects with and without a transition to psychosis. Schizophr Res 2009;109:60-65.
Verdoux H, Lengronne J, Liraud F, Gonzales B, Assens F, Abalan F et al. Medication adherence in psychosis: predictors and impact on outcome. A 2-year follow-up of first-admitted subjects. Acta Psychiatr Scand 2000;102:203-210.
Verduzco FW, Escobedo IO, Anaya GP. Estudio de costos de hospitalización por Esquizofrenia. Instituto Mexicano del Seguro Social, citado Mar 2006. Disponible en: www.imss.gob.mx
Veser FH, Veser BD, McMullan JT, Zealberg J, Currier GW. Risperidone versus haloperidol, in combination with lorazepam, in the treatment of acute agitation and psychosis: a pilot, randomized, double-blind, placebo-controlled trial. J Psychiatr Pract 2006;12:103-108.
Vesterager L, Christensen T, Olsen BB, Kraup G, Forchhammer HB, Melau M et al. Cognitive training plus a comprehensive psychosocial programme (OPUS) versus the comprehensive psychosocial programme alone for patients with first-episode schizophrenia (the NEUROCOM trial): A study protocol for a centrally randomized, observer-blinded multicentre clinical trial. Bio Med Central 2011;12:1-9.
Viesca-Treviño C. Usos de las plantas medicinales mexicanas. Arqueología mexicana, 1999;7:30-35.
Vieweg WV, Wood MA, Fernandez A, Beatty-Brooks M, Hasnain M, Pandurangi AK. Proarrhythmic risk with antipsychotic and antidepressant drugs: implications in the elderly. Drugs Aging 2009;26:997-1012.
Vieweg WV, Wood MA. Tricyclic antidepressants, QT interval prolongation, and torsade de pointes. Psychosomatics 2004;45:371-377.
Villamil SV, Estrada GJ, López FM. Experiencia de un modelo de atención primaria en salud mental (Fase piloto) Psiquiatría 2006;22:7-12.
Villamil SV, Valencia CM, Diaz ML, Medina M, Juárez F. Funcionamiento psicosocial de pacientes esquizofrénicos de acuerdo con su consumo de alcohol. Salud Mental 2005;28:40-48.
Villari V, Rocca P, Fonzo V, Montemagni C, Pandullo P, Bogetto F. Oral risperidone, olan-zapine and quetiapine versus haloperidol in psychotic agitation. Prog Neuro Psychopharmacol Biol Psychiatry 2008;32:405-413.
Villaseñor Bayardo SJ, Baena Zúñiga A, Virgen Montelongo R, Aceves Pulido MP, Moreno M, González IP. La participación de la familia del paciente en la hospitalización psiquiátrica de "Puertas Abiertas". Un modelo de atención etnopsiquiátrica. Rev Neuro Psiquiatr 2003;66:185-194.
Villaseñor-Bayardo SJ. L'elaboration du concept de bouffée delirante. Mémoire EHESS. París. 1992; p.95.
Villaseñor-Bayardo SJ, Díaz-Martínez A. Observaciones etnopsiquiátricas Nahuas. Psiquiatría 1995;11:1-5.
Villaseñor-Bayardo SJ. De la variabilidad nosológica: el caso de los Nahuas de Guerrero en México. Inv Salud 1999;1:87-93.
Villaseñor-Bayardo SJ. El concepto de la "bouffée delirante" dentro de las clasificaciones de las enfermedades mentales. Rev Res Psiquiat 1993;4:26-30.
Villaseñor-Bayardo SJ. La etnopsiquiatría. Nociones generales sobre su origen y desarrollo. Salud Mental 1994;17:16-20.
Volavka J, Czobor P, Sheitman B, Lindenmayer JP, Citrome L, McEvoy J et al. Clozapine, Olanzapine, Risperidone, and Haloperidol in the Treatment of Patients with Chronic Schizophrenia and Schizoaffective Disorder. Am J Psychiatry 2002;159:255-262.
Volkow ND, Fowler JS. Neuropsychiatric disorders: investigation of schizophrenia and substance abuse. Semin Nucl Med 1992;22:254-267.
Volpe JJ. Perinatal brain injury: from pathogenesis to neuroprotection. Ment Retard Dev Disabil Res Rev 2001;7:56-64.
Volz A, Khorsand V, Gillies D, Leucht S. Benzodiazepines for schizophrenia. Cochrane Database Syst Rev 2007;Jan 24;(1):CD006391.
Von Knorring L, Lindstrom E. Principal components and further possibilities with the PANSS. Acta Psychiatr Scand 1995;388(Suppl):5-10.
Wahlbeck K, Cheine M, Essali MA. Clozapine versus typical neuroleptic medication for schizophrenia. Cochrane Database Syst Rev 2000;(2):CD000059.
Wahlbeck K, Osmond C, Forsén T, Barrer D, Ericsson J. Associations between childhood living circumstances and schizophrenia: a population-based cohort study. Acta Psychiat Scand 2001;104:356-360.
Waish E, Buchanan A, Fahy T. Violence and schizophrenia: examining the evidence. Br J Psychiatry 2001;180:490-495.
Walker E, Kestler L, Bollini A, Hochman K. Schizophrenia: etiology and course. Annu Rev Psicol 2004;55:401-430.
Wallace C, Mullen P, Burgess P, Palmer S, Ruschena D, Browne C. Serious criminal offending and mental disorder. Case linkage study. Br J Psychiatry 1998;172:477-484.
Wang PS, Schneeweiss S, Avorn J, Fischer MA, Mogun H, Solomon DH et al. Risk of death in elderly users of conventional vs. atypical antipsychotic medications. N Engl J Med 2005;353:2335-2341.
Watts FN, Bennett DH. Rehabilitación Psiquiátrica. Teoría y práctica. Compilación a cargo de Ed. Noriega Limusa 1990.
Wehmeier P, Kluge M, Schacht A. Patterns of physician and patient rated quality of life during antipsychotic treatment in outpatients with schizophrenia. J Psychiatric Res 2008;42:676-683.
Weiden PJ, Olfson M. Cost of relapse in schizophrenia. Schizophr Bull 1995;21:419-429.
Weinberger DR, McClure RK. Neurotoxicity, neuroplasticity, and magnetic resonance imaging morphometry: what is happening in the schizophrenic brain? Arch Gen Psychiatry 2002;59:553-558.
Weinberger DR. From neuropathology to neurodevelopment. Lancet 1995;348:552-557.
Weinberger DR. Implications of normal brain development for the pathogenesis of schizophrenia. Arch Gen Psychiatry 1987;44:660-667.
Weiner RD, Coffey CE, Krystal AD. The monitoring and management of electrically induced seizures. Psychiatr Clin N Am 1991;14:845-869.
Weiner RD, Coffey CE. Indications for use of electroconvulsive therapy. En: Frances AJ, Hales RE (eds). Review of Psychiatry Volume 7. Washington, DC: American Psychiatric Press, Inc. 1988;458-481.
Weiner RD, Rogers HJ, Davidson JR, Khan EM. Effects of electroconvulsive therapy upon brain electrical activity. Ann NY Acad Sci 1986;462:270-281.
Weiner RD. The role of stimulus waveform in therapeutic and adverse effects of ECT. Psychopharmacol Bull 1982;18:71-72.
Weinmann S, Read J, Aderhold V. Influence of antipsychotics on mortality in schizophrenia: Systematic review. Schizophr Res 2009;113:1-11.
Weisman de Mamani A, Wasserman S, Duarte E, Dunham R, Koneru V. Capítulo 5. Un tratamiento familiar para esquizofrenia basado en la información cultural. En: Valencia M. Alternativas terapéuticas para la esquizofrenia. Editorial Herder. México 2012.
Weiss F, Danzl C, Hummer K, Kemmler G, Lindner C, Reinstadler K et al. Weight gain induced by olanzapine. Schizophr Res 1998;29:179.
Wenzel-Seifert K, Wittmann M, Haen E. Torsade de Pointes episodes under treatment with selective serotonin reuptake inhibitors. Pharmacopsychiatry 2010;43:279-281.
Werner A. Obsessive-compulsive symptoms in schizophrenia. Am J Psychiatry 1997;154: 1635-1636.
Werry JS, McClellan JM, Andrews LK, Ham M. Clinical features and outcome of child and adolescent schizophrenia. Schizophr Bull 1994;20:619-630.
Whitney KA, Fastenau PS, Evans JD, Lysaker PH. Comparative neuropsychological function in obsessive-compulsive disorder and schizophrenia with and without obsessive-compulsive symptoms. Schizophr Res 2004;69:75-83.
Whittington C, Barnes TRE, Kendall T. Antipsychotics for people with persistent negative symptoms of schizophrenia. Cochrane Database of Systematic Reviews 2010.
WHO heads of Centres Collaborating in WHO Co-Ordinated Studies on Biological Aspects of Mental Illness. Prophylactic Use of Anticholinergics in Patients on Long-Term Neuroleptic Treatment. Br J Psychiatry 1990;156:412.
WHO. The World Health Report. Life in the 21st Century: A vision for all. Geneva: WHO; 1998.
Wiersma D, Nienhuis FJ, Slooff CJ, Giel R. Natural course of schizophrenic disorders: a 15-year follow-up of a Dutch incidence cohort. Schizophr Bull 1998;24:75-85.
Wiersma D, Wanderling J, Dragomirecka E, Ganev K, Harrison G, Der Heiden W et al. Social disability in schizophrenia: its developmental and prediction over 15 years in incidente cohorts in six european centres. Psychol Med 2000;30:1155-1167.
Wig NN. Diagnóstico y clasificación en psiquiatría. Aspectos transculturales. Confrontaciones psiquiátricas 1984;20 :12-45.
Williams GV, Goldman-Rakic PS. Modulation of memory fields by dopamine D1 receptors in prefrontal cortex. Nature 1995;376:572-575.
Wing JK, Brown GW. Institutionalism and schizophrenia. Cambridge University Press. London; 1970.
Wittkower ED, Rin H. Transcultural psychiatry. Arch Gen Psychiatry 1965;13:387-394.
Wittkower ED. Transcultural Psychiatry. In: John G Howells (ed). Modern Perspectives in World Psychiatry. New York: Blunner/Mazel; 1971.
Wojtecki L, Colosimo C, Fuentes R. Deep brain stimulation for movement disorders - a history of success and challenges to conquer. Front Integr Neurosci 2012;6:6.
Woodruff PW, McManus IC, David AS. Meta-analysis of corpus callosum size in schizophrenia. J Neurol Neurosurg Psychiatry 1995;58:457-461.
Woods SW, Addington J, Cadenhead KS, Cannon TD, Cornblatt BA, Heinssen R et al. Validity of the prodromal risk syndrome for first psychosis: findings from the North American Prodrome Longitudinal Study. Schizophr Bull 2009;35:894-908.
Woods SW, Morgenstern H, Saksa JR, Walsh BC, Sullivan MC, Money R et al. Incidence of tardive dyskinesia with atypical versus conventional antipsychotic medications: a prospective cohort study. J Clin Psychiatry 2010;71:463-474.
Woods SW. Chlorpromazine equivalent doses for the newer atypical antipsychotics. J Clin Psychiatry 2003;64:663-667.
World Health Organization. International statistical classification of diseases and related health problems. 10th revision, 2nd ed. Geneva 2004.
Worrel JA. Atypical antipsychotic agents: a critical review. Am J Health Syst Pharm 2000;57:238-255.
Wright EC. Non-compliance-or how many aunts has Matilda? Lancet 1993;342:909-913.
Wright IC, Rabe-Hesketh S, Woodruff PWR, David AS, Murray RM, Bullmore ET. Meta-analysis of regional brain volumes in schizophrenia. Am J Psychiatry 2000;157:16-25.
Wright P, Birkett M, David SR, Meehan K, Ferchland I, Alaka KJ el al. Double-blind, placebo-controlled comparison of intramuscular olanzapine and intramuscular haloperidol in the treatment of acute agitation in schizophrenia. Am J Psychiatry 2001;158:1149-1151.
Wright P, Meehan K, Birkett M, Lindborg SR, Taylor CC, Morris P et al. A comparison of the efficacy and safety of olanzapine versus haloperidol during transition from intramuscular to oral therapy. Clin Ther 2003;25:1420-1428.
Wu SY, Liu CC, Hsieh MH. Successful re-exposure to clozapine following uneventful rechallenge with olanzapine in a patient with neutropenia related to both agents. Prog Neuropsychopharmacol Biol Psychiatry 2008;32:1089-1090.
Wykes T, Tarrier N, Lewies S. Outcome and innovation in psychological treatment of schizophrenia. Wiley & Sons. Chichester; 1998.
Wysokinski A, Kowman M, Kloszewska I. The prevalence of metabolic syndrome and Framingham cardiovascular risk scores in adult inpatients taking antipsychotics - a retrospective medical records review. Psychiatr Danub 2012;24:314-322.
Xia J, Merinder L, Belgamwar MR. Psychoeducation for schizophrenia. Schizophr Bull 2011;37:21-22.
Yamaguchi H, Takahashi A, Takano A, Kojima T. Direct effects of short-term psychoedu-cational intervention for relatives of patients with schizophrenia in Japan. Psychiatry Clin Neurosci 2006;60:590-597.
Young A, Sullivan G, Burnam A. Measuring the quality of outpatient treatment for schizophrenia. Arch Gen Psychiatry 1998;55:611-617.
Young CR, Bowers MB, Mazure CM. Management of the adverse effects of clozapine Schizophrenia Bull 1998;24:381-390.
Yovell Y, Opler LA. Clozapine reverse cocaine craving in a treatment resistant mentally ill chemical abuse: a case report and a hypothesis. J Nerv Ment Dis 1994;182:591-592.
Yung AR, Buckby JA, Cosgrave EM, Killackey EJ, Baker K, Cotton SM et al. Association between psychotic experiences and depression in a clinical sample over 6 months. Schizophr Res 2007;91:246-253.
Yung AR, McGorry PD, McFarlane CA, Jackson HJ, Patton GC, Rakkar A. Monitoring and care of young people at incipient risk of psychosis. Schizophr Bull 1996;22:283-303.
Yung AR, McGorry PD. The prodromal phase of first episode psychosis: past and current conceptualizations. Schizophr Bull 1996;22:353-370.
Yung AR, McGorry PD. The initial prodrome in psychosis: descriptive and qualitative aspects. Aust N Z J Psychiatry 1996;30:587-599.
Yung AR, Nelson B, Stanford C, Simmons MB, Cosgrave EM, Killackey E et al. Validation of "prodromal" criteria to detect individuals at ultra high risk of psychosis: 2 year follow-up. Schizophr Res 2008;105:10-17.
Yung AR, Phillips LJ, Yuen HP, McGorry PD. Risk factors for psychosis in an ultra high-risk group: psychopathology and clinical features. Schizophr Res 2004;67:131-142.
Yung AR, Stanford C, Cosgrave E, Killackey E, Phillips L, Nelson B et al. Testing the Ultra High Risk (prodromal) criteria for the prediction of psychosis in a clinical sample of young people. Schizophr Res 2006;84:57-66.
Zammit S, Allebeck P, Andreasson S, Lundberg I, Lewis G. Self reported cannabis use as a risk factor for schizophrenia in Swedish conscripts of 1969: historical cohort study. Br Med J 2002;325:1199-1201.
Zervas IM, Theleritis C, Soldatos CR Using ECT in schizophrenia: a review from a clinical perspective. W J Biol Psychiatry 2012;13:96-105.
Zhornitsky S, Stip E. Oral versus Long-Acting Injectable Antipsychotics in the Treatment of Schizophrenia and Special Populations at Risk for Treatment Nonadherence: A Systematic Review. Schizophr Research Treatment 2012;2012:407171. Doi:10.1155/2012/407171.
Zimmet SV, Strous RD, Burgess ES, Kohnstamm S, Green AL. Effects of clozapine on substance use in patients with schizophrenia and schizoaffective disorders: a retrospective survey. J Clin Psychopharmacol 2000;20:94-98.
Zohar J, Kaplan Z, Benjamin J. Clomipramine treatment of obsessive compulsive symptomatology in schizophrenic patients. J Clin Psychiatry 1993;54:385-388.
Woods SW. Chlorpromazine equivalent doses for the newer atypical antipsychotics. J Clin Psychiatry 2003; 64: 663-667.
World Health Organization. International statistical classification of diseases and related health problems. 10th revision, 2nd ed. ed. Geneva 2004.
Worrel JA. Atypical antipsychotic agents: a critical review. Am J Health Syst Pharm 2000; 57: 238-255.
Wright EC. Non-compliance or how many aunts has Matilda? Lancet 1993; 342: 909-913.
Wright IC, Rabe-Hesketh S, Woodruff PWR, David AS, Murray RM, Bullmore ET: Meta-analysis of regional brain volumes in schizophrenia. Am J Psychiatry 2000; 157: 16-25.
Wright P, Birkett M, David SR, Meehan K, Ferchland I, Alaka KJ, el al. Double-blind, placebo-controlled comparison of intramuscular olanzapine and intramuscular halo-peridol in the treatment of acute agitation in schizophrenia. Am J Psychiatry 2001; 158: 1149-1151.
Wright P, Meehan K, Birkett M, Lindborg SR, Taylor CC, Morris P, et al. A comparison of the efficacy and safety of olanzapine versus haloperidol during transition from intramuscular to oral therapy. Clin Ther 2003; 25: 1420-1428
Wu SY, Liu CC, Hsieh MH. Successful re-exposure to clozapine following uneventful rechallenge with olanzapine in a patient with neutropenia related to both agents. Prog Neuropsychopharmacol Biol Psychiatry 2008; 32: 1089-1090.
Wykes T, Tarrier N, Lewies S. Outcome and innovation in psychological treatment of schizophrenia. Wiley & Sons. Chichester; 1998.
Wysokinski A, Kowman M, Kloszewska I. The prevalence of metabolic syndrome and Framingham cardiovascular risk scores in adult inpatients taking antipsychotics - a retrospective medical records review. Psychiatr Danub 2012; 24: 314-322.
Xia J, Merinder L, Belgamwar MR. Psychoeducation for schizophrenia. Schizophr Bull 2011; 37: 21-22.
Yamaguchi H, Takahashi A, Takano A, Kojima T. Direct effects of short-term psychoeducational intervention for relatives of patients with schizophrenia in Japan. Psychiatry Clin Neurosci 2006; 60: 590-597.
Young A, Sullivan G, Burnam A. Measuring the quality of outpatient treatment for schizophrenia. Arch Gen Psychiatry 1998; 55: 611-617
Young CR, Bowers MB, Mazure CM. Management of the adverse effects of clozapine Schizophrenia Bull 1998; 24: 381-390.
Yovell Y, Opler LA. Clozapine reverse cocaine craving in a treatment resistant mentally ill chemical abuse: a case report and a hypothesis. J Nerv Ment Dis 1994; 182: 591-592
Yung AR, Buckby JA, Cosgrave EM, Killackey EJ, Baker K, Cotton SM, et al. Association between psychotic experiences and depression in a clinical sample over 6 months. Schizophr Res 2007; 91: 246-253
Yung AR, McGorry PD, McFarlane CA, Jackson HJ, Patton GC, Rakkar A. Monitoring and care of young people at incipient risk of psychosis. Schizophr Bull 1996; 22: 283-303
Yung AR, McGorry PD: The prodromal phase of first episode psychosis: past and current conceptualizations. Schizophr Bull 1996; 22: 353-370
Yung AR, McGorry PD. The initial prodrome in psychosis: descriptive and qualitative aspects. Aust N Z J Psychiatry 1996; 30: 587-599
Yung AR, Nelson B, Stanford C, Simmons MB, Cosgrave EM, Killackey E, et al. Validation of "prodromal" criteria to detect individuals at ultra high risk of psychosis: 2 year follow-up. Schizophr Res 2008; 105: 10-17
Yung AR, Phillips LJ, Yuen HP, McGorry PD. Risk factors for psychosis in an ultra high-risk group: psychopathology and clinical features. Schizophr Res 2004; 67: 131-42
Yung AR, Stanford C, Cosgrave E, Killackey E, Phillips L, Nelson B, et al. Testing the Ultra High Risk (prodromal) criteria for the prediction of psychosis in a clinical sample of young people. Schizophr Res 2006; 84: 57-66
Zammit S, Allebeck P, Andreasson S, Lundberg I, Lewis G. Self reported cannabis use as a risk factor for schizophrenia in Swedish conscripts of 1969: historical cohort study. Br Med J 2002; 325: 1199-1201
Zervas IM, Theleritis C, Soldatos CR. Using ECT in schizophrenia: a review from a clinical perspective. W J Biol Psychiatry 2012; 13: 96-105
Zhornitsky S, Stip E. Oral versus Long-Acting Injectable Antipsychotics in the Treatment of Schizophrenia and Special Populations at Risk for Treatment Nonadherence: A Systematic Review. Schizophr Res Treatment 2012; 2012: 407171
Zimmet SV, Strous RD, Burgess ES, Kohnstamm S, Green AL. Effects of clozapine on substance use in patients with schizophrenia and schizoaffective disorders: a retrospective survey. J Clin Psychopharmacol 2000; 20: 94-98
Zohar J, Kaplan Z, Benjamin J. Clomipramine treatment of obsessive compulsive symptomatology in schizophrenic patients. J Clin Psychiatry 1993; 54: 385-388.














