Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Salud mental
versão impressa ISSN 0185-3325
Salud Ment vol.36 no.4 México Jul./Ago. 2013
Actualización por temas
La enfermedad de Parkinson: neurología para psiquiatras
Parkinson's disease: neurological bases for psychiatrists
Enrique Chávez-León,1 Martha Patricia Ontiveros-Uribe,2 José Damián Carrillo-Ruiz3
1 Coordinador de Psicología Clínica de la Universidad Anáhuac México Norte. Asociación Psiquiátrica Mexicana. Colegio Mexicano de Neuropsicofarmacología.
2 Subdirectora de Hospitalización y Urgencias del Instituto Nacional de Psiquiatría Ramón de la Fuente Muñiz.
3 Coordinador del Área de Fisiología de la Escuela de Psicología de la Universidad Anáhuac México Norte; Unidad de Neurocirugía Funcional, Estereotaxia y Radiocirugía del Hospital General de México.
Correspondencia:
Dr. Enrique Chávez-León.
Avenida Universidad Anáhuac 46, Lomas Anáhuac, 52786,
Huixquilucan, Edo. de México.
E.mail: ecleon@yahoo.com.
Recibido: 10 de septiembre de 2012.
Aceptado: 25 de abril de 2013.
ABSTRACT
Parkinson's disease is a progressive and degenerative disease due to the loss of the substantia nigra dopaminergic neurons in the mesencephalon. Its manifestations are: tremor at rest, rigidity and slowing of movements, and alterations in posture and gait. The early onset of dementia or the presence of hallucinations, not related to the dopaminergic treatment, are associated with the presence of dementia with Lewy bodies (DLB) or Alzheimer's disease. The scales used to assess the stage and severity of Parkinson's disease are: the scale of Stages of Hoehn and Yahr, and the Unified Parkinson's Disease Rating Scale. Although there is not a drug that stops the progression of Parkinson's disease, the current treatment for this illness consist in: a) dopamine replacement through the use of its precursor, levodopa, b) administering substances, like ropinirole, pramipexole, and bromocriptine, that increase dopamine activity to stimulate their receptors, and c) inhibiting the enzymes that destroy dopamine as the catechol- O-methyltrans-ferase with entacapone, and monoamine oxidase type B (MAOB) with selegiline and rasagiline. Surgical treatment of Parkinson's disease consists of ablative procedures and deep brain stimulation. This review describes their indications, administration and side effects.
Key words: Parkinson disease, treatment, clinical manifestations, dopaminergic agonists, MAO inhibitors.
RESUMEN
La enfermedad de Parkinson es una enfermedad degenerativa y progresiva debida a la pérdida de las neuronas dopaminérgicas de la sustancia nigra del mesencéfalo. Sus manifestaciones son: temblor en reposo, rigidez y enlentecimiento de los movimientos, alteraciones en la postura y en la marcha. La aparición temprana de problemas en la memoria o alucinaciones, no debidas al tratamiento, indica la presencia de demencia con cuerpos de Lewy. Las escalas utilizadas para evaluar el estado y la gravedad de la enfermedad de Parkinson son: la Escala de los Estadios de Hoehn y Yahr y la Escala Unificada de Calificación de la Enfermedad de Parkinson (UPDRS). Aunque todavía no existe un medicamento que detenga la evolución de la enfermedad de Parkinson, el tratamiento actual consiste en mejorar los síntomas mediante: a) la reposición de la dopamina por medio del uso de su precursor (levodopa, L-Dopa), b) la administración de sustancias que aumentan la actividad dopaminérgica al estimular a sus receptores (ropinirol, pramipexol, bromocriptina) y c) la inhibición de las enzimas que destruyen la dopamina como la catecol- O- metiltransferasa (COMT) con la entacapona, y a la monoamino oxidasa tipo B (MAOB) con la selegilina y la rasagilina. Existe además el tratamiento quirúrgico de la enfermedad de Parkinson que consiste en procedimientos ablativos y la estimulación cerebral profunda. En esta revisión se describen los elementos básicos de la enfermedad, su cuadro clínico y sus complicaciones. En una segunda parte se aborda el tratamiento médico con sus indicaciones, administración y efectos secundarios, y para terminar se describirá el tratamiento quirúrgico.
Palabras clave: Enfermedad de Parkinson, antiparkinsónicos, cuadro clínico, tratamiento, agonistas dopaminérgicos, inhibidores de la MAO.
INTRODUCCIÓN
En la psiquiatría, los conocimientos de neurología son necesarios para realizar una práctica integral y ética. Habitualmente la actividad clínica propia del psiquiatra consiste en manejar las alteraciones mentales que acompañan a los problemas neurológicos, como en la enfermedad de Parkinson y la de Alzheimer, la demencia por cuerpos de Lewy, la corea de Huntington, las secuelas de los traumatismos craneoencefálicos, la esclerosis múltiple y la epilepsia, y de padecimientos caracterizados por síntomas neurológicos que no corresponden propiamente a la patología de la Neurología como los trastornos conversivo y disociativo y el de somatización. Por todo lo anterior es necesario contar con los conocimientos aportados por la Neurología.1 Así, el presente trabajo tiene como objetivos: describir los signos y síntomas asociados con la enfermedad de Parkinson, resaltar la importancia del diagnóstico apropiado para el manejo de este padecimiento y describir los agentes farmacológicos que se utilizan habitualmente para sus distintas etapas. En un segundo trabajo se revisarán las alteraciones mentales y de la conducta que con alguna frecuencia acompañan a la enfermedad de Parkinson.
La enfermedad de Parkinson es una abiotrofia, es decir, una enfermedad neurológica degenerativa y progresiva debida a la pérdida de las neuronas dopaminérgicas de la sustancia nigra del mesencéfalo, cuya etiología es desconocida (idiopática). Las manifestaciones características de esta enfermedad consisten en la tríada motora de temblor en reposo, rigidez y enlentecimiento de los movimientos (bradiquinesia) o incapacidad de iniciar los mismos (acinesia), además de las alteraciones en la postura y la marcha, que se presentan frecuentemente en etapas tardías, aunque algunos pacientes pueden debutar con problemas en el caminar. El diagnóstico de la enfermedad se hace con la presencia de dos de estos síntomas y la respuesta a la administración de L-dopa o a alguno de los agonistas dopaminérgicos. Aunque todavía no se ha descubierto un tratamiento curativo, existen terapias que mejoran la sintomatología motora más importante.2
HISTORIA
El primero en describir la enfermedad que lleva su nombre fue James Parkinson, en 1817. Parkinson pensaba que la causa de la enfermedad era una alteración en el funcionamiento de la médula espinal, que podría extenderse al bulbo raquídeo, resaltando que no existía "modificación del intelecto ni de los sentidos".3 En 1880, Jean-Martin Charcot bautizó la parálisis agitante como "enfermedad de Parkinson", y utilizó la escopolamina para el tratamiento del temblor.4 La sustancia nigra del mesencéfalo había sido descubierta por Félix Vicq d'Azyr. Más de un siglo después, Paul Blocq y Georges Marinesco establecieron su papel en la enfermedad de Parkinson a partir del hallazgo, en un paciente tuberculoso que padecía de temblor en el hemicuerpo contralateral, de un absceso en la sustancia nigra. Dos años después, en 1895, Edouard Brissaud sugirió una etiología vascular de la enfermedad de Parkinson. En 1913, el patólogo alemán Friederich Lewy describió los cuerpos que llevan su nombre y los propuso como marcador de la enfermedad. Entre 1918 y 1920 la epidemia mundial (pandemia) de influenza española, descrita por Von Economo, ocasionó que alrededor de cinco millones de personas desarrollaran síntomas parkinsónicos después de haberla padecido. En 1919 Constantin Trétiakoff, validó la hipótesis propuesta por Brissaud al describir la pérdida de las neuronas en esa área del mesencéfalo tanto en el Parkinson idiopático como en el postencefalítico. Hacia la década de 1940, el tratamiento original de la enfermedad de Parkinson era quirúrgico basado en los trabajos originales de Spiegel y Wycis en los ganglios basales, concretamente la lesión en el tálamo, los campos de Forel y la región subtalámica, para posteriormente ser modificado por Cooper al ligar la arteria coroideo posterior, y usarse el globo pálido también como blanco. Fenelon y Guiot, en 1955, al lesionar el globus pallidus, tuvieron éxito en 73% de sus pacientes. Sin embargo, en 1956, Arvid Carlsson descubrió la alteración en la concentración de la dopamina y sostuvo que la sintomatología parkinsónica se debía a la disminución de este neurotransmisor, por lo que recibió, en el año 2000, el Premio Nobel de Fisiología. En 1960, Hornikyewicz y Birkmayer inyectaron Dopa a pacientes con enfermedad de Parkinson, y con ello observaron resultados espectaculares. En 1967, George Constantin Cotzias, del Laboratorio Nacional Brookhaven de Nueva York, administró levodopa (L-Dopa) por vía oral, creando así un método terapéutico efectivo. La utilización de la cirugía fue en declive hasta la década de 1980, cuando se evidenció que la sola utilización del medicamento no podía curar la enfermedad, además de la presencia de otros efectos secundarios.
Con una mejor comprensión de la patogenia, los esfuerzos se encaminaron a abordar quirúrgicamente otros sitios de los ganglios basales mediante el implante de tejidos, la estimulación profunda en los núcleos ya conocidos, además del núcleo subtalámico, así como el uso de la radiocirugía.5-8
EPIDEMIOLOGÍA
Los síntomas parkinsónicos, principalmente el temblor y la bradicinesia, debidos a la enfermedad de Parkinson, parálisis supranuclear progresiva, degeneración corticobasal, demencia frontotemporal y demencia por cuerpos de Lewy, se observan en 15% de las personas ancianas y casi en 50% de los mayores de 80 años; la enfermedad de Parkinson es la causa más frecuente de síntomas parkinsónicos. En los países industrializados, la enfermedad de Parkinson es la segunda enfermedad neurodegenerativa más frecuente después de la enfermedad de Alzheimer, que afecta a 1% de la población mayor de 55 años y a 3% de la mayor de 70 años. La edad promedio de inicio son los 60 años de edad y en 80% de los casos los pacientes desarrollan esta enfermedad entre los 40 y los 70 años de edad; sólo 5% presentan síntomas antes de los 40 años. Las personas que desarrollan la enfermedad entre los 21 y los 40 años son diagnosticadas con enfermedad de Parkinson de aparición temprana y de origen genético; el inicio a distintas edades puede limitar su diagnóstico.9 La Organización Mundial de la Salud considera que cerca de 40 millones de personas padecen la enfermedad y un 30% adicional no ha sido diagnosticado.10 En nuestro país, de acuerdo con la Secretaría de Salud, afecta a medio millón de mexicanos mayores de 60 años.
ETIOLOGÍA
Aunque se sabe que la alteración patológica que subyace a la enfermedad de Parkinson es la pérdida de las neuronas dopaminérgicas en el área ventral de la pars compacta de la sustancia nigra, aún no se conoce la causa de la enfermedad de Parkinson; en la mayoría de los casos se debe a la interacción de factores ambientales y genéticos.
Los mecanismos propuestos como causa de este padecimiento incluyen:7
El estrés oxidativo, producto del efecto de las "especies reactivas de oxígeno" (radicales libres y peróxidos) formadas a partir de las reacciones metabólicas normales, como la generación de energía de las mitocondrias, de la actividad del sistema enzimático hepático citocromo P450, por la exposición al humo del tabaco o a los gases emitidos por automóviles e industrias (manganeso, monóxido de carbono, organofosforados), asbesto y radicaciones ionizantes, al consumo exagerado de alcohol y a infecciones por virus (por ejemplo, el de la influenza). La excitotoxicidad debida a una activación sostenida y excesiva de los receptores para aminoácidos excitadores, como el ácido glutámico, con el consecuente aumento de la concentración de calcio intracelular, lesión y muerte neuronal.
Otros mecanismos propuestos son: disfunción mitocondrial, alteración del citoesqueleto neuronal y del transporte axonal y muerte celular programada.
La diabetes aumenta el riesgo de padecer la enfermedad de Parkinson excepto en mujeres jóvenes;11 en cambio, el consumo de café y el tabaquismo disminuye el riesgo de padecer enfermedad de Parkinson.
GENÉTICA
Los estudios familiares y de gemelos han permitido identificar genes causales y variantes genéticas que incrementan el riesgo de padecer la enfermedad de Parkinson. Por ejemplo, el llamado PARK8, localizado en el cromosoma 12, el gen SNCA mutado de la alfa sinucleína, componente de los cuerpos de Lewy, localizado en el cromosoma 4, primera mutación identificada en la enfermedad de Parkinson con transmisión autosómica dominante. Las mutaciones en los genes del cromosoma 6 que codifican la proteína Parkin (PRKN) son los defectos hereditarios más frecuentemente observados y se asocian particularmente con la forma autosómica recesiva juvenil de enfermedad de Parkinson de inicio temprano.
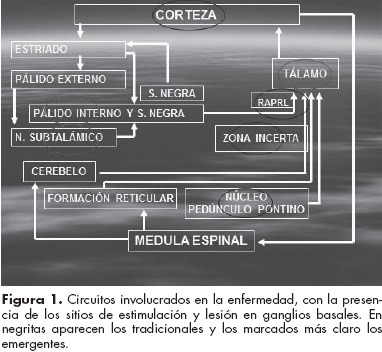
La pérdida de neuronas dopaminérgicas ocurre por lo regular en la vejez; sin embargo, es menos grave y afecta otros tipos de células de la pars compacta de la sustancia nigra del mesencéfalo. La pérdida de las neuronas dopaminérgicas en los circuitos fronto-córtico-estriato-talámico se relaciona con los síntomas motores de la enfermedad de Parkinson.9 Desde la década de 1980 existe un esquema clásico de la enfermedad mediada por los receptores dopaminérgicos D1-D5, D2 a D4 por las vías directa e indirecta desde la sustancia nigra hacia el neostriado. Su desbalance produce la enfermedad.12 (figura 1)
ESCALAS DE EVALUACIÓN
Las escalas que se utilizan para evaluar el estadio y la gravedad de la enfermedad de Parkinson son las siguientes:
1. Estadios de Hoehn y Yahr.13
2. La Escala Unificada de Calificación de la Enfermedad de Parkinson (UPDRS, Unified Parkinson's Disease Scale).
Ambas se encuentran accesibles en Internet en idioma inglés.14
Escala de estadios de Hoehn y Yahr
Una de las formas de evaluación frecuentemente referida en la literatura científica en la enfermedad de Parkinson y de fácil aplicación en la clínica diaria es la Clasificación por Estadios de Hoehn y Yahr.13 Su puntuación va desde cero (no hay signos de enfermedad), uno (enfermedad exclusivamente unilateral), 1.5 (afectación unilateral y axial), dos (afectación bilateral sin alteraciones del equilibrio), 2.5 (afectación bilateral leve con recuperación en la prueba de retropulsión (prueba del empujón), tres (afectación bilateral leve a moderada, con inestabilidad postural pero el paciente es independiente físicamente), cuatro (incapacidad grave, aunque puede caminar o permanecer en pie sin ayuda), hasta cinco (está en cama o requiere silla de ruedas).13 Esta escala está contenida también en la Escala Unificada de Calificación de la Enfermedad de Parkinson (UPDRS).
La Escala Unificada de Calificación de la Enfermedad de Parkinson (UPDRS)
La Escala Unificada de Calificación de la Enfermedad de Parkinson (UPDRS) tiene varios apartados, que en su mayoría se califican del 0 al 4: el 0, sin alteraciones y el 4, como un síntoma de mucho deterioro. El apartado I evalúa el nivel de funcionamiento cognitivo, la conducta y el estado de ánimo. El apartado II comprende las actividades de la vida diaria. En el apartado III se encuentra la evaluación del estado motor. El apartado IV contiene las complicaciones de la terapia. Los últimos dos apartados contienen dos escalas: el apartado V cubre los Estadios Modificados propuestos por Hoehn y Yahr, y el apartado VI abarca la Escala de las Actividades de la Vida Diaria de Schwab y England. Esta escala está accesible en Internet.14 Recientemente la Sociedad de Trastornos del Movimiento la sometió a revisión.15
CUADRO CLÍNICO
La enfermedad de Parkinson, afección crónica y progresiva, pertenece al grupo de trastornos del movimiento. Sus síntomas claves son: a) el temblor en las manos, los brazos, las piernas o el maxilar inferior, b) la rigidez de las extremidades y el tronco, c) la lentitud de movimientos, d) la inestabilidad postural o alteración del equilibrio, e) las alteraciones de la marcha. Además de los síntomas motores, los pacientes presentan: alteraciones cognitivas, mentales y de la conducta,2 y alteraciones vegetativas como sialorrea, constipación y seborrea.
Casi 20% de los pacientes con enfermedad de Parkinson presentan sintomatología inicial que no es de tipo motor; los síntomas consisten en fatiga, molestias musculoesqueléticas y depresión. Muchos pacientes pasan entre cuatro y ocho años con esta sintomatología, antes de que hagan su aparición los síntomas motores.
Síntomas motores
Las manifestaciones motoras comienzan focalmente, por lo común en una de las extremidades, cuando la concentración de dopamina cae por debajo de 60 a 70% en la región motora del cuerpo estriado contralateral (putamen posterior). Al principio se manifiestan de un solo lado del cuerpo y gradualmente progresan al lado contrario. Los síntomas motores consisten en acinesia (hipoquinesia y bradiquinesia), aumento del tono muscular (rigidez) y temblor. A continuación se describen con mayor amplitud estos síntomas.
A. Temblor. Es el síntoma más frecuente de comienzo de la enfermedad. El temblor en reposo es de 4-6 Hz y es de predominio distal. Los dedos de las manos son los más afectados, donde se observa el signo de "cuenta de monedas"; también puede existir temblor en las extremidades inferiores. Pueden afectarse los músculos de la mandíbula y de la lengua, pero es muy raro que se afecten los del tronco y el cuello. El temblor se acrecienta cuando se movilizan otras partes del cuerpo, se realizan operaciones aritméticas y con el estrés, y desaparece durante el sueño.16
B. Alteraciones del tono muscular. Tanto los músculos flexores como los extensores están afectados en el paciente con enfermedad de Parkinson, por lo que pueden observarse las siguientes alteraciones del tono muscular: aumento del tono muscular en reposo, disminución en la distensión durante la movilización pasiva, aumento de la resistencia a la extensión y mayor facilidad para la flexión. El aumento en la resistencia es mucho más patente cuando se extiende lentamente la extremidad afectada. Durante la exploración física se identifica por el signo de la rueda dentada. En los pacientes puede existir la "fascies de jugador de póker" (inexpresiva), y al avanzar la enfermedad puede haber alteraciones en el habla (taquifemia o farfulleo) y disfagia por alteraciones musculoesqueléticas.
C. Acinesia. La acinesia se define como ausencia de movimiento y tiene distintas formas de manifestarse: 1. La hipocinesia consiste en la disminución de la frecuencia y la amplitud de los movimientos espontáneos. Las manifestaciones típicas son disminución en el parpadeo y en las expresiones faciales, reducción o ausencia en el braceo, y la ausencia de movimientos asociados en las actividades de la vida cotidiana, al levantarse, moverse y caminar. La micrografía o disminución en la amplitud del trazo y la lentitud para escribir son también manifestaciones de la hipocinesia. 2. La marcha parkinsónica se caracteriza por la tendencia a la flexión, la disminución en la amplitud de la zancada y en la elevación del pie al caminar. Las dificultades para iniciar la marcha hacen que el paciente tarde en empezarla e incluso se quede "congelado". Dentro de la enfermedad es característica una marcha llamada festinante, con gran dificultad para dar el primer paso. 3. La bradicinesia se caracteriza por disminución en la velocidad del movimiento con una paulatina disminución de su amplitud hasta la desaparición del movimiento; para la persona con Parkinson es difícil llevar a cabo movimientos secuenciales o simultáneos. Los movimientos más afectados son aquellos que inicia el sujeto (Figura 2).

El diagnóstico se hace clínicamente. La mayoría de los expertos señalan que la presencia de dos de los tres síntomas cardinales (acinesia, rigidez y temblor) y una buena respuesta a L-Dopa permiten establecer el diagnóstico. Al principio del padecimiento puede ser difícil establecer el diagnóstico, ya que los síntomas son sutiles e incluso el mismo paciente puede no notarlos; por otro lado, algunos de los síntomas aparecen por el envejecimiento normal.
Además de la sintomatología antes señalada, ya se mencionó que los pacientes con enfermedad de Parkinson pueden presentar otros síntomas como: sialorrea, disartria, sudoración, molestias visuales y genitourinarias, alteraciones del sueño, seborrea, edema, constipación, parestesias y disminución del olfato.9 La disfunción urinaria es frecuente en el paciente con enfermedad de Parkinson, incluso desde etapas tempranas del padecimiento. Los estudios urodinámicos en pacientes sin tratamiento muestran anormalidad en la fase de almacenamiento con hiperactividad del músculo detrusor de la vejiga y aumento en la urgencia urinaria. En la fase de la micción las anormalidades consisten en hipoactividad del mismo detrusor y alteración en la relajación uretral debido al mal funcionamiento del esfínter. Al parecer no guardan relación con la gravedad de la enfermedad de Parkinson.17
Las alteraciones del sueño se hacen más patentes con el avance de la enfermedad. Por ejemplo, el paciente puede tener dificultad para conciliar el sueño debido al temblor, la rigidez y el frío que experimenta. También puede despertar temprano por las discinecias provocadas por el medicamento y el insomnio relacionado con la apnea del sueño y el síndrome de piernas inquietas.
Las alteraciones gastrointestinales consisten en constipación por enlentecimiento del peristaltismo, disfagia y reflujo.2
DIAGNÓSTICO DIFERENCIAL
La enfermedad de Parkinson progresa mucho más lentamente que otros trastornos parkinsónicos y responde a la L-Dopa. Otros trastornos como la parálisis supranuclear progresiva o la atrofia multisistémica tienen una progresión rápida con inestabilidad postural y caídas desde las etapas tempranas, poca respuesta a la L-Dopa, hipotensión ortostática y otros síntomas de disfunción autonómica, disfagia y parálisis en los movimientos oculares al dirigirlos hacia arriba. La aparición temprana de amnesia y de alucinaciones, no relacionadas con el tratamiento, señala la presencia de demencia con cuerpos de Lewy o enfermedad de Alzheimer, aunque la enfermedad cursa con problemas cognitivos hasta en 20% de los pacientes. La presencia de mioclonias (movimientos involuntarios, breves, bruscos y similares a sacudidas que provocan una contracción muscular brusca), signos piramidales —como el signo de Babinski— y signos cerebelosos señalan el diagnóstico de otras causas de síntomas parkinsónicos y no la enfermedad de Parkinson. También puede haber confusión con otras enfermedades extrapiramidales como la enfermedad de Wilson, las distonías e incluso con espasticidad posterior a infartos cerebrales.
TRATAMIENTO
Hasta este momento no existe un medicamento que detenga la evolución de la enfermedad de Parkinson. Sin embargo, debido a que las manifestaciones motoras del padecimiento se deben a la depleción de dopamina en el sistema nigroestriado, el tratamiento fundamental consiste en administrar sustancias o realizar maniobras que aumenten su concentración.
El tratamiento actual de la enfermedad de Parkinson consiste en la reposición de la dopamina por medio del uso de su precursor, la L-Dopa, o de sustancias que aumentan la actividad de ese neurotransmisor al estimular a los receptores dopaminérgicos (ropinirol, pramipexol, bromocriptina). Otros medicamentos actúan inhibiendo las enzimas que destruyen la dopamina como la catecol- O-metiltransferasa (COMT) (entacapona) y la monoamino oxidasa tipo B (MAOB) (selegilina y la rasagilina).
Los agonistas dopaminérgicos como el pramipexol y el ropinirol son efectivos, aunque pueden producir efectos secundarios (sedación, ataques de sueño, alteraciones del comportamiento y alucinaciones) más frecuentemente que la L-Dopa.18 Estos medicamentos reducen el riesgo de la discinesia y las fluctuaciones motoras en las etapas tempranas de la enfermedad y en aquellos pacientes cuyas manifestaciones se iniciaron antes de los 40 años de edad.
Ningún medicamento ha demostrado tener un efecto neuroprotector, aunque los estudios por medio de imágenes cerebrales demuestran que los agonistas dopaminérgicos como el ropinirol y el pramipexol disminuyen la pérdida de neuronas dopaminérgicas,19,20 y el uso de rasagilina desde el inicio del tratamiento retrasa la progresión del padecimiento.21
Agonistas dopaminérgicos
Levodopa (L-Dopa)
Carbidopa/Levodopa. El uso de la combinación carbidopa/ levodopa (C/L) desde hace ya cerca de 40 años aumentó significativamente la sobrevida de los pacientes con enfermedad de Parkinson. Este medicamento sigue siendo el tratamiento más efectivo, aunque otros tratamientos más nuevos pueden utilizarse desde el principio. La carbidopa/levodopa es benéfica durante las primeras etapas del padecimiento y con efecto persistente a largo plazo. La recuperación en la movilidad y la actividad física constante tienen una influencia positiva en la integridad del Sistema Nervioso Central y la neuroplasticidad.22 Sin embargo, a lo largo de los años, y debido a la evolución del padecimiento, se torna menos útil y a menudo condiciona síntomas de discinesia.
La presentación comercial de la combinación carbidopa/ levodopa tiene dos números. El primero representa la concentración de carbidopa: carbidopa/levodopa (25/250)=25mg de carbidopa y 250 mg de L-Dopa. La carbidopa evita las náuseas, por lo que es preferible usar esta combinación. Se necesitan aproximadamente entre 70 y 100mg diarios de carbidopa para saturar la enzima dopadescarboxilasa y evitar la conversión de L-Dopa en dopamina en la periferia, causa de la náusea y el vómito.
La presentación de liberación prolongada tiene menor biodisponibilidad que la de liberación inmediata, su efecto es más variable y mucho menos rápido, es más cara y los alimentos interfieren con su liberación.
La L-Dopa es un aminoácido que cruza la barrera hematoencefálica a través de un trasportador molecular que liga éste y otros aminoácidos, por lo que se satura con facilidad. Otros productos de la digestión de las proteínas de la dieta, presentes simultáneamente, compiten con la L-Dopa, disminuyendo su eficacia. De ahí la recomendación de tomar este medicamento una hora antes de ingerir alimentos o dos horas después. Si el paciente experimenta náusea al tomarla con el estómago vacío, vale la pena tomarlo con un pan, galletas saladas, un plátano u otro alimento sin proteínas. Aunque es preferible utilizar la dosis mínima útil, es importante buscar que el paciente esté en el mejor nivel de funcionamiento posible. El tratamiento debe distribuirse en tres dosis, una hora antes de cada alimento.23
Carbidopa/levodopa (25/250) (Sinemet®, Cloisone®). Para la combinación carbidopa/levodopa (25/250) la dosificación inicial es de media tableta una o dos veces al día y después añadir media tableta más, para completar tres dosis diarias. A la semana se puede aumentar paulatinamente media tableta hasta obtener la mejoría esperada o llegar a tres tabletas diarias. Esta presentación del medicamento tiene la desventaja de tener una concentración baja de carbidopa, insuficiente para evitar la náusea. En pacientes con enfermedad avanzada puede fraccionarse la tableta para evitar las discinesias o disminuir el efecto ON-OFF.
Benseracida/levodopa (25/100) (Madopar®). La combinación benseracida/levodopa, 25 y 100mg, respectivamente, es similar a la de carbidopa/levodopa (25/100) y su administración puede guiarse por los lineamientos mencionados para ella. La benseracida, al igual que la carbidopa, inhibe la dopadescarboxilasa periférica. La conversión de la L-Dopa en dopamina en el torrente sanguíneo puede producir náusea. Aunque la dopamina circulante no atraviesa la barrera hematoencefálica, sí puede estimular las áreas quimioreceptoras del tallo cerebral. La náusea se controla con ondansetron (antagonista de los receptores serotoninérgicos tipo 3, 5HT3) y con domperidona (antagonista de los receptores dopaminérgicos periféricos que no atraviesa la barrera hematoencefálica, aunque aumenta los niveles de prolactina). No deben utilizarse medicamentos antagonistas dopaminérgicos con efecto sobre el Sistema Nervioso Central, como la metoclopramida o la tietilperazina.
Los pacientes con enfermedad de Parkinson pueden presentar inestabilidad autonómica e hipotensión arterial, por lo que se recomienda medir la tensión arterial antes de iniciar el tratamiento con la carbidopa/levodopa, y sólo indicarla cuando la tensión arterial sistólica sea mayor de 90mm de mercurio. Posteriormente debe vigilarse la presión, sobre todo cuando sea necesario aumentar la dosis del precursor dopaminérgico L-Dopa.
El objetivo del tratamiento es lograr la mayor respuesta a la L-Dopa, esto es, la dosis que permita al paciente una vida activa, que incluya el ejercicio.
Si es necesario retirar el medicamento, la disminución debe ser paulatina al mismo ritmo semanal, pues existe el riesgo de un síndrome semejante al llamado síndrome maligno por neurolépticos si se suspende abruptamente.
Durante los primeros años de tratamiento, los pacientes responden en forma estable y permanecen bien durante todo el día. Sin embargo, después de varios años, el efecto dura mucho menos, fluctúa y se observa al momento en que se toma el medicamento. Por ejemplo, la duración del efecto del medicamento puede ser de una a seis horas. La toma matutina permite que el paciente pueda empezar a caminar hasta una hora después de despertar, y horas después nuevamente tiene dificultades para movilizarse. Aumentar la dosis en ese momento no produce mayor beneficio; en cambio pueden redistribuirse la dosis y acercarse las tomas. Al mismo tiempo que se acorta el tiempo de acción del medicamento, los pacientes pueden manifestar discinesia (movimientos involuntarios de tipo coreico en tronco, extremidades, cuello y cabeza causados por la medicación). La discinesia es una manifestación de una dosis excesiva de L-Dopa, por lo que lo prudente es disminuir la dosis individual que produce los movimientos anormales. Desafortunadamente la reducción de la L-Dopa condiciona la reaparición del parkinsonismo. En este caso es prudente adicionar al tratamiento la amantadina.
Amantadina (Kinestrel® y PK-Merz®). Si el ajuste de la L-Dopa no puede mejorar los síntomas de la discinesia sin inducir parkinsonismo, es necesario administrar 100 mg de amantadina dos veces al día inicialmente y después de tres a cuatro veces al día de acuerdo con la respuesta.
Agonistas dopaminérgicos
La Academia Americana de Neurología estableció que los agonistas dopaminérgicos (ropinirol y pramipexol) pueden utilizarse como alternativa en el tratamiento inicial o como tratamiento adicional a la L-Dopa para disminuir las complicaciones motoras a largo plazo.24 Este tratamiento es especialmente deseable para los pacientes más jóvenes con enfermedad leve en quienes se busca retrasar lo más posible el uso, finalmente inevitable, de la L-Dopa.25
Los agonistas dopaminérgicos actúan en forma directa sobre los receptores dopaminérgicos de la neurona postsináptica del cuerpo estriado, sin necesidad de ser almacenados por las neuronas de la vía nigroestriada. Todos los agonistas dopaminérgicos utilizados para el control de la sintomatología motora del paciente con enfermedad de Parkinson actúan sobre los receptores dopaminérgicos tipo 2 (D2), cuya concentración es alta en el cuerpo estriado, aunque varía su afinidad.
Los agonistas dopaminérgicos pueden ser productos derivados o no del cornezuelo de centeno (ergot). Así los agonistas dopaminérgicos derivados de éste son: pergolida, apomorfina y bromocriptina. Y los no derivados (no ergolinas) más utilizados en la actualidad son: ropinirol y pramipexol.26
Aunque el control de los síntomas es mejor con L-Dopa, los agonistas dopaminérgicos disminuyen el riesgo de desarrollar discinesia, distonía y fluctuaciones en la actividad motora. Sin embargo, se asocian a una serie de efectos secundarios como edema, somnolencia, estreñimiento, mareo, alucinaciones y náusea, que ocasionan el abandono del tratamiento con mayor frecuencia.25
Ropinirol
El ropinirol es un agonista potente de la dopamina que actúa sobre los receptores dopaminérgicos tipo 2 y 3 (D2 y D3). Además de la indicación del tratamiento de la enfermedad de Parkinson, también resulta útil para el síndrome de piernas inquietas. Debido a su actividad dopaminérgica a nivel hipotalámico, inhibe la secreción de prolactina. El ropinirol es metabolizado en el hígado por la isoenzima CYP1A2, lo que ocasiona que cuando se administran ciprofloxacina, enoxacina, fluvoxamina o estrógenos, pueden aumentar sus niveles séricos. En cambio el tabaquismo se relaciona con disminución de la concentración del ropinirol.
La administración del ropinirol en los pacientes con Parkinson debe iniciarse con 0.25mg tres veces al día, la segunda semana deben administrarse 0.5mg tres veces al día, la tercera semana 0.75mg tres veces al día y para la cuarta semana tomar 1 mg tres veces al día. El rango terapéutico es amplio y oscila entre tres y nueve miligramos diarios. Aunque puede administrarse con alimentos, la presencia de éstos disminuye la velocidad de absorción. Cuando se ha adicionado ropinirol al tratamiento con L-Dopa, es posible disminuir la dosis de ésta hasta en un 20%. Debe tenerse siempre presente que no debe suspenderse bruscamente el tratamiento, debido a que ello puede ocasionarse un síndrome maligno.27,28
La presentación del ropinirol (Requip IR®) es en tabletas de 0.25 y 1mg.
Pramipexol
El pramipexol es un agonista de la dopamina con afinidad por los receptores D2 y D3. Como este medicamento tiene una eliminación fundamentalmente vía renal, la cimetidina y otras sustancias que inhiben la excreción tubular renal pueden disminuir su eliminación. No existe interacción con la selegilina; con la L-Dopa puede ser necesario disminuir su dosis; con la amantadina, cuya eliminación también es renal, puede ocurrir alguna interacción. Su administración debe iniciarse con 0.125mg tres veces al día, con incrementos posteriores a 0.250 tres veces al día en la segunda semana y a 0.50 tres veces al día en la tercera semana. El efecto terapéutico se observa con esta última posología, de 1.5mg diarios. Si se desea alcanzar el máximo efecto terapéutico, los incrementos posteriores deben hacerse adicionando 0.750mg semanalmente, no más rápidos, vigilando la presencia de efectos secundarios y sin rebasar 4.5mg diarios, correspondientes a la dosis máxima.28
La presentación del pramipexol (Sifrol®) es en tabletas de 0.125, 0.25, 0.50, 1.0 y 1.5mg.
Bromocriptina
Aunque la bromocriptina tiende a producir menos efectos colaterales a nivel motor, muchos pacientes abandonan el tratamiento debido a estos efectos o a falta de respuesta al tratamiento. Cuando se ha utilizado la bromocriptina combinada con la L-Dopa no parece prevenir ni retrasar las complicaciones motoras.28,29
La bromocriptina (Parlodel®) viene en comprimidos de 2.5 y 5mg.
Rotigotina (Nubrenza)
Es un agonista dopaminérgico no derivado del cornezuelo que se administra en forma transdérmica en parche. Sus indicaciones son el tratamiento de la enfermedad de Parkinson y el síndrome de pierna inquietas. Desde el año 2008 ya no está disponible en los Estados Unidos, pero sí en México (cuadro 1).
Inhibidores del metabolismo de la dopamina
Inhibidores de la MAOB
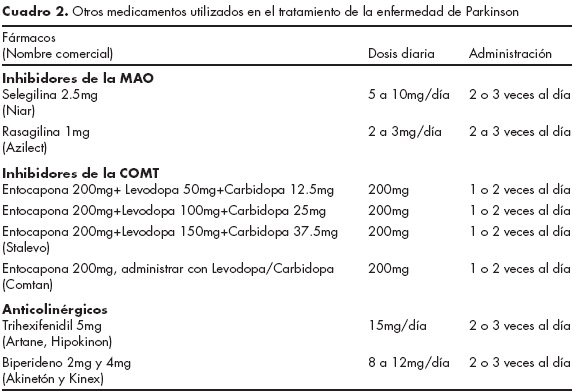
La degeneración de las neuronas dopaminérgicas del sistema nigroestriado causa la acinesia/bradicinesia, rigidez y temblor. Los inhibidores de la monoamino oxidasa tipo B (MAOB), como la selegilina, la rasagilina y la safinamida, se utilizan para aumentar la concentración de dopamina en la sinapsis al impedir la acción de la monoamino oxidasa (MAO). La función de la MAO es destruir la dopamina y otros neurotransmisores una vez que han sido recapturados en la neurona presináptica.30 La selegilina y la rasagilina pueden utilizarse desde el inicio del tratamiento de la enfermedad de Parkinson, aunque se recomiendan para etapas más avanzadas y en los casos en que el tratamiento con L-Dopa dé lugar a fluctuaciones importantes. Es probable que además tengan acciones de neuroprotección, como lo muestran los estudios realizados en animales. Cuando se ha utilizado la selegilina como tratamiento inicial de los pacientes con enfermedad de Parkinson, ha tenido que adicionarse L-Dopa después de tres o cuatro años.29 La selegilina inhibe selectivamente la monoamino oxidasa tipo B (MAOB), disminuyendo el catabolismo de la dopamina en la neurona presináptica y aumentando la concentración y actividad de este neurotransmisor.30 La selegilina inhibe la MAO, de forma selectiva y reversible, y sólo inhibe la MAOB, lo que permite el metabolismo de sustancias químicas que pueden afectar el funcionamiento del Sistema Nervioso Central, por lo que no es indispensable evitar los alimentos que contengan tiramina, como quesos, vinos, cerveza, embutidos, alimentos en salmuera, yogurt, soya y frijol. Sin embargo, debe vigilarse de manera rutinaria la presencia de hipertensión y evitar el uso de opioides y antidepresivos. Estas recomendaciones y restricciones deben mantenerse hasta una semana después de haber suspendido la administración de la selegilina. La administración de la selegilina debe iniciarse con 2.5mg por la mañana y, si no se observan efectos secundarios importantes (vértigo, náusea y vómito, cefalea, hipotensión, ansiedad, palpitaciones, alucinaciones o confusión), se puede aumentar a 5mg diarios dividida en dos dosis, vigilando los efectos secundarios y la interacción con medicamentos y alimentos. La dosis habitual es de 10mg diarios, 5mg dos veces al día.28 La presentación de la selegilina (Niar®) es de 5mg. Actualmente su uso ha decrecido con el uso de otros fármacos.
La rasagilina es otro inhibidor selectivo de la MAOB que a dosis de 1 mg produce mejoría de los síntomas motores.31 La rasagilina (Azilect®) viene en comprimidos de 1mg (cuadro 2).
Inhibidores de la COMT
Entacapona
La combinación de la carbidopa/levodopa con la entacapona, inhibidora de la enzima catecol-O-metiltransferasa (COMT) encargada del metabolismo de las catecolaminas en la hendidura sináptica, se ha utilizado como tratamiento de inicio; sin embargo, su efecto puede no ser mayor que el de la carbidopa/levodopa sola.32 Esta combinación está indicada cuando existen fluctuaciones motoras debido al efecto ON/OFF de la L-Dopa. Sin embargo, el beneficio sobre ellas y sobre la discinesia puede no ser suficiente, y en cambio pueden presentarse mayores efectos secundarios, incluidas náuseas y diarrea.28,29 Existe alguna evidencia de que el uso de este inhibidor de la COMT puede aumentar el riesgo de problemas cardiovasculares y cáncer de próstata.29
El Stalevo® contiene 200 mg de entacapona con concentraciones variables de L-Dopa (50, 100, 150 y 200mg) y de carbidopa (12.5, 25, 37.5 y 50mg) (cuadro 2).
Anticolinérgicos
Los anticolinérgicos pueden resultar de cierta utilidad pero producen efectos secundarios graves como confusión mental, alteraciones de la memoria, inquietud y alucinaciones. Su uso está contraindicado en pacientes seniles, sobre todo en aquéllos con demencia.29
El trihexifenidilo (Artane® e Hipokinon®) y el biperideno (Akinetron® y Kinex®) son dos anticolinérgicos disponibles. Sus presentaciones respectivas son 5mg, y 2 y 4mg. Los anticolinérgicos pueden ser el tratamiento inicial en pacientes cuya sola manifestación sea temblor o rigidez incipiente y también pueden combinarse con los medicamentos ya descritos (cuadro 2).
Tratamiento quirúrgico de la enfermedad de Parkinson
En general, existen dos tipos de cirugías para los pacientes con enfermedad de Parkinson:28 los procedimientos lesionales y la estimulación cerebral profunda.
Procedimientos lesionales. Las cirugías lesionales consisten en la introducción de un electrodo que quema el núcleo o las fibras que son los blancos para mejorar los síntomas. Dentro de las cirugías se cuentan: la talamotomía (destrucción del núcleo VOa, Vop o Vim del tálamo), la palidotomía (lesión del globo pálido interno), la leucotomía de RAPRL (radiaciones prelemniscales) y la subtalamotomía (fulguración del núcleo subtalámico).33
El transplante de células productoras de dopamina, fetales o de la médula suprarrenal son también dos maniobras quirúrgicas utilizadas en el tratamiento de la enfermedad de Parkinson.34 Estas últimas han caído en desuso, pero un panorama muy prometedor es el desarrollo de las células madre en la terapéutica de la enfermedad.
La estimulación cerebral profunda. La estimulación cerebral profunda es un tratamiento efectivo para los pacientes con síntomas motores refractarios a medicamentos. Está basada en el mismo principio de los marcapasos cardiacos y consiste en la implantación de electrodos en los mismos blancos que han servido para la lesión como el tálamo, fundamentalmente para tratar el temblor, o en el globo pálido, para tratar la rigidez y en menor grado el temblor, que permiten la estimulación eléctrica a través de un dispositivo similar a un marcapaso cardiaco controlado por el propio paciente.35
Actualmente, el estándar de oro para tratar la mayoría de los síntomas de la enfermedad es la estimulación cerebral profunda del núcleo subtalámico, que mejora la función motora, incluidos la marcha y el equilibrio, del paciente con enfermedad de Parkinson.36 En los estudios de seguimiento a diez años se ha observado mejoría significativa en la actividad motora, en el tremor en reposo y durante la actividad, así como en la bradicinesia. Por otro lado, también reduce la presencia de discinesia y de las fluctuaciones motoras y hace posible utilizar dosis menores de medicamentos.37 Otros sitios están surgiendo como blancos para la estimulación cerebral: las RAPRL, la corteza motora, el núcleo pedúnculo pontino y la zona incerta.38
REFERENCIAS
1. Carson AJ, Zeman A, Stone J, Sharpe MC. Neurology and neurosurgery. En: Levenson JL (ed.). Textbook of psychosomatic medicine. Psychiatric care of the medically ill. Washington: APPI; 2011. [ Links ]
2. Lerner AJ, Riley D. Neuropsychiatric aspects of dementias associated with motor dysfunction. En: Yudofsky SC, Hales RE (eds). The American psychiatric publishing textbook of neuropsychiatry and behavioral sciences. Quinta edición. Arlington: APPI; 2008. [ Links ]
3. Parkinson J. An essay on the shaking palsy. J Neuropsychiatry Clin Neurosci 2002;14:223-236. [ Links ]
4. Goetz CG. Charcot on Parkinson's disease. Mov Disord 1986;1(1):27-32. [ Links ]
5. Kempster PA, Hurwitz B, Lees AJ. A new look at James Parkinson's Essay on the Shaking Palsy. Neurology 2007;69(5):482-485. [ Links ]
6. Louis ED. The shaking palsy, the first forty-five years: a journey through the British literature. Mov Disord 1997;12(6):1068-1072. [ Links ]
7. Lees AJ. Unresolved issues relating to the shaking palsy on the celebration of James Parkinson's 250th birthday. Mov Disord 2007;22(Supl 17):s327-s334. [ Links ]
8. Parent M, Parent A. Substantia nigra and Parkinson's disease: a brief history of their long and intimate relationship. Can J Neurol Sci 2010;37(3):313-319. [ Links ]
9. Marsh L, Margolis RL. Neuropsychiatric aspects of movement disorders. En: Kaplan, Sadock's (eds.). Comprehensive textbook of psychiatry. Philadelphia: Lippincott Willimas & Wilkins; 2009; pp.481-493. [ Links ]
10. Malaspina D, Corcoran C, Schobel S, Hamilton SP. Epidemiological and genetic aspects of neuropsychiatric disorders. En: Yudofsky SC, Hales RE (eds). The American psychiatric publishing textbook of neuropsychiatry and behavioral sciences. Quinta edición. Arlington: APPI; 2008. [ Links ]
11. Sun Y, Chang YH, Chen HF, Su YH et al. Risk of Parkinson disease onset in patients with diabetes. A 9- year population- based cohort study with age and sex stratifications. Diabetes 2012;35:1047-1049. [ Links ]
12. Alexander GE, Crutcher MD, DeLong MR. Basal ganglia-thalamocortical circuits : Parallel substrates for motor, oculomotor, prefrontal and limbic functions. Prog Brain Res 1990;85:119-146. [ Links ]
13. Hoehn MM, Yahr MD. Pakinsonism: onset, progression, and mortality. Neurology 1967;17:427-442. [ Links ]
14. Fahn S, Elton R. Miembros del Comité de Desarrollo de la UPDRS En: Fahn S, Marsden CD, Calne DB, http://www.mdvu.org/library/ratingscales/pd/updrs.pdf. Accesada el 12 de abril de 2012. [ Links ]
15. Goetz CG, Tilley BC, Shaftman ST et al. Movement disorder society-sponsored revision of the Unified Parkinson's Disease Rating Scale (MDS- UPDRS): scale presentation and clinimetric testing results. Mov Disord 2008:23(15):2129-2170. [ Links ]
16. Rodríguez-Oroz MC, Jahanshahi M, Krack P et al. Initial clinical manifestations of Parkinson's disease: features and pathophysiological mechanisms. Lancet Neurol 2009;8:1128-1139. [ Links ]
17. Uchivama T, Sakakibara R, Yamamoto T et al. Urinary dysfunction in early and untreated Parkinson's disease. J Neurol Neurosurg Psychiatry 2011;82:1382-1386. [ Links ]
18. Ahlskog JE. Cheaper, simpler, and better: Tips for treating seniors with Parkinson disease. Mayo Clin Proc 2011;86(12):1211-1216. [ Links ]
19. Whone AL, Watts RL, Stoessl AJ et al. Slower progression of Parkinson's disease with ropinirole versus levodopa: The REAL-PET study. Ann Neurol 2003;54(1):93-101. [ Links ]
20. Parkinson Study Group. Dopamine transporter brain imaging to assess the effects of pramipexole vs levodopa on Parkinson disease progression. JAMA 2002;287(13):1653-1661. [ Links ]
21. Olanow CW, Hauser RA, Jankovic J et al. A randomized, double-blind, placebo-controlled, delayed start study to assess rasagiline as a disease modifying therapy in Parkinson's disease (the ADAGIO study): rationale, design, and baseline characteristics. Mov Disord 2008;23(15):2194-2201. [ Links ]
22. Ahlskog JE. Parkinson's disease: does vigorous exercise have a neuroprotective effect in Parkinson's disease? Neurology 2011;77:288-294. [ Links ]
23. Estañol-Vidal B, Senties Madrid H. Enfermedad de Parkinson. En: De la Fuente JR, Heinze G (eds). Salud mental y medicina psicológica. México: McGraw Hill, 2012. [ Links ]
24. Miyasaki JM, Martin W, Suchowersky O et al. Practice parameter: Initiation of treatment for Parkinson's disease: an evidence- based review: report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology 2002;58:11-17. [ Links ]
25. Hitzema N, Rafii F. Am Fam Physician 2009; 80 (1): 28- 30. [ Links ]
26. Leentjens AFG. The role of dopamine agonists in the treatment of depression in patients with Parkinson's disease. A systematic review. Drugs 2011;71(3):273-286. [ Links ]
27. Hauser RA, Rascol O, Korczyn AD et al. Ten- year follow- up of Parkinson's disease patients randomized to initial therapy with ropinirole or levodopa. Mov Disord 2007;22(16):2409-2417. [ Links ]
28. Olanow CW, Stern MB, Sethi K. The scientific and clinical basis for the treatment of Parkinson disease. Neurology 2009;72(21) (Supl 4):S1-S136. [ Links ]
29. Jain L, Benko R, Safranek S. Which drugs work best for early Parkinson's disease? J Fam Pract 2012;61(2):106-108. [ Links ]
30. Chávez-León E, Del Bosque Garza J, Ontiveros-Uribe MP. Manual de psicofarmacología. México: Asociación Psiquiátrica Mexicana; 2007. [ Links ]
31. Schapira A. Monoamine oxidase B inhibitors for the treatment of Parkinson's disease: A review of symptomatic and potential disease- modifying effects. CNS Drugs 2011;25(12):1061-1071. [ Links ]
32. Stocchi F, Rascol O, Kieburtz K et al. Initiating levodopa/carbidopa therapy with and without entacapone in early Parkinson disease: the STRIDE-PD study. Ann Neurol 2010;68:18-27. [ Links ]
33. Sandoval LI, Jiménez F, Soto J et al. Resultados del tratamiento quirúrgico de la enfermedad de Parkinson en la Unidad de Neurocirugía Funcional, Estereotaxia y Radiocirugía, del Hospital General de México en el período de 1992 a 2009. Rev Mex Neuroci 2010;11(1):20-25. [ Links ]
34. Behari M, Singhal KK. Cell based therapies in Parkinson's disease. Ann Neurosc. 2011; 18 (2): 76- 83. [ Links ]
35. Weaver FM, Follet K, Stern M et al. Bilateral deep brain stimulation vs best medical therapy for patients with advanced Parkinson disease: a randomized controlled trial. JAMA 2009;301(1):63-73. [ Links ]
36. McNeely ME, Hershey T, Campbell MC et al. Effects of deep brain stimulation of dorsal versus ventral subthalamic nucleus regions on gait and balance in Parkinson's disease. J Neurol Neurosurg Psychiatry 2011;82:1250-1255. [ Links ]
37. Castrioto A, Lozano AM, Poon YY et al. Ten-year outcome of subtha-lamic stimulation in Parkinson disease: A blinded evaluation. Arch Neurol 2011;68:1550-1556. [ Links ]
38. Carrillo-Ruiz J, Velasco F, Jiménez F et al. Prelemniscal radiation neuromodulation in Parkinson's disease treatment. En: Topics in Neuromodulation treatment. José D. Carrillo-Ruiz (ed). Croacia: Intech; 2012; pp. 63-86. [ Links ]
Artículo sin conflicto de intereses




![Adaptación y validación psicométrica del Cuestionario de Consecuencias Funcionales del Dormir (Functional Outcomes Sleep Questionnaire [FOSQ]) en habitantes de la Ciudad de México](/img/pt/prev.gif)









