Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Salud mental
versión impresa ISSN 0185-3325
Salud Ment vol.36 no.3 México may./jun. 2013
Artículo original
Consideraciones metodológicas y éticas para la conducción de ensayos clínicos controlados aleatorizados (ECCA) sobre intervenciones para las adicciones
Methodological and ethical aspects in conducting randomized controlled clinical trials (RCT) for addictive disorder's interventions
Rodrigo Marín-Navarrete,1 José Fernández-Mondragón,1 Angélica Eliosa-Hernández,1 Liliana Templos Nuñez,1 Javier Graue-Moreno,1 Diana Galván-Sosa,1 Carla Fernández-De la Fuente,1Georgina Gómez-Valencia,1 Carlos Berlanga2
1 Unidad de Ensayos Clínicos. Subdirección de Investigaciones Clínicas. INPRFM.
2 Sub-Director de Investigaciones Clínicas. INPRFM.
Correspondencia: Dr. Rodrigo Marín-Navarrete.
Unidad de Ensayos Clínicos, Sub-Dirección de Investigaciones Clínicas,
Instituto Nacional de Psiquiatría Ramón de la Fuente Muñiz,
Calz. México-Xochimilco 1 01, San Lorenzo Huipulco, Tlalpan, 14370, México DF.
Tel. (55) 41 60 - 5480 y 5481. E-mail: rmarin@inprf.gob.mx
ABSTRACT
According to epidemiologic reports, the harmful use of alcohol and illicit drugs has increased among the Mexican population. This use is associated to several risks and issues that affect public health and the public well-being of the country. In this article it is acknowledged the need for development of treatment models and interventions whose therapeutic value is demonstrated by scientific evidence, that respond to the attention needs of the population affected by substance use in our country and that can be generalized in community clinical practice.
In clinical research, randomized controlled clinical trials (RCT's) are the "gold standard" to demonstrate the effect of a therapeutic intervention. A randomized controlled clinical trial is a prospective study in which the effect, value and safety of one or various experimental interventions are tested against a "control" intervention in human subjects.
Acknowledging that in Mexico there is a lack of research on addiction treatment that is compliant with all the requirements to be considered as an RCT, this article presents some methodological and ethical considerations that are neccesary for their design and conduction. These considerations include from the establishment of a relevant research question and objectives, adequate study design, development of strategies for data management, statistical analysis, monitoring of interventions, safety monitoring and research quality assurance and protection of human subjects.
Key words: Substance use disorders, treatment, controlled clinical trials, randomized clinical trials, methodology, ethical aspects.
RESUMEN
Según reportes epidemiológicos, el consumo nocivo de alcohol y drogas ilegales dentro de la población mexicana ha ido en aumento, lo que se asocia a varios riesgos o problemáticas que afectan la salud y bienestar públicos del país. Se reconoce la necesidad de desarrollar modelos de tratamiento e intervenciones cuyo valor terapéutico esté respaldado por la evidencia científica, que respondan a las necesidades de atención de la población afectada por el consumo de sustancias en nuestro país y que puedan generalizarse en la práctica clínica comunitaria.
Dentro de la investigación clínica, el "estándar de oro" para demostrar el efecto de una intervención terapéutica son los ensayos clínicos controlados aleatorizados (ECCA). Un ECCA es un estudio prospectivo en el cual se prueba el efecto, valor y seguridad de una o varias intervenciones experimentales contra una intervención "control" en sujetos humanos.
Reconociendo que en México hay una falta de investigaciones sobre tratamientos para las adicciones que cumplan con todos los requisitos para ser considerados ECCA, en este artículo se presentan distintas consideraciones metodológicas y éticas que deben tomarse en cuenta para su diseño y conducción en la materia; abarcando aspectos que parten desde el establecimiento de una pregunta y objetivos relevantes hasta el diseño adecuado del estudio y el desarrollo de estrategias para la administración de datos, análisis estadístico, monitoreo de las intervenciones, monitoreo de seguridad y aseguramiento de la calidad de la investigación y protección de los sujetos humanos que participan.
Palabras clave: Trastornos por consumo de sustancias, tratamiento, ensayos clínicos controlados, ensayos clínicos aleatorizados, metodología, aspectos éticos.
INTRODUCCIÓN
Diversos reportes internacionales señalan que existe una tendencia hacia el aumento, o la estabilización, en la prevalencia del consumo nocivo de alcohol y drogas en la población mundial y nacional.1,2 Dicho consumo se encuentra asociado a diversos riesgos y problemas de impacto y relevancia para la salud y el bienestar público como la comorbilidad psiquiátrica, la mortalidad por enfermedades crónicas, los accidentes automovilísticos que causan muertes y discapacidad, entre otras más que generan un deterioro en la calidad de vida y estabilidad de la población.3-7 Ante este escenario es de vital importancia que las intervenciones dedicadas a minimizar el impacto del consumo de sustancias se encuentren razonablemente fundamentadas por los hallazgos de la investigación clínica.6
Entre los principios recomendados para el tratamiento del consumo de sustancias por la Organización Mundial de la Salud (OMS) y por la Oficina de las Naciones Unidas para la Droga y el Delito (UNODC) se encuentra el desarrollo y diseminación de modelos de tratamiento basados en evidencia científica que sean reproducibles y sensibles a las distintas necesidades de cada paciente y de su contexto socio-cultural.8 Dentro de las investigaciones clínicas, el "estándar de oro" para evaluar el efecto de una intervención es el modelo de ensayos clínicos controlados aleatorizados (ECCA). Un ensayo clínico es un estudio prospectivo en humanos en el cual se compara el efecto, valor y/o seguridad de una o más intervenciones terapéuticas contra una condición "estándar", que semeje a un experimento por control para establecer relaciones causa-efecto.9,10 Para que un ensayo clínico pueda cumplir su objetivo debe ser diseñado y conducido de acuerdo a principios científicos sólidos y debe ser reportado de manera
apropiada.11,12 Diversos esfuerzos realizados en otros países han buscado conducir ensayos clínicos con rigor científico para evaluar intervenciones especializadas en el tratamiento de las adicciones con relativo éxito, llevando a la diseminación de modelos de atención basados en evidencia a escenarios comunitarios de atención.13 Reconociendo que en México hace falta conducir investigaciones clínicas sobre tratamientos para las adicciones que cumplan con los estándares y rigor científico de un ECCA,14 este artículo tiene por objetivo presentar algunas consideraciones metodológicas y éticas que deben tenerse en mente para su diseño y conducción.
CONSIDERACIONES METODOLÓGICAS
De acuerdo al tipo de estudio
El establecer un diseño adecuado en la investigación de tratamientos en adicciones implica una mayor complejidad debido a la heterogeneidad de los pacientes consumidores de sustancias2,8 y a que no todos los tratamientos funcionan de la misma manera.15-17 También se deben tomar en cuenta otras variables relacionadas con la investigación de tratamientos y con la práctica clínica en adicciones. Dichas variables se pueden conceptualizar de la siguiente manera: ¿en cuál población?, ¿cuál intervención terapéutica (en qué dosis, a lo largo de cuánto tiempo)?, ¿aplicada por qué profesionales, en qué escenarios, con cuáles resultados se cree que está ligada la intervención y cuáles son los beneficios o ventajas que representa con respecto a lo ya disponible? 9,18 Así, los ECCA pueden clasificarse a partir de varios criterios distintos: por tipo de tratamiento, por diseño, por objetivo y por fase o etapa de desarrollo del tratamiento (figura 1).
De acuerdo al tipo de tratamiento
Pueden clasificarse en ensayos farmacológicos (incluyendo vacunas), terapias conductuales, cirugía, regímenes nutricionales y otros mecanismos terapéuticos.10
De acuerdo al diseño
Esta clasificación incluye, entre otros aspectos, la manera en que los participantes se asignan a las intervenciones.9,10,19 Cada tipo de ensayo según su diseño se describe con más detalle en el cuadro 1.

De acuerdo al objetivo
Pueden clasificarse en función de su objetivo o del momento dentro del desarrollo clínico de la intervención en que se encuentran (fase o etapa). En ambas clasificaciones se establece un razonamiento secuencial en el desarrollo de varios ensayos clínicos sobre una misma intervención considerando la influencia de los hallazgos obtenidos previamente. Esta diferenciación secuencial tiene una función descriptiva y no necesariamente implica que un ensayo deba encasillar su diseño alrededor de ésta pues un mismo ensayo puede presentar un diseño incorporando objetivos de varias fases o etapas de manera simultánea.11,19-22 Una descripción más detallada de cada tipo de ensayo según su objetivo se presenta en el cuadro 2.

De acuerdo a la fase de desarrollo en intervenciones farmacológicas y conductuales
Las intervenciones farmacológicas contemplan cuatro fases secuenciales que van desde una primera prueba experimental (fase I) en humanos, para ver su efecto, hasta pruebas de su interacción con otras drogas o tratamientos disponibles después de que se ha demostrado su uso terapéutico (fase IV).9-11,19,20,23 Una descripción más detallada de cada fase se presenta en el cuadro 3. Las intervenciones conductuales, en combinación con los tratamientos farmacológicos, presentan una buena relación costo-efectividad para reducir el consumo, extender el tiempo de abstinencia e impactar en otras áreas de funcionamiento de los pacientes.8,24 Onken, Blaine y Battjes (1997) proponen un modelo de investigación en etapas para terapias conductuales análogo al modelo farmacológico y que contempla tres etapas, las cuales se describen a detalle en el cuadro 4.25,26


Definición de la población de estudio
Implícito dentro de la formulación de la pregunta de investigación está el definir la población particular que participará en el ensayo. Para ello se propone plantearse las siguientes preguntas: ¿cuáles son los pacientes que más podrían recibir el beneficio terapéutico de la intervención?, ¿en cuáles es más detectable el efecto de la misma? , ¿quiénes son aquellos en los que la aplicación de la intervención representa un alto riesgo de daño o de no-mejora? y (en algunos casos) ¿se va a incluir a sujetos sanos en el estudio?. La respuestas a estas preguntas permitirán definir criterios de inclusión y criterios de exclusión que deberán seguirse para seleccionar a los pacientes.9,11,19,23
ALEATORIZACIÓN DEL TRATAMIENTO
Uno de los aspectos más importantes en un ECCA es la asignación por azar de tratamientos, ya que con ello se asegura que todos los participantes en el estudio tengan las mismas probabilidades de poder asignarse a la intervención (experimental o control) y sin que los investigadores puedan predecir o influir en este proceso, evitando así un "sesgo de selección".10,11,19,23,27 Existen distintos métodos de aleatorización acordes al diseño, al tamaño de la muestra y a los objetivos de cada ensayo, los cuales se describen en el cuadro 5.9-11,19,23,27
Análisis estadístico e interpretación de resultados
Su aplicación permite minimizar las fuentes de error en la interpretación de los resultados, por lo tanto es imprescindible sistematizar los procedimientos para lograr el análisis de resultados válidos y confiables. Dentro de las consideraciones estadísticas que se deben tomar en cuenta en el desarrollo de un ensayo clínico aleatorizado, existen tres temas fundamentales a desarrollar: 1) la planeación del tamaño de la muestra, 2) los procedimientos de aleatorización (explicados en la sección anterior) y 3) el plan de análisis estadístico27 (figura 2). De esta forma, una parte fundamental de los ECCA es implementar una estrategia en función de los objetivos del estudio,28,29 y fundamentada en el planteamiento del diseño.30 Adicionalmente, dentro del protocolo de investigación puede describirse brevemente el software utilizado para el análisis de datos, nombrar la utilización de técnicas estadísticas preliminares para asegurar el cumplimiento de los supuestos estadísticos o, en el caso de que no se cumplan, buscar pruebas equivalentes que no presenten dichas limitaciones.31
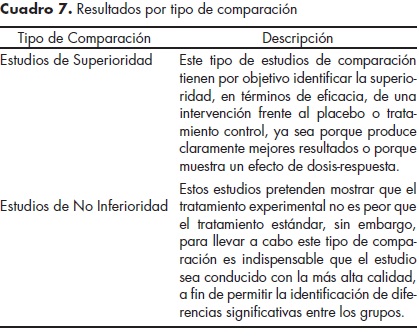
Para la interpretación de los resultados existen al menos dos métodos: el primero se refiere al principio de "intención de tratar", el cual considera la inclusión de todos los participantes aleatorizados en el análisis, a fin de mantener la comparabilidad entre los grupos de intervención;10,23,30,32 el segundo es el "análisis por protocolo", en el que únicamente se considera en los resultados a los que cumplieron con el protocolo a lo largo del estudio10,30 (cuadro 6). Por otro lado, los ECCA pueden tener dos tipos de comparación de resultados: los estudios de superioridad y los de no inferioridad. Los primeros identifican superioridad de una intervención en términos de eficacia; los segundos muestran que el tratamiento experimental no es peor que el tratamiento estándar. Ambos tipos de estudio se explican con mayor detalle en el cuadro 7. La opción a elegir dependerá de la relevancia clínica y no de la estadística.10,30

En un ensayo clínico controlado aleatorizado se lleva a cabo más de un análisis de datos a lo largo del estudio, en general éstos pueden dividirse en tres: análisis basal, intermedio o de seguimiento y análisis final. Cabe señalar que cada uno constituye un elemento imprescindible para la obtención válida y confiable de los resultados finales31 (cuadro 8).
Monitoreo clínico o de tratamiento
Una medida esencial para asegurar la validez interna en los ECCA es poder comprobar que la intervención terapéutica es administrada a todos los participantes en cumplimiento o adherencia con su diseño y evitar el "sesgo de intervención" tanto en los ensayos farmacológicos como en los conductuales.9,11,33 En los ensayos farmacológicos se debe asegurar el cumplimiento o adherencia, lo que implica contar con un procedimiento para monitorear que a todos los participantes se les administra el fármaco correcto y que reciben dicho fármaco siguiendo las indicaciones prescritas con opciones tales como muestras de sangre, marcadores biológicos asociados, monitoreo de los suministros, contabilización de píldoras, auto-reportes o revisión de registros.9,11,19,33 La elección de la estrategia deberá basarse en un análisis de su confiabilidad y usabilidad con respecto al diseño y objetivos del estudio así como las características particulares de la población de pacientes y la intervención del estudio.34
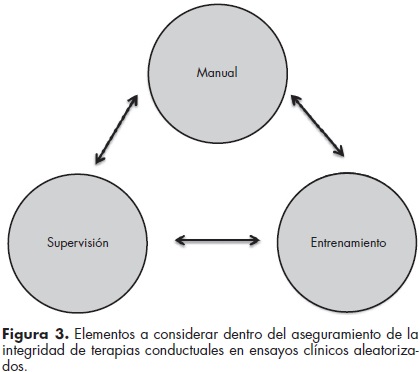
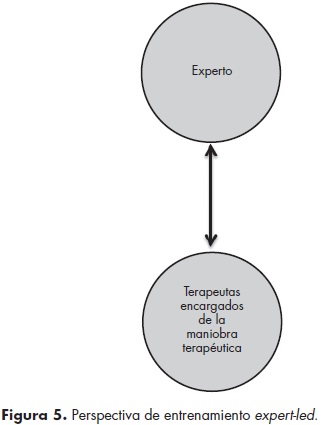
En las intervenciones conductuales la validez interna se afecta cuando existe poca o nula diferenciación entre los tratamientos, por intervenciones difusas y por variaciones en la forma en que se lleva a cabo la intervención.35 Por ello, la estandarización de la maniobra constituye un elemento crucial.36-38 Hay al menos tres elementos para asegurar la integridad de las terapias en los ECCA: el manual de intervención, el entrenamiento y la supervisión26,37,39,40 (figura 3). La creación de un manual para una nueva terapia conductual ocurre en la etapa I del modelo de etapas de las terapias conductuales mencionado previamente (cuadro 8),25 e implica la definición de los elementos críticos del nuevo tratamiento.26,41 Por lo que respecta al entrenamiento, existen diferentes retos a considerar. Éstos incluyen el grado de motivación, interés, experiencia y educación previa de los terapeutas, la aproximación terapéutica con que usualmente llevan a cabo su práctica y el formato y duración de la capacitación ofrecida.42 Beidas y Kendall (2010) proponen que un entrenamiento didáctico sin monitoreo ni evaluación de la práctica subsecuente de las habilidades aprendidas tiene poco o ningún efecto en la destreza y/o adherencia de los terapeutas a la maniobra aprendida. En este sentido, el entrenamiento y la supervisión se convierten en dos procesos muy ligados entre sí, ya que bajo esta óptica se aprende por medio de talleres prácticos y con supervisión continua y retroalimentación sobre el trabajo realizado en las sesiones.40,43-45 Dentro de este estilo se distinguen dos diferentes aproximaciones: expert-led y train-the-trainer. En la perspectiva train-the-trainer (figura 4), o entrenar al entrenador, un experto entrena a otros terapeutas en la maniobra y les enseña cómo entrenar a su vez a otras personas en su centro de tratamiento, sosteniendo sesiones de retroalimentación, monitoreo y supervisión constantes.46 En esta aproximación, a diferencia del expert-led (figura 5), se tiene la ventaja de contar con un profesional que conoce el tratamiento y que al mismo tiempo cuenta con la capacidad de entrenar y supervisar a otros profesionales. Es así que se convierte en un supervisor cuya práctica favorece la fidelidad a la maniobra terapéutica, y por ende protege la validez interna del estudio.47

El entrenamiento, la acreditación y la supervisión continua están ligados al proceso de transferencia de entrenamiento y a la transferencia de tecnología, traduciéndose esto en la diseminación y utilización de maniobras eficaces y efectivas en escenarios reales,47,48 lo que significa un gran reto en la atención del consumo de sustancias.42
Monitoreo de seguridad
La evidencia que respalda la decisión clínica de utilizar una intervención sobre otra se constituye en la misma dimensión tanto por su eficacia o efectividad demostrada como por sus posibles efectos iatrogénicos, o no-deseados, en todas las poblaciones de pacientes donde potencialmente pueda aplicarse. Por esto es un requisito regulatorio en la conducción de ensayos clínicos el contar con un mecanismo o sistema de recolección de datos acerca de todos estos efectos en los participantes. Durante la conducción de un ECCA a todos estos efectos no-deseados se les identifica bajo la designación de "eventos adversos".9,10,49 En el tratamiento de las adicciones y de otros trastornos de la salud mental los pacientes tienen un alto riesgo de presentar afecciones renales, cardiacas o respiratorias e infecciones asociadas al consumo; así como accidentes, conductas sexuales de riesgo, comportamiento violento o problemas con la ley debidos al abuso de sustancias; además de una exacerbación de la sintomatología psiquiátrica, o incluso conductas suicidas, causadas por el consumo de alcohol o de drogas1,5,8,15,50,51 o dificultades en el funcionamiento familiar, laboral o social del sujeto.52 La conducción de un ECCA debe contemplar un plan acorde para la identificación, evaluación, seguimiento y reporte de posibles eventos adversos. Los mecanismos o herramientas que se utilicen para llevar a cabo este monitoreo de seguridad deberán ser parte del protocolo de investigación.9,52 En el cuadro 9 se muestra una propuesta de las distintas categorías de eventos adversos que deben identificarse en los participantes de un ECCA.9 Todo conocimiento que tengan los investigadores acerca de los posibles riesgos o eventos adversos que se detecten y que están relacionados con la intervención de estudio debe ser informado a las instancias regulatorias aplicables (p.ej. comités de ética institucionales) y, si se considera necesario, a todos los participantes del estudio.

ADMINISTRACIÓN DE DATOS
El propósito del ECCA es generar datos a partir de los cuales sea posible proveer una respuesta a una pregunta de investigación. Uno de los procesos asociados a esta tarea es la administración de datos, que es un proceso que se inicia desde antes del reclutamiento. Su finalidad es asegurar la calidad de los datos generados lo cual, en buena medida, depende de la claridad con la que se han definido los objetivos y el análisis estadístico del estudio.9 Los resultados que se reporten al finalizar son tan buenos como lo sea la calidad de los datos recaudados y analizados. Se define como "buen" resultado a aquél que suministra las respuestas correctas a las preguntas inicialmente planteadas, no a los resultados positivos o estadísticamente significativos.53 El plan de administración de datos abarca desde el diseño de los Formularios de Reporte de Caso (FRC) hasta la entrega de datos para el análisis estadístico. Por ello los datos necesitan ser constantemente monitoreados durante el estudio y se debe recolectar el máximo de datos posibles para su análisis.54 La introducción de nuevas tecnologías en el proceso de administración de datos ha reducido significativamente los errores que se producían al recolectarlos mediante los FRC al sustituirlos por los FRC electrónicos. Actualmente se utilizan los denominados Sistemas de Administración de Datos Clínicos (CDMS - Clinical Data Management Systems). Del mismo modo, la inclusión de la Internet permite que los CDMS estén disponibles en línea, permitiendo la recolección y/o monitoreo de datos en distintos sitios y horarios.
CONSIDERACIONES ÉTICAS
"Equipoise" o principio de incertidumbre sobre los tratamientos
La primera implicación ética asociada a los ensayos clínicos tiene que ver con la asignación aleatoria de intervenciones terapéuticas. Si los investigadores o clínicos que colaboran en el reclutamiento y tratamiento de pacientes para un ensayo clínico tienen "certidumbre" acerca de las ventajas terapéuticas de una intervención sobre otra, tienen la obligación ética de proveer al paciente aquella intervención que tenga más posibilidades de representar un beneficio para él.49,55 Freedman (1987) ha propuesto el principio ético de "Equipoise" el cual establece que para que un ECCA se realice, las intervenciones de estudio deberán ser "equiparables" entre sí en cuestiones del beneficio terapéutico que representan para el paciente. Esto implica que los investigadores, al no tener control sobre qué intervención terapéutica se proveerá a los participantes, deben estar en un estado de "genuina incertidumbre" acerca del posible beneficio terapéutico que recibirá el participante del estudio, independientemente de la intervención que se le asigne. La función última de la investigación sobre la intervención sería resolver esa incertidumbre.55-57
Plan de calidad y protección de los participantes
Aunque la investigación de tratamientos data desde antes,59 no fue sino hasta el siglo XX que se reconoció la necesidad de contar con estándares y regulaciones en función de asegurar la protección de los humanos participantes en una investigación.9,10,49 En el cuadro 10 se muestra a detalle una relación de las principales guías desarrolladas para estos fines.58-64 Toda investigación sobre una intervención lleva implícita un importante dilema ético en la calidad de sus resultados, pues éstos fundamentarán una decisión sobre la salud, tanto de los participantes como de los pacientes que potencialmente se verán beneficiados por ésta. En un esfuerzo de estandarización conducido por varias agencias reguladoras de medicamentos en varios países (englobadas como la Conferencia Internacional de Armonización o ICH, por sus siglas en inglés) sobre la investigación con sujetos humanos, se establecieron los Lineamientos de las Buenas Prácticas Clínicas (BPC), en 1990.58
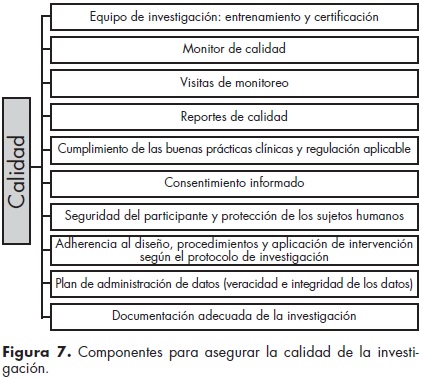
Todo ensayo clínico debe contemplar el desarrollo de un plan de monitoreo de calidad en donde se registre un seguimiento de la evolución del sujeto participante en el estudio. El objetivo de dicho plan, según las BPC, es asegurar que: a) estén protegidos los derechos y el bienestar de los sujetos humanos, b) los datos reportados del estudio estén completos, sean precisos y verificables, c) la conducción del estudio esté en conformidad con el diseño y procedimientos reportados por los investigadores, con las BPC, y con las regulaciones aplicables63,64 (figura 6). Un punto esencial es la constante auditoría del ensayo desde su diseño, planeación, ejecución y análisis y reporte de resultados en la que deben estar involucrados autoridades, patrocinadores, investigadores y colaboradores relacionados con el estudio. En la figura 7 se enumeran todos los componentes que deben estar involucrados en la investigación para el aseguramiento de la calidad.

Consentimiento informado y confidencialidad
En México, la Ley General de Salud, en su artículo 20 del reglamento en materia de investigación para la salud, define el consentimiento informado como: "el acuerdo por escrito, mediante el cual el sujeto de investigación o, en su caso, su representante legal autoriza su participación en la investigación, con pleno conocimiento de la naturaleza de los procedimientos y riesgos a los que se someterá, con la capacidad de libre elección y sin coacción alguna".62 En el consentimiento informado se encuadran las particularidades de la participación del sujeto en la investigación, y se documenta la decisión del paciente de participar en ella.65 Es responsabilidad de los investigadores redactarlo de manera clara y sin ambigüedades, siguiendo una estructura de contenidos.63,64 En el cuadro 11 se muestra una propuesta de contenido para el documento de consentimiento informado a partir de lo establecido en la Ley General de Salud y las Buenas Prácticas Clínicas.62,63 Se debe entregar al participante un duplicado del documento de consentimiento informado firmado, así como hacer público el procedimiento mediante el cual se obtuvo.11,49,62

Una investigación clínica trata usualmente de cuestiones de naturaleza personal de los participantes cuyo manejo es delicado. En el caso particular de las investigaciones sobre trastornos por consumo de sustancias esta información adquiere un grado mayor de delicadeza, pues los participantes se exponen a sufrir consecuencias legales o sociales si se llegase a revelar su identidad como participantes en un ensayo clínico.49 Toda información que pueda identificar a los participantes debe mantenerse bajo estricta confidencialidad. Es indispensable que los investigadores informen a los participantes antes de su reclutamiento, así como a las instancias regulatorias aplicables, acerca de los procedimientos que se seguirán para garantizar la confidencialidad de los participantes así como sobre los casos en que ésta puede estar limitada (p.ej. si durante su participación se identifica un riesgo suicida en el paciente se deberá notificar a sus familiares y responsables clínicos para que se le derive a una atención especializada).10,11,49
REDACCIÓN DEL PROTOCOLO
El protocolo de investigación es un documento en el cual los investigadores hacen pública todas las consideraciones tomadas alrededor de la conducción de un ECCA para su revisión por las instancias regulatorias, patrocinadores y comunidad científica en general. Dicho documento debe describir de manera detallada todos los elementos y procedimientos que se van a realizar. Aunque no existe un consenso universal sobre lo que debe contener un documento de protocolo, pues puede variar de acuerdo a cada ensayo, se han hecho
esfuerzos por brindar un estándar de los contenidos mínimos que se deben incluir, entre los que se encuentran: los antecedentes y razonamiento del estudio, objetivos y pregunta de investigación, población a estudiar, intervenciones de estudio, método de reclutamiento y aleatorización de participantes, plan de análisis estadístico y las consideraciones éticas; adicionalmente pueden incluirse el plan de diseminación de la intervención una vez que se haya demostrado su efecto y el plan de administración del estudio9-11,27,66 (Cuadro 11).
CONCLUSIONES
En este trabajo hemos revisado, si bien no exhaustivamente, los principales aspectos metodológicos relacionados con los ECCA cuando se utilizan para realizar proyectos de investigación en el campo de las adicciones. Podemos concluir que estos lineamientos son la base indispensable para llevar a cabo tareas de investigación clínica en esta área con un alto grado de calidad. De esta manera los resultados que se obtengan podrán ser reproducidos por otros centros o bien ser extendidos a otras instancias relativas a los problemas de la salud.
En la Unidad de Ensayos Clínicos de la Subdirección de Investigaciones Clínicas del INPRFM se inició recientemente un proyecto de investigación con una intervención conductual en pacientes con adicciones, para el cual fue necesario llevar a cabo un riguroso entrenamiento metodológico. El aprendizaje y la experiencia derivados del mismo dieron la pauta para poder escribir este artículo. De esta forma, consideramos que su contenido ayudará a establecer los lineamientos mínimos indispensables para futuros estudios.
REFERENCIAS
1. UNODC. World Drug Report 2012. United Nations publication. Sales No. E.12.XI.1 [ Links ]
2. Instituto Nacional de Psiquiatría Ramón de la Fuente Muñiz; Instituto Nacional de Salud Pública; Secretaría de Salud. Encuesta Nacional de Adicciones 2011; México; 2012. [ Links ]
3. Secretaria de Salud. Subsecretaría de Prevención y Promoción de la Salud. Dirección General Adjunta de Epidemiología. Dirección de Investigación Operativa Epidemiológica. Sistema de Vigilancia Epidemiológica de las Adicciones (SISVEA). Informe 2009; México; 2009. [ Links ]
4. World Health Organization. The Global Burden of Disease: 2004 update. United Nations publication.; 2008. [ Links ]
5. Ocampo R., Bojórquez I., Cortés M. Consumo de sustancias y suicidios en México; resultados del Sistema de Vigilancia Epidemiológica de las Adicciones, 1994-2006. Salud Pública Mex 2009; 51: 306-313. [ Links ]
6. WHO, UNODC. Principles of Drug Dependence Treatment: Discussion Paper. United Nations publication 2008. [ Links ]
7. Degenhardt L., Hall W. Extent of illicit drug use and dependence, and their contribution to the global burden of disease. Lancet 2012; 379:55-70. [ Links ]
8. Strang J., Babor T., Caulkins, J., Fischer B., Foxcroft D., Humphreys K. Drug policy and the public good: evidence for effective interventions. Lancet 2012; 379: 71-83. [ Links ]
9. Friedman LM, Furberg CD, DeMets, DL. Fundamentals of Clinical Trials. 4th. Ed. New York. Springer; 2010. [ Links ]
10. Lazcano-Ponce E, Salazar-Martínez E, Gutierrez-Castrellón P, Angeles-Llerenas A, Hernández-Garduño, A. Viramontes, JL. Ensayos clínicos aleatorizados: variantes, métodos de aleatorización, análisis, consideraciones éticas y regulación. Salud Pública Mex; 2004; 46(6): 559-584. [ Links ]
11. International Conference of Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use. Harmonised Tripartite Guideline: General considerations for Clinical Trials. E8. ICH Harminised Tripartite Guideline; 1997. Obtenido en: www.ich.org. [ Links ]
12. Moher D, Shulz K, Altman D. The CONSORT Statement: revised recommendations for improving the quality of reports of parallel-group randomized trials. JAMA 2001;285(15):1987-1991. [ Links ]
13. McLelland, T. Congratularions on the 10-year anniversary of the National Drug Abuse Treatment Clinical Trial Network - Now, what's new for the coming decade?. Journal of Substance Abuse Tretment; 2010; 38(Suppl 1): S1-S3. [ Links ]
14. Rojas E, Real T, García-Silberman S, Medina-Mora ME. Revisión sistemática sobre tratamiento de adicciones en México. Salud Mental 2011; 34: 351-365. [ Links ]
15. Marín-Navarrete R, Benjet C, Borges G, Eliosa-Hernández A, Nanni-Alvarado R, Ayala-Ledesma, M, Fernández-Mondragón J, Medina-Mora ME. Comorbilidad de los trastornos por consumo de sustancias con otros trastornos psiquiátricos en centros residenciales de ayuda-mutua para la atención de las adicciones (CRAMAA). En prensa. [ Links ]
16. Tiet QQ, Mausbach, B. Treatments for patients with dual diagnoses: a review. Alcoholism: Clinical and Experimental Research 2007; 31(4): 513-536. [ Links ]
17. Medina-Mora ME, Borges G, Lara-Muñoz C, Benjet C, Blanco-Jaimes J, Fleiz-Bautista C, Villatoro-Velázquez J, Rojas-Guiot E, Zambrano-Ruiz J, Casanova-Rodas L, Aguilar-Gaxiola S. Prevalencia de trastornos mentales y uso de servicios: Resultados de la Encuesta Nacional de Epidemiología Psiquiátrica en México. Salud Mental 2003; 26(4):1-16. [ Links ]
18. Carroll K. Dissemination of evidence-based practices: how far we've come, and how much further we've got to go; Addiction 2012; 107: 1031-1033. [ Links ]
19. Lees B, Nitsch D, Wang D, Bakhai A. Patient Selection. En: Wang, Bakhai A (eds). Clinical Trials. A Practical Guide to Design, Analysis, and Reporting. Chicago. Remedica; 2006. [ Links ]
20. Clarke G. Improving the transition from basic efficacy research to effectiveness research in substance abuse treatment. Journal of Substance Abuse Treatment; 1995; 63(5): 718-725. [ Links ]
21. Robbins M, Alonso E, Horigian V, Bachrach K, Burlew K, Carrión I, Hodgkins C, Miller M, Schindler E, VanDeMark , Henderson C, Szapocznik J. Transporting Clinical Research to Community Settings: Designing and Conducting a Multisite Trial of Brief Strategic Family Therapy. Addiction Science & Clinical Practice; 2010; 5(2): 54-61. [ Links ]
22. Hien D, Cohen L, Campbell A. Methodological Innovation to Increase the Utility and Efficiency of Psychotherapy Research for Patients with Co-ocurring Mental Health and Substance Use Disorders. Professional Psychology Research and Practice; 2009; 40(5): 502-509. [ Links ]
23. Green S. Design of Randomized Trials. Epidemiologic Reviews; 2002; 24(1): 4-11. [ Links ]
24. Carroll K, Onken L. Behavioral Therapies for Drug Abuse. American Journal of Psychiatry; 2005; 162: 1452-1460. [ Links ]
25. Onken L, Blaine J, Battjes, R. Behavioral therapy research: A conceptualization of a process. En: Henngler S, Amentos R (eds), Innovative approaches from difficult to treat populations. Rochester, N.Y: University of Rochester Press; 1997. [ Links ]
26. Rounsaville B, Carroll K, Onken L. A Stage Model of Behavioral Therapies Research: Getting Started and Moving on From Stage 1. Clinical Psychology and Social Practice; 2001; 8:133-142. [ Links ]
27. Knatterud GL. Management and Conduct of Randomized Controlled Trials. Epidemiologic Reviews; 2002; 24(1): 12-25. [ Links ]
28. European Medicines Agency (2006) Statistical Principles for Clinical Trials. Recuperado de http://www.emea.eu.int [ Links ]
29. Guillén A., Carreño A., Canal N. (2006) Fases del análisis estadístico de los datos de un estudio. En Guillén A y Crespo R. (Ed.) Métodos estadísticos para enfermería nefrológica. (pp. 247-260) España: Sociedad Española de Enfermería Nefrológica, SEDEN. Recuperado de http://www.revistaseden.org/files/17-CAP17.pdf [ Links ]
30. Lazcano-Ponce E., Salazar-Martínez E., Gutiérrez-Castrellón P., Ánge-les-Llerenas A., Hernández-Garduño A., Viramontes J.L. (2009). Ensayos Clínicos Aleatorizados. En Hernández M. (Ed.). Epidemiología: Diseño y análisis de estudios. (1a ed., pp.77-119). México: Editorial Médica Panamericana e Instituto Nacional de Salud Pública. [ Links ]
31. Álvarez-Cáceres R. (2005). Ensayos Clínicos: diseño, análisis e interpretación. España: Díaz de Santos. [ Links ]
32. Peduzzi P., Henderson W., Hartigan P., Lavori P. (2002). Analysis of Randomized Controlled Trials. Epidemiol Rev, 1(24), 26-38. [ Links ]
33. Cramer J, Roy A. Burrell A, Fairchild C, Fuldeore M, Ollendorf D, Wong P. Medication Compliance and Persistence: Terminology and Definitions. Value in Health; 2008. 11(1): 44-47. [ Links ]
34. Farmer K. Methods for measuring and monitoring medication adherence in clinical trials and clinical practice. Clinical Therapeutics; 1999; 21(6): 1074-1090. [ Links ]
35. Kazdin AE. Methods of psychotherapy research. En Bongar B, Beutler E (eds.). Comprehensive textbook of psychotherapy: Theory and practice. New York: Oxford University Press. [ Links ]
36. Yeaton, W. H. & Sechrest, L. (1981). Critical dimensions in the choice and maintenance of successful treatments: Strength, integrity, and effectiveness.(Journal of Consulting and Clinical Psychology, 49, 156-167). [ Links ]
37. Carroll K, Martino S, Rousanville B. No Train, No Gain? Clinical Psychology: Science and Practice 2010;17:36-40. [ Links ]
38. Waskow IE. Specification of the technique variable in the NIMH Treatment of Depression Collaborative Research Program. En Williams J, Spitzer R (eds). Psychotherapy research: Where are we and where should we go. New York: Guilford Press;1984. [ Links ]
39. Chambless DL, Hollon SD. Defining empirically supported therapies. Journal of Consulting and Clinical Psychology 1998;66:7-18. [ Links ]
40. Beidas R, Kendall PC. Training therapists in evidence-based practice: A critical review of studies from a systems-contextual perspective. Clinical Psychology: Science and Practice 2010;17: 1-30. [ Links ]
41. Marcus M, Liehr P, Schmitz J, Moeller G, Swank P, Fine M, Cron S, Granmayeh K, Carroll D. Behavioral Therapies Trials: A Case Example. Nurs Res 2007;56(3):210-216. [ Links ]
42. Carroll K, Farentinos C, Ball S, Crits-Christoph P, Libby B, Morgenstern J, Obert J, Polcin D, Woody G. MET meets the real world: design issues and clinical strategies in the Clinical Trials Network. Journal of Substance Abuse Treatment 2002;23:73-80. [ Links ]
43. Miller W, Yahne C, Moyers T, Martínez J, Pirritano M. A Randomized Trial of Methods to Help Clinicians Learn Motivational Interviewing. Journal of Consulting and Clinical Psychology 2004;72:1050-1062. [ Links ]
44. Martino S, Carroll K, Ball S. Teaching, monitoring and evaluating motivational interviewing practice. En Tober G, Raistrick D. (eds). Motivational Dialogue: preparing addiction professionals for motivational interviewing practice. New York: Routledge/Taylor & Francis Group; 2007. [ Links ]
45. Carpenter KM, Cheng WY, Smith JL, Brooks AC, Amrhein PC, Wain RM, Nunes EV. "Old dogs" and new skills: how clinician characteristics relate to motivational interviewing skills before, during, and after training. J Consult Clin Psychol. 2012;80(4):560-573. [ Links ]
46. Martino S, Ball S, Nich C, Canning-Ball M, Rounsaville B, Carroll K. Teaching community program clinicians motivational interviewing using expert and train-the-trainer strategies. Addiction 2010;106:428-441. [ Links ]
47. Amodeo M, Storti S, Larson, M. Moving Empirically Supported Practices to Addiction Treatment Programs: Recruiting Supervisors to Help in Technology Transfer. Substance Use and Misuse 2010;45:968-982. [ Links ]
48. O'Donovan A, Halford W, Walters B. Towards Best Practice Supervision of Clinical Psychology Trainees. Australian Psychologist 2011;46:101-112. [ Links ]
49. Sugarman J. Ethics in the Design and Conduct of Clinical Trials. Epidemiologic Reviews; 2002; 24(1): 54-58. [ Links ]
50. Adrian M, Barry S. Physical and mental health problems associated with the use of alcohol and drugs. Substance Use and Misuse; 2003; 38: 1575-15614. [ Links ]
51. Petry N. Roll J, Runsaville B, Ball S, Stitzer M, Peirce, J, Blaine J, Kirby K, McCarty D, Carroll K. Serious adverse events in randomized psychosocial treatment studies: Safety of Arbitrary Edicts? J Consult Clin Psycol; 2008; 76(6):1076-1082. [ Links ]
52. Horigian V, Robbins M, Dominguez R, Ucha J, Rosa C. Principles for defining adverse events in behavioral intervention research: lessons from a family-focused adolescent drug abuse trial. Clinical Trials; 2010; 7(1): 58-68. [ Links ]
53. McFadden E. Management of Data in Clinical Trials. 2nd. Ed. Hoboken N.J. Wiley Series in Probability and Statistics; 2007. [ Links ]
54. Krishnankutty B, Bellary S, Kumar B, Moodahahu L. Data management in clinical research. Educational Forum; 2012; 44(2): 168-172. [ Links ]
55. Freedman B. Equipoise and the ethics of clinical research. New England Journal of Medicine; 1987; 317(3): 141-154. [ Links ]
56. Ubel P, Silbergleit R. Behavioral equipoise: a way to resolve ethical stalemates in clinical research. The American Journal of Bioethics; 2011; 11(2): 1-8. [ Links ]
57. Weijer C, Shapiro S, Cranley-Glass K, Enkin M. For and Against: Clinical Equipoise and not the uncertainty principle is the moral underpinning of the randomized controlled trial. British Medical Journal; 2000; 321: 756-758. [ Links ]
58. Tribunal Internacional de Núremberg. Código de Núremberg. 1947. Obtenido de: www.bioeticanet.info/documentos/Nuremberg.pdf [ Links ]
59. World Medical Association; WMA Declaration of Geneva. 1948. Obtenido de: http:///www.wma.net/en/30publications/10policies/g1/ [ Links ]
60. Declaración de Helsinki de la Asociación Médica Internacional. Principios éticos para las investigaciones médicas en seres humanos. Seúl; Asamblea Médica Internacional; 2008. Obtenido en: www.wma.net/es/30publications/10policies/b3/17c_es.pdf [ Links ]
61. National Commission for the Protection of Human Subjects of Biomedical and Behavioral Research. El Informe Belmont. Principios y Guías éticas para la protección de los sujetos humanos en investigación. EE.UU., 1979. Obtenido en www.bioeticaweb.com/index2.php?option_content&do_pdf=1&id=1060. [ Links ]
62. Reglamento de la Ley General de Salud en materia de Investigacion para la Salud. Título Segundo: de los aspectos éticos de la investigación en seres humanos. Capítulo 1: Disposiciones generales. 1983. Obtenido en: http://www.salud.gob.mx/unidades/cdi/nom/compi/rlgsmis.html [ Links ]
63. International Conference of Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use. ICH Harmonised Tripartite Guideline: Guideline for Good Clinical Practice. E6(R1.; 1996. Obtenido en: www.ich.org. [ Links ]
64. Organización Panamericana de la Salud. Grupo de trabajo en Buenas Prácticas Clínicas. Buenas Prácticas Clínicas: Documento de las Américas. Obtenido en www.paho.org/spanishadths/ev/BPC-doct-esp.doc [ Links ]
65. Mondragón-Barrios L. Ética en la Investigación Psicosocial. Salud Mental; 2007; 30(6): 25-31 [ Links ]
66. Chan A-W, Tetzla JM, Altman DG, et al. SPIRIT 2013 statement: defining standard protocol items for clinical trials. Ann Intern Med 2013; 158 (en prensa). [ Links ]














