Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Salud mental
versão impressa ISSN 0185-3325
Salud Ment vol.35 no.5 México Set./Out. 2012
Artículo original
Regulación de la liberación de serotonina en distintos compartimientos neuronales
Regulation of serotonin release from different neuronal compartments
Citlali Trueta,1 Montserrat G Cercós1
1Departamento de Neurofisiología, Subdirección de Investigaciones en Neurociencias, Instituto Nacional de Psiquiatría Ramón de la Fuente Muñiz.
Correspondencia:
Citlali Trueta. Departamento de Neurofisiología,
Subdirección de Investigaciones en Neurociencias,
Instituto Nacional de Psiquiatría Ramón de la Fuente Muñiz.
Calz. México-Xochimilco 101, San Lorenzo Huipulco,
Tlalpan, 14370, México, DF.
E-mail: ctrueta@imp.edu.mx
SUMMARY
Serotonin is fundamental for the modulation of social behavior, emotions and a wide variety of physiological functions. The functions of serotonergic systems have been highly conserved along the evolutionary scale and in general small numbers of neurons innervate virtually all the nervous system, and exert multiple effects depending on the site of release. Synaptic pools produce fast and local effects, while extrasynaptic pools in the soma, dendrites, axons and the periphery of synapses produce diffuse effects, characteristic of mood modulation. Serotonin release from synaptic terminals is produced by exocytosis of small clear vesicles and is activated by single or low-frequency impulses, while increases in the stimulation frequency produce synaptic facilitation and depression. In contrast, release from the soma is produced by exocytosis of dense-cored vesicles and requires stimulation at high frequencies, the activation of L-type calcium channels and calcium-induced calcium release from intracellular stores. Serotonin released from the presynaptic terminals immediately activates auto-receptors in the same terminals, locally decreasing the subsequent excitability, firing frequency and release. Differential regulation of serotonin release in different cell compartments allows the same neuron to produce different types of effects depending on the firing rate.
Key words: Serotonin, synapse, extrasynaptic, exocytosis, autoinhibition, firing rate.
RESUMEN
La serotonina es fundamental para la modulación de la conducta social, las emociones y una gran cantidad de funciones fisiológicas. La función de los sistemas serotonérgicos se ha conservado a lo largo de la escala evolutiva y, en general, números pequeños de neuronas inervan prácticamente todo el Sistema Nervioso. Estas neuronas son capaces de ejercer múltiples efectos, dependiendo de si liberan serotonina de pozas sinápticas, que ejercen efectos rápidos y locales o de pozas extrasinápticas en la periferia de las sinapsis, el axon, el cuerpo celular o las dendritas, con lo que se producen efectos lentos y difusos, característicos de los estados de ánimo. La liberación de serotonina en las terminales sinápticas es producida por la exocitosis de vesículas claras pequeñas y se activa con impulsos sencillos o a baja frecuencia. La estimulación con trenes de impulsos a frecuencias crecientes produce facilitación y depresión sináptica. En contraste, la liberación a partir del soma es producida por la exocitosis de vesículas de núcleo denso y requiere de la estimulación a frecuencias altas, la activación de canales de calcio tipo L y de la liberación de calcio de los depositos intracelulares. La serotonina liberada por las terminales sinápticas activa de manera inmediata autorreceptores en las propias terminales que la liberaron, disminuyendo la excitabilidad subsiguiente y, por lo tanto, la frecuencia de disparo y la liberación de manera localizada. La regulación diferencial de la liberación en cada compartimiento celular permite que la misma neurona produzca diferentes tipos de efectos dependiendo de la frecuencia de disparo.
Palabras clave: Serotonina, sinapsis, extrasináptico, exocitosis, autoinhibición, frecuencia de disparo.
INTRODUCCIÓN
La 5-hidroxitriptamina, también conocida como serotonina por la primera función que se describió para esta molécula, es un neurotransmisor y neuromodulador de gran relevancia en la regulación de estados de ánimo, funciones fisiológicas y conductas en los animales a lo largo de toda la escala filogenética, incluido el ser humano. En los mamíferos, los efectos de la serotonina se hacen evidentes en la regulación de diversos aspectos de la conducta social,1 la alimentación,2,3 el sueño, la atención,4 la ansiedad,5 los ritmos circadianos,6 la conducta sexual7,8 y la generación de patrones motores rítmicos como la locomoción, masticación y respiración,8-11 entre muchos otros. En los humanos, las alteraciones en el sistema serotonérgico están relacionadas con trastornos conductuales y neurológicos que incluyen los alimenticios, la depresión,12 la epilepsia,13 la esquizofrenia14 y la ansiedad.15
Las características del sistema serotonérgico y sus funciones se han mantenido altamente conservadas a lo largo de la escala evolutiva. Por ejemplo, la conducta agresiva y el establecimiento de la dominancia social son reguladas por la serotonina desde los crustáceos16-18 hasta los primates.1,19-21 Una característica especial que define a este sistema es que el número de neuronas serotonérgicas es pequeño comparado con el total de neuronas en el Sistema Nervioso; sin embargo, estas pocas neuronas regulan una gran diversidad de funciones. Por ejemplo, mientras en los anélidos el sistema serotonérgico está formado por siete neuronas (de un total de alrededor de 400) en cada ganglio segmental, los mamíferos tienen alrededor de 9000 neuronas serotonérgicas, lo que representa una proporción de sólo una por cada 200 000 neuronas en el Sistema Nervioso Central. Los somas de estas neuronas en los mamíferos se encuentran agrupadas en una serie de núcleos conocidos como los núcleos del raphé en el tallo cerebral, pero inervan todo el Sistema Nervioso Central.4,22 Los axones de las neuronas en los núcleos más posteriores ascienden para inervar el encéfalo, incluidos los ganglios basales, el tálamo, la corteza y el cerebelo, mientras que los de las neuronas de los núcleos anteriores descienden para inervar la médula espinal.
DIFERENTES MODOS DE LIBERACIÓN EN LAS MISMAS NEURONAS
Los axones de las neuronas serotonérgicas en el encéfalo se ramifican de manera profusa y dan lugar a miles de millones de terminales varicosas23,24 que inervan grandes volúmenes cerebrales de manera difusa. A pesar de que en algunas áreas del Sistema Nervioso, como la médula espinal y la substantia nigra reticulata, estas terminales establecen contactos sinápticos especializados; en muchas otras áreas la gran mayoría de estas terminales no establecen contactos sinápticos,25-29 sino que parecen ser sitios de liberación extrasináptica, en los que la serotonina es liberada al medio extracelular, por el que se difunde hasta encontrar receptores en neuronas a distintas distancias del sitio de liberación. Además de estos sitios de liberación extrasináptica en las varicosidades, el soma de las neuronas serotonérgicas tanto de vertebrados como de invertebrados libera grandes cantidades de serotonina al medio extracelular.30-32 Las neuronas serotonérgicas, entonces, liberan serotonina tanto a partir de terminales sinápticas, como a partir de sitios extrasinápticos en el soma, los axones y las dendritas.
La serotonina liberada por las terminales sinápticas produce efectos rápidos y localizados sobre las terminales postsinápticas, que se propagan únicamente a través de las neuronas que se conectan de manera directa con las serotonérgicas, como en un circuito eléctrico alambrado. Por el contrario, la serotonina liberada en sitios extrasinápticos se difunde en el medio extracelular en un volumen variable y puede activar cualquier neurona que tenga receptores para este transmisor, siempre que la concentración de serotonina que difunde sea suficiente para activar dichos receptores. Esto requiere de la liberación de grandes cantidades de moléculas y tiene efectos mucho más difusos que la liberación sináptica. Este mecanismo de acción, llamada transmisión paracrina, o transmisión por volumen,33,34 parece ser fundamental para la modulación de la actividad de los circuitos neuronales que regulan la conducta y las emociones.35 La liberación de neurotransmisores por el cuerpo celular de las neuronas parece ser una fuente importante de moléculas que median la transmisión por volumen y la modulación de los circuitos neuronales.32
Dado que el sistema serotonérgico está compuesto por un número relativamente pequeño de neuronas, que sin embargo regulan una gran cantidad de funciones diversas, y dado que estas neuronas liberan serotonina a partir de diferentes compartimientos celulares, con funciones distintas, no es difícil imaginar que la liberación de serotonina deba estar regulada de manera muy precisa y que la liberación a partir de cada compartimiento celular sea regulada de manera diferente, a pesar de ocurrir en la misma neurona. Nuestro grupo de trabajo se ha enfocado en el estudio de la regulación diferencial de la liberación de serotonina a partir de sitios sinápticos y extrasinápticos.
REGULACIÓN DE LA LIBERACIÓN SINÁPTICA Y EXTRASINÁPTICA DE SEROTONINA
Una propiedad fundamental de las neuronas es su capacidad para producir impulsos eléctricos y codificar la información que reciben y transmiten mediante cambios en la frecuencia de disparo de dichos impulsos. La frecuencia de disparo de potenciales de acción es fundamental para determinar la cantidad de neurotransmisor que libera una neurona, porque determina la cantidad de calcio que entra a través de canales de calcio sensibles al voltaje en la membrana plasmática. Por ello, hemos estudiado cómo la liberación sináptica y la extrasináptica dependen de la frecuencia de disparo de la neurona.
La liberación de serotonina a partir de terminales sinápticas es muy difícil de analizar en neuronas in situ dentro del Sistema Nervioso, porque las terminales sinápticas se encuentran en ramificaciones axonales lejanas al soma y sus efectos son difíciles de localizar. Por ello, prácticamente todo lo que se sabe acerca de los mecanismos de liberación sináptica de serotonina se ha estudiado en una sinapsis formada entre neuronas en cultivo, aisladas del Sistema Nervioso Central de la sanguijuela.36
El Sistema Nervioso Ccentral de la sanguijuela contiene 21 ganglios segmentales, que controlan de manera relativamente independiente cada segmento del animal y son similares entre sí. El número de neuronas en cada ganglio es relativamente pequeño y constante (alrededor de 400) y el gran tamaño de sus somas facilita los registros electrofisiológicos, de manera que la mayoría de las neuronas han sido identificadas por su función, sus conexiones y su patrón de actividad eléctrica, además de tener una forma, tamaño y localización característica en el ganglio. Este Sistema Nervioso tiene además la capacidad de regenerarse después de una lesión, formando de nuevo conexiones específicas y funcionales.37,38 Gracias a estas características, las neuronas identificadas pueden ser aisladas una a una y mantenidas en cultivo, donde sobreviven por semanas conservando sus características fisiológicas.39 Además, en cultivo forman sinapsis específicas, algunas de las cuales han sido ampliamente estudiadas.39-41
En cada ganglio de este Sistema Nervioso hay siete neuronas serotonérgicas, pero 50% de la serotonina es producido por un par de neuronas llamadas células de Retzius, localizadas en la parte central del ganglio. Las neuronas de Retzius en cultivo continúan sintetizando y liberando serotonina42 y si hacen contacto con otra neurona de Retzius o con una neurona mecanosensorial sensible a la presión (células P) forman una sinapsis química inhibidora donde la célula de Retzius es siempre presináptica43 y la liberación es cuántica y dependiente de calcio.44 Esta preparación tiene grandes ventajas para estudiar una sinapsis serotonérgica, ya que las terminales se forman muy cerca del soma y las células en cultivo son prácticamente isopotenciales, por lo que los registros de los eventos sinápticos son un reflejo fiel de la liberación de serotonina por la neurona presináptica. La figura 1 muestra un par de neuronas de Retzius formando una sinapsis en cultivo.

En las terminales presinápticas de las células de Retzius, la serotonina se encuentra tanto en vesículas claras pequeñas (40nm de diámetro), similares a las contenidas en la mayoría de las sinapsis, como en vesículas grandes (100nm de diámetro) de núcleo denso.45-47 Las vesículas claras se encuentran cerca de la membrana presináptica y liberan su contenido directamente a la hendidura sináptica fusionándose en la zona activa de la sinapsis. Las vesículas de núcleo denso liberan 17 veces más serotonina que las claras,46 y generalmente se encuentran rodeando a la poza de vesículas claras,45,47 por lo que se cree que no liberan su contenido directamente en la zona activa de la sinapsis, sino en sitios alrededor de ésta; es decir, producen liberación perisináptica, como ocurre con este tipo de vesículas en otros tipos neuronales. 48-50 En esta sinapsis, la liberación de serotonina depende del potencial de membrana presináptico y del calcio44,51 y presenta fenómenos de plasticidad similares a los de las sinapsis centrales, tales como facilitación causada por el calcio residual52 y depresión ante la actividad repetitiva.43
La liberación sináptica de serotonina se ha estudiado estimulando de manera controlada la neurona de Retzius presináptica y registrando las respuestas de la célula P post-sináptica en sinapsis formadas en cultivo. En esta preparación, las sinapsis se forman directamente sobre el soma de la célula postsináptica, o muy cerca de éste, y por ello las corrientes postsinápticas se pueden registrar directamente con microelectrodos en el soma de la célula postsináptica. Las corrientes postsinápticas son entonces un indicador fiel de la cantidad de serotonina liberada por la neurona presináptica.
Para producir la liberación de serotonina a partir de las vesículas claras contenidas en las terminales presinápticas, es suficiente el disparo de un potencial de acción, que produce la fusión de unas cuantas vesículas sinápticas44 (figura 1B). La estimulación con impulsos pareados produce facilitación sináptica,51,52 es decir, un incremento en la cantidad de transmisor liberado ante el segundo impulso, siempre que el intervalo entre los impulsos exceda unas cuantas centenas de milisegundos. La estimulación con trenes de impulsos produce, por otro lado, una facilitación al principio del tren, debida al incremento de la probabilidad de liberación por la entrada repetitiva de calcio, seguida de depresión sináptica, es decir, una disminución de la cantidad de transmisor liberado, debida al agotamiento de la poza de vesículas listas para liberar (figura 2). El balance entre la facilitación y la depresión cambia dependiendo de la frecuencia de disparo (Trueta y De-Miguel, en preparación), pero en cualquier caso, un tren de diez impulsos produce la liberación de únicamente unas decenas de vesículas de serotonina.

Por otro lado, la liberación a partir de las vesículas de núcleo denso que rodean las terminales sinápticas requiere de la estimulación repetitiva46 y se incrementa con la frecuencia de estimulación. La serotonina liberada a partir de esta poza de vesículas produce efectos en las terminales postsinápticas, pero es posible que también difunda en el espacio extrasináptico y alcance receptores en otras neuronas y medie efectos paracrinos.
En contraste con la liberación sináptica de serotonina, la liberación extrasináptica a partir del cuerpo celular de estas neuronas ocurre únicamente a partir de vesículas grandes de núcleo denso, que no están cerca de la membrana, y por lo tanto su movilización y fusión requieren de la estimulación con trenes de impulsos a frecuencias mucho mayores, cercanas a los 20 impulsos por segundo, para activarse.30,53 La liberación extrasináptica en el soma de las neuronas de Retzius se ha estudiado utilizando el colorante fluorescente FM1-43, que es un compuesto lipofílico que cuando se une a la membrana plasmática emite fluorescencia al ser iluminado con luz de una longitud de onda de 488nm, tiñendo la membrana. Cuando la neurona es estimulada y libera neurotransmisor, las vesículas secretoras que se fusionan con la membrana plasmática también se tiñen con el colorante que hay en el medio extracelular, haciendo que la intensidad de la fluorescencia se incremente.54 Posteriormente, cuando las vesículas se endocitan, se llevan consigo el colorante, y después de lavar el colorante del medio extracelular y de la membrana plasmática se observan puntos fluorescentes que indican los sitios donde ocurrió la exocitosis y la endocitosis. En las neuronas de Retzius hemos mostrado que el número de puntos fluorescentes se puede utilizar para estimar la cantidad de liberación que ocurrió en respuesta a la estimulación en presencia del colorante.30 La liberación somática de serotonina ocurre a partir de cúmulos de vesículas de núcleo denso, que actúan como unidades funcionales para la secreción. Cada cúmulo contiene entre 100 y 200 vesículas53 y su fusión con la membrana ocurre a lo largo de varios minutos después de un tren corto de estimulación eléctrica.30 La estimulación con un tren de diez impulsos a 10 o 20Hz produce la fusión de cerca de cien cúmulos vesiculares, es decir, se libera el contenido de 10 000 a 20 000 vesículas de núcleo denso, en contraste con la cantidad de vesículas que liberan su contenido en las termínales sinápticas. Debido a que los cúmulos vesiculares en las neuronas en reposo no están cerca de la membrana, sino que se encuentran a varias micras de distancia,53 la liberación tiene además una latencia de varias decenas de segundos, que se requieren para mover las vesículas hacia la membrana plasmática. Esto también contrasta con la liberación sináptica, que ocurre en milisegundos. Además, mientras que la liberación de transmisores en las terminales sinápticas está generalmente asociada a la apertura de canales de calcio de tipo N o P/Q,55 la liberación somática requiere de la activación de canales de tipo L30 y también de la liberación de calcio de depósitos intracelulares como el retículo endoplásmico.56
En resumen, la liberación sináptica de serotonina se activa con impulsos sencillos o a baja frecuencia, y con incrementos en la frecuencia de estimulación se puede producir facilitación y depresión. Un tren de diez impulsos libera el contenido de sólo unas decenas de vesículas de serotonina. La liberación ocurre inmediatamente después de la estimulación (en milisegundos) y tiene efectos específicamente localizados en las terminales postsinápticas. La liberación somática, en cambio, requiere de trenes de impulsos a frecuencias altas, ocurre a lo largo de varios minutos y un tren de estimulación similar produce la fusión de decenas de miles de vesículas de núcleo denso, que además contienen 17 veces más serotonina que las sinápticas, es decir, la cantidad de moléculas de serotonina que libera el soma es tres órdenes de magnitud mayor que la que liberan las terminales sinápticas.
AUTORREGULACIÓN EN NEURONAS SEROTONÉRGICAS
Un mecanismo importante de regulación de la liberación de neurotransmisores es la autorregulación que el propio transmisor ejerce sobre las neuronas que lo liberan. En el caso de la serotonina, es bien conocido que las neuronas serotonérgicas, tanto de vertebrados como de invertebrados, tienen receptores para este neurotransmisor, que participan en la regulación de su actividad eléctrica. Los autorreceptores de serotonina en los mamíferos son todos miembros de la familia de receptores 5-HT1. Estos receptores tienen una alta afinidad por la serotonina y están acoplados a proteínas Gi/ o,57 que a su vez activan canales de potasio,58 con lo cual se produce una hiperpolarización que disminuye la frecuencia de disparo de las neuronas. En invertebrados, los autorreceptores de serotonina activan sobre todo canales de cloro.59 Un caso interesante son las neuronas de caracol, que tienen activación de conductancias tanto de cloro como de potasio en respuesta a la serotonina.60
En los mamíferos, los autorreceptores 5-HT1A se encuentran localizados en el área somatodendrítica de las neuronas serotonérgicas en los núcleos del raphé.61,62 Por el contrario, las terminales presinápticas de las mismas neuronas contienen a los autorreceptores 5-HT1B y 5-HT1D.63-66 El hecho de que las neuronas tengan varios tipos de autorreceptores ubicados en distintas partes sugiere que las neuronas serotonérgicas quizás también tengan una auto-inhibición diferencial en distintos compartimentos celulares. Una especulación interesante es que, mediante la distribución de diferentes mecanismos de autoinhibición en sus membranas, las neuronas serotonérgicas regulen sus patrones de actividad eléctrica y sus diferentes modos de liberación de serotonina al nivel local. La compartimentalización del mecanismo de autoinhibición podría permitir la regulación local de la liberación de 5-HT en distintas áreas en el Sistema Nervioso Central, donde se controlan diferentes funciones.
La mayor parte de la evidencia de autorregulación serotonérgica proviene de estudios en los que se han aplicado agonistas o antagonistas de los autorreceptores serotonérgicos para evaluar su efecto sobre la actividad de las neuronas que liberan serotonina. Por ejemplo, el incremento de los niveles de serotonina extracelular o la aplicación de agonistas serotonérgicos disminuye la frecuencia de disparo de las neuronas serotonérgicas, mientras que la aplicación de antagonistas de los autorreceptores serotonérgicos incrementa su frecuencia de disparo.67-79 De manera consistente, la síntesis y la liberación de serotonina en respuesta a la estimulación extracelular son reducidas por agonistas e incrementadas por antagonistas de los autorreceptores serotonérgicos.71,80-94 Estos estudios han demostrado que la actividad eléctrica de las neuronas serotonérgicas se regula, en parte, por la concentración extracelular de serotonina, es decir, lo que llamamos el "tono" serotonérgico. Sin embargo, el efecto inmediato que tiene la serotonina liberada por una neurona sobre la misma neurona en el sitio de liberación no ha sido estudiado en forma exhaustiva.
AUTOINHIBICIÓN LOCAL INMEDIATA PRODUCIDA POR LA LIBERACIÓN DE SEROTONINA EN TERMINALES SINÁPTICAS
Nuestros estudios han mostrado que la liberación de serotonina por las terminales sinápticas de las neuronas de Retzius produce una autoinhibición local en los sitios de liberación.95 La estimulación de estas neuronas aisladas en cultivo produce un potencial de acción, seguido de una hiperpolarización pospotencial que dura varios cientos de milisegundos (figura 3, A1). Al invertir el gradiente transmembranal de cloro inyectando cloruro por medio del electrodo intracelular lleno de KCl, esta respuesta se invirtió, produciendo una despolarización después del potencial de acción (figura 3, A2), lo que sugiere que es producida por corrientes de cloro. Como la serotonina activa en estas neuronas receptores acoplados a canales de cloro, este resultado sugirió que dicha respuesta podría ser producida por la serotonina liberada por la propia neurona. Para probar esta posibilidad, bloqueamos la liberación de serotonina, sustituyendo el calcio de la solución extracelular por magnesio. Esto abolió por completo y de manera reversible la respuesta observada después del potencial de acción (figura 3, B1), sugiriendo que dicha respuesta es causada por alguna sustancia liberada por la propia neurona en respuesta a la estimulación eléctrica. Para probar que la serotonina es responsable de esta respuesta, vaciamos la reserva de serotonina de las neuronas incubándolas por siete días con reserpina, que impide que se empaque la serotonina en vesículas. Las neuronas tratadas de esta manera no mostraron la respuesta postpotencial (figura 3, B2), confirmando que la serotonina produce dicha respuesta. La inhibición producida por la serotonina disminuyó la resistencia de entrada de las neuronas y la excitabilidad subsiguiente, lo cual se hizo evidente al estimular con trenes de pulsos de corriente intracelular idénticos a frecuencias altas, que incrementan la liberación de serotonina. Los primeros pulsos produjeron potenciales de acción, pero más adelante en el tren de estimulación estos pulsos fueron insuficientes para producir el disparo, y se produjeron algunas fallas en los potenciales de acción. Las fallas desaparecieron al bloquear los receptores de serotonina con el antagonista metisergida, confirmando que efectivamente la disminución en la excitabilidad es producida por la serotonina que libera la propia neurona (figura 3 C).
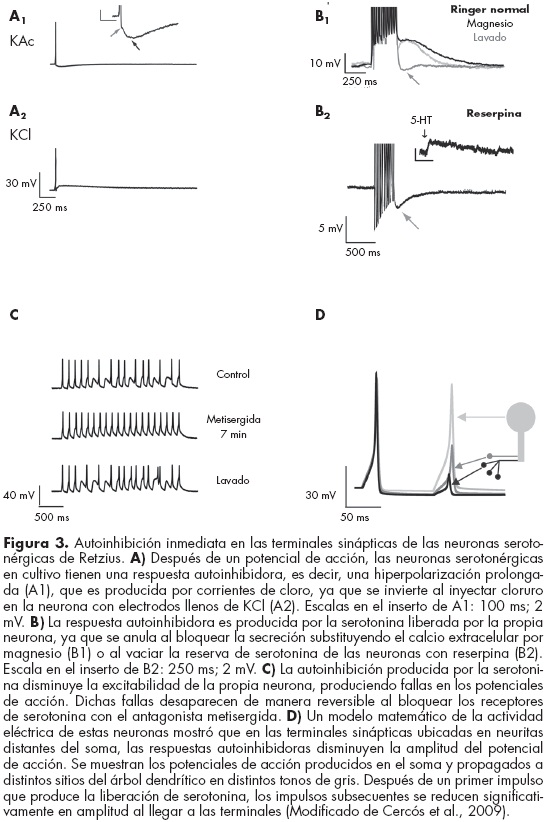
Estos resultados muestran que la serotonina que libera una neurona de Retzius en respuesta a la estimulación eléctrica actúa sobre receptores en la propia neurona de manera inmediata y disminuye la excitabilidad subsiguiente, reduciendo la frecuencia de disparo y por lo tanto la liberación subsiguiente de serotonina. En las neuronas aisladas, las terminales sinápticas se forman muy cerca del soma y por ello los registros en el soma muestran esta autoinhibición. Sin embargo, en las neuronas in situ cabe esperar que la autoinhibición producida en las terminales sinápticas tenga únicamente efectos locales. Esta hipótesis fue validada mediante un modelo eléctrico de las neuronas de Retzius, en el que se simularon las corrientes producidas por la serotonina únicamente en las terminales y se estudiaron los cambios en los potenciales de acción que se propagan del axón hacia éstas. El modelo mostró que la activación de la corriente de cloro producida por la serotonina es capaz de reducir significativamente la amplitud de los potenciales de acción que invaden la terminal hasta niveles que probablemente no sean suficientes para producir la liberación de serotonina. Sin embargo, la producción de potenciales de acción en su sitio de origen no se afecta por la autoinhibición, que tiene únicamente efectos locales (figura 3 D).
La autoinhibición local en las terminales presinápticas parece ser un mecanismo de regulación diferencial de la liberación de serotonina en diferentes compartimentos de la misma neurona. Será interesante estudiar cómo la liberación somática es modulada de manera inmediata por la propia serotonina liberada en este otro compartimiento. La auto-inhibición podría ser un factor importante para regular la liberación de 5-HT durante períodos de actividad eléctrica sostenida lo cual puede reducir al mismo tiempo las consecuencias de una liberación excesiva de serotonina.
CONCLUSIONES
Las neuronas serotonérgicas liberan serotonina por las terminales sinápticas, produciendo efectos locales y rápidos, y por sitios extrasinápticos, en particular en el cuerpo celular, produciendo efectos difusos y de larga duración. La liberación sináptica ocurre a partir de vesículas claras, ante impulsos sencillos o trenes de impulsos a bajas frecuencias, y con frecuencias crecientes presenta facilitación y depresión sináptica, que se equilibran y mantienen la liberación promedio constante. En contraste, la liberación somática ocurre a partir de vesículas electrodensas y requiere de trenes de impulsos a frecuencias altas para activarse.
La liberación perisináptica a partir de vesículas de núcleo denso en el axón parece tener características intermedias entre las de la liberación sináptica y la somática.
La serotonina liberada por las terminales sinápticas activa autorreceptores en las propias terminales de manera inmediata, que producen una hiperpolarización local mediada por corrientes de cloro y una disminución en la excitabilidad que reducen la frecuencia de disparo y la liberación subsiguiente.
AGRADECIMIENTOS
Este trabajo ha sido financiado por los donativos 03-263 RG/BIO/ LA de la Academia de Ciencias del Tercer Mundo (TWAS), 43703 de CONACyT y recursos internos del INPRFM para C.T. y por una beca de doctorado del CONACyT para M.G.C.
REFERENCIAS
1. Raleigh MJ, McGuire MT, Brammer GL, Pollack DB et al. Serotonergic mechanisms promote dominance acquisition in adult male vervet monkeys. Brain Res 1991;559:181-190. [ Links ]
2. Breisch ST, Zemlan FP, Hoebel BG. Hyperphagia and obesity following serotonin depletion by intraventricular p-chlorophenylalanine. Science 1976;192:382-385. [ Links ]
3. Saller CF, Stricker EM. Hyperphagia and increased growth in rats after intraventricular injection of 5,7-dihydroxytryptamine. Science 1976;192:385-387. [ Links ]
4. Jacobs BL, Azmitia EC. Structure and function of the brain serotonin system. Physiological Reviews 1992;72:165-229. [ Links ]
5. Zangrossi H Jr, Viana MB, Zanoveli J, Bueno C et al. Serotonergic regulation of inhibitory avoidance and one-way escape in the rat elevated T-maze. Neurosci Biobehav Rev 2001;25:637-645. [ Links ]
6. Prosser RA, Miller JD, Heller HC. A serotonin agonist phase-shifts the circadian clock in the suprachiasmatic nuclei in vitro. Brain Res 1990;534:336-339. [ Links ]
7. Hull EM, Lorrain DS, Du J, Matuszewich L et al. Hormone-neurotransmitter interactions in the control of sexual behavior. Behav Brain Res 1999;105:105-116. [ Links ]
8. Weiger WA. Serotonergic modulation of behaviour: a phylogenetic overview. Biol Rev Camb Philos Soc 1997;72:61-95. [ Links ]
9. McCall RB, Aghajanian GK. Serotonergic facilitation of facial moto-neuron excitation. Brain Research 1979;169:11-27. [ Links ]
10. Jacobs BL, Fornal CA. 5-HT and motor control: a hypothesis. Trends Neurosci 1993;16:346-352. [ Links ]
11. White SR, Fung SJ, Jackson DA, Imel KM. Serotonin, norepinephrine and associated neuropeptides: effects on somatic motoneuron excitability. Prog Brain Res 1996;107:183-199. [ Links ]
12. Arango V, Underwood MD, Mann JJ. Serotonin brain circuits involved in major depression and suicide. Prog Brain Res 2002;136:443-453. [ Links ]
13. Jobe PC, Dailey JW, Wernicke JF. A noradrenergic and serotonergic hypothesis of the linkage between epilepsy and affective disorders. Crit Rev Neurobiol 1999;13:317-356. [ Links ]
14. Brieden T, Ujeyl M, Naber D. Psychopharmacological treatment of aggression in schizophrenic patients. Pharmacopsychiatry 2002;35:83-89. [ Links ]
15. Jenike MA, Rauch SL, Cummings JL, Savage CR et al. Recent developments in neurobiology of obsessive-compulsive disorder. J Clin Psychiatry 1996;57:492-503. [ Links ]
16. Livingstone MS, Harris-Warrick RM, Kravitz EA. Serotonin and octo-pamine produce opposite postures in lobsters. Science 1980;208:76-79. [ Links ]
17. Harris-Warrick RM, Kravitz EA. Cellular mechanisms for modulation of posture by octopamine and serotonin in the lobster. J Neurosci 1984;4:1976-1993. [ Links ]
18. Kravitz EA. Serotonin and aggression: insights gained from a lobster model system and speculations on the role of amine neurons in a complex behavior. J Comp Physiol A 2000;186:221-238. [ Links ]
19. Higley JD, Linnoila M. Low central nervous system serotonergic activity is traitlike and correlates with impulsive behavior. A nonhuman primate model investigating genetic and environmental influences on neurotransmission. Ann N Y Acad Sci 1997;836:39-56. [ Links ]
20. Ferris CF. Adolescent stress and neural plasticity in hamsters: a vaso-pressin-serotonin model of inappropriate aggressive behaviour. Exp Physiol 2000;85(número especial):85S-90S. [ Links ]
21. Lesch KP, Merschdorf U. Impulsivity, aggression, and serotonin: a molecular psychobiological perspective. Behav Sci Law 2000;18:581-604. [ Links ]
22. Dahlström A, Fuxe K. Localization of monoamines in the lower brain stem. Experientia 1964;20:398-399. [ Links ]
23. Audet MA, Descarries L, Doucet G. Quantified regional and laminar distribution of the serotonin innervation in the anterior half of adult rat cerebral cortex. J Chem Neuroanat 1989;2:29-44. [ Links ]
24. Oleskevich S, Descarries L. Quantified distribution of the serotonin innervation in adult rat hippocampus. Neuroscience 1990;34:19-33. [ Links ]
25. Descarries L, Mechawar N. Ultrastructural evidence for diffuse transmission by monoamine and acetylcholine neurons of the central nervous system. Prog Brain Res 2000;125:27-47. [ Links ]
26. Kosofsky BE, Molliver ME. The serotoninergic innervation of cerebral cortex: different classes of axon terminals arise from dorsal and median raphe nuclei. Synapse 1987;1:153-168. [ Links ]
27. Van Bockstaele EJ, Pickel VM. Ultrastructure of serotonin-immunoreactive terminals in the core and shell of the rat nucleus accumbens: cellular substrates for interactions with catecholamine afferents. J Comp Neurol 1993;334:603-617. [ Links ]
28. Ridet JL, Rajaofetra N, Teilhac JR, Geffard M et al. Evidence for nonsynaptic serotonergic and noradrenergic innervation of the rat dorsal horn and possible involvement of neuronglia interactions. Neuroscience 1993;52:143-157. [ Links ]
29. Chazal G, Ralston HJ 3rd. Serotonin-containing structures in the nucleus raphe dorsalis of the cat: an ultrastructural analysis of dendrites, presynaptic dendrites, and axon terminals. J Comp Neurol 1987;259:317-329. [ Links ]
30. Trueta C, Méndez B, De-Miguel FF. Somatic exocytosis of serotonin mediated by L-type calcium channels in cultured leech neurones. J Physiol (Lond) 2003;547:405-416. [ Links ]
31. Kaushalya SK, Desai R, Arumugam S, Ghosh H et al. Three-photon microscopy shows that somatic release can be a quantitatively significant component of serotonergic neurotransmission in the mammalian brain. J Neurosci Res 2008;86:3469-3480. [ Links ]
32. Trueta C, De-Miguel FF. Extrasynaptic exocytosis and its functional implications in the nervous system. Frontiers in Membrane Physiology 2012 (en prensa). [ Links ]
33. Agnati LF, Fuxe K, Zoli M, Ozini I et al. A correlation analysis of the regional distribution of central enkephalin and β-endorphin immunoreactive terminals and of opiate receptors in adult and old male rats. Evidence for the existence of two main types of communication in the central nervous system: the volume transmission and the wiring transmission. Acta Physiologica Scandinavica 1986;128:201-207. [ Links ]
34. Agnati LF, Fuxe K, Zoli M, Pich EM et al. Aspects on the information handling by the central nervous system: focus on cotransmission in the aged rat brain. Prog Brain Res 1986;68:291-301. [ Links ]
35. Fuxe K, Borroto-Escuela DO, Romero-Fernandez W, Ciruela F et al. On the role of volume transmission and receptor-receptor interactions in social behaviour: Focus on central catecholamine and oxytocin neurons. Brain Research Published Online First: 1 February 2012. doi:10.1016/j.brainres.2012.01.062 [ Links ]
36. Zimmermann H. Synaptic Transmission. Cellular and molecular basis. Stuttgart-New York: Georg Thieme Verlag, Oxford University Press; 1993. [ Links ]
37. Baylor DA, Nicholls JG. Patterns of regeneration between individual nerve cells in the central nervous system of the leech. Nature 1971;232:268-270. [ Links ]
38. Jansen JK, Nicholls JG. Regeneration and changes in synaptic connections between individual nerve cells in the central nervous system of the leech. Proc Natl Acad Sci USA 1972;69:636-639. [ Links ]
39. Fuchs PA, Nicholls JG, Ready DF. Membrane properties and selective connexions of identified leech neurones in culture. J Physiol (Lond) 1981;316:203-223. [ Links ]
40. Ready DF, Nicholls J. Identified neurones isolated from leech CNS make selective connections in culture. Nature 1979;281:67-69. [ Links ]
41. Fernández-de-Miguel F, Drapeau P. Synapse formation and function: insights from identified leech neurons in culture. J Neurobiol 1995;27:367-379. [ Links ]
42. Henderson LP. The role of 5-hydroxytryptamine as a transmitter between identified leech neurones in culture. J Physiol (Lond) 1983;339:309-324. [ Links ]
43. Fuchs PA, Henderson LP, Nicholls JG. Chemical transmission between individual Retzius and sensory neurones of the leech in culture. J Physiol (Lond) 1982;323:195-210. [ Links ]
44. Henderson LP, Kuffler DP, Nicholls J, Zhang R. Structural and functional analysis of synaptic transmission between identified leech neurones in culture. J Physiol (Lond) 1983;340:347-358. [ Links ]
45. Kuffler DP, Nicholls J, Drapeau P. Transmitter localization and vesicle turnover at a serotoninergic synapse between identified leech neurons in culture. J Comp Neurol 1987;256:516-526. [ Links ]
46. Bruns D, Jahn R. Real-time measurement of transmitter release from single synaptic vesicles. Nature 1995;377:62-65. [ Links ]
47. Bruns D, Riedel D, Klingauf J, Jahn R. Quantal release of serotonin. Neuron 2000;28:205-220. [ Links ]
48. Golding DW, Bayraktaroglu E. Exocytosis of secretory granules - A probable mechanism for the release of neuromodulators in invertebrate neuropiles. Experientia 1984;40:1277-1285. [ Links ]
49. Zhu PC, Thureson-Klein A, Klein RL. Exocytosis from large dense cored vesicles outside the active synaptic zones of terminals within the trigeminal subnucleus caudalis: a possible mechanism for neuropeptide release. Neuroscience 1986;19:43-54. [ Links ]
50. Lysakowski A, Figueras H, Price SD, Peng YY. Dense-cored vesicles, smooth endoplasmic reticulum, and mitochondria are closely associated with non-specialized parts of plasma membrane of nerve terminals: implications for exocytosis and calcium buffering by intraterminal organelles. J Comp Neurol 1999;403:378-390. [ Links ]
51. Dietzel ID, Drapeau P, Nicholls JG. Voltage dependence of 5-hydroxy-tryptamine release at a synapse between identified leech neurones in culture. J Physiol (Lond) 1986;372:191-205. [ Links ]
52. Stewart RR, Adams WB, Nicholls JG. Presynaptic calcium currents and facilitation of serotonin release at synapses between cultured leech neurones. J Exp Biol 1989;144:1-12. [ Links ]
53. Trueta C, De-Miguel FF, Kuffler DP. Cycling of dense core vesicles involved in somatic exocytosis of serotonin by leech neurons. Frontiers Membrane Physiology 2012 (en prensa). [ Links ]
54. Cochilla AJ, Angleson JK, Betz WJ. Monitoring secretory membrane with FM1-43 fluorescence. Annu Rev Neurosci 1999;22:1-10. [ Links ]
55. Reuter H. Diversity and function of presynaptic calcium channels in the brain. Curr Opin Neurobiol 1996;6:331-337. [ Links ]
56. Trueta C, Sánchez-Armass S, Morales MA, De-Miguel FF. Calcium-induced calcium release contributes to somatic secretion of serotonin in leech Retzius neurons. J Neurobiol 2004;61:309-316. [ Links ]
57. Lin SL, Setya S, Johnson-Farley NN, Cowen DS. Differential coupling of 5-HT(1) receptors to G proteins of the G(i) family. Br J Pharmacol 2002;136:1072-1078. [ Links ]
58. Aghajanian GK, Lakoski JM. Hyperpolarization of serotonergic neurons by serotonin and LSD: studies in brain slices showing increased K+ conductance. Brain Res 1984;305:181-185. [ Links ]
59. Lessmann V, Dietzel ID. Development of serotonin-induced ion currents in identified embryonic Retzius cells from the medicinal leech (Hirudo medicinalis). J Neurosci 1991;11:800-809. [ Links ]
60. Gerschenfeld HM. Serotonin: two different inhibitory actions on snail neurons. Science 1971;171:1252-1254. [ Links ]
61. Blier P, Piñeyro G, el Mansari M, Bergeron R et al. Role of somato-dendritic 5-HT autoreceptors in modulating 5-HT neurotransmission. Ann N Y Acad Sci 1998;861:204-216. [ Links ]
62. Verge D, Daval G, Patey A, Gozlan H et al. Presynaptic 5-HT autoreceptors on serotonergic cell bodies and/or dendrites but not terminals are of the 5-HT1A subtype. Eur J Pharmacol 1985;113:463-464. [ Links ]
63. Göthert M. Presynaptic serotonin receptors in the central nervous system. Ann N Y Acad Sci 1990;604:102-112. [ Links ]
64. Roberts C, Price GW, Middlemiss DN. Ligands for the investigation of 5-HT autoreceptor function. Brain Res Bull 2001;56:463-469. [ Links ]
65. Sari Y. Serotonin1B receptors: from protein to physiological function and behavior. Neurosci Biobehav Rev 2004;28:565-582. [ Links ]
66. Stamford JA, Davidson C, McLaughlin DP, Hopwood SE. Control of dorsal raphé 5-HT function by multiple 5-HT(1) autoreceptors: parallel purposes or pointless plurality? Trends Neurosci 2000;23:459-465. [ Links ]
67. Gallager DW, Aghajanian GK. Inhibition of firing of raphe neurones by tryptophan and 5-hydroxytryptophan: blockade by inhibiting serotonin synthesis with Ro-4-4602. Neuropharmacology 1976;15:149-156. [ Links ]
68. Trulson ME, Jacobs BL. Dose-response relationships between systemically administered L-tryptophan or L-5-hydroxytryptophan and raphe unit activity in the rat. Neuropharmacology 1976;15:339-344. [ Links ]
69. de Montigny C, Aghajanian GK. Preferential action of 5-methoxytryp-tamine and 5-methoxydimethyltryptamine on presynaptic serotonin receptors: A comparative iontophoretic study with LSD and serotonin. Neuropharmacology 1977;16:811-818. [ Links ]
70. Rogawski MA, Aghajanian GK. Serotonin autoreceptors on dorsal raphe neurons: structure-activity relationships of tryptamine analogs. J Neurosci 1981;1:1148-1154. [ Links ]
71. Chaput Y, Blier P, de Montigny C. In vivo electrophysiological evidence for the regulatory role of autoreceptors on serotonergic terminals. J Neurosci 1986;6:2796-2801. [ Links ]
72. VanderMaelen CP, Matheson GK, Wilderman RC, Patterson LA. Inhibition of serotonergic dorsal raphe neurons by systemic and iontophoretic administration of buspirone, a non-benzodiazepine anxiolytic drug. Eur J Pharmacol 1986;129:123-130. [ Links ]
73. Trulson ME, Crisp T. Do serotonin-containing dorsal raphe neurons possess autoreceptors? Exp Brain Res 1986;62:579-586. [ Links ]
74. Trulson ME, Frederickson CJ. A comparison of the electrophysiological and pharmacological properties of serotonin-containing neurons in the nucleus raphe dorsalis, raphe medianus and raphe pallidus recorded from mouse brain slices in vitro: role of autoreceptors. Brain Res Bull 1987;18:179-190. [ Links ]
75. Sprouse JS, Aghajanian GK. Responses of hippocampal pyramidal cells to putative serotonin 5-HT1A and 5-HT1B agonists: a comparative study with dorsal raphe neurons. Neuropharmacology 1988;27:707-715. [ Links ]
76. Sinton CM, Fallon SL. Electrophysiological evidence for a functional differentiation between subtypes of the 5-HT1 receptor. Eur J Pharmacol 1988;157:173-181. [ Links ]
77. O'Connor JJ, Kruk ZL. Frequency dependence of 5-HT autoreceptor function in rat dorsal raphe and suprachiasmatic nuclei studied using fast cyclic voltammetry. Brain Research 1991;568:123-130. [ Links ]
78. Fornal CA, Litto WJ, Metzler CW, Marrosu F et al. Single-unit responses of serotonergic dorsal raphe neurons to 5-HT1A agonist and antagonist drug administration in behaving cats. J Pharmacol Exp Ther 1994;270:1345-1358. [ Links ]
79. Gobert A, Lejeune F, Rivet JM, Audinot V et al. Modulation of the activity of central serotoninergic neurons by novel serotonin1A receptor agonists and antagonists: a comparison to adrenergic and dopaminergic neurons in rats. J Pharmacol Exp Ther 1995;273:1032-1046. [ Links ]
80. Baumann PA, Waldmeier PC. Negative feedback control of serotonin release in vivo: comparison of 5-hydroxyindolacetic acid levels measured by voltammetry in conscious rats and by biochemical techniques. Neuroscience 1984;11:195-204. [ Links ]
81. Stauderman KA, Jones DJ. Presynaptic serotonin receptors regulate 3Hserotonin release from rat spinal cord synaptosomes. Eur J Pharmacol 1986;120:107-109. [ Links ]
82. Bonanno G, Maura G, Raiteri M. Pharmacological characterization of release-regulating serotonin autoreceptors in rat cerebellum. Eur J Pharmacol 1986;126:317-321. [ Links ]
83. Hjorth S, Magnusson T. The 5-HT 1A receptor agonist, 8-OH-DPAT, preferentially activates cell body 5-HT autoreceptors in rat brain in vivo. Naunyn Schmiedebergs Arch Pharmacol 1988;338:463-471. [ Links ]
84. Sharp T, Bramwell SR, Clark D, Grahame-Smith DG. In vivo measurement of extracellular 5-hydroxytryptamine in hippocampus of the anaesthetized rat using microdialysis: changes in relation to 5-hydroxy-tryptaminergic neuronal activity. J Neurochem 1989;53:234-240. [ Links ]
85. Wichmann T, Limberger N, Starke K. Release and modulation of release of serotonin in rabbit superior colliculus. Neuroscience 1989;32:141-151. [ Links ]
86. Invernizzi R, Bramante M, Samanin R. Chronic treatment with citalopram facilitates the effect of a challenge dose on cortical serotonin output: role of presynaptic 5-HT1A receptors. Eur J Pharmacol 1994;260:243-246. [ Links ]
87. Bonvento G, Scatton B, Claustre Y, Rouquier L. Effect of local injection of 8-OH-DPAT into the dorsal or median raphe nuclei on extracellular levels of serotonin in serotonergic projection areas in the rat, brain. Neurosci Lett 1992;137:101-104. [ Links ]
88. Galzin AM, Poirier MF, Lista A, Chodkiewicz JP, Blier P, Ramdine R, et al. Characterization of the 5-hydroxytryptamine receptor modulating the release of 5-3Hhydroxytryptamine in slices of the human neocortex. J Neurochem 1992;59:1293-1301. [ Links ]
89. Starkey SJ, Skingle M. 5-HT1D as well as 5-HT1A autoreceptors modulate 5-HT release in the guinea-pig dorsal raphé nucleus. Neuropharmacology 1994;33:393-402. [ Links ]
90. Davidson C, Stamford JA. Evidence that 5-hydroxytryptamine release in rat dorsal raphé nucleus is controlled by 5-HT1A, 5-HT1B and 5-HT1D autoreceptors. Br J Pharmacol 1995;114:1107-1109. [ Links ]
91. Piñeyro G, Castanon N, Hen R, Blier P. Regulation of 3H5-HT release in raphe, frontal cortex and hippocampus of 5-HT1B knock-out mice. Neuroreport 1995;7:353-359. [ Links ]
92. Rollema H, Lu Y, Schmidt AW, Zorn SH. Clozapine increases dopamine release in prefrontal cortex by 5-HT1A receptor activation. Eur J Pharmacol 1997;338:R3-5. [ Links ]
93. Rutz S, Riegert C, Rothmaier AK, Jackisch R. Presynaptic modulation of 5-HT release in the rat septal region. Neuroscience 2007;146:643-658. [ Links ]
94. Birthelmer A, Ehret A, Riegert C, Rothmaier AK et al. Modulation of electrically evoked serotonin release in cultured rat raphe neurons. J Neurochem 2007;100:1613-1625. [ Links ]
95. Cercós MG, De-Miguel FF, Trueta C. Real-time measurements of synaptic autoinhibition produced by serotonin release in cultured leech neurons. J Neurophysiol 2009;102:1075-1085. [ Links ]














