Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Salud mental
versión impresa ISSN 0185-3325
Salud Ment vol.35 no.5 México sep./oct. 2012
Artículo original
Procesamiento central del dolor neuropático: una aproximación integrativa
Central processing of neuropathic pain: an integrative approach
Ulises Coffeen,1 Karina Simón,1 Francisco Mercado,1 Angélica Almanza,1 Lucía Magis,1 Orlando Jaimes,1 Bernardo Contreras,1 Francisco Pellicer1
1 Laboratorio de Neurofisiología Integrativa, Dirección de Investigaciones en Neurociencias, Instituto Nacional de Psiquiatría Ramón de la Fuente Muñiz.
Correspondencia:
Dr. Francisco Pellicer.
Departamento de Neurofisiología Integrativa.
Instituto Nacional de Psiquiatría Ramón de la Fuente Muñiz.
Calz. México-Xochimilco 101, San Lorenzo Huipulco,
Tlalpan, 14370, México, DF. Tel: (55) 4160-5105.
E-mail: pellicer@imp.edu.mx
SUMMARY
The term pain matrix refers to the structures and pathways in the central nervous system that play a role in pain processing and integration. For the last several years, our group has been studying the mechanisms that are involved in the establishment of long-term pain. Our research focus has been the study of the different nuclei and corticolimbic pathways that are involved in the affective-cognitive component of pain. In addition, we have also explored painful processes and memory.
The pain matrix is constituted by the ventral tegmental area (VTA), anterior cingulate cortex (ACC), and insular cortex, among others. VTA is a predominantly dopaminergic area and has projections to ACC and the insular cortex. Stimulation of this region can reduce nociception, whereas its lesion has the opposite effect.
In the ACC, it has been studied how excitatory aminoacids, such as glutamate, increase nociception while inhibitory ones decrease it. Moreover, this cortex is associated with mechanisms of pain memory. In this sense, we have seen that blocking cholinergic receptors diminishes the acquisition of pain-related memories. Nociceptive stimuli increase the expression of inhibitory muscarinic M2 receptors.
In relation with insular cortex, the focus of study has been on the dopaminergic system. We have found that blocking dopaminergic D2 receptors significantly reduces neuropathic nociception. In response to an inflammatory process there is a decrease in the extracellular levels of dopamine and in the expression of mRNA for excitatory dopamine D1 receptors, while there is an increase in mRNA expression for inhibitory D2 receptors.
Despite current progress in this research area, more studies are needed in order to integrate the relationship among the different neurotransmission systems. This will contribute to the proposal of novel therapeutic alternatives to the conventional treatments for pain.
Key words: Pain, nociception, insular cortex, anterior cingulate cortex, ventral tegmental area.
RESUMEN
El término "matriz del dolor" se refiriere a todas las estructuras y vías del Sistema Nervioso Central relacionadas con la integración del dolor. Nuestro grupo estudia desde hace varios años los principales mecanismos involucrados en el desarrollo del dolor a largo plazo. Nos hemos enfocado en el estudio de diferentes núcleos y vías cortico-límbicas que están relacionadas con la parte afectiva-cognitiva, así como en la memoria de los procesos dolorosos. Dentro de estos núcleos se encuentra el área tegmental ventral (ATV), la corteza anterior del cíngulo (CAC) y la corteza insular. El ATV es una estructura principalmente dopaminérgica con proyecciones a la CAC y a la corteza insular. Como se verá más adelante, estimular este núcleo disminuye la nocicepción, mientras que el lesionarlo, la aumenta. En la CAC se ha estudiado cómo aminoácidos excitadores como el glutamato aumentan la nocicepción y cómo, por el contrario, los aminoácidos inhibitorios como la taurina, la disminuyen. Además esta corteza está relacionada con mecanismos de memoria dolorosa. Hemos visto que el bloqueo de receptores colinérgicos disminuye la adquisición de la memoria relacionada al dolor. Además, un estímulo nociceptivo aumenta la expresión de los receptores muscarínicos inhibitorios M2.
En el caso de la corteza insular, se ha estudiado principalmente el papel del sistema dopaminérgico. Hemos encontrado que el bloqueo de receptores dopaminérgicos D2 disminuye de manera significativa la nocicepción neuropática. Encontramos también que los niveles extracelulares de dopamina en esta región disminuyen a consecuencia de un proceso inflamatorio, además de que disminuye la expresión del RNAm de los receptores excitadores D1 y aumenta la de los receptores inhibidores D2. A pesar del avance que se ha obtenido en esta área de investigación, se necesitan más estudios para integrar la relación entre los diferentes sistemas de neurotransmisión y poder proponer alternativas a los tratamientos convencionales para las diferentes patologías que cursan con una experiencia dolorosa.
Palabras clave: Dolor, nocicepción, corteza insular, corteza anterior del cíngulo, área tegmental ventral.
INTRODUCCIÓN
En los últimos años se ha acuñado el término "matriz del dolor" para referirse a todas las estructuras y vías del Sistema Nervioso Central (SNC) relacionadas con la integración del dolor. Esta matriz está formada por los receptores periféricos que codifican el daño, la médula espinal, el tálamo, la amígdala, el área tegmental ventral (ATV), la sustancia gris periacueductal, los ganglios basales y las cortezas: cerebelar, insular, parietal posterior, prefrontal, del cíngulo anterior, motor suplementaria y somatosensorial primaria y secundaria.1
Dentro de esta matriz del dolor operan varios sistemas de neurotransmisión. En este sentido, neurotransmisores como los péptidos opioides, la dopamina, la acetilcolina y aminoácidos como el glutamato o la glicina, modulan la génesis, desarrollo y percepción del dolor a nivel central. Dicha modulación es diferencial de acuerdo no sólo al sistema de neurotransmisión sino también a la vía y locus en el cual esté ejerciendo su función.1
Nuestro grupo de investigación se ha enfocado en estudiar parte de esta red compleja de neurotransmisores y núcleos corticales que integran la experiencia dolorosa. En el presente artículo mencionaremos los principales avances que se han obtenido a la fecha en esta área. En particular nos enfocaremos en tres de las principales regiones corticolím-bicas que forman parte de la matriz del dolor, y que además están implicadas directamente con los mecanismos de dolor a largo plazo, el ATV, la corteza anterior del cíngulo (CAC) y la corteza insular.
ÁREA TEGMENTAL VENTRAL
Uno de los sistemas supraespinales que claramente juega un papel en la modulación de la entrada nociceptiva es el sistema dopaminérgico. El núcleo dopaminérgico que proyecta de manera importante a varios núcleos de la matriz del dolor, es el ATV (área A10 dopaminérgica). Este núcleo proyecta de manera monosináptica al tálamo anterior y medial, al hipocampo, amígdala, núcleo accumbens y a las cortezas del cíngulo anterior e insular.2
Dentro de las primeras evidencias que implican al ATV en la modulación del dolor se encuentra la dada por Albe-Fessard et al. (1984), donde se probó el efecto analgésico de la auto-estimulación del ATV en ratas desaferentadas.3 Esta estructura participa en varios circuitos neuronales que están relacionados con la analgesia inducida por estimulación eléctrica,4,5 el estrés,6 la morfina7 y la electroacupuntura.8 Además, se ha sugerido que el ATV participa en la llamada analgesia disociativa9 en la cual se ha perdido el componente afectivo desagradable del dolor.
Más aún, la importancia del ATV como modulador antinociceptivo se ha demostrado en modelos experimentales de dolor neuropático,310 y también en modelos de autolesióninducidos por inflamación (infiltración de carragenina en el cojinete plantar de la rata) también considerado como un modelo de dolor neuropático.11 La lesión del ATV aumenta la ocurrencia de esta conducta, mientras que la estimulación eléctrica de esta misma área después de la inducción de un estímulo nociceptivo, pero no antes, indujo un proceso antialgésico el cual disminuyó la conducta de autolesión. Estos resultados asocian de forma directa la participación del ATV en el procesamiento y modulación del dolor de largo plazo.12
También hay evidencia de que lesiones neuroquímicas del ATV, inducidas por 6-hydroxy-dopamina, aumentan las respuestas nociceptivas. Los modelos de dolor subagudos y crónicos (neurectomía y la inyección de formaldehido o carragenina) presentan cambios en sus respuestas antialgésicas, mientras que con los modelos de dolor agudo no alteran de forma significativa los reflejos antialgésicos obtenidos con las pruebas de sacudida de la cola y el de flexión antialésico por estimulación térmica (tail-flick y plantar test).7,10 Esto evidencia el papel que juegan los núcleos supra espinales en la respuesta del dolor de largo plazo.
Un hecho anatómico relevante es que la ATV proyecta de manera monosináptica a dos de las principales estructuras córtico-límbicas que pertenecen a la matriz del dolor, la corteza anterior del cíngulo y la corteza insular. Como se verá a continuación, existe evidencia de cómo la dopamina y otros sistemas de neurotransmisión modulan los procesos nociceptivos.13
CORTEZA ANTERIOR DEL CÍNGULO
La relación entre la corteza anterior del cíngulo y el procesamiento de las emociones lo estableció Papez por primera vez en la década de 1930.14 Recientemente Vogt ha propuesto una emblemática dicotomía en relación con la circunvolución del cíngulo.15,16 Por una parte el cíngulo caudal está relacionado con funciones visioespaciales y de memoria. La parte rostral del cíngulo está relacionada en la ejecución de funciones asociadas con la esfera afectiva particularmente con la parte del desagrado. El sistema límbico rostral está constituido por estructuras como la amígdala y el septum, las cortezas órbitofrontal, del cíngulo anterior y la corteza insular, el estriado ventral incluyendo el núcleo accumbens. Muchas de estas estructuras, como se ha mencionado anterioremente, conforman la llamada matriz del dolor.5
En el siglo pasado se reportó que pacientes con dolor refractario al tratamiento farmacológico presentaban alivio después de una cingulotomía. De manera interesante se encontró que la lesión quirúrgica del cíngulo no modificaba la sensación dolorosa, pero sí la percepción desagradable que la acompaña.17
La CAC recibe proyecciones de los núcleos anteromedial18 y medialdorsal (AM y MD)19 del tálamo, a través del haz medial del cerebro anterior o haz del cíngulo y la ramaanterior de la cápsula interna.20 Diversos estudios electrofisiológicos han mostrado evidencia de que existen neuronas nociceptivas dentro de la CAC,16,21,22 que responden a la estimulación eléctrica del núcleo MD.21,23 A su vez, estos núcleos tienen aferencias nociceptivas.24 También se ha documentado el papel de los aminoácidos excitadores y su relación con la actividad proalgésica en estas vías.25 En este sentido, la estimulación eléctrica de estos núcleos incrementa la incidencia y la intensidad de la nocicepción y de conductas relacionadas con el aumento del dolor.26
Como se ha mencionado, la CAC recibe proyecciones dopaminérgicas directamente del ATV mediante el haz medial del cerebro anterior.15,16 A pesar de que es conocido que la dopamina puede modular las funciones de la CAC y de que es un sitio importante en la modulación nociceptiva, hay poca evidencia experimental con respecto a estas relaciones. A este respecto, nuestro grupo encontró que una sola microinyección de dopamina dentro de la CAC redujo la conducta de autotomía inducida por una neurectomia.27
En esta misma línea de investigación hemos encontrado que la amantadina, un fármaco antagonista NMDA28 y liberador dopaminérgico,29 disminuyó la nocicepción crónica al administrarse vía i.p. y mostró un efecto similar a la inyección de dopamina en la CAC.30 Más aún, el bloqueo selectivo de receptores D1 y D2 dentro de la CAC disminuyó el efecto antinociceptivo de la amantadina, en un modelo de dolor crónico en animales.27 Encontramos además que la administración i.p. de amantadina disminuyó no sólo la nocicepción crónica inducida por denervación, sino que también aumentó los niveles extracelulares de dopamina cuantificada mediante microdiálisis y cromatrografía líquida de alta resolución en la CAC, con animales en libre movimiento.1 También existe evidencia clínica de la efectividad de la amantadina en el dolor neuropático: la administración por dos semanas de amantadina por vía oral puede reducir el dolor por cinco meses en pacientes con dolor neuropático.31
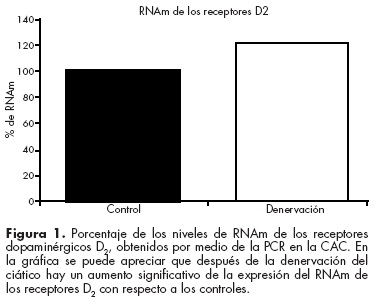
En un estudio reciente demostramos que la estimulación nociceptiva modifica la expresión de los receptores dopaminérgicos D1 y D2 en la CAC. Utilizando un modelo de dolor neuropático, encontramos un incremento en la inmunoreactividad y la expresión del RNAm de los receptores inhibitorios D2, y esto se correlaciona de manera directa con la respuesta conductual relacionada al dolor de los animales32 (figura 1). Esto evidencia el papel modulador del sistema dopaminérgico dentro de la CAC en la nocicepción y da esperanza para lograr futuras alternativas terapéuticas, no opioides, en el alivio del dolor neuropático.
Otro sistema de neurotransmisión relacionado con el desarrollo del dolor, es el glutamatérgico. En este sentido se ha mostrado que los receptors NMDA tienen una participación importante en el procesamiento del dolor. La aplicación de antagonistas NMDA en diversas áreas del SNC tiene efectos antinociceptivos, independientemente de la ruta de administración utilizada.33
En nuestros experimentos, la aplicación de MK801 (antagonista NMDA) en la CAC disminuyó significativamente la conducta nociceptiva en un modelo de dolor crónico.27 De igual manera ocurrió en otras áreas del SNC.34
En sentido opuesto, encontramos que la microinyección en la CAC de taurina, un aminoácido esencial que se comporta como agonista del receptor a glicina, disminuye la nocicepción en un modelo animal de dolor neuropático.35 Esto muestra que mientras el agonismo de aminoácidos excitatorios aumenta la nocicepción, el agonismo de los inhibitorios la disminuyen, destacándose así la participación de los receptores NMDA y glicinérgicos en la sensación de dolor.
Por otra parte, la CAC junto con estructuras como el hipocampo, el lóbulo temporal, la amígdala y el núcleo accumbens, están relacionados con procesos de memoria y aprendizaje.15,36 Una asociación fisiológica de relevancia ocurre entre el dolor y la memoria, es decir que hay una diferencia entre el acceso a la memoria con la finalidad de evocar un conocimiento y el de recordar un dolor, el cual evoca, más que el conocimiento previo, la alarma aversiva relacionada al daño. El mecanismo relacionado con la memoria al dolor ha sido poco estudiado en condiciones de dolor crónico.
Clásicamente se ha relacionado a la acetilcolina con los procesos de memoria.37 La CAC recibe proyecciones colinérgicas principalmente del complejo de la banda diagonal del septum38 y presenta una alta densidad de receptores colinérgicos en la CAC y en la corteza de la ínsula.39 Más aún, existen reportes que vinculan la participación de la CAC en los procesos de memoria post-entrenamiento.40 En este sentido, Devinsky et al. (1995) sugieren que la CAC está relacionada con el aprendizaje asociado con la predicción y evitación del estímulo nocivo.
Con esto en mente, nuestro grupo probó si el bloqueo colinérgico dentro de la CAC era capaz de modificar la nocicepción crónica. Para tal motivo microinyectamos escopolamina (antagonista colinérgico) en la CAC utilizando un modelo de dolor crónico por desaferentación. Los resultados mostraron una relación funcional entre la memoria relacionada al dolor y la CAC, en particular con la adquisición de la memoria relacionada a un evento doloroso.41
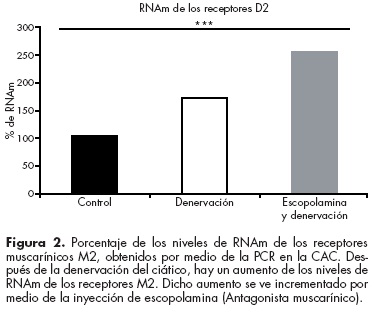
Recientemente encontramos un aumento en la expresión del RNAm de los receptores muscarínicos inhibitorios M2 a consecuencia de la lesión del nervio ciático que produce dolor neuropático. Más aún, si se inyecta escopolamina se produce un incremento del RNAm y la inmunoreactividad del receptor D242 (figura 2). Esto implica que la escopolamina inicia un mecanismo que incrementa la expresión de un receptor inhibitorio, con lo cual se puede explicar, en parte, la reducción del dolor neuropático.42
CORTEZA INSULAR
La corteza insular fue descrita por primera vez por el anatomista alemán Johann Christian Reil en el siglo XVIII. Este descubrimiento fue inmortalizado por Henry Gray en la primera edición de su famoso libro Gray's Anatomy.43 A pesar de que ha pasado mucho tiempo desde su primera descripción, la corteza insular no se ha estudiado extensivamente debido, en parte, a su localización anatómica profunda.
Sin embargo, estudios clínicos recientes por medio de técnicas no invasivas como el mapeo cerebral, así como estudios fisiológicos y farmacológicos en animales, han ayudado a estudiar de manera más extensa la neuroanatomía funcional de la corteza insular. Esto nos ha permitido identificar y describir su papel en diversas funciones como la memoria, los procesos viscerales y motores, el control simpatético del tono cardiovascular, así como en procesos gustativos, auditivos, vestibulares y emocionales, además de su participación en la cognición, el dolor y, recientemente, en las adicciones.44,45 Además, esta multiplicidad de funciones relaciona a diversos sistemas de neurotransmisión que convergen en la corteza insular. Sistemas como el gabaérgico, el opioidérgico, el glutamatérgico, el serotoninérgico y, de manera importante, el sistema dopaminérgico.46
Entre algunos antecedentes clínicos que permiten relacionar a la corteza insular con el dolor se encuentra un síndrome denominado asimbolia al dolor, que se presenta cuando hay un daño directo en la corteza insular y es considerado un transtorno secundario a una desconexión entre el sistema límbico y la corteza somatosensorial.47 Los pacientes con asimbolia al dolor reconocen el dolor, pero no tienen una respuesta apropiada, tanto motora como emocional, ante un estímulo doloroso aplicado a cualquier parte de su cuerpo.47,48
En este mismo sentido, la ínsula está relacionada con el síndrome del dolor pseudotalámico, en el cual hay una alteración en la apreciación de la temperatura. La ínsula caudal y el opérculo parietal posterior son dos áreas comúnmente relacionadas con esta patología. Se ha propuesto que este síndrome es atribuible a la interrupción de las conexiones entre estas áreas corticales (incluyendo la corteza somatosensorial) y el tálamo dorsal. El dolor espontáneo es una manifestación clínica de esta interrupción. La pérdida de la inhibición cortical hacia el tálamo puede ser el mecanismo responsable.44
Actualmente se sabe que las proyecciones nociceptivas hacia la corteza insular provienen de varias vías, incluyendo aferencias trigeminales.49 Más aún, la corteza insular no sólo está relacionada con la percepción dolorosa como respuesta a un estímulo, sino que se ha señalado como el sitio en donde se integra la anticipación a esta percepción,50,51 relacionando así mecanismos de la memoria a largo plazo.52 Este hecho juega un papel importante en el desarrollo del dolor neuropático en pacientes que están expuestos a un dolor crónico, dado que su percepción del mismo puede estar alterada o aumentada50 Tan sólo el hecho de estar a la expectativa de sentir una estimulación dolorosa, sin que ésta ocurra, puede aumentar la activación de esta corteza.53
Nuestro grupo ha estudiado cómo la lesión puntual de este núcleo en la rata disminuye distintas conductas relacionadas a eventos que cursan con dolor, neuropático o producido por inflamación, con la disminución de fenómenos como la alodínia o hiperalgesia, mientras que no modifica las relacionadas con el dolor agudo (reflejo de flexión).54 La lesión de la ínsula en los humanos aumenta el umbral doloroso y su estimulación puede producir dolor, lo que sugiere que la ínsula funciona como un núcleo pronociceptivo.55
Como se mencionó anteriormente, existe una relación entre la dopamina y la modulación supraespinal del dolor, la cual se ha descrito ampliamente.56* Esta evidencia se observó primero en el campo clínico en pacientes con enfermedad de Parkinson, los cuales, junto con otros síntomas, presentan percepción alterada del dolor.57 Además, pacientes con polineuropatía diabética también presentan disminución del dolor cuando se les administra L-Dopa (precursor dopaminérgico).58
Como hemos visto, de manera semejante a la investigación en humanos, la evidencia de estudios en animales indica que el sistema dopaminérgico está ampliamente relacionado con los procesos dolorosos y que actúa en prácticamente toda matriz del dolor.56,59,60
La parte agranulada rostral de la corteza insular recibe proyecciones dopaminérgicas densas, lo que la constituye en un sitio de liberación y metabolismo dopaminérgico.60-62 Además, tiene una alta densidad de receptores dopaminérgicos de la familia D1 y una expresión moderada de receptores dopaminérgicos de la familia D2.63 Se ha demostrado que la aplicación de un antagonista dopaminérgico D1 en la parte agranulada rostral de la ínsula, aumenta el grado de nocicepción de los animales de experimentación en un modelo de inyección intraplantar de formalina, mientras que un inhibidor de la recaptura de dopamina dentro de esta misma región, incrementa el umbral termonociceptivo.62
Desde esta perspectiva, realizamos diversos experimentos para analizar el papel del sistema dopaminérgico dentro de la región agranulada rostral de la corteza insular, en relación con el dolor neuropático. Durante el desarrollo de los experimentos utilizamos el modelo de autotomía, el cual es un modelo de dolor neuropático que se puede evaluar de forma crónica. El estudio consistió en probar el efecto de la microinyección de agonistas y antagonistas selectivos para los receptores dopaminérgicos, subtipos D1 y D2, directamente en la corteza insular. El estudio mostró, por un lado, que la activación de los receptores D2 (inhibidores) disminuyó de manera importante la nocicepción de los animales, y por otro, que cuando bloqueamos a los receptores D1 (excitadores) con un antagonista selectivo, obtuvimos el mismo efecto (figura 3). Esto nos habla del papel diferencial de la dopamina dentro de la ínsula, de acuerdo al tipo de receptor al cual se acople, además de que apoya el hecho de que la dopamina está relacionada con el desarrollo y mantenimiento del dolor neuropático.64
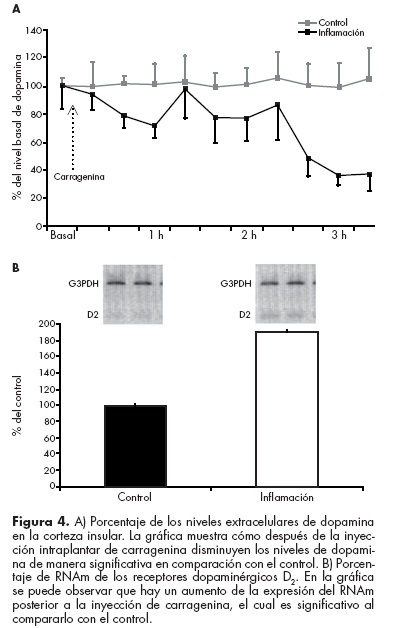
Recientemente reportamos que la inducción de un proceso inflamatorio (inyección plantar de carragenina) disminuye los niveles extracelulares de dopamina y sus metabolitos (Dopac y HVA) en la corteza insular de ratas en libre movimiento. Esta disminución se correlaciona positivamente con la latencia de retiro de la pata (conducta medida en este modelo de inflamación), lo cual indica que mientras menor cantidad de dopamina exista en el medio extracelular el animal experimentará más dolor y viceversa. También encontramos que dicho proceso inflamatorio provoca el aumento en la expresión del RNAm de los receptores dopaminérgicos D2 y una disminución del RNAm de los receptores D1 (figura 4). Esto hace evidente que la dopamina en la ínsula tiene un doble papel compensatorio: por un lado disminuye la liberación de dopamina y la expresión del RNAm de los receptores D1 (excitadores) y por otro lado aumenta la expresión del RNAm de los receptores D2 (inhibidores).65
En este sentido, si tomamos en cuenta que la liberación de dopamina en la corteza insular disminuye ante un evento nociceptivo, sumado al hecho de que el bloqueo de receptores D1 (excitadores y los más abundantes dentro de la corteza insular) disminuye la conducta relacionada al dolor, podemos decir que la ínsula actúa como un sitio pronociceptivo. La evidencia neuroanatómica que respalda esta hipótesis está dada por el hecho de que al eliminar por completo este núcleo, la conducta relacionada al dolor disminuye de manera significativa.54
De manera interesante, los niveles de dopamina no cambian después de la termonocicepción aguda repetida; esto se debe, en parte, a que los procesos agudos son integrados principalmente por la médula espinal,66 lo que sugiere que la corteza insular juega un papel en los procesos dolorosos crónicos y no en los agudos.
COMENTARIOS FINALES
Como hemos visto, los mecanismos relacionados con el desarrollo del dolor son complejos. Sin embargo, las funciones que ejercen los distintos sistemas de neurotransmisión dentro de los núcleos y vías que conforman la matriz del dolor, tienen algo en común. En general, la activación de un receptor inhibitorio disminuye en diferente grado la nocicepción. Tal es el caso, por ejemplo, de los receptores muscarínicos M2 y glicinérgicos en la corteza anterior del cíngulo o los dopaminérgicos D2 en la corteza insular.
Esto habla de la importancia que tiene el desarrollo del dolor en la escala evolutiva, donde son necesarios mecanismos similares y complementarios para tener una respuesta adaptativa más eficiente. Sin embargo se necesitan estudios adicionales con el fin de integrar plenamente la relación entre los diferentes sistemas de neurotransmisión, lo que también permitiría proponer alternativas terapéuticas a los tratamientos convencionales para las diferentes patologías que cursan con una experiencia dolorosa de larga duración.
REFERENCIAS
1. Pellicer F, Ortega-Legaspi JM, López-Avila A, Coffeen U et al. Dopamine pathways and receptors in nociception and pain. Pharmacology Pain: IASP Press; 2010. [ Links ]
2. Oades RD, Halliday GM. Ventral tegmental (A10) system: neurobiology. 1. Anatomy and connectivity. Brain Research 1987;434:117-165. [ Links ]
3. Sarkis D, Souteyrand JP, Albe-Fessard D. Self-stimulation in the ventral tegmental area suppresses self-mutilation in rats with forelimb deafferentiation. Neurosci Lett 1984;44:199-204. [ Links ]
4. Mayer DJ, Liebeskind JC. Pain reduction by focal electrical stimulation of the brain: an anatomical and behavioral analysis. Brain Res 1974;68:73-93. [ Links ]
5. Pellicer F, Torres-López E, Sotres-Bayón F, López-Avila A et al. The affective and cognitive dimension of nociception in an animal model: The role of the anterior cingulate cortex. En: Lucas A (ed.). Frontiers in pain research: Nova Publishers; 2006. [ Links ]
6. Thierry AM, Tassin JP, Blanc G, Glowinski J. Selective activation of mesocortical DA system by stress. Nature 1976;263:242-244. [ Links ]
7. Morgan MJ, Franklin KB. 6-Hydroxydopamine lesions of the ventral tegmentum abolish D-amphetamine and morphine analgesia in the formalin test but not in the tail flick test. Brain Research 1990;519:144-149. [ Links ]
8. Ma QP, Zhou Y, Han JS. Electroacupuncture accelerated the expression of c-Fos protooncogene in dopaminergic neurons in the ventral tegmental area of the rat. Int J Neurosci 1993;70:217-22. [ Links ]
9. Franklin KB. Analgesia and the neural substrate of reward. Neurosci Biobehav Rev 1989;13:149-154. [ Links ]
10. Saade NE, Atweh SF, Bahuth NB, Jabbur SJ. Augmentation of nociceptive reflexes and chronic deafferentation pain by chemical lesions of either dopaminergic terminals or midbrain dopaminergic neurons. Brain Research 1997;751:1-12. [ Links ]
11. López-Avila A, Rodriguez-Manzo G, Coffeen U, del Angel R et al. Self-injury behaviour induced by intraplantar carrageenan infiltration: a model of tonic nociception. Brain Res Brain Res Protoc 2004;13:37-44. [ Links ]
12. Sotres-Bayón F, Torres-Lopez E, Lopez-Avila A, del Angel R et al. Lesion and electrical stimulation of the ventral tegmental area modify persistent nociceptive behavior in the rat. Brain Research 2001;898:342-349. [ Links ]
13. Burkey AR, Carstens E, Jasmin L. Dopamine reuptake inhibition in the rostral agranular insular cortex produces antinociception. J Neurosci 1999;19:4169-4179. [ Links ]
14. Papez JW. A proposed mechanism of emotion. Archives Neurology Psychiatry 1937;38:725-743. [ Links ]
15. Devinsky O, Morrell MJ, Vogt BA. Contributions of anterior cingulate cortex to behaviour. J Neurology 1995;118( Pt 1):279-306. [ Links ]
16. Vogt BA, Finch DM, Olson CR. Functional heterogeneity in cingulate cortex: the anterior executive and posterior evaluative regions. Cereb Cortex 1992;5:435-443. [ Links ]
17. Foltz E, White L. Pain "relief" by frontal cingulotomy. J Neurosurg 1962;19:98-100. [ Links ]
18. Domesick VB. Thalamic relationships of the medial cortex in the rat. Brain, Behavior Evolution 1972;6:457-483. [ Links ]
19. Krettek JE, Price JL. The cortical projections of the mediodorsal nucleus and adjacent thalamic nuclei in the rat. J Comp Neurol 1977;171:157-191. [ Links ]
20. Domesick VB. The fasciculus cinguli in the rat. Brain Res 1970;20:19-32. [ Links ]
21. Mantz J, Milla C, Glowinski J, Thierry AM. Differential effects of ascending neurons containing dopamine and noradrenaline in the control of spontaneous activity and of evoked responses in the rat pre-frontal cortex. Neuroscience 1988;27:517-526. [ Links ]
22. Sikes RW, Vogt BA. Nociceptive neurons in area 24 of rabbit cingulate cortex. J Neurophysiol 1992;68:1720-1732 [ Links ]
23. Dostrovsky JO, Guilbaud G. Nociceptive responses in medial thalamus of the normal and arthritic rat. Pain 1990;40:93-104. [ Links ]
24. Rinaldi PC, Young RF, Albe-Fessard D, Chodakiewitz J. Spontaneous neuronal hyperactivity in the medial and intralaminar thalamic nuclei of patients with deafferentation pain. J Neurosurgery 1991;74:415-421. [ Links ]
25. Gigg J, Tan AM, Finch DM. Glutamatergic excitatory responses of anterior cingulate neurons to stimulation of the mediodorsal thalamus and their regulation by GABA: an in vivo iontophoretic study. Cereb Cortex 1992;2:477-484 [ Links ]
26. Torres-López E, del Angel R, Pellicer F. Thalamic anteromedial and mediodorsal nuclei stimulation enhances the self-injury behavior induced by an inflammatory process in the rat. Analgesia 2000;5:67-73. [ Links ]
27. López-Avila A, Coffeen U, Ortega-Legaspi JM, del Angel R et al. Do-pamine and NMDA systems modulate long-term nociception in the rat anterior cingulate cortex. Pain 2004;111:136-143. [ Links ]
28. Kornhuber J, Quack G, Danysz W, Jellinger K et al. Therapeutic brain concentration of the NMDA receptor antagonist amantadine. Neuropharmacology 1995;34:713-721. [ Links ]
29. Gordon I, Weizman R, Rehavi M. Modulatory effect of agents active in the presynaptic dopaminergic system on the striatal dopamine transporter. European J Pharmacology 1996;298:27-30. [ Links ]
30. Coffeen U, Lopez-Avila A, Pellicer F. Systemic amantadine diminishes inflammatory and neuropathic nociception in the rat. Salud Mental 2009;32:139-144. [ Links ]
31. Eisenberg E, Pud D. Can patients with chronic neuropathic pain be cured by acute administration of the NMDA receptor antagonist amantadine? Pain 1998;74:337-339. [ Links ]
32. Ortega-Legaspi JM, de Gortari P, Garduno-Gutierrez R, Amaya MI et al. Expression of the dopaminergic D1 and D2 receptors in the anterior cingulate cortex in a model of neuropathic pain. Molecular Pain 2011;7:97. [ Links ]
33. Nikolajsen L, Hansen CL, Nielsen J, Keller J et al. The effect of keta-mine on phantom pain: a central neuropathic disorder maintained by peripheral input. Pain 1996;67:69-77. [ Links ]
34. Nasstrom J, Karlsson U, Berge OG. Systemic or intracerebroventricular injection of NMDA receptor antagonists attenuates the antinociceptive activity of intrathecally administered NMDA receptor antagonists. Brain Res 1993;623:47-55. [ Links ]
35. Pellicer F, Lopez-Avila A, Coffeen U, Manuel Ortega-Legaspi J et al. Taurine in the anterior cingulate cortex diminishes neuropathic nociception: a possible interaction with the glycine(A) receptor. European J Pain 2007;11:444-451. [ Links ]
36. Chapman CR. Limbic processes and the affective dimension of pain. Prog Brain Res 1996;110:63-81. [ Links ]
37. Drachman DA, Leavitt J. Human memory and the cholinergic system. A relationship to aging? Arch Neurol 1974;30:113-121. [ Links ]
38. Gaykema RP, Luiten PG, Nyakas C, Traber J. Cortical projection patterns of the medial septum-diagonal band complex. J Comp Neurol 1990;293:103-124. [ Links ]
39. Tohyama M, Takatsuji K. The acetylcholinergic system Atlas of neu-roactive substances and their receptors in the rat: Oxford: Oxford University Press; 1998. [ Links ]
40. Farr SA, Uezu K, Creonte TA, Flood JF et al. Modulation of memory processing in the cingulate cortex of mice. Pharmacology Biochemistry Behavior 2000;65:363-368. [ Links ]
41. Ortega-Legaspi JM, Lopez-Avila A, Coffeen U, del Angel R et al. Sco-polamine into the anterior cingulate cortex diminishes nociception in a neuropathic pain model in the rat: an interruption of 'nociception-related memory acquisition'? Eur J Pain 2003;7:425-429. [ Links ]
42. Ortega-Legaspi JM, Leon-Olea M, de Gortari P, Amaya MI et al. Expression of muscarinic M1 and M2 receptors in the anterior cingulate cortex associated with neuropathic pain. European J Pain 2010;14:901-910. [ Links ]
43. Binder DK, Schaller K, Clusmann H. The seminal contributions of Johann-Christian Reil to anatomy, physiology, and psychiatry. Neurosurgery 2007;61:1091-1096. [ Links ]
44. Augustine J. Circuitry and functional aspects of the insular lobe in primates including humans. Brain Res Rev 1996;22:229-244. [ Links ]
45. Augustine JR. The insular lobe in primates including humans. Neurol Res 1985;7:2-10. [ Links ]
46. Coffeen U, Ortega-Legaspi JM, Pellicer F. Dopamine and pain modulation in the insular cortex. Dopamine: Functions, regulation and health effects. Nueva York: Nova Science Publishers Inc.; 2012. [ Links ]
47. Berthier M, Starkstein S, Leiguarda R. Asymbolia for pain: a sensory-limbic disconnection syndrome. Ann Neurol 1988;24:41-49. [ Links ]
48. Geschwind N. Disconnexion syndromes in animals and man. I. Brain 1965;88:237-294. [ Links ]
49. Barnett EM, Evans GD, Sun N, Perlman S et al. Anterograde tracing of trigeminal afferent pathways from the murine tooth pulp to cortex using herpes simplex virus type 1. J Neurosci 1995;15:2972-2984. [ Links ]
50. Ploghaus A, Tracey I, Gati J, Clare S et al. Dissociating pain from its anticipation in the human brain. Science 1999;284:1979-1981. [ Links ]
51. Porro CA, Baraldi P, Pagnoni G, Serafini M et al. Does Anticipation of Pain Affect Cortical Nociceptive Systems? J Neuroscience 2002;22:3206-3214. [ Links ]
52. Lenz FA, Gracely RH, Zirh AT, Romanoski AJ et al. The sensory-limbic model of pain memory. Pain Forum 1997;6:22-31. [ Links ]
53. Sawamoto N, Honda M, Okada T, Hanakawa T et al. Expectation of pain enhances responses to nonpainful somatosensory stimulation in the anterior cingulate cortex and parietal operculum/posterior insula: an event-related functional magnetic resonance imaging study. J Neurosci 2000;20:7438-7445. [ Links ]
54. Coffeen U, Manuel Ortega-Legaspi J, Lopez-Munoz FJ, Simon-Arceo K et al. Insular cortex lesion diminishes neuropathic and inflammatory pain-like behaviours. European J Pain 2011;15:132-138. [ Links ]
55. Ostrowsky K, Magnin M, Ryvlin P, Isnard J et al. Representation of pain and somatic sensation in the human insula: a study of responses to direct electrical cortical stimulation. Cereb Cortex 2002;12:376-385. [ Links ]
56. Wood PB. Role of central dopamine in pain and analgesia. Expert Rev Neurother 2008;8:781-797. [ Links ]
57. Silva EG, Viana MA, Quagliato EM. Pain in Parkinson's disease: analysis of 50 cases in a clinic of movement disorders. Arq Neuropsiquiatr 2008;66:26-29. [ Links ]
58. Ertas M, Sagduyu A, Arac N, Uludag B et al. Use of levodopa to relieve pain from painful symmetrical diabetic polyneuropathy. Pain 1998;75:257-259. [ Links ]
59. Mantz J, Thierry AM, Glowinski J. Effect of noxious tail pinch on the discharge rate of mesocortical and mesolimbic dopamine neurons: selective activation of the mesocortical system. Brain Research 1989;476:377-381. [ Links ]
60. Ohara P, Granato A, Moallem T, Wang B et al. Dopaminergic input to GABAergic neurons in the rostral agranular insular cortex of the rat. J Neurocytol 2003;32:131-141. [ Links ]
61. Burkey AR, Carstens E, Wenniger JJ, Tang J et al. An opioidergic cortical antinociception triggering site in the agranular insular cortex of the rat that contributes to morphine antinociception. J Neurosci 1996;16:6612-6623. [ Links ]
62. Burkey AR, Carstens E, Jasmin L. Dopamine reuptake inhibition in the rostral agranular insular cortex produces antinociception. J Neurosci 1999;19:4169-4179. [ Links ]
63. Hurd YL, Suzuki M, Sedvall GC. D1 and D2 dopamine receptor mRNA expression in whole hemisphere sections of the human brain. J Chem Neuroanat 2001;22:127-137. [ Links ]
64. Coffeen U, Lopez-Avila A, Ortega-Legaspi JM, del Angel R et al. Dopamine receptors in the anterior insular cortex modulate long-termnociception in the rat. Eur J Pain 2008;12:535-543. [ Links ]
65. Coffeen U, Ortega-Legaspi JM, de Gortari P, Simon-Arceo K et al. Inflammatory nociception diminishes dopamine release and increases dopamine D2 receptor mRNA in the rat's insular cortex. Mol Pain 2010;6:75. [ Links ]
66. Willis WD, Jr. Dorsal horn neurophysiology of pain. Ann N Y Acad Sci 1988;531:76-89. [ Links ]
* Pellicer F, Ortega-Legaspi J, López-Avila A, Coffeen U. Dopamine pathways and receptors in nociception and pain. En: Press I (ed). Pharmacology of Pain; 2010.














