Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Salud mental
versión impresa ISSN 0185-3325
Salud Ment vol.35 no.5 México sep./oct. 2012
Artículo original
Participación de las hormonas gonadales en el efecto de los fármacos antidepresivos en la rata macho
Participation of gonadal hormones in the effect of antidepressant drugs in male rats
Lucía Martínez-Mota,1 José Jaime Herrera-Pérez,1 Maribel Olivares Nazario,1,2 Alonso Fernández-Guasti2
1 Laboratorio de Farmacología Conductual, Dirección de Investigaciones en Neurociencias, Instituto Nacional de Psiquiatría Ramón de la Fuente Muñiz.
2 Departamento de Farmacobiología, Centro de Investigación y de Estudios Avanzados del IPN.
Correspondencia:
Dra. Lucía Martínez-Mota.
Instituto Nacional de Psiquiatría Ramón de la Fuente Muñiz,
Calz. México-Xochimilco 101, San Lorenzo Huipulco,
Tlalpan, 14370, México, DF.
Tel/fax: 5655-9980. E-mail: lucia@imp.edu.mx
SUMMARY
It has been proposed that gonadal hormones participate in regulation of mood and emotion in men as well as in the effect of psychoactive drugs, such as antidepressants. However, evaluation of this type of interactions has been poorly studied in clinic and basic studies. The objective of the present study was to determine the role of gonadal hormones, testosterone (T) and 17β-estradiol (E2), one of its main metabolites, in the effect of two antidepressant drugs: desipramine and fluoxetine. The former is a tricyclic antidepressant that inhibits noradrenaline reuptake in a preferential manner, while the second is a serotonin selective reup-take inhibitor (SSRI) and the most prescribed antidepressant. Behavioral evaluations were conducted in adult male rats, intact or orchidectomized (Orx), treated with T (0-2 mg/rata), E2 (0-40 µg/rata), desipramine (0-20 mg/kg), fluoxetine (0-20 mg/kg) and their combinations. Forced swimming test was used as an animal model to detect antidepressant-like effect induced by treatments, on the basis of its predictive validity. We found that desipramine and fluoxetine produced an anti-depressant-like effect in gonadally intact male rats. However, the antidepressant-like effect of both treatments was cancelled in Orx males. Treatment with E2, but not with T, produced antidepressant-like actions in Orx males. Interestingly, treatment with E2 restored the antidepressant-like effect of desipramine and fluoxetine, while supplementation with T only reestablished the antidepressant-like action of desipramine, evidencing that gonadal hormones have a differential participation in regulation of neurotransmitter systems involving in the antidepressant effect. In conclusion, the main testicular androgen T, participates in the expression of the effect of antidepressant drugs, mainly via conversion to its estrogenic metabolite E2. These results give support to the idea that a combined therapy of gonadal hormones and antidepressant drugs may be more convenient to treat depressive disorders in hypogonadal men resistant to conventional antidepressant drugs.
Key words: Animal models of depression, antidepressants, forced swimming test, estradiol, testosterone.
RESUMEN
Se ha propuesto que las hormonas gonadales participan en la regulación del estado de ánimo en los varones, y en el efecto de los fármacos psicoactivos, tales como los antidepresivos. Sin embargo, la evaluación de este tipo de interacciones ha sido estudiada escasamente. El objetivo del presente trabajo fue determinar el papel que cumplen las hormonas testosterona (T) y 17β-estradiol (E2), uno de sus principales metabolitos, en el efecto de dos fármacos antidepresivos utilizados en la práctica clínica, desipramina y fluoxetina. El primero es un tricíclico con acciones sobre el sistema noradrenérgico, mientras que la fluoxetina es un inhibidor selectivo de la recaptura de serotonina. Las evaluaciones se llevaron a cabo utilizando ratas macho adultas jóvenes, gonadalmente intactas u orquidectomizadas (Orx), bajo tratamiento con T (0-1 mg/rata), E2 (0-40 µg/rata), desipramina (0-20 mg/kg), fluoxetina (0-20 mg/kg) y sus respectivas combinaciones. Se utilizó la prueba de nado forzado (PNF) para detectar las acciones antidepresivas de los tratamientos. Encontramos que desipramina y fluoxetina redujeron la conducta de depresión en los machos gonadalmente intactos; sin embargo, el efecto de ambos tratamientos fue abolido por la orquidectomía. El tratamiento de restitución hormonal con E2, pero no con T, indujo acciones antidepresivas en los machos Orx. A su vez, cuando los animales Orx recibieron la restitución con T se produjo la recuperación del efecto antidepresivo de la desipramina, mientras que el E2 restableció las acciones antidepresivas de ambos fármacos. En conclusión, el principal andrógeno de origen testicular, la T, participa en la expresión del efecto de los fármacos antidepresivos explorados en el presente estudio, principalmente a través de su metabolito estrogénico, el E2. Estos resultados apoyan la idea de que una terapia adjunta de tratamientos hormonales y antidepresivos sería de beneficio para varones hipogonadales que cursen con depresión resistente a los fármacos antidepresivos convencionales.
Palabras clave: Modelos animales de depresión, fármacos antidepresivos, prueba de nado forzado, testosterona, estradiol.
INTRODUCCIÓN
El declive en los niveles circulantes de androgenes gonadales se asocia con cambios somáticos y psicológicos en el varón, tales como disminución de la energía y de la fuerza muscular, cambios en el estado de ánimo, irritabilidad y disfunción sexual.1-3 Los trastornos psiquiátricos como la depresión también se presentan o exacerban con cambios en la condición endocrina; de hecho, varios autores han encontrado una correlación negativa entre los niveles de testosterona (T) en pacientes hipogonadales y la gravedad de la sintomatología depresiva.4,5 Una observación interesante sobre esta relación es que la terapia con andrógenos anabólicos reduce los síntomas depresivos en los pacientes hipogonadales, de manera similar a como lo hacen los fármacos antidepresivos tradicionales,6-8 lo que sugiere una interacción entre los andrógenos, los circuitos cerebrales y los sistemas de neurotransmisión que participan en la regulación del estado de ánimo y los trastornos afectivos. Como una confirmación de esta idea, dos estudios han reportado que el tratamiento de restitución hormonal con T recupera el efecto antidepresivo de los inhibidores selectivos de la recaptura de serotonina (ISRS) en pacientes hipogonadales deprimidos, refractarios a dichos tratamientos.9
Se ha determinado que muchos de los efectos de la T -organizacionales y activacionales- se producen por acción de sus metabolitos. La T es catabolizada por la enzima 5α-reductasa para obtener el metabolito dihidrotestosterona, un andrógeno más potente que la hormona madre, el cual no puede ser aromatizado. Asimismo, la enzima aromatasa convierte T a 17β-estradiol (E2), el estrógeno natural más potente.10 Mediante el uso de modelos animales de trastornos psiquiátricos se ha establecido que la T produce acciones antidepresivas en el ratón macho,11 mientras que el metabolito 3α,5α-androstanediol (3α-diol) disminuye la ansiedad, mejora las funciones cognoscitivas (aprendizaje y memoria)12,13 y produce efectos hedónicos14,15 en las ratas macho, a través de su interacción con los receptores a estrógenos.16 A su vez, el E2 administrado directamente como un tratamiento de restitución hormonal en ratas hembra produce efectos antidepresivos,17,18 parecidos a los de los ISRS. Sin embargo, en la rata macho no se ha determinado si la T y el E2 son capaces de inducir acciones antidepresivas en modelos experimentales.
La prueba de nado forzado (PNF) es uno de los modelos animales más utilizados en la investigación para detectar efectos antidepresivos de los fármacos.19 En esta prueba, las ratas son forzadas a nadar en un cilindro con agua en dos sesiones separadas por un periodo de 24 horas. La primera sesión es considerada un estresor de intensidad alta, que favorece el desarrollo de desesperanza, un signo de la depresión en el humano, que en la rata se refleja en incremento de la conducta de inmovilidad. Una variedad de tratamientos antidepresivos reduce el tiempo de inmovilidad o el número de inmovilidades, lo que se interpreta como un efecto antidepresivo. La versión modificada de la PNF20 analiza además las conductas activas de nado y escalamiento, la primera es estimulada por fármacos que actúan en el sistema serotonérgico, mientras que el escalamiento es favorecido por los fármacos con acciones sobre los sistemas catecolaminérgicos. Por lo tanto, mediante un análisis de este tipo es posible elucidar un mecanismo de acción primario por el cual se produce el efecto antidepresivo de nuevas sustancias.
La PNF también es sensible al efecto de las hormonas de origen gonadal, ya que el tratamiento con progestinas o estrógenos reduce la conducta de inmovilidad en las hembras ovariectomizadas.21-23 De forma interesante, se ha demostrado que el E2 facilita el efecto antidepresivo de la desipramina y la fluoxetina, al producir menor conducta de inmovilidad y mayor expresión de las conductas activas.22 De los andrógenos únicamente se sabe que, en ratones, el tratamiento con T produce un efecto antidepresivo similar al inducido por la desipramina.11 Sin embargo, no existen más estudios sistemáticos donde se explore el efecto de la combinación de antidepresivos y hormonas gonadales en sujetos del sexo masculino.
Tomando en cuenta esta información, el objetivo del presente trabajo fue determinar el papel que cumplen las hormonas T y E2 en el efecto de dos fármacos antidepresivos utilizados en la práctica clínica, desipramina y fluoxetina. El primero es un tricíclico que inhibe de forma preferente la recaptura de noradrenalina, mientras que la fluoxetina inhibe selectivamente la recaptura de serotonina.
MATERIAL Y MÉTODOS
Animales
Se utilizaron ratas macho de la cepa Wistar, de tres meses de edad (200-250g), que se alojaron en cajas de policarbonato (60 x 40 x 20cm, cinco por caja) en un cuarto con ciclo de luz/oscuridad de 12 x 12 horas (la luz se encendió a las 22:00 horas). Todos los animales tuvieron libre acceso a agua y alimento, excepto en el periodo de experimentación. El comité de ética institucional aprobó el protocolo (3370.0) y el manejo de los animales se hizo de acuerdo con los lineamientos de la norma oficial mexicana NOM-062-ZOO-1999.
Cirugía
Las ratas fueron orquidectomizadas bajo anestesia con tribromoetanol (200mg/kg). Después de suturar el músculo y la piel, se desinfectó el área manipulada y se permitió la recuperación de los animales durante tres semanas antes de iniciar los experimentos.
Tratamientos
Los antidepresivos desipramina (Sigma Chemicals Co., MO) y fluoxetina se utilizaron en forma de clorhidrato (Eli-Lilly S.A.), disueltos en solución salina isotónica (0.9%). Las hormonas esteroides, propionato de testosterona (T) y 17β-estradiol (E2) (Sigma Chemicals Co., MO) se disolvieron en aceite de maíz con dos gotas de diclorometano.
Prueba de nado forzado (PNF)
Se utilizó la versión modificada de la PNF, propuesta por Detke et al.20 Las ratas se colocaron en un cilindro de vidrio (46cm de altura x 20cm de diámetro), con agua a 23-25 °C, que alcanzó un nivel de 30cm a partir de la base del cilindro. Las ratas fueron forzadas a nadar en dos sesiones separadas por un periodo de 24 horas. La primera sesión (15min) denominada preprueba se utilizó para favorecer el desarrollo de un estado de desesperanza, que se reflejó en mayor expresión de la conducta de inmovilidad (conducta tipo depresión). La segunda sesión de nado (5min), o prueba, se videograbó para el posterior análisis.
Se utilizó un sistema de registro instantáneo que consistió en anotar cada cinco segundos la conducta realizada por el animal, de tal forma que se obtuvieron 60 observaciones (cuentas) en cinco minutos de registro. Se analizaron las conductas de: inmovilidad, definida como todos los episodios en los cuales el animal hizo únicamente los movimientos mínimos para mantenerse a flote; nado, definida como los movimientos de desplazamiento en el cilindro, incluyendo el buceo; y escalamiento, definido como los movimientos vigorosos de las patas anteriores dirigidos a las paredes del cilindro, que indican intento de trepado. La reducción de la inmovilidad en la prueba se interpretó como un efecto antidepresivo, mientras que el aumento de las conductas activas evidenció las acciones de los tratamientos sobre los sistemas de neurotransmisión serotonérgico (para nado) o noradrenérgico (para escalamiento).20
Para descartar posibles efectos inespecíficos de los tratamientos, todos los animales fueron evaluados en la prueba de campo abierto cinco minutos antes de la evaluación en la PNF (segunda sesión). Se colocó a los animales en una caja de acrílico (60 X 40 X 20cm) con el piso dividido en cuadros de 10 x 10cm. Se permitió la ambulación y se contó el número de cuadros cruzados por cada rata en cinco minutos de prueba, considerando como un cruce cuando la rata pasa tres cuartas partes de su cuerpo hacia el cuadro adyacente.
Diseño experimental
Efecto de los antidepresivos en machos intactos y Orx. Las ratas intactas fueron tratadas con desipramina (2.5-10mg/kg) o fluoxetina (2.5-10mg/kg), mediante un esquema subcrónico, que consistió en tres inyecciones por vía subcutánea (s.c.), administradas en un periodo de 24 horas: 23.5, cinco y una hora antes de la sesión de nado de cinco minutos. El grupo control recibió en el mismo esquema inyecciones de solución salina isotónica 0.9%. Las dosis de desipramina y fluoxetina se seleccionaron de reportes de la literatura científica que indican su efectividad como antidepresivos en la PNF.20,23
Los grupos de ratas Orx fueron tratadas con desipramina o fluoxetina, únicamente con las dosis que fueron efectivas en los machos intactos. El grupo control recibió inyecciones de solución salina isotónica; todos los tratamientos fueron aplicados mediante el esquema subcrónico señalado anteriormente.
Efecto de T y E2 en los machos Orx. Grupos independientes de ratas Orx fueron tratadas con: propionato de T (0.5-2mg/ rata) durante 10 días, una inyección s.c. por día, o E2(5-20μg/ rata), en única administración s.c. La evaluación del efecto de la T se realizó 28 horas después de la última administración, mientras que el efecto de E2 se analizó 48 horas después de la administración, de acuerdo con datos previos.17,24
Efecto de las hormonas y los antidepresivos en machos Orx
Grupos independientes de ratas Orx fueron tratadas con vehículo (aceite de maíz) o propionato de T (0.5mg/rata), 10 inyecciones s.c., una por día, más los antidepresivos desipramina (2.5mg/kg) o fluoxetina (10mg/kg) en tratamiento subcrónico (tres inyecciones s.c. en un periodo de 24 horas). Otros grupos de animales fueron tratados con vehículo (aceite de maíz) o E2 (5-10μg/rata), una administración s.c., más los antidepresivos desipramina (2.5mg/kg) o fluoxetina (10mg/kg). Las dosis se seleccionaron de acuerdo con los resultados encontrados en los experimentos previos.
Análisis estadístico
Los resultados se analizaron con un ANOVA de una vía, seguido de una prueba de Tukey cuando el resultado del ANOVA alcanzó la significancia estadística. Todos los resultados se expresaron como medias y error estándar de la media.
RESULTADOS
Desipramina y fluoxetina producen acciones antidepresivas en los machos intactos. Como se esperaba, la desipramina produjo reducción de la inmovilidad (F339 =9.22, P<0.001) y aumento del escalamiento (F3,39 =6.86, P<0.001), sin cambios en el nado (F3,39 =0.01, P=0.99). La dosis efectiva de desipramina se estableció en 10mg/kg. Fluoxetina a la misma dosis produjo reducción de la inmovilidad (F3,36 =8.22, P<0.001) de forma estadísticamente significativa, y provocó un aumento estadísticamente significativo en las conductas de nado (F3,36 =11.78, P<0.001) y escalamiento (F3,36 =3.95, P<0.01).
Por otra parte, la dosis de desipramina y fluoxetina que fue efectiva en los machos intactos (10mg/kg) no produjo reducción de la inmovilidad en los machos castrados. Incluso una dosis más alta de ambos tratamientos antidepresivos (20 mg/kg) fue incapaz de modificar las conductas en la PNF. Los resultados del ANOVA de una vía fueron: para desipramina: inmovilidad F2,27 =1.98; nado F2,27 =1.91, P=0.16; escalamiento F2,27 =2.42, P=0.10; para fluoxetina: inmovilidad F2,28 =2.69, P=0.06; nado F2,28 =1.44, P=0.25; escalamiento F2,28 =0.33, P=0.72.
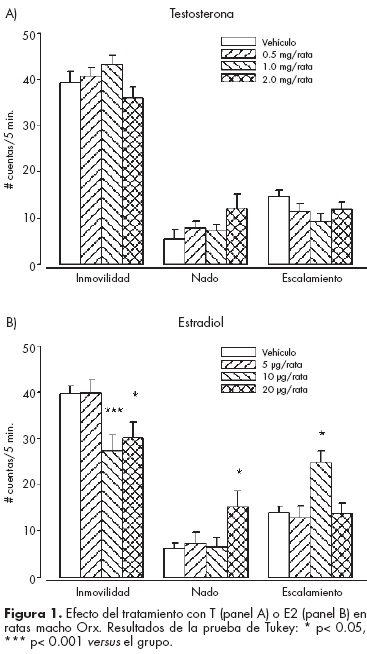
E2, pero no T, produce acciones antidepresivas en los machos Orx. En la figura 1 se muestra que los tratamientos hormonales con T (panel A) y E2 (panel B) produjeron efectos diferenciales en la PNF. El E2 indujo acciones antidepresivas en los machos castrados, a partir de 10 µg/ rata, que se detectaron con reducción de la conducta de inmovilidad (F3,39 =4.31, P<0.005), aumento del nado (F339 =4.31, P=0.005) y del escalamiento (F339 =5.95, P< 0.001). En contraste, la T no modificó significativamente la inmovilidad (F343 =1.02, P=0.37), el nado (F343 =0.56, P=0.57) o el escalamiento (F343 =2.97, p=0.06).
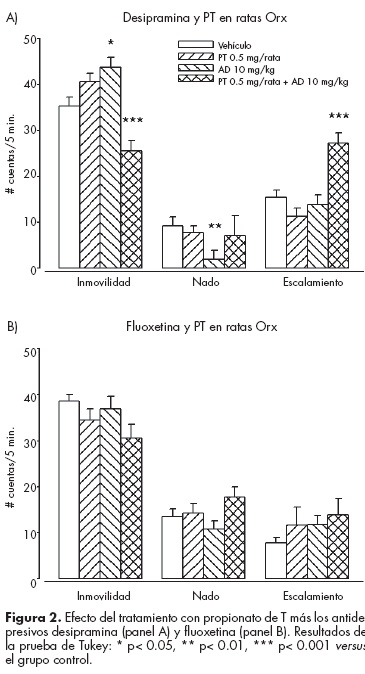
T recupera el efecto antidepresivo de desipramina, pero no de fluoxetina. En la figura 2 se muestra que el tratamiento de restitución hormonal con el andrógeno permitió el efecto antidepresivo de la desipramina, que se determinó mediante reducción de la inmovilidad (F3,41 =13.79, P<0.001), aumento del escalamiento (F =2.98, P=0.04), sin cambios en el nado (F3,41 =14.63, P<0.001). En contraste, T en combinación con fluoxetina, no redujo la inmovilidad; pero se produjo un aumento de la misma (F337 =6.14, P=0.002) con el antidepresivo que correspondió con bajo nado (F3,37 =6.64, P=0.001), sin cambios en el escalamiento (F3,37 =1.09, P=0.36).
E2 recupera el efecto antidepresivo de desipramina y fluoxetina. En la figura 3 se ilustra que E2 en combinación con desipramina (panel A) provocó disminución de la inmovilidad (F5,60=4.79, P=0.001), aumento del nado (F5,60 =3.26, P=0.01) y del escalamiento (F560 =4.16, P=0.003). La facilitación del efecto de desipramina con E2 a 5µg/kg se observó con diferentes dosis del antidepresivo (datos no mostrados), incluso a una tan baja como 2.5mg/kg, que es la combinación graficada. Una dosis más alta del E2 (10µg/ rata), que per se produce acciones antidepresivas, no facilitó el efecto del antidepresivo más allá del nivel alcanzado con la dosis baja del estrógeno. En el panel B se observa que la combinación de E2 con fluoxetina produjo reducción de la inmovilidad (F5,57 =19.46, P<0.001) y aumento del escalamiento (F5,57 =13.46, P<0.001), sin modificar el nado (F5,57 =1.89, P=0.11). El análisis post hoc mostró que la dosis subóptima de E2 (5μ/rata) incrementó la inmovilidad; sin embargo, la combinación del antidepresivo con la dosis óptima del estrógeno (10μg/ rata) produjo una reducción de la inmovilidad estadísticamente más significativa que la encontrada con el tratamiento estrogénico.

Los tratamientos no producen alteraciones motoras en la prueba de campo abierto. Los resultados de la evaluación en la prueba de campo abierto (datos no mostrados) indican que ninguno de los tratamientos estudiados: los antidepresivos, las hormonas gonadales y sus combinaciones, produjeron incremento de la actividad motriz que pudiera relacionarse con el aumento de las conductas activas inducidas por los mismos tratamientos en la PNF.
DISCUSIÓN
Los resultados del presente estudio apoyan la hipótesis de que, en sujetos del sexo masculino, las hormonas de origen gonadal modulan el efecto de los fármacos antidepresivos.
Las acciones organizacionales y activacionales de los andrógenos son producidas tanto por éstos como por su conversión a estrógenos.10 En el presente estudio encontramos que la T no produjo efectos antidepresivos en los machos castrados, lo que contrasta con reportes previos que usan ratones11 o ratas macho12-16 como sujetos experimentales. Es posible que las discrepancias encontradas entre los reportes se deban a diferencias metodológicas, tales como la especie de roedor, el tipo de andrógeno utilizado, la duración del tratamiento y las variaciones en la PNF. Por ejemplo, Bernardi et al.11 utilizaron ratones Swiss-Webster cuatro semanas después de la castración, que recibieron un tratamiento breve (cuatro administraciones) de T, mientras que Frye et al.12-16 usaron tratamientos de T, dihidrotestosterona y 3α-diol administrados de forma aguda, así como una versión modificada de la PNF, en la cual se prescinde de la preprueba. Otros resultados del laboratorio sugieren que al menos para la depresión, la T tiene una relevancia fisiológica que depende de la edad. Por un lado encontramos que la castración en los machos adultos jóvenes no favorece el desarrollo de anhedonia en el modelo de estrés moderado crónico; las bajas concentraciones de T en machos viejos se asocian a una mayor vulnerabilidad para desarrollar anhedonia,25 en tanto que la recuperación de las concentraciones del andrógeno en los machos viejos previene el desarrollo de anhedonia.26
En contraste con la T, el E2 produjo claras acciones antidepresivas en los machos Orx. Aunque el mecanismo de acción de los estrógenos como antidepresivos no ha sido estudiado en los machos, es posible que esté relacionado con la regulación del eje hipotálamo-hipófisis-adrenal (HPA). El nado forzado activa el eje HPA promoviendo un incremento en la síntesis y liberación del glucocorticoide corticosterona, el principal mediador del estrés. A su vez, el incremento en la concentración de corticosterona se correlaciona positivamente con la conducta de inmovilidad en la PNF.27,28 Se ha determinado que tanto la T como el E2 y el 3α-diol regulan las concentraciones de corticosterona en los machos.29 La T reduce la concentración de corticosterona,30 mientras que el efecto de E2 depende de la dosis utilizada: cuando los niveles de E2 se encuentran en el rango fisiológico la concentración de corticosterona se reduce y podría asociarse a una disminución de la conducta de inmovilidad; sin embargo, cuando los niveles del estrógeno exceden el rango fisiológico, el eje HPA se activa favoreciendo una mayor liberación del gluco-corticoide y presumiblemente más conducta depresiva.18Esta interpretación apoya los resultados del presente trabajo.
El efecto antidepresivo de E2 en los machos Orx se limitó a las dosis de 10 y 20μg/rata. Este resultado es consistente con otros de la literatura, en los cuales se demuestra que el tratamiento con E2 produce acciones antidepresivas ansiolíticas y sobre la cognición en un rango de dosis limitado.17,18,31 De hecho, los estudios en hembras demuestran que éstas responden a dosis tan bajas como 2.5μg/rata, lo que señala una mayor sensibilidad a las acciones del E2 en sujetos del sexo femenino.
El tratamiento con E2 incrementó ambas conductas activas, nado y escalamiento, lo que contrasta con los resultados obtenidos en las hembras, donde predomina la conducta de nado.17,22 De acuerdo con la interpretación de las conductas activas propuesta por Detke et al.,20 es posible que en los machos, a diferencia de las hembras, se produzca la activación de ambos sistemas de neurotransmisión, serotonérgico y noradrenérgico. Esta idea corresponde con el efecto de E2 sobre el RNA mensajero de las enzimas limitantes para la producción de serotonina y noradrenalina,32,33 aunque es necesario conducir estudios específicos para probar esta hipótesis.
El presente trabajo confirma el efecto antidepresivo de desipramina y fluoxetina en la PNF en machos gonadalmente intactos,20 el cual se evidenció con reducción de la inmovilidad y aumento de las conductas de escalamiento y nado, respectivamente. De forma interesante, la Orx canceló por completo el efecto de los antidepresivos, incluso cuando se duplicó su dosis. Este hallazgo destaca, ya que tradicionalmente no se considera a las secreciones testiculares como moduladoras de los efectos de los antidepresivos. Sin embargo, algunos estudios clínicos llevados a cabo con un bajo número de sujetos revelan que en pacientes hipogonadales, deprimidos, resistentes a los ISRS, un tratamiento de restitución hormonal con T permitió que se expresara el efecto de dichos antidepresivos; a su vez, la suspensión del tratamiento hormonal disminuyó la acción antidepresiva de los ISRS.9 Por lo tanto, los resultados del presente trabajo dan sustento a los resultados obtenidos en los estudios clínicos.
La falta de efecto antidepresivo de desipramina y fluoxetina en los machos Orx podría deberse a un mecanismo farmacocinético. La Orx reduce la tasa de desmetilación de algunos antidepresivos,34 lo que llevaría a niveles incrementados de los antidepresivos en la sangre. Los resultados del presente trabajo argumentan contra esta propuesta ya que incluso una dosis de 20mg/kg de desipramina y fluoxetina fue incapaz de producir un efecto antidepresivo en los machos castrados. Otra posible explicación involucra mecanismos farmacodinámicos, ya que la Orx produce una reducción de los sitios de unión a nisoxetina tritiada en el bulbo olfatorio y en la corteza prefrontal,35 así como una reducción del RNA mensajero del transportador de serotonina en los núcleos dorsales del rafé.36 Por lo tanto, la reducción tanto del transportador de noradrenalina como de serotonina provocada por la Orx podría ser responsable de la falta de efecto de los antidepresivos. En apoyo a esta idea, Kakiuchi et al.37 han postulado que el efecto de los ISRS depende directamente del número de sitios blanco en el Sistema Nervioso Central.
En nuestro estudio se determinó que un tratamiento crónico de T recuperó las acciones antidepresivas de la desipramina. El mismo tratamiento hormonal restableció las concentraciones de dopamina en el área preóptica reducidas por la castración.24 Los niveles de dopamina cerebrales son necesarios para la expresión del efecto antidepresivo de la desipramina en la PNF,38 por lo que es posible que los cambios en la concentración de esta catecolamina por la castración y posterior tratamiento con T den lugar a variaciones en la respuesta al antidepresivo tricíclico. Dado que E2, uno de los metabolitos de la T, favorece la síntesis de la noradrenalina, es de esperarse que participe también en la recuperación del efecto antidepresivo de la desipramina.
El tratamiento con T no restableció las acciones antidepresivas de fluoxetina, sin embargo, el metabolito E2 mejoró las acciones del ISRS. Un gran número de estudios apoya la idea de que la conversión de T a E2 es un paso importante para la regulación de los efectos de los andrógenos. Estudios moleculares indican que el tratamiento con E2 y T, pero no con dihidrotestostosterona, mejora la expresión del RNA mensajero del transportador de serotonina,39 sitio blanco de los ISRS. Asimismo, el tratamiento con T y E2 recupera el recambio de la serotonina en el hipotálamo y el estriado de ratas castradas, pero este efecto no fue producido por la dihidrotestosterona.40 Kendall et al.41 encontraron que la Orx provocó una reducción de la densidad de los receptores 5-HT2 en la corteza frontal, que fue restablecida con estrógenos, pero no con T ni con dihidrotestosterona. Finalmente, experimentos de nuestro laboratorio indican que la inactivación de la enzima aromatasa mediante un tratamiento con formestano bloqueó el efecto antidepresivo de la fluoxetina en los machos gonadalmente intactos.42
Es importante considerar que las interacciones entre T, E2 y los antidepresivos se analizaron en animales jóvenes Orx, lo que equivaldría a los estudios realizados en hombres hipogonadales, una patología que compromete el desarrollo de los varones. Sin embargo, una condición fisiológica normal que cursa con bajos niveles hormonales es el envejecimiento. Al respecto, datos recientes del laboratorio indican que en ratas macho viejas el efecto antidepresivo del citalopram, un ISRS, sufre un retardo en su expresión, y tal cambio se correlacionó con los bajos niveles de T encontrados en esta población.43
En conclusión, el principal andrógeno de origen testicular, la T, participa en la expresión del efecto de los fármacos antidepresivos explorados en el presente estudio, principalmente a través de su metabolito estrogénico, el E2. Estos resultados apoyan la idea de que una terapia adjunta de tratamientos hormonales y antidepresivos sería de beneficio para varones hipogonadales que cursen con depresión resistente a los fármacos antidepresivos convencionales, y sugieren nuevas formas de tratamiento para pacientes ancianos con deficiencia parcial de andrógenos.
AGRADECIMIENTOS
Al químico José Juan Cruz Martínez y al técnico Sergio Márquez Baltazar por el desarrollo de los experimentos y por el cuidado hacia los animales de laboratorio.
Este trabajo fue desarrollado gracias al apoyo económico otorgado por el Consejo Nacional de Ciencia y Tecnología (CONACyT No. 62020), el Instituto Nacional de Psiquiatría Ramón de la Fuente Muñiz (3370.0) y al Departamento de Farmacobiología del Centro de Investigación y de Estudios Avanzados del IPN.
REFERENCIAS
1. Margolese HC. The male menopause and mood: testosterone decline and depression in the aging male -Is there a link? J Geriatr Psychiat Neurol 2000;13:93-101. [ Links ]
2. Seidman SN. Testosterone deficiency and mood in aging men: pathogenic and therapeutic interactions. World J Biol Psychiat 2003;4:14-20. [ Links ]
3. Seidman SN, Walsh BT. Testosterone and depression in aging men. Am J Geriatr Psychiat 1999;7:18-33. [ Links ]
4. Yesavage JA, Davidson J, Widrow L, Berger PA. Plasma testosterone levels, depression, sexuality, and age. Biol Psychiat 1985;20:222-225. [ Links ]
5. Schweiger U, Deuschle M, Weber B, Korner A et al. Testosterone, gonadotropin, and cortisol secretion in male patients with major depression. Psychosom Med 1999;61:292-296. [ Links ]
6. Vogel W, Klaiber EL, Broverman DM. A comparison of the antidepressant effects of a synthetic androgen (Mesterolone) and amitriptyline in depressed men. J Clin Psychiat 1985;46:6-8. [ Links ]
7. Wagner GJ, Rabkin JG, Rabkin R. A comparative analysis of standard and alternative antidepressants in the treatment of Human Immunodeficiency Virus patients. Com Psychiat 1996;37:402-408. [ Links ]
8. O'Connor DB, Archer J, Hair WM, Wu FC. Exogenous testosterone, aggression, and mood in eugonadal and hypogonadal men. Physiol Behav 2002;75:557-566. [ Links ]
9. Seidman SN, Rabkin JG. Testosterone replacement therapy for hypogonadal men with SSRI-refractory depression. J Affect Dis 1998;48:157-161. [ Links ]
10. Sharpe RM. The role of oestrogen in the male. TEM 1998; 9:371-377. [ Links ]
11. Bernardi M, Genadani S, Tagliavini S, Bertolini A. Effects of castration and testosterone in experimental models of depression in mice. Behav Neurosci 1989;103:1148-1150. [ Links ]
12. Edinger KL, Frye CA. Testosterone's anti-anxiety and analgesic effects may be due in part to actions of its 5alpha-reduced metabolites in the hippocampus. Psychoneuroendocrinology 2005;30:418-430. [ Links ]
13. Edinger KL, Lee B, Frye CA. Mnemonic effects of testosterone and its 5alpha-reduced metabolites in the conditioned fear and inhibitory avoidance tasks. Pharmacol Biochem Behav 2004;78:559-568. [ Links ]
14. Rosellini RA, Svare BV, Rhodes ME, Frye CA. The testosterone metabolite and neurosteroid 3a-androstanediol may indicate the effects of testosterone on conditioned place preference. Brain Res Rev 2001;37:162-171. [ Links ]
15. Frye CA, Park D, Tanaka M, Rosellini R et al. The testosterone metabolite and neurosteroid 3alpha-androstanediol may mediate the effects of testosterone on conditioned place preference. Psychoneuroendocrinology 2001;26:731-750. [ Links ]
16. Edinger KL, Frye CA. Androgens' effects to enhance learning may be mediated in part through actions at estrogens receptor-beta in the hippocampus. Neurobiol Learn Mem 2007;87:78-85. [ Links ]
17. Estrada-Camarena E, Fernández-Guasti A, López-Rubalcava, C. Different estrogenic compounds produce an antidepressant-like effect in the forced swimming test. Neuropsychopharmacology 2003;28:830-838. [ Links ]
18. Walf AA, Frye CA. Antianxiety and antidepressive behavior produced by physiological estradiol regime may be modulated by hypo-thalamic-pituitary-adrenal axis activity. Neuropsychopharmacology 2005;30:1288-1301. [ Links ]
19. Porsolt RD, Le Pichon M, Jalfre M. Depression: a new animal model sensitive to antidepressant treatments. Nature 1977;266:730-732. [ Links ]
20. Detke MJ, Rickels M, Lucki I. Active behaviors in the rat forced swimming test differently produced by serotonergic and noradrenergic an-tidepressants. Psychopharmacology 1995;21:66-72. [ Links ]
21. Martínez-Mota L, Contreras CM, Saavedra M. Progesterone reduces immobility in rats forced to swim. Arch Med Res 1999;30:286-289. [ Links ]
22. Estrada-Camarena E, Fernández-Guasti A, López-Rubalcava C. Interaction between estrogens and antidepressants in the forced swimming test in rats. Psychopharmacology 2004;173:139-145. [ Links ]
23. Contreras CM, Martínez-Mota L, Saavedra M. Desipramine restricts estrous cycle oscillations in swimming. Prog Neuropsychopharmacol Biol Psychiat 1998;22:1121-1128. [ Links ]
24. Putnam SK, Du J, Sato S, Hull EM. Testosterone restoration of copulatory behavior correlates with medial preoptic dopamine release in castrated male rats. Horm Behav 2001;39:216-224. [ Links ]
25. Herrera-Pérez JJ, Martínez Mota L, Fernández-Guasti A. Aging increases susceptibility to develop anhedonia in male rats. Prog Neuropsychopharmacol Biol Psychiat 2008;32:1798-1803. [ Links ]
26. Herrera-Pérez JJ, Martínez-Mota L, Chavira R, Fernández-Guasti A. Testosterone prevents but not reverse anhedonia in middle-aged males and lacks an effect on stress vulnerability in young adults. Horm Behav 2012;DOI: 10.1016/jyhbehav.2012.02.015. [ Links ]
27. Kirby LG, Lucki I. The effect of repeated exposure to forced swimming on extracellular levels of 5-hydroxytryptamine in the rat. Stress 1998;2:251-263. [ Links ]
28. Kirby LG, Show-Green JM, Davis K, Lucki I. The effect of different stressors on extracellular levels of 5-hydroxytryptamine and 5-hydroxyindoleacetic acid. Brain Res 1997;760:218-230. [ Links ]
29. Lund TD, Hinds LR, Handa RJ. The androgen 5a-dihydrotestosterone and its metabolite 5a-androstan-3β,17β-diol inhibit the hypothalamus-pituitary-adrenal response to stress by acting through estrogen receptor β-expressing neurons in the hypothalamus. J Neurosci 2006;26:1448-1456. [ Links ]
30. Viau V, Meaney MJ. The inhibitory effect of testosterone on hypothalamic-pituitary-adrenal response to stress is mediated by the medial preoptic area. J Neurosci 1996;16:1866-1876. [ Links ]
31. Shores TJ, Leuner B. Estrogen-mediated effects on depression and memory formation in females. J Affect Dis 2003;74:85-96. [ Links ]
32. Serova L, Rivkin M, Nakashima A, Sabban EL. Estradiol stimulates gene expression of norepinephrine biosynthetic enzymes in rat locus coeruleus. Neuroendocrinology 2002;75:193-200. [ Links ]
33. Maharjan S, Serova L, Sabban EL. Transcriptional regulation of tyro-sine hydroxylase by estrogen: opposite effects with estrogen receptors alpha and beta and interactions with cyclic AMP. J Neurochem 2005;93:1502-1514. [ Links ]
34. Skett P, Mod, A, Rafte, J, Sahalin L et al. The effects of gonadectomy and hypophysectomy on the metabolism of imipramine and lidocaine by the liver of male and female rats. Biochem Pharm 1980;29:2759-2762. [ Links ]
35. Shang Y, Boja JW, Dluzen DE. Castration differentially alters [3H]nisoxetine binding to norepinephrine uptake sites in olfactory bulb and frontal cortex of male rats. Synapse 1999;31:250-255. [ Links ]
36. McQueen JK, Wilson H, Sumner BE, Fink G. Serotonin transporter (SERT) mRNA and binding site densities in male rat brain affected by sex steroids. Brain Res Mol Brain 1999;63:241-247. [ Links ]
37. Kakiuchi T, Tsukada H, Fukumoto D, Nishiyama S. Effects of Aging on Serotonin Transporter Availability and its Response to Fluvoxamine in the Living Brain: PET Study with [11C](+)McN5652 and [11C](-)McN5652 in Conscious Monkeys. Synapse 2001;40:170-179. [ Links ]
38. Cervo L, Samanin R. Evidence that dopamine mechanisms in the nucleus accumbens are selectively involved in the effect of desipramine in the forced swimming test. Neuropharmacology 1987;26:1469-1472. [ Links ]
39. McQueen JK, Wilson H, Sumner BE, Fink G. Serotonin transporter (SERT) mRNA and binding site densities in male rat brain affected by sex steroids. Brain Res Mol Brain 1999;63:241-247. [ Links ]
40. Bitar MS, Ota M, Linnoila M, Shapiro BH. Modification of gonadectomy-induced increases in brain monoamine metabolism by steroid hormones in male and female rats. Psychoneuroendocrinology 1991;16:547-557. [ Links ]
41. Kendall DA, Stancel GM, Enna SJ. The influence of sex hormones on antidepressant-induced alterations in neurotransmitter receptor binding. J Neurosci 1982;2:354-360. [ Links ]
42. Martínez-Mota L, Cruz Martínez JJ, Márquez-Baltazar MS, Fernández-Guasti A. Estrogens participate in the antidepressant-like effect of desipramine and fluoxetine in male rats. Pharmacol Biochem Behav 2008;88:332-340. [ Links ]
43. Herrera-Pérez JJ, Martínez-Mota L, Fernández-Guasti A. Aging impairs the antidepressant-like response of citalopram in male rats. Eur J Pharmacol 2010;639:39-43. [ Links ]














