Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Salud mental
versión impresa ISSN 0185-3325
Salud Ment vol.35 no.4 México jul./ago. 2012
Actualización por temas
Neuromodulación e histamina: regulación de la liberación de neurotransmisores por receptores H3
Neuromodulation and histamine: regulation by H3 receptors of neurotransmitter release
Guillermo Aquino–Miranda,1,2 José–Antonio Arias–Montaño1
1 Departamento de Fisiología, Biofísica y Neurociencias, Cinvestav–IPN.
2 Centro Interdisciplinario de Ciencias de la Salud, IPN.
Correspondencia:
Dr. José–Antonio Arias–Montaño.
Departamento de Neurociencias Cinvestav.
Apartado postal 14–740, 07000, México, DF. México.
Tel. (+5255) 5747–3964. Fax: (+5255) 5747–3754.
E–mail: jaarias@fisio.cinvestav.mx
Recibido: 4 de marzo de 2012.
Aceptado: 23 de abril de 2012.
SUMMARY
Histamine regulates at the pre– and post–synaptic levels several functions of the mammalian Nervous System, in which three (H1, H2, and H3) out of the four G protein–coupled histamine receptors cloned so far are widely distributed. The histamine H3 receptor (H3R) was first identified as an auto–receptor controlling histamine synthesis and release, but several lines of evidence have shown the H3R to regulate as a hetero–receptor the release of a number of neuroactive substances, namely acetylcholine, 5–hydroxytryptamine (5–HT, serotonin), noradrenaline, dopamine, glutamate, y–aminobutyric acid (GABA) and the neuropeptides sustance P and calcitonin gene–related peptide (CGRP). H3R–mediated regulation of the release of these neurotransmitters and neuro–modulators, both in normal and pathological conditions, suggest that drugs acting at the receptor may have therapeutic use in a number of diseases such as sleep disorders, ischemia–induced cardiac arrhythmias, migraine, obesity, Alzheimer's disease and schizophrenia.
Key words: Histamine, H3 receptor, neuromodulation, hetero–receptors, synaptic transmission, signaling.
RESUMEN
La histamina regula a nivel pre y postsináptico diversas funciones del Sistema Nervioso de los mamíferos, el cual expresa de manera abundante tres (H1, H2 y H3) de los cuatro receptores a histamina acoplados a proteínas G descritos a la fecha (H1–H4). El receptor a histamina H3 (H3R) se identificó inicialmente como el autorreceptor responsable del control de la liberación y la síntesis de la histamina. Posteriormente se estableció que este receptor se encuentra también en las terminales axónicas de otras neuronas del Sistema Nervioso Central y periférico, donde regula como heterorreceptor la liberación de varios transmisores. En este trabajo se revisan los efectos de la activación del H3R en la liberación de histamina, acetilcolina, 5–hidroxitriptamina (5–HT, serotonina), noradrenalina, dopamina, glutamato, ácido y–aminobutírico (GABA) y los neuropéptidos sustancia P y el péptido relacionado al gen de la calcitonina (CGRP). La regulación por el receptor H3 de la liberación de estos neurotransmisores y neuromoduladores, tanto en condiciones normales como patológicas, sugiere que los fármacos que actúen sobre dicho receptor pueden tener uso terapéutico en alteraciones diversas como los transtornos del sueño, las arritmias cardiacas causadas por isquemia, la migraña, la obesidad, la enfermedad de Alzheimer y la esquizofrenia.
Palabras clave: Histamina, receptor H3, neuromodulación, hetero–receptores, transmisión sináptica, señalización.
INTRODUCCIÓN
La histamina modula numerosas respuestas funcionales en los mamíferos,1 y su estudio se remonta al año 1910 cuando Dale y Laidlaw2 extrajeron un compuesto del cornezuelo de centeno que inducía contracción del músculo liso intestinal y vasodilatación, acciones a las que se agregaron el inotropismo positivo, la contracción del músculo liso de las vías respiratorias y el estado de choque. Esta última observación permitió identificar a la histamina como un modulador de la respuesta alérgica inmediata. En 1924, Popielski mostró que la histamina inducía secreción ácida en el estómago del perro, y ese mismo año Lewis describió la respuesta a la histamina que lleva su nombre caracterizada por tres eventos: eritema central, edema y eritema periférico.3 En 1927, Best et al. aislaron la histamina del hígado y del pulmón, mostrando que era un constituyente natural de estos tejidos y derivando su nombre de histos, tejido.1,3
A partir de 1937 se sintetizaron fármacos que bloqueaban los efectos de la histamina en la contracción del músculo liso y en la anafilaxia, como la mepiramina y la dfenhidramina,3 y la acción sedante de estos antihistamínicos llevó a inferir que la histamina ejercía también efectos en el Sistema Nervioso Central (SNC).1,3 La generación de anticuerpos contra la histamina y la enzima responsable de su síntesis, la descarboxilasa de L–histidina, permitió determinar la presencia de neuronas histaminérgicas en el SNC y la distribución de sus axones.4,5 Estas neuronas se localizan exclusivamente en el núcleo tubero–mamilar del hipotálamo y envían sus axones al cerebro, el cerebelo y la medula espinal (figura 1), permitiendo la participación de la histamina en la regulación de diversas funciones como el ciclo vigilia–sueño, la actividad locomotora, funciones autónomas y vestibulares, la ingestión de agua y alimentos, la nocicepción, la memoria y el aprendizaje.6
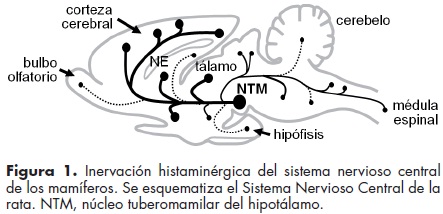
Las acciones de la histamina en el Sistema Nervioso de los mamíferos se deben principalmente a su interacción con receptores acoplados a proteínas G. A la fecha se han clonado cuatro de estos receptores y tres de ellos (H1, H2 y H3) se expresan de manera abundante en el SNC.6,7
El receptor a histamina H3 (H3R) fue identificado farmacológicamente por Arrang et al. en 1983 como un autorreceptor capaz de modular la liberación de histamina en rebanadas de la corteza cerebral de la rata.8 El SNC contiene a la gran mayoría de los H3R, pero estos receptores se encuentran también en los axones de las neuronas de los sistemas simpático y parasimpático.7,9,10 En el SNC, el H3R se expresa en alta densidad en la corteza cerebral, los ganglios basales (neoestriado, globo pálido y sustancia negra reticulada: SNr), la corteza entorrinal, el núcleo accumbens y el complejo amigdaloide.11 La comparación con la expresión del RNAm correspondiente indica que la mayoría de los H3Rs se encuentra en terminales nerviosas, pero en el neoestriado, la corteza cerebral y el hipocampo el receptor se expresa también en los cuerpos neuronales y sus dendritas (figura 2).
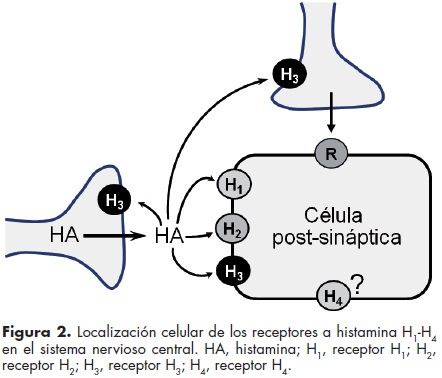
En este trabajo se revisa la participación del H3R en la regulación de la transmisión sináptica química mediante la modulación a nivel presináptico de la liberación de neurotransmisores, específicamente de la propia histamina, la acetilcolina, la noradrenalina, la 5–hidroxitriptamina (5–HT, serotonina), la dopamina, el glutamato, el ácido y–aminobutírico (GABA) y los neuropéptidos sustancia P y el péptido relacionado con el gen de la calcitonina (cuadro 1).
CARACTERÍSTICAS GENERALES DEL H3R
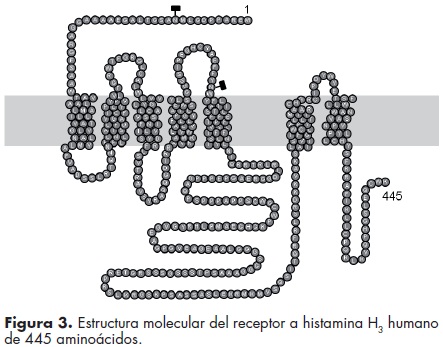
El cDNA del H3R humano fue clonado en 1999, cuando se mostró que codificaba una proteína de 445 aminoácidos (figura 3).12 El gen se encuentra en el cromosoma 20 en la posición 20q13.33 y se ha sugerido que la región codificadora consiste de tres exones y dos intrones.13 En el cerebro de los roedores y el humano el procesamiento alternativo en los sitios de unión exónintrón genera al menos 20 isoformas del H3R, si bien algunas de estas isoformas carecen de las regiones necesarias para la unión del agonista y la activación del receptor.13,14
Señalización intracelular
La activación del H3R desencadena diversas vías de señalización intracelular que se ilustran en la figura 4.

Inhibición de la formación de AMPc. Mediante su acoplamiento a proteínas Gαi/o los E3Rs inhiben la actividad de las adenilil ciclasas, efecto sensible a la acción de la toxina de Bordetella pertussis (PTX), con la consecuente inhibición de la formación de AMPc y por tanto de la actividad de la cinasa A de proteínas (PKA).13
Modulación de canales de Ca2+ activados por voltaje. La activación de los H3Rs reduce la entrada de Ca2+ inducida por despolarización,15–17 efecto que muy probablemente involucra una acción directa de los dímeros Gβγ de las proteínas Gαi/o, en los canales de Ca2+ activados por voltaje tipos N y P/ Q.18
Activación de cinasas de proteína activadas por mitógenos (MAPKs, mitogen–activated protein kinases). Los dímeros Gβγ liberados por la activación de las proteínas Gαi/o estimulan a las MAPKs,19 efecto que ha sido mostrado para los H3Rs en diversas preparaciones celulares.20–22
Otras acciones. La activación del H3R inhibe la actividad del intercambiador Na+/H+ (NHX),16 estimula la actividad de la cinasa Akt20–22 y activa canales de K+ rectificadores entrantes modulados por proteínas G (GIRKs).23
Actividad constitutiva
Tanto los H3Rs expresados en líneas celulares como los receptores nativos muestran actividad espontánea o constitutiva, debida a una secuencia de 12 aminoácidos localizada en el extremo carboxilo de la tercera asa intracelular.24 En el SNC la actividad constitutiva de los autorreceptores H3 ejerce un control tónico inhibitorio sobre la síntesis y la liberación de la histamina y sobre la actividad eléctrica de las neuronas histaminérgicas.6,25
Farmacología
El H3R tiene alta afinidad por la histamina [Ki (constante de inhibición) 10 nM], similar a la reportada para el receptor H4 (Ki 15 nM), pero diferente de los receptores H1 (Ki 1,260 nM) o H2 (Ki 1,995 nM).26,27 Se han sintetizado un número importante de ligandos del H3R. Los agonistas incluyen a la N–metilhistamina (NAMH), la (R)–α–metilhistamina (RAMH), el imetit, el immepip, la immetridina y el metimepip. Los antagonistas clásicos del H3R son los compuestos imidazólicos tioperamida y el clobenpropit. Otros antagonistas imidazólicos son el cipralisant y el SCH–79687. Los compuestos imidazólicos actúan sobre el citocromo P450, un efecto indeseable que ha motivado la síntesis de antagonistas no imidazólicos como el A–317920, el A–331440, el ABT–239 y el JNJ–5207852.7 La mayoría de los antagonistas del H3R son también agonistas inversos y reducen los efectos del receptor cuando éste tiene actividad constitutiva.
Existen variaciones en la afinidad por agonistas y antagonistas que sugieren diferencias interespecie del H3R, particularmente entre el humano y la rata, debidas primariamente a dos aminoácidos localizados en el tercer dominio transmembranal del receptor (alanina119 y valina122 en la rata, treonina119 y alanina122 en el humano).7,28
MODULACIÓN POR H3RS DE LA LIBERACIÓN DE NEUROTRANMISORES
Modulación de la liberación de histamina
En 1983 Arrang et al. mostraron que en rebanadas de la corteza cerebral de la rata la liberación de [3H]–histamina inducida por despolarización y dependiente de Ca2+ era inhibida por histamina exógena, un efecto mimetizado por la NAMH e inhibido por la impromidina y la burimamida, con potencias diferentes de las reportadas para el bloqueo de los receptores H2.8 Con base en lo anterior, se propuso que este efecto se debía a un nuevo subtipo de receptor al que se denominó H3. Posteriormente, se mostró que este receptor modulaba también la síntesis de la histamina.29
La autoinihibición de la liberación de [3H]–histamina inducida por alto K+ se observó también en rebanadas del neoestriado, el hipocampo, el hipotálamo y en terminales nerviosas aisladas (sinaptosomas) de la corteza cerebral de la rata.30 El efecto autorregulatorio ha sido también observado in vivo mediante estudios de microdiálisis. Así, la activación del H3R reduce la liberación de histamina en el hipotálamo31 y en la corteza cerebral de la rata,32 mientras que el antagonista tioperamida aumenta los niveles de la amina en el hipotálamo, el núcleo basalis magnocellularis y la corteza cerebral.33
Modulación de la liberación de acetilcolina (Ach)
La modulación por H3Rs de la transmisión colinérgica fue mostrada por primera vez en el Sistema Nervioso periférico, al observarse que la histamina y la NMHA inhibían la contracción del íleo del cobayo inducida por estimulación eléctrica, sin afectar la contracción inducida por ACh exógena.34 En las neuronas submucosas intestinales, los potenciales postsinápticos excitadores generados por estimulación eléctrica de las fibras inter–ganglionares fueron abolidos por la histamina y la NMHA,35 y en la preparación de músculo liso longitudinal/plexo mientérico la liberación de [3H]–ACh inducida por estimulación eléctrica es inhibida por la histamina y la RAMH, donde el efecto de la primera es bloqueado por la tioperamida.9
En el SNC, experimentos in vitro mostraron que la activación del H3R inhibía la liberación de [3H]–ACh inducida por K+ en rebanadas de la corteza entorrinal de la rata.36 Sin embargo, en sinaptosomas de la misma región36 y en rebanadas del hipocampo,37 la liberación de [3H]–ACh no fue afectada por la activación del H3R, cuestionando la presencia del receptor en las terminales nerviosas colinérgicas.
Estudios in vivo con microdiálisis han mostrado que la activación del H3R inhibe la liberación de ACh en la corteza fronto–parietal,38 el hipocampo,39 el núcleo accumbens o estriado ventral40 y la amígdala basolateral41 de la rata. A semejanza de los estudios en rebanadas y sinaptosomas, los estudios in vivo indican que, más que una acción directa sobre receptores localizados en las terminales colinérgicas, la modulación por H3Rs de la liberación de ACh en el SNC involucra efectos trans–sinápticos.38 Por ejemplo, en el núcleo accumbens tanto la histamina como los agonistas y antagonistas del H3R aumentan la liberación de ACh,40 sugiriendo la presencia de H3Rs que inhiben la liberación de GABA42 o de dopamina43 (ver abajo), lo que resultaría en un aumento en la liberación de ACh.
Modulación de la liberación de noradrenalina
Existen evidencias de la regulación por H3Rs de la liberación de noradrenalina tanto en el SNC como en el Sistema Nervioso periférico.
Se han identificado H3Rs funcionales en las terminales adrenérgicas de la arteria mesentérica44 y del corazón del cobayo,45 del perro46 y del humano,47 cuya activación reduce la liberación de noradrenalina. Este efecto es sensible a la toxina de B. Pertussis, indicando la acción de proteínas Gαi/o que inhiben canales de Ca2+ tipo N y la vía AMPc/PKA.10,48 En terminales simpáticas cardiacas, la estimulación del H3R conduce a la transactivación de receptores a prostanoides, que contribuyen a la inhibición de la liberación del neurotransmisor.21
La activación del H3R inhibe también la liberación de noradrenalina en modelos animales de isquemia cardiaca aguda y prolongada. En la isquemia prolongada la liberación es independiente de Ca2+ y se debe a la inversión de la dirección del transportador de noradrenalina (NET).49,50 En esta condición, el efecto de los H3Rs probablemente involucra acciones sobre el intercambiador Na+/H+51,52 y canales de Na+ activados por voltaje.53
En el SNC, la activación del H3R disminuye la liberación de [3H]–noradrenalina inducida por estimulación eléctrica o química en la corteza cerebral,54,55 la médula espinal,56 el cerebelo, el hipocampo, el hipotálamo57 y el bulbo olfatorio58 de los roedores, y la corteza cerebral del humano,59 mediante proteínas Gαi/o que reducen la disponibilidad de Ca2+ en las terminales nerviosas.60 La inhibición por los H3Rs de la liberación de noradrenalina ha sido también observada in vivo en el hipocampo y en la corteza cerebral de la rata.61,62
Modulación de la liberación de 5–hidroxitriptamina (5–HT)
La información disponible se refiere sólo a estudios in vitro. En rebanadas y sinaptosomas de la corteza cerebral de la rata la activación del H3R inhibe la liberación de [3H]–5–HT evocada por estimulación eléctrica o química, sensible a la tetrodotoxina y dependiente de Ca2+.63,64 En rebanadas cerebrales y utilizando voltametría cíclica rápida, se mostró que la activación de H3Rs inhibe la liberación de 5–HT inducida por estimulación eléctrica en la SNr de la rata. Este efecto no fue modificado por antagonistas de los receptores a GABA o glutamato, lo que indica una acción directa en las terminales serotoninérgicas.65 En contraste, en rebanadas del bulbo olfatorio de la rata, la activación del H3R no modificó la liberación de [3H]–5–HT inducida por alto K+.58
Las células enterocromafines del sistema digestivo producen y almacenan grandes cantidades de 5–HT y en estas células la activación de H3Rs inhibe también la liberación de 5–HT.66,67
Modulación de la liberación de dopamina
En rebanadas del neoestriado del ratón y de la SNr de la rata la liberación de [3H]–dopamina inducida por estimulación eléctrica o química es inhibida por la activación de H3Rs,42,43 lo que sugiere la presencia del receptor en las terminales y dendritas de las neuronas dopaminérgicas nigro–estriatales. Sin embargo, la activación del H3R no modificó la liberación de [3H]–dopamina evocada por despolarización en rebanadas o sinaptosomas del neoestriado de la rata y del conejo (referencias43,68 y resultados no publicados de nuestro laboratorio), lo que indica diferencias entre especies y regiones cerebrales.
Estudios de microdiálisis in vivo han mostrado que la administración de antagonistas del H3R aumenta los niveles extracelulares de dopamina en la corteza prefrontal, pero no en el neoestriado de la rata.62,69,70 En el núcleo accumbens, la administración sistémica o local de antagonistas del H3R aumenta la liberación de dopamina inducida por metaanfetamina. Sin embargo, el efecto de la perfusión local de los antagonistas fue menor al originado por la administración sistémica,71 lo que cuestiona la presencia de H3Rs en las terminales de las neuronas del área tegmental ventral, principal fuente de inervación dopaminérgica al núcleo accumbens.72
Modulación de la liberación de glutamato
Por medio de técnicas electrofisiológicas, Brown y Reymann mostraron que la activación de H3Rs presinápticos inhibe la transmisión glutamatérgica del giro dentado del hipocampo de la rata al reducir la entrada de Ca2+ a las terminales nerviosas.73,74 Estudios electrofisiológicos y bioquímicos indican que el H3R inhibe también la transmisión glutamatérgica en el neoestriado,75 la amígdala basolateral,76 el tálamo77 y el globo pálido de la rata,78 y en sinaptosomas del neoestriado y del tálamo de esta especie la activación del H3R reduce la liberación de glutamato y el aumento en la concentración de Ca2+ inducidos por despolarización.17,77
Modulación de la liberación de GABA
En rebanadas de la SNr y del neoestriado de la rata, la liberación de [3H]–GABA inducida por K+ es potenciada por la activación de receptores presinápticos a dopamina de la familia D1, y este efecto es inhibido de manera selectiva por H3Rs que actúan sobre canales de Ca2+ tipo P/Q.42,79,80
El efecto inhibidor de los H3Rs en la liberación de GABA ha sido observado in vivo en el núcleo vestibular medial de la rata,81 así como en neuronas corticales de la rata en cultivo primario82 y neuronas disociadas del núcleo ventromedial del hipotálamo de la rata.83 En contraste, la activación de los H3Rs no tiene efecto sobre la liberación de [3H]–GABA evocada por K+ en rebanadas y sinaptosomas del tálamo, el globo pálido y el bulbo olfatorio de la rata,58,77,78 lo que indica que no todas las neuronas GABAérgicas expresan H3Rs presinápticos.
Modulación de la liberación de neuropéptidos
Los experimentos de Ichinose et al.84 y de Taylor et al.85 indicaron que en el músculo liso bronquial e intestinal la histamina inhibía la constricción no adrenérgica/no colinérgica y que este efecto podía estar mediado por H3Rs que redujeran la liberación de neuropéptidos, en particular de la sustancia P, en las terminales nerviosas sensoriales. En acuerdo con lo anterior, la activación de los H3Rs reduce la liberación de la sustancia P inducida con estimulación eléctrica antidrómica del nervio ciático en la almohadilla de la pata trasera de la rata86 o por capsaicina en el pulmón del conejo.87
En la arteria mesentérica de la rata, la activación del H3R inhibe la respuesta vasodilatadora inducida por estimulación eléctrica de los nervios pariarteriales sin modificar la respuesta a la administración del péptido relacionado con el gen de la calcitonina (CGRP, calcitonin gene–related peptide),88 lo que sugiere que H3Rs presinápticos localizados en las terminaciones nerviosas periarteriales controlan la liberación de este péptido.
CONCLUSIONES
Existe cada vez más evidencia de la participación de la histamina en la modulación de la función del Sistema Nervioso mediante la activación de H3Rs que controlan la liberación de varios neurotransmisores tanto en condiciones normales como patológicas. Ello ha conducido al diseño y evaluación de fármacos que actúan en el receptor y diversas compañías farmacéuticas se encuentran activas en este campo. Los agonistas del H3R pueden tener uso terapéutico en alteraciones del sueño, alivio del dolor, prevención y tratamiento de arritmias cardiacas causadas por isquemia y en los procesos inflamatorios neurogénicos involucrados en la migraña, mientras que los antagonistas pueden ser útiles en el tratamiento de la obesidad, del sueño y de alteraciones cognitivas.7,89–91 En particular, el uso potencial en los transtornos cognitivos se basa en la capacidad de los antagonistas de los H3Rs de aumentar la liberación de histamina, acetilcolina, noradrenalina y dopamina, lo que tendría relevancia para el tratamiento del déficit de atención/hiperactividad, la enfermedad de Alzheimer92 y la esquizofrenia. En conjunto, lo anterior sustenta la pertinencia de estudios adicionales que amplíen nuestra comprensión de la función del H3R.
AGRADECIMIENTOS
El trabajo de investigación de los autores es apoyado por el Cinvestav y el Consejo Nacional de Ciencia y Tecnología (Conacyt, donativos). G. Aquino–Miranda es becario de investigación del Conacyt.
REFERENCIAS
1. Haas HL, Sergeeva OA, Selbach O. Histamine in the nervous system. Physiol Rev 2008;88:1183–241. [ Links ]
2. Dale HH, Laidlaw PP. The physiological action of β–iminazolylethylamine. J Physiol 1910;41:318–344. [ Links ]
3. Parsons ME, Ganellin CR. Histamine and its receptors. Br J Pharmacol 2006;147(Supl 1):S127–S135. [ Links ]
4. Panula P, Yang HY, Costa E. Histamine–containing neurons in the rat hypothalamus. Proc Natl Acad Sci USA 1984;81:2572–2576. [ Links ]
5. Watanabe T, Taguchi Y, Shiosaka S, Tanaka J et al. Distribution of the histaminergic neuron system in the central nervous system of rats; a fluorescent immunohistochemical analysis with histidine decarboxylase as a marker. Brain Res 1984;295:13–25. [ Links ]
6. Haas H, Panula P. The role of histamine and the tuberomamillary nucleus in the nervous system. Nat Rev Neurosci 2003;4:121–130. [ Links ]
7. Leurs R, Bakker RA, Timmerman H, de Esch IJ. The histamine H3 receptor: from gene cloning to H3 receptor drugs. Nat Rev Drug Discov 2005;4:107–120. [ Links ]
8. Arrang JM, Garbarg M, Schwartz JC. Auto–inhibition of brain histamine release mediated by a novel class (H3) of histamine receptor. Nature 1983;302:832–837. [ Links ]
9. Poli E, Coruzzi G, Bertaccini G. Histamine H3 receptors regulate acetylcholine release from the guinea pig ileum myenteric plexus. Life Sci 1991;48:PL63–PL68. [ Links ]
10. Silver RB, Poonwasi KS, Seyedi N, Wilson SJ et al. Decreased intracellular calcium mediates the histamine H3–receptor–induced attenuation of norepinephrine exocytosis from cardiac sympathetic nerve endings. Proc Natl Acad Sci USA 2002;99:501–506. [ Links ]
11. Pillot C, Heron A, Cochois V, Tardivel–Lacombe J et al. A detailed mapping of the histamine H3 receptor and its gene transcripts in rat brain. Neuroscience 2002;114:173–193. [ Links ]
12. Lovenberg TW, Roland BL, Wilson SJ, Jiang X et al. Cloning and functional expression of the human histamine H3 receptor. Mol Pharmacol 1999;55:1101–1107. [ Links ]
13. Bongers G, Bakker RA, Leurs R. Molecular aspects of the histamine H3 receptor. Biochem Pharmacol 2007;73:1195–1204. [ Links ]
14. Bakker RA. Histamine H3–receptor isoforms. Inflamm Res 2004;53:509–516. [ Links ]
15. Takeshita Y, Watanabe T, Sakata T, Munakata M et al. Histamine modulates high–voltage–activated calcium channels in neurons dissociated from the rat tuberomammillary nucleus. Neuroscience 1998;87:797–805. [ Links ]
16. Silver RB, Mackins CJ, Smith NC, Koritchneva IL et al. Coupling of histamine H3 receptors to neuronal Na+/H+ exchange: a novel protective mechanism in myocardial ischemia. Proc Natl Acad Sci USA 2001;98:2855–2859. [ Links ]
17. Molina–Hernandez A, Nunez A, Sierra JJ, Arias–Montano JA. Histamine H3 receptor activation inhibits glutamate release from rat striatal synaptosomes. Neuropharmacology 2001;41:928–934. [ Links ]
18. Tedford HW, Zamponi GW. Direct G protein modulation of Cav2 calcium channels. Pharmacol Rev 2006;58:837–862. [ Links ]
19. Marinissen MJ, Gutkind JS. G–protein–coupled receptors and signaling networks: emerging paradigms. Trends Pharmacol Sci 2001;22:368–376. [ Links ]
20. Bongers G, Sallmen T, Passani MB, Mariottini C et al. The AktfGSK–3beta axis as a new signaling pathway of the histamine H3 receptor. J Neurochem 2007;103:248–258. [ Links ]
21. Levi R, Seyedi N, Schaefer U, Estephan R et al. Histamine H3–receptor signaling in cardiac sympathetic nerves: Identification of a novel MAPK–PLA2–COX–PGE2–EP3R pathway. Biochem Pharmacol 2007;73:1146–1156. [ Links ]
22. Mariottini C, Scartabelli T, Bongers G, Arrigucci S et al. Activation of the histaminergic H3 receptor induces phosphorylation of the Akl/ GSK–3β pathway in cultured cortical neurons and protects against neurotoxic insults. J Neurochem 2009;110:1469–1478. [ Links ]
23. Sahlholm K, Nilsson J, Marcellino D, Fuxe K et al. The human histamine H3 receptor couples to GIRK channels in Xenopus oocytes. Eur J Pharmacol 2007;567:206–210. [ Links ]
24. Arrang JM, Morisset S, Gbahou F. Constitutive activity of the histamine H3 receptor. Trends Pharmacol Sci 2007;28:350–357. [ Links ]
25. Morisset S, Rouleau A, Ligneau X, Gbahou F et al. High constitutive activity of native H3 receptors regulates histamine neurons in brain. Nature 2000;408:860–864. [ Links ]
26. Leurs R, Smit MJ, Menge WM, Timmerman H. Pharmacological characterization of the human histamine H2 receptor stably expressed in Chinese hamster ovary cells. Br J Pharmacol 1994;112:847–854. [ Links ]
27. Gillard M, Van Der Perren C, Moguilevsky N, Massingham R et al. Binding characteristics of cetirizine and levocetirizine to human H(1) histamine receptors: contribution of Lys191 and Thr194. Mol Pharmacol 2002;61:391–399. [ Links ]
28. Sander K, Kottke T, Stark H. Histamine H3 receptor antagonists go to clinics. Biol Pharm Bull 2008;31:2163–2181. [ Links ]
29. Arrang JM, Garbarg M, Schwartz JC. Autoinhibition of histamine synthesis mediated by presynaptic H3–receptors. Neuroscience 1987;23:149–157. [ Links ]
30. Arrang JM, Garbarg M, Schwartz JC. Autoregulation of histamine release in brain by presynaptic H3–receptors. Neuroscience 1985;15:553–562. [ Links ]
31. Jansen FP, Mochizuki T, Yamamoto Y, Timmerman H et al. In vivo modulation of rat hypothalamic histamine release by the histamine H3 receptor ligands, immepip and clobenpropit. Effects of intrahypothalamic and peripheral application. Eur J Pharmacol 1998;362:149–155. [ Links ]
32. Lamberty Y, Margineanu DG, Dassesse D, Klitgaard H. H3 agonist immepip markedly reduces cortical histamine release, but only weakly promotes sleep in the rat. Pharmacol Res 2003;48:193–198. [ Links ]
33. Giannoni P, Passani MB, Nosi D, Chazot PL et al. Heterogeneity of histaminergic neurons in the tuberomammillary nucleus of the rat. Eur J Neurosci 2009;29:2363–2374. [ Links ]
34. Trzeciakowski JP. Inhibition of guinea pig ileum contractions mediated by a class of histamine receptor resembling the H3 subtype. J Pharmacol Exp Ther 1987;243:874–880. [ Links ]
35. Frieling T, Cooke HJ, Wood JD. Histamine receptors on submucous neurons in guinea pig colon. Am J Physiol 1993;264:G74–G80. [ Links ]
36. Arrang JM, Drutel G, Schwartz JC. Characterization of histamine H3 receptors regulating acetylcholine release in rat entorhinal cortex. Br J Pharmacol 1995;114:1518–1522. [ Links ]
37. Alves–Rodrigues A, Timmerman H, Willems E, Lemstra S et al. Pharmacological characterisation of the histamine H3 receptor in the rat hippocampus. Brain Res 1998;788:179–186. [ Links ]
38. Blandina P, Giorgetti M, Cecchi M, Leurs R et al. Histamine H3 receptor inhibition of K+–evoked release of acetylcholine from rat cortex in vivo. Inflamm Res 1996;45(Supl 1):S54–S55. [ Links ]
39. Bacciottini L, Passani MB, Giovannelli L, Cangioli I et al. Endogenous histamine in the medial septum–diagonal band complex increases the release of acetylcholine from the hippocampus: a dual–probe microdialysis study in the freely moving rat. Eur J Neurosci 2002;15:1669–1680. [ Links ]
40. Prast H, Tran MH, Fischer H, Kraus M et al. Histaminergic neurons modulate acetylcholine release in the ventral striatum: role of H3 histamine receptors. Naunyn Schmiedebergs Arch Pharmacol 1999;360:558–564. [ Links ]
41. Passani MB, Cangioli I, Baldi E, Bucherelli C et al. Histamine H3 receptor–mediated impairment of contextual fear conditioning and in–vivo inhibition of cholinergic transmission in the rat basolateral amygdala. Eur J Neurosci 2001;14:1522–1532. [ Links ]
42. Garcia M, Floran B, Arias–Montano JA, Young JM et al. Histamine H3 receptor activation selectively inhibits dopamine D1 receptor–dependent [3H]GABA release from depolarization–stimulated slices of rat substantia nigra pars reticulata. Neuroscience 1997;80:241–249. [ Links ]
43. Schlicker E, Fink K, Detzner M, Gothert M. Histamine inhibits dopamine release in the mouse striatum via presynaptic H3 receptors. J Neural Transm Gen Sect 1993;93:1–10. [ Links ]
44. Ishikawa S, Sperelakis N. A novel class (H3) of histamine receptors on perivascular nerve terminals. Nature 1987;327:158–160. [ Links ]
45. Endou M, Poli E, Levi R. Histamine H3–receptor signaling in the heart: possible involvement of Gi/Go proteins and N–type Ca++ channels. J Pharmacol Exp Ther 1994;269:221–229. [ Links ]
46. Mazenot C, Ribuot C, Durand A, Joulin Y et al. In vivo demonstration of H3–histaminergic inhibition of cardiac sympathetic stimulation by R–alpha–methyl–histamine and its prodrug BP 2.94 in the dog. Br J Pharmacol 1999;126:264–268. [ Links ]
47. Imamura M, Seyedi N, Lander HM, Levi R. Functional identification of histamine H3–receptors in the human heart. Circ Res 1995;77:206–210. [ Links ]
48. Seyedi N, Mackins CJ, Machida T, Reid AC, Silver RB et al. Histamine H3–receptor–induced attenuation of norepinephrine exocytosis: a decreased protein kinase a activity mediates a reduction in intracellular calcium. J Pharmacol Exp Ther 2005;312:272–280. [ Links ]
49. Schomig A. Catecholamines in myocardial ischemia. Systemic and cardiac release. Circulation 1990;82:II13–22. [ Links ]
50. Du XJ, Dart AM. Mechanisms of noradrenaline release in the anoxic heart of the rat. Cardiovasc Res 1993;27:2011–2015. [ Links ]
51. Imamura M, Lander HM, Levi R. Activation of histamine H3–receptors inhibits carrier–mediated norepinephrine release during protracted myocardial ischemia. Comparison with adenosine A1–receptors and α2–adrenoceptors. Circ Res 1996;78:475–481. [ Links ]
52. Leineweber K, Heusch G, Schulz R. Regulation and role of the presynaptic and myocardial Na+/H+ exchanger NHE1: effects on the sympathetic nervous system in heart failure. Cardiovasc Drug Rev 2007;25:123–131. [ Links ]
53. Hatta E, Yasuda K, Levi R. Activation of histamine H3 receptors inhibits carrier–mediated norepinephrine release in a human model of protracted myocardial ischemia. J Pharmacol Exp Ther 1997;283:494–500. [ Links ]
54. Schlicker E, Fink K, Hinterthaner M, Gothert M. Inhibition of nora–drenaline release in the rat brain cortex via presynaptic H3 receptors. Naunyn Schmiedebergs Arch Pharmacol 1989;340:633–638. [ Links ]
55. Schlicker E, Behling A, Lummen G, Gothert M. Histamine H3A receptor–mediated inhibition of noradrenaline release in the mouse brain cortex. Naunyn Schmiedebergs Arch Pharmacol 1992;345:489–493. [ Links ]
56. Celuch SM. Possible participation of histamine H3 receptors in the modulation of noradrenaline release from rat spinal cord slices. Eur J Pharmacol 1995;287:127–133. [ Links ]
57. Timm J, Marr I, Werthwein S, Elz S et al. H2 receptor–mediated facilitation and H3 receptor–mediated inhibition of noradrenaline release in the guinea–pig brain. Naunyn Schmiedebergs Arch Pharmacol 1998;357:232–239. [ Links ]
58. Aquino–Miranda G, Osorio–Espinoza A, Escamilla–Sanchez J, Gonzalez–Pantoja R et al. Histamine H3 receptors modulate depolarization–evoked [3H]–noradrenaline release from rat olfactory bulb slices. Neuropharmacology 2011. [ Links ]
59. Schlicker E, Werthwein S, Zentner J. Histamine H3 receptor–mediated inhibition of noradrenaline release in the human brain. Fundam Clin Pharmacol 1999;13:120–122. [ Links ]
60. Schlicker E, Kathmann M, Detzner M, Exner HJ et al. H3 receptor–mediated inhibition of noradrenaline release: an investigation into the involvement of Ca2+ and K+ ions, G protein and adenylate cyclase. Naunyn Schmiedebergs Arch Pharmacol 1994;350:34–41. [ Links ]
61. Di Carlo G, Ghi P, Orsetti M. Effect of R–(–)–α–methylhistamine and thioperamide on in vivo release of norepinephrine in the rat hippocampus. Prog Neuropsychopharmacol Biol Psychiatry 2000;24:275–284. [ Links ]
62. Medhurst AD, Atkins AR, Beresford IJ, Brackenborough K et al. GSK189254, a novel H3 receptor antagonist that binds to histamine H3 receptors in Alzheimer's disease brain and improves cognitive performance in preclinical models. J Pharmacol Exp Ther 2007;321:1032–1045. [ Links ]
63. Schlicker E, Betz R, Gothert M. Histamine H3 receptor–mediated inhibition of serotonin release in the rat brain cortex. Naunyn Schmiedebergs Arch Pharmacol 1988;337:588–590. [ Links ]
64. Fink K, Schlicker E, Neise A, Gothert M. Involvement of presynaptic H3 receptors in the inhibitory effect of histamine on serotonin release in the rat brain cortex. Naunyn Schmiedebergs Arch Pharmacol 1990;342:513–519. [ Links ]
65. Threlfell S, Cragg SJ, Kallo I, Turi GF et al. Histamine H3 receptors inhibit serotonin release in substantia nigra pars reticulata. J Neurosci 2004;24:8704–710. [ Links ]
66. Bertrand PP, Bertrand RL. Serotonin release and uptake in the gastrointestinal tract. Auton Neurosci 2010;153:47–57. [ Links ]
67. Racke K, Reimann A, Schworer H, Kilbinger H. Regulation of 5–HT release from enterochromaffin cells. Behav Brain Res 1996;73:83–87. [ Links ]
68. Smits RP, Mulder AH. Inhibitory effects of histamine on the release of serotonin and noradrenaline from rat brain slices. Neurochem Int 1991;18:215–220. [ Links ]
69. Fox GB, Esbenshade TA, Pan JB, Radek RJ et al. Pharmacological properties of ABT–239 [4–(2–{2–[(2R)–2–Methylpyrrolidinyl]ethyl}–benzofuran–5–yl)benzonitrile]: II. Neurophysiological characterization and broad preclinical efficacy in cognition and schizophrenia of a potent and selective histamine H3 receptor antagonist. J Pharmacol Exp Ther 2005;313:176–190. [ Links ]
70. Ligneau X, Perrin D, Landais L, Camelin JC et al. BF2.649 [1–{3–[3–(4–Chlorophenyl)propoxy]propyl}piperidine, hydrochloride], a nonimidazole inverse agonisl/antagonist at the human histamine H3 receptor: Preclinical pharmacology. J Pharmacol Exp Ther 2007;320:365–375. [ Links ]
71. Munzar P, Tanda G, Justinova Z, Goldberg SR. Histamine H3 receptor antagonists potentiate methamphetamine self–administration and methamphetamine–induced accumbal dopamine release. Neuropsychopharmacology 2004;29:705–717. [ Links ]
72. Wise RA. Dopamine, learning and motivation. Nat Rev Neurosci 2004;5:483–494. [ Links ]
73. Brown RE, Reymann KG. Histamine H3 receptor–mediated depression of synaptic transmission in the dentate gyrus of the rat in vitro. J Physiol 1996;496:175–184. [ Links ]
74. Brown RE, Haas HL. On the mechanism of histaminergic inhibition of glutamate release in the rat dentate gyrus. J Physiol 1999;515:777–786. [ Links ]
75. Doreulee N, Yanovsky Y, Flagmeyer I, Stevens DR et al. Histamine H3 receptors depress synaptic transmission in the corticostriatal pathway. Neuropharmacology 2001;40:106–113. [ Links ]
76. Jiang X, Chen A, Li H. Histaminergic modulation of excitatory synaptic transmission in the rat basolateral amygdala. Neuroscience 2005;131:691–703. [ Links ]
77. Garduno–Torres B, Trevino M, Gutierrez R, Arias–Montano JA. Pre–synaptic histamine H3 receptors regulate glutamate, but not GABA release in rat thalamus. Neuropharmacology 2007;52:527–535. [ Links ]
78. Osorio–Espinoza A, Alatorre A, Ramos–Jimenez J, Garduno–Torres B et al. Pre–synaptic histamine H3 receptors modulate glutamatergic transmission in rat globus pallidus. Neuroscience 2011;176:20–31. [ Links ]
79. Arias–Montano JA, Floran B, Garcia M, Aceves J, Young JM. Histamine H3 receptor–mediated inhibition of depolarization–induced, dopamine D1 receptor–dependent release of [3H]–gamma–aminobutryic acid from rat striatal slices. Br J Pharmacol 2001;133:165–171. [ Links ]
80. Arias–Montano JA, Floran B, Floran L, Aceves J et al. Dopamine D1 receptor facilitation of depolarization–induced release of gamma–amino–butyric acid in rat striatum is mediated by the cAMP/PKA pathway and involves P/Q–type calcium channels. Synapse 2007;61:310–319. [ Links ]
81. Bergquist F, Ruthven A, Ludwig M, Dutia MB. Histaminergic and glycinergic modulation of GABA release in the vestibular nuclei of normal and labyrinthectomised rats. J Physiol 2006;577:857–868. [ Links ]
82. Dai H, Fu Q, Shen Y, Hu W et al. The histamine H3 receptor antagonist clobenpropit enhances GABA release to protect against NMDA–induced excitotoxicity through the cAMP/protein kinase A pathway in cultured cortical neurons. Eur J Pharmacol 2007;563:117–123. [ Links ]
83. Jang IS, Rhee JS, Watanabe T, Akaike N. Histaminergic modulation of GABAergic transmission in rat ventromedial hypothalamic neurones. J Physiol 2001;534:791–803. [ Links ]
84. Ichinose M, Barnes PJ. Histamine H3–receptors modulate nonadrenergic noncholinergic neural bronchoconstriction in guinea–pig in vivo. Eur J Pharmacol 1989;174:49–55. [ Links ]
85. Taylor SJ, Kilpatrick GJ. Characterization of histamine– H3 receptors controlling non–adrenergic non–cholinergic contractions of the guinea–pig isolated ileum. Br J Pharmacol 1992;105:667–674. [ Links ]
86. Ohkubo T, Shibata M, Inoue M, Kaya H et al. Regulation of substance P release mediated via prejunctional histamine H3 receptors. Eur J Pharmacol 1995;273:83–88. [ Links ]
87. Nemmar A, Delaunois A, Beckers JF, Sulon J et al. Modulatory effect of imetit, a histamine H3 receptor agonist, on C–fibers, cholinergic fibers and mast cells in rabbit lungs in vitro. Eur J Pharmacol 1999;371:23–30. [ Links ]
88. Sun P, Takatori S, Jin X, Koyama T et al. Histamine H3 receptor–mediated modulation of perivascular nerve transmission in rat mesenteric arteries. Eur J Pharmacol 2011;655:67–73. [ Links ]
89. Esbenshade TA, Browman KE, Bitner RS, Strakhova M et al. The histamine H3 receptor: an attractive target for the treatment of cognitive disorders. Br J Pharmacol 2008;154:1166–1181. [ Links ]
90. Schwartz JC. The histamine H3 receptor: from discovery to clinical trials with pitolisant. Br J Pharmacol 2011;163:713–721. [ Links ]
91. Passani MB, Blandina P. Histamine receptors in the CNS as targets for therapeutic intervention. Trends Pharmacol Sci 2011;32:242–249. [ Links ]
92. Wallace TL, Ballard TM, Pouzet B, Riedel WJ et al. Drug targets for cognitive enhancement in neuropsychiatric disorders. Pharmacol Biochem Behav 2011;99:130–145. [ Links ]














