Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Salud mental
versión impresa ISSN 0185-3325
Salud Ment vol.34 no.2 México mar./abr. 2011
Artículo original
Estudio preliminar de la expresión del mensaje genético del transportador de serotonina en células mononucleares de sangre periférica en pacientes con dependencia al alcohol con y sin depresión mayor comórbida
Preliminary study of the genetic message expression of serotonin transporter in peripheral blood mononuclear cells in patients with alcohol dependence with and without comorbid major depression
Enrique Becerril–Villanueva,1 Julia Moreno–Aguilar,2 Danelia Mendieta–Cabrera,2 Denia González–Cruz,2 Guillermina Natera–Rey,3 Lenin Pavón–Romero,1 María Eugenia Hernández–Gutiérrez1
1 Laboratorio de Psicoinmunología de la Dirección de Investigaciones en Neurociencias, Instituto Nacional de Psiquiatría Ramón de la Fuente, INPRF.
2 Dirección de Servicios Clínicos, INPRF.
3 Dirección de Investigaciones Epidemiológicas y Psicosociales, INPRF.
Correspondencia:
Dra. María Eugenia Hernández–Gutiérrez.
Laboratorio de Psicoinmunología.
Dirección de Investigaciones en Neurociencias.
Instituto Nacional de Psiquiatría Ramón de la Fuente.
Calzada México–Xochimilco 101, San Lorenzo Huipulco,
Tlalpan, 14370, México DF.
Tel: 4160 5083 Fax: 5655 9980.
E–mail: droso200@imp.edu.mx
Recibido primera revisión: 28 de julio de 2010.
Segunda versión: 27 de octubre de 2010.
Tercera versión: 21 de enero de 2011.
Aceptado: 2 de febrero de 2011.
Abstract
The 2008 National Addiction Survey demonstrated the existence of 39 million alcohol drinkers, of whom 4.2 million are excessive drinkers and 4.8 million are alcohol dependents. No reports of the comorbidity of psychiatric disorders in alcohol consumers in our country exist. Nevertheless, 40% to 50% of alcohol–dependent patients from other countries have some sort of psychiatric disorder, such as major depression.
Serotonergic function is a key mediator of mood states, impulsiveness, and addictive behavior, including alcohol consumption. Several studies have noted alterations in the serotonergic system in alcoholics (as demonstrated by an increase in the shooting frequency of raphe nuclei serotonergic neurons, an increase in serotonin levels in the accumbens nuclei, and a loss in serotonergic neurons in the raphe nuclei) and depressed patients (decreases in the density of serotonin reuptake transporter [5–HTT] and serotonin levels [5–HT]).
Clinical studies have documented that excessive alcohol intake reduces 5–HT levels and that this condition potentiates psychiatric disorders, such as anxiety, major depression, and alcohol dependence. These data demonstrate an association between alcoholism, psychiatric disorders, and alcohol dependence.
By molecular biology techniques, genetic risk factors have been identified and candidate genes, such as 5–HTT, have been selected. This gene is associated with a greater susceptibility to onset of alcohol–dependence and major depression.
The 5–HTT gene lies in the SLC6A4 locus of 1 7q1 1.1–q12 and encodes a 600–amino–acid integral membrane protein. This transporter regulates serotonergic neurotransmission through removal of 5–HT from the synaptic space. Pharmacological research has shown that selective reuptake inhibitors (5–HTT blockers) reduce alcohol intake in alcohol–dependent and major depression patients.
Serotonergic system receptors, such as 5–HTT, 5–HT1, and 5–HT2, are expressed in nervous system and immune system cells; thus it is likely that both systems have functional similarities. Due to this property, peripheral blood mononuclear cells (PBMCs) can be used to research neurodegenerative, psychiatric, and alcohol dependence disorders.
The aim of this study was to assess 5–HTT expression levels in the PBMCs from alcohol–dependent patients and patients with comorbid alcohol–dependence and major depression disorder.
Materials and methods
The Outpatient Consultative Service from the Centro de Ayuda a Alcohólicos y Familiares (CAAF) and the Centro de Alcohólicos y Drogadictos <<Carrasco>> screened 70 patients from February to November 2008. Twenty patients who met the criteria of alcohol dependence, according to the Spanish version of the Mini International Neuropsychiatric Interview (MINI), were accepted. Alcohol dependence was based on the Alcohol Dependence Scale (EDA) that was adapted to the Mexican population.
Healthy volunteers (n = 12) were selected concurrently from the general population of Mexico City with the start of patient enrollment. A psychiatrist evaluated the mental health of these patients using MINI. Clinical and laboratory trials demonstrated normal standard reference values.
Patients were included based on INPRFNC092318.1 research protocol procedures, which were approved by the Ethics Committee of the Instituto Nacional de Psiquiatría Ramón de la Fuente.
All participants were given a detailed explanation concerning the study objectives and gave their signed informed consent.
The patients for this study were men and women, aged 18 years and older who presented a diagnosis of alcohol dependence. Patients were grouped as follows: Group A: diagnosed alcohol dependence (n=12) and Group B: diagnosed alcohol dependence depressed patients (n=12).
All patients arrived to the clinical laboratory from 8:00 to 9:00 a.m. to undergo a peripheral blood test. Blood was drawn by venous puncture and placed into anticoagulant–coated tubes. The blood was then diluted in an isotonic saline solution (SSI) (1:1, v/v) and transferred to a tube that contained Ficoll–Histopaque solution (1:2, v/v) to form a density gradient. The sample was centrifuged at 1600 rpm for 30 minutes at 4°C. The gradient interphase, which contained the mononuclear cells, was collected, SSI cells were washed, and Trizol was added.
RNA isolation and RT–PCR
RNA extraction from the PBMCs was performed using Trizol, wherein a monophase phenol solution and guanidine isothiocyanate were used to lyse cells and dividing the sample into 2 phases: aqueous and organic. The aqueous phase was separated with chloroform, and RNA was precipitated with isopropanol. Genetic material was washed with alcohol and allowed to dry. RNA was resuspended with RNase– and DNase–free water. The index of purity of the RNA samples ranged between 1.8 and 2.0.
RNA samples were treated with DNase 1 (Invitrogen Life Technologies, CA, USA) to eliminate DNA contamination. Total RNA was used for the generation of cDNA and was performed from 1 |Ig of total RNA in a reaction volume of 20 (xL containing 5X Buffer 5|lL Retro–Transcriptase (Promega, WI, USA), 15 mM MgCl2, 1.25 ul 10 mM dNTP mix (Promega, WI, USA), 200 U M–MLV reverse transcriptase (Promega, WI, USA) and 1 |xL of 10 mM OligodT (GE, UK). The reaction mixture was incubated for 60 minutes at 42°C in a thermocycler (Thermocycler Gradient, Eppendorf, Germany) and applied a final cycle of 90°C for 5 minutes.
The reverse–transcribed product (cDNA) was amplified by PCR in a final reaction volume of 25 |xL containing 2 |xL of cDNA, 1 mM deoxyribonucleotide dNTP Mix (Promega, WI, USA), 0.75 mM MgCl2, 2.5 mM oligonucleotide GoTaq and 1.25 units DNA polymerase (Promega, WI, USA). PCR was performed for 25 cycles, using a cycling program of 94°C for 1 minute, 60°C for 1 minute and 72°C for 1.30 minutes in a thermocycler for the amplification of 5–HTT and GAPDH. The oligo–nucleotides used for 5–HTT were: sense 5'–GAACTCCTGGAACAC TGGCAAC–3' and antisense 5'–ATGACAAATCCCGAAACGAAGC–3' (534 base pairs, [bp] product). In the case of GAPDH sequences of oligonucleotides used were: sense 5'–TGGGGAAGGTGAAGGTC GGAGTC–3' and antisense 5'–GACTTCAACAGCGACACCCACTC–3' (874 bp product). The amplicons were separated on an agarose gel and stained with ethidium bromide. The bands were analyzed by computerized densitometry. The optical density values for 5–HTT were calculated as the quotient between the values for 5–HTT and GADPH, expressed as the mean ± standard deviation.
Statistic analysis was performed using the Shapiro–Wilk homogeneity test and nonparametric Mann–Whitney test. Differences were considered statistically significant when ≤ p 0.05
Results
5–HTT levels were nondetectable (ND) in patient with comorbid alcohol–dependence and major depressive disorder. By Shapiro Wilk test, healthy volunteers and alcohol–dependent patients did not differ. Healthy volunteers expressed higher levels of 5–HTT gene (0.5012 ± 0.1349) compared with alcohol–dependent patients (0.3150 ± 0.1836) (p < 0.0036, Mann–Whitney).
Discussion
Our PCR method allowed us to determine that 5–HTT expression is lower in the two groups of patients compared with healthy volunteers. These results are consistent with studies that have reported that 5–HTT expression declines in lymphocytes from major depression disorder patients compared with healthy volunteers. The lack of detection of 5–HTT in alcohol– dependence depressed patients suggests that this comorbidity leads to alterations in the expression of this 5–HTT.
Finally, our work is the first preliminary study that characterizes 5–HTT expression in the Mexican population, comparing alcohol dependence patients and patients with comorbid alcohol–dependence and major depression.
Key words: Alcohol–dependent, major depressive disorder, 5–TT, PBMC, RT–PCR.
Resumen
La Encuesta Nacional de Adicciones 2008 reportó que en México existen 39 millones de personas que consumen alcohol y 4.8 millones presentan dependencia. A nivel mundial varios estudios indican que los pacientes con dependencia al alcohol (40 a 50%) presentan comorbilidad con algún tipo de padecimiento psiquiátrico.
La función serotoninérgica es un mediador clave en los estados de ánimo, la impulsividad y las conductas adictivas, entre ellas el consumo de alcohol. Se ha reportado que el consumo excesivo de alcohol etílico disminuye los niveles de serotonina, aumenta la frecuencia de disparo de las neuronas serotoninérgicas en el núcleo del rafé y aumenta los niveles de serotonina en el núcleo accumbens.
Las técnicas de biología molecular han permitido identificar factores de riesgo genético y se han seleccionado genes candidatos del sistema serotoninérgico, siendo uno de ellos el gen para el transportador de serotonina (5–HTT), el cual se ha demostrado que se encuentra asociado tanto a una mayor susceptibilidad para el establecimiento de la dependencia al alcohol como a la depresión mayor.
Los receptores del sistema serotoninérgico como el 5–HTT, el 5–HT1 y el 5–HT2 se expresan tanto en las células del Sistema Nervioso como en las células del sistema inmunológico, lo que sugiere una similitud funcional de ambos sistemas. Es por ello que las células mononucleares de sangre periférica (PBMC) han sido utilizadas como un modelo de estudio en los trastornos de dependencia al alcohol y en los psiquiátricos.
El objetivo de este estudio fue evaluar los niveles de expresión del gen 5–HTT en células mononucleares de sangre periférica de pacientes con dependencia al alcohol con y sin depresión mayor comórbida.
En el Servicio de Consulta Externa del Centro de Ayuda a Alcohólicos y Familiares (CAAF) y en el Centro de Alcohólicos y Drogadictos <<Carrasco>> se evaluaron 70 pacientes durante el periodo comprendido entre febrero y noviembre de 2008. De entre éstos se incluyeron 24 que cumplieron con los criterios diagnósticos para la dependencia al alcohol de acuerdo al DSM–IV por medio de la entrevista estructurada Mini International Neuropsychiatric Interview (MINI) en su versión en español. Cumplieron además con los siguientes criterios de inclusión: a) Que fueran pacientes de nuevo ingreso, b) Mayores de 18 años, c) De sexo femenino o masculino, d) Libres de tratamiento farmacológico tres semanas antes de incluirlos al estudio y e) Firmar carta de consentimiento informado para participar en el estudio.
Se incluyeron para comparación voluntarios sanos (n = 12) los cuales fueron seleccionados de la población abierta de la Ciudad de México en el periodo de febrero a noviembre de 2008 y que cumplieran con los siguientes criterios: a) No tener algún diagnóstico psiquiátrico, para lo cual se aplicó el MINI, b) Mayores de 1 8 años, c) Sexo femenino o masculino, d) Libres de tratamiento farmacológico tres semanas antes de incluirlos en el estudio y e) Firmar carta de consentimiento informado para participar en el estudio.
Todos los participantes asistieron de 8:00 hs. a 9:00 hs. al laboratorio clínico del Instituto Nacional de Psiquiatría Ramón de la Fuente para la obtención de la muestra de sangre periférica de la cual se obtuvieron las PBMC. Se realizó la extracción del material genético (RNA) de las muestras de PBMC con el reactivo de Trizol®.
Aislamiento del RNA y RT–PCR
Las muestras de RNA fueron tratadas con DNasa 1 (Invitrogen Life Technologies; CA, USA) para eliminar la contaminación con DNA. La síntesis de cDNA (DNA copia) fue equivalente para todos los casos y se realizó a partir de 1 |Xg de RNA total en un volumen de reacción de 20|lLque contenía 5¡lLde Buffer 5x para Retro–Transcriptasa (Promega; WI, USA), 15 mM de MgCl2, 1.25 |xl 10 mM de la mezcla dNTP (Promega; WI, USA), 200 U M–MLV transcriptasa reversa (Promega; WI, USA) y 1 |xL de 10 mM OligodT (GE, UK). La mezcla de reacción se incubó durante 60 minutos a 42°C en un termociclador (Gradient Thermocycler; Eppendorf, Germany) y se aplicó un ciclo final de 90°C por cinco minutos.
La amplificación para el 5–HTT se realizó en un volumen final de reacción de 25 (xL que contenía 2 (xL de cDNA, 1 mM de desoxiribonucleotidos Mix dNTP (Promega; WI, USA), 0.75 mM de MgCl2, 2.5 mM de oligonucleótidos y 1.25 unidades de GoTaq DNA Polimerasa (Promega; WI, USA) con una fase de desnaturalización de 94°C/1 minuto, una fase de alineación de 60°C/1 minuto y una fase de extensión de 72°C/1.30 minutos, durante 35 ciclos.
Los oligonucleótidos utilizados para el 5–HTT fueron los siguientes: sentido (5'–GAACTCCTGGAACACTGGCAAC–3') y el antisentido (5'– ATGACAAATCCCGAAACGAAGC–3') con un peso de 534 pares de bases (pb). En el caso del GAPDH las secuencias de oligonucléotidos utilizadas fueron: sentido (5'–TGGGGAAGGTGAAGG TCGGAGTC–3') y antisentido (5 '–GACTTCAACAGCGACACCCACTC–3') con un peso de 874 pb. Los productos de amplificación se separaron en geles de agarosa al 2% y se tiñeron con bromuro de etidio. El análisis se realizó por densitometría computarizada (QuantityOne, Bio–Rad 2008).
Los voluntarios sanos presentaron una mayor expresión del gen (0.5012±0.1349) comparados con los pacientes con dependencia al alcohol (0.3150±0.1836), esta diferencia fue significativa (p<0.0036, Mann–Whitney). Los niveles de expresión del gen 5–HTT para los pacientes con dependencia al alcohol con depresión mayor comórbida fueron significativamente reducidos (no detectables).
Con la técnica del PCR se determinó que la expresión del gen 5–HTT está disminuida en los dos grupos de pacientes comparados con los voluntarios sanos. Estos resultados coinciden con los estudios que han reportado que la expresión del gen 5–HTT en linfocitos de pacientes con trastorno depresivo mayor es menor comparada con los sujetos sanos. La no detección del mensaje genético del 5–HTT en los pacientes dependientes al alcohol con depresión mayor comórbida sugiere que la comorbilidad puede potenciar la reducción en la expresión del 5–HTT.
Palabras clave: Dependencia al alcohol, depresión mayor, 5–HTT, PBMC, RT–PCR.
INTRODUCCIÓN
La Organización Mundial de la Salud (OMS) define al alcoholismo con el término <<síndrome de dependencia al alcohol (SDA)>> y lo describe como un trastorno de conducta crónico, manifestado por un estado psíquico y físico que conduce compulsivamente a la ingesta excesiva de alcohol.1
El alcohol etílico es la sustancia psicoactiva de mayor consumo y su dependencia está asociada de manera directa o indirecta con las diez principales causas de mortalidad en la población general.2 La Encuesta Nacional de Adicciones 2008 reportó que en México existen 39 millones de personas que consumen alcohol, de las cuales 4.2 millones presentan abuso en su ingesta y 4.8 millones muestran dependencia.3 Actualmente, en nuestro país no existen estudios epidemiológicos sobre los individuos que consumen alcohol con trastorno psiquiátrico comórbido, sin embargo en otros países se ha reportado que un 40 a 50% de los pacientes con dependencia al alcohol presentan algún padecimiento psiquiátrico, entre ellos la depresión mayor.4
Estos datos indican una relación entre la dependencia al alcohol y los trastornos psiquiátricos, de tal manera que estos pacientes comórbidos constituyen una parte compleja de la población y representan un problema de salud prioritario. Por esto se requieren investigaciones neurobiológicas que permitan conocer los mecanismos que subyacen al establecimiento y mantenimiento de estos trastornos.
El sistema serotoninérgico del Sistema Nervioso Central (SNC) es un mediador fundamental en los estados del ánimo, la impulsividad y las conductas adictivas, incluido el consumo de alcohol. Su importancia se debe a que las vías serotoninérgicas procedentes de los núcleos del rafé se proyectan hacia la corteza, el hipocampo y las estructuras subcorticales, de tal manera que su función en el comportamiento del consumo de alcohol puede ser de manera directa, modulando los efectos de reforzamiento, o indirecta, como mediador en el control de los impulsos y del estado afectivo.5,6
Varios estudios reportan anormalidades en el sistema serotoninérgico de los pacientes con dependencia al alcohol y depresión mayor sin comorbilidad. Los pacientes dependientes al alcohol presentan un aumento en la frecuencia de disparo de las neuronas serotoninérgicas del núcleo del rafé, un aumento en los niveles de serotonina (5–HT) en el núcleo accumbens, unión del alcohol con los receptores serotoninérgicos y pérdida de neuronas serotoninérgicas en el núcleo del rafé en pacientes dependientes al alcohol con consumo crónico.6–8 Además, se ha observado que los individuos con un consumo excesivo del alcohol presentan una disminución de la 5–HT y esta condición participa en el establecimiento de trastornos psiquiátricos como la ansiedad, la depresión mayor y el desarrollo de la dependencia al alcohol.9,10 Por otra parte, en los pacientes con trastorno depresivo mayor se ha observado una disminución en la concentración de la 5–HT así como una disminución en la densidad del transportador de recaptura de la serotonina (5–HTT) en el SNC, lo que conduce a un déficit en la neurotransmisión serotoninérgica.11 Finalmente, estudios clínicos en pacientes con dependencia al alcohol con depresión mayor comórbida detectaron una disminución en los niveles del catabolito de la 5–HT (ácido 5–hidroxi–indolacético [5–HIIA]), en el líquido cefalorraquídeo, lo cual indica una disfunción serotoninérgica.12,13
El diagnóstico doble de dependencia al alcohol y trastorno depresivo mayor es una entidad con una etiología multifactorial donde convergen factores biológicos, psicosociales y ambientales.14 Con respecto a los factores biológicos, los estudios familiares utilizados para evaluar la contribución de los factores genéticos en la etiología de la dependencia al alcohol y de la depresión mayor15 han determinado un porcentaje de heredabilidad (proporción de las variaciones en el fenotipo debidas a los genes y expresada en porcentaje) para el abuso del alcohol de un 50 a 60%16,17 y para la depresión mayor de un 40%.18 Sin embargo cabe señalar que esta susceptibilidad genética requiere, para la manifestación de ambas enfermedades, de condiciones ambientales favorables y de una exposición precisa.19,20
Los estudios de genética y las técnicas de biología molecular han permitido identificar genes candidatos como factores de riesgo o susceptibilidad para desarrollar la dependencia al alcohol y la depresión mayor; uno de estos genes es el que codifica para el transportador de recaptura de la serotonina (5–HTT).
El gen del 5–HTT está ubicado en el locus SLC6A4 del cromosoma 17q11.1–q12 y su expresión da como resultado una proteína integral de membrana de 600 aminoácidos. Este transportador regula la neurotransmisión serotoninérgica a través de la remoción de la 5–HT del espacio sináptico. Estudios clínicos en pacientes con dependencia al alcohol y depresión mayor reportan una disminución en la densidad y funcionalidad en el 5–HTT.21 Por otra parte, estudios realizados en modelos animales tipo <<knockouts>> para el transportador 5–HTT revelan que la pérdida de la función del gen 5–HTT altera los efectos neurales y conductuales inducidos por el alcohol.22
La administración de inhibidores selectivos de la recaptura de serotonina (ISRS, bloqueadores del 5–HTT) a pacientes con dependencia al alcohol, de ingesta intensa, y a pacientes con dependencia al alcohol y trastorno depresivo mayor comórbido inducen una reducción en el consumo de alcohol.23–28 Estas evidencias indican que el 5–HTT presenta una reducción anormal que conlleva a un déficit en la transmisión serotoninérgica en el SNC. Sin embargo este transportador y otros receptores del sistema serotoninérgico también se expresan en varios tejidos a nivel periférico, lo que puede ser útil para el estudio de la expresión del gen 5–HTT en los pacientes con tratamiento farmacológico. Se ha demostrado que el 5–HTT tiene una secuencia de aminoácidos idéntica y una misma sensibilidad farmacológica en el tejido cerebral y en los linfocitos.5,29 Además se han reportado analogías estructurales y funcionales entre las neuronas y los linfocitos. En ambos casos, los procesos de activación, transmisión de señales y terminación de las sinapsis neuronal e inmunológica están regulados en el espacio y en el tiempo. La regulación espacial se debe a la estabilización de las moléculas implicadas en la señalización celular en localizaciones específicas (por ejemplo, los anillos concéntricos observados en la sinapsis inmune, o la espina dendrítica en la sinapsis neuronal). La concentración de estos intermediarios de la señalización y su jerarquía temporal produce un efecto amplificador de la señal.5,30,31 Además, los linfocitos expresan receptores para varios neurotransmisores considerados como pertenecientes únicamente a las neuronas, entre ellos los del sistema serotoninérgico.32 Al respecto, Faraj et al. han reportado que los linfocitos de pacientes con dependencia al alcohol recuperados y con periodos prolongados de abstinencia presentan una mayor captura de serotonina y que este evento es independiente del periodo de abstinencia, sugiriendo un rasgo hereditario más que el abuso crónico del alcohol.33 Adicionalmente, Rausch et al. determinaron una mayor captura de serotonina en sujetos con historia familiar de dependencia al alcohol (padres alcohólicos) versus sujetos sin historia familiar de dependencia al alcohol; este hallazgo podría indicar un factor biológico asociado al riesgo en el consumo de alcohol.34
Con base en las evidencias anteriores el linfocito ya se propone como un modelo periférico para el estudio del sistema serotoninérgico de varias enfermedades de tipo psiquiátrico como la depresión mayor y la dependencia al alcohol. El objetivo de nuestro estudio fue evaluar los niveles del gen 5–HTT en células mononucleares de sangre periférica, en pacientes con dependencia al alcohol con y sin depresión mayor comórbida, como una primera aproximación para la determinación de la existencia o no de una expresión anómala del 5–HTT en este tipo de pacientes en la población mexicana.
MATERIAL Y MÉTODOS
Diseño del estudio
El estudio fue un procedimiento analítico, observacional de tipo transversal.
Participantes
Pacientes
En el Servicio de Consulta Externa del Centro de Ayuda al Alcohólico y a sus Familiares (CAAF) y el Centro de Alcohólicos y Drogadictos <<Carrasco>> se evaluaron 70 pacientes durante el periodo que va de febrero a noviembre de 2008. De entre éstos se incluyeron 24 que cumplieron con los criterios diagnósticos para la dependencia al alcohol de acuerdo al DSM–IV por medio de la entrevista estructurada Mini International Neuropsychiatric Interview (MINI) en su versión en español.35
Los pacientes cumplieron con los siguientes criterios de inclusión: a) Que fueran pacientes de nuevo ingreso, b) Mayores de 18 años, c) De sexo femenino o masculino, d) Libres de tratamiento farmacológico tres semanas antes de incluirlos al estudio y e) Firmar la carta de consentimiento informado para participar en el estudio.
Los pacientes se agruparon de acuerdo a su diagnóstico en pacientes con dependencia al alcohol con depresión mayor comórbida (n=12) y sin ella (n=12).
Voluntarios sanos
Se incluyeron voluntarios sanos (n=12) los cuales fueron seleccionados de la población abierta de la Ciudad de México en el periodo comprendido entre febrero y noviembre de 2008, que cumplieran con los siguientes criterios: a) No tener algún diagnóstico psiquiátrico, basándose en la aplicación del MINI, b) Mayores de 18 años, c) Sexo femenino o masculino, d) Libres de tratamiento farmacológico tres semanas antes de incluirlos en el estudio y e) Firmar la carta de consentimiento informado para participar en el estudio.
Procedimiento
A todos los participantes, tanto pacientes como voluntarios sanos, que cumplieron con los criterios de inclusión, se les explicó la naturaleza del estudio y se les invitó a participar. Si estuvieron de acuerdo firmaron la carta de consentimiento informado. La captación de pacientes se realizó de acuerdo a los procedimientos del protocolo de investigación INPRFNC092318.1 aprobado por el Comité de ética del Instituto Nacional de Psiquiatría Ramón de la Fuente Muñiz.
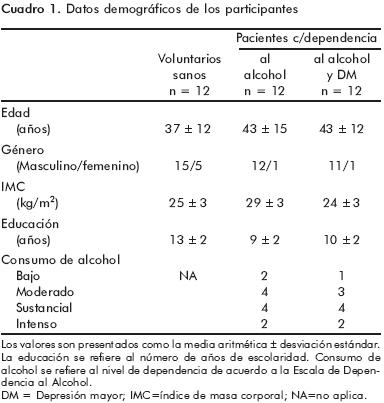
Los pacientes y los voluntarios sanos fueron evaluados con la escala MINI. Los pacientes se agruparon de acuerdo a su diagnóstico en pacientes con dependencia al alcohol con depresión mayor comórbida (n=12) y sin ella (n=12). Todos los pacientes fueron evaluados con la Escala de Dependencia al Alcohol (EDA) para medir el nivel de dependencia al alcohol (cuadro 1).36
Los participantes asistieron de 8:00 hs. a 9:00 hs. al laboratorio clínico del Instituto Nacional de Psiquiatría Ramón de la Fuente para la obtención de la muestra de sangre periférica.
Obtención de las células mononucleares de sangre periférica (PBMC)
La muestra de sangre periférica de los participantes se colectó en tubos con anticoagulante (Vacutainer–Becton & Dickinson; NJ, USA) por punción venosa en el horario de 8:00 hs. a 9:00 hs. La sangre (5mL) se diluyó con solución salina isotónica (SSI) (1:1, v/v) y se depositó en un tubo con una solución de Ficoll–Histopaque (1:2, v/v) (Sigma–Aldrich; St Louis, USA) para formar un gradiente de densidad. La muestra se centrifugó a 1600 rpm durante 30 minutos a 4°C y se aislaron las células mononucleares de la interfase del gradiente. Finalmente las PBMC se lavaron con SSI y se les adicionó el reactivo de Trizol®.
Extracción del RNA
La extracción del ácido ribonucleico (RNA, por sus siglas en inglés) total fue aislado de las PBMC de los voluntarios sanos y pacientes con el reactivo de Trizol® (Invitrogen Life Technologies; CA, USA). Se utilizó una solución monofásica de fenol e isotiocinato de guanidina para la lisis de las células y la separación de la muestra en dos fases (acuosa y orgánica). Después se adicionaron 200 |iL de cloroformo y se centrifugó 10000 rpm por 10 min a 4°C para separar la fase acuosa. La precipitación del RNA se realizó con isopropanol y el material genético se lavó con alcohol al 75%. Finalmente la muestra se dejó secar durante cinco minutos a temperatura ambiente y se resuspendió con agua libre de RNasas y DNasas (Gibco; NY, USA). La cantidad y calidad del RNA obtenido se determinó con un espectrofotómetro (BioPhotometer; Eppendorf, Germany) en un rango de 260–280 nm y se almacenó a –80°C. El índice de pureza de las muestras de RNA fue de 1.8 y 2.0.37
Obtención de la expresión del gen GADPH y 5–HTT
La enzima gliceraldehído–3–fosfato deshidrogenasa (GADPH), al ser una enzima indispensable para la respiración celular, su expresión es constitutiva y ha sido seleccionada la expresión de su gen como un control endógeno (gen constitutivo o gen de normalización) para las técnicas de biología molecular como el RT–PCR porque se ha demostrado que mantiene un nivel de expresión constante, aun en diferentes estados fisiológicos de la célula y en respuesta a los tratamientos experimentales.38,39
Amplificación mediante RT–PCR
Las muestras de RNA fueron tratadas con DNasa 1 (Invitrogen Life Technologies; CA, USA) para eliminar la contaminación con DNA (Huang Z, 1996). La síntesis de cDNA (DNA copia) fue equivalente para todos los casos y se realizó a partir de 1 |ig de RNA total en un volumen de reacción de 2O|J,L que contenía 5|J,L de Buffer 5x para Retro–Transcriptasa (Promega; WI, USA), 15 mM de MgCl2,1.25 [ú 10 mM de la mezcla dNTP (Promega; WI, USA), 200 U M–MLV transcriptasa reversa (Promega; WI, USA) y 1 |J,L de 10 mM OligodT (GE, UK). La mezcla de reacción se incubó durante 60 minutos a 42°C en un termociclador (Gradient Thermocycler; Eppendorf, Germany) y se aplicó un ciclo final de 90°C por cinco minutos.
La amplificación para el 5–HTT se realizó en un volumen final de reacción de 25 |J,L que contenía 2 |J,L de cDNA, 1 mM de desoxiribonucleótidos Mix dNTP (Promega; WI, USA), 0.75 mM de MgCl2, 2.5 mM de oligonucleótidos y 1.25 unidades de GoTaq DNA Polimerasa (Promega; WI, USA) con una fase de desnaturalización de 94°C/1 minutos, una fase de alineación de 60°C/1 minuto y una fase de extensión de 72°C/1.30 minutos, durante 35 ciclos.40
Los oligonucleótidos utilizados para el 5–HTT fueron los siguientes: sentido (5'–GAACTCCTGGAACACTGGCAAC–3') y el antisentido (5'– ATGACAAATCCCGAAACGAAGC–3') con un peso de 534 pares de bases (pb).41 En el caso del GAPDH las secuencias de oligonucléotidos utilizadas fueron: sentido (5'–TGGGGAAGGTGAAGGTCGGAGTC–3') y antisentido (5'–GACTTCAACAGCGACACCCACTC–3') con un peso de 874 pb. Los productos de amplificación se separaron en geles de agarosa al 2% y se tiñeron con bromuro de etidio. El análisis se realizó por densitometría computarizada (QuantityOne, Bio–Rad 2008).
Análisis estadístico
Los valores de expresión del gen 5–HTT fueron obtenidos con la siguiente fórmula:
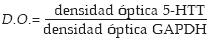
Y fueron expresados como la media aritmética. Los datos de los voluntarios sanos y los de los pacientes fueron analizados con la prueba de homogeneidad de Shapiro–Wilk. Se aplicó la prueba no paramétrica de Mann–Whitney para obtener las diferencias en la expresión del gen 5–HTT entre voluntarios sanos y pacientes. Los análisis se realizaron con el programa estadístico Graph Pad 5.0 (San Diego, CA, USA). Las diferencias fueron consideradas estadísticamente significativas cuando la probabilidad del error tipo I fue p<0.05.
RESULTADOS
Parámetros clínicos
Los voluntarios sanos presentaron valores de biometría hemática dentro de los rangos de referencia normales. Los pacientes mostraron anormalidades en sus eritrocitos (tamaño y forma) así como en el contenido de hemoglobina. Asimismo, en el grupo de dependencia al alcohol se detectaron dos pacientes, uno con consumo moderado y otro con consumo intenso asociado a plaquetopenia. En el grupo de dependencia al alcohol con depresión mayor comórbida se detectaron dos pacientes con anormalidades hematológicas, ambos con un consumo sustancial de alcohol; el primero de ellos presentó trombocitosis y el segundo anemia microcítica–hipocrómica, trombocitopenia y monocitosis.
Los pacientes con alteraciones hematológicas recibieron la recomendación de asistir a una consulta médica especializada. Estos hallazgos clínicos detectados en los eritrocitos no interfirieron con la evaluación de la expresión del mensaje genético porque a) los eritrocitos no contienen núcleo y b) sólo se utilizaron células mononucleares (PBMC).42
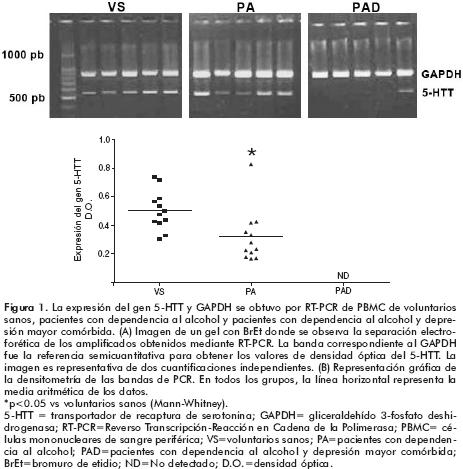
Expresión del gen 5–HTT
Los pacientes con dependencia al alcohol y depresión mayor comórbida presentaron niveles de expresión del gen 5–HTT disminuidos de manera significativa y se reportaron como No Detectado (ND). La prueba de homogeneidad de Shapiro Wilks no fue significativa para la expresión del gen 5–HTT en las poblaciones de los voluntarios sanos y los pacientes con dependencia al alcohol. Los voluntarios sanos presentaron una mayor expresión del gen 5–HTT (0.5012±0.1349) comparados con los pacientes con dependencia al alcohol (0.3150±0.1836) y esta diferencia fue significativa (p<0.0036, Mann–Whitney) (figura 1).
DISCUSIÓN
El alcohol produce alteraciones en el sistema hematopoyético e induce una agranulocitosis tóxica que conlleva a cuadros de anemia, leucopenia y trombocitopenia, disminuyendo la agregación plaquetaria.42 Las pruebas de biometría hemática de algunos pacientes mostraron índices de trombocitopenia y plaquetopenia; sin embargo estas anormalidades no afectaron la cantidad y calidad de la muestra de RNA porque la extracción se realizó a partir de las PBMC.
La técnica del RT–PCR nos permitió determinar que la expresión del gen 5–HTT está disminuida en los dos grupos de pacientes comparados con los voluntarios sanos. Los pacientes con dependencia al alcohol mostraron una disminución en los niveles de expresión del gen 5–HTT. A la fecha no existe ningún estudio con el que podamos comparar este hallazgo. Sin embargo, a partir de la hipótesis de que las neuronas comparten una gran similitud funcional con las células de la respuesta inmunológica, y que el 5–HTT tanto en cerebro como en los linfocitos presenta una secuencia de aminoácidos idéntica y una misma sensibilidad farmacológica, podríamos sugerir que los estudios mediante tomografía por emisión de fotón único (SPECT, por sus siglas en inglés) en pacientes alcohólicos que reportan una reducción significativa del 5–HTT en el tallo cerebral, comparado con sujetos sanos y nuestros resultados en linfocitos podrían ser una aproximación similar al hallazgo obtenido por el SPECT.43
Por otra parte, en los pacientes con dependencia al alcohol y depresión mayor comórbida la expresión del gen 5–HTT fue significativamente menor comparada con los otros grupos. Nuestros resultados coinciden parcialmente con los estudios que muestran una expresión disminuida del gen 5–HTT en pacientes con trastorno depresivo mayor comparados con voluntarios sanos.29,44
La coincidencia parcial de nuestros resultados en los pacientes con dependencia al alcohol se debe a que los estudios de otros grupos de investigación se han enfocado a identificar las variaciones alélicas en el polimorfismo funcional del gen 5–HTT (5–HTTTLPR).45–47 Cabe señalar que los resultados de estos reportes no son concluyentes probablemente por las características demográficas de las poblaciones de estudio (sexo, edad, grupo étnico, subtipos de dependencia al alcohol y comorbilidad con otras adicciones y enfermedades psiquiátricas).48
Una valoración indirecta de la densidad y funcionalidad del 5–HTT proviene de los estudios de captura de serotonina marcada radioactivamente. En estas cuantificaciones se establece la constante de disociación (Kd) y la velocidad máxima (Vmax) de la unión ligando–receptor (serotonina– transportador 5–HTT). En relación con este tipo de estudios, Faraj et al. reportan que los pacientes alcohólicos, recuperados y con periodos de abstinencia, presentan mayor captura de serotonina, lo cual podría sugerir un aumento en la densidad del 5–HTT.33 Por otra parte, en el estudio de Javors et al. se seleccionaron pacientes que cumplieron con el criterio de dependencia al alcohol pero realizaron una selección por subcategorías que se basó en consumidores tempranos < 25 años y consumidores tardíos > 25 años y observaron una mayor captura de serotonina ([3H]–5–HT) en los consumidores tempranos versus los consumidores tardíos, lo cual indicaría que los criterios de selección de los pacientes con dependencia al alcohol deben estar bien delimitados para interpretar correctamente los resultados.49 Dado que estos datos de captura indican una disminución del 5–HTT es posible suponer que nuestros datos del 5–HTT en los pacientes con dependencia al alcohol coinciden con lo reportado por estos autores.
CONCLUSIÓN
Los pacientes con dependencia al alcohol con y sin depresión mayor comórbida presentan una disminución en la transcripción del 5–HTT, así que la expresión mínima del mensaje genético del 5–HTT detectado en nuestros pacientes con dependencia al alcohol y depresión mayor comórbida sugiere que esta asociación puede inducir una mayor reducción en la transcripción del gen 5–HTT y dar como resultado niveles mínimos de expresión del gen 5–HTT.
Nuestro estudio se realizó con un número reducido de voluntarios sanos y pacientes, por lo que nuestros datos son preliminares y no se pueden extrapolar directamente para determinar el significado biológico del déficit en la expresión del gen 5–HTT en la patofisiología de los pacientes con dependencia al alcohol con y sin depresión mayor comórbida.
AGRADECIMIENTOS
El trabajo fue realizado con el financiamiento del ICyTDF (2007) y del INPRF proyecto NC092318.1. Agradecemos al ingeniero José Francisco Cortés Sotres, Jefe de Apoyo Académico, su asesoría para la elaboración de este manuscrito.
ABREVIATURAS
5–HT: Serotonina; 5–HT1: Receptor de Serotonina tipo 1; 5–HT2: Receptor de Serotonina tipo 2; 5–HTT: Transportador de Serotonina; 5–HIIA: ácido 5–hidroxi–indolacético; PBMC: Periferical Blood Mononuclear Cells (Células Mononucleares de Sangre Periférica); SSI: Solución Salina Isotónica; GADPH: Gliceraldheído 3–fosfato Deshidrogenasa; cDNA: DNA complementario; DNA: Ácido Desoxirribonucleico; RNA: Ácido Ribonucleico; PCR: Reacción en Cadena de la Polimerasa; RT–PCR: Retro–Transcriptasa Reacción en Cadena de la Polimerasa
REFERENCIAS
1. World Health Organization. Global Status Report on Alcohol 2004. Switzerland: Singapore Press; 2004. [ Links ]
2. Fleiz C, Borges G, Rojas E, Benjet C et al. Uso de alcohol, tabaco y drogas en población mexicana, un estudio de cohortes. Salud Mental 2007;30:63–73. [ Links ]
3. Consejo Nacional Contra las Adicciones, Instituto Nacional de Psiquiatría Ramón de la Fuente, Instituto Nacional de Salud Pública, Fundación Gonzalo del Rio Aronte IAP. Encuesta Nacional de Adicciones 2008. México; 2009. [ Links ]
4. Yaldizli O, Kuhl HC, Graf M, Wiesbeck GA et al. Risk factors for suicide attempts in patients with alcohol dependence or abuse and a history of depressive symptoms: a subgroup analysis from the WHO/ISBRA study. Drug Alcohol Rev 2010;29:64–74. [ Links ]
5. Kandel ER, Schwartz JH, Jessell TM. Principles of neural science. Cuatra edición. USA: United Satates of America Press; 2000. [ Links ]
6. Vengeliene V, Bilbao A, Molander A, Spanagel R. Neuropharmacology of alcohol addiction. Br J Pharmacol 2008; 154:299–315. [ Links ]
7. Heinz A, Goldman D, Gallinat J, Schumann G et al. Pharmacogenetic insights to monoaminergic dysfunction in alcohol dependence. Psychopharmacology (Berl) 2004;174:561–570. [ Links ]
8. Johnson BA. Role of the serotonergic system in the neurobiology of alcoholism: implications for treatment. CNS Drugs 2004;18:1105–1118. [ Links ]
9. Naranjo CA, Chu AY, Tremblay LK. Neurodevelopmental liabilities in alcohol dependence: central serotonin and dopamine dysfunction. Neurotox Res 2002;4:343–361. [ Links ]
10. Pivac N, Muck–Seler D, Mustapic M, Nenadic–Sviglin K et al. Platelet serotonin concentration in alcoholic subjects. Life Sci 2004;76:521–531. [ Links ]
11. Nemeroff CB, Owens MJ. Treatment of mood disorders. Nat Neurosci 2002;5(Suppl):1068–1070. [ Links ]
12. Roy A, Bissette G, Nemeroff CB, DeJong J et al Cerebrospinal fluid thyrotropin–releasing hormone concentrations in alcoholics and normal controls. Biol Psychiatry 1990;28:767–772. [ Links ]
13. Williams W, Reimold M, Kerich M, Hommer D et al Glucose utilization in the medial prefrontal cortex correlates with serotonin turnover rate and clinical depression in alcoholics. Psychiatry Res 2004;132:219–224. [ Links ]
14. Uher R, McGuffin P. The moderation by the serotonin transporter gene of environmental adversity in the aetiology of mental illness: review and methodological analysis. Mol Psychiatry 2008;13:131–146. [ Links ]
15. Moussas G, Christodoulou C, Douzenis A. A short review on the aetiology and pathophysiology of alcoholism. Ann Gen Psychiatry 2009;8:10. [ Links ]
16. Ehlers CL, Gizer IR, Vieten C, Gilder A et al Age at regular drinking, clinical course, and heritability of alcohol dependence in the San Francisco family study: a gender analysis. Am J Addict 2010;19:101–110. [ Links ]
17. Stacey D, Clarke TK, Schumann G. The genetics of alcoholism. Curr Psychiatry Rep 2009;11:364–369. [ Links ]
18. Wurtman RJ. Genes, stress, and depression. Metabolism 2005;54:16–19. [ Links ]
19. Kuzelova H, Ptacek R, Macek M. The serotonin transporter gene (5–HTT) variant and psychiatric disorders: review of current literature. Neuro Endocrinol Lett 2010;31:4–10. [ Links ]
20. Teicher MH, Andersen SL, Polcari A, Anderson CM et al. The neurobiological consequences of early stress and childhood maltreatment. Neurosci Biobehav Rev 2003;27:33–44. [ Links ]
21. Hariri AR, Holmes A. Genetics of emotional regulation: the role of the serotonin transporter in neural function. Trends Cogn Sci 2006;10:182–191. [ Links ]
22. Boyce–Rustay JM, Wiedholz LM, Millstein RA, Carroll J et al. Ethanolrelated behaviors in serotonin transporter knockout mice. Alcohol Clin Exp Res 2006;30:1957–1965. [ Links ]
23. Cornelius JR, Salloum IM, Ehler JG, Jarrett PJ et al. Fluoxetine in depressed alcoholics. A double–blind, placebo–controlled trial. Arch Gen Psychiatry 1997;54:700–705. [ Links ]
24. Moak DH, Anton RF, Latham PK, Voronin KE et al. Sertraline and cognitive behavioral therapy for depressed alcoholics: results of a placebo–controlled trial. J Clin Psychopharmacol 2003;23:553–562. [ Links ]
25. Naranjo CA, Sellers EM, Sullivan JT, Woodley DV et al. The serotonin uptake inhibitor citalopram attenuates ethanol intake. Clin Pharmacol Ther 1987;41:266–274. [ Links ]
26. Naranjo CA, Kadlec KE, Sanhueza P, Woodley–Remus D et al. Fluoxetine differentially alters alcohol intake and other consummatory behaviors in problem drinkers. Clin Pharmacol Ther 1990;47:490–498. [ Links ]
27. Naranjo CA, Poulos CX, Bremner KE, Lanctot KL. Citalopram decreases desirability, liking, and consumption of alcohol in alcohol–dependent drinkers. Clin Pharmacol Ther 1992;51:729–739. [ Links ]
28. Roy–Byrne PP, Pages KP, Russo JE, Jaffe C et al. Nefazodone treatment of major depression in alcohol–dependent patients: a double–blind, placebo–controlled trial. J Clin Psychopharmacol 2000;20:129–136. [ Links ]
29. Lima L, Urbina M. Serotonin transporter modulation in blood lymphocytes from patients with major depression. Cell Mol Neurobiol 2002;22:797–804. [ Links ]
30. Sheng M, Kim MJ. Postsynaptic signaling and plasticity machanisms. Science 2002;298:797–780. [ Links ]
31. Vicente–Manzanares M, Sánchez–Madrid F. Role of the cytoskeleton during leucocyte responses. Nat Rev Immuol 2004;4:110–122. [ Links ]
32. Levite M. Neurotransmitters activate T–cells and elicit crucial functions via neurotransmitter receptors. Curr Opin Pharmacol 2008;8:460–471. [ Links ]
33. Faraj BA, Olkowski ZL, Jackso RT. Prevalence of high serotonin uptakein in limphocytes of abstinent alcoholics. Biochem Pharmacol 1997;53:53–57. [ Links ]
34. Rausch JL, Monteiro MG, Schuckit MA. Platelet serotonin uptake in men with family histories of alcoholism. Neuropsychopharmacology 1991;4:83–86. [ Links ]
35. Heinze G. Mini International Neuropsychiatric Interview. Sheehan DV, Lecrubier Y (eds.). Spanish South and Central America version/DSM–IV; 2000. [ Links ]
36. Solis L, Cordero M, Cordero R, Martínez M. Caracterización del nivel de dependencia al alcohol entre habitantes de la Ciudad de México. Salud Mental 2007;30:62–68. [ Links ]
37. Rio DC, Ares M Jr, Hannon GJ, Nilsen TW. Purification of RNA using TRIzol (TRI reagent). New York: Cold Spring Harbor Laboratory Presss; 2010; p.5439. [ Links ]
38. Barber RD, Harmer DW, Coleman RA, Clark BJ. GAPDH as a housekeeping gene: analysis of GAPDH mRNA expression in a panel of 72 human tissues. Physiol Genomics 2005;21:389–395. [ Links ]
39. Stamova BS, Apperson M, Walker WL. Identification and validation of suitable endogenous reference genes for gene expression studies in human peripheral blood. BMC Med Genomics 2009;2:49. [ Links ]
40. Ross R, Kumpf K, Reske–Kunz AB. PCR–amplified cDNA probes for verification of differentially expressed genes. Biotechniques 1997;22:894–897. [ Links ]
41. Yang GB, Qiu CL, Aye P, Shao Y et al. Expression of serotonin transporters by peripheral blood mononuclear cells of rhesus monkeys (Macaca mulatta). Cell Immunol 2007;248:69–76. [ Links ]
42. Latvala J, Parkkila S, Niemela O. Excess alcohol consumption is common in patients with cytopenia: studies in blood and bone marrow cells. Alcohol Clin Exp Res 2004;28:619–624. [ Links ]
43. Heinz A, Ragan P, Jones DW, Hommer D et al Reduced central serotonin transporters in alcoholism. Am J Psychiatry 1998;155:1544–1549. [ Links ]
44. Tsao CW, Lin YS, Chen CC, Bai CH et al. Cytokines and serotonin transporter in patients with major depression. Prog Neuropsychopharmacol Biol Psychiatry 2006;30:899–905. [ Links ]
45. Greenberg BD, Tolliver TJ, Huang SJ, Li Q et al. Genetic variation in the serotonin transporter promoter region affects serotonin uptake in human blood platelets. Am J Med Genet 1999;88:83–87. [ Links ]
46. Kranzler H, Lappalainen J, Nellissery M, Gelernter J. Association study of alcoholism subtypes with a functional promoter polymorphism in the serotonin transporter protein gene. Alcohol Clin Exp Res 2002;26:1330–1335. [ Links ]
47. Lesch KP, Bengel D, Heils A, Sabol SZ et al Association of anxiety–related traits with a polymorphism in the serotonin transporter gene regulatory region. Science 1996;274:1527–1531. [ Links ]
48. Kranzler HR, Rosenthal RN. Dual diagnosis: alcoholism and co–morbid psychiatric disorders. Am J Addict 2003;12(Suppl 1):S26–S40. [ Links ]
49. Javors M, Tiouririne M, Prihoda T. Platelet serotonin uptake is higher in early–onset than in late–onset alcoholics. Alcohol Alcohol 2000;35:390–393. [ Links ]














