Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Salud mental
versión impresa ISSN 0185-3325
Salud Ment vol.32 no.6 México nov./dic. 2009
Artículo orginal
Alteraciones estructurales encefálicas en el trastorno por déficit de atención e hiperactividad: una actualización. Primera parte*
Structural brain alterations in attention–deficit/hyperactivity disorder: an update. First part
Luis Guillermo Almeida Montes,1 Josefina Ricardo–Garcell2, Hugo Prado Alcántara,1 Reyna Beatriz Martínez García1
1 Centro Estatal de Salud Mental, SESEQ. Querétaro.
2 Instituto de Neurobiología UNAM, Campus Juriquilla, Querétaro.
Correspondencia:
M. en C. Dr. Luis Guillermo Almeida Montes.
Avenida 5 de febrero 105–Sur.
Colonia Virreyes, 761 70.
Querétaro,
Querétaro. México.
Tel/Fax: (01–442) 224–2487.
E–mail: almeidal@prodigy.net.mx
Recibido: 14 de mayo de 2009.
Aceptado: 2 de Julio de 2009.
Abstract
The DSM–IV–TR (Diagnostic and Statistical Manual of Mental Disorders, fourth Edition, text Revision) defines attention–deficit/hyperactivity disorder (ADHD) as a disorder usually first diagnosed during infancy. Its essential feature is a persistent pattern of inattention and/or hyperactivity–impulsivity that is more frequent and severe than typically observed in individuals at a comparable level of development. It produces a significant impairment in social, academic, or occupational functioning.
The prevalence of ADHD among the general population is between 5–10% in children and adolescents, and 1.2% to 7.3% in adults. In clinical samples, the prevalence in adults is higher: 1 6.80%. Less than 10% of the children diagnosed with ADHD reached a total functional remission when they became adults.
Subjects with ADHD have a higher risk of suffering personality disorders and substance abuse. This disorder has a genetic basis. About 80% of the variance is explained by genetics. Some of the genes implied in this disorder are the dopamine transporter, the dopamine receptor 4, the beta–hydroxilase enzyme, the adrenergic receptor α2, the serotonin transporter and the serotonin receptor 1B.
Environmental factors such as parental nicotine consumption during pregnancy, low birth weight, perinatal problems, parental psychiatric disorders, social adversity, and low parental education are related to a higher risk for ADHD.
Several studies have shown that there are morphological brain abnormalities in subjects with ADHD. Structures like frontal lobe, cerebellar hemispheres and vermis, callosum splenium, cingulate anterior cortex and right caudate, are smaller in subjects with ADHD compared with healthy subjects.
On the other hand, regarding the response to stimulants, studies with positron emission tomography (PET), among other techniques, suggest that the dopamine and noradrenergic systems play a role in the pathophysiology of ADHD.
From 1990 to date, there are 41 morphological studies in ADHD, published in English, reporting volumetric abnormalities. However, the results are contradictory, so definitive conclusions about the brain structures being involved in ADHD remain unclear.
Objective
This article reviews the general neurobiology of ADHD providing an updated and comprehensive overview of the brain structural findings.
The methodologies of morphological studies using magnetic resonance imaging (MRI) are reviewed in detail so as to find the source of the contradictory findings reported in the published studies.
Method
A literature search and review of the relevant published articles in MEDLINE and PsycINFO sites was made using the following key words: attention deficit hyperactivity disorder, neurobiology, morphological alteration, and MRI.
In general, the literature supports the genetic basis of the disorder as well as the involvement of dopaminergic and noradrenergic systems in the pathophysiology. Nevertheless, regarding the structural abnormalities reported in ADHD, there is an enormously heterogeneous methodology in MRI scan acquisition and processing.
Almost every study used a different image analysis to measure brain structures. Some works chose a hand user definition of the region of interest (ROI), which is prone to a user's bias. Other papers used a semi–automated analysis combining a user–defined ROI and segmentation techniques based only in intensity. These methodologies are prone to bias and to a deficient separation of grey and white matter.
Finally, the automated methods where there is no user intervention are preferred because they are not a biased in the selection of ROI and use tissue probability maps to improve the segmentation. Unfortunately, none of these methods has been validated against histological and anatomopatological data. So, there is not a measure of validity and reliability of these methods.
On the other hand, female subjects are extremely underrepresented in these studies: only around 20% of the individuals studied were females and only 50% of the ADHD samples included female subjects, whereas 95% included males. The number of reports done in ADHD adults is very scarce.
Discussion
Despite the multiple inconsistencies found in each MRI study as a consequence of limitations such as small samples size, and methodological differences across the studies such as lack of consistency in the acquisition and the image analysis, the structures more frequently and consistently reported to be smaller in ADHD subjects, compared to healthy subjects, are regions of the frontal lobe, the callosum splenium, the anterior cingulate gyrus, the vermis, the cerebral hemispheres and the right caudate. However, these findings are applicable to the most frequently studied samples: male children. Considering the prevalence and lack of complete remission of ADHD symptoms during adulthood, there is a need for structural studies in adults as well as in women.
Conclusion
The findings and results of MRI studies represent clear but insufficient advances in the knowledge of the anatomical structures involved in ADHD. There is a lack of research on the age–related changes imposed by neurodevelopment. The brain abnormalities and their gender differences in ADHD individual are subjects of future research.
Key words: ADHD, neurobiology, cerebral morphology.
Resumen
El trastorno por déficit de atención e hiperactividad (TDAH) se caracteriza por un patrón persistente de inatención y/o hiperactividad e impulsividad y produce un deterioro en diversas áreas del funcionamiento del individuo. La prevalencia del TDAH en niños y adolescentes en la población general es de 5–10% y en adultos es de 1.2 a 7.3%. Menos del 10% de los niños que fueron diagnosticados con TDAH alcanzan una remisión funcional total en la edad adulta. Estos sujetos presentan más riesgo de sufrir un trastorno grave de la personalidad así como de dependencia a substancias.
Cerca del 80% de la varianza del TDAH se explica por factores genéticos. Los genes que han sido asociados al TDAH con más frecuencia son aquellos que codifican al transportador de dopamina, al receptor de dopamina D4, a la enzima beta–hidroxilasa, al receptor adrenérgico a2, al transportador de serotonina y al receptor de serotonina 1B. Existen variables medioambientales asociadas al TDAH; como el consumo materno de tabaco durante el embarazo, las complicaciones perinatales, la psicopatología de los padres, y la adversidad psicosocial.
Por otra parte, la respuesta a los estimulantes así como los estudios hechos con tomografía por emisión de positrones, sugieren que la dopamina y los sistemas noradrenérgicos tienen un papel en la fisiopatología del TDAH.
Desde 1990 a la fecha, se han realizado 41 estudios morfológicos del TDAH que han reportado anormalidades volumétricas. Sin embargo, los resultados son contradictorios, lo que no permite obtener conclusiones definitivas acerca de las estructuras involucradas en el trastorno.
Objetivo
El presente artículo presenta una revisión general de la neurobiología del TDAH y una actualización de las anomalías estructurales encefálicas en los sujetos con TDAH por medio del uso de imágenes por resonancia magnética (IRM). Se han revisado en detalle las metodologías usadas en los estudios estructurales con el fin de conocer el origen de los hallazgos contradictorios en los estudios publicados hasta la fecha.
Métodos
Se realizó una búsqueda en la bibliografía médica de los artículos publicados en las bases MEDLINE y PsycINFO, con las siguientes palabras clave: TDAH, neurobiología, alteraciones morfológicas e imágenes por resonancia magnética.
Resultados
Los estudios sobre las anormalidades estructurales en el TDAH muestran una enorme heterogeneidad en la metodología de la adquisición y del procesamiento de las IRM. Por otro lado, la mayoría de los estudios se han realizado en niños del sexo masculino. Existen pocos artículos realizados en sujetos del sexo femenino y en adultos.
Discusión
A pesar de las inconsistencias encontradas en cada estudio de IRM, las estructuras encefálicas que se reportan reducidas en los sujetos TDAH son: el lóbulo frontal, el esplenio calloso, el cíngulo anterior, el vermis cerebeloso, los hemisferios del cerebelo y el núcleo caudado derecho. Dada la alta prevalencia del TDAH y la falta de remisión de síntomas en la población adulta, es necesario realizar más estudios estructurales en sujetos adultos y femeninos.
Conclusión
Los resultados obtenidos en los estudios de IRM constituyen avances claros pero insuficientes en el conocimiento de las estructuras anatómicas involucradas en el TDAH. Las anormalidades encefálicas entre los sujetos TDAH y las diferencias de edad y género entre estos sujetos deben ser los objetivos de futuras investigaciones.
Palabras claves: TDAH, neurobiología, morfología cerebral.
INTRODUCCIÓN
El trastorno por déficit de atención e hiperactividad (TDAH) se caracteriza por la presencia persistente de inatención y/o hiperactividad–impulsividad, se inicia en la infancia y produce un deterioro significativo en al menos dos áreas de funcionamiento del individuo (DSM–IV–TR, Diagnostic and Statistical Manual of Mental Disorders, cuarta edición corregida, por sus siglas en inglés).1 De acuerdo con este manual existen tres variedades del trastorno que se definen por el número de síntomas y signos: predominantemente inatento, predominantemente hiperactivo y de tipo combinado.
La prevalencia es de cinco a 10% en niños y adolescentes2 y de 1.2 a 7.3% en adultos,3,4 aunque la prevalencia del TDAH es superior en sujetos que acuden a consulta especializada por otros trastornos psiquiátricos (16.80%).5 El TDAH es un trastorno que puede persistir hasta la vida adulta. Por ejemplo, menos del 10% de los niños que son diagnosticados con TDAH alcanzan una remisión funcional total; esto es, un desempeño adecuado en las áreas laborales, académicas, familiares, etc., a la edad de 18 años.6 Por otro lado, las consecuencias a largo plazo de este trastorno han sido bien documentadas en diversos estudios: El 51.8% de los individuos con TDAH puede evolucionar a un trastorno grave de la personalidad7–9 y hasta un 46% de jóvenes en prisión cumple los criterios del DSM–IV–TR para TDAH.10 Además, los pacientes con TDAH muestran dos veces más riesgo de presentar abuso y dependencia al alcohol y drogas11 y sufren con más frecuencia accidentes de tráfico.12 A pesar de que la etiología y la fisiopatología del TDAH aún no son totalmente conocidas, existen evidencias de que se trata de una enfermedad que está influenciada por factores genéticos. Los estudios familiares han demostrado que los padres y los hermanos de niños con TDAH tienen un riesgo de dos a ocho veces mayor de padecer TDAH.13,14 Los estudios de adopción han demostrado la trasmisión genética del trastorno.15 El gen más estudiado, y por ello el más implicado en la etiología del TDAH, es el alelo repetido 7 del receptor humano a dopamina 4 (DRD4, dopamine receptor D4, por sus siglas en inglés).16 Por otro lado, los resultados de los estudios realizados a través de imágenes cerebrales estructurales y funcionales tienden a apoyar la hipótesis de que existe un substrato biológico en el TDAH, el cual consiste en una anomalía en la estructura y el funcionamiento de redes neurales como, por ejemplo, los circuitos frontoestriatales.
MÉTODOS
Se realizó una revisión de la bibliografía de los artículos publicados desde el año 1970 hasta el 2008 en las bases de datos MEDLINE y PsycINFO con las palabras claves: Trastorno por déficit de atención e hiperactividad, neurobiología, alteraciones morfológicas e imágenes por resonancia magnética.
LA NEUROBIOLOGÍA DEL TDAH
El descubrimiento de las bases neurobiológicas de los trastornos mentales es un asunto central en la agenda de investigación de la psiquiatría moderna.17 Mientras que las revisiones de los sistemas diagnósticos actuales siguen siendo debatidas, la transición desde un sistema de clasificación de las enfermedades mentales basado exclusivamente en la fenomenología, hacia un nuevo sistema basado en la etiología y en el neurodesarrollo, requerirá de un gran acopio de evidencias apoyadas en el conocimiento de las bases neurobiológicas de los trastornos psiquiátricos. La identificación de los factores etiológicos y el entendimiento de los mecanismos que subyacen a la continuidad de los trastornos de inicio en la infancia y que se prolongan hasta la adultez, constituyen objetivos capitales en la paidopsiquiatría contemporánea ya que, recientemente, una considerable cantidad de hallazgos sugieren que la presencia de síntomas conductuales durante la infancia incrementa sustancialmente el riesgo de psicopatología en la vida adulta y disminuye las posibilidades de alcanzar un desarrollo normal en el curso de la vida.18 En el año de 1987, con la publicación del Manual Estadístico y Diagnóstico de las Enfermedades Mentales, tercera edición Revisada (DSM–III–R, Diagnostic and Statistical Manual of Mental Disorder por sus siglas en inglés), se evitaron los modelos etiológicos a favor de modelos basados en la mera descripción de grupos de síntomas y su historia natural. Desde entonces los avances en las neurociencias sugieren que probablemente en un futuro los factores neurobiológicos serán incluidos en los modelos etiológicos y taxonómicos de las enfermedades mentales.
Desafortunadamente, a pesar de los esfuerzos por encontrar una conexión directa entre los genes, la morfología y el funcionamiento cerebral con el diagnóstico psiquiátrico, todavía resta mucho por entender acerca de la relación que guardan estas variables para producir un fenómeno psicopatológico.19 Específicamente en el caso del TDAH, que es uno de los trastornos mentales de inicio en la infancia que se ha estudiado más extensamente, desde el punto de vista neurobiológico no se ha logrado integrar una teoría etiología y fisiopatológica que explique las variaciones en la clínica, la evolución y la respuesta al tratamiento de esta enfermedad.20 A medida que se acumula más evidencia en favor de que el TDAH es una entidad muy heterogénea, no sólo en términos de su presentación clínica sino también de sus bases biológicas, se hace más difícil la interpretación de hallazgos de los diferentes estudios, cuyos resultados suelen ser, en ocasiones, contradictorios.21 De hecho, el <<constructo TDAH>> continúa siendo reevaluado a un nivel predominantemente fenotípico22 a pesar de que desde hace casi dos décadas diversos métodos de estudio: genéticos, electrofisiológicos y de imagenología cerebral, entre otros, han arrojado evidencias sólidas sobre la base biológica de este trastorno.
Los estudios familiares indican claramente que el TDAH es una enfermedad altamente heredable23 y los subsecuentes estudios de gemelos han demostrado que la herencia de este trastorno es de aproximadamente 0.80; esto es, el 80% de la varianza se explica por factores genéticos. Cabe aquí mencionar que también se han identificado factores ambientales que inciden en el neurodesarrollo y que incrementan el riesgo de sufrir TDAH,24 tales como el consumo maternal de nicotina durante el embarazo y el sufrimiento fetal.25
A pesar de las altas estimaciones de la herencia del TDAH, que varían entre el 60% y el 91 %,26 ninguno de los genes investigados ha probado ser suficiente o necesario para causar este trastorno. Por esto se piensa que en la etiología del TDAH están involucrados múltiples genes y que cada uno posee un efecto moderado.27,28 Algunos de los genes que han mostrado alguna asociación con el TDAH son: el gen que codifica al transportador de dopamina (DAT, dopamine transporter, por sus siglas en inglés), al receptor de dopamina D4, al receptor de dopamina D5, a la enzima beta–hidroxilasa, al receptor adrenérgico a2, al transportador a serotonina y al receptor de serotonina 1B.29 Uno de los polimorfismos que ha sido asociado más consistentemente al TDAH es la forma 7–repetida del receptor a dopamina D4 de 48 pares de bases, localizado en el exón 3 del gen que codifica al receptor de dopamina D4 (DRD4–7, dopamine receptor D4–7, por sus siglas en inglés). Se ha estimado que el ser portador del gen DRD4–7, conlleva un riesgo para la presentación de TDAH de entre 1.16–1.45 veces.14
Los estudios de casos y controles han demostrado que el riesgo de padecer TDAH se incrementa hasta cuatro veces si la madre ha consumido tabaco durante el embarazo. Hay variables que pueden confundir este hallazgo, tales como la psicopatología parental, el uso de drogas o alcohol, el bajo peso al nacimiento, el coeficiente intelectual (CI) y la adversidad psicosocial.
No obstante, estos mismos factores juegan un papel por sí mismos e independientemente del consumo de tabaco en la fisiopatología del TDAH. La nicotina se une a los receptores nicotínicos del cerebro. Estos receptores tienen un papel clave en el desarrollo cerebral dado que regulan la producción y la diferenciación del desarrollo sináptico cuando son estimulados por la acetilcolina endógena.27 Hay evidencia de la existencia de una conexión específica entre un bajo peso al nacimiento, definido como menor de 1000 gr. (ELBW, extreme low birth weight, por sus siglas en inglés) y el desarrollo subsecuente de TDAH. Cuando se comparó la prevalencia de TDAH en 127 niños de 12 años de edad que tenían el antecedente de ELBW con sus respectivos controles, se encontró que el 23% de los niños con ELWB presentaron síntomas de TDAH en comparación con el 6% de los niños controles.30 Por otro lado, la prematurez (<37 semanas de embarazo) y otras complicaciones perinatales tales como la rotura prematura de membranas, el trabajo de parto prolongado y la presencia de circular de cordón, incrementan el riesgo de sufrir TDAH.31
Es evidente que el efecto de una sola variable sobre un trastorno complejo como lo es el TDAH, no pueda explicar la expresión total del mismo. Se ha postulado que la razón por la cual no todos los individuos que poseen un <<genotipo vulnerable>> desarrollarán una determinada enfermedad, es debido a que el efecto del genotipo es sólo evidente en los individuos expuestos a un ambiente específico. En un estudio publicado por Kahn et al.,32 se examinó, en niños de cinco años de edad, la asociación independiente y conjunta del polimorfismo del gen que codifica al transportador de dopamina (DAT1) y el consumo materno de tabaco durante el embarazo. Ellos encontraron que sólo los niños que poseían el alelo 10 repetido para el DAT1 y cuyas madres habían fumado durante el embarazo, presentaron síntomas de TDAH, mientras que aquellos niños que únicamente poseían el alelo 10 repetido para el DAT1 o que exclusivamente tenían el antecedente de consumo materno de tabaco, no presentaron sintomatología propia del TDAH.32
Por otro lado, existe evidencia de que la interacción entre genes y ambiente en la fisiopatología del TDAH no se limita a la época perinatal. Un estudio reciente evaluó la interacción de la adversidad psicosocial con el genotipo DAT1 y su relación con el TDAH en un grupo de adolescentes, en donde factores como la adversidad psicosocial definida por problemas maritales entre los padres, la psicopatología parental, un bajo grado de educación materna y la paternidad integrada por un solo miembro, influyen en el desarrollo del TDAH. Los adolescentes que poseían el alelo repetido 10 del DAT1 y que además crecieron en un ambiente desfavorable, mostraron más síntomas de inatención, hiperactividad e impulsividad que los adolescentes que sólo poseían el alelo repetido 10 del DAT1 o que sólo crecieron en ambientes desfavorables.33
MORFOLOGÍA CEREBRAL
Se considera que los síntomas del TDAH son el resultado del déficit en la inhibición de la respuesta y en las funciones ejecutivas, por lo que se presume que estas características neuropsicológicas son el resultado de anormalidades estructurales y funcionales en los circuitos fronto–estriatales–cerebelosos.34,35
Por el momento, los hallazgos más significativos en los estudios de imágenes cerebrales estructurales y funcionales han delineado tres regiones anatómicas: 1. la corteza frontal, particularmente la corteza prefrontal (CPF); 2. los núcleos de la base y 3. el cerebelo. No obstante, las limitaciones metodológicas, tales como muestras pequeñas, magnitudes de efecto pequeñas y moderadas, la falta de consistencia en la metodología de la adquisición y el procesamiento de las imágenes de resonancia magnética (IRM), la variación de los síntomas de acuerdo al subtipo clínico, la edad y el sexo, impiden obtener conclusiones definitivas.36
Dadas estas limitaciones y hallazgos contradictorios en lo que se refiere a cuáles son las estructuras anatómicas que se encuentran alteradas en los sujetos con TDAH, queda claro que se necesitan formas más complejas de evaluar el fenómeno. Por ejemplo: un estudio realizado por Shaw et al.,37 examinó los efectos de los tres polimorfismos implicados en la etiopatogenia del TDAH: 1. el alelo DRD4–7; 2. el alelo DRD1 del gen que codifica al receptor D1 de dopamina y 3. el alelo DAT1 del transportador a dopamina, sobre el desarrollo del grosor de la corteza cerebral en niños con TDAH. Se incluyeron a 105 niños con TDAH, con un promedio de entrada al estudio de 10 años, y 103 niños sanos. Sólo 67 sujetos del grupo de TDAH completaron el seguimiento de seis años. Los niños con TDAH y los niños sanos fueron clasificados según su genotipo. En los niños con TDAH, el poseer el alelo DRD4–7 se asoció con una corteza cerebral más delgada en la región orbital e inferior prefrontal derecha, así como en la corteza posterior derecha. No se observó ninguna diferencia entre los niños sanos portadores del alelo DRD4–7 y los niños con TDAH no portadores de este alelo. Los niños sanos no portadores del alelo DRD4–7 presentaron un mayor grosor en estas áreas corticales en comparación con los otros tres grupos de niños. Sin embargo, estas diferencias desaparecieron a la edad de 18 años. No se encontró ninguna relación entre el grosor de la corteza cerebral y los alelos DRD1 y DAT1.
Por otro lado, existe una controversia sobre la naturaleza de la alteración en el desarrollo cerebral que subyace al TDAH. Particularmente, no ha quedado claro si este trastorno representa solamente un retardo en el desarrollo o si representa más bien una desviación completa del desarrollo. Shaw et al.,38 obtuvieron prospectivamente las imágenes cerebrales por RM de 223 niños con TDAH y 223 niños sanos, desde la infancia hasta la adolescencia, para cuantificar el grosor y la trayectoria de crecimiento en más de 40 000 puntos localizados en la corteza cerebral. El pico del grosor de la corteza fue tomado como un índice de maduración. Se encontró que la maduración regional cerebral procede de una manera similar en los sujetos sanos y en aquellos con TDAH, siendo las áreas sensoriales primarias las que maduran antes que las áreas de asociación polimodales. Sin embargo, se observó un retraso generalizado en la maduración de la corteza cerebral en los niños con TDAH, dado que la edad media a la cual el 50% de los puntos corticales alcanzaron su máximo grosor fue a los 10.5 años (±.01 e.e.). En contraste, los niños sanos alcanzaron este mismo criterio de maduración a la edad de 7.5 años (±.02 e.e.). El retraso fue más prominente en las regiones prefrontales.38 De esta forma queda evidenciado que hacen falta más estudios que tomen en cuenta el genotipo y el neurodesarrollo para obtener una respuesta definitiva acerca de cuál o cuáles son los circuitos anatómicos implicados en el TDAH.
Durante las tres últimas décadas, las teorías sobre la neurobiología del TDAH se han centrado en las catecolaminas norepinefrina (NE) y dopamina (DA). Además de la respuesta benéfica de los estimulantes en los pacientes con TDAH, los estudios realizados en modelos animales de depleción de dopamina, como el de Shaywitz et al., en 1976,39 han demostrado que la ablación química con 6–hidroxidopamina de las fibras dopaminérgicas, causa un estado de parkinsonismo en ratas adultas, así como hiperactividad y dificultades en el aprendizaje en ratas recién nacidas. Estos síntomas fueron parcialmente disminuidos por la administración de metilfenidato. De manera similar, se ha demostrado que la depleción química de NE durante el periodo neonatal, en ratas, produce un modelo animal de inatención.40
Dougerthy et al.,41 con el uso de SPECT (single photon emission computed tomography, por sus siglas en inglés) y el ligando123 altropano, evaluaron la densidad del transportador de dopamina en seis adultos con TDAH y encontraron un 70% de incremento en la densidad de este transportador, con respecto a los controles.41 De manera similar, Krause et al.,42 aplicaron la técnica de SPECT y evaluaron la unión de dopamina a su transportador con el ligando al transportador de dopamina Tc–99m–Tropano en diez adultos con TDAH. Ellos encontraron un aumento en la unión del transportador al ligando en los núcleos de la base. Esta unión anormalmente alta, disminuyó tras cuatro semanas de tratamiento con metilfenidato. Por su parte, Ernest et al.,43 evaluaron la actividad de la enzima 3,4 dehidro–fenilalanina (DOPA) descarboxilasa, que es una medida indirecta de la actividad dopaminérgica, con [18F] DOPA, utilizando PET (PET, positron emisson tomography, por sus siglas en inglés). Encontraron que la actividad de esta enzima estaba reducida en aproximadamente 50% en la corteza prefrontal de adultos con TDAH y por ello sugirieron que una alteración de la función dopaminérgica en esta región cerebral era la responsable de los síntomas del TDAH. El tratamiento con metilfenidato produce un incremento de DA en la hendidura sináptica por medio del bloqueo del DAT. Dado que la DA es conocida por disminuir el disparo de <<fondo>> de las neuronas estriatales al mismo tiempo que fortalece las señales córtico–estriatales en las células del estriado, esto produce un incremento de la proporción señal–ruido en las neuronas blanco, lo que clínicamente se traduce en un incremento de la atención y en una disminución de la distracción. Además, incrementa la motivación hacia objetivos específicos. La evidencia del papel de la NE en el TDAH se basa principalmente en el efecto terapéutico que tienen los estimulantes, los antidepresivos y la atomoxetina en su tratamiento, dado que estas tres clases de medicamentos inhiben la recaptura de NE. La NE es responsable de mantener el estado de alerta, prerrequisito para la atención. Dado que no existen ligandos para NE para observar su transportador, la relevancia del tratamiento con estimulantes sobre el sistema de NE no ha sido estudiada con técnicas de imágenes cerebrales. Sin embargo, la NE incrementa las respuestas a estímulos relevantes y también suprime las respuestas a los no irrelevantes, lo que incrementa la eficiencia del procesamiento de la información.44
El locus coeruleus proyecta al área tegmental ventral y a pesar de que existen pocas sinapsis entre neuronas noradrenérgicas (NNA) y dopaminérgicas (NDA), hay numerosos sitios de contacto en donde las NNA ejercen influencia sobre las NDA. Probablemente el contacto íntimo en estos sitios de unión produce una difusión de NA hacia el interior de las NDA. Existen receptores α2 en las terminales dopaminérgicas. Las NNA postsinápticas que reciben el input noradrenérgico, se proyectan hacia las NDA y, de manera similar, las NDA corticales que reciben el input dopaminérgico, influencian a las NNA. Se ha demostrado que cuando se administra la NE o un agonista α1 en la corteza prefrontal de la rata, se produce una liberación de DA. Cuando la DA o un agonista dopaminérgico D1 es infundido en la corteza prefrontal de la rata, se produce una liberación de NA. Dado que tanto los receptores a! y D1 se encuentran exclusivamente en las neuronas postsinápticas, es posible que estas neuronas <<regresen>> al área tegmental ventral o al locus coeruleus para estimular la liberación de DA y NE. A nivel de la corteza prefrontal las catecolaminas facilitan sus acciones entre sí, lo que sugiere su participación en la cognición y en la fisiopatología del TDAH. El aspecto clave de la función de las catecolaminas puede no ser el nivel absoluto y estable de NA y DA, sino más bien la liberación de la cantidad óptima del neurotransmisor relativo a la tarea que se está ejecutando, por lo que una liberación muy pequeña puede resultar en inatención y una consecuente falta de respuesta a los estímulos. Por otro lado, la cantidad excesiva puede resultar en una sobreestimulación, hiperactividad y desorganización de las funciones ejecutivas.45 Dadas las consideraciones neurobiológicas anteriores y la alta comorbilidad del TDAH con trastornos por ansiedad o consumo de sustancias, actualmente se propone el <<modelo del espectro de alertamiento de la disfunción cognitiva del TDAH>>29 el cual propone que los individuos con TDAH presentan dos estados en su nivel de alerta: un estado de hipoactivación y otro de hiperactivación. Los sujetos con TDAH que están en el estado de hipoactivación sufren de inatención, disfunción cognitiva, somnolencia e impulsividad, la cual está particularmente asociada a hipoactivación de la corteza orbital. La hipoactivación se relaciona con un bajo nivel de disparo de las NNA y NDA.
Alternadamente, los sujetos con TDAH pueden estar en un estado de hiperactivación que puede producir síntomas cognitivos y estar ligado, además, a otra sintomatología como hiperactividad, insomnio, ansiedad, consumo de sustancias y estados maniacos. Esta condición está asociada con un nivel alto de disparo tónico y fásico de las NNA y NDA.
Hasta aquí se ha ofrecido un breve repaso sobre algunos de los tópicos más relevantes en la neurobiología el TDAH. En adelante, este trabajo se centrará en las investigaciones que han demostrado una anomalía estructural en sujetos con este padecimiento.
ESTUDIOS ESTRUCTURALES REALIZADOS CON IRM EN EL TDAH
En 1971, Satterfield y Dawson propusieron que los síntomas del TDAH eran causados por una alteración en los circuitos frontolímbicos. Sugirieron que la causa probable del TDAH era un control cortical inhibitorio débil sobre las estructuras límbicas. Tales afirmaciones se derivaron de las similitudes clínicas observadas entre adultos con lesiones del lóbulo frontal y niños con TDAH. A pesar de esto, no ha quedado claro si las alteraciones en la función de la corteza frontal observada en los pacientes con TDAH son debidas a alteraciones que tienen su asiento en la misma corteza frontal o en otras regiones cerebrales con las que ésta tiene conexiones. El término <<frontoestriatal>> ha sido utilizado por algunos autores para describir las alteraciones anatómicas y neuropsicológicas del TDAH. No obstante, esta descripción parece ser insuficiente porque existen evidencias de que diversas redes neuronales cerebrales están involucradas en la fisiología normal de la atención y se encuentran deterioradas en los individuos con TDAH. Por ejemplo, la corteza anterior del cíngulo desempeña un papel en los aspectos motivacionales de la atención y en la selección e inhibición de la respuesta conductual, mientras que la corteza parietal derecha se activa durante las pruebas de atención sostenida. El lóbulo parietal inferior derecho da cuenta de la representación extracorporal del espacio, la cual ejerce un papel importante en la selección y focalización de un estímulo. El sistema activador reticular ascendente y el núcleo reticular talámico regulan el tono de la atención y filtran la interferencia sensorial, respectivamente. Finalmente, la memoria de trabajo, la cual está claramente deteriorada en los pacientes con TDAH, tiene sus sustratos anatómicos en el hipocampo anterior, el tálamo anterior y el dorsolateral, el cíngulo anterior, la corteza parietal y la corteza prefrontal dorsolateral.46,47
Los primeros estudios realizados con técnicas estructurales de imágenes cerebrales en sujetos con TDAH a finales de la década de 1970 y durante la de 1980, utilizaron la tomografía axial computarizada. A pesar de los problemas metodológicos inherentes a esta técnica de imagen, los hallazgos de estos estudios van desde la normalidad hasta la atrofia frontal y cerebelosa en pacientes con TDAH.48 Desde 1990, empezaron a publicarse estudios realizados en muestras de pacientes con TDAH en los cuales se utilizó la técnica de IRM, la cual se usa principalmente en el ámbito médico y que produce imágenes de alta calidad del interior del cuerpo humano. La IRM está basada en la técnica de espectroscopía, en la que se proporciona información física y química de las moléculas a partir de la interacción entre la radiación electromagnética y la materia, por lo que se fundamenta en la absorción y la emisión de energía que se encuentra dentro del rango de radiofrecuencia del espectro de la radiación electromagnética. El cuerpo humano está compuesto principalmente por agua y grasa, las cuales están formadas, a su vez, por átomos de hidrógeno que están integrados por electrones y un solo protón. Los protones poseen una propiedad física denominada espín, que se define como un giro o una rotación en el campo electromagnético que, en este caso, es el responsable de la señal de la IRM. Cuando los protones son colocados en este campo electromagnético, éstos absorben energía a una frecuencia determinada que se conoce como frecuencia resonante, de ahí el término resonancia que da nombre a esta técnica.49
Dadas la resolución, la seguridad y la precisión para identificar estructuras anatómicas en el cerebro, la IRM ha sido utilizada para investigar los sustratos anatómicos de diversas enfermedades psiquiátricas. Como se mencionó anteriormente, desde 1990 y hasta la fecha, se han publicado diversos estudios que han utilizado esta técnica en el TDAH (cuadro 1). Con el advenimiento de nuevos métodos de análisis de IRM, los cuales permiten cuantificar el volumen de las estructuras encefálicas producidas por las IRM, se han podido realizar comparaciones entre sujetos con TDAH y sujetos sanos. Las investigaciones realizadas hasta la fecha han incluido principalmente a niños y adolescentes, en su mayoría del sexo masculino. En el cuadro 1 se muestra un resumen de estos estudios y las variables socio demográficas y clínicas de cada una de las muestras.50–84
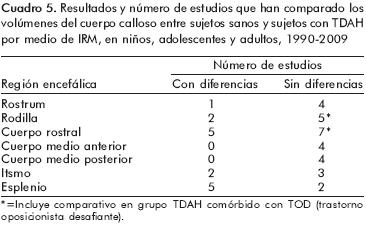
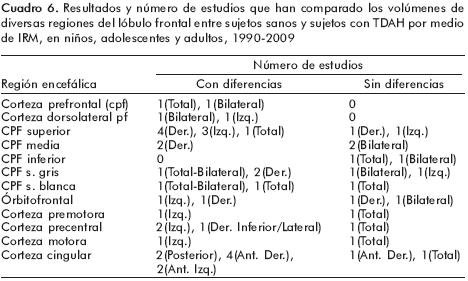
En los cuadros 2 y 3 aparecen las especificaciones técnicas utilizadas en los estudios realizados en niños y adolescentes (cuadro 2) y en adultos (cuadro 3). Los hallazgos principales encontrados en estas publicaciones están resumidos en la figura 1 y en los cuadros 4, 5, 6, 7 y 8. Como puede verse, los resultados son muy heterogéneos y contradictorios.




Es frecuente observar en la bibliografía médica que se publiquen artículos cuyos resultados no son consistentes entre sí. Es por ello que se realizan estudios meta–analíticos que combinan los resultados de varios estudios independientes acerca de un tema específico, utilizando procedimientos estadísticos.85 Los propósitos de esta técnica son: 1. incrementar la potencia estadística aumentando el tamaño de la muestra; 2. intentar resolver controversias cuando los resultados de los diferentes estudios no concuerdan y 3. estimar la magnitud del efecto, que es un índice de cuánta diferencia hay entre dos grupos. Son los tamaños del efecto los que se combinan por métodos estadísticos, su magnitud es la diferencia entre las medias de dos grupos divididas entre la desviación estándar de ambos grupos y se interpreta de la siguiente manera, según Cohen:86 una magnitud del efecto de 0.8 o más indica que las medias de los dos grupos están separadas por 0.8 desviaciones estándar; tamaños de efecto entre 0.2 y 0.5 se consideran como pequeños y medianos, respectivamente. Una herramienta del meta–análisis es la evaluación del sesgo de publicación, por lo que los estudios no publicados tienden a ser pequeños y a no encontrar diferencias significativas. El hecho de no observar una asociación entre el tamaño de la muestra y los hallazgos de los estudios individuales, indica que no hay un sesgo de publicación. Si por el contrario, existe una fuerte correlación entre el tamaño de la muestra y los resultados positivos de los trabajos individuales, esto sugiere un sesgo de publicación.
Una manera gráfica de representar esto son las gráficas de embudo o funnel plots, las cuales muestran la relación entre el tamaño de la muestra y los hallazgos de cada estudio. Una gráfica de embudo en forma de campana sugiere que no hay sesgo de publicación dado que se han incluido en el meta–análisis estudios pequeños con resultados tanto positivos como negativos. En un meta–análisis reciente, que incluyó 22 estudios publicados hasta el año 2005 y en los cuales se utilizaron IRM, se analizaron los resultados de 565 sujetos con TDAH y 586 sujetos sanos con un rango de edad de nueve a 14 años (95% de los sujetos fueron del sexo masculino). Las imágenes fueron obtenidas con equipos de 0.6 a 1.5 T y analizadas tanto por medio de métodos no automatizados como por métodos automatizados, para así definir la selección de las regiones de interés (ROI, regions of interest, por sus siglas en inglés). La magnitud de la diferencia se expresó en términos de la diferencia promedio estandarizada (SMD, standarized mean difference, por sus siglas en inglés), de acuerdo al método de Cohen que consiste en restar el promedio del volumen de la estructura cerebral en cuestión, en este caso el promedio del grupo de los sujetos con TDAH, del volumen promedio de dicha estructura en los sujetos sanos y dividir el resultado entre la desviación estándar de ambos grupos (pooled standard deviation). Si el resultado de esta operación está entre 0.20 y 0.49, se dice que la magnitud de la diferencia es pequeña; si el valor está entre 0.50 a 0.79, se dice que la diferencia es mediana; y si es igual o mayor a 0.80, la diferencia es grande.86
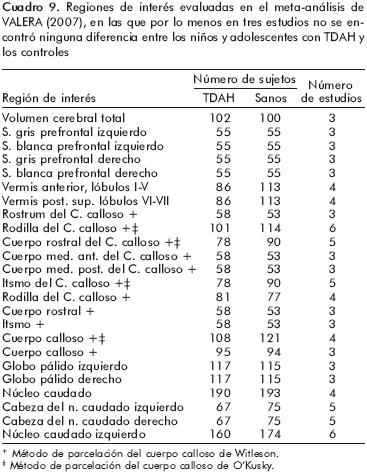
Valera E et al.,87 reportaron las siguientes ROI que mostraron una significativa diferencia de volumen entre los niños y adolescentes con TDAH y los controles, con una magnitud del efecto estandarizada de tamaños mediano y grande en al menos tres estudios: hemisferio derecho (tres estudios, con una significancia menor a 0.001), esplenio del cuerpo calloso (dividido en los métodos O'Kusky y Witleson, seis estudios, con una significancia menor a 0.002), esplenio del cuerpo calloso (dividido con el método Witleson, cuatro estudios, con una significancia menor a 0.001), vermis del cerebelo (tres estudios, con una significancia menor a 0.001), y vermis postero–inferior del cerebelo (cinco estudios, con una significancia menor a 0.001). En cuanto a la magnitud del efecto estandarizada de tamaño pequeño en al menos tres estudios, las ROI fueron: núcleo caudado derecho (seis estudios, con una significancia menor a 0.002), cerebelo izquierdo y derecho (tres estudios en cada uno, con una significancia menor a 0.001 en cada uno) y cerebro total (ocho estudios, con una significancia menor a 0.001).
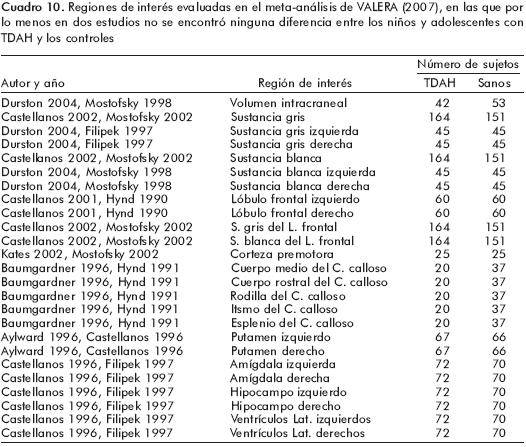
Los resultados del presente meta–análisis87,88 sugieren diferencias en ciertas estructuras cerebrales y que los estudios comparados son homogéneos entre sí y sin algún sesgo de publicación (cuadro 9). Sin embargo, en el mismo meta–análisis se encontraron artículos en los cuales no se hallaron diferencias entre los controles y los sujetos con TDAH (cuadro 10).
* Las referencias de este artículo aparecerán en la segunda parte del mismo. Salud Mental, vol. 33, No. 1, enero–febrero de 2010.
** Artículo sin conflicto de intereses














