Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Salud mental
versión impresa ISSN 0185-3325
Salud Ment vol.32 no.6 México nov./dic. 2009
Artículo orginal
Cambios del EEG por habituación y condicionamiento en niños de tres a 15 años que acuden al Instituto Nacional de Rehabilitación (INR)
EEG changes induced by habituation and conditioning in 3– to 15–year–old children attending the Instituto Nacional de Rehabilitación
Héctor Brust–Carmona,1 Francisco Ramírez–Aboytes,1 Ana Sánchez,2 José Martínez,2 Ángel Rodríguez Miguel,1 Blanca Flores–Ávalos,3 Oscar Yáñez–Suárez4
1 Dirección de Investigación, Instituto Nacional de Rehabilitación.
2 Rehabilitación Neurológica. Instituto Nacional de Rehabilitación.
3 Servicio de Neurofisiología. Instituto Nacional de Rehabilitación.
4 Laboratorio de Neuroimagenología, Universidad Autónoma Metropolitana Iztapalapa UAM–I, México.
Correspondencia:
Dr. Héctor Brust–Carmona.
Laboratorio de Electroencefalografía,
Dirección de Investigación.
Instituto Nacional de Rehabilitación.
Av. México–Xochimilco 289.
Col. Arenal de Guadalupe, 14389.
México, DF.
Tel. 5999 1000 Ext. 13101.
Email: hbrust@inr.gob.mx
Recibido: 24 de febrero de 2009.
Aceptado: 21 de mayo de 2009.
Abstract
During waking, stimuli activate the sensory pathways giving rise to sensation and the response to such stimulation. The electrobiochemical changes and modifications in EEG rhythms event–related synchronization or event–related desynchronization, ERD or ERS) propagated in the specific and unspecific cortex are added to the changes elicited by the responses and to the new signals originated by those same responses, bringing about perception. Diverse factors can alter these glialneuronal circuits, producing alterations in attention processes (ADD) and in the integration with their meaning. The inability to identify signals and integrate correct coordinated responses leads to deficiencies in responding to the environment and to associated morbidities that are added to ADD. ADD and its associated morbidities cause high social and economic impacts and, even more so, because of their persistence into adolescence and adulthood. Therefore, highly accurate diagnostic procedures are needed for these diseases. According to the CIE–10, in the clinical setting symptoms are analyzed without studying the neuro–developmental and neuro–degenerative signs that identify alterations in neuronal circuits. As is known, behavior (including motivation, memory, thoughts) results from the Central Nervous System (CNS) activity, and the EEG records the electrical activity of neurons and synapses of the cerebral cortex, where cognitive processes are most likely to take place.
To establish more accurate diagnostic procedures for ADD, we are integrating an electronic database, considering the intensity and cerebral distribution of theta (θ), alpha (α), and beta (β) rhythms. We propose that the ERD of α and β reflects a cortical activation that gives rise to sensory–motor coordination processes. The first stimulations induce ERD, and their repetitions produce its decrement (ERS): ERD habituation. In addition, this ERD to ERS change might be reversed when giving meaning to the stimulation. We present herein the changes in θ, α, and β rhythms induced by repeated photostimulation (RPS), with the same characteristics, that, when presented, requires the subject to press a knob.
Hundred–twenty–four children were studied at the Instituto Nacional de Rehabilitación (INR, for its initials in Spanish) in Mexico City. Children were of either gender and aged from 3 to 15 years, separated in four groups of 3–year intervals. During clinical exploration, we searched for possible delays in physical–emotional–intellectual development, epilepsy, and medical or psychological treatments during the last six months, which were considered exclusion factors. Parents were briefed on the study, explaining them that the procedure had a low–risk nature and allowed for the analyzis of the electrical activity of the brain. Once having understood and accepted the procedure, they signed the informed consent form prepared by the institution. Children were explained <<how the batteries of the brain>> work and that the procedure caused no pain at all. They were asked to close their eyelids during the recordings, and to remain as motionless as possible. The exclusion factors left a sample of 94 children for the habituation analysis and of 47 for the simple conditioning procedures. The EEG was recorded in dorsal decubitus position, with a digital 24–channel electroencephalograph, according to the 10/20 international system. In addition, we recorded eye movements and the EKG. After 5–min recordings with closed eyelids, photo–stimulation was started at 5 flashes per second during 2s, repeated 20 times (RPS), at 21 to 25 sec. intervals. After finishing the series, 5 min rest were provided, and then a round device with a knob was placed in the children's hands, telling them to press the knob at the start of the RPS and to release it at the end. Analyses were performed with 1.6 to 40 Hz bandwidth filters. From the bipolar leads, samples recorded 2 sec. before, during, and after the 1st, 5th, 10th, 20th associations (PS–knob pressing) were manually chosen. For conditioning analyses, we also measured the response latency. The Fourier's FT was applied to the samples and the absolute potency (AP) was calculated for θ (4.0 to 7.5 Hz), α (8.0 to 12.5 Hz), and β (13 to 20 Hz). The average of these frequencies was obtained for each hemisphere (Right, RH; Left, LH) and for both (BH). Wilcoxon's test for related samples was used with (α > 0.05 as significant.
Analyses of the AP of the three frequencies in all children revealed a background activity below 10 µV2. The first RPS produced a decrease in the AP of θ and α, with an increase in β in BH. At the 5th RPS, θ and α continued to decrease along with an increase in β. At the 10th RPS, θ and α decreased less but the increase in β persisted.
At the 15th RPS, θ continued to decrease but α increased in the LH and decreased somewhat in the RH, whereas β continued its increase in BH. At the 20th RPS, the AP of θ and a decreased in BH, but the difference was smaller than that recorded during the previous RPS. The AP of β continued to increase in BH. The most relevant aspects are: a) in G–1 (children aged 3 to 6 years), the AP of the three frequencies is higher, predominating θ, which is twice the magnitude of that of the whole group; b) the 1st PS produced an increase in the AP of all three frequencies, which was not recorded in the other groups (children aged 6.5 to 15 years); c) in G–4 (children 12.5 to 15 years of age), the 1st and 5th PS produced a clear diminution in the AP of θ and a (ERD), which was smaller at the 10th RPS and reversed at the 15th and 20th RPS (ERS). After indicating to the children that with each RPS they would have to press a knob, the background activity increased to 12 µV2. During the 1st association (assoc), the AP of θ and α decreased with a slight decrease in β; the response latency was 930 ms. At the 5th assoc, θ decreased together with a small increase in a and β, and the response latency decreased to 750 ms. On the 10th and 15th assoc, the three frequencies increased and the latency decreased to 650 and 640 ms, respectively. On the 20th assoc, the AP increase of each rhythm was smaller, and the latency increased to 750 ms.
The EEG analysis per group revealed a higher AP for 0 in the smaller children that decreased along increasing age together with a relative increase in a, which reached its maximal value in G–4. In the four groups, the RPS induced an undulating tendency towards a decrease in the EEG desynchronization that represents habituation, being more noticeable in G–4. Although the reached synchronization level did not reflect a better inhibition, as described in adults, it suggested that, in these children, the inhibitory activity on sensory control has not yet developed completely. Another important finding is that in G–1, the 1st RPS induced and increase in θ and α that was not observed in the other groups. This suggests that a facilitation of the circuits predominates in this age group. Children of G–4 depict the best habituation curve; however, because of the reduced number of children in this group, some data did not reach statistical significance, their clinical relevance is a strong indicator of the need to enlarge the sample size for more in–depth analyses. The knob–pressing response improved in correlation with the chronological age, coinciding with the decrease in θ and the increase of α. Surprisingly, according to our hypothesis, conditioning at the cortical level would be reflected in an increase of the β rhythm (DRE), which we did not register. However, we did find an inverse correlation between the decrease or increase in θ and α rhythms, as well as a better motor response with interhemispheric differences, manifested more intensely in the RH, which for most of the studied population represents the <<non–dominant>> hemisphere. The modification of θ and a may be explained as resulting from the functional integration of the specific and unspecific central–encephalic–thalamic–cortical sensorial circuits that may be related, in turn, to alpha rhythm generation and the limbic circuits, related to the theta rhythm, which participate in the integration of memory.
Key words: EEG, theta, alpha and beta rhythms, modification by habituation and conditioning, cognitive processes.
Resumen
Algunos cambios del ambiente activan las vías sensoriales generando la sensación y la respuesta a dicha estimulación. Los cambios electrobioquímicos modifican el EEG que al propagarse en la corteza cerebral se suman a los potenciales que generan las respuestas y éstas producen nuevas señales que dan lugar a la percepción. Diversos factores pueden alterar la organización de esos circuitos glioneuronales produciendo trastornos de la atención (TDA), de su integración con su significado, lo que regula el tipo e intensidad de respuestas adecuadas al contexto social. La discapacidad de estas funciones genera comorbilidades que se suman al TDA. Estas enfermedades son de alto impacto socio–económico y cultural y lo son más cuando persisten en la adolescencia y la adultez. Por esto es necesario desarrollar metodologías diagnósticas de alta precisión. Actualmente se acepta que la conducta integral resulta de la actividad del Sistema Nervioso (SN). El EEG registra la actividad eléctrica de las neuronas de la corteza cerebral donde se realizan procesos cognitivos. Para caracterizar el EEG estamos integrando, en una base de datos electrónica, la intensidad y distribución cerebral de los ritmos delta (Δ), theta (θ), alfa (α) y beta (β). Proponemos que la desincronización (DRE) refleja la activación cortical, base de los procesos de coordinación sensoriomotora. Las primeras estimulaciones producen DRE que, al repetirse, disminuyen la habituación de la DRE. Además, es posible que se invierta este cambio DRE a sincronización (SRE) al darle significado a la misma estimulación. En este trabajo se presentan los cambios de θ, α y β ante la fotoestimulación repetida y cuando el sujeto tiene que presionar un botón al inicio de dicha estimulación.
Sujetos y método
Se atendieron 124 niños, de tres a 15 años, separados en cuatro grupos con intervalos de tres años. En el interrogatorio clínico se indagó el posible retraso del desarrollo físico–emocional–intelectual, de epilepsia o tratamientos médicos o psicológicos convirtiéndose en factores de exclusión. A los niños, delante de los padres, se les explicó cómo funciona su cerebro, que el estudio no produce dolor, que estarán acostados con los párpados cerrados (OC), permaneciendo lo más inmóviles posible, los padres al comprenderlo y aceptar firmaron la autorización. Los factores de exclusión dejaron 94 niños para análisis de habituación y 47 para condicionamiento. El EEG se registró utilizando los montajes bipolares A–P parasagitales del sistema internacional 10/20, además se registraron los movimientos oculares y el EKG. El sujeto con OC se fotoestimulaba 20 veces (FR a 5/s X 2s). Después de 5 min de terminada la serie se les ponía en la mano dominante un aditamento con un botón, indicándoles que lo apretaran al inicio de cada FR y lo liberaran al terminarse (asociaciones). El análisis se efectuó con filtro de 1.6 y 40 Hz. Seleccionando manualmente, de la 1era, 5ª, 10ª 15ª y 20ª FR muestras de registros bipolares de 2s antes, durante y después. Para el condicionamiento se agregó la medición de la latencia de la respuesta. Se aplicó la TRF y se calculó la Potencia Absoluta (PA) de θ (4.0–7.5 Hz), α (8.0–1 2.5 Hz) y β (1 3–20 Hz), se obtuvo el promedio en cada hemisferio (HI, HD) y de ambos (AH). Se utilizó la prueba de Wilcoxon con α >0.05.
Resultados
El promedio de la PA de la actividad de fondo, de todos los niños, está por debajo de 10 µV2. La 1era FR disminuye la PA de θ y de α con incremento de β en AH. En la 5ª FR disminuye θ y α con incremento de β. En la 10° disminuye menos θ y α, persistiendo el incremento de β. En la 15ª continúa la disminución de θ, pero aumenta α en el HI y disminuye en el HD. En AH se incrementa β. En la 20° se vuelve a disminuir θ y α en AH; sin embargo, el rango de la diferencia es menor que el registrado en anteriores FR. La PA de β sigue aumentando en AH. El análisis por grupo muestra que en el G–1, la PA de los tres ritmos es mayor, con predominio de θ, siendo del doble del grupo total. En la 1era FR incrementa la PA de los 3 ritmos, lo cual no se registró en los otros grupos. En el G–4, la 1era y 5ª FR disminuyen la PA de θ y de α (DRE), siendo menor la disminución en la 10ª y se invierte en la 1 5ª y 20ª (SER). Consecutivamente a la explicación de que con la FR deben presionar el botón, se incrementa el promedio de la PA a 12 µV2 en promedio de la muestra. En la 1era Aso disminuye la PA de 6 y de θ incluyendo una discreta disminución de β, la latencia es de 930 ms. En la 5ª Aso disminuye θ con pequeño incremento de θ y α y la latencia es de 750 ms. En la 10ª y 15ª continúa el incremento de los tres ritmos y la latencia disminuye a 650 y 640 ms, respectivamente. Mientras que en la 20ª el incremento de la PA de cada ritmo es menor y la latencia se incrementa a 750 ms.
Interpretación
El análisis del EEG por grupo revela mayor PA de θ en el G1, lo cual disminuye con la edad y con relativo aumento de α, alcanzando su máximo en el G4. En todos los niños se registra una disminución ondulante de la DRE que representa la habituación, siendo más notable en G4, aunque no se alcanza una SRE homogénea que indique mejor inhibición, como se describe en adultos, lo que sugiere que en los niños no se ha desarrollado completamente esa actividad de control sensorial. Otro dato importante es que en el G1, la 1era FR incrementa θ y α que no se observa en los otros grupos, lo que sugiere que en este grupo aún predomina la facilitación de los circuitos. El G4 presenta mejor curva de habituación, aunque por los pocos niños y el número de FR analizadas, algunos datos no alcanzan significado estadístico pero sí de importancia clínica, lo cual obliga a incrementar la muestra y analizar cada una de las FR. La respuesta de presionar el botón mejora en correlación con la edad, que coincide con la disminución de θ e incremento de α. Lo sorprendente es que, de acuerdo a la hipótesis, el condicionamiento se reflejaría en un incremento de β (DRE), lo cual no registramos pero sí observamos una correlación entre la disminución o aumento de θ con lo inverso de α y una mejor respuesta motora con diferencias interhemisféricas que se manifiestan con mayor intensidad en el HD, el cual, en la mayoría de los niños, representa el H subrogado. Las modificaciones descritas de θ y α se explican como resultado de la integración funcional de circuitos sensoriales centroencefálicos–tálamo–corteza específicos e inespecíficos relacionados con la generación del ritmo α, mientras que el ritmo θ se relaciona con los circuitos límbicos, que participan en la integración de la memoria.
Palabras clave: EEG, ritmos theta, alfa y beta, modificaciones por habituación y condicionamiento, maduración EEG y motora, procesos cognitivos.
INTRODUCCIÓN
En vigilia, los cambios del medio externo activan los procesos sensoriales por intermedio de los receptores y conexiones específicas generando, por un lado, la sensación en cada una de las vías correspondientes (visual, auditiva, olfatoria, gustativa, somática) y, por otra, la respuesta somática y vegetativa (atención inespecífica o reflejo de orientación). Los cambios electrobioquímicos generados por esos estímulos y las modificaciones de los ritmos EEG (desincronización o sincronización relacionada a un evento DRE/SER),1,2 al propagarse en las áreas corticales específicas (corteza visual) e inespecíficas (corteza parietal, frontal), se suman algebraicamente a los cambios de potenciales que generan las respuestas corporales tanto vegetativas como somáticas (conducta externa e interna del sujeto). Con esto y las nuevas señales que provocan las mismas respuestas (servo–información de los cambios corporales, e internos por la <<recompensa>> comida,3,4 por ejemplo, con sus factores emocionales, de agrado) se integran la percepción (<<darse cuenta de>>), se incrementa la vigilia, la motivación y se establecen los modelos neurofuncionales de expectativa.5 Estos cambios morfofuncionales de los circuitos neurogliales se empiezan a producir en el cerebro de los bebés con el simple hecho de ver, de oír, etcétera, a las personas que los rodean.6,7 Este cúmulo de señales produce cambios en los circuitos neurogliales participantes y se guarda como la <<clave neurosináptica>> que representa la información de la señal recibida, del tipo de respuesta emitida y las consecuencias de la misma para la conservación de la homeostasis del organismo (memoria a corto y largo plazo en sus diferentes tipos, sensorial, motor y recompensa de la misma).
Diversos factores pueden alterar la integración morfofuncional de dichos circuitos glioneuronales produciendo alteraciones de la capacidad de detectar, codificar y decodificar los cambios del ambiente (trastornos de atención, TDA), de integrar las <<claves correspondientes>> con su simbolismo (integración de la información, electro–morfograma sensorio–motor).8 Así mismo, pueden producirse alteraciones en la regulación del tipo e intensidad de las respuestas somáticas y vegetativas, lo cual puede llevar al sujeto a presentar respuestas inadecuadas, primero en el contexto familiar y luego en el social: hiperactividad, impulsividad, desafío de reglas.9 La discapacidad de identificar señales e integrar respuestas coordinadas adaptativas correctas genera comorbilidades que se suman a la enfermedad inicial de TDA.
El TDA y sus comorbilidades se han convertido en enfermedades de alto impacto socioeconómico y cultural, aún más al demostrarse que persisten en la adolescencia y en la vida adulta, las cuales se agravan en las mujeres.10–14 El TDA en la mujer adulta tiene un mayor impacto en la sociedad mexicana, debido a que la participación de la mujer es fundamental para su correcto funcionamiento.15
Es indispensable elaborar y establecer procesos diagnósticos objetivos de alta precisión, que aseguren la detección temprana de estas alteraciones en bebés, en niños y su ratificación en adolescentes y adultos. Para lograrlo se utilizan, por un lado, procedimientos clínicos que, de acuerdo a las indicaciones del CIE 10, analizan los síntomas pero aún no se desarrollan procesos de exploraciones físicas que establezcan <<signos>> diagnósticos del neurodesarrollo o de neurodegeneración, que identifiquen alteraciones morfofuncionales de los circuitos glioneuronales en los primeros años de la vida o en los adultos.
Actualmente se acepta que todas las manifestaciones conductuales externas e internas (incluyendo: memoria, pensamientos, percepciones, etcétera) resultan de la actividad neuro–eléctrica–bioquímica del Sistema Nervioso (SN), siendo el EEG el registro de la actividad eléctrica de las neuronas y terminales sinápticas en la corteza cerebral, se le propone como un procedimiento para establecer los estándares de comparación que apoyen diagnósticos más precisos y en tiempos apropiados del neurodesarrollo en niños y de la posible neurodegeneración incipiente en adultos, cuando todavía no se manifieste la enfermedad neurológica o psiquiátrica, y que represente tan sólo una incapacidad manejable por neuro–rehabilitación, misión fundamental del INR.
Con estos objetivos estamos desarrollando una serie de trabajos de investigación clínica que se han iniciado con la integración de una base de datos electrónica de los niños que acuden al INR, analizando el EEG en condiciones de reposo con los parpados cerrados (OC) y abiertos (OA). Con ello pretendemos establecer patrones de comparación de las cuatro frecuencias de banda ancha delta (δ), theta (θ), alfa (α) y beta (β) de niños de tres a 15 años separados en cuatro grupos,* así como sus modificaciones en niños clasificados con TDA o sin TDA.**
Actualmente se acepta la hipótesis de que la desincronización de α y de β relacionada a un evento (DRE) es reflejo de activación cortical con incremento de excitabilidad neuronal en las áreas corticales relacionadas con los procesos de coordinación sensoria–motora;16,17 por lo tanto proponemos que las primeras estimulaciones incrementan la DRE que, al repetirse, irán produciendo sincronización (SER), lo cual se ha descrito como habituación de la desincronización del EEG.18 Además, es posible que se invierta este cambio DRE–SRE al darle significado a la misma estimulación, es decir, al indicarle al sujeto que presione un botón al inicio de dicha estimulación y lo realice varias veces (condicionamiento). En este trabajo presentamos los cambios de los ritmos θ, α y β ante la fotoestimulación repetida (FR) 20 veces con las mismas características, análisis del proceso de habituación, y además en la condición en la cual el sujeto tiene que presionar con su mano dominante un botón al inicio de dicha estimulación, constituyendo un siguiente tipo de aprendizaje.
SUJETOS Y MÉTODO
Se atendieron 124 niños que acudieron al INR por indicaciones del personal escolar o por invitación abierta a todos los niños efectuada por profesionales del INR en escuelas públicas del suroeste del Distrito Federal, México, sin distinción de género, que estuvieran dentro del rango de tres a 15 años, y que fueron separados en cuatro grupos: 1. de tres a seis; 2. de seis y medio a nueve; 3. de nueve y medio a 12 y 4. de 12.5 a 15 años. El estudio se inició con una historia clínica, indagando la posible presencia de retraso del desarrollo físico–emocional–intelectual, de epilepsia de cualquier tipo o que en los seis meses anteriores hubieran recibido tratamiento médico o psicológico y, por último, que no pudieran controlar su conducta durante el registro del EEG (como se explica más adelante), convirtiéndose en los factores de exclusión. A los padres de familia se les explicó en qué consiste el estudio, haciendo énfasis en que es un procedimiento no invasivo (de bajo riesgo), que no produce molestias o dolor y permite analizar la actividad eléctrica del cerebro de sus niños, que continuaran alimentándolos como de costumbre y no los desvelaran. Al comprender y aceptar, firmaron el formato de autorización que utiliza el INR. A los niños se les explicó de modo sencillo y con símiles cómo funcionan <<las baterías de su cerebro>>, asimismo se les daba un electrodo para que lo palparan y se lo colocaran en la frente, se les pedía que se mantuvieran lo más inmóviles posible con los parpados cerrados (OC), sin parpadear ni mover los globos oculares o contraer los músculos faciales, si no lo lograban no se realizaba el registro en esa ocasión. En algunos niños del G1 fueron necesarias hasta tres sesiones para obtener un buen registro y en los otros grupos de una a dos citas. No obstante, varios niños no lograron dejar de parpadear o mover los ojos, contraer los músculos masticadores, orbiculares y frontales, lo que los eliminaba de la muestra; esto se exageró en algunos niños en la condición de asociación fotoestimulación–presión del botón. Dichos factores de exclusión dejaron una muestra de 94 niños para análisis de la habituación y 47 para el condicionamiento simple.
Patrón de registro. En todos los niños se realizó el EEG en decúbito dorsal, con poca iluminación ambiental y relativa disminución de estímulos sonoros, con un electroencefalógrafo digital Viasys Nicolet One, de 24 canales distribuidos de acuerdo con el sistema internacional 10/20 con los montajes bipolares antero–posterior para–sagital. Además se registraron los movimientos oculares y el EKG. Después de 5 min de registro con párpados cerrados (OC) se procedía con la FR a 5 destellos/s durante 2s repetida 20 veces con un intervalo variable de 21 a 25s. Al terminar la serie se dejaban pasar de 2 a 5 min, se continuaba con el registro del EEG y enseguida se les ponía en la mano dominante un aditamento redondo con un botón en su extremo, indicándoles que debían apretarlo inmediatamente al iniciarse la FR y liberarlo al término de la misma.
El análisis con ancho de bandas entre 1.6 y 40 Hz comprobó que no se registraron electrogramas anormales. Del registro se seleccionaron manualmente de las derivaciones bipolares (HI: Fp1–F3, F3–C3, C3–P3, P3–O1 y HD: Fp2–F4, F4–C4, C4–P4, P4–O2) muestras de 2s antes durante y después de la 1era, 5ª, 10ª, 15ª y 20ª FR y para la asociación FR–presión del botón se agregó la medición de la latencia de la respuesta. A las muestras se aplicó la TR de Fourier y se calculó la Potencia Absoluta (PA) de las frecuencias θ (4.0 a 7.5 Hz), α (8.0 a 12.5 Hz) y β (13 a 20 Hz), se calculó el promedio en cada H y de ambos hemisferios (AH). Para la elaboración de las gráficas se utilizó el programa Excell y para los cálculos estadísticos se usó SPSS aplicando la prueba de Wilcoxon para muestras relacionadas con α >0.05.
RESULTADOS
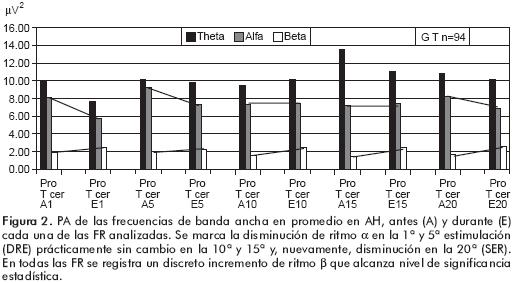
En todos los niños, el EEG con los parpados cerrados presentó las ondas representativas de la actividad δ, θ, α y β en todas las regiones de AH. En general, la PA de los ritmos lentos (δ y θ) es mayor en las regiones cerebrales anteriores y en algunos sujetos también presentan mayor PA de ondas de ritmo β, mientras que la PA del ritmo α es mayor en las regiones mediales y posteriores. Al analizar el promedio de la PA de dichas frecuencias, se observó que están por debajo de 10 µV2. La 1ª FR produce disminución de la PA de θ y de α con incremento de β, tanto en cada hemisferio como en el promedio de AH, como se ilustra en la figura 1.

En la 5ª FR se sigue presentando la disminución de la PA de ambos ritmos θ y α con incremento de β. En la 10ª FR es menor la disminución de la PA de θ y α y persiste el incremento de la PA de β. En la 15ª FR se vuelve a disminuir la PA de θ, pero aumenta la de a en el HI y disminuye un poco en el HD. En AH se incrementa la PA de β. En la 20ª FR se vuelve a disminuir la PA de ambas θ y a en AH, sin embargo, la diferencia es menor de lo registrado durante las otras estimulaciones. La PA del ritmo β sigue aumentando en AH. Después de la estimulación, las PA de las frecuencias analizadas regresan casi a su nivel previo. Los datos estadísticos indican que el incremento de β siempre alcanzó valores significativos mientras que la disminución de a sólo fue significativa en la 1ª FR y, en la 10ª, la disminución de θ alcanzó significancia estadística.
En el análisis de la FR en cada grupo de niños, lo primero que llama la atención es la mayor PA de las tres frecuencias en los niños del G1, con predominio de theta que alcanza valores del doble de magnitud que el grupo total. Lo segundo es que la 1ª FR produce incremento de la PA de las tres frecuencias analizadas (figura 3). Los datos estadísticos del G1 indican que la PA del ritmo β alcanza niveles de significancia en todas las FR, excepto en la 5ª en el HD y en las 10ª y 15ª en el HI. El incremento de la PA de α no alcanza valores significativos y θ lo alcanza en la 5ª estimulación en el HD.
En el G2 se registra una acentuada disminución de la PA de θ con permanencia de la PA de las otras frecuencias. Los datos estadísticos del G2 indican que el incremento de la PA de β sigue alcanzando significancia en AH, excepto en la 5ª FR. La disminución de a es significativa en el HI ante la 1ª FR y en el HD en la 5ª, en la cual también disminuye la PA de θ. [Figura 4]
En el G3 sigue disminuyendo la PA de θ con relativa permanencia de la PA de los otros ritmos del EEG. En este grupo ante la 1era FR la disminución de la PA de θ y de a con incremento de β es más notable, así como en la 5ª. Sin embargo, en la 15ª y 20ª se registra un incremento de las tres frecuencias, mientras que en la 20ª únicamente se mantiene el incremento de β, que siempre alcanza valores significativos.
En el G4 se registra una mayor disminución de la PA de θ con incremento de α, de tal manera que en la figura 5 se observan las columnas del histograma al revés de lo que se mostró en las otras figuras. La FR produce una clara disminución de la PA de θ y de a en la 1ª y 5ª (DRE), mucho menor en la 10ª e inversión en la 15ª y 20ª (SRE), aunque en esta última se observa una disminución acentuada de la PA de las tres frecuencias.
Los registros en la situación de condicionamiento simple se inician después de la explicación de lo que debe efectuar el niño y de probar que aprieta el botón, registrándose la señal correspondiente en el EEG. El análisis del promedio del grupo total de niños muestra un incremento de la PA (arriba de 12 µV2) comparada con la registrada al empezar la etapa de FR (menos de 10 µV2). En la 1ª asociación (Aso) se registra una disminución de la PA de θ y de a incluyendo una discreta disminución del ritmo β, la latencia de respuesta es de 930 ms (con fines de ilustración en las gráficas dicho valor se dividió entre 100). En la siguiente Aso analizada (5ª) se registra discreta disminución de θ con pequeño incremento de α y de P y la latencia disminuye a 750 ms. En la 10ªy 15ª Aso continúa el incremento de la PA de las tres frecuencias y la latencia disminuye a 650 y 640, respectivamente. Mientras que en la 20ª Aso el incremento de la PA de cada ritmo es menor y la latencia se incrementa a 750 ms. [Figura 6]
En el análisis por grupo, encontramos que en el G1 todo el tiempo se registra una mayor PA de ritmo θ. Ante la 1ª Aso se disminuye la PA de θ y de α, en forma sorpresiva no se incrementa β, y la latencia es de 1020 ms. En la 5ª Aso sigue disminuyendo a pero θ aumenta y en la 10ª estos ritmos aumentan, la latencia disminuye a 940 ms. En la 10ª aumentan θ y a y la latencia es de 680 ms. En la 15ª Aso aumentan 8 y a y la latencia se incrementa a 810 ms y, por último, en la 20ª vuelve a disminuir a, sin embargo, la latencia aumenta a 970 ms. La actividad θ aumenta en la 5ª Aso y en todas las demás disminuye. La disminución de θ en la 1ª Aso alcanza una p=0.008 en el HI y la disminución de a alcanza p=0.047 en el HI y de 0.028 HD en la 20ª Aso.
En el G2 disminuye la PA de las tres frecuencias comparada con las del G1. En la 1ª Aso se disminuyen las tres frecuencias, la disminución de a en el HI alcanza una p=0.030 y en el HD de 0.067, la disminución de θ es significativa en el HD (p=0.052) y la latencia es de 960 ms. En la 5ª se disminuye θ y a aumentando β, la latencia es de 930 ms. En la 10ª se incrementa θ y disminuye a sin cambio importante en β, la latencia es de 630 ms. En la 15ª se aumentan θ, α y β, pero sólo el incremento de β alcanza una p=0.002, disminuyendo la latencia a 570 ms y, por último, en la 20ª aumentan θ y α, el cambio de β da una p=0.05, pero la latencia aumenta a 700 ms.
En el G3, en los intervalos entre estimulaciones se registra la menor PA de las tres frecuencias, siendo más importante la de θ, debido a lo que parece un incremento relativo de α. En la 1ª Aso se disminuyen casi al 50% los ritmos θ y α y muy poco β, la latencia es de 840 ms. En la 5ª, se incrementa θ y α, disminuyendo β, la latencia es de 560 ms. En la 10ª y 15ª disminuyen θ y α con incremento de β y la latencia aumenta a 580 ms y 630 ms, respectivamente. En la 20ª, se incrementa θ y no cambian α ni β, sin embargo, la latencia es de 750 ms. En este grupo sólo la disminución del ritmo θ en la 1ª Aso alcanza una p=0.008 en el HD y en la 20ª sólo el incremento de β alcanza una p=0.014.
En el G4, la disminución de θ es tan importante que parece que se incrementa la PA de α. En la 1ª y 5ª Aso, se disminuye la PA de θ y α, con discreto incremento de β en la 5ª Aso, después se aumenta considerablemente la PA de α y siempre se registra disminución de β ante la FR que le indica al niño que debe presionar el botón, la latencia inicial 510 ms, disminuye a 350 ms, se mantiene en 350 ms y en la 15ª aumenta a 360 ms, en la 20ª la latencia es de 460 ms. En este grupo, en la 1era Aso, la disminución de a alcanza una p=0.043 en el HD; en la 10ª solamente el incremento de β en el HD alcanza valor significativo de p = 0.043. En la 15ª, el incremento de β en AH presenta una p = 0.043 (figura 7).
Es importante mencionar que la latencia de presionar el botón disminuye en relación con la edad cronológica y tiende a disminuir aún más al repetir las asociaciones.
DISCUSIÓN
El promedio del grupo total de niños en la situación de FR muestra en promedio una PA de las frecuencias no mayor de 10 µV2 en todas las derivaciones, mientras que, en la situación de condicionamiento, la PA se aumenta a más de 12 µV2, indicando un incremento de la actividad espontánea cerebral relacionable con la situación de expectativa.
El análisis del EEG por grupo de edad encuentra mayor potencia del ritmo θ en los niños menores que disminuye al aumentar la edad con relativo incremento del ritmo α, alcanzando su máximo en el G4. En los cuatro grupos, por la FR, se nota una tendencia ondulante con disminución de la desincronización del EEG que representa el aprendizaje calificado de habituación, aunque no se alcanza el nivel de sincronización que indique mejor inhibición de la respuesta al evento de FR, como se describe en los adultos que se habitúan con 10 estimulaciones,18 sugiriendo que en los niños no se ha desarrollado completamente la actividad inhibidora de control sensorial.19 Otro dato importante en los niños, que se oculta al efectuar promedios, es que, en respuesta a la fotoestimulación, la PA tanto de θ como de α en el G1 se incrementa ante la 1ª FR, lo cual no se observó en los siguientes grupos. Este hallazgo proporciona soporte a lo expresado arriba de que a esta edad predominan las influencias facilitadoras y todavía no se desarrollan los procesos de inhibición. Es importante mencionar que en el G2 se nota la disminución ondulante de la habituación, que coincide con la edad de ingreso a la enseñanza primaria, donde los niños tienen que aprender a discriminar con mayor cuidado los estímulos significativos de los no significativos,20 aunque esto se contradice en el G3 ya que estos deberían tener una mejor capacitación de habituarse. Los hallazgos en el G4 vuelven a apoyar la hipótesis previa, aunque por el reducido número de niños de este grupo no se alcanzan valores de significancia estadística, pero sí de importancia clínica que obliga a incrementar la muestra. Algo similar se observó en las situaciones de condicionamiento simple, lo calificamos así porque el paradigma utilizado no llena las características del condicionamiento clásico, ya que no aplicamos un estímulo incondicional. La respuesta de presionar el botón va mejorando simplemente en correlación con la edad cronológica, maduración conductual correlacionable con la disminución del ritmo θ e incremento de α. Lo sorprendente es que, de acuerdo a la hipótesis, el condicionamiento a nivel cortical se reflejaría en un incremento del ritmo β, que no registramos, lo que sí obtuvimos fue una correlación entre la disminución o aumento de ritmo θ con lo inverso del ritmo α y una mejor respuesta motora con ciertas diferencias interhemisféricas que, por lo general, se manifiestan con mayor intensidad en el hemisferio derecho, el cual en la mayoría de la población estudiada representa el hemisferio no dominante. Las modificaciones descritas de los ritmos alfa y theta se explican como resultado de la integración funcional de los circuitos sensoriales centro–encefálicos–tálamo–corteza específicos e inespecíficos relacionables con la generación del ritmo α; mientras que el ritmo theta resulta de la integración de los circuitos límbicos, principalmente del hipocampo,4,21 que participa en la integración de los electro–morfogramas que representan la consolidación de la memoria. Con este trabajo integramos las magnitudes de los diversos ritmos de banda ancha registrados en las diferentes edades cronológicas de los niños en una base de datos, que al incrementarla tendrá valores estadísticos que nos permitirán apoyar los diagnósticos de las alteraciones conductuales de los niños con metodologías más precisas y así poder continuar con la identificación de las modificaciones del EEG por factores familiares, sociales y de educación.22–25 Sin embargo, no pudimos establecer una relación directa y estadísticamente significativa de los cambios del EEG con la edad de los niños, probablemente debido, por un lado, a que ambos procesos, habituación y condicionamiento, son como casi todas las respuestas biológicas fenómenos ondulantes, y escogimos analizar cinco de 20 estimulaciones a intervalos de cinco en cinco y, por otro lado, al hecho de haber promediado las frecuencias analizadas de todas las regiones de cada hemisferio cerebral. Esta hipótesis la estamos evaluando en un siguiente trabajo, contando con un nuevo programa de análisis del EEG que, en forma automática, digitaliza la actividad de todos los canales y obtiene promedios de los registros durante las 20 FR y las 20 asociaciones, aplicando transformaciones que analizan las bandas de frecuencias sin asumir que son constantes en el tiempo como lo hace la TR de Fourier. Además, este programa permitirá efectuar una distribución topográfica por frecuencia en las diversas regiones cerebrales y continuar el análisis de los procesos de atención, percepción y lenguaje.26
AGRADECIMIENTOS
Nuestro reconocimiento a la técnica electroencefalografista señora Ofelia Ornelas Sánchez y a la señora Ingrid Mascher G. por la revisión del manuscrito.
REFERENCIAS
1. Neuper C, Pfurtscheller G. Event–related dynamics of cortical rhythms: frecuency–specific features and functional correlates. Int J Psychophysiol 2001;43(1):41–58. [ Links ]
2. Pfurtscheller G, Neuper C, Berger J. Source Localization Using Event–Related Desynchronization (ERD) within the alpha band. Brain Topography 1994;6(4) :269. [ Links ]
3. Dommett E, Coizet V, Blaha CD, Martindale J, Lefebvre V et al. How visual stimuli activate dopaminergic neurons at short latency. Science 2005;307:1476. [ Links ]
4. Llinas RR. Fisiología de la cognición y su relación (con el síndrome de la disritmia talamocortical. En <<Bases neuronales de la conciencia y sus modificaciones en neurología y psiquiatría>>. Academia Nacional de Medicina, sesión especial del 28 de noviembre de 2002. [ Links ]
5. Kandel ER, Schwartz JH, Jessel TM. Cognition and the cortex in essentials of neural science and behavior. Appleton and Lange; 1995; pp 347–366. [ Links ]
6. Millar G. Reflecting on another's mind. Science 2005;308:945–947. [ Links ]
7. Rizzolatti G, Fogassi L, Gallese V. Mirrors in the Mind Scientific American. October, 2006. [ Links ]
8. Damasio A. The feeling of what happens: body and emotion. En: The making of consciousness. New YorK: Harcourt Brace; 1999; pp 386. [ Links ]
9. Grupo de expertos nacionales para el estudio del trastorno por déficit de atención e hiperactividad (GENPETDAH AC). Primer consenso latinoamericano sobre el trastorno por déficit de atención e hiperactividad, México 2007. [ Links ]
10. Staller J, Faraone SV. Attention–deficit hyperactivity disorder in girls: epidemiology and management. CNS Drugs 2006;20(2):107–123. [ Links ]
11. Biederman, J, Faraone SV, Mick E et al. Clinical correlates of ADHD in females: findings from a large group of girls ascertained from pediatric and psychiatric referral sources. J Am Acad Child Psychiatry 1999;38(8): 966–975. [ Links ]
12. Muller BW, Gimbel K, Keller–Pliessnig A, Sartory G, Gastpar M et al. Neuropsychological assessment of adult patients with attention–deficit/hyperactivity disorder. Eur Arch Psychiatry Clin Neurosci 2007;2:112–119. [ Links ]
13. Rucklidge JJ, Kaplan BJ. Psychological functioning of women identified in adulthood with attention–deficit/hyperactivity disorder. J Attention Disorders 1997;2:167–176. [ Links ]
14. Biederman J, Mick E, Faraone SV, Braaten E, Doyle A et al. Influence of gender on attention deficit hyperactivity disorder in children referred to a psychiatry clinic. American J Psychiatry 2002;159:36–42. [ Links ]
15. Cisneros Madrid C. ¡Ah... las mujeres! Matriarcado. Sociedad Mexicana de Geografía y Estadística. México: 2008; Número, 232. [ Links ]
16. Neuper C, Wörtz M, Pfurtscheller G.ERD/ERS patterns reflecting sensorimotor activation and deactivation. Prog Brain Res 2006;159:211–222. [ Links ]
17. Klostermann F, Nikulin VV, Kühn AA, Marzinzik F, Wahl M, et al. Task–related differential dynamics of EEG alpha– and beta–band synchronization in cortico–basal motor structures. Eur J Neurosci 2007;25(5) :1604–1615. [ Links ]
18. Amochaev A, Salamy A, Alvarez W, Peeke H. Topographic mapping and habituation of event related EEG alpha band desynchronization. Int J Neurosci 1989;49(3–4):151–155. [ Links ]
19. Kisley MACA; Sherrie DP, Randal GR, Levisohn PM. Freedman R. Early postnatal development of sensory gating. Neuroreport 2003;14(5) :693–697. [ Links ]
20. Gasser T, Verleger R, Bächer P, Sroka L. Development of the EEG of school–age children and adolescents. I. Analysis of band power. Electroencephalogr Clin Neurophysiol 1988;69(2) :91–99. [ Links ]
21. Brust–Carmona H, Brust–Mascher E, Mascher–Gramlich I. Aprendamos a aprender. México: Editorial Trillas; 2007. [ Links ]
22. Harmony T, Marosi E, Díaz de León AE, Becker J, Fernández T. Effect of sex, psychosocial disadvantages and biological risk factors on EEG maturation. Electroencephalogr Clin Neurophysiol 1990;75(6):482–491. [ Links ]
23. Otero GA, Pliego–Rivero FB, Fernández T, Ricardo J. EEG development in children with sociocultural disadvantages: a follow–up study. Clin Neurophysiol 2003; 114(10):1918–1925. [ Links ]
24. Somsen RJ, van't Klooster BJ, van der Molen MW, van Leeuwen HM, Licht R. Growth spurts in brain maturation during middle childhood as indixed by EEG power spectra. Biol Psychol 1997;44(3)187–209. [ Links ]
25. Klimesch W. EEG alpha and theta oscillations reflect cognitive and memory performance: a review and analysis Brain Research Reviews 1999;29:169–195. [ Links ]
26. Pulvermüller F, Birbaumer N, Lutzenberger W, Mohr B. High–frequency brain activity: its possible role in attention, perception and language processing. Prog Neurobiol 1997;52(5):427–445. [ Links ]
* Flores Avalos B, Sánchez Quezada A, Martínez Cortez J, Zambrano E, Brust–Carmona H. Características del EEG cuantitativo y su evolución en niños de 3 a 15 años que acuden al INR.
** Brust–Carmona H, Zambrano E, Martínez Cortez J, Sánchez Quezada A, Flores Avalos B. Caracterización de los ritmos del EEG de niños con o sin trastornos de atención.
*** Artículo sin conflicto de intereses














