Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Salud mental
versión impresa ISSN 0185-3325
Salud Ment vol.32 no.1 México ene./feb. 2009
Artículo original
La actividad Alfa frontal en insomnes primarios con dificultad para iniciar el sueño
Frontal alpha activity in primary insomniacs with sleep onset difficulties
Pedro Figueredo–Rodríguez1, Yolanda del Río–Portilla1, Jorge Iván Sánchez–Romero1, Alfonso Pérez–Ortiz1, María Corsi–Cabrera1*(**)
1 Laboratorio de Sueño. Facultad de Psicología. Universidad Nacional Autónoma de México.
*Correspondencia:
María Corsi–Cabrera.
Facultad de Psicología UNAM.
Fax: 56222316 y 56222310
E.mail: corsi@servidor.unam.mx
Recibido primera versión: 1 de octubre de 2007
Segunda versión: 27 de junio de 2008
Aceptado: 27 de agosto 2008
Abstract
Difficulty in sleep initiation, with or without objective signs, is one of the most frequent complaints in primary insomniacs.
The electroencephalographic (EEG) activity characteristic of waking (beta and alpha oscillations) is gradually replaced by the EEG signs of sleep (sleep spindles and theta/delta waves) during the sleep onset period (SOP) in normal subjects. The decrease in fast oscillations occurs at the first signs of stage 1, whereas theta and delta increase occurs later, indicating that waking promoting mechanisms are turned off before sleep–promoting mechanisms are fully started. It could be therefore hypothesized that difficulty in sleep initiation in insomniacs might be due to either a hyperactivation of waking promoting systems, a weakness of sleep promoting mechanisms or an imbalance between them.
Quantitative EEG analysis has revealed higher beta during wakefulness, as well as during sleep and lower slow (delta) activity in insomniacs. The presence of alpha activity during cognitive information processing, especially of slow alpha activity in relation to attention, as well as in some pathologies associated to sleep disturbances, has suggested that alpha activity during sleep is a sign of activation; however, alpha activity during sleep has been less studied in insomniacs. Only broad bands have been considered in all of the aforementioned studies, and in almost all of them the analyses were restricted to central regions. It is therefore important to study the entire frequency spectrum of EEG activity in insomniacs.
Sleep initiation does not occur simultaneously over the entire cortex but starts as a local process which gradually invades the rest of the cortex, in which the frontal lobes play a crucial role. Frontal and parietal regions are part of an important network involved in attention and conduction of thought. Thus, quantitative analysis of narrow EEG bands and their distribution in the cerebral cortex may contribute to a better understanding of neural mechanisms compromised in etiology of sleep initiation in primary insomnia.
The main objective of the present investigation was, therefore, to analyze the spectral power of narrow EEG bands in the 19 derivations of the 10–20 International System during SOP in primary insomniacs with difficulty in sleep initiation.
Given that one of the main complaints of insomniacs is the difficulty to initiate sleep and that hyperarousal is one of the factors proposed to be involved in the etiology of insomnia, EEG activity during SOP of the first night in the laboratory was analyzed to control activating effects of surrounding circumstances and isolate permanent EEG characteristics.
Subjects were 19–34 years old, right–handed with primary sleep insomnia, which were thoroughly screened via structured psychiatric, medical and sleep interviews and scales. Subjects were younger and the age range was narrower than in other EEG frequency spectral content studies of primary insomniacs to avoid confounding effects of changes in sleep architecture or in EEG generated by development.
All patients met the criteria for primary insomnia with sleep onset difficulty and impaired daytime function on three or more nights per week for at least six months and with no medical, psychiatric or neurological conditions; they were not medicated and had no other sleep disorders. Participants taking sleep medications or other drugs (urine test), respiratory or sleep disorders such as apnea and periodic limb movements (PSG) were excluded.
The control group (n = 9) was matched for age and dexterity, but had no complaints of insomnia and reported their sleep as restorative and satisfactory.
All participants underwent a single night of standard polysomnography (EEG, EOG and EMG) in the laboratory. In addition, the 19 electrode sites of the 10–20 International System referred to ipsilateral earlobes, oral–nasal airflow and anterior tibialis EMG were recorded. PSG was scored in 30 sec epochs, blind to the subject group according to Rechtschaffen and Kales criteria.
EEG from SOP (lights out to consolidate sleep), defined as 3 consecutive minutes of delta sleep, was digitized at 1024 Hz with 12 bits resolution and filter settings of 0.03–70 Hz. EEG was segmented into two–sec non–overlapping epochs and inspected for artifacts.
All artifact–free epochs were Fast Fourier Transformed and absolute (AP) and relative power (RP: AP in each Hz bin/total spectrum power × 100) was obtained for 1 Hz bins. AP and RP was log–transformed before statistical analysis, and was averaged over each derivation and sleep stage of SOP. Group differences were compared by means of Student's t tests and probability level was set at p<0.05.
In contrast with healthy controls, insomniac patients exhibited higher alpha RP (7 and 8 Hz) over all frontal derivations during stage 2 of SOP and higher RP of isolated beta and gamma frequencies during wakefulness.
PSG of both groups showed the <<first night effect>> with decreased total sleep time, decreased sleep efficiency index and REM sleep percentage compared to normal values for the 20–30 age decade; PSG variables were not significantly different between the two groups except for wakefulness percentage during SOP.
Insomniacs did differ from controls in subjective estimation of sleep quality and continuity in spite of similar PSG.
The absence of significant differences between insomniacs and controls in sleep EEG activity (delta, theta and sigma frequencies) suggests that sleep homeostatic function is preserved in insomniacs, which agrees with results obtained in other studies after partial sleep deprivation.
The absence of a stronger promoting effect of insomnia in the insomniac group by the first recording night indicates that EEG characteristics found in this group cannot be attributed to external stimuli nor surrounding circumstances and rather suggests a more stable alteration; however, further studies of larger groups and other age spans are needed to confirm present results.
The evidence mentioned above suggests an imbalance between waking and sleep promoting mechanisms in primary insomniacs with difficulty in sleep initiation and sleep perception. Attention depends not only on vigilance level, but also on frontal regions which, together with posterior association areas, conform an essential network for purposive endogenously guided attention. The presence in insomniacs of alpha activity in frontal regions, which is a sign of top–down control of attention, and its absence in posterior regions during stage 2 suggests the persistence of a certain level of endogenous attention during stage 2 of SOP, which contributes in turn to the subjective perception of sleep onset difficulties and bad sleep quality.
Key words: Primary insomnia, EEG, alpha activity, polysomnography, frontal lobe.
Resumen
La dificultad para conciliar el sueño es uno de los síntomas más frecuentes del insomnio primario. La apreciación subjetiva de un periodo prolongado de latencia al sueño, aun en presencia de signos de sueño, puede deberse a la coexistencia de los mecanismos promotores de la vigilia y del sueño, y la lucha por el predominio de uno de ellos.
La red de atención ejecutiva, conformada por las áreas de asociación frontales y parietales, cumple un papel de particular importancia en el control endógeno de la atención y en la regulación del alertamiento por parte de la corteza. Las frecuencias del EEG en el rango de actividad alfa lenta (7 y 8 Hz) participan en los procesos cognoscitivos activos de la vigilia, especialmente en la atención y la memoria, y son indicadoras del control corticofugo, o top–down, de estos procesos. Sin embargo, el análisis cuantitativo del EEG durante el proceso de conciliación del sueño en los insomnes se ha centrado fundamentalmente en la actividad delta, theta y beta, y únicamente en las regiones centrales (C3 y C4), de tal forma que el análisis de banda estrecha del EEG y su distribución en toda la corteza podría contribuir a una mejor comprensión de los mecanismos neurales comprometidos en la etiología del insomnio primario.
El objetivo principal de esta investigación es, por lo tanto, analizar el espectro de frecuencias con resolución de 1 Hz en todas las derivaciones del Sistema Internacional 10–20 en insomnes primarios crónicos durante el periodo inicial del sueño (PIS) y comparar a estos últimos con un grupo control. Con el fin de aislar las características del EEG de los insomnes de causas circunstanciales, se analizará la primera noche de PSG igualando en ambos grupos el efecto activador que ejerce el medio circundante sobre el Sistema Nervioso Central, el estado psicológico y la arquitectura del sueño.
Se estudiaron nueve pacientes insomnes primarios cuya queja principal era la dificultad para iniciar el sueño y nueve sujetos controles libres de problemas de sueño, diestros y entre 19–34 años de edad. Se realizó la PSG durante la primera noche en el laboratorio siguiendo los procedimientos estándar y adicionalmente se registraron las 19 derivaciones del Sistema Internacional 10–20. Se obtuvieron los espectros de potencia del EEG de todas las derivaciones con resolución de 1 Hz del PIS (tiempo comprendido entre las buenas noches y el sueño consolidado: 3 minutos consecutivos de sueño delta).
Los insomnes tuvieron mayor actividad alfa lenta (7 y 8 Hz) en las regiones frontales durante la etapa 2 del PIS y de algunas frecuencias rápidas (beta y gamma) en la vigilia; subestimaron la calidad de sueño; y mostraron el mismo efecto de primera noche que los controles.
La ausencia de diferencias entre los dos grupos en el EEG típico del sueño (delta, theta y sigma) sugiere que los insomnes tienen preservada la función homeostásica del sueño. La ausencia de diferencias en la PSG de los insomnes y controles indica que la dificultad para conciliar el sueño del grupo de insomnes no se encuentra en estímulos externos ambientales ni en condiciones circunstanciales y sugiere que se debe a alteraciones más permanentes.
El conjunto de estas evidencias apunta hacia una alteración de la vigilia en concordancia con las hipótesis que proponen que el insomnio tiene un componente primordial de activación fisiológica y psicológica. La atención depende, además del nivel de vigilancia, de las regiones frontales que, junto con las áreas posteriores de asociación, conforman una red esencial para la atención dirigida endogenamente. La presencia de ritmo alfa en las regiones frontales y su ausencia en las áreas posteriores durante la etapa 2 en los insomnes podría reflejar la permanencia de cierto nivel de atención endógena durante la etapa 2 del PIS y podría constituir un mecanismo alterado del sistema frontal subyacente a la dificultad para iniciar el sueño.
Palabras clave: Insomnio primario, EEG, actividad alfa, polisomnografía, lóbulo frontal.
INTRODUCCIÓN
El insomnio se caracteriza por una dificultad repetida para iniciar, mantener y consolidar el sueño, por una mala calidad del mismo y por sus consecuencias diurnas. Un síntoma frecuente es la estimación subjetiva de una latencia prolongada al sueño,1,2 que a veces se acompaña de signos objetivos, pero frecuentemente no se correlaciona la evaluación subjetiva y la latencia al sueño determinada en la polisomnografía (PSG).3–7
A pesar de su prevalencia,8 la etiología del insomnio aún se debate. Los insomnes tienen mayor activación cerebral en vigilia6,9,10 y en sueño,11,12 mayor temperatura, metabolismo,13 tono simpático14 y activación psicológica, intromisión de pensamientos, estrés subjetivo, procesamiento de información, atención y memoria.3,5,15 La activación cerebral, fisiológica y psicológica ha conducido a postular un estado generalizado de mayor activación o hipervigilancia,16 en tanto que la disminución de la actividad delta durante el sueño ha servido para proponer también una debilidad de sus mecanismos.4,11,12,17,18
Al iniciar el sueño, la actividad EEG de la vigilia y del alertamiento (alfa, beta y gamma), que depende de mecanismos activadores globales, se sustituye paulatinamente por husos de sueño, complejos K y ondas delta y theta que dependen de mecanismos promotores de sueño. La entrada al sueño, por lo tanto, depende de la caída de los mecanismos promotores de la vigilia y de la puesta en marcha de los del sueño, que compiten en el nivel de la red tálamo–cortical.19 El análisis cuantitativo del EEG del periodo inicial del sueño (PIS) ha revelado que la disminución de la actividad rápida ocurre desde el inicio de la E1, cuando todavía no hay incremento de delta y theta, lo que indica que la disminución de los mecanismos promotores de la vigilia aparece antes de que se activen los mecanismos promotores del sueño. El predominio de los mecanismos de vigilia y/o la debilidad de los del sueño, o su desequilibrio, puede conducir, por lo tanto, a la dificultad para iniciar el sueño en los insomnes.20
La red de atención ejecutiva, conformada por las áreas de asociación frontales y parietales21 ejerce un control corticofugo, o top–down, sobre la red tálamo–cortical. La actividad alfa lenta (7 y 8 Hz) participa activamente en los procesos de atención y memoria e indica el control endógeno cortical de la atención y el alertamiento.22 El análisis cuantitativo del EEG de los insomnes durante el PIS se ha centrado en la actividad delta, theta y beta en las regiones centrales, dejando fuera la actividad alfa y el resto de la corteza, excepto por algunos trabajos aislados.11,12,22 Dado que los insomnes tienen mayor activación psicológica (atención), el análisis espectral del EEG en toda la corteza, particularmente en las regiones fronto–parietales, facilitaría la comprensión de los mecanismos neurales subyacentes a la dificultad para iniciar el sueño en los insomnes primarios.
Se ha postulado que la dificultad para conciliar el sueño en los insomnes crónicos se debe a una alteración intrínseca como factor predisponerte.23 Por lo tanto, el <<efecto de primera noche>>,24 considerado un modelo de insomnio agudo25 que altera la arquitectura del sueño y el estado psicológico, permitiría aislar las características EEG permanentes de las causas circunstanciales, y el EEG de la primera noche debería ser diferente entre insomnes y controles.
Teniendo en cuenta lo anterior, se analizó el EEG en banda estrecha en todas las derivaciones del Sistema Internacional 10–20, la estimación subjetiva de la cantidad y calidad de sueño, así como el nivel de hipervigilancia y ansiedad en un grupo de insomnes primarios crónicos con dificultad para iniciar el sueño y en sujetos normales sometidos a igualdad de circunstancias.
MÉTODO
Participaron nueve insomnes primarios crónicos (cinco mujeres y cuatro hombres) entre 19 y 32 años de edad, con menos de seis horas diarias de sueño por más de seis meses, cuya queja principal fue una dificultad para iniciar el sueño, y sin tratamiento farmacológico. Los insomnes se seleccionaron según los criterios para insomnio primario del DSM–IV.2 El grupo control tuvo nueve sujetos (tres mujeres y seis hombres) entre 19 y 34 años sin quejas de insomnio. Todos los participantes eran diestros26 y tenían años de escolaridad semejantes para no afectar la capacidad al momento de responder a cuestionarios y pruebas. La edad se restringió para evitar cambios en el EEG o en los patrones de sueño debidos a niveles hormonales o a la ontogenia.27,28 Se reclutaron en la Clínica de Sueño de la Facultad de Medicina de la UNAM y en la comunidad universitaria. Todos firmaron su consentimiento informado y se ofreció tratamiento a los insomnes. El proyecto fue aprobado por el Comité de Ética de la Facultad de Medicina.
Los criterios de no inclusión para ambos grupos fueron no exceder diariamente una copa de alcohol, 10 cigarrillos, una taza o un vaso de café, té, refresco de cola, chocolate u otras bebidas estimulantes. Tampoco debían ingerir drogas que afectaran el sueño o el EEG, o padecer depresión moderada o severa (puntaje ≥13 en el Inventario de Depresión de Beck,29,30 y ≥15 en la Escala de Hamilton).31 Todos completaron un diario de sueño durante dos semanas antes del estudio para eliminar aquellos con alteraciones circadianas. Un médico general especializado en medicina del sueño realizó una historia clínica detallada y una entrevista estructurada para la selección de los participantes, lo cual se corroboró con el Índice de Calidad del Sueño de Pittsburg32 y con la Escala de Insomnio de Atenas.33,34 Los criterios de exclusión fueron: alteraciones en el EEG de vigilia y sueño, síndrome de piernas inquietas, movimientos periódicos de los miembros y trastornos respiratorios durante el sueño detectados por la PSG; presencia de cocaína, anfetaminas, mariguana, opioides y benzodiazepinas en orina (Multi–Drug 6 Panel Urine Test, MEDIMPEX United Inc., 984 Bristol Pike, Bensalem, PA, 19020, Estados Unidos) o deseo de abandonar el estudio. Se eliminaron seis sujetos: cuatro por artefactos técnicos y dos por movimientos periódicos de los miembros, con lo que quedaron nueve en cada grupo. La PSG en las mujeres se programó entre el 5°–10° día de ciclo menstrual para evitar variaciones en el EEG.35 Se analizó el EEG de la primera noche en el laboratorio para igualar en los dos grupos el efecto activador del medio circundante y poder determinar así las características intrínsecas en los insomnes crónicos.
Se obtuvieron las siguientes variables dependientes: arquitectura del sueño de toda la noche y del PIS, espectro del EEG, calidad del sueño, niveles de ansiedad e hyperarousal y gravedad del insomnio. El PIS se definió como el tiempo comprendido entre las buenas noches y los primeros tres minutos consecutivos de sueño delta (etapa 3, etapa 4 o mezcla de ambas) o sueño consolidado.
Polisomnografía
La PSG se efectuó en el horario habitual de cada sujeto en una habitación faradizada, parcialmente sonoamortiguada y con adecuada aclimatación. Un experto sin conocimiento previo de la identidad del sujeto obtuvo, de acuerdo con Rechtschaffen y Kale,36 los registros de EEG (C3 y C4), EOG, EMG del mentón y la clasificación de las etapas del sueño. Se registraron además la actividad cardiaca, el flujo de aire naso–bucal y los músculos tibiales anteriores. Se determinó el tiempo total de sueño y su eficiencia, la latencia y porcentaje de las etapas 1 (E1), 2(E2), 3(E3), 4(E4), MOR y vigilia intra–sueño, y el número de movimientos del sueño total, mismas que para el PIS se calcularon hasta el criterio de consolidación.
Registro y análisis del EEG del PIS
Se registraron las 19 derivaciones del Sistema Internacional 10–20 referidas a A1 y A2 con un polígrafo Grass Modelo 8–20E con filtros entre 0.03 y 70Hz y se digitalizaron a 1024Hz con un convertidor analógico–digital de 12bits con el programa Gamma (versión 4.4).
El EEG del PIS se segmentó en épocas consecutivas de dos segundos y se descartaron los segmentos con artefactos. Se calculó el espectro de banda estrecha (1 Hz) de 1 a 50Hz de potencia absoluta (PA) y relativa (PR: PA de cada frecuencia sobre la PA de la banda total) con la Transformada Rápida de Fourier para cada época y derivación con el programa POTENCOR.37 Los resultados se promediaron para cada sujeto, etapa y derivación.
Escalas de evaluación
Se evaluaron la continuidad y la calidad del sueño mediante dos escalas subjetivas tipo Lickert: Continuidad y Estimación Subjetiva de la Calidad del Sueño.6 El nivel de ansiedad se midió con la Escala de Ansiedad (IDARE)38 usando sus dos escalas: la Ansiedad–Rasgo y la Ansiedad–Estado. El nivel de vigilancia se obtuvo con la Escala del Hyperarousal en la que un puntaje mayor de 41 es indicativo de hipervigilancia.39 Para obtener un valor cuantitativo del insomnio, se empleó el Indice de Gravedad del Insomnio,40 que según el puntaje obtenido lo clasifica en no significativo (0– 7), discreto (8– 14), moderado (15– 21) y grave (22– 28).
Análisis estadístico
Los resultados de las escalas de evaluación, de la PSG y de la PA y PR del PIS se compararon entre controles e insomnes mediante la t de Student (p<0.05). La PA y PR se transformaron a logaritmos para aproximarlos a una distribución normal.
RESULTADOS
El cuadro 1 muestra las características sociodemográficas de los grupos de insomnes y controles; a su vez, el cuadro 2 presenta los resultados obtenidos con las escalas utilizadas para la inclusión de los participantes. Como puede observarse, los resultados en el Índice de Calidad del Sueño de Pittsburgh y en la Escala de Insomnio de Atenas corroboran el diagnóstico clínico, así como la mala calidad y cantidad de sueño en el grupo de insomnes, y la buena calidad y cantidad de sueño en los controles. A pesar de cumplir ambos grupos con los puntajes establecidos como criterio de inclusión en el Índice de Depresión de Beck y en la Escala de Hamilton para la Depresión, el análisis estadístico muestra diferencias significativas en ambas escalas, que indican mayores niveles de depresión subclínica en los insomnes.


PSG de toda la noche y del PIS
Como se muestra en el cuadro 3, no hubo diferencias significativas entre grupos en la arquitectura del sueño de toda la noche ni del PIS. Solamente el porcentaje de vigilia durante el PIS fue significativamente mayor en los sujetos controles.

Análisis espectral del PIS
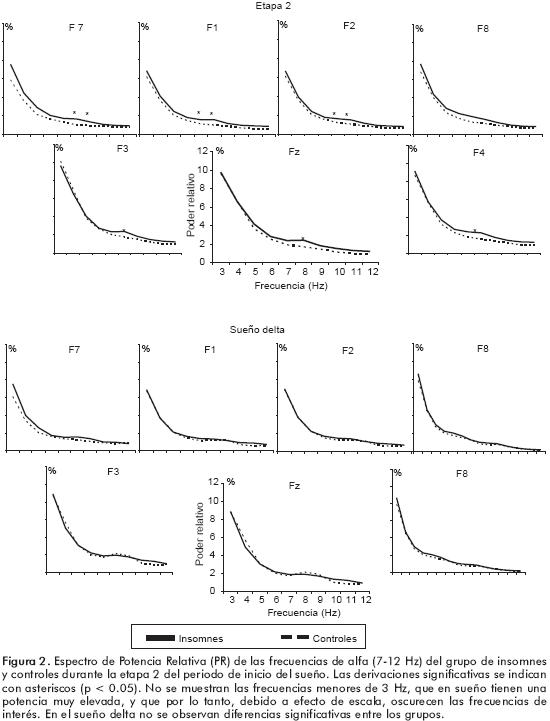
La figura 1 muestra el espectro de PR beta y gamma (18–50Hz) de la vigilia del PIS. Se observa mayor PR beta y gamma en los insomnes, significativa en frecuencias aisladas en el hemisferio izquierdo (F7, C3, P3, O1) y en Fz. Las diferencias desaparecen en E1, E2, así como en E3 y E4 después de alcanzar el criterio de consolidación del sueño.

Como puede verse en la figura 2, la PR de las frecuencias de alfa lenta (7 y 8Hz) fue significativamente mayor en los insomnes que en los controles sólo en la E2 en prácticamente todas las regiones frontales, y en 9 Hz en F7. La PR de algunas frecuencias lentas, 1 y 2Hz en T5, 2Hz en F7 y 6Hz en O2 fue también mayor en los insomnes. La PA no mostró diferencias significativas entre los dos grupos.
Escalas de evaluación
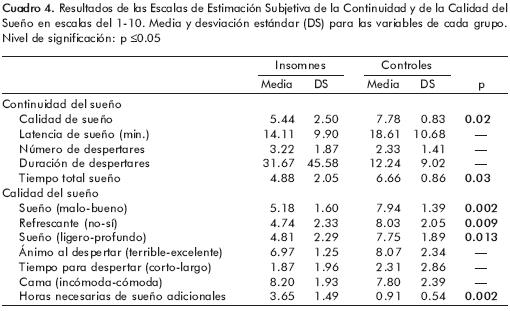
Como puede verse en el cuadro 4, los insomnes subestimaron la cantidad de sueño y refirieron menor calidad en ambas escalas, sueño menos reparador o refrescante y más ligero e insuficiente, a pesar de encontrar confortables las condiciones de registro. No difirieron en cambio en la latencia estimada de sueño, en el número y duración de los despertares y en el estado de ánimo al despertar. La latencia a E2 derivada de la PSG (media=8.80 min; DS=4.34) fue significativamente menor (p<0.007) que la estimación subjetiva (media=16.36; DS=10.26) en ambos grupos. No hubo diferencias significativas (p<0.31) entre la estimación subjetiva y la latencia a la E3 (media=19.33; DS: 6.61).
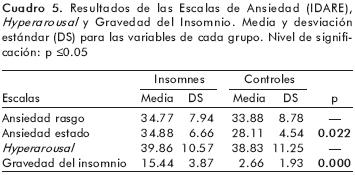
La gravedad del insomnio en los insomnes y su ausencia en los controles se confirmó con la Escala de Gravedad del Insomnio (cuadro 5). Los insomnes mostraron mayor grado de ansiedad estado que los controles, sin diferencias en la ansiedad rasgo, ni en el nivel de hipervigilancia.
DISCUSIÓN
El grupo de insomnes mostró un patrón de EEG durante el PIS diferente al grupo control; los insomnes tuvieron mayor PR de 7 y 8Hz, correspondientes con actividad alfa lenta en las regiones frontales en la E2 y mayor PR de algunas frecuencias rápidas de beta y gamma en el hemisferio izquierdo en la vigilia, y subestimaron la cantidad y calidad del sueño. Estas diferencias entre insomnes y controles se manifestaron a pesar de que el efecto de primera noche fue semejante en los dos grupos, por lo que no pueden atribuirse a las circunstancias ambientales y sugieren una característica intrínseca y distintiva de la dificultad para conciliar el sueño en insomnes crónicos.
La actividad alfa lenta (7–8Hz) se incrementa en la vigilia durante tareas que demandan atención y memoria22 y su persistencia durante el sueño se ha interpretado como un signo de vigilancia.41–43 La dificultad para iniciar el sueño en los insomnes primarios se ha atribuido a una activación fisiológica incrementada que persiste durante el sueño,10,14,16,44,45 asociada al procesamiento de información y memoria de los sucesos que rodean el inicio del sueño.15 Los insomnes tuvieron mayor PR de alfa lento que los controles en las regiones frontales y no en las posteriores en la E2, diferencia que desaparece al alcanzar un sueño consolidado que coincide con la estimación subjetiva del sueño. Las regiones frontales y posteriores de asociación conforman una red esencial para la atención dirigida endogenamente.46 La persistencia de actividad alfa en la E2 del PIS, en regiones frontales en los insomnes, y la ausencia de diferencias entre los dos grupos en las áreas posteriores sugieren la persistencia de cierto nivel de activación frontal de los mecanismos ejecutivos de la atención, independiente de la entrada sensorial, que dificulta que se <<desenganche>> la atención endógena.
Ambos grupos tuvieron composiciones espectrales delta, theta y sigma, semejantes, lo cual indica, en concordancia con otros estudios,11 que está preservada la función promotora del sueño. La presencia simultánea en la E2 del PIS de los insomnes, de alfa y de cantidades normales de delta, theta y sigma indica la puesta en marcha del mecanismo promotor del sueño y una desactivación incompleta de los mecanismos de la vigilia, lo que sugiere la existencia de un desequilibrio entre ambos mecanismos,20 que pudiera subyacer a la dificultad subjetiva para iniciar el sueño.
Aunque no hubo diferencias significativas entre los grupos en la Escala de Hyperarousal, el incremento de beta en la vigilia en los insomnes es un signo de hipervigilancia16 y está de acuerdo con resultados descritos por otros autores.6,11
De acuerdo con lo esperado, la PSG de los dos grupos mostró iguales signos típicos del <<efecto de primera noche>>,25 menor cantidad total y eficiencia de sueño, mayor porcentaje de vigilia y E1 y menor de sueño MOR, en comparación con la década 20–30 años.28 La ausencia de diferencias entre los dos grupos indica que la activación frontal durante el PIS en el grupo de insomnes no puede atribuirse a la activación de un medio circundante novedoso y apoya la existencia de un factor predisponente en el insomnio primario. Lo anterior sugiere que las diferencias encontradas en el EEG no son circunstanciales y que probablemente se deben a la existencia de un factor intrínseco.23
El interés de esta investigación se centró en la búsqueda de patrones EEG durante el PIS que pudieran explicar la dificultad para iniciar el sueño en insomnes primarios, por lo que el principal criterio de inclusión fue la manifestación de una dificultad para iniciar el sueño, sin establecer diferencia entre insomnio psicofisiológico e insomnio paradójico, ya que ambos tipos de insomnio manifiestan una dificultad para conciliarlo.1,35,47,48 A pesar de las quejas de una latencia prolongada al sueño referidas en las historias clínicas de estos insomnes, no ocurrió así en el laboratorio. De acuerdo con esto, el grupo de insomnes estudiados debería clasificarse como insomnio de tipo psicofisiológico. Sin embargo, la evaluación subjetiva de la calidad y cantidad de sueño, así como la estimación subjetiva de la latencia al sueño, los clasificaría como de insomnio paradójico. Estos resultados indican un estado mixto de insomnio psicofisiológico y paradójico en estos insomnes, y señalan la complejidad de la etiología del insomnio.
El reducido número de pacientes incluidos en esta investigación se debe a la minuciosa selección de un grupo depurado de insomnes primarios crónicos con dificultades para iniciar el sueño, suficientemente jóvenes como para evitar que el deterioro de los patrones típicos de sueño y de la actividad cerebral confundieran los resultados; por lo anterior será necesario confirmar estos hallazgos en un grupo mayor con diferentes edades. Asimismo, será necesario extender los análisis al EEG de toda la noche para comprobar si el incremento de alfa se limita solamente al PIS.
En conclusión, someter ambos grupos a las mismas circunstancias ambientales de dormir por primera vez en un ambiente desconocido permitió evidenciar un patrón distintivo de actividad cerebral en los insomnes que indica que las causas del insomnio de este grupo no se encuentran en estímulos externos ambientales y sugiere la existencia de una alteración intrínseca. La presencia de mayor actividad alfa lenta frontal durante la E2 del PIS en los insomnes indica una desactivación incompleta de la región frontal, la cual mantiene cierto nivel de atención endógena, que sugiere a su vez una alteración de la red frontal de la atención.
AGRADECIMIENTOS
Pedro Figueredo–Rodríguez es becario por DGEP (UNAM). El trabajo fue financiado parcialmente por DGAPA (UNAM) IN202406–2 y CONACYT. Los autores agradecen al ingeniero Fernando Salinas Íñiguez por su asistencia técnica, a la psicóloga Consuelo Soliz Bermejo por el análisis de los datos y a Isabel Pérez–Montfort por la revisión del resumen en inglés.
REFERENCIAS
1. American Academy of Sleep Medicine. ICSD–2–International classification of sleep disorders. Diagnostic and coding manual. Second edition. American Academy of Sleep Medicine; 2005. [ Links ]
2. American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders. Washington: IV ed. American Psychiatric Association; 1994; p.886. [ Links ]
3. Hall M, Buysse DJ, Nowell PD, Nofzinger EA, Houck P et al. Symptoms of stress and depression as correlates of sleep primary insomnia. Psychosomatic Med 2000;62:227–230. [ Links ]
4. Krystal AD, Edinger JD, Wohlgemuth WK, Marsh GR. NREM sleep EEG frequency correlates of sleep complaints in primary insomnia subtypes. Sleep 2002;25:630–640. [ Links ]
5. Perlis ML, Giles DE, Mendelson WB, Bootzin RR, Wyatt JK. Psychophysiological insomnia: the behavioral model and a neurocognitive perspective. J Sleep Res 1997;6:179–188. [ Links ]
6. Perlis ML, Smith MT, Andrews PJ, Orff H, Giles DE. Beta/gamma EEG activity in patients with primary and secondary insomnia and good sleeper controls. Sleep 2001;24:110–117. [ Links ]
7. Rosa RR, Bonnet MH. Reported chronic insomnia is independent of poor sleep as measured by electroencephalography. Psychosomatic Med 2000;62:474–482. [ Links ]
8. Ohayon M. Epidemiology of insomnia: what we know and what we still need to learn. Sleep Med Rev 2002;6(2) :97–1 11. [ Links ]
9. Freedman RR. EEG power spectra in sleep–onset insomnia. Electroenceph. Clin Neurophysiol 1986;63:408–413. [ Links ]
10. Nofzinger EA, Buysse DJ, Germain A, Price JC, Miewald JM et al. Functional neuroimaging evidence for hyperarousal in insomnia. Am J Psychiatry 2004;161:2126–2129. [ Links ]
11. Besset A, Villemin E, Tafti M, Billiard M. Homeostatic process and sleep spindles in patients with sleep–maintenance insomnia: effects of partial (21h) sleep deprivation. Electroenceph Clin Neurophysiol 1998; 107:122–132. [ Links ]
12. Merica H, Blois R, Gaillard JM. Spectral characteristics of sleep EEG in chronic insomnia. Eur J Neurosci 1998;10:1826–1834. [ Links ]
13. Bonnet MH, Arand DL. 24–hour metabolic rate in insomniacs and matched normal sleepers. Sleep 1995;18:581–588. [ Links ]
14. Bonnet MH, Arand DL. Heart rate variability in insomniacs and matched normal sleepers. Psychosomatic Med 1998; 60:610–615. [ Links ]
15. Perlis ML, Bootzin RR, Fleming G, Drummond SP, Rose M et al. Alpha sleep and information processing, perception of sleep, pain and arousability in fibromyalgia. Int J Neurosci 1997;89: 265–280. [ Links ]
16. Bonnet MH, Arand DL. Hyperarousal and insomnia. Sleep Medicine Rev 1997;1:97–108. [ Links ]
17. Gaillard JM: Chronic primary insomnia: possible physiopathological involvement of slow wave deficiency. Sleep 1978;1:133–147. [ Links ]
18. Lamarche CH, Ogilvie RD. Electrophysiological changes during the sleep onset period of psychophysiological insomniacs, psychiatric insomniacs and normal sleepers. Sleep 1997;20:724–733. [ Links ]
19. Steriade M. Cellular substrates of brain rhythms. En: Niedermeyer E, Lopes da Silva F (eds.). Electroencephalography: Basic Principles, Clinical Applications, and Related Fields. Baltimore: Lippincott Williams and Wilkins; 1998. [ Links ]
20. Corsi–Cabrera M, Muñoz–Torres Z, Del Río Portilla Y, Guevara MA. Power and coherent oscillations distinguish REM sleep, stage 1 and wakefulness. Int J Psychophysiology 2006;60 (1):59–66. [ Links ]
21. Fuster J. Cortex and mind: Unifying cognition. New York: Oxford University Press; 2003. [ Links ]
22. Klimesch W, S=chack B, Sauseng P. The functional significance of theta and upper alpha oscillations. Exp Psychol 2005;52(2):99–108. [ Links ]
23. Spielman AJ, Caruso LS, Glovinsky PB. A behavioral perspective on insomnia treatment. Psychiatr Clin North Am 1987; 10:541– 553. [ Links ]
24. Agnew HW, Webb WB, Williams RL. The first night effect: an EEG study of sleep. Psychophysiol 1966;2:263–266. [ Links ]
25. Curcio G, Ferrara M, Piergianni A, Fratello F, De Gennaro L. Paradoxes of the first night effect: a quantitative analysis of antero–posterior EEG topography. Clin Neurophysiol 2004;115:1178–1188. [ Links ]
26. Annet M. The binomial distribution of right, mixed and left–handedness. Q J Experimental Psychol 1967;61:303–321. [ Links ]
27. Smith J, Kara I, Yang M. Ontogeny of delta activity during human sleep–Electroenceph. Clin Neurophysiol 1977;43: 229–237. [ Links ]
28. Williams RL, Karakan I, Hursch CJ. EEG of human sleep: Clinical applications. New York: Wiley; 1974. [ Links ]
29. Beck AT, Ward CH, Mendelson M, Mock J, Erbaugh J. An inventory for measuring depression. Arch General Psychiatry 1961; 4:561–571. [ Links ]
30. Jurado S, Villegas ME, Méndez L, Rodríguez F, Loperena V et al. La estandarización del Inventario de Depresión de Beck para los residentes de la ciudad de México. Salud Mental 1998;21(3):26–31. [ Links ]
31. Hamilton M. Development of a rating scale for primary depressive illness. Br J Soc Clin Psychol 1967;6(4):278–96. [ Links ]
32. Buysse DJ, Reynolds CF, Monk TH, Berman SR, Kupfer DJ. The Pittsburgh Sleep Quality Index: a new instrument for psychiatric practice and research. Psychiatry Res 1989;28:193– 213. [ Links ]
33. Nenclares Portocarrero A, Jiménez–Genchi A. Estudio de la validación de la traducción al español de la Escala Atenas de Insomnio. Salud Mental 2005;28(5):34–39. [ Links ]
34. Soldatos CR, Dikeos DG, Paparrigopoulos T. Athens Insomnia Scale: Validation of an instrument based on ICD–10 criteria. J Psychosomatic Res 2000;48:555. [ Links ]
35. Solís–Ortiz S, Corsi–Cabrera M, Ramos J, Arce C, Guevara MA. EEG oscillations during menstrual cycle. Int J Neurosc 1994; 76:279–292. [ Links ]
36. Rechtschaffen A, Kales A (eds.). A manual of standardized terminology, techniques and scoring system for sleep stages of human subjects. Los Angeles: Brain Information Service. Brain Research Institute, University of California; 1968. [ Links ]
37. Guevara MA, Ramos J, Hernández–González M, Zarabozo D, Corsi–Cabrera M. POTENCOR: a program to calculate power and correlation spectra of EEG signals. Computer Methods Programs Biomedicine 2002;72(3):241–250. [ Links ]
38. Spielberger CD, Díaz–Guerrero R. IDARE: inventario de ansiedad, rasgo–estado. México: El Manual Moderno; 1975. [ Links ]
39. Pavlova M, Berg O, Gleason R, Walker F, Roberts S et al. Self–reported hyperarousal traits among insomnia patients. J Psychosom Res 2001;51(2):435–41. [ Links ]
40. Bastien CH, Vallieres A, Morin CM. Validation of the Insomnia Severity Index as an outcome measure for insomnia research. Sleep Med 2001;4:297–307. [ Links ]
41. Hauri P, Hawkins DR. Alpha–delta sleep. Electroenceph Clin Neurophysiol 1973;34:233–237. [ Links ]
42. Pivik RT, Harman K: A reconceptualization of EEG alpha activity as an index of arousal during sleep: all alpha activity is not equal. J Sleep Res 1995;4:131–137. [ Links ]
43. Wittig RM, Zorick FJ, Blumer D, Heilbronn M, Roth T. Disturbed sleep in patients complaining of chronic pain. J Nerv Ment Dis 1982;170(7) :429–31. [ Links ]
44. Adam K, Tomeny M, Oswald I. Physiological and psychological differences between good and bad sleepers. J Psychiatry Res 1986;20:301–316. [ Links ]
45. Bonnet MH, Arand DL. Physiological activation in patients with sleep state misperception. Psychosomatic Med 1997, 59:533–540. [ Links ]
46. Posner MI, Raichle ME. Images of mind. New York: 1994. [ Links ]
47. Harvey AG. A cognitive model of Insomnia. Behaviour Research Therapy 2002;40:869–893. [ Links ]
48. Salín–Pascual RJ, Roehrs TA, Merlotti LA, Zorick F, Roth F. Long–term study of the sleep of insomnia patients with sleep state misperception and other insomnia patients. Am J Psychiatry 1992,149:904–908. [ Links ]
**Participantes en menor escala: Reyes Haro Valencia, Ulises Jiménez. Clínica de Sueño, Facultad de Medicina, UNAM.














