Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista mexicana de fitopatología
versão On-line ISSN 2007-8080versão impressa ISSN 0185-3309
Rev. mex. fitopatol vol.41 no.3 Texcoco Set. 2023 Epub 13-Out-2023
https://doi.org/10.18781/r.mex.fit.2301-2
Artículos científicos
Biopelícula de algas epífitas y hongos en plantaciones forestales de pinabete (Abies guatemalensis) en Guatemala
1 Departamento de Biología, Facultad de Ciencias y Humanidades, Universidad del Valle de Guatemala, 18 Avenida 11-95 Zona 15, Guatemala, C.P. 01015, Guatemala;
2Laboratorio de Protección Vegetal, Centro de Estudios Agrícolas y Alimentarios, Universidad del Valle de Guatemala, 18 Avenida 11-95 Zona 15, Guatemala, C.P. 01015, Guatemala.
3Herbario UVAL. Centro de Estudios Agrícolas y Alimentarios, Universidad del Valle de Guatemala, 18 Avenida 11-95 Zona 15, Guatemala, C.P. 01015, Guatemala
4 Coordinación de Pinabete, Instituto Nacional de Bosques (INAB), 7 Avenida 12-90 Zona 13, Guatemala, C.P. 01013, Guatemala
En los últimos años se ha reportado la incidencia de una nueva plaga en las plantaciones de pinabete (Abies guatemalensis), una biopelícula de microorganismos conocida como el “alga verde”. El objetivo de esta investigación fue identificar las algas y hongos que conforman la biopelícula que crece sobre las hojas del pinabete. Se recolectaron muestras de hojas en tres localidades con presencia de la biopelícula, y se aislaron las algas y hongos presentes en estas. Se realizó el cultivo in vitro de los microorganismos y se identificaron por medio de microscopía de luz, en el caso de los hongos, también se realizó una extracción de ADN y una amplificación de la región ITS. A partir de 120 hojas colectadas de 15 árboles se identificaron cuatro algas de los géneros Desmococcus, Klebsormidium y la clase Trebouxiophyceae, así como 11 hongos de los géneros Alternaria, Aspergillus, Fusarium, Mucor, Trichoderma y Ulocladium. La biopelícula que afecta a las plantaciones del pinabete en Guatemala está compuesta por varias especies de algas epifitas, hongos, las cuales pueden variar de acuerdo con la localidad. Aún es necesario abordar los factores que afectan la riqueza de microorganismos de la biopelícula y su relación simbiótica.
Palabras clave: Desmococcus; Klebsormidium; cultivo in vitro; Fusarium; Trichoderma; ITS
In recent years, a new pest has been reported in Guatemalan fir (Abies guatemalensis) plantations, a biofilm of microorganisms known as “green algae”. The objective of this research was to identify the algae and fungi that make up the biofilm growing on Guatemalan fir leaves. Leaf samples were collected from three locations where the biofilm has been reported, and the algae and fungi present on the leaves were isolated. Microorganisms were cultured in vitro and identified by light microscopy; in the case of fungi, DNA extraction and amplification of the ITS region were also performed. Four algae of the genera Desmococcus, Klebsormidium and the class Trebouxiophyceae, and 11 fungi of the genera Alternaria, Aspergillus, Fusarium, Mucor, Trichoderma and Ulocladium were identified from 120 leaves of 15 trees. It was concluded that the biofilm affecting Guatemalan fir plantations in Guatemala is composed of several species of epiphytic algae and fungi, which may vary according to the locality. The factors affecting the richness of microorganisms in the biofilm and their symbiotic relationship still need to be addressed.
Keywords: Desmococcus; Klebsormidium; in vitro culture; Fusarium; Trichoderma; ITS
El pinabete (Abies guatemalensis) es una especie amenazada de Mesoamérica, usada comúnmente en Guatemala como árbol de navidad. La extracción de árboles y ramillas de bosques naturales llevó a una reducción del 95% de las poblaciones en 45 años (CONAP, 2010). El pinabete se encuentra en la Lista Roja de Especies Amenazadas de la IUCN y en el apéndice 1 de CITES, por lo que se prohíbe el comercio internacional. En los años 90 se establecieron plantaciones de pinabete para satisfacer la demanda de árboles navideños a nivel nacional, lo que redujo el impacto sobre los bosques naturales y contribuyó a la conservación de la especie. El cultivo de pinabete ha demostrado ser una estrategia de conservación efectiva basada en el aprovechamiento sostenible (Strandby et al., 2006; Strandby et al., 2008).
Uno de los principales retos de las plantaciones de pinabete es el control de plagas forestales como áfidos (Mindarus sp.), la fumagina (Capnodium sp.) causada por excreciones de áfidos y la pudrición de raíz por Phytophthora. En los últimos años, se ha reportado una nueva plaga que está afectando significativamente las plantaciones: el “alga verde” del pinabete (Strandby et al., 2008; INAB, 2018). Esta se reconoce por una cobertura polvosa de color verde que se forma sobre el tronco, las hojas y puede llegar a cubrir ramas completas. La biopelícula reduce la incidencia de luz y aumenta la acumulación de materia orgánica, lo cual puede ocasionar la muerte de las ramas. También afecta la calidad estética de los árboles y reduce su valor en el mercado, poniendo en riesgo la rentabilidad del cultivo de pinabete. Como su nombre lo sugiere, este fenómeno es causado por un alga verde, sin embargo, no hay estudios que aborden la identificación del alga, así como su posible asociación con otros microorganismos como hongos (INAB, 2018; INAB, 2019).
Las algas terrestres pueden crecer sobre superficies inertes como rocas y edificaciones, así como en la superficie de organismos vivos como plantas o animales (Novakova y Neustupa, 2015). Este último fenómeno se conoce como epibiosis, en el cual un organismo (epibionte) habita sobre la superficie de otro (basibionte), el cual puede o no verse afectado (Wahl, 2009). Las algas comúnmente se asocian con otros microorganismos para formar biopelículas, tales como bacterias y hongos (Freystein y Reisser, 2010).
Varios autores han reportado casos de biopelículas de algas y hongos creciendo sobre hojas de Abies y otras coníferas en Europa y Norteamérica (Sochting, 1997; Poggio, 2002; Novakova y Neustupa, 2015). Sin embargo, este fenómeno no ha sido descrito previamente en A. guatemalensis, por lo que el objetivo de esta investigación fue la identificación de las algas y hongos que conforman la biopelícula que crece sobre las hojas del pinabete (Abies guatemalensis).
Materiales y métodos
Recolección de muestras. Se visitaron tres plantaciones de pinabete en los departamentos de Chimaltenango (Finca Valle Alto), Guatemala (Finca Billebén) y San Marcos (Finca Buena Vista) durante un año, de marzo de 2019 a marzo de 2020. Estas plantaciones fueron seleccionadas con base a registros del Instituto Nacional de Bosques que indican la presencia de la biopelícula, la cual se ha reportado en 10 plantaciones y un bosque natural (Figura 1). En cada plantación se realizó un muestreo dirigido y se seleccionaron cinco árboles de pinabete que mostraran signos de infestación del “alga verde”, y que tuvieran una altura mayor a dos metros y un diámetro mayor a 10 cm a una altura de 1.5 m. Los árboles se georreferenciaron y en cada uno se seleccionaron cuatro ramas infestadas que estuvieran localizadas a la altura del previamente mencionada en los cuatro puntos cardinales. Se realizó un registro fotográfico de las ramas, se cortaron, se guardaron en bolsas plásticas y se almacenaron en una hielera para transportarlas al Laboratorio de Protección Vegetal de la Universidad del Valle de Guatemala. Estas se observaron bajo microscopio estereoscopio y se realizó un raspado de la cobertura de las hojas para su observación bajo microscopio de luz para la identificación de algas y hongos.

Figura 1 Registros de plantaciones de pinabete (Abies guatemalensis) con presencia de algas y hongos que conforman la biopelícula y sitios muestreados.
Identificación de algas. Se seleccionaron dos hojas de cada rama para el análisis, con un total de 8 hojas por árbol y 40 hojas por sitio de muestreo. Se realizó un raspado de la cobertura de cada hoja y se desinfestó durante 5 min con una solución de antibióticos (Gentamicina 50 µg mL-1, Estreptomicina 100 µg mL-1 y Carbendazim 64 µg mL-1). Los raspados se filtraron al vacío y se sembraron en medio de cultivo sólido y líquido, tomando como referencia los métodos de Stanier et al. (1971), Andersen (2005) y Videv et al. (2017). Se utilizó el medio de cultivo de Kuhl y Lorenzen (1964) que está compuesto por 10mM KNO3, 4.5mM NaH2PO4 * 1 H2O, 0.5mM Na2HPO4 * 2 H2O, 1mM MgSO4 * 7 H2O, 0.1mM CaCl2 * 2 H2O, 0.025mM FeSO4 * 7 H2O, 1μM ZnSO4 * 7 H2O, 1μM MnSO4 * 1 H2O, 1μM H3BO3, 0.01μM (NH4)6Mo7O24 * 4 H2O, 0.01μM CuSO4 * 5 H2O.
Los cultivos en medio líquido se mantuvieron con aireación constante y bombeo de CO2 a razón de 60 burbujas por min, con una temperatura de 28 ºC y un fotoperiodo de 12 h con lámparas fluorescentes. Los cultivos se supervisaron diariamente para separar los que mostraran crecimiento de bacterias y hongos, los cuales se filtraron y se sembraron en medio papa-dextrosa-agar (PDA) para la identificación de los microorganismos contaminantes. Después de una semana de crecimiento, se realizaron observaciones bajo microscopio de luz para identificar las algas a nivel de género. Se tomaron como referencia claves taxonómicas de algas terrestres (Graham y Wilcox, 2009; Freystein y Reisser, 2010; John y Rindi, 2015; Archibald et al., 2017) y la clasificación actual de acuerdo con las bases de datos AlgaeBase e Index Nominum Algarum (AlgaeBase, 2023).
Identificación de hongos. Los hongos se aislaron a partir de las hojas recolectadas, se utilizó el mismo número de muestras que en la identificación de algas. Se cortaron segmentos de 2 cm de largo y se desinfectaron con hipoclorito de sodio al 2% y agua destilada. El material vegetal se sembró en medio de cultivo PDA, se colocaron cuatro hojas de cada rama en una caja Petri y se incubaron a 28 ºC durante 5 días. Los hongos que crecieron sobre las hojas se cultivaron y se realizó la purificación de los cultivos por medio de la técnica de punta de hifa (Soto et al., 2017). Después se hicieron montajes de las estructuras reproductivas y esporas en portaobjetos y se observaron bajo microscopio de luz para identificarlos a nivel de género. Se tomaron como referencia las claves taxonómicas de Farr et al. (1989) y Phillips y Burdekin (1992).
Extracción de ADN y análisis molecular de hongos. Cinco de los hongos aislados se identificaron a nivel de especie por medio de análisis genético. Se realizó la extracción de ADN con el protocolo de CTAB de Murray y Thompson (1980). Se añadió 300 mg de micelio a un tubo Eppendorf de 1.5 mL, al cual se le agregó 600 μL de buffer de extracción CTAB (2% CTAB, 1% polyvinylpyrrolidone [PVP], 100mM Tris-HCl pH 8.0, 1.4M NaCl, 20mM EDTA y 0.2% 2-mecaptoetanol) precalentado a 65 °C. Se maceró el micelio con un macerador automático, se agregó 500 μL de cloroformo: alcohol isoamílico (24:1), se centrifugó a 13,000 rpm por 10 min y se transfirió el sobrenadante a un nuevo tubo. Después se agregó 500 μL de isopropanol frío y 50 μL de acetato de amonio 7.5M y se incubó a -20 °C por una hora. Se centrifugó la muestra a 13,000 rpm por 10 min y se decantó el sobrenadante, se añadió 150 μL de etanol 70% frío y se centrifugó a 13,000 rpm durante cinco min. Se decantó el sobrenadante y se secó el precipitado a 30 °C durante 20 min, finalmente se resuspendió en 50 μL de amortiguador TE (10mM Tris-HCl, 1mM EDTA) precalentado a 65 °C, y se almacenó en refrigeración a 4 °C.
Se cuantificó el ADN y se analizó la región ITS por medio de la Reacción en Cadena de la Polimerasa (PCR) utilizando los siguientes cebadores: ITS1 (5’TCCGTAGGTGAACCTG-CGG3’) e ITS4 (5’TCCTCCGCTTATTGATATGC3’) (White et al., 1990). El producto de PCR esperado fue de 650 pb. El volumen de la reacción fue de 25 μL, el cual contenía 17.7 μL de agua destilada estéril, 2.5 μL de buffer 10X con MgCl2 a 25mM, 1 μL de la mezcla de dNTPs (10 mM), 1.3 μL de cada cebador (10 pmol μL-1) y 0.2 μL de Taq-DNA polymerase 5U μL-1 (Invitrogen®). La reacción se realizó en un termociclador utilizando el siguiente programa: desnaturalización inicial a 95 °C por 15 min, 35 ciclos de desnaturalización a 94 °C por 30 s, alineamiento a 52 °C por 90 s y extensión a 72 °C por 1 min; una extensión final de 60 °C por 30 min.
Los fragmentos amplificados se visualizaron por electroforesis en gel de agarosa al 1% y se enviaron a la empresa Macrogen, Corea para su secuenciación. Las secuencias obtenidas se analizaron y compararon con las depositadas en la base de datos GenBank de NCBI (National Center for Biotechnology Information) por medio del programa BLAST (Basic Local Alignment Search Tool), posteriormente se depositaron para obtener su número de acceso (Zhang et al., 2000). Las secuencias se depositaron en el SRA (Sequence Read Archive) con los números de acceso SRR24660263, SRR24660264, SRR24660265, SRR24660266 y SRR24660267. Estas muestras forman parte del número de acceso de BioProject PRJNA974074.
Resultados y discusión
Observaciones en campo. Se encontraron troncos y ramas con infestación parcial y completa de la biopelícula (Figura 2). Esta se reconoció por la presencia de una cobertura verde polvosa en troncos, ramas y hojas, iniciando en la parte inferior y extendiéndose a la parte superior de las mismas. En las muestras de Finca Billebén y Finca Valle Alto se observaron ramas con una biopelícula más densa con secciones necróticas de color gris (Figura 2E), lo que indica una etapa avanzada de la infestación. Esto puede deberse a la infestación avanzada de hongos en la biopelícula, lo cual ya ha sido reportado previamente por Sochting (1997) en hojas de Picea abies. También se ha observado una mayor incidencia de hongos en hojas de coníferas conforme aumenta la edad de las ramas (Carroll et al., 1977; Terhonen et al., 2011).

Figura 2 Árboles de pinabete (Abies guatemalensis) infestados con la biopelícula de algas y hongos. A y B) Troncos cubiertos por la biopelícula. C y D) Ramas con cobertura parcial de la biopelícula. E) Rama con cobertura total de la biopelícula. F) Rama de pinabete infestada con brotes foliares libres de la infestación.
Se encontró que, aún en las ramas completamente infestadas, los nuevos brotes de hojas no mostraron cobertura de la biopelícula (Figura 2F). Esta observación se realizó en octubre, y la producción de brotes inicia en mayo con la temporada de lluvias, lo que indica que los brotes pueden pasar hasta cinco meses libres de la biopelícula. Este fenómeno también ha sido reportado previamente en Picea abies, donde se encontró que las nuevas hojas empiezan a ser colonizadas por algas hasta seis meses después de haber brotado, y que las ramas más viejas tienen una cobertura más densa (Sochting, 1997).
Además de algas y hongos, también se encontraron musgos (Figura 3B), líquenes foliosos (Figura 3C), ácaros, diatomeas, polen y exoesqueletos de insectos en la biopelícula. Esta acumulación de detritos y materia orgánica en la biopelícula reduce aún más la fotosíntesis en las hojas y acelera la senescencia (Reuther, 1978; Sochting, 1997).

Figura 3 Ramas y hojas de pinabete infestadas con la biopelícula de algas y hongos vistas bajo estereoscopio. A) Corteza de pinabete 20 X. B) Rama de pinabete 20 X. C y D) Ramas de pinabete 10 X. E) Hoja de pinabete cubierta por la biopelícula con una sección necrótica 20 X. F) Envés de hoja de pinabete 45 X.
Las observaciones en campo demostraron que la biopelícula de algas y hongos no crece únicamente sobre el pinabete. En dos plantaciones se encontró hojarasca de otras especies de árboles con la misma cobertura de algas (Figura 4). Esta hojarasca se encontró en la copa de los pinabetes afectados, mientras que la hojarasca en el suelo no mostraba presencia de la biopelícula, lo que indica que esta se adhirió a las hojas por su proximidad con la fuente del inóculo.
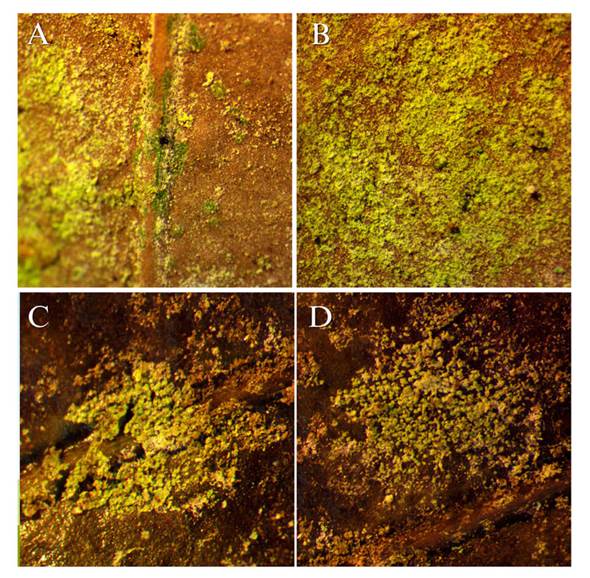
Figura 4 Hojas de angiospermas encontradas en la copa de pinabetes infestados con algas. A y B) Localidad: Finca Billeben, Guatemala 15 X. C y D) Localidad: Finca Valle Alto 15 X.
Aún se desconoce por qué el pinabete es afectado por la biopelícula de algas y hongos, pero en otras coníferas de la misma región no presentan dicho fenómeno, tales como Pinus maximinoi o P. oocarpa. De acuerdo con Hoffman (1989), el crecimiento de algas epífitas está más controlado por factores físicos (temperatura, iluminación, humedad) que por la especie de planta basibionte. Aun así, otros factores como el pH de la corteza y la especie del árbol influyen en la colonización de algas (Alwi et al., 2015; Stifterova y Neustupa, 2015), por lo que los árboles de pinabete podrían presentar características que facilitan el crecimiento de estas.
Identificación de algas. En las 120 hojas de los 15 árboles analizados (5 árboles por sitio de muestreo) se encontraron cuatro especies de algas en las hojas de pinabete (Cuadro 1). El alga Desmococcus sp. se encontró en las tres localidades (Figura 5), dos especies diferentes del género Klebsormidium se encontraron en dos localidades (Finca Valle Alto y Finca Billeben) y un alga unicelular de la clase Trebouxiophyceae se encontró en una localidad (Finca Billeben), esta no fue identificada a nivel de género debido a la falta de características diagnósticas observables. No fue posible realizar análisis genético de las algas debido a la falta de cultivos puros, por lo que es necesario optimizar el método de desinfección del material vegetal utilizando diferentes concentraciones de antifúngicos y tiempos de desinfección que puedan eliminar hongos y bacterias sin afectar el crecimiento las algas (Laezza et al., 2022).
Cuadro 1 Comparación de grupos de algas y hongos encontrados en las plantaciones de pinabete pinabete en las localidades de Chimaltenango, Guatemala y San Marcos, Guatemala.
| Localidades | |||
|---|---|---|---|
| Clasificación | Finca Billeben, Guatemala | Finca Valle Alto, Chimaltenango | Finca Buena Vista San Marcos |
| Algas | |||
| Desmococcus sp. | X | X | X |
| Klebsormidium sp1. | X | ||
| Klebsormidium sp2. | X | ||
| Trebouxiophyceae | X | ||
| Hongos | |||
| Alternaria sp. | X | ||
| Aspergillus sp. | X | ||
| Fusarium equiseti | X | ||
| F. graminearum | X | ||
| Fusarium sp. | X | ||
| Mucor hiemalis | X | ||
| Mucor sp. | X | ||
| Trichoderma koningiopsis | X | ||
| Trichoderma viride | X | ||
| Trichoderma sp. | X | ||
| Ulocladium sp. | X | ||
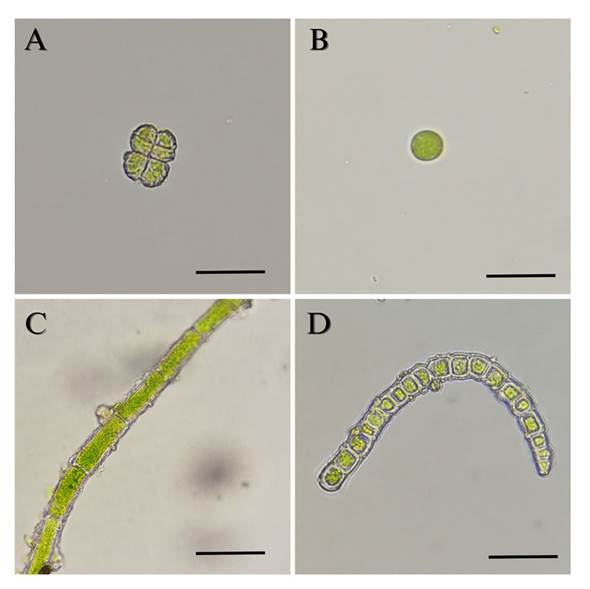
Figura 5 Algas aisladas a partir de hojas de pinabete infestados con biopelícula de algas y hongos. A) Desmococcus sp. 400 X. B) Trebouxiophyceae 400 X. C) Klebsormidium sp1. 400 X. D) Klebsormidium sp2. 400 X. La barra de escala equivale a 10 μm.
Las algas identificadas en este estudio pertenecen a géneros que se han descrito como organismos formadores de biopelículas fotosintéticas en superficies naturales y artificiales como suelos, plantas, rocas y construcciones (Ljaljević-Grbić et al., 2010; Rindi y Guiry, 2004; Stifterova y Neustupa, 2015). Ninguna de las algas identificadas ha sido reportada como parásitas o causantes de enfermedades en plantas, estas utilizan la corteza y las ramas como superficie para crecer, así como otros organismos epibiontes, entre ellos líquenes o musgos (Neustupa y Albrechtova 2003; Wahl, 2009).
Se encontró que la composición de especies de algas en la biopelícula puede variar de acuerdo con la localidad. Esta variación puede deberse a la madurez y la edad de la cobertura sobre las hojas. Se ha demostrado que existe una sucesión en las biopelículas de microorganismos similar a la que sucede en los bosques, ya que la abundancia y riqueza de especies de algas varía de acuerdo con el tiempo (Neustupa y Albrechtova, 2003; Pogio, 2002). El alga Desmococcus sp. se encontró en todas las localidades, lo que sugiere que es un colonizador temprano en la biopelícula (Schnurr y Allen, 2015). Por otra parte, las algas filamentosas como Klebsormidium suelen ser colonizadores tardíos (Sochting, 1997). Esto implica que las localidades de Finca Billebén y Finca Valle Alto presentan árboles con una biopelícula más desarrollada y de mayor edad. En estas mismas localidades se encontraron ramas con parches necróticos con una infestación avanzada de hongos.
La variabilidad en la riqueza de especies también puede deberse a factores como el pH de la corteza, la humedad, iluminación y concentración de nitrógeno y fósforo (Novakova y Neustupa, 2015). La intensidad de manejo de un bosque también puede afectar las especies de una biopelícula, ya que los bosques que tienen una mayor frecuencia de raleos y podas presentan una menor cobertura de dosel y una mayor riqueza de especies de algas (Glaser et al., 2018; Stifterova y Neustupa, 2015). Estos factores ambientales y antropogénicos deberán ser abordados en futuras investigaciones para conocer cómo afectan el desarrollo de la biopelícula en las hojas del pinabete.
Identificación de hongos. A partir de las 120 hojas de los 15 árboles analizados, se aislaron 11 especies de hongos que se encontraron en las hojas de pinabete (Cuadro 1), pertenecientes a seis géneros (Alternaria, Aspergillus, Fusarium, Mucor, Trichoderma y Ulocladium). Estos géneros corresponden a organismos que se conocen como patógenos, saprófitos y benéficos. Cinco de los hongos se identificaron molecularmente a nivel especie por la amplificación de la región ITS (Cuadro 2). Al comparar las secuencias de este estudio con las del banco de genes del NCBI, se observó una homología que oscilo entre 93.3 al 97.6 % (Cuadro 2). Esta baja homología puede deberse a que sean otras variantes o especies. Por lo que se considera pertinente realizar más estudios morfológicos y moleculares.
Cuadro 2 Porcentaje de similitud de secuencias de la región ITS de hongos aislados e identificados de hojas de pinabete.
| ID | Especie | Cobertura (%) | Homología (%) | Referencia de BLAST | Accesión |
|---|---|---|---|---|---|
| ITS seq of Fusarium b | Fusarium equiseti | 99.5 | 97.65 | F. equiseti isolate Anna6 small subunit ribosomal RNA gene, partial sequence; internal transcribed spacer 1, 5.8S ribosomal RNA gene, and internal transcribed spacer 2, complete sequence; and large subunit ribosomal RNA gene, partial sequence | MN498032.1 |
| ITS seq of Fusarium R | F. graminearum | 99.65 | 96 | F. graminearum isolate PAK-14 small subunit ribosomal RNA gene, partial sequence; internal transcribed spacer 1, 5.8S ribosomal RNA gene, and internal transcribed spacer 2, complete sequence; and large subunit ribosomal RNA gene, partial sequence | MH054924.1 |
| ITS seq of Mucor h | Mucor hiemalis | 99.31 | 93.55 | M. hiemalis isolate SL71_64a_Y2 internal transcribed spacer 1, partial sequence; 5.8S ribosomal RNA gene and internal transcribed spacer 2, complete sequence; and large subunit ribosomal RNA gene, partial sequence | MN105537.1 |
| ITS seq of Trichoderma k | Trichoderma koningiopsis | 98.32 | 96.14 | T. koningiopsis isolate XXTF7 small subunit ribosomal RNA gene, partial sequence; internal transcribed spacer 1, 5.8S ribosomal RNA gene, and internal transcribed spacer 2, complete sequence; and large subunit ribosomal RNA gene, partial sequence | MN602642.1 |
| ITS seq of Trichoderma v | T. viride | 97.23 | 94.23 | T. viride strain CTCCSJ-A-SD33116 internal transcribed spacer 1, partial sequence; 5.8S ribosomal RNA gene, complete sequence; and internal transcribed spacer 2, partial sequence | MF632117.1 |
Se encontraron tres especies de Trichoderma (Trichoderma sp., T. koningiopsis, T. viride) en la Finca Billeben (Guatemala) y la Finca Buena Vista (San Marcos). Estas especies son antagónicas de patógenos como Fusarium, y han sido aisladas previamente a partir de hojas de Abies y otras coníferas de Europa (Hanackova et al., 2015; Hayes, 1965; Tokumasu et al., 1994). Los hongos Alternaria sp. y Ulocladium sp. también se encontraron en la Finca Billeben (Guatemala), estos hongos pueden causar necrosis en hojas y se han reportado afectando especies arbóreas (Danelia et al., 2021; Vannini y Vettraino, 2000).
En la finca Valle Alto se encontraron dos especies de Fusarium: F. equiseti y F. graminearum. Esta última causa la podredumbre del tallo en maíz y afecta principalmente a gramíneas, a pesar de esto, ha sido aislada a partir de numerosas familias de plantas. Las esporas del hongo se depositan y acumulan en hojas y se convierten en una fuente de inóculo para gramíneas (Miller et al., 2007). En este caso, las esporas de este hongo posiblemente se transportaron desde plantaciones de maíz aledañas, ya que este cultivo suele asociarse con el pinabete en un modelo agroforestal (INAB, 2019).
No se encontró ningún género de hongos que estuviera en común en todas las localidades, los géneros Mucor y Trichoderma se encontraron en dos de las tres localidades, y estos han sido aislados en conjunto en hojas de coníferas en descomposición (Hanackova et al., 2015; Hayes, 1965; Tokumasu et al., 1992).
Al observar los raspados de la biopelícula bajo microscopio se encontró que las algas verdes y hongos están estrechamente relacionados. Se observó micelio de hongos con acumulación de algas unicelulares (Trebouxiophyceae) alrededor (Figura 6A y B), así como hifas y esporas de hongos adheridos a filamentos del alga Klebsormidium sp. (Figura 6C y D). Este y otros géneros de algas filamentosas terrestres producen una matriz extracelular de polisacáridos a la cual pueden adherirse otras algas, cianobacterias y hongos (Warren et al., 2019). Además, las hifas de los hongos se adhieren a otros componentes de la biopelícula, como partículas de suelo, para agregarlos y compactarlos (Belnap et al., 2003). Aún no está claro si existe una relación de mutualismo, comensalismo o parasitismo entre los microorganismos que conforman la biopelícula, lo cual deberá ser abordado en futuras investigaciones.

Figura 6 Raspados de la biopelícula de hojas de pinabete vistos bajo microscopio partir de hojas de pinabete infestados con la biopelícula. A y B) Micelio de hongos rodeado de algas unicelulares 400 X. C y D) Filamentos de Klebsormidium sp1 rodeados de hifas y esporas de hongos 400 X. La barra de escala equivale a 10 μm.
Conclusiones
La biopelícula que afecta a las plantaciones del pinabete en Guatemala está compuesta por algas epifitas, hongos y materia orgánica. En 15 árboles de pinabete en tres localidades se encontraron algas de los géneros Desmococcus, Klebsormidium y de la clase Trebouxiophyceae. Estas algas no son organismos parásitos del pinabete, sino que lo utilizan como soporte de manera similar a líquenes y otros epibiontes. También se encontraron hongos de los géneros Alternaria, Aspergillus, Fusarium, Mucor, Trichoderma y Ulocladium, los cuales se han reportado como hongos patógenos, saprófitos y benéficos. Se encontró que la riqueza de especies de algas y hongos varía de acuerdo con la localidad, lo cual puede deberse a factores ambientales o antropogénicos.
Agradecimientos
Los autores agradecemos a Salvador Pira, José Billeb y Antonio Pineda, productores de pinabete, por apoyar en la colecta de muestras, así como a Patricia Herrera, María Bermúdez, Leyda Hernández, Julio Álvarez y Melvin Hernández, personal del Laboratorio de Protección Vegetal de la Universidad del Valle de Guatemala, por su apoyo en el aislamiento y análisis genético de los hongos.
REFERENCIAS
AlgaeBase. 2023. World-wide electronic publication, National University of Ireland, Galway: https://www.algaebase.org/content/?tc=accept&undefined (consulta, marzo 2023). [ Links ]
Alwi I, Asmida I, Khairiyah S, Buyong F, Mohamad N, Daud D and Rusop M. 2015. Bark pH as a factor affecting the density of epiphytic terrestrial algae in Taman Wetland Putrajaya, Malaysia. Journal of Applied and Physical Sciences 1: 13-18. https://doi.org/10.20474/japs-1.1.4 [ Links ]
Andersen R. 2005. Algal Culturing Techniques. First Edition. Elsevier. Amsterdam, Netherlands. 592p. Disponible en línea: https://www.elsevier.com/books/algal-culturing-techniques/andersen/978-0-12-088426-1 [ Links ]
Archibald J, Simpson AG and Slamovits CH. 2017. Handbook of the Protists. Second Edition. Springer. Dordrecht, Netherlands. 1657p. https://doi.org/10.1007/978-3-319-28149-0 [ Links ]
Belnap J, Budel B and Lange OL. 2003. Biological Soil Crusts: Characteristics and distribution. Pp 3-30. In: Belnap J and Lange OL (eds.). Biological Soil Crusts: Structure, Function and Management. Vol 150. Springer. Dordrecht, Netherlands . 479p. https://doi.org/10.1007/978-3-642-56475-8 [ Links ]
Carroll F, Muller E and Sutton BC. 1977. Preliminary Studies on the Incidence of Needle Endophytes in some European Conifers. Sydowia 29: 87-103. https://www.zobodat.at/pdf/Sydowia_29_0087-0103.pdf [ Links ]
CONAP (Consejo Nacional de Áreas Protegidas). 2010. Estrategia Nacional Para la Conservación del Pinabete (Abies guatemalensis Rehder) 2008-2017. Documento técnico No. 80(01-2010). Guatemala, Guatemala. 106p. Disponible en línea: https://conap.gob.gt/conservacion-del-pinabete/ [ Links ]
Danelia I, Zaqariashvili N, Amiranashvili L, Badridze G and Kvitsiani S. 2021. The mycological study of conifers in Tbilisi and its surroundings. Journal of Forest Science 67: 464-476. https://doi.org/10.17221/79/2021-JFS [ Links ]
Farr DF, Bills GF, Chamuris GP and Rossman AY. 1989. Fungi on plants and plant products in the United States. First Edition. APS Press. Minnesota, USA. 1252p. Disponible en línea: https://my.apsnet.org/APSStore/Product-Detail.aspx?WebsiteKey=2661527A-8D44-496C-A730-8CFEB6239BE7&iProductCode=40993 [ Links ]
Freystein K and Reisser W. 2010. Green Biofilms on Tree Bark: more than just algae. Pp: 559-573. In: Sekbach J and Grube M (eds.). Symbioses and Stress. Cellular Origin, Life in Extreme Habitats and Astrobiology. Vol. 17. Springer. Dordrecht, Netherlands . 615p. https://doi.org/10.1007/978-90-481-9449-0_29 [ Links ]
Glaser K, Baumann K, Leinweber P, Mikhailyuk T and Karsten U. 2018. Algal richness in BSCs in forests under different management intensity with some implications for P cycling. Biogeosciences 15: 4181-4192. https://doi.org/10.5194/bg-15-4181-2018 [ Links ]
Graham LE and Wilcox LW. 2009. Algae. Second Edition. Prentice Hall. New Jersey, USA. 1416p. Disponible en línea: https://www.worldcat.org/title/algae/oclc/750763673 [ Links ]
Hanackova Z, Koukol O, Stursova M, Kolarik M and Baldrian P. 2015. Fungal succession in the needle litter of a montane Picea abies forest investigated through strain isolation and molecular fingerprinting. Fungal Ecology 13: 157-166. https://doi.org/10.1016/j.funeco.2014.09.007 [ Links ]
Hayes AJ. 1965. Studies on the decomposition of coniferous leaf litter, II. Changes in external features and succession of microfungi. Journal of Soil Science 16: 242-258. https://doi.org/10.1111/j.1365-2389.1965.tb01435.x [ Links ]
Hoffmann L. 1989. Algae of terrestrial habitats. Botanical Reviews 55: 77-105. https://doi.org/10.1007/BF02858529 [ Links ]
INAB (Instituto Nacional de Bosques). 2018. Manual de campo para el manejo sanitario de plantaciones de árboles navideños de pinabete. Cooperativa Integral Agrícola Joya Hermosa de las Tres Cruces R.L. Guatemala, Guatemala. 26p. Disponible en línea: https://inab.gob.gt/images/profor/Manual%20de%20Campo%20para%20el%20Manejo%20Sanitario%20de%20Plantaciones%20de%20arboles%20navidenos%20de%20Pinabete.pdf [ Links ]
INAB (Instituto Nacional de Bosques). 2019. Paquete Tecnológico Forestal para Pinabete Abies guatemalensis Rehder, versión 1.0. Serie técnica DT-032-2019. Departamento de Investigación Forestal. Guatemala, Guatemala. 58p. Disponible en línea: https://www.inab.gob.gt/images/publicaciones/PTF%20PINABETE.pdf [ Links ]
John D and Rindi F. 2015. Filamentous (Nonconjugating) and Plantlike Green Algae. Pp: 375-427. In: Wehr JD, Sheath RG and Kociolek JP (eds.). Freshwater algae of North America: Ecology and Classification. Second Edition. Academic Press. Washington, USA. 1066p. https://doi.org/10.1016/B978-0-12-385876-4.00008-6 [ Links ]
Kuhl A and Lorenzen H. 1964. Handling and Culturing of Chlorella. Pp: 159-187. In: Prescott DM (eds.). Methods in Cell Biology. Vol 1. Elsevier. Amsterdam, Netherlands. 464p. https://doi.org/10.1016/S0091-679X(08)62092-0 [ Links ]
Ljaljević-Grbić M, Vukojevic J, Subakov-Simić G, Krizmanić J and Stupar M. 2010. Biofilm forming cyanobacteria, algae and fungi in two historic monuments in Belgrade, Serbia. Archives of Biological Sciences 3: 625-631. https://doi.org/10.2298/ABS1003625L [ Links ]
Laezza C, Salbitani G and Carfagna S. 2022. Fungal Contamination in Microalgal Cultivation: Biological and Biotechnological Aspects of Fungi-Microalgae Interaction. Journal of Fungi 10: 1099-1105. https://doi.org/10.3390/jof8101099 [ Links ]
Miller SS, Reid LM, Harris LJ. 2007. Colonization of maize silks by Fusarium graminearum, the causative organism of gibberella ear rot. Canadian Journal of Botany 85: 369-376. https://doi.org/10.1139/B07-027 [ Links ]
Murray M and Thompson W. 1980. Rapid isolation of high molecular weight plant DNA. Nucleic Acids Research 19: 4321-4325. https://doi.org/10.1093/nar/8.19.4321 [ Links ]
Neustupa J and Albrechtova J. 2003. Aerial algae on spruce needles in the Krusne Hory Mts., Czech Republic. Czech Phycology Olomouc 3: 161-167. https://fottea.czechphycology.cz/pdfs/fot/2003/01/15.pdf [ Links ]
Novakova R and Neustupa J. 2015. Microalgal biofilms on common yew needles in relation to anthropogenic air pollution in urban Prague, Czech Republic. Science of the Total Environment 508: 7-12. https://doi.org/10.1016/j.scitotenv.2014.11.031 [ Links ]
Phillips D and Burdekin DA. 1992. Diseases of Forest and Ornamental Trees. Second Edition. The MacMillan Press. London, England. 581p. https://doi.org/10.1007/978-1-349-10953-1 [ Links ]
Poggio L. 2002. Epiphytic algae on Norway spruce needles in Sweden: geographical distribution, time-trends and influence of site factors. Department of Forest Soils, Swedish University of Agricultural Sciences. Uppsala, Sweden. 32p. Disponible en línea: https://stud.epsilon.slu.se/11831/1/poggio_l_171016.pdf [ Links ]
Rindi F and Guiry MR. 2004. Composition and spatial variability of terrestrial algal assemblages occurring at the bases of urban walls in Europe. Phycologia 3: 225-235. https://doi.org/10.2216/i0031-8884-43-3-225.1 [ Links ]
Schnurr P and Allen DG. 2015. Factors affecting algae biofilm growth and lipid production: A review. Renewable and Sustainable Energy Reviews 52: 418-429. https://doi.org/10.1016/j.rser.2015.07.090 [ Links ]
Sochting U and Sutton BC. 1997. Scolecotheca cornuta gen. et sp. nov. on needles of Picea abies from Denmark. Mycological Research 101: 1366-1370. https://doi.org/10.1017/S0953756297004048 [ Links ]
Sochting U. 1997. Epiphyllic cover on spruce needles in Denmark. Annales Botanici Fennici 34: 157-164. http://www.jstor.org/stable/23726495 [ Links ]
Soto PA, Rodríguez AG, Fernández YL, Pedraza ME, López PL, Díaz CM y Fernández SP. 2017. Protocolos de aislamiento y diagnóstico de Phytophthora spp.: Enfoque aplicado a la investigación. Revista Mexicana De Ciencias Agrícolas (8): 1867-1880. https://doi.org/10.29312/remexca.v8i8.708 [ Links ]
Stanier RY, Kunisawa R, Mandel M and Cohen-Bazire G. 1971. Purification and Properties of Unicellular Blue-Green Algae (Order Chroococcales). Bacteriological Reviews 35: 171-205. https://doi.org/10.1128/br.35.2.171-205.1971 [ Links ]
Stifterova A and Neustupa J. 2015. Community structure of corticolous microalgae within a single forest stand: evaluating the effects of bark surface pH and tree species. Fottea Olomouc 2: 113-122. https://doi.org/10.5507/fot.2015.013 [ Links ]
Strandby U, Prado JP, Sorensen M and Kollmann J. 2006. Conservation and utilization of Abies guatemalensis Rehder - an endemic conifer in Central America. Biodiversity and Conservation 15: 3131-3151. http://dx.doi.org/10.1007/s10531-005-5405-x [ Links ]
Strandby U, Prado JP, Brauner U, Smith C, Nielsen C, Sorensen M and Kollmann J. 2008. Conservation through utilization: a case study of the vulnerable Abies guatemalensis in Guatemala. Oryx 2: 206-213. https://doi.org/10.1017/S0030605308007588 [ Links ]
Terhonen E, Marco T, Sun H, Jalkanen R, Kasanen R, Vuorinen M, Asiegbu F. 2011. The effect of latitude, season and needle-age on the mycota of Scots pine (Pinus sylvestris) in Finland. Silva Fennica 3: 301-317. https://doi.org/10.14214/sf.104 [ Links ]
Tokumasu S, Aoki T and Oberwinkler F. 1994. Fungal succession on fir needles in Germany. Mycoscience 35: 29-37. https://doi.org/10.1007/BF02268525 [ Links ]
Vannini A and Vettraino AM. 2000. Ulocladium chartarum as the causal agent of a leaf necrosis on Quercus pubescens. Forest Pathology 30: 297-303. https://doi.org/10.1046/j.1439-0329.2000.00210.x [ Links ]
Videv PV, Gartner G, Uzunov BA, Dimitrova PH and Stoyneva-Gartner MP. 2017. Epimycotic Algae on the Medicinal Fungus Trametes versicolor (L.) Lloyd. International Journal of Advanced Research in Botany 3: 18-26. http://dx.doi.org/10.20431/2455-4316.0302004 [ Links ]
Wahl M. 2009. Epibiosis. Pp: 61-72. In: Wahl M (eds.). Marine Hard Bottom Communities. Ecological Studies. Vol 206. Springer. Dordrecht, Netherlands . 446p. https://doi.org/10.1007/b76710_4 [ Links ]
Warren SD, St. Clair LL, Stark LR, Lewis LA, Pombubpa N, Kurbessoianm T, Stajich JE, and Aanderud ZT. 2019. Reproduction and Dispersal of Biological Soil Crust Organisms. Frontiers in Ecology and Evolution 344: 1-18. https://doi.org/10.3389/fevo.2019.00344 [ Links ]
White TJ, Bruns T, Lee S and Taylor J. 1990. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. Pp: 315 -322. In: Junis MA (eds.). PCR protocols: A guide to methods and applications. Academic Press. San Diego, United States. https://doi.org/10.1016/B978-0-12-372180-8.50042-1 [ Links ]
Zhang Z, Schwartz S, Wagner L and Miller W. 2000. A greedy algorithm for aligning DNA sequences. Journal of Computational Biology 7:203-214. https://doi.org/10.1089/10665270050081478 [ Links ]
Recibido: 31 de Enero de 2022; Aprobado: 11 de Julio de 2023











 texto em
texto em 


