Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista mexicana de fitopatología
versão On-line ISSN 2007-8080versão impressa ISSN 0185-3309
Rev. mex. fitopatol vol.41 no.3 Texcoco Set. 2023 Epub 13-Out-2023
https://doi.org/10.18781/r.mex.fit.2303-4
Artículos científicos
Películas biodegradables con actividad fungistática para el control postcosecha de Fusarium solani en fruto de aguacate Hass
1 Centro de Investigación en Biotecnología Aplicada-Instituto Politécnico Nacional, Tlaxcala 90700, México;
2 CONACyT-Centro Universitario de Vinculación y Transferencia de Tecnología, Benemérita Universidad Autónoma de Puebla, Puebla 72570, México;
3 Dirección de Innovación y Transferencia de Conocimiento, Benemérita Universidad Autónoma de Puebla, Puebla 72570, México.
Existen escaza información sobre el uso de películas biodegradables para el control de enfermedades en cultivos de importancia agrícola. En consecuencia, el objetivo de este trabajo fue determinar la eficacia de películas híbridas de quitosano con aceite esencial de tomillo sobre frutos de aguacate Hass previamente infectados con Fusarium solani proveniente de la sierra nororiental de Puebla, México. Se identificó morfológica y molecularmente la cepa nativa de F. solani y se evaluó la actividad fungistática de tres películas de quitosano suplementadas con 0.7% (FT1), 1.0% (FT2) y 1.3% (FT3) de aceite esencial de tomillo en condiciones in situ sobre el crecimiento de F. solani en frutos de aguacate. La textura, transmitancia y opacidad de las películas fueron obtenidas mediante microscopía electrónica de barrido y espectrometría UV-Vis, respectivamente. De manera general, se observó que aquellas películas con mayor concentración de aceite esencial de tomillo (1-1.3% p/v) presentaron menor transmitancia en el rango de luz UV y mayor opacidad. Los frutos de aguacate infectados con F. solani simultáneamente tratados con las películas FT2 y FT3 redujeron la aparición de síntomas de infección preservando la firmeza, así como el contenido de fibra, grasa, azúcares reductores y proteína de manera significativa (p < 0.01). De igual forma, promovieron la conservación del contenido de los nutracéuticos ácido linoleico, ácido oleico, ácido palmítico y ácido palmitoleico por 21 días. Estos resultados sugieren que dichos materiales tienen la capacidad de controlar la fusariosis generada por este hongo prolongando la vida útil del fruto de aguacate Hass.
Palabras clave: Quitosano; Thymus vulgaris; fitopatógeno; pudrición; análisis bromatológicos; ácidos grasos
Little is known on the use of biodegradable films for the control of diseases in crops of agricultural importance. Consequently, the objective of this work was to determine the efficacy of chitosan hybrid films impregnated with thyme essential oil on Hass avocado fruits previously infected with Fusarium solani isolated from the northeastern highlands of Puebla, Mexico. The native strain of F. solani was morphologically and molecularly identified and the fungistatic activity of three chitosan films supplemented with 0.7% (FT1), 1.0% (FT2) and 1.3% (FT3) of thyme essential oil was evaluated in situ on the growth of F. solani in avocado fruits. Texture, transmittance and opacity of the films were obtained by scanning electron microscopy and UV-Vis spectrometry, respectively. Overall, it was recorded that films with a higher concentration of thyme essential oil (1-1.3% w/v) presented lower transmittance in the UV light range and higher opacity. Avocado fruits infected with F. solani simultaneously treated with FT2 and FT3 reduced the appearance of symptoms while preserved firmness, as well as fiber, fat, reducing sugars, and protein content (p < 0.01). In the same context, these materials promoted the conservation of the content of the nutraceuticals linoleic acid, oleic acid, palmitic acid and palmitoleic acid for 21 days. These results suggest that the hybrid films generated in the present study have the ability to control fusariosis caused by this fungus, prolonging the shelf life of Hass avocado fruit.
Key words: Chitosan; Thymus vulgaris; phytopathogens; rot; bromatological analysis; fatty acids
El género Fusarium, es un grupo de hongos fitopatógenos responsables de la pudrición seca y blanda de varias especies vegetales. Este género afecta el rendimiento y la calidad del fruto, además de producir micotoxinas que son perjudiciales para el ser humano. Algunas de las micotoxinas biosintetizadas por este género son el deoxinivalenol y zearalenonas que pueden afectar la salud animal incluyendo la humana (Liu et al., 2022). Dentro de las especies toxigénicas comunes se encuentran Fusarium sambucinum, F. oxysporum y F. solani (Liu et al., 2022). Fusarium solani es un hongo fitopatógeno responsable de la marchitez de algunas plantas, ya que afecta desde la raíz hasta la parte aérea provocando un daño que puede ser apreciado a simple vista (Mejía-Bautista et al., 2016). Adicionalmente, se ha registrado la presencia de F. solani en maíz (Zea mays), frijol (Phaseolus vulgaris), cilantro (Coriandrum sativum), jitomate (Solanum lycopersicum), trigo (Triticum aestivum), papa (Solanum tuberosum), aguacate (Persea americana) entre otros cultivos (Kong et al., 2022). El fruto del aguacate Hass representa un importante ingreso económico para México puesto que es el principal productor y exportador a nivel mundial (Ramos-Aguilar et al., 2021). Dicho fruto presenta alta demanda debido a las propiedades nutrimentales que ofrece al consumidor destacando el contenido de vitaminas, fibra, proteínas, azúcares reductores, minerales y ácidos grasos insaturados acumulados en su pulpa (Ramos-Aguilar et al., 2021). Algunos de estos componentes son aprovechados por microorganismos oportunistas para su beneficio afectando colateralmente la calidad del fruto (Mejía-Bautista et al., 2016). Fusarium solani es catalogado como un hongo fitopatógeno presente en el aguacate Hass porque causa marchitez o tristeza (Hernández-Medina et al., 2015). Este hongo se ha caracterizado por estar presente en el periodo de poscosecha siendo un factor que limita la comercialización del aguacate (Wanjiku et al., 2020). Aunque se ha observado un incremento en la producción del fruto, las pérdidas persisten debido a diversos factores bióticos y abióticos que alteran su fisiología (Bowen et al., 2018; Pandey et al., 2021). Se tiene registrado que las malas prácticas en el manejo del fruto durante la poscosecha provocan el desarrollo de problemas fitosanitarios (Ramírez-Gil et al., 2021). Estos problemas se han convertido en una crisis que incrementa cada día por el uso desmedido de agroquímicos. Así mismo, la aplicación indiscriminada estas sustancias aumenta la resistencia microbiana (Pandey et al., 2021). Por lo anterior, se ha optado por el uso de agentes de control de hongos fitopatógenos que sean eficaces y no perjudiciales para el medio ambiente y la salud pública. En función de lo anterior, nuestro grupo de investigación se ha enfocado en el diseño y aplicación de películas fungistáticas sobre base quitosano y enriquecidas con aceites esenciales de canela y tomillo para el control de distintos patógenos del aguacate Hass. Los materiales generados, han mostrado controlar de manera eficiente el crecimiento de Fusarium verticillioides y Clonostachys rosea en frutos de aguacate en condiciones de poscosecha (Coyotl-Pérez et al., 2022a; 2022b). En este contexto, los resultados sobre el uso de películas de quitosano impregnadas con el aceite esencial de tomillo reportados por Coyotl-Pérez et al. (2022a), señalaron que estos materiales son una alternativa viable para controlar la pudrición blanda causada por C. rosea en aguacate, por lo que la exploración de estas películas sobre otros patógenos del mismo fruto es altamente recomendable. La agricultura sostenible busca hacer frente a estos problemas con el fin de limitar el uso de productos sintéticos con efectos tóxicos (Eke et al., 2020). Actualmente, el uso de materiales antifúngicos como el quitosano ha adquirido una gran importancia principalmente para el control de enfermedades poscosecha (Yan et al., 2021). Sin embargo, el quitosano no es un polímero con actividad antifúngica de amplio espectro y puede ser inefectivo contra ciertos hongos filamentosos (Coyotl-Pérez et al., 2022a; 2022b). Los materiales hechos a base de quitosano y aceites esenciales representan una alternativa agroecológica para reducir la incidencia de enfermedades fúngicas durante el periodo poscosecha (Fernández et al., 2015). Con base a lo anterior, el objetivo de este trabajo fue determinar la eficacia de películas de quitosano impregnadas con aceite esencial de tomillo, sobre frutos de aguacate Hass infectados con una cepa nativa de Fusarium solani aislada y caracterizada a partir de frutos sintomáticos colectados en la Sierra Nororiental de Puebla.
Materiales y métodos
Aislamiento e identificación del hongo asociado. Fusarium solani fue aislado de aguacates con síntomas de pudrición blanda como resultado de la exploración de hongos asociados al fruto de aguacate Hass de la Sierra Nororiental del estado de Puebla, en investigaciones realizadas por Coyotl-Pérez et al. (2022a; 2022b) durante junio de 2021 en Yaonáhuac, Puebla, México (19°56′55″ N 97°26′26″ W; 1997 msnm). Una vez aislado, el hongo se mantuvo en medio agar dextrosa y papa (PDA). Adicionalmente, se realizaron microcultivos de 1 cm2 en PDA para la identificación y descripción de las estructuras reproductivas del hongo. El microcultivo se almacenó a 25 ºC durante 5 d en oscuridad y las estructuras fueron observadas en microscopio óptico Primo Star Carl Zeiss.
Identificación molecular. El hongo fue identificado mediante extracción del ADN genómico con el Kit E.Z.N.A Plant DNA DS Mini Kit (Omega Bio-Tek) y amplificación de marcadores moleculares usando los iniciadores ITS1 (TCCGTAGGTGAACCTGCGG) e ITS4 (TCCTCCGCTTATTGATATGC) para la obtención de la secuencia parcial del espaciador trascrito interno del gen ribosomal 18S (Coyotl-Pérez et al., 2022b). Además, se emplearon los iniciadores EF-1H (ATGGGTAAGGAAGACAAGAC) y EF-2T (GGAAGTACCAGTGATCATGTT) para la obtención de la secuencia parcial del gen del factor de elongación 1-alfa (TEF-1α) (Coyotl-Pérez et al., 2022b). Los amplicones resultantes se secuenciaron utilizando los servicios comerciales de Macrogen Inc. (Seúl, Corea del Sur). Una vez obtenidas, las secuencias fueron comparadas con aquellas depositadas en la base de datos del National Center for Biotechnology Information (NCBI), mediante alineamientos múltiples usando el programa BLAST.
Pruebas de patogenicidad. Siembras de hongos de 10 días de crecimiento en PDA, fueron incubados a 4 °C por 12 horas y expuestos a la radiación solar por 3 horas, durante tres días consecutivos. Lo anterior con la finalidad de estimular la generación de estructuras reproductivas. Las pruebas de patogenicidad se realizaron en frutos de aguacate Hass asintomáticos colectados en la misma zona de estudio de acuerdo con Coyotl-Perez et al. (2022a) . Las estructuras reproductivas (conidias) fueron recuperadas del medio de cultivo con solución salina estéril usando una micropipeta de 200 µL para finalmente ajustarse a una concentración de 10,000 conidios por mL usando una cámara de Neubauer. Un total de 100 conidias fueron inoculadas en cada fruto sano mediante penetración mecánica, con el objetivo de aumentar las probabilidades de infección. Los aguacates fueron incubados a temperatura ambiente (25 °C) a una humedad relativa de 70 °C y fotoperiodo de 12 h:12 h de luz y oscuridad durante por 21 días. Los síntomas y signos de pudrición blanda fueron monitoreados diariamente durante el mismo periodo de tiempo.
Análisis filogenético. El análisis filogenético de la cepa nativa de F. solani se realizó de acuerdo a lo reportado por Romero-Arenas et al. (2022), usando el programa Clustal X versión 2.0. Los alineamientos múltiples se efectuaron con las secuencias ITS y EF-1α por separado. Posteriormente, se utilizó el programa de análisis evolutivo MEGA versión 11.0.11 para realizar la concatenación (ensamblaje) de ambas secuencias y la obtención del árbol filogenético.
Cuantificación de la actividad antifúngica in vitro. El aceite esencial de tomillo usado en esta investigación se extrajo y evaluó de acuerdo con los protocolos descritos previamente por Coyotl-Pérez et al. (2022a) . La composición química del aceite se detalla en el Cuadro 1. La obtención de la concentración mínima inhibitoria (MIC) se obtuvo mediante microdilución en caldo dextrosa y papa (PDB) en microplacas de Elisa de 96 pocillos usando resazurina (1 mM; Sigma-Aldrich Co. St Louis MO) como indicador de viabilidad en un volumen final de 300 µL. Discos hifales de 5 mm de diámetro fueron colocados en cada pozo e incubados a 28 °C por 48 h con diferentes concentraciones de aceite esencial de tomillo (0.1-6 mg mL-1) emulsificado en etanol absoluto. Los discos hifales fueron obtenidos a partir de cultivos de F. solani de 7 d crecidos en PDA. Al término de este tiempo, la absorbancia se determinó a 630 nm usando PDB más resazurina y PDB con resazurina más discos hifales como controles para normalizar los resultados obtenidos.
Cuadro 1 Composición química del aceite esencial de tomillo usado como agente antifúngico en las películas de quitosano evaluadas en la presente investigación. El perfil químico ha sido reportado previamente por Coyotl-Pérez et al. (2022a).
| Compound | etention index | Abundance (%) |
|---|---|---|
| Alpha-Pinene | 939 | 2.5 |
| Camphene | 946 | 2.8 |
| Beta-Pinene | 974 | 2.1 |
| Alpha-Phellandrene | 1002 | 0.5 |
| (2E)-Hexenyl acetate | 1010 | 2.9 |
| o-Cymene | 1022 | 15.7 |
| Gamma-Terpinene | 1054 | 12.4 |
| Linalool | 1095 | 1.6 |
| 1-Terpineol | 1130 | 2.4 |
| Camphor | 1141 | 0.5 |
| Borneol | 1165 | 1.4 |
| Alpha-Terpineol | 1186 | 0.3 |
| Thymol, methyl eter | 1232 | 1.7 |
| Thymol | 1289 | 43.6 |
| Beta-Cubebene | 1387 | 3.3 |
| Beta-Elemene | 1389 | 0.5 |
| Beta-Caryophyllene | 1417 | 1.2 |
| Total | 95.4 |
Para obtener la MIC se efectuaron 20 repeticiones (n=20) para cada punto de la curva dosis-respuesta y se calculó el porcentaje de inhibición con la siguiente formula:
Donde:
Abs: es el valor de la absorbancia a 630 nm
AE: Aceite esencial
Elaboración de películas y caracterización fisicoquímica. Las películas se obtuvieron de acuerdo a la metodología reportada por Coyotl-Pérez et al. (2022a; 2022b) usando quitosano de peso molecular medio adquirido de Sigma-Aldrich Co. (St. Louis, MO, USA) con ligeras modificaciones. Tres concentraciones de aceite esencial de tomillo (0.7, 1.0 y 1.3% p/v) fueron mezcladas con 0.1 L de una solución de quitosano al 1% (p/v) en agitación constante a 50 °C durante una hora y media. Veinte mililitros de la solución fueron vertidos en placas de Petri de 9 cm de diámetro para ser deshidratadas a 25 °C en un desecador de vidrio conteniendo gel de sílice durante 5 d. Las películas fueron extraídas manualmente de la placa Petri y denominas como FT1, FT2 y FT3 en orden creciente de concentración de aceite. Posteriormente, fueron sometidas a análisis fisicoquímicos y evaluación biológica de acuerdo con Coyotl-Pérez et al. (2022a) y Morales-Rabanales et al. (2022). En la parte fisicoquímica se determinó la transmitancia y opacidad mediante espectrofotometría UV-Vis así como la textura por microscopía electrónica de barrido (SEM) usando un aparato JEOL JSM-6610 (Akishima, Kanto, Japón). Las condiciones de los ensayos SEM fueron aquellas reportadas por Morales-Rabanales et al. (2022). Por otra parte, se midió el grosor de cada película (n=10) con un micrómetro digital iGaging con precisión de 0.001 mm. La opacidad y transmitancia fueron asociadas al grosor y la absorbancia de las películas de acuerdo con los mismos autores (Morales-Rabanales et al., 2022). Las pruebas biológicas con los materiales obtenidos se detallan en la siguiente sección.
Actividad fungistática de las películas de quitosano y aceite esencial de tomillo. Frutos sanos de aguacate colectados en la zona de estudio fueron trasladados al laboratorio para ser sanitizados por inmersión con hipoclorito de sodio al 20% durante 1 hora y posteriormente se enjugaron con agua destilada estéril. Para cada tratamiento se utilizaron 25 aguacates (n=25), los cuales fueron inoculados en un solo punto del fruto con 100 conidios disueltos con solución salina (20 µL) usando una micropiteta de 20 µL de capacidad. Posteriormente, se les colocó una película específica (FT1-FT3). La cantidad de conidios en la solución se calculó usando una cámara de Neubauer. Los grupos controles constaron de aguacates infectados sin película (control de infección), aguacates sanos sin película (controles de no infección) y, aguacates cubiertos con películas de quitosano puro sin aceite esencial. Los grupos experimentales fueron incubados a 25 °C a una humedad relativa del 70% en fotoperiodo de 12 h luz y 12 h oscuridad durante 21 días y se documentó la aparición de síntomas y signos de infección, como fueron pérdida de turgencia y aparición de micelio durante 21 d. Simultáneamente, se realizó una evaluación in situ sobre la superficie de las películas, donde se utilizaron cuadros de 1 cm2 sobre los cuales se vertieron 100 conidios viables diluidos en un volumen final de 10 µL. Como control de germinación conidial se empleó 1 cm2 de PDA inoculado con la misma cantidad de conidios. Las películas fueron incubadas a 25 °C a una humedad relativa del 70% en fotoperiodo de 12 h luz y 12 h oscuridad por 7 d. Al término de este tiempo, los materiales se observaron bajo microscopio óptico para constatar la presencia micelio. En los tratamientos en los que se observó micelio este se recolectó y se resembró en medio PDA para corroborar la presencia de F. solani.
Análisis de parámetros de calidad. Como primer parámetro de calidad, se evaluó la firmeza de acuerdo con Coyotl-Pérez et al. (2022a). Adicionalmente, se determinó la composición nutricional (proteínas, azúcares reductores, grasa y fibra) de los frutos de aguacate bajo la metodología reportada por la AOAC (2019). Complementariamente, se determinaron los niveles de ácido linoleico (18:2 n-6), ácido oleico (18:1 n-9), ácido palmítico (16:0) y ácido palmitoleico (16:1) como valoración del contenido nutracéutico del fruto (Coyotl-Pérez et al., 2022a).
Análisis estadístico. Los datos de los tratamientos fueron interpretados mediante un análisis de varianza acoplado a una prueba Tukey (p < 0.01) con software GraphPad Prism versión 8.0.1.
Resultados y discusión
Identificación y caracterización. Morfológicamente, la cepa aislada presentó una coloración blanca en su anverso y crema en el reverso (Figura 1A y 1B). Esta mostró borde filamentoso, textura algodonosa, consistencia suave y crecimiento radial moderado (4-7 días). Los macroconidios fueron rectos y ligeramente curvados con paredes delgadas. Las células apicales se encontraron ligeramente curvadas y septadas, a partir de las cuales emergen monofiálides no ramificadas. Los macroconidios midieron 20 a 40 μm de largo, fueron delgados, ligeramente curveados y cada macroconidio presentó tres septos (Figura 1C) Los microconidios midieron de 5.96 a 10.3 μm de largo (Figura 1D). Estas características morfológicas fueron consistentes con las descritas por Wanjiku et al. (2020) y Dugassa et al. (2021) para Fusarium solani.
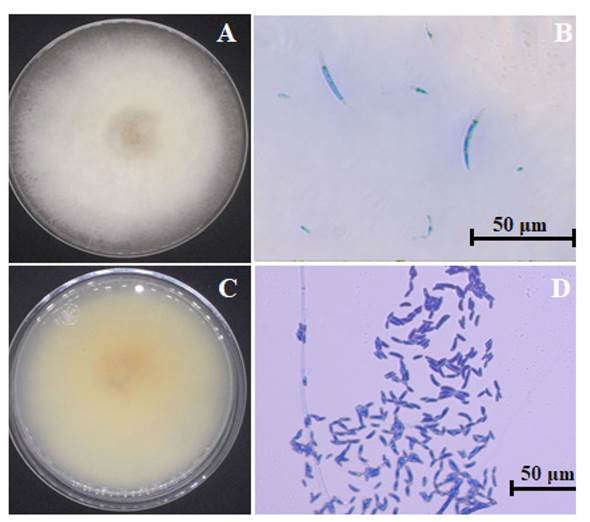
Figura 1 Morfología de Fusariun solani. A) crecimiento radial observado desde el anverso de la placa Petri en medio PDA después de 7 dias. B) crecimiento radial observado desde el reverso de la placa Petri. C) Macroconidios observados a 50X sin tinción. D) Microconidios observados a 50X teñidos con azul de algodón
El análisis molecular, reveló que la secuencia codificante para el espaciador transcrito interno tuvo una homología del 98.8% con la secuencia MN523174.1 de Fusarium solani reportada por Rivedal et al. (2020). La secuencia fue depositada en el banco de genes del NCBI con el número de accesión OR016146. Por otra parte, la secuencia de 682 pb correspondiente al factor de elongación 1-alfa, tuvo una homología del 97.7% con la secuencia HM852038.1 de Fusarium solani reportada por Scheel et al. (2013).
Análisis filogenético. La historia evolutiva se infirió utilizando el método Neighbor-Joining, misma que permitió predecir la filogenia de Fusarium solani mostrando una suma de longitud de rama igual a 0.23497162 (Figura 2). El porcentaje de réplicas se agrupó en la prueba de arranque (1000 permutaciones) a una escala de 0.020 a partir la concatenación de secuencias ITS y EF-1α. Este análisis involucró 12 secuencias de nucleótidos y el modelo evitó brechas de alineación con un total de 1014 posiciones en el conjunto final de datos. Dichas secuencias se eligieron con base al porcentaje de homología con las secuencias obtenidas para F. solani aisladas en la presente investigación.
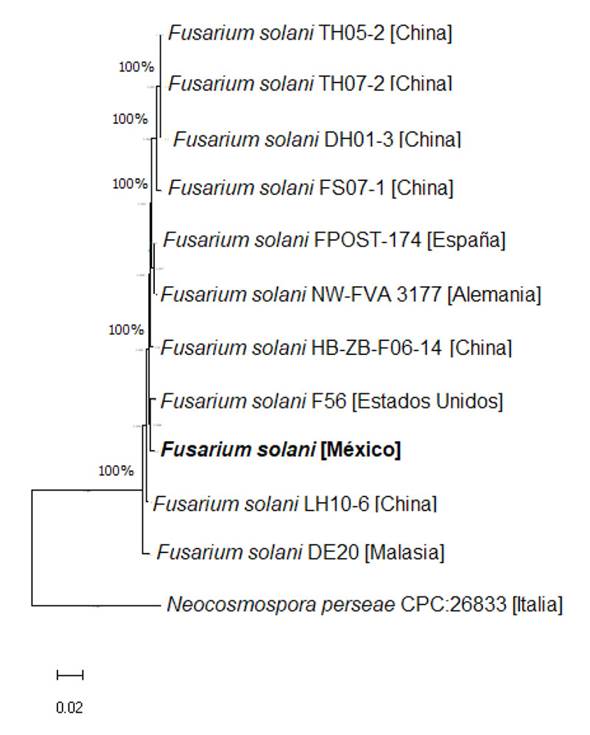
Figura 2 Árbol filogenético de Fusarium solani con secuencias concatenadas de ITS y EF-1α. La cepa de F. solani aislada de la Sierra Nororiental del estado de Puebla se resalta en letras negritas
Las secuencias concatenadas pertenecieron a las accesiones descritas en el Cuadro 2. La mayoría de secuencias homólogas de Fusarium solani pertenecieron a aquellas aisladas de Panax ginseng provenientes de China.
Cuadro 2. Secuencias génicas extraídas del banco de genes del National Center fo Biotechnology Information para estimar la proximidad filogenética.
| Species | Strain | Source | Country | Accesion ITS/TEF-1α | |
|---|---|---|---|---|---|
| Fusarum solani | FS07-1 | Panax ginseng | China | MN636714.1 | MN650117.1 |
| F. solani | DH01-3 | Ginseng (root) | China | MN637839.1 | MN650105.1 |
| F. solani | TH05-2 | Ginseng (root) | China | MN637848.1 | MN652892.1 |
| F. solani | LH10-6 | Oryza sativa | China | MK611942.1 | MN927129.1 |
| F. solani | F56 | Lilium longiflorum | Estados Unidos | HQ379676.1 | KY020039.1 |
| F. solani | FPOST-174 | Strawberry | España | KY484986.1 | KX215054.1 |
| F. solani | HB-ZB-F06-14 | Beet | China | KT213074.1 | KT213256.1 |
| F. solani | DE20 | Mangrove soil | Malasia | KF897899.1 | KM580560.1 |
| F. solani | TH07-2 | Ginseng (root) | China | MN637851.1 | MN652894.1 |
| F. solani | NW-FVA_3177 | Fraxinus excelsior | Alemania | MH191237.1 | MH220421.1 |
| Neocosmospora perseae | CPC:26833 | Persea americana | Italia | LT991944.1 | LT991906.1 |
| F. solani | MA-W2 | Persea americana | Mexico | OR016146 | TEF submitted |
Ensayos de evaluación antimicrobiana por microdilución en caldo. Los resultados del presente estudio demostraron que el aceite esencial de tomillo ejerció una MIC de 4.4 ± 0.04 mg mL-1 sobre F. solani. Se sabe que los aceites esenciales funcionan como agentes antifúngicos naturales, ecológicos, renovables y fácilmente biodegradables para la conservación de muchos alimentos (Pandey et al., 2017). El mecanismo de acción de los aceites esenciales radica en desestabilizar la pared celular y membrana citoplasmática de hongos y bacterias (Pacheco-Hernández et al., 2020). En consecuencia, se genera una fuga de compuestos intracelulares que provocan la muerte celular por lisis (Eke et al., 2020). Se ha reportado la acción antimicrobiana de algunos extractos metanólicos de plantas como aquellos de Artemisia annua (Zaker, 2014) y Larrea tridentata (Rodríguez-Castro et al., 2020) contra Fusarium solani con porcentajes de inhibición superiores al 50% en dosis de 5 mg mL-1. Coyotl-Pérez et al. (2022a) reportaron la concentración de aceite esencial tomillo evaluada contra Clonostachys rosea fue de 2.13 mg mL−1, siendo mucho menor. Interesantemente, el aceite usado en este estudio tuvo la misma composición química que la reportada por los mismos autores, siendo el timol (43.6%), O-cimeno (15.7%) y ɣ-terpineno (12.4%) los compuestos mayoritarios (Coyotl-Pérez et al., 2022a
Caracterización fisicoquímica de las películas. La microestructura obtenida por microscopía electrónica de barrido (SEM) reveló que la superficie de las películas híbridas de quitosano obtenidas en este trabajo, fue uniforme al igual que aquellas reportadas para inhibir el crecimiento de C. rosea en fruto de aguacate (Coyotl-Pérez et al., 2022a). No se observaron poros, burbujas o grietas (Figura 3), lo cual indicó una alta miscibilidad entre la matriz polimérica y el aceite esencial. Sin embargo, pequeñas irregularidades fueron observadas al corte transversal (Figura 3), mismas que no interfirieron su maleabilidad. La adición de aceites esenciales en matrices poliméricas requiere emulsificación y como resultado, el material seco no presenta gotas de lípidos en la superficie (Lian et al., 2020; Ardjoum et al., 2023). Se ha observado este mismo fenómeno en otras películas impregnadas con aceites esenciales de clavo (Syzygium aromaticum), citronela (Pelargonium citrodorum) y tomillo (Thymus vulgaris) (Haghighi et al., 2019). De acuerdo con estudios previos, la superficie de una gran variedad de películas híbridas suele ser uniforme y no presenta burbujas, gotas, poros o grietas (Haghighi et al., 2019). Contrastantemente, los materiales generados en esta investigación muestran pequeños poros al corte transversal, sobre todo en aquellas películas con mayor cantidad de aceite como FT2 y FT3 (Figura 3). Estos poros podrían atribuirse a la volatilidad del aceite esencial durante el secado (Lauriano et al., 2017).

Figura 3 Imágenes de microscopía electrónica de barrido de la vista transversal y superficie de las películas elaboradas con quitosano y aquellas suplementadas con aceite esencial de tomillo (FT1-FT3).
La transmitancia observada para las películas de quitosano que contuvieron 0.7% de aceite esencial de tomillo mostró un comportamiento similar a aquellas de quitosano puro (Figura 4A). La transmitancia UV (190-300 nm) y de luz visible (350-800) fue semejante en las películas de quitosano y FT1 sin diferencias estadísticamente significativas (p < 0.01). Sin embargo, se observaron diferencias estadísticamente significativas (p < 0.01) entre las películas FT2 y FT3 con aquellas de quitosano y FT1 a partir de 400-1000 nm (Figura 5). Por el contrario, la opacidad de las películas FT2 y FT3 mostró un claro efecto protector contra la luz UV con diferencias estadísticamente significativas (p < 0.01) respecto al resto de las películas (Figura 4B). Así mismo, las películas de quitosano puro y FT1 no presentaron diferencias estadísticamente significativas entre ellas. Por otro lado, el grosor de las películas aumentó con base a la concentración de aceite impregnado concordando con Coyotl-Pérez et al. (2022a). El grosor de las películas de quitosano, FT1, FT2 y FT3 fue de 0.103, 0.208, 0.223 y 0.251 mm respectivamente siendo reproducible con lo reportado previamente para el mismo tipo de películas (Coyotl-Pérez et al., 2022a). Lian et al. (2020) elaboraron películas con diferentes polímeros (goma xantana, pululano, goma tragacanto y goma arábiga) suplementadas con aceite esencial de tomillo para controlar el crecimiento de E. coli en nectarina. Dichas películas también mostraron un aumento en grosor al adicionar concentraciones crecientes de aceite esencial. No obstante, algunos estudios sugieren que el grosor de las películas suplementadas con aceites esenciales está asociado con los cambios de los enlaces de hidrógeno, así como con la ionización de los grupos amino o carboxilo (Lian et al., 2020). Como es sabido, la opacidad y transmitancia cumplen la función de una barrera contra la radiación UV, misma que provoca una degradación rápida de los alimentos. Altos niveles de opacidad y baja transmitancia son clave para preservar las propiedades organolépticas y retardar la oxidación de lípidos (Romanazzi et al., 2017). La capacidad de repeler la luz UV es un factor importante en la conservación de alimentos ya que dicha radiación causa una rápida degradación debido al estrés oxidativo que genera (Romanazzi et al., 2017).

Figura 4 Transmitancia (A) y opacidad (B) de las películas de quitosano puro (sin aceite esencial) y películas impregnadas con aceite esencial de tomillo en concentraciones de 0.7 (FT1), 1.0 (FT2) y 1.3 % p/v (FT3). Las letras indican diferencias estadísticamente significativas (p < 0.01) de acuerdo a la prueba ANOVA-Tukey (n=5)

Figura 5 Cinética cualitativa de la colonización de Fusarium solani en frutos de aguacate tratados con películas de quitosano y aceite esencial de tomillo en concentraciones de 0.7 (FT1), 1.0 (FT2) y 1.3% p/v (FT3) durante 21 días.
Evaluación in situ de películas de quitosano impregnados con aceite esencial de tomillo. De las cuatro películas evaluadas, las de quitosano puro no ejercieron un efecto inhibitorio sobre el crecimiento de F. solani. Un resultado similar fue observado en fruto de aguacate Hass infectado con Clonostachys rosea y Fusarium verticillioides (Coyotl-Pérez et al., 2022a; 2022b). Por otro lado, las películas FT2 y FT3 mostraron un claro retraso en el crecimiento de F. solani hasta 21 días post-tratamiento (Figura 5). La adición de aceite esencial de tomillo a la matriz de quitosano potencializa el efecto antimicrobiano, esto de acuerdo con resultados previos observados en películas elaboradas con almidón de maíz sobre Escherichia coli y Listeria monocytogenes (Ardjoum et al., 2023). Se ha demostrado que recubrimientos de pectina impregnados con aceites esenciales reducen el recuento de microorganismos (bacterias lácticas, levaduras y mohos) en alimentos de origen animal como las mortadelas (Gedikoğlu, 2022). Por otro lado, se han evaluado diversos aceites esenciales ricos en carvacrol y timol para mejorar la vida útil poscosecha de aguacate. Estos aceites esenciales fueron extraídos de Thymus daenensis y Satureja khuzistanica y mostraron alta efectividad contra la antracnosis (Colletotrichum gloeosporioides) (Sarkhosh et al., 2017).
Los frutos de aguacate tratados con los recubrimientos no mostraron síntomas de infección mientras que los frutos infectados no tratados fueron afectados desde los primeros tres días (Figura 6A). Por otro lado, los aguacates infectados, tratados con las películas de quitosano y FT1 presentaron crecimiento desde el día 5 (Figura 6A). Estos resultados sugieren que el quitosano por sí mismo no controla el crecimiento de F. solani. A pesar de esto, se tiene documentado que el quitosano daña la pared celular y altera la permeabilidad de la membrana celular de hongos filamentosos (Romanazzi et al., 2017). La evaluación de la germinación de conidios sobre la superficie de las películas FT1-FT3 demostró una clara pérdida en su viabilidad, sugiriendo que las superficies que contuvieron mayor cantidad de aceite de tomillo son más efectivas y podrían ser usadas preferentemente como agentes preventivos (Figura 6B). Los resultados de esta investigación sugieren que el aceite esencial de tomillo impregnado en películas de quitosano, retrasa de manera sustancial el crecimiento de Fusarium solani al menos por 21 días. Sin embargo, el efecto residual podría incluir hasta 30 días de protección de acuerdo a observaciones documentadas (datos no mostrados).
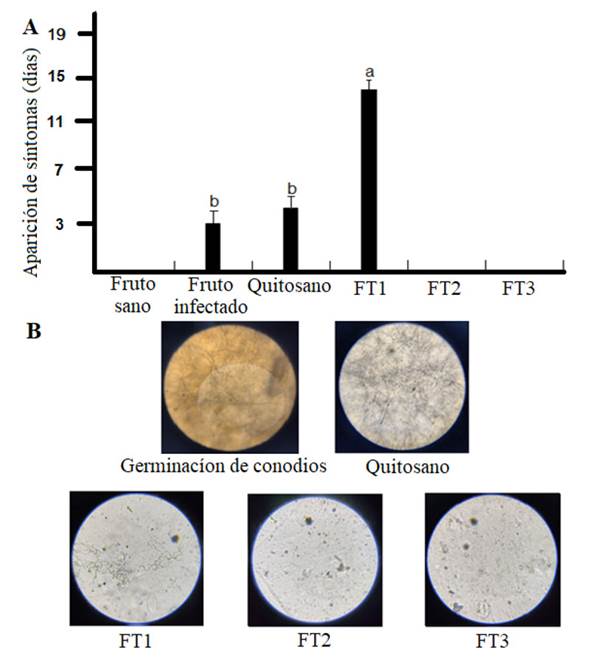
Figura 6 Cinética de aparición de síntomas de infección tras la inoculación in situ de Fusarium solani en frutos de aguacate (A). Evaluación de la viabilidad de conidios de F. solani sobre la superficie de las películas FT1-FT3 (B). Medias (n=25) con letra distinta indican diferencias estadísticamente significativas (p < 0.01) por ANOVA-Tukey.
Firmeza de frutos de aguacate. Los frutos infectados disminuyeron notablemente su firmeza (69.5%) en 21días. En el mismo tiempo, los aguacates sanos mostraron una pérdida de turgencia del 19.5 al 26.6% (Figura 7). Las películas FT1, FT2 y FT3 conservaron significativamente la firmeza de los aguacates (p < 0.01) al día 21 en comparación con aguacates infectados y sanos. El timol (como volátil mayoritario del aceite esencial de tomillo) es un monoterpenoide fenólico que causa daño físico a los hongos cambiando la permeabilidad de la membrana celular (Sarkhosh et al., 2017). Los resultados del análisis estadístico revelaron diferencias estadísticamente significativas (p < 0.01) en la firmeza de aguacates sanos y aquellos cubiertos con las películas FT2 y FT3. Así mismo, los aguacates tratados con las películas de quitosano puro presentaron una pérdida mayor al 13% en relación con aguacates sanos no tratados. Estas evidencias reforzaron el hecho de que el quitosano no ejerce una actividad fungistática prolongada sobre F. solani. Se ha reportado que la aplicación de aceite esencial de tomillo y ajedrea (Satureja montana) mantiene la firmeza de frutos de aguacate en comparación con los aceites de menta (Mentha piperita), canela (Cinnamomum verum) o lavanda (Lavandula angustifolia) durante el almacenamiento (Sarkhosh et al., 2017). Estudios previos efectuados por nuestro grupo de investigación, indican que la pérdida de firmeza en fruto de aguacate Hass cosechados en la sierra nororiental del estado de Puebla, es mayormente afectada por Clonostachys rosea (Coyotl-Pérez et al., 2022a; 2022b). La pérdida de firmeza puede atribuirse a la degradación de los componentes de la pared celular (pectinas) por la acción de pectinesterasas y poligalacturonasas fúngicas (Huber et al., 2001). La pérdida de turgencia se traduce en un déficit de agua en los tejidos vegetales provocando cambios en la textura vegetal (Bello et al., 2016). La firmeza es un parámetro muy importante en la calidad de frutos perecederos y las técnicas que favorecen su conservación representan un área de oportunidad que debe ser abordada con especial interés (Jha et al., 2012; Pedreschi et al., 2019).
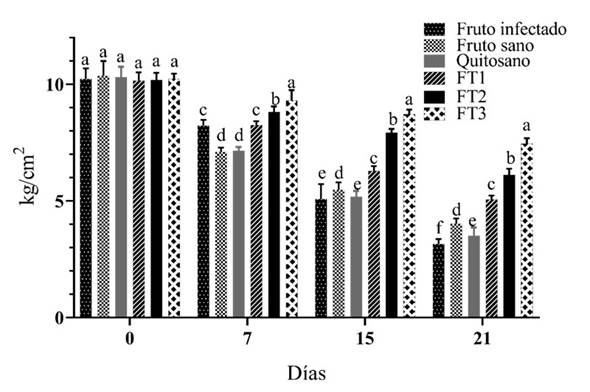
Figura 7 Firmeza de aguacates tratados con las películas híbridas FT1-FT3. Medias con letras divergentes, indican diferencias estadísticamente significativas (p < 0.01) por ANOVA-Tukey (n=25).
Parámetros de calidad nutricional y nutracéutica. Los aguacates infectados con F. solani mostraron una dramática reducción en la cantidad de grasa (1.36 ± 0.4 g/100 g) al día 21 en comparación con frutos sanos (Figura 8). Por lo contrario, los aguacates tratados con las películas FT2 y FT3 presentaron diferencias estadísticamente significativas al día 21 (p < 0.01) respecto al grupo de aguacates infectados. Sin embargo, aquellos frutos tratados con las películas de quitosano puro y FT1 no presentaron diferencias estadísticamente significativas en relación a los frutos infectados, pero si con los frutos sanos. Respecto al contenido de grasa total, los aguacates infectados tuvieron una reducción de más del 60% al día 21 en relación a frutos sanos. De igual forma, la cantidad de proteína disminuyó 49% en aguacates infectados por F. solani al día 21 en comparación con aguacates sanos (p < 0.01). También se observó que los aguacates infectados, así como aquellos tratados con películas de quitosano puro y FT1 no presentaron diferencias estadísticamente significativas (p < 0.01) entre ellos al día 21. Sin embargo, los aguacates tratados con las películas FT3 mostraron diferencias estadísticamente significativas (p < 0.01) en comparación con los aguacates sanos e infectados. Por otro lado, los aguacates tratados con las películas FT2 y FT3 preservaron hasta un 37% más el contenido de proteínas al día 21 en comparación con frutos sanos. Contrariamente, los azúcares reductores disminuyeron hasta un 90% en frutos infectados al día 21 en comparación con frutos sanos. Este hecho podría estar relacionado con la actividad parasítica del hongo filamentoso al usar azucares reductores como fuente de carbono. En adición, al día 21 los aguacates infectados previamente tratados con las películas FT2-FT3 presentaron diferencias estadísticamente significativas en el contenido de azúcares en comparación con aguacates sanos (p < 0.01). Así mismo, el contenido de fibra en aguacates infectados se redujo hasta un 90% al día 21 en comparación a frutos sanos. Los tratamientos con quitosano y FT1 presentaron diferencias estadísticamente significativas (p < 0.01) al día 21 respecto a los aguacates sanos ya que existió una pérdida del 70 y 21%, respectivamente. Los tratamientos FT2 y FT3 mantuvieron eficientemente el contenido de fibra, pero entre estos tratamientos no existieron diferencias estadísticamente significativas (p < 0.01) en comparación con aguacates sanos.
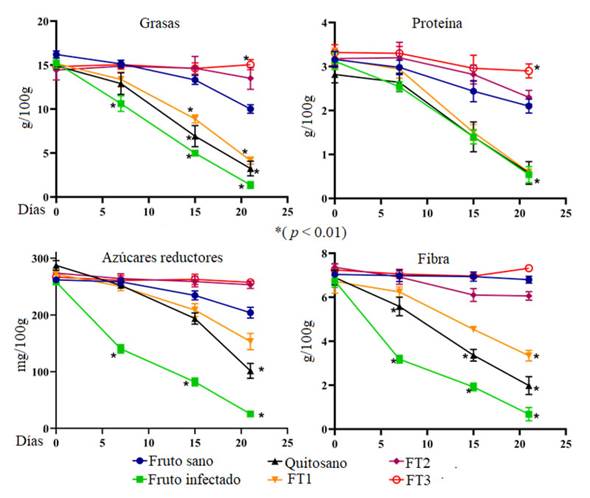
Figura 8 Contenido de grasas, proteínas, azúcares reductores y fibra en frutos de aguacates Hass tratados con las películas hibridas impregnadas con aceite esencial de tomillo en concentraciones de 0.7 (FT1), 1.0 (FT2) y 1.3% p/v (FT3) durante 21 días. Los asteriscos indican medias (n=25) con diferencias estadísticamente significativas sobre ANOVA-Tukey (p < 0.01).
El fruto de aguacate contiene nutrientes que favorecen la dieta humana debido a la alta cantidad de proteínas (4%), pero sobre todo es altamente valuado por la cantidad de grasas benéficas (30%) (Selladurai y Madhav, 2020). Aunado a ello, el contenido de ácidos grasos juega un papel muy importante para disminuir el riesgo de enfermedades cardiovasculares (Krumreich et al., 2018).
El decremento en el contenido de azúcares reductores fue inversamente proporcional al incremento en la producción de ácidos grasos. Esto podría estar relacionado a la sobreexpresión de genes asociados a la glucólisis como fuente potencial de piruvato para la síntesis de ácidos grasos por medio de la excreción de citrato hacia el citosol (Pedreschi et al., 2019). La determinación de los niveles del ácido linoleico en frutos infectados reveló que F. solani disminuyó drásticamente su contenido al día 21 respecto a frutos sanos (Figura 9). Tal disminución fue evidente en aguacates infectados durante la maduración y sugiere que F. solani podría metabolizar ácidos grasos como sustrato para su desarrollo (Pedreschi et al. 2019; Bowen et al., 2018). Por lo contrario, los aguacates que fueron tratados con las películas FT3 presentaron diferencias estadísticamente significativas al día 21 (p < 0.01) respecto a los aguacates sanos. Los frutos infectados y aquellos tratados con las películas de quitosano no presentaron diferencias estadísticamente significativas entre sí, pero si en contraste con frutos sanos al día 21. El contenido de ácido oleico en aguacates infectados tuvo una reducción del 70% al 21 siendo altamente significativa (p < 0.01). Villa et al. (2011) reportaron al ácido oleico como el principal ácido graso en el aguacate Hass ya que conforma entre el 67-70% del total de su composición lipídica. Los autores observaron un aumento significativo de ácidos grasos monoinsaturados y saturados durante la maduración del aguacate. Contrariamente, concluyeron que el contenido de ácidos grasos poli-insaturados disminuyó. Los aguacates infectados con películas de quitosano presentaron diferencias estadísticamente significativas al día 21 en referencia a los aguacates sanos. Sin embargo, los aguacates tratados con las películas FT3 no presentaron diferencias estadísticamente significativas (p < 0.01) en comparación con los aguacates sanos al día 21.

Figura 9 Contenido de ácido linoleico, oleico, palmítico y palmitoleico en frutos de aguacates Hass tratados con las películas hibridas impregnadas con aceite esencial de tomillo en concentraciones de 0.7 (FT1), 1.0 (FT2) y 1.3% p/v (FT3) durante 21 días. Los asteriscos indican medias (n=25) con diferencias estadísticamente significativas por ANOVA-Tukey (p < 0.01).
Por otra parte, el ácido palmítico disminuyó 63.5% en frutos infectados mientras que aquellos tratados con películas de quitosano presentaron diferencias estadísticamente significativas en contraste con los aguacates sanos (p < 0.01). De la misma forma, los aguacates tratados con las películas FT1 y FT2 presentaron diferencias estadísticamente significativas en referencia a los aguacates sanos ya que preservaron el contenido de este ácido graso entre un 37.1 y 40%. Finalmente, el contenido de ácido palmitoleico en aguacates infectados se redujo hasta un 67.6% respecto a aguacates sanos. Los tratamientos con quitosano y FT1 presentaron diferencias estadísticamente significativas (p < 0.01) al día 21 respecto a los aguacates sanos para este ácido graso, mientras que los tratamientos FT2 y FT3 mantuvieron el contenido de ácido palmitoleico sin mostrar diferencias estadísticamente significativas en referencia a los aguacates sanos. Pedreschi et al. (2019) sostienen que la concentración de los ácidos palmítico y palmitoleico en aguacates usualmente aumenta entre 65 a 105 días en plantas intactas. Los resultados de esta investigación sugieren que durante un periodo de 21 días los niveles de estos ácidos grasos son estables, sin embargo, se requiere una ventana mayor de tiempo para corroborar los hallazgos de Pedreschi et al. (2019).
Conclusiones
Las películas generadas en esta investigación mostraron actividad fungistática contra una cepa nativa de Fusarium solani aislada de aguacate Hass proveniente de la Sierra Nororiental del estado de Puebla. La adición del aceite esencial de tomillo en combinación con quitosano resultó en una mejora de las propiedades biológicas y fisicoquímicas en dichas películas. Remarcablemente, las películas de quitosano puro no detuvieron el crecimiento del hongo bajo las condiciones experimentales de este trabajo. Se observó que la transmitancia y opacidad mejoraron sustancialmente con la adición del aceite esencial de tomillo. Las películas fungistáticas obtenidas en esta investigación retrasaron el crecimiento del hongo y preservaron las propiedades nutrimentales y nutracéuticas en fruto de aguacates Hass por 21 días. Estos resultados sugieren la posible utilización de estas películas en frutos de aguacate para reducir la incidencia de F. solani durante la poscosecha.
Cited literature
AOAC. 2019. Official Methods of Analysis of AOAC International. 21st ed. AOAC International; Gaithersburg, MA, USA. [ Links ]
Ardjoum N, Chibani N, Shankar S, Salmieri S, Djidjelli H and Lacroix M. 2023. Incorporation of Thymus vulgaris essential oil and ethanolic extract of propolis improved the antibacterial, barrier and mechanical properties of corn starch-based films. International Journal of Biological Macromolecules 224: 578-583. https://doi.org/10.1016/j.ijbiomac.2022.10.146. [ Links ]
Bello LJE, Balois MR, Sumaya MMT, Juárez LP, Jiménez REI, Sánchez HLM, López G GG and García PJD. 2016. Biopolímeros de mucilago, pectina de nopalitos y quitosano, como recubrimiento en almacenamiento y vida de anaquel de frutos de aguacate Hass. Acta Agrícola y Pecuaria 2(2): 43-50. http://aap.uaem.mx/index.php/aap/article/view/24 [ Links ]
Bowen J, Billing D, Connolly P, Smith W, Cooney J and Burdon J. 2018. Maturity, storage and ripening effects on anti-fungal compounds in the skin of ‘Hass’ avocado fruit. Postharvest Biology and Technology 146(1): 43-50. https://doi.org/10.1016/j.postharvbio.2018.08.005 [ Links ]
Coyotl-Pérez WA, Rubio-Rosas E, Morales-Rabanales QN, Ramírez-García SA, Pacheco-Hernández Y, Pérez-Esapaña VH, Romero-Arenas O and Villa-Ruano N. 2022a. Improving the shelf life of avocado fruit against Clonostachys rosea with chitosan hybrid films containing thyme essential oil. Polymers 14(10): 2050. https://doi.org/10.3390/polym14102050 [ Links ]
Coyotl-Pérez WA, Morales-Rabanales QN, Lozoya-Gloria E, Becerra-Martinez E, Ramirez-García SA, Mosso-González C and Villa-Ruano N. 2022b. Fungistatic films containing cinnamon essential oil: new coatings to preserve the nutraceutical content of avocado fruit against fusariosis. Chemistry and Biodiversity 19(8): e202200441. https://doi.org/10.1002/cbdv.202200441 [ Links ]
Dugassa A, Alemu T and Woldehawariat Y. 2021. In-vitro compatibility assay of indigenous Trichoderma and Pseudomonas species and their antagonistic activities against black root rot disease (Fusarium solani) of faba bean (Vicia faba L.). BMC Microbiology 21(1): 115. https://doi.org/10.1186/s12866-021-02181-7 [ Links ]
Eke P, Adamou S, Fokom R, Dinango NV, Tsouh FPV, Wakam LN, Nwaga D and Fekam BF. 2020. Arbuscular mycorrhizal fungi alter antifungal potential of lemongrass essential oil against Fusarium solani, causing root rot in common bean (Phaseolus vulgaris L.). Heliyon 6(12): e05737. https://doi.org/10.1016/j.heliyon.2020.e05737. [ Links ]
Fernández VD, Bautista BS, Fernández VD, Ocampo RA, García PA and Falcón RA. 2015. Películas y recubrimientos comestibles: una alternativa favorable en la conservación poscosecha de frutas y hortalizas. Revista Ciencias Técnicas Agropecuarias 24(3): 52-57. http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S2071-00542015000300008 [ Links ]
Gedikoğlu A. 2022. The effect of Thymus vulgaris and Thymbra spicata essential oils and/or extracts in pectin edible coating on the preservation of sliced bolognas. Meat Science 184: 108697. https://doi.org/10.1016/j.meatsci.2021.108697. [ Links ]
Haghighi H, Biard S, Bigi F, De Leo R, Bedin E, Pfeifer F, Heinz WS, Licciardello F and Pulvirenti A. 2019. Comprehensive characterization of active chitosan-gelatin blend films enriched with different essential oils. Food Hydrocolloids 95:33-42. https://doi.org/10.1016/j.foodhyd.2019.04.019 [ Links ]
Hernández-Medina CA, Henao-Henao ED, Velasco-Belalcázar ML and Gómez-López ED. 2015. Caracterización morfológica y molecular de aislados de Fusarium asociadas aguacate (Persea americana Mill), en el Valle del Cauca. Fitopatología Colombiana 39(2): 51-56. https://www.researchgate.net/publication/309662918_CARACTERIZACION_MORFOLOGICA_Y_MOLECULAR_DE_AISLADOS_DE_Fusarium_ASOCIADAS_AGUACATE_Persea_americana_Mill_EN_EL_VALLE_DEL_CAUCA [ Links ]
Huber DJ, Kaarkurt Y and Jeon J. 2001. Delay of avocado (Persea americana) fruit riperning by 1-methylcylopropene and wax tratments. Postharvest Biology and Technology 28: 171-175. https://doi.org/10.1016/S0925-5214(02)00176-X [ Links ]
Jha SN, Jaiswal P, Narsaiah K, Gupta M, Bhardwaj R and Singh AK. 2012. Non-destructive prediction of sweetness of intact mango using near infrared spectroscopy. Scientia Horticulture 138: 171-175. https://doi.org/10.1007/s13197-010-0033-1 [ Links ]
Kong W, Huo H, Gu Y, Cao Y, Wang J, Liang J and Niu S. 2022. Antifungal activity of camphor against four phytopathogens of Fusarium. South African Journal of Botany 148: 437-445. https://doi.org/10.1016/j.sajb.2022.05.019 [ Links ]
Krumreich FD, Borges CD, Mendonça CRB, Jansen-Alves C and Zambiazi RC. 2018. Bioactive compounds and quality parameters of avocado oil obtained by different processes. Food Chemistry 257(1): 376-381. https://doi.org/10.1016/j.foodchem.2018.03.048 [ Links ]
Lauriano SVG, Fernando AL, Afonso PJR, Freitas RP, Lopes AA S and Braz FFM. 2017. Physical properties of chitosan films incorporated with natural antioxidants. Industrial Crops and Products 107: 565-572. https://doi.org/10.1016/j.indcrop.2017.04.056. [ Links ]
Lian H, Shi J, Zhang X and Peng Y. 2020. Effect of the added polysaccharide on the release of thyme essential oil and structure properties of chitosan based film. Food Packaging and Shelf Life 23: 100467. https://doi.org/10.1016/j.fpsl.2020.100467. [ Links ]
Liu Y, Liu S, Luo X, Wu X, Ren J, Huang X, Feng S, Lin X, Ren M and Dong P. 2022. Antifungal activity and mechanism of thymol against Fusarium oxysporum, a pathogen of potato dry rot, and its potential application. Postharvest Biology and Technology 192: 112025. https://doi.org/10.1016/j.postharvbio.2022.112025 [ Links ]
Mejía-Bautista M A, Cristóbal-Alejo J, Tun-Suárez J M and Reyes-Ramírez A. 2016. In vitro activity of Bacillus spp. on mycelial growth inhibition of Fusarium equiseti and Fusarium solani isolated from habanero peppers (Capsicum chinense Jacq.). Agrociencia 50(3): 1123-1135. https://www.scielo.org.mx/scielo.php?pid=S1405-31952016000801123&script=sci_arttext&tlng=en [ Links ]
Morales-Rabanales Q N, Cóyotl-Pérez W A, Rubio-Rosas E, Cortes-Ramírez G S, Sánchez-Ramírez J F, Villa-Ruano N. 2022. Antifungal properties of hybrid films containing the essential oil of Schinus molle: protective effect against postharvest rot of tomato. Food Control 134: 108766. https://doi.org/10.1016/j.foodcont.2021.108766 [ Links ]
Pandey A K, Kumar P, Singh P, Tripathi N N and Bajpai V K. 2017. Essential oils: sources of antimicrobials and food preservatives. Frontiers in Microbiology 7: 1-14. https://doi.org/10.3389/fmicb.2016.02161 [ Links ]
Pandey A K, Deka B, Varshney R, Chepkirui C E and Babu A. 2021. Do the beneficial fungi manage phytosanitary problems in the tea agro-ecosystem? BioControl 66: 445-462. https://doi.org/10.1007/s10526-021-10084-9Pandey [ Links ]
Pacheco-Hernández Y, Sánchez-Hernández GR, Reyes-Cervantes E, Romero-Hernández O, Pérez-Xochipa I and Villa-Ruano N. 2020. Chemical variation and pharmacological properties of Dyssodia decipiens essential oil. Chemistry and Biodiversity 17(10): e2000487. https://doi.org/10.1002/cbdv.202000487 [ Links ]
Pedreschi R, Uarrota V, Fuentealba C, Alvaro JE, Olmedo P, Defilippi BG and Campos V R. 2019. Primary metabolism in avocado fruit. Frontiers in Plant Science 10. https://doi.org/10.3389/fpls.2019.00795 [ Links ]
Ramírez-Gil JG, Henao-Rojas JC and Morales-Osorio JC. 2021. Postharvest diseases and disorders in avocado cv. Hass and their relationship to preharvest management practices. Heliyon 7(1): e05905. https://doi.org/10.1016/j.heliyon.2021.e05905. [ Links ]
Ramos-Aguilar AL, Ornelas-Paz J, Tapia-Vargas LM, Gardea-Béjar AA, Elhadi MY, Ornelas-Paz JJ, Ruiz-Cruz S, Rios-Velasco C and Ibarra-Junquera V. 2021. Comparative study on the phytochemical and nutrient composition of ripe fruit of Hass and Hass type avocado cultivars. Journal of Food Composition and Analysis 97: 103796. https://doi.org/10.1016/j.jfca.2020.103796. [ Links ]
Rivedal HM, Stone AG, Severns PM and Johnson KB. 2020. Characterization of the fungal community associated with root, crown, and vascular symptoms in an undiagnosed yield decline of winter squash. Phytobiomes Journal 4: 178-192. https://doi.org/10.1094/PBIOMES-11-18-0056-R [ Links ]
Rodríguez-Castro A, Torres-Herrera S, Domínguez-Calleros A, Romero-García A and Silva-Flores M. 2020. Extractos vegetales para el control de Fusarium oxysporum, Fusarium solani y Rhizoctonia solani, una alternativa sostenible para la agricultura. Abanico Agroforestal 2: 1-13. http://dx.doi.org/10.37114/abaagrof/2020.7 [ Links ]
Romanazzi G, Feliziani E, Baños SB and Sivakumar D. 2017. Shelf life extension of fresh fruit and vegetables by chitosan treatment. Critical Reviews in Food Science and Nutrition 57(3): 579-601. https://doi.org/10.1080/10408398.2014.900474 [ Links ]
Romero-Arenas O, Pérez-Vázquez MAK, Rivera TJA, Pacheco-Hernández Y, Ramirez-Garcia SA, Landeta-Cortés G and Villa-Ruano N. 2022. Volatiles of Zanthoxylum limoncello as antifungal agents against the postharvest rot of manzano pepper triggered by Fusarium temperatum. Horticulturae 8(8): 700. https://doi.org/10.3390/horticulturae8080700 [ Links ]
Sarkhosh A, Vargas AI, Schaffer B, Palmateer AJ, Lopez P, Soleymani A and Farzaneh M. 2017. Postharvest management of anthracnose in avocado (Persea americana Mill.) fruit with plant-extracted oils. Food Packaging and Shelf Life 12: 16-22. https://doi.org/10.1016/j.fpsl.2017.02.001. [ Links ]
Scheel CM, Hurst S F, Barreiros G, Akiti T, Nucci M and Balajee S. A. 2013 Molecular analyses of Fusarium isolates recovered from a cluster of invasive mold infections in a Brazilian hospital. BMC Infectious Diseases 13(49): 12. https://doi.org/10.1186/1471-2334-13-49 [ Links ]
Selladurai R and Madhav AC. 2020. Nutrient management for avocado (Persea americana Miller), Journal of Plant Nutrition 43(1): 138-147. https://doi.org/10.1080/01904167.2019.1659322 [ Links ]
Villa RJA, Molina CFJ, Ayala ZJF, Olivas GI and González AGA. 2011. Effect of maturity stage on the content of fatty acids and antioxidant activity of ‘Hass’ avocado. Food Research International 44: 1231-1237. https://doi.org/10.1016/j.foodres.2010.11.012 [ Links ]
Wanjiku EK, Waceke JW, Wanjala BW and Mbaka JN. 2020. Identification and pathogenicity of fungal pathogens associated with stem end rots of avocado fruits in Kenya. International Journal of Microbiology 4063697: 8. https://doi.org/10.1155/2020/4063697 [ Links ]
Yan D, Li Y, Liu Y, Li N, Zhang X and Yan C. 2021. Antimicrobial properties of chitosan and chitosan derivatives in the treatment of enteric infections. Molecules 26(23): 7136. https://doi.org/10.3390/molecules26237136 [ Links ]
Zaker M. 2014. Antifungal evaluation of some plant extracts in controlling Fusarium solani, the causal agent of potato dry rot in vitro and in vivo. International Journal of Agriculture and Biosciences 3(4): 190-195. https://www.cabdirect.org/cabdirect/abstract/20143326583 [ Links ]
Recibido: 31 de Marzo de 2022; Aprobado: 11 de Julio de 2023











 texto em
texto em 


