Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista mexicana de fitopatología
versão On-line ISSN 2007-8080versão impressa ISSN 0185-3309
Rev. mex. fitopatol vol.41 no.2 Texcoco Mai. 2023 Epub 11-Ago-2023
https://doi.org/10.18781/r.mex.fit.2302-1
Notas Fitopatológicas
Aislamiento e identificación de hongos antagonistas de hongos asociados a la marchitez del chile en el sur de Guanajuato, México
1 Programa de Investigación en Inocuidad de Alimentos. Campo Experimental Bajío-INIFAP. km 6.5 carretera San Miguel de Allende-Celaya, Celaya, Gto. C.P. 38110, México;
2 Universidad Tecnológica del Suroeste de Guanajuato. km 1.2 carretera Valle-Huanímaro, Valle de Santiago, Gto. C.P. 38407, México;
3 Programa de Sanidad Vegetal. Campo Experimental General Terán-INIFAP. km 31 carretera Montemorelos-China, Ex Hacienda Las Anacuas, General Terán, N.L. C.P. 67400, México;
4 Programa de Investigación en Sanidad Vegetal. Campo Experimental Valle de México-INIFAP. km 13.5 carretera Los Reyes-Texcoco, Coatlinchan, Texcoco, Edo. Méx., C.P. 56250, México.
El cultivo de chile (Capsicum annum) en México representa una fuente importante de ingresos; sin embargo, cada año se presentan pérdidas en la producción entre el 40 y 100% por la enfermedad conocida como marchitez. Esta enfermedad provoca la muerte prematura de plantas ocasionada por el complejo formado por Rhizoctonia solani, Fusarium oxysporum, F. solani y Phytophthora capsici. El objetivo de esta investigación fue aislar hongos antagónicos a patógenos asociados a la marchitez del chile a partir de muestras de suelo obtenidas en el sur de Guanajuato, México. Se aislaron hongos con potencial antagónico a Phytophthora spp., Fusarium spp. y Rhizoctonia spp. Se identificaron tres hongos con actividad antagónica constante, inhibiendo el crecimiento micelial, entre el 41-83%. La identificación molecular de los antagonistas se realizó amplificando las regiones intergénicas transcripcionales (ITS) del componente ADN 18S ribosomal, identificando los géneros Trichoderma, Aspergillus y Penicillium. Esta investigación contribuye al estudio de alternativas de control biológico de patógenos de raíz, empleando microorganismos nativos presentes en suelos de cultivo afectados por la marchitez del chile en el sur de Guanajuato, México.
Palabras clave: Inhibición de crecimiento; microorganismos benéficos; patógenos de raíz
The chili crop (Capsicum annuum) in Mexico represents an important economic source; however, every year there are losses in production of 40 to 100% due to the root disease known as wilt, which causes premature death of plants, this disease is caused by the fungi complex formed by Rhizoctonia solani, Fusarium oxysporum, Fusarium solani and Phytophthora capsici. The objective of this research was to isolate antagonistic fungi to the pathogens causing wilt from soil samples obtained in the southern of the state of Guanajuato, Mexico. Antagonistic fungi potential against Rhizoctonia spp., Fusarium spp. and Phytophthora spp. were isolated. Then three fungi isolates presented antagonistic potential, inhibiting mycelial growth by 41 to 83%. Molecular identification of the antagonist fungi was performed by amplifying the intergenic transcriptional regions (ITS) of the 18S ribosomal DNA component of fungi. This research contributes to the study of biological control of root pathogens using beneficial native microorganisms present in crop soils affected by pathogens associated with chili wilt in southern Guanajuato, Mexico.
Keywords: Growth inhibition; beneficial microorganisms; root pathogens
La producción de chile (Capsicum annuum) en México en 2021 generó una producción de 3,086,742 t con un valor de producción de 30,642.66 millones de pesos (SIAP, 2022). No obstante, en los últimos años el rendimiento de esta hortaliza ha sido afectado por diversas enfermedades, principalmente de raíz, que provoca síntomas de marchitez y muerte prematura de la planta (Pérez- Acevedo, 2017). Se estima que la marchitez puede causar pérdidas en el cultivo del chile del 40 al 100%, esto dependerá de los genotipos de chile, las condiciones ambientales, la patogenicidad de los patógenos y la cantidad de inóculo en el suelo (Tembhurne et al., 2017). De acuerdo con diversos autores, esta enfermedad es ocasionada por un complejo formado por Rhizoctonia solani, Fusarium oxysporum, F. solani y Phytophthora capsici (Montero-Tavera et al., 2013). Este complejo causa marchitamiento y caída prematura de las hojas, clorosis, necrosis y estrangulamiento en la base del tallo, pudrición suave y acuosa, estos síntomas se presentan debido a la obstrucción de los haces vasculares (Pérez-Acevedo, 2017). Además, del daño causado por P. capsici, como la pérdida de turgencia y amarillamiento de hojas, necrosis en la base del tallo y muerte de planta en menos de 25 días (Gómez-Hernández et al., 2018; Pérez-Acevedo et al., 2017). De acuerdo con Morid et al. (2012) la sintomatología causada por Fusarium spp. es la decoloración y enrollamiento de las hojas, seguido del marchitamiento total de la planta causado por el daño al sistema vascular y la interrupción de los procesos fisiológicos para la producción. Durante los primeros días de crecimiento de plántulas se ha determinado la asociación de Rhizoctonia sp. y Phytium sp. (Pérez-Acevedo et al., 2017), causando marchitez, clorosis, seguido de necrosis en la base del tallo, caída de epidermis y por último la muerte de la planta.
Para el manejo de estos patógenos, se realiza diferentes prácticas de manejo del cultivo como la aplicación de agroquímicos, control de humedad del suelo y prácticas culturales (González-Chavira et al., 2009). En los últimos años se han desarrollado estudios enfocados en el control biológico con el fin de reducir la aplicación de agroquímicos, además de salvaguardar la salud del consumidor y reducir el impacto al medio ambiente (Zhao et al., 2021). Los microorganismos más utilizados para el control de P. capsici, R. solani y F. oxysporum son bacterias, actinomicetos y hongos micoparásitos (Yadav et al., 2021). Estos agentes de control biológico se encuentran de forma natural en la microbiota del suelo, donde pueden persistir en una mezcla microscópica de miles y millones de ellos por cada gramo de suelo (Ezziyyani et al., 2004). La importancia del control biológico depende en gran medida de las especies nativas de microorganismos que pueden funcionar como antagonistas a través de la antibiosis, competencia por espacio o por nutrimentos, interacciones directas con el patógeno (micoparasitismo y lisis enzimática) e inducción de resistencia.
Dada la importancia económica del cultivo de chile en Guanajuato, el presente trabajo tuvo como objetivo aislar hongos antagónicos a partir de muestras de suelo obtenidas en áreas de producción del sur de Guanajuato, México, para determinar su efecto contra hongos asociados a la marchitez de chile. Con este estudio se aporta información local para el control biológico de los hongos causantes de la marchitez.
En julio de 2017 se aislaron hongos y oomicetos asociados a la marchitez en plantas de chile poblano cv. San Luis cultivada en tres parcelas del Campo Experimental Bajío del Instituto Nacional de Investigaciones Forestales, Agrícoas y Pecuarias (INIFAP). Se seleccionaron cinco plantas de cada parcela que presentaban marchitez, pudrición de tallo, achaparramiento, tallo grueso y muerte de brotes, se colocaron en una hielera en bolsas de polietileno hasta su traslado al laboratorio para su procesamiento. Durante el ciclo OI-2018 y PV-2019 se realizaron colectas de suelo en 25 localidades de ocho municipios productores de chile en Guanajuato. Se registraron plantas en crecimiento vegetativo con síntomas característicos de marchitez: pudrición en tallo, clorosis y enanismo. En ambos ciclos se constató que no se realizó un manejo agronómico (nula desinfestación previa a la siembra del suelo, deficiente control de malezas y encharcamientos causados por el terreno mal nivelado o por fugas de agua de la cinta de riego). Se tomaron cinco submuestras de suelo de alrededor de las plantas de chile a una profundidad de 15-20 cm, estas se homogenizaron para obtener una muestra compuesta de 500 g (Cuadro 1).
Cuadro 1 Sitios de colecta de suelo y plantas de chile para el aislamiento de organismos antagónicos asociados a la marchitez del chile en el sur de Guanajuato. Ciclos de muestreo, Otoño-Invierno 2018 y Primavera Verano 2019.
| Municipio | Localidad | Coordenadas geográficas | Variedades de chile por unidad de producción |
|---|---|---|---|
| O-I/2018 | |||
| Celaya | Rancho “Estrada” | 20.530793; -100.869292 | Crusadier, Aristóteles |
| Irapuato | Cuarta Brigada | 20.623832; -101.275164 | Crusadier, Aristóteles |
| Irapuato | Rancho “Los Lobos” | 20.592263; -101.31285 | Crusadier; Aristóteles |
| Villagrán | Rancho “El Pintor” | 20.514751 -100.944374 | Imperial |
| Silao | Loma Bonita | 20.992519; -101.507566 | Húngaro |
| Silao | Rancho “Santa Faustina” | 20.887298; -101.435176 | Secuoya, Estrella |
| Romita | Fracción Puerta Grande | 20.88635; -101.495124 | Don Vicente |
| Pénjamo | Rancho “Buenos Aires” | 20.381657; -101.834033 | Arista |
| Pénjamo | Rancho “San Gabriel” | 20.429055; -101.598688 | 5807 |
| Abasolo | Rancho “El Palomar” | 20.413018;-101.556484 | 5807 |
| P-V/2019 | |||
| Cortazar | Rancho “Las Fuentes” | 20.447392; -100.969701 | Serrano |
| Villagrán | Rancho “La Charca” | 20.500479; -101.026391 | Bravo |
| Villagrán | 20.490822; -101.027278 | Serrano | |
| J. Rosas | Santiago Cuenda | 20.599575; -101.002517 | Serrano |
| Abasolo | En nombre de Dios | 20.548681; -101.549556 | Serrano |
| La Galera | 20.441680; -101.569290 | Serrano | |
| Rancho 1 | 20.450681; -101.595814 | Serrano | |
| Rancho “El Pitayo” | 20.470594; -101.575088 | Tajín | |
| Pénjamo | Rancho “Buenos Aires” | 20.386537; -101.837438 | Jalapeño |
| Guanajuato | San José de Llanos | 20.845623; -101.315313 | Jalapeño |
| Silao | Rancho “Santa Faustina” | 20.889908;-101.438975 | Pimiento |
| Parcela junto RSF | 20.924923; -101.433522 | Pimiento | |
| Rancho de Elisa | 20.935769; -101.435210 | Pimiento | |
| Romita | El Ranchito | 20.893356; -101.488338 | Jalapeño |
| La Aldea | 20.898463; -101.481889 | Serrano | |
Las plantas con síntomas de marchitez se procesaron de la siguiente manera: se eliminó la parte aérea de las plantas, se conservó el tallo, cuello de raíz y raíz, y se realizaron cortes de 1 cm2 de tejido, mismos que se desinfestaron con hipoclorito de sodio al 5% por 30 s y dos lavados con agua estéril. El tejido se colocó en medio Papa Dextrosa Agar (PDA) y se incubaron a 25°C y se observó el crecimiento de micelio durante cinco a siete días. Una vez que se desarrollaron las colonias se procedió a su aislamiento. Todas las cepas de interés se identificaron de acuerdo con sus características morfológicas (Sneh et al., 1991; Van der Plaats-Niterink, 1981; Barnett y Hunter, 1972). Para la purificación de cepas se hicieron re aislamientos en PDA mediante punta de hifa (Rhizoctonia sp., Phytium sp. y Phytophthora sp.) y cultivos monoconidales (Fusarium sp. y Alternaria sp.).
Las muestras de suelo se procesaron mediante diluciones seriadas (101-107), se tomó 1 g de muestra de suelo tamizado, como diluyente se empleó solución salina (NaCl 0.8 %). Todas las diluciones se homogenizaron en un vortex Genius® por 1 minuto. Se tomaron 500 µL de las diluciones 103, 105 y 107 y se sembraron por triplicado en medio PDA y Agar Luria (AL) por extensión en superficie, con un total de 18 cajas de cultivo por muestra, que se incubaron a 25°C por 72 h, los hongos que crecieron en los medios de cultivo se re aislaron en medio PDA y se identificaron a nivel género considerando sus características macroscópicas y microscópicas, tales como tamaño, color, tipo de micelio y forma de las colonias; además de hifas, micelio, conidios y conidióforos. Las colonias que presentaban características morfológicas similares fueron descartadas y se eliminaron aquellas con crecimiento lento. Para la obtención de cepas puras se realizaron cultivos monospóricos. Los hongos con posible capacidad antagónica, se sometieron a una preselección a través de confrontaciones duales con Phytophthora spp., Fusarium spp. y Rhizoctonia spp. En cajas de medio PDA se marcaron en línea cuatro puntos separados por 1.7 cm; en el primer punto (aprox. a 1 cm del borde de la caja) se sembró el microorganismo antagonista candidato y en los tres puntos restantes se sembró el hongo. Los posibles antagonistas se sembraron con tres días de anticipación a la confrontación, con la finalidad de dar ventaja a su crecimiento. La incubación se desarrolló a 25°C durante cinco días. Las confrontaciones se hicieron por triplicado, se emplearon 12 cajas de cultivo y un testigo. Se midió el radio de crecimiento de Phytophthora spp., Fusarium spp. y Rhizoctonia spp. para determinar el porcentaje de inhibición del crecimiento radial (PICR). Para el cálculo del PICR se empleó la fórmula utilizada por Suárez et al. (2008):
Donde R1: radio del hongo asociados a la marchitez (testigo) y R2: radio del hongo asociados a la marchitez frente al antagonista.
Se eligieron los hongos que presentaron PICR mayor a 50%, además de que tuvieran efecto antagónico frente a los hongos confrontados, esta prueba consistió en colocar a 1 cm del borde de la caja petri un disco de medio PDA con micelio de Phytophthora spp., Fusarium spp. y Rhizoctonia spp. en el otro extremo el hongo antagonista (Correa et al., 2007). En esta prueba se emplearon 10 repeticiones. Los diámetros de crecimiento de los hongos asociados a la marchitez se midieron a las 120 h. Para el testigo se determinó el crecimiento radial de Phytophthora sp., Fusarium sp. y Rhizoctonia sp. en ausencia del antagonista, el PICR se determinó con la fórmula utilizada por Suárez et al. (2008). Adicionalmente, se determinó el grado de antagonismo de los aislados seleccionados según la escala de Bell et al. (1982), que indica en seis clases el área que coloniza el organismo antagónico en presencia del fitopatógeno. Los PICR en la preselección y en los cultivos duales se establecieron bajo un diseño factorial de dos factores: antagonista (11 niveles) y patógeno (3 niveles). Los datos se transformaron con la función arcoseno para realizar un análisis de varianza y comparación de medias. Se empleó el software R versión 1.1.1717, PBC.
Para la identificación molecular de los hongos se utilizó en la extracción de ADN el protocolo de Lievens et al. (2003) a partir de cepas de 15 días. El ADN genómico se cuantificó en el espectrofotómetro Nanodrop 8000 (Thermo Scientific®) a una longitud de onda de 260 nm, y su integridad se verificó por electroforesis en geles de agarosa al 1%. Todas las muestras de ADN fueron diluidas a 10 ng µL-1. Se realizó la amplificación de la región espaciador interno (ITS) del componente ADN 18S ribosomal de hongos, con los iniciadores descritos por White et al. (1990) ITS1 (5’TCCGTAGGTGAACCTG- CGG3’) y ITS4 (5’TCCTCCGCTTATTGATATGC3’). El producto de PCR final esperado fue de 650 pb. La purificación del producto de PCR se realizó con el kit ZR DNA Sequencing Cleanup KitTM D4050S según el protocolo del fabricante. La secuenciación se realizó en el Departamento de Servicios Genómicos del Langebio, CINVESTAV-Campus Irapuato. La información se analizó con el programa Finch TV, Versión 1.4.0. y comparada en la base de datos del BLAST: Basic Local Alignment Search Tool.
Los microorganismos asociados a la marchitez del chile presentes en las muestras fueron Fusarium spp., seguido de Rhizoctonia spp. y Phytophthora spp.; sin embargo, también se observó la presencia de Pythium spp. y Alternaria spp. En el Cuadro 2 se indica la sintomatología observadas en las plantas colectadas y el hongo u oomiceto que se asoció.
Cuadro 2 Aislados de hongos y oomicetos asociados a la marchitez del chile en plantas sintomáticas colectadas en el sur de Guanajuato, México.
| Síntoma | Tejido muestreado | Hongo aislado |
|---|---|---|
| Marchitez de planta, achaparramiento | Raíz, tallo | Rhizoctonia spp. (binucleada) |
| Marchitez de planta, achaparramiento | Raíz, tallo | Rhizoctonia spp. (mono nuclear) |
| Muerte de brote | Raíz, tallo | Rhizoctonia spp. (binucleada) |
| Muerte de brote | Raíz | Pythium spp. |
| Muerte de brote | Raíz, tallo, cuello de raíz | Fusarium spp. |
| Muerte de brote | Raíz | Alternaria spp. |
| Muerte de brote | Raíz | Alternaria spp. |
| Tallo grueso | Tallo | Alternaria spp. |
| Marchitez | Raíz, tallo, cuello de raíz | Phytophthora spp. |
Adicionalmente, se obtuvieron 120 hongos con posible actividad antagónica; con la determinación de morfología y velocidad de crecimiento, se eligieron a 11 de ellos para emplearlos en la preselección como agentes antagonistas. El análisis de varianza mostró interacción entre los dos factores a un nivel de significancia de 0.001 (Cuadro 3). El mayor efecto inhibitorio para Phytophthora spp. se observó con H5P1 (80.12%). Para Fusarium spp. se tuvieron dos resultados similares con HMZA (80.1%) y H6P2 (82.41%). En el caso de Rhizoctonia spp., tanto HMZA (80.6%) y H6P2 (81.69%) mantuvieron las mayores inhibiciones. El menor PICR se obtuvo con la confrontación de Rhizoctonia spp. contra H11P (16.44%). Por lo anterior se seleccionaron a las cepas H5P1, H6P2 y HMZA debido a que mostraron constante potencial antagónico con PICR en un intervalo de 50 a 82% y se identificaron a nivel molecular.
Cuadro 3 Porcentaje de Inhibición del Crecimiento Radial (PICR %) de las cepas preseleccionadas de hongos aislados con potencial antagónico para hongos asociados a la marchitez del chile en el sur de Guanajuato, México.
| Hongo | Hongos antagonistas | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| HMZA | H4P5 | H4C12 | H5P1 | H6P2 | H11P | H13P | H14P | H14P3 | H20P | H22P | |
| Phy | 71.4 ± 2.4 cde | 31.45 ± 1.6 nopq | 55.58 ± 0.5 f | 80.12 ± 1.9 ab | 75.38 ± 1.4 bcd | 25.58 ± 2.3 pqr | 50.04 ± 2.3 fghi | 25.14 ± 1.8 gr | 29.48 ± 4.4 nopq | 27.55 ± 2.1 opqr | 25.46 ± 2.0 pqr |
| Fus | 80.1 ± 1.1 ab | 20.72 ± 1.5 rs | 43.94 ± 1.8 ghij | 66.67 ± 1.2 e | 82.41 ± 1.3 a | 35.86 ± 2.2 jklmn | 35.94 ± 1.1 jklmn | 50.44 ± 2.0 fgh | 33.49 ± 2.5 lmnop | 52.41 ± 2.6 fg | 52.81 ± 1.8 f |
| Rhi | 80.6 ± 1.2 ab | 42.33 ± 2.2 hijk | 30.76 ± 0.9 nopq | 77.71 ± 0.9 bc | 81.69 ± 2.3 a | 16.47 ± 3.9 s | 41.57 ± 3.6 ijkl | 35.22 ± 3.5 klmno | 57.23 ± 7.4 f | 53.13 ± 5.0 f | 40.08 ± 2.6 jklm |
Phy: Phytophthora spp., Fus: Fusarium spp., Rhi: Rhizoctonia spp. Nota: Letras iguales no presentan diferencias estadísticas significativas (p<0.001). Los valores corresponden a la media y ± desviación estándar.
La amplificación con los iniciadores ITS1 e ITS4 mostraron amplicones de aproximadamente 650 pb, característicos de aislados fúngicos (White et al., 1990). Con la secuenciación y comparación de genes del BLAST se logró la identificación de los aislados con homología del 100%. Los hongos antagónicos identificados fueron Aspergillus flavus (H5P1), Penicillium sp. (H6P2) y Trichoderma harzianum (HMZA). (No. de accesión GeneBank KM386418.1, KP131554.1, KJ598874.1, respectivamente). En cuanto a la capacidad de inhibición de las cepas los hongos antagonistas contra Phytophthora spp., Fusarium spp. y Rhizoctonia spp., se observó un PICR promedio de 50 a 82% (Cuadro 4). Se encontró interacción entre los niveles del antagonista y de los patógenos con un nivel de significancia de 0.001. Se observó un comportamiento similar bajo la técnica de confrontación dual, la inhibición del crecimiento radial de Phytophthora spp. fue mayor cuando se confrontó con A. flavus (79.72%) y Penicilliun sp. (75.30%); Fusarium spp. y Rhizoctonia spp. presentaron mayor inhibición frente a T. harzianum (82.55 % y 80.36%, respectivamente). Los porcentajes menores de inhibición se observaron en la confrontación de Fusarium sp. contra Penicillium sp. (50.77%) y Rhizoctonia sp. frente a Aspergillus flavus.
Cuadro 4 Porcentaje de inhibición de crecimiento radial (PICR) de hongos antagónicos aislados contra hongos asociados a la marchitez de chile en el sur de Guanajuato, México.
| Hongo | T. harzianum | A. flavus | Penicillium sp. |
|---|---|---|---|
| Phytophthora spp. | 70.19 ± 2.03 cd | 79.72 ± 2.06 ab | 75.30 ± 2.55 bc |
| Fusarium spp. | 82.55 ± 1.29 a | 66.83 ± 11.69 de | 50.77 ± 2.89 g |
| Rhizoctonia spp. | 80.36 ± 1.59 ab | 59.18 ± 2.01 f | 62.59 ± 2.00 ef |
Nota: Letras iguales no presentan diferencias estadísticas significativas (p<0.001). Los valores corresponden a la media y ± desviación estándar.
Por otra parte, se determinó que de acuerdo con la clasificación de Bell et al. (1982) se obtuvieron antagonismo clase 2 y 3 (Cuadro 5). Para la clase 2 se cubrieron dos terceras partes del área de crecimiento de los patógenos; para la clase 3 el agente antagónico y el patógeno colonizaron cada uno la mitad de la superficie, antagonismo clase 3 se observó con Penicillium sp. frente a Phytophthora spp. y Rhizoctonia spp., de la misma forma T. harzianum frente a Rhizoctonia spp. (Figura 1).
Cuadro 5 Clase de antagonismo según Bell et al. (1982) de T. harzianum, A. flavus y Penicillium sp. vs hongos asociados a la marchitez del chile.
| Hongo antagonista | Hongo | Clase de antagonismo |
|---|---|---|
| Trichoderma harzianum | Phytophthora spp. | 2 |
| Fusarium spp. | 2 | |
| Rhizoctonia spp. | 3 | |
| Aspergillus flavus | Phytophthora spp. | 2 |
| Fusarium spp. | 2 | |
| Rhizoctonia spp. | 2 | |
| Penicillium sp. | Phytophthora spp. | 3 |
| Fusarium spp. | 2 | |
| Rhizoctonia spp. | 3 |
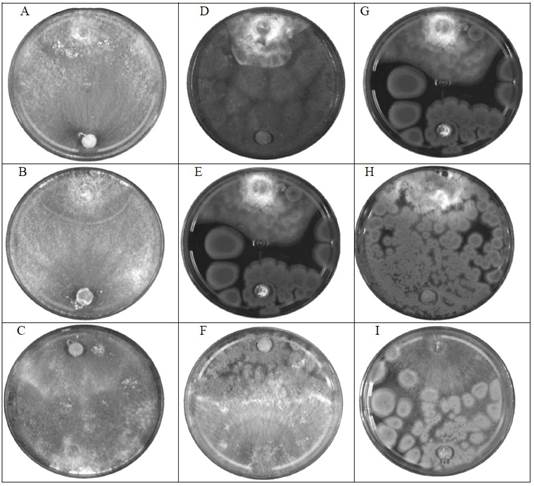
Figura 1 Confrontación dual (fitopatógeno vs. antagónico) Phytophthora spp., Fusarium spp. y Rhizoctonia spp. A) T. harzianum vs Phytophthora spp., B) T. harzianum vs Fusarium spp., C) T. harzianum vs Rhizoctonia spp., D) A. flavus vs Phytophthora spp., F) A. flavus vs Fusarium spp., G) A. flavus vs Rhizoctonia spp., H) Penicillium sp. vs Phytophthora spp., J) Penicillium sp. vs Fusarium spp., K) Penicillium sp. vs Rhizoctonia spp. Arriba: cepa de patógeno, abajo: cepa de antagónico. Cultivos de 5 días de crecimiento.
Los hongos encontrados en las plantas que presentaron síntomas de marchitez coinciden con lo documentado por autores como Gómez-Hernández et al. (2018), y Albañíl-Juárez et al. (2015) y Velásquez-Valle et al. (2013), quienes asociaron a la enfermedad con P. capsici, Rhizoctonia sp., Fusarium sp., Verticillium sp. y Pythium sp. En el caso de Alternaria sp, se encontró en raíces de plantas que presentaron muerte de brote, este patógeno no siempre ha sido detectado en la marchitez de chile, autores como Vásquez-López et al. (2009) identificaron a Alternaria en plantas con síntomas; sin embargo, no determinaron con exactitud su patogenicidad. En tanto, Garibaldi et al. (2019) y Begum et al. (2010) demostraron que Alternaria alternata y Alternaria tenuis causaron síntomas e incluso daños severos en la producción. Albañil-Juárez et al. (2015) documentaron en el Bajío y suroeste de Guanajuato que los hongos con mayor incidencia han sido F. oxysporum, seguido de Rhizoctonia sp. y Phytophthora sp.
Los tres hongos antagónicos que mostraron mayores PICR han sido documentados como agentes de biocontrol para otros patógenos, Polanco-Florián et al. (2020) identificaron a Aspergillus y Penicillium como biocontroladores de Lasiodiplodia theobromae y Fomitopsis meliae causantes de la muerte regresiva de los cítricos, los autores indicaron que durante mucho tiempo estos hongos se han considerado saprofitos, incluso productores de toxinas; sin embargo, basándose en otras investigaciones, se indica que existen razas atoxigénicas que actúan por exclusión competitiva y que por estas características han sido considerados para emplearse en formulaciones comerciales de productos para biocontrol. Trichoderma se ha usado por años para el control de patógenos de suelo, de forma comercial se ofrece como un estimulador a la resistencia, biofertilizante, bioplaguicida y mejorador de crecimiento (Asad, 2022). El biocontrol que ejerce Trichoderma sobre patógenos asociados a enfermedades de raíz ha sido comúnmente estudiado, de acuerdo con Abd-El-Khair et al. (2019) es capaz de estimular la defensa de las plantas a través de la producción de enzimas que inhiben al patógeno y por lo tanto se reduce el marchitamiento y pudriciones de raíces. Jamil (2021) indica que Trichoderma actúa como simbionte endófito al colonizar las raíces de las plantas y al mismo tiempo secreta estimulantes químicos benéficos para las plantas. Se ha demostrado que especies de Trichoderma mantienen valores de micoparasitismo frente a fitopatógenos en una escala de 1 a 3 (Michael-Aceves et al., 2009), para la elección de cepas de este antagonista se hace referencia a su agresividad para micoparasitar y la ventaja contra el patógeno con respecto a su velocidad de crecimiento (Guédez et al., 2012). En este trabajo se observó que T. harzianum fue capaz de cubrir o crecer sobre el fitopatógeno Phytophthora spp. en menos de una semana a temperatura ambiente, esto coincide con lo mencionado por Ezziyyani et al. (2004) quienes observaron que en la confrontación in vitro, T. harzianum es capaz de sobre pasar a P. capsici y llegar a reducir la colonia del patógeno en solo 4 días. Para patógenos de raíz Andrade-Hoyos et al. (2019) demostraron la efectividad de T. asperellum, T. viride y T. harzianum aislados de suelo sobre el crecimiento de Rhizoctonia sp., Fusarium sp. y Phytophthora capsici, sus resultados mostraron que no existieron diferencias significativas en la inhibición de las cepas, que fue superior a 85%; los autores señalaron que esta respuesta se debía a la síntesis de metabolitos secundarios y mecanismos de acción de micoparasitismo. En otro estudio realizado por Mousumi-Das et al. (2018) determinaron que T. harzianum mostró inhibición frente a F. oxysporum de 78.3%, para P. capsici de 65.3% y con R. solani 45.3%. Por otra parte, Miguel-Ferrer et al. (2021), determinaron un PICR de 53% y una clase 2 de antagonismo en la escala de Bell de T. harzianum frente a F. solani.
En el caso de Penicillium, el biocontrol se ha determinado por competencia de nutrientes, desintegración del micelio del patógeno y por antibiosis de acción lítica (Jiménez-Camargo et al., 2018), además también se ha identificado la producción de compuestos antimicrobianos como la Glandicolina B (Sánchez-Fernández et al., 2013). De forma general, Aspergillus tiene la capacidad de inhibir el crecimiento de patógenos a través de la antibiosis y la competencia por nutrientes (Quiroz-Sarmiento et al., 2008), también se ha identificado en este hongo la producción de compuestos antifúngico como la Fumitremorgina B (Sánchez-Fernández et al., 2013).
Por otra parte, Atalla et al. (2020) demostraron que Aspergillus oryzae a través de la producción de xilanasa disminuyó el crecimiento lineal de A. alternata, F. oxysporum, Phoma destructor, R. solani y Sclerotium rolfsii causantes de la pudrición de raíz en haba. No obstante, Quiroz-Sarmiento et al. (2008) reconocen que, aunque se han encontrado cepas de Aspergillus que presentan antagonismos frente a patógenos de raíz, es necesario realizar pruebas de patogenicidad y evaluar la posible producción de enzimas y los riegos toxicológicos a la planta. En relación al uso de Penicillium, existen estudios que demuestran un control biológico eficaz de patógenos asociados a raíz, Boughalleb- M’ Ha mdi et al. (2018) determinaron que al aplicar P. italicum y P. digitatum se redujo el daño a raíces en plántulas de melón, además disminuyó la severidad de la enfermedad. El grado de antagonismo de Aspergillus y Penicillium no ha sido documentado de forma extensa, son escasos los estudios con respecto a la clase de antagonismo que ejercen, no se define el tipo de antagonismo sino refieren el porcentaje de inhibición del crecimiento de los patógenos. Silva-Acosta y Paez-Redondo (2021) evaluaron el efecto de cepas de Aspergillus, Penicillium y Trichoderma sobre el control de Phytophthora sp. asociado a palma aceitera, sus resultados demostraron que A. niger y Trichoderma sp. mostraron 74 y 79% de inhibición en el crecimiento del oomicete, respectivamente. Por otra parte, Almeyda-León et al. (2020) identificaron a Aspergillus y Penicillium como biocontroladores en el crecimiento de Macrophomina phaseolina en porcentajes superiores al 60%. De la misma forma, Jiménez-Camargo et al. (2018) demostraron que cepas de Penicillium causaban inhibiciones del 54 al 81% en el desarrollo de P. capsici aislada de plántulas con síntomas de marchitez.
Se aislaron Rhizoctonia spp., Phythium spp., Fusarium spp., Alternaria spp. y Phytophthora spp. asociados a plantas de chile en predios de producción, ubicados en el sur de Guanajuato, México. Con el muestreo realizado en las unidades productoras de chile con problemas de marchitez, se identificaron tres cepas (T. harzianum, A. flavus y Penicillium sp.) que presentaron antagonismo constante, con inhibición de 41 al 83%. En el caso de A. flavus y Penicillium sp., es importante continuar con estudios detallados para determinar si es posible utilizarlos como biocontroladores. Los resultados sugieren a estos tres organismos como alternativa de control biológico para fitopatógenos asociados a la marchitez del suelo empleando los antagonistas que están en estrecha relación dentro de las áreas de producción. De acuerdo con el efecto inhibitorio in vitro observado, se precisa continuar y escalar el posible control de la enfermedad in situ que aseguren su efectividad y uso.
Cited literature
Abd-El-Khair H, Elshahawy IE, Haggag HEK. 2019. Field application of Trichoderma spp. combined with thiophanate-methyl for controlling Fusarium solani and Fusarium oxysporum in dry bean. Bulletin of the National Research Centre 43:19. https://doi.org/10.1186/s4226. [ Links ]
Albañil-Juárez JA, Mariscal-Amaro LA, Martínez-Martínez TO, Anaya-López JL, Cisneros López HC y Pérez Ramírez HA. 2015. Estudio regional de fitopatógenos asociados a la secadera del chile en Guanajuato, México. Revista Mexicana de Ciencias Agrícolas 6(spe11):2191-2197. https://doi.org/10.29312/remexca.v0i11.797. [ Links ]
Almeyda-León IH, Rodríguez-Guerra R, López-Arroyo JI, Rodríguez-Villarreal RA, Robledo- Leal ER, Armijo-Martínez LF. 2020. Caracterización funcional de hongos aislados de suelo por su capacidad antagónica contra Macrophomina phaseolina. Biotecnología y Sustentabilidad 5(1):62-74. https://doi.org/10.57737/biotecnologiaysust.v5i1.920. [ Links ]
Andrade-Hoyos P, Luna-Cruz A, Osorio-Hernández E, Molina-Gayosso E, Landero-Valenzuela N y Barrales-Cureño H. 2019. Antagonismo de Trichoderma spp. vs hongos asociados a la marchitez de chile. Revista Mexicana de Ciencias Agrícolas 10(6):1259-1272. https://doi.org/10.29312/remexca.v10i6.1326. [ Links ]
Asad SA. 2022. Mechanisms of action and biocontrol potential of Trichoderma against fungal plant diseases-A review. Ecological complexity 49: 100978. https://doi.org/10.1016/j.ecocom.2021.100978. [ Links ]
Atalla SMM, Ahmed NE, Awad HM, El Gamal NG, El Shamy AR. 2020. Statistical optimization of xylanase production, using different agricultural wastes by Aspergillus oryzae MN894021, as a biological control of faba bean root diseases. Egyptian Journal of Biological Pest Control 30:125. https://doi.org/10.1186/s41938-020-00323-z. [ Links ]
Barnett H. and Hunter B. 1998. Illustrated genera of imperfect fungi. American Phytopathological Society Press. St. Paul Minnesota. USA. 218 p. [ Links ]
Begum MF, Rahman MA and Alam MF. Biological Control of Alternaria fruit rot of chili by Trichoderma species under field conditions. 2010. Mycobiology 38(2):113-117. https://doi.org/10.4489/MYCO.2010.38.2.113. [ Links ]
Bell D, Well H and Markham C. 1982. In vitro antagonism of Trichoderma species against six fungal plant pathogens. Phytopathology 72:379-382. https://doi.org/10.1094/Phyto-72-379. [ Links ]
Boughalleb-M’ Ha mdi N, Sa le m I.B a n d M’ Ha mdi M. 2018. Evaluation of the e fficiency of Trichoderma, Penicillium, and Aspergillus species as biological control agents against four soil - borne fungi of melon and watermelon. Egyptian Journal of Biological Pest Control 28:25. [ Links ]
Correa S, Mello M, Ávila Z, Minare L, Pádua R y Gomes D. 2007. Cepas de Trichoderma spp. para el control biológico de Sclerotium rolfsii SAAC. Fitosanidad 11(1): 3 -9. [ Links ]
Ezziyyani M, Pérez SC, Sid AA, Requena ME y Candela ME. 2004. Trichoderma harzianum como biofungicida para el biocontrol de Phytophthora capsici en plantas de pimiento (Capsicum annuum L.). Anales de Biología 26:35-45. [ Links ]
Garibaldi A., Gilardi G., Matic S., Gullino M. L. 2019. First report of Alternaria alternata on chili pepper (Capsicum frutescens) in Italy. Plant Disease 103(5):1024-1025. https://doi.org/10.1094/PDIS-09-18-1616-PDN [ Links ]
Gómez-Hernández D, Carrillo-Rodríguez JC, Chávez-Servia JL, Perales-Segovia C. 2018. Pathogenicity of Phytophthora capsici Leon and Rhizoctonia solani Khün, on seedlings of ‘costeño’ pepper (Capsicum annuum L.). Revista BioCiencias 5,e356. https://doi.org/10.15741/revbio.05.e356. [ Links ]
González-Chavira M M, Villordo-Pineda E, Pons-Hernández JL, Delgadillo-Sánchez F, Paredes-Melesio R, Godoy-Hernández H, Anaya-López JL, Gámez-Vázquez FP, Medina-Cazares T y Rodríguez-Guerra R. 2009. Guía para el manejo de la marchitez del chile en Guanajuato. México: Prometeo Editores. Primera Edición. ISBN. 978-607-953013-6. [ Links ]
Guédez C, Cañizalez L, Castillo C y Olivar R. 2012. Evaluación in vitro de aislamientos de Trichoderma harzianum para el control de Rhizoctonia solani, Sclerotium rolfsii y Fusarium oxysporum en plantas de tomate. Revista de la Sociedad Venezolana de Microbiología 32(1):44-49. http://ve.scielo.org/scielo.php?script=sci_arttext&pid=S1315-25562012000100009. [ Links ]
Jamil A. 2021. Antifungal and plant growth promoting activity of Trichoderma spp. against Fusarium oxysporum f. sp. lycopersici colonizing tomato. Journal of Plant Protection Research 61(3): 243-253. https://doi.org/10.24425/jppr.2021.137950 [ Links ]
Jiménez-Camargo A, Valadez-Moctezuma E y Lozoya-Saldaña H. 2018. Antagonismo de Penicillium sp. contra Phytophthora capsici (Leonian). Revista Fitotecnia Mexicana 41(2), 137-148. https://doi.org/10.35196/rfm.2018.2.137-148 [ Links ]
Lievens B, Brouwer M, Vanachter ACRC, Lévesque CA, Cammue BPA and Thomma BPHJ. 2003. Design and development of a DNA array for rapid detection and identification of multiple tomato vascular wilt pathogens. FEMS Microbiology Letters 223(1): 113-122. https://doi.org/10.1016/S0378-1097(03)00352-5. [ Links ]
Michael-Aceves AC, Otero-Sánchez M and Solano-Pascacio L. 2009. Biocontrol in vitro con Trichoderma spp. de Fusarium subglutinans (Wollenweb y Reinking) Nelson, Toussoun y Marasas y F. oxysporum Schlecht., agentes causales de la “escoba de bruja” del mango (Mangifera indica L.). Revista Mexicana de Fitopatología 27:18-26. http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S0185-33092009000100003& [ Links ]
Miguel-Ferrer L, Romero-Arenas O, Andrade-Hoyos P, Sánchez-Morales P, Rivera-Tapia JA y Fernández-Pavía SP. 2021. Actividad antifúngica de Trichoderma harzianum y T. koningiopsis contra Fusarium solani asociado en la germinación y vigor de plántulas de chile Miahuateco. Revista Mexicana de Fitopatología 39(2):228-247.: https://doi.org/10.18781/R.MEX.FIT.2101-5 [ Links ]
Montero-Tavera V, Guerrero-Aguilar BZ, Anaya-López JL, Martínez-Martínez TO, Guevara- Olvera L y González-Chavira MM. 2013. Diversidad genética de aislados de Rhizoctonia solani (Kuhn) de chile en México. Revista Mexicana de Fitopatología 4(7):1043-1054. https://doi.org/10.29312/remexca.v4i7.1144. [ Links ]
Morid B, Hajmansoor S, Kakvan N.2012. Screening of resistance genes to Fusarium root rot and Fusarium wilt diseases in tomato (Lycopersicon esculentum) cultivars using RAPD and CAPs markers. Euro Journal of Experimental Biology 2:931-939. https://www.ajol.info/index.php/ajb/article/view/79909 [ Links ]
Mousumi MD, Haridas M and Sabu A. 2018. Biological control of black pepper and ginger pathogens, Fusarium oxysporum, Rhizoctonia solani and Phytophthora capsici, using Trichoderma spp, Biocatalysis and Agricultural Biotechnology, https://doi.org/10.1016/j.bcab.2018.11.021. [ Links ]
Pérez-Acevedo CE, Carrillo-Rodríguez JC, Chávez-Servia JL, Perales-Segovia C, Enríquez del Valle R, Villegas-Aparicio Y. 2017. Diagnóstico de síntomas y patógenos asociados con marchitez del chile en Valles Centrales de Oaxaca. Revista Mexicana de Ciencias Agrícolas 8(2): 281-293. https://doi.org/10.29312/remexca.v8i2.50. [ Links ]
Polanco-Florián LG, Alvarado-Gómez OG, Olivares-Sáenz E, González-Garza R y Pérez- González O. 2020. Control biológico de Lasiodiplodia theobromae y Fomitopsis meliae causantes de la muerte regresiva de los cítricos. Revista mexicana de ciencias agrícolas 11(5):1069-1081. https://doi.org/10.29312/remexca.v11i5.2272 [ Links ]
Quiroz-Sarmiento VF, Ferrera-Cerrato R, Alarcón A, y Lara Hernández ME. 2008. Antagonismo in vitro de cepas de Aspergillus y Trichoderma hacia hongos filamentosos que afectan al cultivo del ajo. Revista Mexicana de Micología 26: 27-34. https://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S0187-31802008000100005 [ Links ]
SIAP. Servicio de Información Agroalimentaria y Pesquera Acciones y Programas. Anuario Estadístico de la Producción Agrícola. En línea: https://nube.siap.gob.mx/cierreagricola/.(Consulta, junio 2022) [ Links ]
Sánchez-Fernández RE, Sánchez-Ortiz BL, Sandoval-Espinosa YKM, Ulloa-Benítez A, Armendáriz-Guillén B, García-Méndez MC y Macías-Rubalcava ML. 2013. Hongos endófitos: fuente potencial de metabolitos secundarios bioactivos con utilidad en agricultura y medicina. TIP 16(2): 132-146. https://doi.org/10.1016/S1405-888X(13)72084-9. [ Links ]
Silva-Acosta GE y Paez-Redondo AR. 2021. Antagonismo in vitro de nueve hongos aislados del Caribe colombiano sobre Phytophthora sp. asociado a palma aceitera. Ingeniería y Desarrollo 39(2):2145-9371. https://dx.doi.org/10.14482/inde.39.2.579.546 [ Links ]
Sneh BL and Ogoshi A. 1991. Identification of Rhizoctonia species. Am Phytopathol Soc Press. St. Paul, Minnesota. 133 pp. [ Links ]
Suárez C, Fernández R, Valero N, Gámez R y Páez A. 2008. Antagonismo in vitro de Trichoderma harzianum Rifai sobre Fusarium solani (Mart.) Sacc. Asociado a la marchitez en maracuyá. Revista Colombiana de Biotecnología 10(3): 35-43. http://www.scielo.org.co/scielo.php?script=sci_arttext&pid=S0123-34752008000200005. [ Links ]
Tembhurne B, Belabadevi B, Kisan B, Tilak I, Ashwathanarayana D, Suvarna N and Naik M. 2017. Molecular Characterization and Screening for Fusarium (Fusarium solani) Resistance in Chili (Capsicum annuum L.) Genotypes. International Journal Current Microbiology Applied Science. 6:1585-1597. 23. DOI:10.20546/ijcmas.2017.609.195. [ Links ]
Van del Plaats-Niterink A.J. 1981. Monograph of the genus Pythium. Studies in micology 21:1-242. https://www.studiesinmycology.org/sim/Sim21/full%20text.htm. [ Links ]
Vásquez L A, Tlapal BB, Yáñez MM, Pérez PR y Quintos EM. 2009. Etiología de la marchitez del “Chile de agua” (Capsicum annuum) en Oaxaca, México. Revista Fitotecnica de México 32 (2): 127-134. https://www.scielo.org.mx/pdf/rfm/v32n2/v32n2a8.pdf. [ Links ]
Velásquez-Valle R y Amador-Ramírez, MD. 2007. Análisis sobre la investigación del chile seco (Capsicum annuum L.), realizadas por el Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias en los estados de Aguascalientes y Zacatecas, México. Revista Mexicana de Fitopatología 25:80-84. https://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S0185-33092007000100011. [ Links ]
White TJ, Bruns T, Lee S, Taylor J. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. In PCR protocols a guide to methods and applications 315 -322. Academic Press, San Diego. 1990. [ Links ]
Yadav M., Kumar D.M. and Sanmukh U.R. 2021. Systemic Resistance in Chilli Pepper against Anthracnose (Caused by Colletotrichum truncatum) Induced by Trichoderma harzianum, Trichoderma asperellum and Paenibacillus dendritiformis. Journal of Fungi (Basel) 7(4): 307. https://doi.org/10.3390/jof7040307. [ Links ]
Zhao X, Liu X, Zhao H, Ni Y, Lian Q, Qian H, He B, Liu H and Ma Q. 2021. Biological control of Fusarium wilt of sesame by Penicillium bilaiae 47M-1. Biological Control 158, 104601. https://doi.org/10.1016/j.biocontrol.2021.104601 [ Links ]
Recibido: 10 de Febrero de 2023; Aprobado: 24 de Abril de 2023











 texto em
texto em 


