Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista mexicana de fitopatología
versão On-line ISSN 2007-8080versão impressa ISSN 0185-3309
Rev. mex. fitopatol vol.41 no.2 Texcoco Mai. 2023 Epub 11-Ago-2023
https://doi.org/10.18781/r.mex.fit.2302-7
Articles
Neopestalotiopsis sp. y Colletotrichum karstii agentes causales de manchas foliares en palma camedor (Chamaedorea quezalteca) en México
1 Laboratorio de biofertilizantes y bioinsecticidas, Facultad de Ingeniería sede Villa Corzo, Universidad de Ciencias y Artes de Chiapas. Carretera Villa Corzo Ejido Monterrey Km 3.0. CP. 29000, Chiapas, México;
2 Centro de Investigación en Alimentación y Desarrollo-CIAD, C.P. 31570, Ciudad Cuauhtémoc, Chihuahua, México.
Las plantaciones de palma camedor (Chamaedorea quezalteca) de la región Frailesca, Chiapas, México, desde el 2020 son afectadas por enfermedades foliares que inducen síntomas de mancha foliar y antracnosis que reducen la producción, calidad de las hojas y con ello la pérdida de su valor comercial. Los objetivos de este trabajo fueron identificar los agentes causales y cuantificar la incidencia y severidad de las enfermedades foliares en plantaciones de palma camedor. De manera recurrente se aislaron dos hongos, uno de hojas con síntomas de mancha foliar y otro de antracnosis, ambos fueron identificados morfológicamente y molecularmente mediante la secuenciación del espaciador de transcrito interno (ITS5/ITS4), las pruebas de patogenicidad se realizaron en plantas sanas donde se inocularon conidios de los hongos, y en campo se cuantificó la incidencia y severidad de la enfermedad con apoyo de una escala pictográfica. Los hongos identificados fueron Neopestalotiopsis sp. en síntomas de mancha foliar y Colletotricum karstii en antracnosis, ambos patógenos reprodujeron los mismos síntomas observados en campo, a través de las pruebas de patogenicidad. Los porcentajes de incidencia y severidad de las enfermedades se transformaron a área bajo la curva del progreso de la enfermedad (ABCPE), estas enfermedades presentaron un promedio anual de incidencia y severidad de 35.33% (ABCPE= 14180) y 39.16% (ABCPE=12885) para mancha foliar, 19.5% (ABCPE= 7123) y 55.83% (ABCPE= 20380) para antracnosis, respectivamente.
Palabras clave: Palmae; Areacaceae; mancha foliar; antracnosis
Since 2020, camedor palm (Chamaedorea quezalteca) plantations in the Frailesca region, Chiapas, Mexico, have been affected by foliar diseases that induce leaf spot and anthracnose symptoms that reduce production, leaf quality and thus the loss of their commercial value. The objectives of this work were to identify the causal agents and to quantify the incidence and severity of foliar diseases in plantations of camedor palm. Two fungi were recurrently isolated, one from leaves with leaf spot symptoms and the other with anthracnose, both were identified morphologically and molecularly by sequencing the internal transcribed spacer (ITS5/ITS4), pathogenicity tests were performed on healthy plants where fungal conidia were inoculated, and in the field the incidence and severity of the disease were quantified with the support of a pictographic scale. The fungi identified were Neopestalotiopsis sp. in leaf spot symptoms and Colletotricum karstii in anthracnose, both pathogens reproduced the same symptoms observed in the field, by means of pathogenicity tests. Disease incidence and severity percentages were transformed to area under the disease progress curve (AUDPC), these diseases presented an annual average incidence and severity of 35.33% (AUDPC= 14180) and 39.16% (AUDPC=12885) for leaf spot, 19.5% (AUDPC= 7123) and 55.83% (AUDPC= 20380) for anthracnose, respectively.
Key words: Palmae; Areacaceae; leaf spot; anthracnose
La familia Palmae (Arecaceae) se clasifica en seis subfamilias con 4000 especies y 200 géneros en todo el mundo (Ahmad et al., 2020). Las palmas presentan una diversidad morfológica y ecológica, se encuentran habitualmente en regiones climáticas tropicales, subtropicales y mediterráneas. En su mayoría, las palmas se usan con fines estéticos y de ornato, pero algunas especies se utilizan también para alimentación (Howard, 2001). En la industria hortícola, las palmas ornamentales representan 404 millones de dólares, es decir, el 10% de la producción total (Hodges et al., 2011). Además, desde el punto de vista ecológico estas plantas disminuyen la contaminación ambiental y tienen un efecto positivo en la atmósfera (El-Juhany, 2010). Las palmas ornamentales son afectadas por factores bióticos, como los insectos y las enfermedades, y abióticos, como la temperatura, la nutrición y la composición del suelo (Schmidhuber y Tubiello, 2007; Aldana et al., 2009). Diferentes hongos fitopatógenos, bacterias, virus y nematodos reducen el valor estético de las palmas en diferentes etapas, provocando síntomas que incluyen marchitez, tizón, manchas, podredumbre de la raíz, podredumbre del tallo y del pecíolo, cascarilla de diamante y enfermedades de la vaina de la hoja, así como marchitamiento por Fusarium oxysporum (Broschat et al., 2014). Estudios recientes realizados en Chamaedorea cataractarum, C. seifrizii y C. costaricana reportaron algunos patógenos responsables de las enfermedades en estas palmas, como Ganoderma spp., causante de la podredumbre basal del tallo, enfermedad letal que tiene un enorme potencial de propagación (Shakeel et al., 2020). Otro de los principales patógenos de las palmas es Phytophthora palmivora, que provoca la enfermedad devastadora denominada pudrición letal del cogollo de las palmas (Broschat et al., 2014; Shakeel et al., 2020). Así mismo, se ha reportado la enfermedad de mancha foliar complejo Helminthosporium, provocado por un grupo de hongos (Drechslera setariae, Exserohilum rostratum y Phaeotrichoconis crotalariae) (Shakeel et al., 2020).
En centroamérica el género Chamaedorea se distribuye en Guatemala, El Salvador, Honduras y al sur de México, formando parte del bosque mesófilo de montaña y del bosque tropical perennifolio (Granados et al., 2004; López et al., 2005). En Chiapas, el género Chamaedorea se localiza en las depresiones de la Sierra Madre de Chiapas y en la Selva Lacandona (Buda Arango et al., 2014) en altitudes que van desde los 900 a 2300 msnm (Martínez et al., 2011). Para el caso de la región Frailesca, Chiapas, Chamaedorea quezalteca conocida comúnmente como palma camedor es la especie que más se cultiva para su uso comercial.
Chamaedorea quezalteca se ha extraído desde los años cuarenta para abastecer los mercados florísticos internacionales, primordialmente a Estados Unidos, por lo que actualmente se le ha considerado como un producto forestal no maderable (PFNM) (Pérez et al., 2012), esta actividad económica resulta factible para pequeñas comunidades rurales, ya que no requiere tecnología sofisticada (Evans, 1993). Esto representa para varios productores rurales la participación en una economía de subsistencia hacia una economía de mercado, lo que ha significado el aumento de sus ingresos económicos.
Desde el 2020, en la región Frailesca Chiapas, las plantaciones de palma camedor son afectadas por dos enfermedades foliares, mancha foliar y antracnosis, que disminuyen la producción y la calidad de las hojas, lo que impacta directamente el ingreso económico de los productores. Actualmente en México no se cuenta con ningún reporte de enfermedades foliares asociadas a la palma camedor (Chamaedorea quezalteca). Por lo que los objetivos de esta investigación fueron identificar los agentes causales, cuantificar la incidencia y severidad de las enfermedades foliares, mancha foliar y antracnosis en plantaciones comerciales de palma camedor.
Materiales y métodos
Colecta de material biológico. 20 muestras de hojas de cada una de las enfermedades de mancha foliar y antracnosis se colectaron en plantaciones de palma camedor de ocho años de edad ubicados en los Ejidos Sierra Morena (16° 08´51.6” LN - 93° 36´ 30.06” LW) y Plan de Ayala (15°90´47.22¨ LN-93°21´25.00¨ LW) del municipio de Villa Corzo, Chiapas. Las muestras se colocaron en bolsas de plástico acondicionadas con papel absorbente, se etiquetaron y trasladaron al Laboratorio de Biofertilizantes y Bioinsecticidas de la Universidad de Ciencias y Artes de Chiapas, Sede Villa Corzo y se conservaron en un recipiente con agua hasta su uso.
Aislamiento y purificación de los hongos. Las hojas de palma camedor con síntomas de mancha foliar y antracnosis se diseccionaron en trozos de 0.5 cm2, se lavaron con etanol al 70 % por 3 minutos y con hipoclorito de sodio al 10 % por 10 min, posteriormente se lavaron dos veces con agua destilada estéril por 2 min. Se sembraron 10 trozos de cada uno de los síntomas en medio papa dextrosa agar (PDA) por triplicado e incubados a 28 °C, fotoperiodo 12:12 luz/oscuridad por 10 días, el crecimiento micelial de los hongos fue monitoreado cada 24 horas y purificados por punta de hifa y cultivo monospórico (Ruiz-Cisneros et al., 2017).
Identificación morfológica. De los 30 trozos de tejido sembrados en PDA se aislaron 10 hongos de cada uno de los síntomas de mancha foliar y antracnosis que fueron los primeros que emergieron de los tejidos después de 48 h, se identificaron morfológicamente a nivel de género mediante sus estructuras de reproducción observadas en un microscopio óptico (Axiolab 5, Carl Zeiss) y con el apoyo de claves taxonómicas (Barnett and Hunter, 2006; Watanabe, 2002).
Identificación molecular. Para la identificación molecular, el hongo aislado de las hojas con síntomas de mancha foliar y el hongo de antracnosis se sembraron en cajas petri con PDA cubierto con un celofán estéril y se incubó por 7 días a 28 ºC. El micelio fue cosechado y congelado con nitrógeno líquido, se extrajo el ADN siguiendo el protocolo de Raeder and Broda (1989). El ADN total se utilizó para amplificar el espaciador de transcrito interno (ITS) del 18S del rADN utilizando los oligos ITS5 (5’-GGAAGTAAAAGTCGTAACAAGG-3’) e ITS4 (5’-TCCTCCGCTTATTGATATGC-3’) con las siguientes condiciones de amplificación de una etapa inicial de desnaturalización de 94 ºC por 5 minutos, seguidos de 30 ciclos (extensión 94 ºC 30 s, alineamiento 60 ºC 30 s, extensión 72 ºC por 45 s) y una extensión final de 72 ºC por 10 minutos, donde el fragmento puede ser de 710 a 850 pb según la especie de hongo (White et al., 1990). Los amplicones de la reacción en cadena de la polimerasa (PCR) fueron secuenciados por el método de Sanger en un secuenciador ABI (Applied Biosystems). Las secuencias fueron comparadas con la base de datos NCBI usando el algoritmo de BLAST (Altschul et al., 1990).
Prueba de patogenicidad. Los postulados de Koch se realizaron en condiciones de campo bajo sombra en las instalaciones de la Universidad de Ciencias y Artes de Chiapas (UNICACH), se usaron plántulas de dos años de edad sembradas en bolsa de polietileno de 5 kg y sustrato suelo natural de las mismas plantaciones. Los dos hongos aislados e identificados previamente se cultivaron en medio PDA a 28 ºC fotoperiodo 12:12 luz/oscuridad por 15 días. La inoculación de Neopestalotiopsis sp. se realizó de manera directa y consistió en tomar los picnidios de los acérvulos con una aguja hipodérmica e inocular las hojas de las plantas a través de una ligera herida a la epidermis (Rebollar et al., 2020) y para C. karstii se utilizó una solución de conidias de 1x 106 esporas mL-1 y se inocularon 10 µL. Para ambos hongos se inocularon cinco plantas (dos hojas por planta). Las plantas inoculadas se asperjaron agua destilada estéril, se cubrieron con bolsas de plástico y se descubrieron al tercer día. Se mantuvieron en irrigaciones regulares y en observación hasta que aparecieron los síntomas de las enfermedades. De los síntomas obtenidos se tomaron muestras y se reaislaron los hongos inoculados siguiendo el protocolo previamente descrito. Se utilizaron cinco plantas control inoculadas con agua estéril y el experimento se realizó por duplicado.
Incidencia y severidad en campo. Para cuantificar la incidencia de las enfermedades foliares de palma camedor, se seleccionó una parcela de 1 ha de ocho años de edad ubicada en el ejido Sierra Morena, se hizo un muestreo de cinco de oros, en cada punto se etiquetaron y muestrearon 20 plantas, se cuantificó el número de plantas con síntomas de un total de 100 plantas, los muestreos se realizaron cada dos meses durante un año en los mismos puntos y mismas plantas y en cada uno se promedió los valores de los cinco puntos. Para la severidad de las enfermedades se construyó una escala pictográfica de daño con valores de 1-5; donde 1 representa (0% de daño), 2 (1-25% de daño), 3 (26-50% de daño), 4 (51-75% de daño) y 5 (76-100% de daño) (Figura 1), el porcentaje de daño se midió de manera directa de cada una de las plantas cuantificadas en la incidencia de la enfermedad. Los porcentajes de incidencia y severidad de la enfermedad se transformaron a valores de áreas bajo la curva del progreso de la enfermedad (ABCPE) (Pedroza y Samaniego, 2009).
Resultados y discusión
Identificación morfológica y molecular. De las hojas con síntomas de mancha foliar se aisló y purificó 10 colonias de hongos, que con base a los análisis morfológicos formadas en medio PDA todas fueron identificadas como Neopestalotiopsis sp., ya que presentaron características de hongo filamentoso algodonoso con hifas elevadas inicialmente de color blanco, acérvulos que parecen pequeñas pústulas de color negro brillante con abundante conidios de forma fusiformes con tres células centrales pigmentadas y las basales hialinas (dimensiones de 13.22 a 15.88 µm de longitud x 2.82 a 3.59 µm de ancho), con dos a cuatro sétulas apicales (medidas 5.99 x 8.49 µm de longitud y 0.67 x 1.21 µm de ancho) y un pedicelo en las células basales (Barnett and Hunter, 2006; Watanabe, 2002) (Figura 2). Estructuras con características similares fueron reportadas por Rebollar et al. (2020) en cultivo de fresa y Gerardo-Lugo et al. (2020) en cultivo de mango, tres células centrales pigmentadas de color amarillo y 3 sétulas apicales con un pedicelo en las células basales; sin embargo, las características morfológicas de los hongos fitopatógenos y en especial Neopestalotiopsis pueden variar y ser modificadas por las condiciones ambientales y estas no son confiables como medio de identificación (Maharachchikumbura et al., 2011). Estudios realizados por Acosta-González (2022) confirman que hay diferencias en el diámetro del crecimiento final, así como la coloración, la textura del micelio, la producción de acérvulos, la elevación del micelio y los márgenes del género Neopestalotiopsis. La identificación molecular se basó en el análisis de la secuencia consenso del gen 18S rDNA (ITS5/ITS4) que presentó una alta similitud con Neopestalotiopsis sp. con una cobertura de 99% y un porcentaje de similitud de 99.48%, la secuencia fue registrada en el GenBank con número de acceso ON860658 (White et al., 1990).

Figura 2 Síntoma de manchas foliar en hojas de palma camedor en campo, manchas ovaladas de color café claro con un punto negro en el centro afectando a los foliolos de la hoja (A), colonia blanca-marrón con micelio algodonoso y abundante acérvulos en el centro (B), acérvulos de color negro brillante con abundante conidios (C) y conidios con tres células pigmentadas en el centro y basales hialinas, con sétulas apicales y pedicelo basal (D) de Neopestalotiopsis sp formadas en PDA, síntomas presentados a los cuatro (E) y ocho (F) días después de la inoculación, conidias reaisladas producidas en PDA de las pruebas de patogenicidad (E) y planta control (F).
Para el síntoma de antracnosis se identificó a Colletotrichum karstii como agente causal de esta enfermedad, la identificación se realizó a partir de 10 aislamientos frecuentes de hongos las cuales se caracterizan por ser filamentoso, las colonias forman esporodoquios de reproducción asexual con conidios hialinos, marrón pálido semi esféricos, simples o ramificados o erectos (dimensiones de 6.47 a 8.59 µm de longitud x 2.69 a 3.31 µm de ancho), conidióforos de 17.04 a 33.35 µm de altura (Barnett and Hunter, 2006; Watanabe, 2002) (Figura 3). Características similares de este hongo fueron reportados en otros cultivos como la fresa en Brasil (Soares, 2021) y cultivo de papaya en México (Pacheco et al., 2022). La identificación molecular se obtuvo a través del análisis de la secuencia consenso obtenida por la amplificación del gen 18S rDNA (ITS5/ITS4) que presentó alta similitud con Colletotrichum karstii con una cobertura de 100% y un porcentaje de similitud de 99.83%, se registró en el GenBank con el número de acceso ON799261 (White et al., 1990).
Pruebas de patogenicidad. Las plantas inoculadas con Neopestalotiopsis sp. presentaron los primeros síntomas de mancha foliar a los cuatro días posteriores y a los ocho días, los síntomas de pequeñas manchas ovaladas con un punto negro en el centro fueron marcados y definidos, iguales a los observados en campo. El control no presentó ninguna sintomatología. Las plantas con síntomas se utilizaron para reaislar el patógeno y se corroboró que Neopestalotiopsis sp. es el agente causal de la enfermedad de mancha foliar (Figura 2). Estos resultados concuerdan con lo reportado por Khoo et al. (2022) que encontró que las plantas de Ixora chinensis inoculadas con Neopestalotiopsis cubana manifestaron los síntomas a los siete días, mientras que las plantas de mango inoculadas con Neopestalotiopsis sp., y de fresa inoculadas con Neopestalotiopsis rosae presentaron los síntomas a los 10 días después de la inoculación (Gerardo-Lugo et al., 2020; Rebollar et al., 2020).
En la prueba de patogenicidad con el hongo Colletotrichum karstii, los síntomas de antracnosis se manifestaron a partir del tercer día con pequeñas manchas café obscuras poco definidas y a los 11 días las manchas irregulares estaban bien marcadas reproduciendo los mismos síntomas observados en campo, el hongo fue reaislado e identificado como C. karstii (Figura 3). De acuerdo a lo reportado por Ayvar-Serna et al. (2021) en frutos de aguacate inoculados con el mismo patógeno manifestaron los síntomas a los cinco días, por su parte Fernández-Herrera (2020) coincide en que lo síntomas se empiezan a manifestarse a los tres días posteriores a la inoculación en plantas de orquídeas de Dendrobium nobile y a los siete días en frutos de chile (Saini et al., 2016).

Figura 3 Síntoma de antracnosis en palma camedor en campo, manchas irregulares de color negro afectando a los foliolos de la hoja (A), colonia de color marrón pálido con abundante esporodoquios (B), conidióforos y conidios hialinos semiesféricos (C) de Colletotrichum karstii formadas en PDA, síntomas manifestados a los tres (D) y 11 días (E) después de la inoculación de la prueba de patogenicidad y planta control (F).
Incidencia y severidad en campo. Durante el período de muestreo en campo de la enfermedad ocasionada por Neopestalotiopsis sp. se observó que la incidencia y la severidad presentaron una intensidad dependiente del clima y manejo durante el progreso de la enfermedad (Figura 4). Para el mes de junio se registró una incidencia de 12% (ABCPE=732), correspondiente a uno de los meses más secos de muestreo de verano, mientras que en agosto correspondiente a la temporada húmeda por las lluvias y de mayor actividad antropogénica por los cortes de hojas de palma, se presentó el valor más alto 45% (ABCPE= 2790). Para la severidad se registró un comportamiento similar a la incidencia, el mes más seco abril, se registró 25% de severidad (ABCPE=1525), mientras que el mes mas lluvioso y húmedo octubre 50% (ABCPE= 3355) (Figura 4). En este sentido se ha reportado que la enfermedad de manchas foliares provocada por Neopestalotiopsis en hojas de eucalipto, las lesiones son mas severas cuando la interacción del patógeno y la plantas se exponen a periodos prolongados de humedad (Belisario et al., 2019). Según lo reportado por Maharachchikumbura et al. (2011) la incidencia y la severidad están asociadas al grosor de la lámina foliar y a la etapa de maduración de las hojas ya que las hifas penetran en los espacios de las células de las hojas cuando se encuentran en estado maduro por lo que, la susceptibilidad de éstas, también depende del grosor de la cutícula y de la producción de fitotoxinas como pestalopironas, hidroxipestalopironas y pestalocidos. Es importante señalar que, aunque se haya registrado una incidencia mínima de 12% y severidad del 25% las palmas no pueden ser comercializadas, ya que la parte comercial de la palma camedor son sus hojas y con el mínimo daño que presenten, no cumplen con los estándares de calidad establecidos por el mercado según lo menciona De los Santos (2005), en el informe de mercado de la palma camedor en México.

Figura 4 Incidencia y severidad (área bajo la curva del progreso de la enfermedad) de la mancha foliar provocada por Neopestalotiopsis sp. en plantaciones comerciales de palma camedor de ocho años de edad en el año 2021.
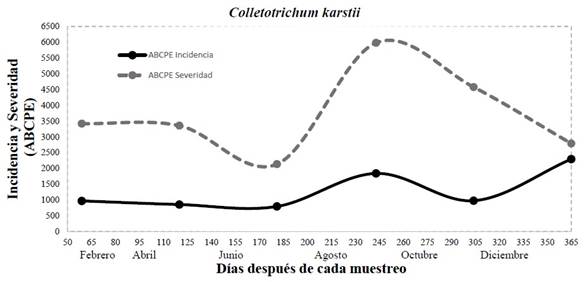
En cuanto al comportamiento de la enfermedad ocasionada por Colletotrichum karstii en el mes de junio se presentó una incidencia de 13% (ABCPE= 793) que corresponde a una estación de calor e inicio de las lluvias en la región, mientras que el valor más alto se registró en el mes de diciembre con 37% (ABCPE= 2257), época que se presentan temperaturas frescas y alta humedad relativa (Figura 5). Con respecto a la severidad la enfermedad tuvo un comportamiento similar al de incidencia donde el valor más bajo se registró en junio con 35% (ABCPE= 2135), y en agosto a octubre donde la temperatura es más fresca con alta humedad relativa por las lluvias torrenciales se presentó una severidad de 65% (ABCPE= 4030) y 75% (ABCPE= 4575) respectivamente (Figura 5). En este sentido, los factores ambientales son importantes para la diseminación y progreso de la enfermedad, principalmente humedad relativa y precipitación juegan un papel en la epidemiología de Colletotrichum karstii en huertos de cítricos (Mayorking et al., 2019). Estudios realizados por Velho et al. (2014) mencionan que la incidencia y severidad provocada por este patógeno puede defoliar los árboles de manzana y se ve favorecido por la alta humedad y la temperatura. Asimismo, se ha reportado a Colletotrichum y Pestalotiopsis como hongos potenciales, agentes causales de manchas foliares en palma donde la enfermedad es diseminada por esporas fácilmente dispersada por el viento y la lluvia (Tariq et al., 2015).
Conclusiones
De acuerdo con la caracterización morfológica, molecular y las pruebas de patogenicidad, se concluye que Neopestalotiopsis sp. es el agente causal de las manchas foliares y Colletotrichum karstii responsable de la enfermedad antracnosis en palma camedor. El progreso de la incidencia y severidad de estas enfermedades son dependientes de los factores de humedad relativa ocasionada por las lluvias y manejo agronómico, esto reduce la calidad y producción de palma, por lo cual, este es el primer reporte en México de estos patógenos asociados al cultivo de palma camedor (Chamaedorea quezalteca).
Agradecimientos
A los ejidos de Plan de Ayala y Sierra Morena, ambos del municipio de Villa Corzo, Chiapas por colaborar en este proyecto de investigación y al Centro de Investigación en Alimentación y Desarrollo - Unidad Cuauhtémoc Chihuahua por el apoyo en la identificación molecular de los patógenos.
REFERENCIAS
Acosta-González U. 2022. Caracterización de aislamientos de Neopestalotiopsis spp. y efecto de fungicidas en pre y post-infección en el cultivo de fresa (tesis doctoral), Universidad Autónoma Chapingo. Estado de México. 133p. https://repositorio.chapingo.edu.mx/handle/123456789/1443 [ Links ]
Ahmad I, Saeed HAR and Khan MAS. 2020. Ornamental Horticulture: Economic Importance, Current Scenario and Future Prospects. Pp:3-40. In: I. Ul Haq and S. Ijaz, (Eds.), Etiology and Integrated Management of Economically Important Fungal Diseases of Ornamental Palms. Sustainability in Plant and Crop Protection. Vol. 16. Springer, Cham. 274p. https://doi.org/10.1007/978-3-030-56330-1_1 [ Links ]
Aldana de la TJA, Aldana de la TR, Calvache GH y Franco BPN. 2009. Manual de plagas de la palma de aceite en Colombia. (en línea) Colombia. Cenipalma. Bogotá, Colombia. 198p. http://repositorio.fedepalma.org/handle/123456789/107711. [ Links ]
Altschul SF, Gish W, Miller W, Myers EW and Lipman JD. 1990. Basic local alignment search tool. Journal of Molecular Biology 215: 403-410. https://doi.org/10.1016/S0022-2836(05)80360-2 [ Links ]
Ayvar-Serna S, Díaz-Nájera JF, Vargas-Hernández M, Camacho-Tapia M, Valencia-Rojas GA, Lima NB and Tovar-Pedraza JM. 2021. First report of Colletotrichum jiangxiense causing avocado anthracnose in Mexico. Plant Disease 105(2): 502. https://doi.org/10.1094/PDIS-03-20-0459-PDN [ Links ]
Barnett H and Hunter B. 2006. Ilustrated genera of imperfect fungi. Fourth edition, The American Phytopatological Society Minessota, Estados Unidos. 240p. [ Links ]
Belisário R, Aucique-Pérez CE, Abreu LM, Salcedo SS, de Oliveira WM and Furtado SS. 2019. Infection by Neopestalotiopsis spp. occurs on unwounded eucalyptus leaves and is favoured by long periods of leaf wetness. Plant Pathology 69: 194-204. https://doi.org/10.1016/j.hpj.2020.10.004 [ Links ]
Broschat TK, Elliott ML and Hodel DR. 2014. Ornamental palms: biology and horticulture. Pp:1-120. In: M. H. Meyer, M. S. Reid and D. Swietlik (Eds.), Horticultural reviews. Wiley-Blackwell. 488p. https://doi.org/10.1002/9781118916827.ch01 [ Links ]
Buda Arango G, Trench T y Durand L. 2014. El aprovechamiento de palma camedor en la Selva Lacandona, Chiapas, México: ¿Conservación con desarrollo?. Estudios sociales. Revista de alimentación contemporánea y desarrollo regional 22(44): 199-223. [ Links ]
De los Santos Espinoza J, Paniagua JL y González A. 2005. Informe de mercado de la palma camedor (Chamaedorea spp.). Grupo Mesófilo A.C. Oaxaca México. 26p. https://assets.publishing.service.gov.uk/media/57a08c7240f0b64974001214/R7925i_Palma_camedora.pdf [ Links ]
El-Juhany LI. 2010. Degradation of date palm trees and date production in Arab countries: Causes and potential rehabilitation. Australian Journal of Basic and Applied Sciences 4(8): 3998-4010. https://www.researchgate.net/publication/236229832 [ Links ]
Evans M. 1993. Conservation by commercialization. Pp:815-822. In: C. Hladik A. Hladik O. Linares. H. Pagezy. A. Semple and M. Hadley, (Eds.), Tropical Forests, People and Food: Biocultural Interactions and Applications to Development. MAB Series. Vol. 13. UNESCO. 852p. [ Links ]
Fernández-Herrera E, Rentería-Martínez ME, Ramírez-Bustos II, Moreno-Salazar SF, Ochoa-Meza A and Guillén-Sánchez D. 2020. Colletotrichum karstii: causal agent of anthracnose of Dendrobium nobile in Mexico. Canadian Journal of Plant Pathology 42 (4):514-519. https://doi.org/10.1080/07060661.2020.1731711 [ Links ]
Gerardo-Lugo SS, Tovar-Pedraza JM, Maharachchikumbura SS, Apodaca-Sánchez MA, Correia KC, Sauceda-Acosta CP and Beltrán-Peña H. 2020. Characterization of Neopestalotiopsis species associated with mango grey leaf spot disease in Sinaloa, Mexico. Pathogens 9(10): 788. https://doi.org/10.3390/pathogens9100788 [ Links ]
Granados SD, Hernández GMA, López RGF y Santiago LM. 2004. El cultivo de palma camedor (Chamaedorea sp.) en sistemas agroforestales de Cuichapa, Veracruz. Revista Fitotecnia Mexicana 27:233-241. https://www.redalyc.org/articulo.oa?id=61027303 [ Links ]
Hodges RJ, Buzby JC and Bennett B. 2011. Postharvest losses and waste in developed and less developed countries: opportunities to improve resource use. The Journal of Agricultural Science 149:37-45. https://doi.org/10.1017/S0021859610000936 [ Links ]
Howard FW. 2001. Insect pests of palms and their control. Pesticide Outlook, 12, 240-243. https://doi.org/10.1039/B110547G [ Links ]
Khoo YW, Tan HT, Khaw YS, Li S and Chong KP. 2022. First Report of Neopestalotiopsis cubana Causing leaf blight on Ixora chinensis in Malaysia. Plant Disease 106 (10): 2747. https://doi.org/10.1094/PDIS-02-22-0277-PDN [ Links ]
López C, Chanfon S y Segura G. 2005. La riqueza de los bosques mexicanos: más allá́ de la madera. Experiencias de comunidades rurales. Montana, México, Secretaria de Medio Ambiente y Recursos Naturales (SEMARNAT) y CIFOR. 200 p. https://www.cifor.org/knowledge/publication/1890 [ Links ]
Maharachchikumbura SS, Guo LD, Chukeatirote E, Bahkali AH and Hyde KD. 2011.Pestalotiopsis: morphology, phylogeny, biochemistry and diversity. Fungal diversity 50 (1):167-187. https://doi.org/10.1007/s13225-011-0125-x [ Links ]
Martínez-Camilo R, González-Espinosa M, Pérez-Farrera MA, Quintana-Ascencio PF and Ruiz-Montoya L. 2011. Evaluation of leaf harvesting effect on Chamaedorea quezalteca Standl. & Steyerm. (Palmae), in the El Triunfo Biosphere Reserve, Chiapas, México. Agrociencia 45(4): 507-518. https://www.redalyc.org/articulo.oa?id=30219802009 [ Links ]
Mayorquin JS, Nouri MT, Peacock BB, Trouillas FP, Douhan GW, Kallsen C and Eskalen A. 2019. Identification, Pathogenicity, and Spore Trapping of Colletotrichum karstii Associated with Twig and Shoot Dieback in California. Plant disease 103(7):1464-1473. https://doi.org/10.1094/PDIS-08-18-1425-RE [ Links ]
Pacheco-Esteva MC, Soto-Castro D, Vásquez-López A, Lima NB and Tovar-Pedraza JM. 2022. First Report of Colletotrichum chrysophilum Causing Papaya Anthracnose in Mexico. Plant Disease 106 (12):3213. https://doi.org/10.1094/PDIS-03-22-0681-PDN [ Links ]
Pedroza SA and Samaniego JA. 2009. Analisis del area bajo la curva del progreso de la enfermedad (ABCPE) en patosistemas agrícolas. Pp:179-189. In: Bautista ME, Soto RL and Pérez PR. 2009. Tópicos selectos de estadística aplicada a la fitosanidad. Primera Edición. Colegio de Posgraduados y IPN- CIIDIR-Oaxaca. 235p. [ Links ]
Pérez-Farrera MA, Martínez-Camilo R, Martínez-Meléndez N, López-Mendoza S, Espinoza-Medinilla EE, Sánchez-Kramsky S y Ruiz-Castillejos C. 2012. Monitoreo de la palma camedor (Chamaedorea quezalteca, Arecaceae) en la reserva de la biósfera La Sepultura, en el Estado de Chiapas, México. Universidad de Ciencias y Artes de Chiapas, Facultad deCiencias Biológicas. Informe Técnico Final, CONANP. Tuxtla Gutiérrez, México. 112 p. [ Links ]
Raeder U and Broda P. 1989. Rapid preparation of DNA from filamentous fungi. Letters in Applied Microbiolology 1:17-20. https://doi.org/10.1111/j.1472-765X.1985.tb01479.x [ Links ]
Rebollar-Alviter A, Silva-Rojas HV, Fuentes-Aragón D, Acosta-González U, Martínez-Ruiz M and Parra-Robles BE. 2020. An emerging strawberry fungal disease associated with root rot, crown rot and leaf spot caused by Neopestalotiopsis rosae in Mexico. Plant Disease 104(8):2054-2059. https://doi.org/10.1094/PDIS-11-19-2493-SC [ Links ]
Ruiz-Cisneros MF, Rios-Velasco C, Berlanga-Reyes DI, Ornelas-Paz JJ, Acosta-Muñiz CH, Romo-Chacón A, Zamudio-Flores PB, Pérez-Corral DA, Salas-Marina MA, Ibarra-Rendón, JE and Fernández-Pavía SP. 2017. Incidence and causal agents of root diseases and its antagonists in apple orchards of Chihuahua, Mexico. Revista Mexicana de Fitopatología 35(3):437-462. https://doi.org/10.18781/R.MEX.FIT.1704-3 [ Links ]
Saini TJ, Gupta SG, Char BR, Zehr UB and Anandalakshmi R. 2016. First report of chilli anthracnose caused by Colletotrichum karstii in India. New Disease Reports 34:6. https://doi.org/10.5197/j.2044-0588.2016.034.006 [ Links ]
Schmidhuber J and Tubiello FN. 2007. Global food security under climate change. Proceedings of the National Academy of Sciences 104(50):19703-19708. https://doi.org/10.1073/pnas.0701976104 [ Links ]
Shakeel Q, Wu M, Zhang J and Zia-Ul-Haq. 2020. Fungal Diseases of Cat Palm (Chamaedorea cataractarum), Bamboo Palm (Chamaedorea seifrizii) and Cluster Palm (Chamaedorea costaricana). Pp:125-140. In: I. Ul Haq and S. Ijaz (eds), Etiology and Integrated Management of Economically Important Fungal Diseases of Ornamental Palms. Sustainability in Plant and Crop Protection, Vol 16. Springer, Cham. 274p. https://doi.org/10.1007/978-3-030-56330-1_6 [ Links ]
Soares VF, Velho AC., Carachenski A, Astolfi P and Stadnik MJ. 2021. First Report of Colletotrichum karstii Causing Anthracnose on Strawberry in Brazil. Plant Disease 105 (10): 3295. https://doi.org/10.1094/PDIS-03-21-0518-PDN [ Links ]
Tariq RMS, Shahzad S and Rajput AQ. 2020. Fungal Diseases of Foxtail Palm (Wodyetia bifurcata). Pp:115-123. In: I. Ul Haq and S. Ijaz (eds), Etiology and Integrated Management of Economically Important Fungal Diseases of Ornamental Palms. Sustainability in Plant and Crop Protection, Vol 16. Springer, Cham. https://doi.org/10.1007/978-3-030-56330-1_5 [ Links ]
Velho AC, Stadnik MJ, Casanova L, Mondino P and Alaniz S. (2014). First report of Colletotrichum karstii causing Glomerella leaf spot on apple in Santa Catarina State, Brazil. Plant Disease98(1):157-157. https://doi.org/10.1094/PDIS-05-13-0498-PDN [ Links ]
Watanabe T. (2002). Pictorial Atlas of Soil and Seed Fungi Morphologies of Cultured Fungi and Key to Species. Second edition. CRC PRESS. Boca Raton, Florida, USA. 486 p. [ Links ]
White TJ, T. Brunts, S. Lee and J. Taylor. 1990. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. Pp:315-322. In: M. A. Innis, D. H. Gelfand, J. J. Sninsky and T. J. White (Eds.), PCR Protocols: A Guide to Methods and Applications. Academic Press, New York. 482p. http://dx.doi.org/10.1016/B978-0-12-372180-8.50042-1 [ Links ]
Recibido: 13 de Febrero de 2022; Aprobado: 05 de Abril de 2023











 texto em
texto em