Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de fitopatología
versión On-line ISSN 2007-8080versión impresa ISSN 0185-3309
Rev. mex. fitopatol vol.41 no.1 Texcoco ene. 2023 Epub 11-Ago-2023
https://doi.org/10.18781/r.mex.fit.2210-3
Artículos científicos
Clima, fructificación y moniliasis determinan la intensidad epidémica de Phytophthora capsici en cacao en México
1 División Académica de Ciencias Biológicas, Universidad Juárez Autónoma de Tabasco. Km. 0.5 Carretera Villahermosa-Cárdenas, CP 86150, Villahermosa, Tabasco, México
2 Colegio de Postgraduados, Campus Montecillo, Texcoco, CP. 56230. Estado de México, México
3 Colegio de Postgraduados, Campus Tabasco, H. Cárdenas, Tabasco, CP 86500, México
En México, Theobroma cacao es afectado por la mancha negra (MN) causada por Phytophthora capsici. Actualmente se carece de un estudio epidemiológico de esta enfermedad. El objetivo fue conocer la influencia del clima, fructificación y la incidencia de la moniliasis (Moniliophthora roreri) en la intensidad epidémica de MN en cinco localidades del sureste de México. Se analizó la estructura temporal epidémica de MN y se estudió la correlación de cambios absolutos de incidencia MN con temperatura, humedad relativa (HR), precipitación, y flujos de fructificación. La posible competencia entre P. capcisi y M. roreri también se analizó correlativamente. Las epidemias tuvieron una duración de 15 a 25 semanas restringidas a septiembre - febrero con incidencias finales (Y f ) del 6 al 24%. Las curvas se ajustaron al modelo Gompertz (r = 0.059 - 0.123, R2 0.97 - 0.99) con fase exponencial en octubre correspondiendo con la mayor precipitación pluvial. La MN se asoció positivamente con HR mayor al 90%, precipitación, periodos de temperaturas menores de 19.9 y de 20 - 26.9 °C, y con intensidad de fructificación. P. capcisi tuvo menor aptitud parasítica que M. roreri, el cual indujo epidemias más tempranas, con mayor duración e intensidad. La caracterización de MN como epidemia policíclica justifica estrategias de manejo dirigidas a la reducción del inóculo secundario.
Palabras clave: Mancha negra; Theobroma cacao; Moniliasis; Gompertz
In Mexico, Theobroma cacao is affected by the black pod rot (BPR) caused by Phytophthora capsici. Currently, an epidemiological study of this disease is lacking. The objective was to determine the influence of climate, fruit set and the incidence of cacao frosty pod rot (Moniliophthora roreri) on the epidemic intensity of BPR in five locations in southeastern Mexico. The temporal structure of BPR epidemics was analyzed and the correlation of absolute change of BPR incidence with temperature, relative humidity (RH), precipitation, and fruiting flows was studied. The possible competition between P. capcisi and M. roreri was also analyzed correlatively. The epidemics had a duration of 15 to 25 weeks restricted to September - February with 6 to 24% final incidence (Y f ). The curves were best fitted to the Gompertz model (r = 0.059 - 0.123, R2 0.97 - 0.99) with an exponential phase in October corresponding with the highest rainfall. BPR was positively associated with RH greater than 90%, precipitation, temperature periods lower than 19.9, and 20 - 26.9 °C, and with fruiting intensity. P. capcisi had less parasitic fitness than M. roreri, which induced earlier epidemics, with greater duration and intensity. The characterization of BPR as a polycyclic epidemic justifies management strategies aimed at reducing the secondary inoculum.
Key words: Black pod rot; Teobroma cacao; Cacao frosty pod rot; Gompertz
El cacao (Theobroma cacao) es un cultivo importante en la agricultura del sureste de México. Actualmente se cultivan 52,994 ha, donde Tabasco y Chiapas concentran la mayor producción del país (SIAP, 2022). Este cultivo es afectado por diversos factores, tanto ambientales, económicos y sociales, a los cuales se suma la presencia de plagas y enfermedades (Hernández-Gómez et al., 2016). En este país, una de las enfermedades importantes es la moniliasis, causada por el hongo Moniliophthora roreri, la cual causa pérdidas de hasta 75% de la producción (Torres-de la Cruz et al., 2020). Le sigue en importancia la mancha negra del fruto del cacao (MN), causada por el oomiceto Phytophthora capsici (Hernández-Gómez et al., 2016; Ortíz-García, 1996), con pérdidas productivas entre 20 y 25% (Bowers et al., 2001).
La MN se reportó por primera vez en el Caribe en 1727 en la isla de Trinidad (Tollenaar, 1959). En la actualidad se tienen registros de esta enfermedad en África, Asia, Oceanía y América (Sánchez-Cuevas et al., 2015). Hasta 1979, P. palmivora fue considerado el agente causal de la MN (Akrofi, 2015). Actualmente, a nivel mundial se ha documentado más de siete especies del género Phytophthora como agentes causales de la MN. En cada país donde se cultiva T. cacao existen diversas especies prevalentes induciendo daños contrastantes. Las principales especies causales de MN son P. palmivora, P. megakarya, P. citrophthora, P. megasperma, P. arecae, P. heveae y P. capsici (Kroon et al., 2012). En el continente americano se ha reportado principalmente a P. palmivora, P. parasitica y P. capcisi (Ortiz-García, 1991; Bahía et al., 2015), y más recientemente P. tropicalis (Aragaky y Uchida, 2021) y P. cacaoicola (Decloquement et al., 2021). En México, inicialmente se señaló a P. palmivora como el agente causal; sin embargo, Ortiz-García (1996) demostró que P. capsici es el único agente causal de la MN en Tabasco y Norte de Chiapas. Recientemente se confirmó la implicación de P. capsici en la MN en Chiapas (Hernández-Gómez et al., 2016).
La MN se caracteriza por producir lesiones necróticas en los frutos (mazorcas y granos) y tejido foliar (Sánchez-Cuevas et al., 2015). Aunque el daño en fruto es más frecuente, a diferencia de Moniliophthora roreri, puede causar cancro del tallo y provocar la muerte del árbol (Marelli et al., 2019). Los frutos de todas las edades son susceptibles a la MN y la infección aparece en forma de manchas circulares de borde regular, de color café oscuro, las cuales se extienden uniformemente por la superficie hasta cubrir totalmente la mazorca (Acrofi, 2015). Los frutos infectados se tornan color negro, se momifican y pueden permanecer en el árbol por varios meses (Ndoumbe Nkeng et al., 2017). Los síntomas y la progresión de la MN dependen del genotipo del cacao, la especie de Phytophthora involucrada y la influencia de temperatura, humedad relativa y la precipitación (Puig et al., 2018).
En México, los estudios relacionados a la MN son escasos (Hernández-Gómez et al., 2016; Ortiz-García, 1996). En el sureste de México existe la disposición por reactivar la producción de cacao; sin embargo, la MN y la moniliasis del cacao son fuertes limitantes parasíticas endémicas por lo que se requiere información epidemiológica para desarrollar estrategias de mitigación regionales efectivas y pertinentes. Por lo anterior, el objetivo de esta investigación fue conocer la influencia de los factores climáticos, los flujos de fructificación y la incidencia de la moniliasis del cacao en la intensidad epidémica de la MN en cinco plantaciones-localidades en el sureste de México.
Materiales y métodos
Área de estudio. Este trabajo se desarrolló en cinco plantaciones de cacao en el estado de Tabasco y región Norte de Chiapas, México. Los datos fueron registrados en el ciclo productivo 2011-2012. El área de estudio se encuentra en un clima cálido húmedo con abundantes lluvias en verano. La precipitación media anual es de 2432 mm, con periodos de lluvia que se extienden de junio a marzo, y periodo de sequía en abril y mayo. La temperatura media anual es de 26 °C y predominan los suelos vertisoles y gleysoles (INEGI, 2017). Datos de ubicación geográfica y altitud de cada plantación se indican en Cuadro 1.
Cuadro 1 Ubicación geográfica de plantaciones de cacao experimentales para el estudio epidémico de la mancha negra en Tabasco y Norte de Chiapas, México.
| Municipio/ Estado | Plantación | Altitud (msnm) | Latitud N | Longitud O |
|---|---|---|---|---|
| Paraíso, Tabasco | Moctezuma | 3 | 18° 21’ 06.9” | 93° 12’ 57.8” |
| Cunduacán, Tabasco | La Piedra | 14 | 18° 07’ 45.2” | 93° 11’ 52.4” |
| Cárdenas, Tabasco | Poblado C-28 | 3 | 18° 01’ 46.7” | 93° 29’ 42.0” |
| Huimanguillo, Tabasco | Paredón | 7 | 17° 44’ 59.6” | 93° 23’ 57.8” |
| Pichucalco, Chiapas | Platanar | 76 | 17° 33’ 01.3” | 93° 18’ 90.9” |
Características de las plantaciones. El estudio se realizó en plantaciones comerciales tradicionales de cacao, constituidas por híbridos de tipo Trinitario, susceptibles a la MN. Las plantaciones tuvieron de 20 a 25 años y una densidad de 784 plantas ha-1 con un arreglo topológico aproximado de 3.5 × 3.5 m. En cada plantación se delimitó una parcela experimental de 180 árboles en un área rectangular de 10 × 18 árboles de cacao. En total se evaluaron 48 árboles en la sección central de 4 × 12. El manejo de las plantaciones consistió en la eliminación mecánica de brotes vegetativos basales y el control mecánico de maleza.
Registro de frutos. Frutos mayores a 7 cm de longitud, incluyendo chilillos, frutos verdes y maduros, se registraron de forma semanal durante un año para determinar la fluctuación del flujo de frutos potenciales a la infección por P. capsici y para relacionar la incidencia de enfermedad.
Evaluación de incidencia de MN y la moniliasis del cacao. En cada plantación se etiquetaron todos los frutos de 8 a 10 cm de largo, provenientes de los flujos de floración y amarre de frutos que se presentaron durante el año de evaluación. El número de frutos se estimó mediante censo de 48 árboles. Cada fruto se observó semanalmente in situ para detectar síntomas y signos de MN que consistieron en manchas circulares con borde regular color café oscuro, y una capa de micelio poco densa con apariencia de algodón blanquecino. Por otra parte, para evaluar el potencial competitivo de la infección del hongo causante de la moniliasis sobre la incidencia de MN se registró semanalmente el número de frutos enfermos por moniliasis cuyos síntomas fueron mancha color café (mancha chocolate) con bordes irregulares y esporulación abundante de acuerdo con Torres-de la Cruz et al. (2020). Para estimar la incidencia de cada enfermedad se registró el número de frutos enfermos entre el número total de frutos evaluados por 100.
Análisis temporal del progreso de la mancha negra del cacao. El análisis temporal de la MN se realizó de acuerdo con Torres-de la Cruz et al. (2020). Para ello, por cada parcela se generaron gráficas del progreso temporal del porcentaje de incidencia, acumulada y no acumulada, en función del tiempo. Con el progreso acumulado parcelario se estimó la incidencia inicial (Y 0 ), área bajo la curva de progreso de enfermedad (ABCPE), tasa de infección aparente (r) con el modelo Gompertz en su forma no lineal, e incidencia acumulada final (Y f ) (Torres-de la Cruz et al. 2020; Campbell y Madden, 1990). Adicionalmente, se ajustaron los modelos epidemiológicos monomolecular y logístico para analizar el posible efecto monocíclico y policíclico de la infección. Los valores de incidencia se multiplicaron por cuatro para escalar la curva epidémica y permitir el ajuste a los modelos epidemiológicos ya que Y f fue inferior al 10%.
Variables climáticas. La temperatura y la humedad relativa se registró por plantación a intervalos de 2 h mediante sensores Hobo H8® (Onset Instruments, Pocasset, MA, EUA), instalados a 2 m de altura al centro de parcela. Los datos se recolectaron semanalmente. Datos de precipitación acumulada mensual de 2011 y 2012 se obtuvieron de registros de estaciones más cercanas a las plantaciones estudiadas: Poblado C-28 (Estación 27078), Paraíso (Estación 27034), Tulipán (Estación 27051), INIFAP (Estación 27095), Platanar (Estación 07130).
Análisis estadístico. Los cálculos de la tasa de infección aparente (r), ABCPE y el ajuste de los datos de incidencia a modelos epidemiológicos se realizaron con procedimientos NLIN, SUMMARY y GLM de SAS® (SAS Institute, 2004). Como criterio de bondad de ajuste se utilizó el coeficiente de determinación. Se realizó la comparación entre plantaciones con cada una de las variables ambientales mediante ANOVA (p = 0.5). Con un desfase semanal por efecto del periodo promedio de incubación, la incidencia absoluta de MN se correlacionó con la temperatura promedio semanal, humedad relativa promedio semanal, y con el número de frutos. Análogamente, la incidencia absoluta se correlacionó con intervalos desfasados de temperatura y humedad relativa para lo cual se calculó el número de horas/semana de temperatura y humedad relativa en los siguientes intervalos: temperatura, a) < 19.9 °C; b) 20-26.9 °C; c) 27- 29.9 °C; d) 30-34.9 °C, y e) > 35 °C; y humedad relativa, a) < 59.9 %, b) 60-90 %, y c) > 90 %. La incidencia acumulada mensual se correlacionó con la precipitación acumulada mensual, sin desfase, y se analizó la correlación entre incidencia final de MN con la precipitación acumulada durante los meses de progresión epidémica (septiembre 2011- febrero 2012). Para evaluar la potencial de competencia entre los agentes causales de moniliasis y MN se correlacionaron picos de moniliasis desfasados por dos a tres semanas, durante octubre-enero, respecto a picos de MN. Las correlaciones se analizaron con el coeficiente de Spearman (Rho) mediante el software IBM SPSS® 22.0.
Resultados y discusión
Comportamiento temporal de la mancha negra del cacao. Se generaron cinco epidemias de MN, una por cada localidad-parcela estudiada (Figura 1). En los sitios Moctezuma, La Piedra y Poblado C-28, la MN se presentó de 15 - 18 semanas. En Paredón y Platanar la MN se extendió por 25 semanas. Todas las epidemias en general exhibieron una curva sigmoidal con ligeros eventos inter-sigmoidales. Las epidemias de Moctezuma, Paredón y Platanar tuvieron una prolongada fase pre-exponencial entre el 30 de agosto y 15 de octubre. Epidemias de MN de conformación sigmoidal atípicas también se han reportado para P. megakarya en Camerún (Ndoumbe-Nkeng et al., 2017). Esto incrementos atípicos, inter-sigmoidales pueden deberse a nuevos focos de infección (Ndoumbe-Nkeng et al., 2017; Ristaino, 2000). Mientras que Torres-de la Cruz y colaboradores (2020), los atribuyeron a variaciones en el ritmo de fructificación con eventos intermitentes de infección en el caso de Moniliophthora roreri.
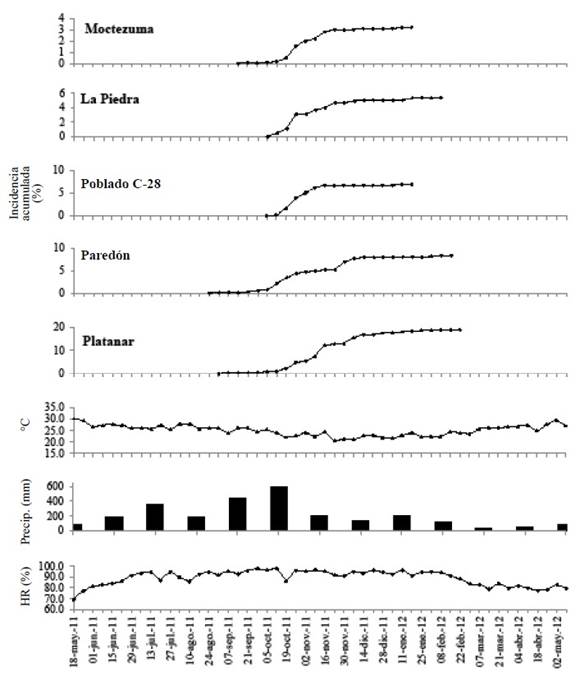
Figura 1 Curvas epidémicas del progreso temporal acumulado de incidencia de la mancha negra del cacao, causada por Phytophthora capsici, en cinco localidades-plantaciones comerciales con tecnología tradicional. Comportamiento promedio de temperatura, humedad relativa y precipitación en las cinco localidades de Tabasco y Norte de Chiapas. Ciclo productivo 2011-2012.
La incidencia final (Y f ), ajustada por el número de frutos producidos durante el periodo de enfermedad, fluctuó de 6.3 a 24.8% con una incidencia promedio de 12.5% (Cuadro 2). La menor Y f se presentó en la plantación de Moctezuma, mientras que la mayor se obtuvo en Platanar (Cuadro 2). Estos resultados representan una intensidad baja respecto a otras regiones en África con ocurrencia de P. megakarya entre baja y alta incidencia (1.15 al 70%), y baja y moderada (16 al 40%) según la precipitación pluvial anual (Ndoumbe-Nkeng et al., 2009). La dependencia de la precipitación de Phytophthora spp. para altas tasas de infección está bien documentada. Sin embargo, la intensidad de incidencia de MN puede depender también de la variedad de la planta de cacao, manejo sanitario, especie de Phytophthora implicada, y el manejo cultural de plantación (Akrofi, 2015; Montes-Belmont y de los Santos, 1989).
Cuadro 2 Parámetros epidemiológicos del progreso de la incidencia acumulada de la mancha negra del cacao (Phytophthora capsici) en cinco plantaciones de Tabasco y Norte de Chiapas, México, y ajuste a un modelo epidemiológico.Ciclo productivo 2011-2012.
| Localidad | ABCPEw | rx | Yf y | Modelo | R2z |
|---|---|---|---|---|---|
| Moctezuma | 141.94 | 0.059 | 6.29 | Gompertz | 0.97 |
| La Piedra | 326.06 | 0.067 | 7.76 | Gompertz | 0.97 |
| Poblado C-28 | 514.73 | 0.123 | 12.77 | Gompertz | 0.99 |
| Paredón | 442.92 | 0.035 | 10.76 | Gompertz | 0.95 |
| Platanar | 2,416.80 | 0.046 | 24.78 | Gompertz | 0.99 |
w ABCPE: Área bajo la curva del progreso de la enfermedad.
xr: Tasa de infección aparente de la enfermedad estimado con el modelo Gompertz.
y Y f : Incidencia final acumulada.
zR2: Coeficiente de determinación.
Los valores de intensidad de las epidemias, estimados con ABCPE, fluctuaron entre 141.9 y 2,416.8 (Cuadro 2). La parcela con mayor ABCPE fue Platanar (2,416.8) y la menor se obtuvo en Moctezuma (141.9). Sin embargo, la alta ABCPE del primero no correspondió con la mayor tasa de infección (r = 0.016) debido a su prolongada epidemia respecto a Poblado C-28 (r = 0.041) (Cuadro 2).
Las curvas epidémicas en todas las plantaciones evaluadas tuvieron la mejor bondad de ajuste al modelo Gompertz (Cuadro 2. De acuerdo con Campbell y Madden (1990), el modelo Gompertz describe epidemias policíclicas, con curvas de progreso sigmoidal asimétricas. En una epidemia policíclica, el agente causal tiene la capacidad de producir varios ciclos de infección, el cual permite incrementos epidémicos intermitentes. En un trabajo previo con Moniliophthora roreri se demostró también eventos policíclicos favorecidos por la permanencia de frutos infectados en el árbol, los cuales proveen inóculo para infecciones continuas mientras existan condiciones ambientales favorables para el desarrollo de la enfermedad y flujos productivos de frutos (Torres-de la Cruz et al., 2020).
La caracterización de MN como epidemia policíclica puede tener implicaciones en el establecimiento de estrategias de manejo dirigidas a la reducción del inóculo secundario que permita retrasar o disminuir la intensidad de la tasa epidémica (Torres-de la Cruz et al., 2020; Campbell y Madden, 1990). En este caso, la remoción periódica de frutos enfermos puede tener un impacto negativo en la incidencia de MN. En epidemias de MN causadas por P. megakarya, se reportó que la remoción de frutos enfermos puede reducir hasta 30% la incidencia (Ndoumbe-Nkeng, 2004). La frecuencia de remoción de fuentes de inóculo es determinante. Remociones semanales fueron más efectivas que quincenales, con reducción de hasta el 66% de incidencia (Soberanis et al., 1999). Mediante simulaciones numéricas se encontró que el intervalo óptimo de remoción fue de 4 d (Nembot et al. 2017). Adicionalmente, la aplicación de fungicidas eficaces puede contribuir a la reducción del inóculo primario y secundario. Por ejemplo, el sulfato de cobre y caldo bordelés ha sido ampliamente utilizado en México para el control de MN (Torres-de la Cruz et al., 2019).
Producción de frutos y cambio absoluto de incidencia MN y moniliasis. La densidad de frutos, de 7 cm hasta frutos maduros, mostró una fluctuación temporal similar en todas las plantaciones evaluadas. La presencia de frutos de diferentes edades, aunque cuantitativamente variable, se mantuvo durante todo el año de evaluación. La mayor producción de frutos totales se concentró en los meses de agosto a diciembre (28 frutos árbol-1) con un pico productivo en octubre - noviembre (Figura 2), periodo que coincidió con la fase epidémica exponencial en todas las localidades-plantaciones (Figura 1). Estadísticamente, se demostró la correlación positiva de la incidencia absoluta con la intensidad de fructificación con un desfase de una semana (Rho = 0.52 - 0.74) (Cuadro 3). Esta dependencia de disponibilidad específica de tejido del hospedante ya se había reportado en Brasil para MN (Medeiros, 1967). Análogamente, Torres-de la Cruz y colaboradores (2020) también reportaron estrecha dependencia entre la incidencia de moniliasis del cacao con la densidad de frutos para las condiciones de México, lo cual planteó la hipótesis de competencia entre estos patógenos.

Figura 2 Fluctuación de frutos de cacao (mayores de 7 cm - frutos maduros) e incidencia absoluta de mancha negra del cacao (Phytophthora capsici) y moniliasis del cacao (Moniliophthora roreri), en cinco plantaciones comerciales tradicionales de Tabasco y Norte de Chiapas, México. Ciclo productivo mayo 2011-mayo 2012.
Cuadro 3 Coeficientes de correlación de Spearman (Rho) de incidencia absoluta de mancha negra del cacao con temperatura y humedad relativa promedio semanal, desfasados una semana antes de la aparición de la enfermedad, con precipitación acumulada mensual sin desfase, y con la moniliasis del cacao con desfase de dos o tres semanas, en cinco localidades-plantaciones comerciales de cacao en Tabasco y Norte de Chiapas. Ciclo productivo 2011-2012.
| Localidad, Estado | Correlación de Spearman (Rho) | ||||
|---|---|---|---|---|---|
| Temperatura promedio semanal | Humedad relativa promedio semanal | Precipitación acumulada mensual | Frutos | Moniliasisx | |
| Moctezuma, Tabasco | -0.66 | 0.48 | 0.47 | 0.74 | -0.60 |
| La Piedra, Tabasco | -0.52 | 0.47 | 0.34 | 0.52 | -0.61 |
| Poblado C-28, Tabasco | -0.72 | 0.51 | 0.54 | 0.66 | -0.48 |
| Paredón, Tabasco | -0.71 | 0.59 | 0.49 | 0.53 | -0.48 |
| Platanar, Chiapas | -0.73 | 0.60 | 0.76 | 0.66 | -0.62 |
xValores en negritas indican desfase de 3 semanas.
El incremento absoluto de MN y moniliasis exhibieron múltiples picos de incidencia con mayor intensidad y frecuencia en este último (Figura 2). Claramente, la moniliasis precedió eventos de infección causales de MN iniciando entre julio - agosto vs septiembre - octubre para MN. Debido a la ocurrencia de frutos durante todo el año, el comportamiento epidémico contrastante entre y dentro de cada enfermedad se debe a la capacidad parasítica de los patógenos en relación con el ambiente local. En Ghana se reportaron picos de infección de P. megakarya variables debido a la intensidad de precipitación (Dakwa, 1973), con principales picos en agosto y octubre (Opoku et al., 2007; Opoku et al., 2000). Mientras que, en Camerún, con mismo patógeno, se reportaron epidemias que se prolongaron hasta por 23 semanas también en función a la intensidad de lluvia (Ndoumbe-Nkeng et al., 2017). En Bahía, Brasil, la mayor incidencia de MN (P. citrophthora, P. palmivora y P.capsici) se presentó en los meses más fríos del año (junio - agosto) (Oliveira y Luz, 2005), con un pico máximo de incidencia en tres a cinco meses posteriores del inicio de epidemia (Medeiros et al., 1969), indicativo de epidemias más intensas que en este estudio. La epidemia con menor duración se presentó en Moctezuma (8 semanas), localidad con la menor precipitación anual (1767 mm año-1), mientras que Platanar tuvo la mayor (22 semanas), coincidiendo con la mayor precipitación (2992 mm año-1) (Figura 1). Sin embargo, la intensidad epidémica de MN fue inferior, tanto en intensidad de picos como su frecuencia respecto a la moniliasis, lo cual demuestra la mayor aptitud parasítica de M. roreri para las condiciones del sureste de México. Formalmente, esto se evidenció con la correlación negativa significativa entre los cambios absolutos de estas dos enfermedades (Rho = -0.48 - -0.61) (Figura 2, Cuadro 3). M. roreri, es un hongo superior que pudo haber evolucionado con mayor plasticidad infecciosa y ambiental confiriendo mayor aptitud competitiva sobre P. capcisi, al menos a nivel de frutos, restringiendo la incidencia de MN a niveles inferiores al 24%, sobre todo cuando la moniliasis alcanza su etapa necrotrófica generando un entorno enzimático y tisular poco apto para la infección del oomiceto.
Análisis correlativo entre factores climáticos y MN. La temperatura y la humedad relativa mostraron un comportamiento similar en todas las plantaciones, sin diferencias significativas entre sitios (p>0.05). Sin embargo, en Platanar y Paredón, la temperatura tuvo los promedios semanales más bajos (25 y 24.6 °C, respectivamente) que el resto de las parcelas. Por otro lado, la humedad relativa tuvo la mayor variación interparcelaria. No obstante, no se encontraron diferencias significativas entre sitios (p>0.05). Al promediar temperatura y humedad relativa de todos los sitios muestreados, a intervalos semanales, se evidenció dos periodos de temperaturas mayores a 25 °C. El primer periodo se presentó del 25 de mayo al 12 de octubre (2011). El segundo periodo se registró del 14 de marzo al 9 de mayo (2012). El mayor periodo prolongado de humedad relativa superior 90% se presentó de julio a enero (Figura 1).
La precipitación acumulada mensual también exhibió un patrón similar en todos los sitios sin diferencias significativas (p>0.05). Octubre tuvo la mayor precipitación acumulada mensual (452-780 mm) con un promedio regional de 2596 mm año-1. La precipitación total anual fluctuó de 1767 a 3076 mm año-1, siendo menor en Moctezuma, próximo a la costa del Golfo de México, y mayor en Platanar (Figura 1).
La incidencia de MN se correlacionó positivamente con valores moderados con periodos de temperatura menores a 19.9 °C (Rho =0.43 - 0.63) y con periodos de temperatura en el rango de 20 - 26.9 °C (Rho = 0.38 - 0.81) (Cuadro 4). Temperaturas en el rango 27 a 29.9 °C mostraron una correlación negativa (Rho= -0.53 - -0.80) (Cuadro 4). Se han demostrado dos mecanismos de germinación de esporangios de P. palmivora en función de temperatura. Germinación directa con temperaturas cercanas a 25 °C, y ruptura del esporangio, liberación y germinación de zoosporas a 15 - 20°C (Erwin y Ribeiro, 1996). P. capcisi, es posible que la humedad libre predominante en octubre, asociada al incremento de precipitación pluvial, y con temperaturas próximas a los 25 °C active la germinación directa de esporangios constituyendo el inóculo primario, mientras que temperaturas por debajo de este umbral, en condiciones de humedad puede ser responsable de la ruptura de esporangios para la producción de inóculo secundario
Cuadro 4 Coeficientes de correlación de Spearman (Rho) de la incidencia absoluta de mancha negra del cacao con intervalos de temperatura y humedad relativa, desfasados 8 d antes de la aparición de la enfermedad, en cinco parcelas comerciales de cacao en Tabasco y Norte de Chiapas. Ciclo productivo 2011-2012.
| Localidad, Estado | Correlación de Spearman (Rho) | ||||
|---|---|---|---|---|---|
| Intervalo de temperatura | Intervalo de humedad | ||||
| <19.9 °C | 20-26.9 °C | 27-29.9 °C | 60-90 % | >90 % | |
| Moctezuma, Tabasco | 0.43 | 0.81 | -0.80 | -0.45 | 0.77 |
| La Piedra, Tabasco | 0.59 | 0.38 | -0.57 | -0.40 | 0.41 |
| Poblado C-28, Tabasco | 0.41 | 0.65 | -0.67 | -0.57 | 0.57 |
| Paredón, Tabasco | 0.63 | 0.41 | -0.53 | -0.42 | 0.47 |
| Platanar, Chiapas | 0.57 | 0.45 | -0.57 | -0.45 | 0.54 |
En este trabajo, si bien la humedad relativa en general (Rho = 0.47 - 0.60) y la superior a 90% se correlacionó moderadamente con la incidencia (Rho = 0.41- 0.77) (Cuadro 3 y 4), en concordancia con otros trabajos (Akrofi 2015; Deberdt et al., 2008; Oliveira y Luz, 2005; Dakwa, 1973), este factor puede ser en realidad un estimador de humedad de saturación sobre tejidos vegetales, la cual es determinante para la función motriz de las zoosporas flageladas. En consecuencia, como era de esperarse, la precipitación acumulada mensual, y la precipitación asociada al periodo con incidencia de MN (septiembre 2011-febrero 2012) tuvo una correlación moderada con cambios absolutos de enfermedad (Rho = 0.34 - 0.76, y Rho = 0.68, respectivamente) (Cuadro 3 y 4). En África, P. megakarya causó 70.3% de incidencia MN en sitios con precipitaciones superiores a 2200 mm, y del 1.15% en aquellos con menos de 800 mm (Ndoumbe-Nkeng et al., 2009).
En todas las plantaciones, la MN tuvo su fase epidémica exponencial en octubre coincidiendo con la mayor precipitación mensual (452-780 mm) (Figura 1), y con el primer periodo de temperatura promedio superior a 25 °C. Sin embargo, la mayor duración del proceso epidémico en el Platanar, asociado con la más alta precipitación (2992 mm año-1), sugiere que la temperatura es menos restrictiva para la infección. La humedad libre, superficial sobre los tejidos, más que humedad relativa, es determinante para la infección del pseudohongo, lo cual es congruente con su fisiología reproductiva y diseminación. Esto coincide con varios trabajos que asocian la precipitación con la ocurrencia de la enfermedad (Ndoumbe-Nkeng et al., 2009; Dakwa, 1973; Medeiros, 1967).
Los efectos correlativos de incidencia MN absoluta con temperatura y humedad fueron significativos con un desfase semanal entre la inducción climática y la aparición de síntomas. Esta asociación estadística sugiere la existencia de un periodo de incubación promedio de una semana para P. capsici en cacao Trinitario para las condiciones de México. En P. megakarya, el periodo de incubación MN se estimó en seis días en árboles de cacao Amelonado (Ndoumbe-Nkeng et al., 2009; Adebayo et al., 1981).
Conclusiones
El análisis de la estructura epidémica de la mancha negra (MN) en plantaciones comerciales de cacao Trinitario con tecnología tradicional de cinco localidades del sureste de México demostró que esta enfermedad exhibió un proceso epidémico corto y de baja intensidad restringido al periodo septiembre - febrero. La Y f estuvo en el rango de 6 a 24%, con incidencia promedio de 12.4%. La mayor incidencia se presentó en Platanar, Pichucalco, Chiapas y la menor en Moctezuma, Paraíso, Tabasco. La fase exponencial epidémica ocurrió en octubre coincidiendo con la mayor intensidad de precipitación pluvial (452-780 mm), por lo que este factor podría ser determinante. Todas las epidemias se ajustaron al modelo Gompertz (r = 0.059 - 0.123, R2 0.97-0.99). El inóculo primario fue favorecido por precipitación, humedad relativa mayor al 90%, y temperaturas de 20 a 26.9 °C. Temperaturas menores a 20 °C, también contribuyeron al progreso policíclico de la enfermedad posiblemente por efecto en inóculo secundario producido por germinación indirecta de esporangios. A pesar de la disponibilidad de tejido susceptible (i.e., frutos) durante todo el proceso productivo, P. capcisi tuvo menor aptitud parasítica que M. roreri, el cual indujo epidemias más tempranas, con mayor duración e intensidad. La caracterización de MN como epidemia policíclica justifica estrategias de manejo dirigidas a la reducción del inóculo secundario para restringir la tasa epidémica. Se recomiendan estudios etiológicos para determinar el estatus actual del agente causal(es) de la MN.
Agradecimientos
Este trabajo fue financiado por el Consejo Nacional de Ciencia y Tecnología (CONACYT), proyecto CB-200801-106570. A los propietarios de las parcelas comerciales que apoyaron decididamente este trabajo. A los estudiantes Isaí Quevedo Damian y Wilbert del C. Arévalo López quienes contribuyeron con evaluaciones de campo.
REFERENCIAS
Adebayo, AA., Ward, MR., Maddison, AC. and Gregory, PH. 1981. The epidemic on sprayed cocoa at Gambari. (Pp. 145-162). In: Gregory, PH and Maddison, AC. Epidemiology of Phytophthora on cocoa in Nigeria; final report of the International Cocoa Black Pod Research Project. Commonwealth Mycological Institute, Surrey, England. 185p. [ Links ]
Akrofi, AY. 2015. Phytophthora megakarya: A review on its status as a pathogen on cacao in West Africa. African Crop Science Journal 23:67-87. https://www.ajol.info/index.php/acsj/article/view/113716 [ Links ]
Aragaki, M and Uchida, JY. 2001. Morphological distinctions between Phytophthora capsici and P. tropicalis sp. nov. Mycologia 93:137-145. [ Links ]
Bahia, R., Aguilar, C., Luz, E., Lopes, U., Machado, R. and Correa, R. 2015. Resistance to black pod disease in a segregating cacao tree population. Tropical Plant Pathology 40:13-18. https://doi.org/10.1007/s40858-014-0003-7 [ Links ]
Bowers, JH., Bailey, BA., Hebbar, PK., Sanogo, S. and Lumsden, RD. 2001. The impact of plant diseases on world chocolate production. Online. Plant Health Progress. https://doi.org/10.1094/PHP-2001-0709-01-RV. [ Links ]
Campbell CL and Madden LV. 1990. Introduction to Plant Disease Epidemiology. John Wiley and sons. New York, USA. 560 p. [ Links ]
Dakwa JT. 1973. The relationship between black pod incidence and the weather in Ghana. Ghana Journal of Agricultural Science 6:93-102. https://www.degruyter.com/database/IABO/entry/iab19742504/html [ Links ]
Deberdt P, Mfegue CV, Tondje PR, Bon MC, Ducamp M and Hurard C. 2008. Impact of environmental factors, chemical fungicide and biological control on cacao pod production dynamics and black pod disease (Phytophthora megakarya) in Cameroom. Biological Control 44:149-159. https://doi.org/10.1016/j.biocontrol.2007.10.026 [ Links ]
Decloquement J, Ramos-Sobrinho R, Elias SG, Britto DS, Puig AS, Reis A, da Silva RAF, Honorato-Júnior J, Luz EDMN, Pinho DB, Marelli JP. 2021. Phytophthora theobromicolasp. nov.: A New Species Causing Black Pod Disease on Cacao in Brazil. Frontiers in Microbiology 12:537399. https://doi.org/10.3389/fmicb.2021.537399. [ Links ]
Erwin DC and Ribeiro OK. 1996. Phytophthora diseases worldwide. The American Phytopathological Society, St. Paul, Minnesota. 592 p. [ Links ]
Hernández-Gómez E, Hernández-Morales J, Avendaño-Arrazate CH, López-Guillen G, Garrido-Ramírez ER, Romero-Nápoles J y Nava-Díaz C. 2015. Factores socieconómicos y parasitológicos que limitan la producción del cacao en Chiapas, México. Revista Mexicana de Fitopatología 33:232-246. https://www.redalyc.org/pdf/612/61242145008.pdf [ Links ]
INEGI. 2017. Anuario Estadístico y Geográfico de Tabasco 2017. Instituto Nacional de Estadística y Geografía. México. 440 p. https:// www.inegi.org.mx/contenido/productos/prod_serv/contenidos/espanol/bvinegi/productos/nueva_estruc/ anuarios_2017/702825095123.pdf. [ Links ]
Kroon L, Brouwer H, de Cock A and Govers F. 2012. The genus Phytophthora anno 2012. Phytopathology 102:348-364. https://doi.org/10.1094/PHYTO-01-11-0025. [ Links ]
Medeiros AG, Melo JW y Santana JB. 1969. Incidência e disseminação da podridão parda em cacaueiros na Bahia. In Ilhéus, CEPLAC/CEPEC. Informe Técnico. pp. 68-69. [ Links ]
Medeiros AG. 1967. Evolução da podridão-parda nos cacaueiros. In Ilhéus, EPLAC/CEPEC. Informe Técnico. pp. 39-40. [ Links ]
Marelli JP, Guest DI, Bailey BA, Evans HC, Brown JK, Junaid M, barreto RW, Lisboa DO and puig AS. 2019. Chocolate under threat from old and new cacao diseases. Phytopathology 109:1331-1343. https://doi.org/10.1094/PHYTO-12-18-0477- RVW [ Links ]
Montes-Belmont R y de los Santos L. 1989. Especies de Phytophthora aisladas de cacao en México y su distribución geográfica. [ Links ]
Ndoumbe-Nkeng M, Cilas C, Nyemb E, Nyasse S, Bieysse D, Flori A and Sache I. 2004. Impact of removing diseased pods on cocoa black pod caused by Phytophthora megakarya and on cocoa production in Cameroon. Crop Protection 23: 415-424. https://doi.org/10.1016/j.cropro.2003.09.010. [ Links ]
Ndoumbe-Nkeng M, Efombagn MIB, Nyassé S, Nyemb E, Sache I and Cilas C. 2009. Relationships between cocoa Phytophthora pod rot disease and climatic variables in Cameroon. Canadian Journal of Plant Pathology 31:309-320. https://doi.org/10.1080/07060660909507605 [ Links ]
Ndoumbe-Nkeng M, Efombagn-Mousseni IB, Bidzanga-Nomo L, Sache I and Cilas C. 2017. Spatio-temporal dynamics on a plot scale of cocoa black pod rot caused by Phytophthora megakarya in Cameroon. European Journal of Plant Pathology 147: 579-590. https://doi.org/10.1007/s10658-016-1027-2 [ Links ]
Nembot C, Soh PT, Ambang Z, ten Hoopen GM and Dumont Y. 2017. On the use of mathematical modelling to study the impact of phytosanitation on cocoa black pod disease caused by Phytophthora megakarya. InInternational Symposium on Cocoa Research (ISCR), Lima, Peru (pp. 13-17). https://agritrop.cirad.fr/588134/ [ Links ]
Oliveira ML, Luz EDMN. 2005. Identificação e manejo das principais doenças do cacaueiro no Brasil. Ilhéus, CEPLAC/ CEPEC/SEFIT. 132p. [ Links ]
Opoku IY, Appiah AA, Akrofi AY and Owusu GK. 2000. Phytophthora megakarya: a potential threat to the cocoa industry in Ghana. Ghana Journal of Agricultural Science 33:237-248. https://doi.org/10.4314/gjas.v33i2.1876 [ Links ]
Opoku IY, Akrofi AY and Appiah AA. 2007. Assessment of sanitation and fungicide application directed at cocoa tree trunks for the control of Phytophthora black pod infections in pods growing in the canopy. European Journal of Plant Pathology 117: 167-175. [ Links ]
Ortiz-García CF. 1996. Etude de la diversité génétique de popilations de Phytophthora pathogéne du cacaoyer (Theobroma cacao L.) et du cocotier (Cocos nucifera L.). Tesis Doctoral. Université Paul Sabatier-Centre de Fisiología Vegetal - CNRS. Toulouse, Francia. 85 p. [ Links ]
Puig AS, Ali S, Strem M, Sicher R, Gutierrez OA and Bailey BA. 2018. The differential influence of temperature on Phytophthora megakarya and Phytophthora palmivora pod lesion expansion, mycelia growth, gene expression, and metabolite profiles. Physiological and Molecular Plant Pathology 102:95-112. https://doi.org/10.1016/j. pmpp.2017.12.002 [ Links ]
Ristaino JB and Gumpertz ML. 2000. New frontiers in the study of dispersal and spatial analysis of epidemics caused by species in the genus Phytophthora. Annual Review of Phytopathology 38:541-576. https://doi.org/10.1146/annurev.phyto.38.1.541 [ Links ]
Sánchez-Cuevas MC, Jaramillo-Aguilar EE and Ramírez-Morales IE. 2015. Enfermedades del cacao. UTMACH. Ecuador. 152 p. [ Links ]
SAS Institute. 2004. SAS/STAT® 9.1 User’s Guide Statistics. SAS Institute Inc. Cary, North Carolina, USA. 5121 p. [ Links ]
SIAP, Servicio de Información Agroalimentaria y Pesquera. 2022. Avances de siembras y cosechas de cultivos perennes por estado en México 2018. Secretaría de Agricultura, Desarrollo Rural, Pesca y Alimentación. Ciudad de México. http://infosiap.siap.gob.mx:8080/agricola_siap_gobmx/AvanceNacionalCultivo.do (Octubre 2022). [ Links ]
Soberanis W, Ríos R, Arévalo E, Zuniga L, Cabezas O and Krauss U. 1999. Increased frequency of phytosanitary pod removal in cacao (Theobroma cacao) increases yield economically in eastern Peru. Crop Protection 18:677-685. https://doi.org/10.1016/S0261-2194(99)00073-3 [ Links ]
Tollenaar D. 1959. Phytophthora palmivora del Cacao y su Control. Instituto Interamericano de Ciencias Agrícolas. 22p. https://repositorio.iica.int/bitstream/handle/11324/16022/BVE21041908e.pdf?sequence=1&isAllowed=y [ Links ]
Torres-de-la-Cruz M, Quevedo-Damián I, Ortiz-García CF, Lagúnez-Espinoza L, Nieto-Angel D and Pérez-de la Cruz M. 2019. Control químico de Moniliophthora roreri en México. Biotecnia 21:55-61. https://doi.org/10.18633/biotecnia.v21i2.906 [ Links ]
Torres-de la Cruz M, Mora-Aguilera G, Ortiz-García CF, de la Cruz-Pérez A and Gaspar-Génico JA. 2020. Flujos productivos determinan la estructura epidémica de la moniliasis del cacao en el sureste de México. Revista Fitotecnia Mexicana 43:431-431. https://doi.org/10.35196/rfm.2020.4.431 [ Links ]
Recibido: 22 de Septiembre de 2022; Aprobado: 10 de Diciembre de 2022











 texto en
texto en 


