Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de fitopatología
versión On-line ISSN 2007-8080versión impresa ISSN 0185-3309
Rev. mex. fitopatol vol.40 no.3 Texcoco sep. 2022 Epub 14-Nov-2022
https://doi.org/10.18781/r.mex.fit.2206-1
Notas Fitopatológicas
Sensibilidad in vitro de Fusarium sacchari aislado de caña de azúcar a cinco fungicidas
1 Universidad Autónoma de Nuevo León, Facultad de Agronomía, Francisco Villa s/n Colonia Ex Hacienda El Canadá, Gral. Escobedo, Nuevo León CP 66059, México;
2 Universidad Michoacana de San Nicolás de Hidalgo, Facultad de Agrobiología ‘’Presidente Juárez’’, Paseo General Lázaro Cárdenas 2290, Colonia Emiliano Zapata, Uruapan, Michoacán, CP 60170, México;
El presente estudio tuvo como objetivo evaluar la sensibilidad in vitro de Fusarium sacchari a cinco fungicidas de diferentes grupos químicos. Un aislado de F. sacchari obtenido de plantas de caña de azúcar (Saccharum officinarum) con síntomas de marchitez e identificado morfológica y molecularmente por las características del género Fusarium y amplificación de las regiones ITS y TEF, respectivamente, se utilizó para evaluar los fungicidas azoxystrobin, difenoconazol, hymexazol, cyprodinil y tiabendazol, a concentraciones de 1, 10, 100 y 1000 µg mL-1, empleando la técnica de la placa envenenada. El efecto de los fungicidas y las EC50 se determinaron por el porcentaje de inhibición del crecimiento de F. sacchari respecto a su crecimiento en las placas sin fungicida. Los fungicidas difenoconazol a 1000 µg mL-1 y tiabendazol a 100, 1000 y 10 µg mL-1 fueron estadísticamente iguales y presentaron los mayores porcentajes de inhibición del crecimiento micelial (93.5% y 92.1, 91.4 y 89.8%, respectivamente). Los valores EC50 más bajos los presentaron difenoconazol (9.2 µg mL-1), tiabendazol (9.9 µg mL-1) y cyprodinil (10.6 µg mL-1). En conclusión, F. sacchari presentó mayor sensibilidad in vitro a los fungicidas difenoconazol (1000 µg mL-1) y tiabendazol (100, 1000 y 10 µg mL-1).
Palabras clave: Pokkah boeng; caña de azúcar; inhibición; EC50
The present study had the objective of evaluating the in vitro sensitivity of Fusarium sacchari to five fungicides of different chemical groups. An isolate of F. sacchari obtained from sugarcane plants (Saccharum officinarum) with wilt symptoms and identified morphologically and molecularly by the characteristics of the genus Fusarium and amplification of the ITS and TEF regions, respectively, was used to evaluate the fungicides azoxystrobin, difenoconazole, hymexazole, cyprodinil and thiabendazole, at concentrations of 1, 10, 100 and 1000 µg mL-1, using the poison plate technique. The effect of the fungicides and EC50 was determined by the percentage inhibition of F. sacchari growth with respect to the growth on the plates without fungicide. The fungicides difenoconazole at 1000 µg mL-1 and thiabendazole at 100, 1000 and 10 µg mL-1 were statistically equal and presented the highest mycelial growth inhibition percentages (93.5 and 92.1, 91.4 and 89.8 %, respectively). The lowest EC50 values were presented by difenoconazole (9.2 µg mL-1), thiabendazole (9.9 µg mL-1) and cyprodinil (10.6 µg mL-1). In conclusion, F. sacchari presented higher in vitro sensitivity to the fungicides difenoconazole (1000 µg mL-1) and thiabendazole (100, 1000 and 10 µg mL-1).
Keywords: Pokkah boeng; sugarcane; inhibition; EC50
La caña de azúcar (Saccharum officinarum) es uno de los principales cultivos industriales en México con una producción nacional de 5.7 millones de toneladas de azúcar. Los campos cañeros se encuentran distribuidos en siete regiones estratégicas; San Luis Potosí pertenece a la región Noroeste que cuenta con una producción de 1,156,265 t (CONADESUCA, 2021). En 2021, en el municipio de Tamasopo perteneciente a la Huasteca Potosina, se produjeron 653,028 t (SIAP, 2022).
La marchitez de la caña de azúcar o pokkah boeng (PB) es una enfermedad grave que afecta el tallo, los síntomas iniciales se observan en hojas jóvenes que desarrollan zonas cloróticas en la base (Vishwakarma et al., 2013). Si la infección queda limitada a las hojas la planta se recupera lentamente, en etapa avanzada y grave la enfermedad penetra el tallo a través de un punto de crecimiento causando pudrición superior, las hojas jóvenes mueren y se desarrollan en el tejido áreas necróticas asimétricas rojizas (Jeyakumar y Zhang, 2020). Esta enfermedad produce pérdidas de 45.2 a 51.2% en la producción del cultivo y de 42.8 a 59.2% en el contenido de jugo de los tallos (Kumar et al., 2015). La calidad del jugo se reduce (Viswanathan, 2020).
Varias especies del género Fusarium como F. sacchari, F. verticillioides y F. proliferatum (Lin et al., 2014; Zhang y Jeyakumar, 2018) han sido identificadas como el agente causal de la enfermedad de PB (Viswanathan, 2020). Estas pueden crecer en una gran variedad de sustratos y tienen un eficiente mecanismo de diseminación que les permite distribuirse globalmente. Fusarium sacchari es el principal agente causante de PB en la India (Viswanathan et al., 2017), de acuerdo con estudios de patogenicidad una vez que ingresa al hospedante causa daños severos al cultivo, su mecanismo de entrada al mismo no se ha estudiado en detalle (Viswanathan, 2020).
Las raíces de las plantas de caña de azúcar se infectan en las primeras etapas de crecimiento del cultivo; sin embargo, se desconoce la forma de avance de F. sacchari desde las raíces hasta el tallo, probablemente los factores ambientales y de suelo juegan un papel vital en el desarrollo de la enfermedad en los tallos y la severidad con que se presenta (Viswanathan, 2020). Las especies del género Fusarium inactivan sustancias tóxicas de defensa producidas por el hospedante, producen toxinas propias que aumentan su virulencia como eniatinas y ácido fusárico (Agrios, 2005). En este trabajo se evaluó la sensibilidad in vitro de Fusarium sacchari aislado de caña de azúcar con síntomas de PB, a cinco fungicidas de diferentes grupos químicos y se determinó la concentración media efectiva (EC50) para cada uno de los fungicidas.
En febrero y abril de 2019 con base en un muestreo en zigzag se colectaron plantas de caña de azúcar de 1 m de altura en etapa de maduración con síntomas de marchitez en nueve campos cañeros (cuatro plantas por campo) de Tamasopo (22° 09’ 41.0” N 99° 19’ 30.4” S) en la Huasteca Potosina. Las 36 muestras obtenidas fueron trasladas en bolsas de papel al Laboratorio de Biotecnología de la Facultad de Agronomía de la Universidad Autónoma de Nuevo León para su análisis. Fragmentos de tejido con síntomas de necrosis fueron desinfectados con NaClO al 2% por tres minutos, enjuagados tres veces con agua destilada estéril y secados en papel absorbente estéril. El tejido fue sembrado en cajas Petri con medio de cultivo papa dextrosa agar (PDA-Difco®) que fueron incubadas a 25 ± 1 °C en oscuridad por siete días. Dos aislados representativos (HP1 y HP2) fueron seleccionados y transferidos a medio de cultivo PDA e incubados a 25 ± 1 °C en oscuridad hasta la formación de esporas. Suspensiones de conidios a concentración de 1 x 103 fueron preparadas con agua destilada estéril para su siembra por estriado en cajas Petri con medio de cultivo PDA, y a partir de los conidios germinados los aislados se purificaron con la técnica de cultivo monospórico.
La caracterización morfológica de los aislados monospóricos de HP1 y HP2 se realizó por el color y pigmentación de las colonias, así como las características de los conidios, fiálides e hifas en montajes temporales en lactofenol observados a 40 y 100X en microscopio compuesto, de acuerdo con las características del género Fusarium (Leslie y Summerell, 2006).
La patogenicidad de los aislados se determinó mediante la inoculación de una suspensión de conidios 1×106 mL-1 en tallos de plantas de caña de azúcar de las variedades My 55-14 y Mex 79-431 en etapa de cosecha, del tejido necrosado de los tallos inoculados se re-aisló el fitopatógeno en medio de cultivo PDA. Para la identificación molecular de ambos aislados se extrajo ADN de acuerdo con el protocolo de Cenis (1992) y se amplificaron y secuenciaron las regiones ITS (internal transcriber spacer) (White et al., 1990) y TEF (translation elongation factor) (O’Donnell et al., 1998; Carbone y Kohn, 1999) para su comparación con secuencias del GenBank y posterior depósito en el mismo.
El aislado monospórico de HP1 se utilizó para determinar la sensibilidad de F. sacchari a cinco fungicidas de diferentes grupos químicos. Concentraciones de 1, 10, 100 y 1000 µg mL-1 de i.a. fueron evaluadas empleando la técnica de placa envenenada (Dahal y Shrestha, 2018) bajo un diseño experimental completamente al azar con cinco repeticiones. Como testigo se utilizaron cinco cajas Petri con medio de cultivo PDA sin fungicida (0 µg mL-1). Los fungicidas evaluados y grupo químico al que pertenecen fueron: azoxystrobin (estrobilurina, Bankit®, Syngenta), difenoconazol (tiazoles, Score®, Syngenta), hymexazol (isoxazoles, Tachigaren®, Summit Agro), cyprodinil (anilino-pirimidinas, Switch®, Syngenta) y tiabendazol (benzimidazoles, Tecto 60®).
Discos de micelio de 7 mm de diámetro del aislado HP1 se sembraron en las cajas Petri con los medios de cultivo modificados y el testigo para su incubación en oscuridad por siete días a 25 ± 1 °C, en este tiempo el tratamiento testigo llenó la placa. El crecimiento micelial fue medido en dos direcciones perpendiculares a partir del centro de la colonia empleando un calibrador digital de precisión 0.01 mm (Truper®). Se determinó el porcentaje de inhibición del crecimiento radial (Dahal y Shrestha, 2018) y se realizó el análisis de varianza de dos vías de los resultados utilizando el modelo lineal aplicando como variable dependiente los valores linealizados del porcentaje de inhibición, la comparación de medias se realizó por el método Tukey (α=0.05). Para cada fungicida se determinó la EC50 por regresión lineal del logaritmo de la concentración de fungicida y el valor Probit de inhibición de crecimiento (Finney, 1952). Los análisis se realizaron con el programa estadístico R versión 4.0.1 (R Core Team, 2020).
Las características morfológicas de las colonias, conidios y conidióforos de los aislados MHP1 y MHP2 correspondieron a F. sacchari de acuerdo con Leslie y Summerell (2006); la colonia presentó micelio abundante, elevado, blanco pálido, que tornó a violeta a los 14 días de la siembra. Se observaron macroconidios alargados con célula apical curvada y célula basal poco desarrollada con tres septos, así como microconidios abundantes en falsas cabezas en monofiálides o polifiálides, ovoides de una célula. Las secuencias obtenidas en GenBank ON924470 y ON924471 (ITS) presentaron una similitud del 100% con el número de acceso MT882327.1 de F. sacchari mientras que la secuencia ON932086 (TEF) mostró similitud del 99% con el número de acceso MT010988.1 de F. sacchari.
F. sacchari exhibió diferencias significativas a todos los fungicidas y concentraciones evaluados (Figura 1). El análisis de varianza mostró diferencias altamente significativas (p≤0.01) entre los fungicidas y concentraciones. La comparación múltiple de medias del porcentaje de inhibición de crecimiento formó 12 grupos (Cuadro 1). El mayor porcentaje de inhibición se obtuvo con difenoconazol 1000 µg mL-1 (93.5%) y tiabendazol 100 µg mL-1 (92.1%), 1000 µg mL-1 (91.4%) y 10 µg mL-1 (89.8%). El resto de los tratamientos presentaron porcentajes de inhibición de 75.8 a 0%. Diversos estudios de control in vitro de especies de Fusarium reportan efectos significativos de inhibición de crecimiento con estos fungicidas. Alburqueque y Gusqui (2018) obtuvieron un 100% de inhibición en F. oxysporum aislado de jitomate (Solanum lycopersicum) tratado con azoxystrobin, carbendazim, fosfito de cobre y tiabendazol, de manera similar Dahal y Shrestha (2018) reportan un 100% de inhibición en F. oxysporum tratado con carbendazim a 150 y 200 ppm; mientras que Madhavi y Bhattiprolu (2011) obtuvieron con los fungicidas carbendazim y benomil un 92 y 91% de inhibición en F. solani aislado de chile (Capsicum annuum), respectivamente.
De acuerdo con los resultados de la presente investigación, se observó que los fungicidas con código G1 (difenoconazol) cuyo modo de acción es de inhibición en la biosíntesis de esteroles con punto de acción en la inhibición de la desmetilación (FRAC, 2020), y código B1 (tiabendazol) cuyo modo de acción es de inhibición de proteínas motoras y del citoesqueleto con punto de acción en el ensamblaje de las β-tubulinas en la mitosis (FRAC, 2020), fueron los que inhibieron en mayor porcentaje el crecimiento micelial de F. sacchari.
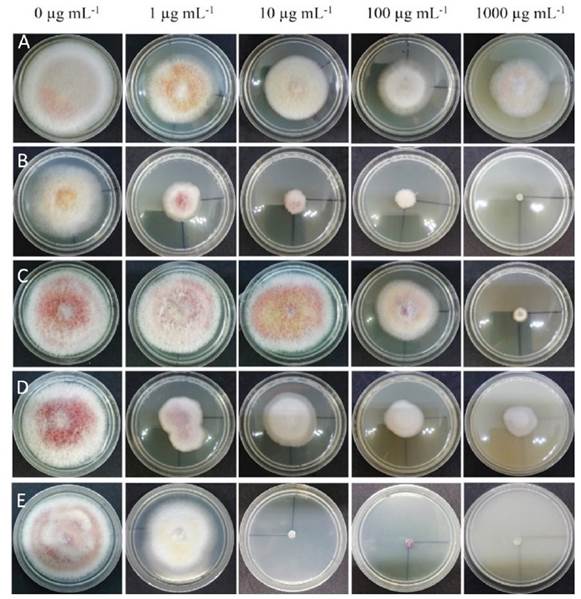
Figura 1 Crecimiento de Fusarium sacchari a los siete días de exposición a concentraciones de 0, 1, 10, 100 y 1000 µg mL-1 de azoxystrobin A), difenoconazol B), hymexazol C), cyprodinil D) y tiabendazol E).
Cuadro 1 Comparación de medias Tukey (0.05) del porcentaje de inhibición del crecimiento micelial de F. sacchari por efecto de cinco fungicidas a cuatro concentraciones.
| Tratamiento | Inhibición (%) | Tratamiento | Inhibición (%) |
|---|---|---|---|
| Difenoconazol 1000 µg mL-1 | 93.5 Az | Cyprodinil 1 µg mL-1 | 47.3 E |
| Tiabendazol 100 µg mL-1 | 92.1 A | Azoxystrobin 100 µg mL-1 | 31.1 F |
| Tiabendazol 1000 µg mL-1 | 91.4 A | Hymexazol 100 µg mL-1 | 28.3 FG |
| Tiabendazol 10 µg mL-1 | 89.8 A | Cyprodinil 10 µg mL-1 | 27.4 FG |
| Hymexazol 1000 µg mL-1 | 75.8 B | Azoxystrobin 1000 µg mL-1 | 26.0 FG |
| Difenoconazol 100 µg mL-1 | 75.1 B | Azoxystrobin 10 µg mL-1 | 18.7 GH |
| Difenoconazol 10 µg mL-1 | 74.7 B | Azoxystrobin 1 µg mL-1 | 13.7 H |
| Cyprodinil 1000 µg mL-1 | 61.8 C | Tiabendazol 1 µg mL-1 | 8.0 HI |
| Cyprodinil 100 µg mL-1 | 60.1 CD | Hymexazol 1 µg mL-1 | 0.3 I |
| Difenoconazol 1 µg mL-1 | 49.3 DE | Hymexazol 10 µg mL-1 | 0.0 I |
ZPorcentajes con la misma letra son estadísticamente iguales, p≤0.01.
Respecto a la EC50 los valores bajos correspondieron a difenoconazol con 1.5 µg mL-1 (error estándar 2.1) y tiabendazol con 7.2 µg mL-1 (error estándar 1.3). Cyprodinil presentó un valor de 36.7 µg mL-1 (error estándar 2.2) e hymexazol un valor de 371.0 µg mL-1 (error estándar 1.3), mientras que el valor más alto fue para azoxystrobin 18420 µg mL-1 (error estándar 5.2). F. sacchari presentó crecimiento en todas las concentraciones evaluadas con azoxystrobin; resultados similares han sido obtenidos por Gutierrez et al. (2006) en donde no presentaron diferencias significativas en el porcentaje de inhibición, así como baja sensibilidad de aislados de Fusarium spp. obtenidos de frutos de jitomate hacia dosis de azoxystrobin (3.3, 9.9 y 27.7 µL L-1 de Quadris, Syngenta).
El tipo de cultivo y enfermedad ocasionada por el fitopatógeno contra el cual se aplica un fungicida tiene efecto sobre su capacidad para realizar la inhibición en el crecimiento. Avonazi et al. (2014) obtuvieron un EC50 promedio de 0.2 mg L-1 en su ensayo con F. graminearum aislado de trigo (Triticum aestivum) expuesto a azoxystrobin, siendo este el fungicida con mayor eficacia en la inhibición de la germinación de esporas. En esta investigación el hymexazol cuyo modo de acción (A3) tiene implicación en el metabolismo de ácidos nucleicos afectando la síntesis de ADN/ARN y el cyprodinil cuyo modo de acción (D1) afecta la síntesis de aminoácidos y proteínas al inhibir la biosíntesis de metionina (FRAC, 2020), presentaron bajos porcentajes de inhibición del crecimiento micelial de F. sacchari en todas las concentraciones evaluadas, teniendo valores de eficacia menores a 76%.
El tiabendazol presentó un rango de inhibición de 7.9 a 91.4% y una EC50 de 7.2 µg mL-1, estos resultados demuestran el efecto antifúngico del tiabendazol derivado de su efecto directo sobre la mitosis, lo que impide el desarrollo del micelio (Melgarejo y Abella, 2011). Tiabendazol inhibió el crecimiento micelial de F. sacchari a partir de la concentración 10 µg mL-1, este resultado coincide con lo reportado por Kawchuk et al. (1994) en donde en su estudio in vitro de aislados de Fusarium spp. obtenidos de tubérculos de papa con síntomas de pudrición seca, el crecimiento micelial fue inhibido con una EC50 de 10 mg L-1; por su parte Gachango et al. (2012) obtuvieron una EC50 de 3.7 mg L-1 con aislados de Fusarium spp. obtenidos también de tubérculos de papa con pudrición seca. Con difenoconazol se obtuvo un rango de inhibición de 49.3 a 93.5% con una EC50 de 1.5 µg mL-1, estos resultados coinciden con los reportados por Gachango et al. (2012) quienes obtuvieron una inhibición micelial del 50% con una EC50 de 1.8 mg L-1. Anderson et al. (2020) en el estudio de sensibilidad de F. graminearum aislado de trigo (Triticum aestivum) a fungicidas del grupo de triazoles, obtuvieron una EC50 inferior a 2 µg mL-1 tanto para tebuconazol como metoconazol, lo cual confirma que los fungicidas del grupo químico de triazoles son eficaces en la disminución del crecimiento del micelio en especies de Fusarium.
Los resultados obtenidos en esta investigación coinciden con trabajos previos en donde se demuestra que fungicidas de diversos grupos químicos como carbendazim (benzimidazoles, B1), metil tiofanato (tiofanatos, B1), oxicloruro de cobre (inorgánicos, M01) y mancozeb (ditio carbamatos, M03) ejercen control para combatir la enfermedad de PB (Vishwakarma et al., 2013; Jeyakumar y Zhang, 2020; TNAU, 2020), teniendo los dos primeros fungicidas modo de acción similar a tiabendazol en la inhibición de proteínas motoras y del citoesqueleto y los dos restantes productos químicos con actividad multisitio (FRAC, 2020).
F. sacchari ha sido reportada como agente causal de la enfermedad PB en diferentes partes de mundo (Lin et al., 2014;Viswanathan et al., 2017; Bao et al. 2020; Paul et al. 2022), en esta investigación se aisló de plantas de caña de azúcar de campos cañeros de la Huasteca Potosina; a pesar de que la enfermedad de PB todavía no presenta impactos económicos en esta región, resulta ser una amenaza fitosanitaria, es por ello recomendable para futuros ensayos incluir aislados del patógeno de diferentes campos de producción.
Cited literature
Agrios GN. 2005. Fitopatología. Segunda edición. Limusa. México. 952p. [ Links ]
Alburqueque AD y Guisqui MR. 2018. Eficiencia de fungicidas químicos para el control in vitro de diferentes fitopatógenos en condiciones controladas. Arnaldoa 25:489-498. http://doi.org/10.22497/arnaldoa.252.25209 [ Links ]
Anderson NR, Freije AN, Bergstrom GC, Bradley CA, Cowger C, Faske T, Hollier C, Kleczewski N, Padgett GB, Paul P, Price T and Wise KA. 2020. Sensitivity of Fusarium graminearum to metconazole and tebuconazole fungicides before and after widespread use in wheat in the United States. Plant Health Progress 21:85-90. http://dx.doi.org/10.10 94/PHP-11-19-0083-RS [ Links ]
Avonazi A, Tonin RB, Reis EM, Camera J and Ranzi C. 2014. In vitro sensitivity of Fusarium graminearum isolates to fungicides. Summa Phytopathologica 40:231-247. http://dx.doi.org/10.1590/0100-5405/1891 [ Links ]
Bao Y, Xu Y, Wang S, Yao Z and Rao GP. 2020. First report of Fusarium sacchari that causes sugarcane wilt disease in China. Plant Disease 104:2289-2289. https://doi.org/10.1094/PDIS-02-20-0229-PDN [ Links ]
Carbone I and Kohn LM. 1999. A method for designing primer sets for speciation studies in filamentous ascomycetes. Mycologia. 91:553-556. [ Links ]
Cenis JL. 1992. Rapid extraction of fungal DNA for PCR amplification. Nucleic Acids Research 20: 2380. [ Links ]
CONADESUCA. Comité Nacional para el Desarrollo Sustentable de la Caña de Azúcar. 2021. 8to Informe Estadístico del Sector Agroindustrial de la Caña de Azúcar en México zafras 2011-2012/2020-2021. http://conadesuca.gob.mx/documentosexternos/8vo_Informe_estadistico.pdf (consulta, julio 2022). [ Links ]
Dahal N and Shrestha RK. 2018. Evaluation of efficacy of fungicides against Fusarium oxysporum f. sp. Lentis in vitro at Lamjung, Nepal. Journal of the Institute of Agriculture and Animal Science 25:105-112. http://dx.doi.org/10.3126/jiaas.v35i1.22520 [ Links ]
Finney DJ. 1952. Probit Analysis. Second Edition. Cambridge University Press. New York, USA. 318p. [ Links ]
FRAC. Fungicide Resistance Action Committee. 2020. https://www.frac.info/docs/default-source/publications/frac-mode-of-action-poster/frac-moa-poster-2020v2.pdf?sfvrsn=a48499a_2 (consulta, agosto 2021). [ Links ]
Gachango E, Hanson LE, Rojas A, Hao JJ and Kirk WW. 2012. Fusarium spp. causing dry rot of seed potato tubers in Michigan and their sensitivity to fungicides. Plant Disease 96:1767-1774. https://doi.org/10.1094/PDIS-11-11-0932-RE [ Links ]
Gutierrez CLJ, Wang Y, Lutton E and McSpadden GBB. 2006. Distribution and fungicide sensitivity of fungal pathogens causing anthracnose-like lesions on tomatoes grown in Ohio. Plant Disease 90:397-403. http://dx.doi.org/10.1094/PD-90-0397 [ Links ]
Jeyakumar JMJ and Zhang M. 2020. Symptoms and their assessment of sugarcane pokkah boeng. International Journal of Environmental and Agriculture Research 6(12):50-54. [ Links ]
Kawchuk LM, Holley JD, Lynch DR and Clear RM. 1994. Resistance to thiabendazole and thiophanate-methyl in Canadian isolates of Fusarium sambucinum and Helminthosporium solani. American Potato Journal 71:185-192. [ Links ]
Kumar S, Chand G, Mandal D, Kumar A and Kumar S. 2015. Deterioration in sugarcane due to wilt disease. Ecology, Environment and Conservation Journal 21:AS145-AS148. [ Links ]
Leslie, JF and Summerell, BA. 2006. The Fusarium laboratory manual. First Edition. Blackwell Publishing. Iowa, USA. 388p. [ Links ]
Lin Z, Xu S, Que Y, Wang J, Comstock JC, Wei J, McCord PH, Chen B, Chen R and Zhang M. 2014. Species-specific detection and identification of Fusarium species complex, the causal agent of sugarcane pokkah boeng in China. PLoS One 9:e104195. [ Links ]
Madhavi GB and Bhattiprolu SL. 2011. Evaluation of fungicides, soil amendment practices and bioagents against Fusarium solani-causal agent of wilt disease in chilli. Journal of Horticultural Sciences 6:141-144. https://jhs.iihr.res.in/index.php/jhs/article/view/423 [ Links ]
Melgarejo GJ y Abella PF. 2011. Fungicidas: mecanismos de acción de los fungicidas. Revista Ventana al Campo Andino. (15):193-202. http://hdl.handle.net/20.500.12324/19031 [ Links ]
O’Donnell K, Kistler H, Cigelnik E and Ploetz R. 1998. Multiple evolutionary origins of the fungus causing Panama disease of banana: concordant evidence from nuclear and mitochondrial gene genealogies. Proceedings of the National Academy of Sciences 95:2044-2049. https://doi.org/10.1073/pnas.95.5.2044 [ Links ]
Paul SK, Mahmud NU, Gupta DR, Alam MN, Chakraborty M and Islam MT. 2022. First report of Fusarium sacchari causing sugarcane wilt in Bangladesch. Plant Disease 106:319-319. https://doi.org/10.1094/PDIS-04-21-0681-PDN [ Links ]
R Core Team. 2020. R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. https://www.R-project.org [ Links ]
SIAP. Servicio de Información Agroalimentaria y Pesquera. 2022. Anuario estadístico de la producción agrícola 2021. https://nube.siap.gob.mx/cierreagricola/ (consulta, julio 2022). [ Links ]
TNAU. Tamil Nadu Agricultural University. 2020. Agritech Portal. Sugarcane. https://agritech.tnau.ac.in/crop_protection/sugarcane_diseases/sugarcane_d4.html (consulta, agosto 2020). [ Links ]
Vishwakarma SK, Kumar P, Nigam A, Singh A and Kumar A. 2013. Pokkah boeng: an emerging disease of sugarcane. Journal of Plant Pathology and Microbiology 4:1-5. http://dx.doi.org/10.4172/2157-7471.1000170 [ Links ]
Viswanathan R, Balaji CG, Selvakumar R, Malathi P, Ramesh Sundar SA, Naveen Prasanth C, Chabra ML and Parameswari B. 2017. Epidemiology of Fusarium diseases in sugarcane: a new discovery of same Fusarium sacchari causing two distinct diseases, wilt and pokkah boeng. Sugar Tech 19:638-646. https://link.springer.com/article/10.1007/s12355-017-0552-4 [ Links ]
Viswanathan R. 2020. Fusarium diseases affecting sugarcane production in India. Indian Phytopathology 73:415-424. https://doi.org/10.1007/s42360-020-00241-y [ Links ]
White TJ, Bruns TD, Lee SB and Taylor JW. 1990. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. Pp: 315-322. In: Innis MA, Gelfand DH, Sninsky JJ and White TJ (eds.) PCR protocols. A guide to methods and applications. Academic Press. New York, USA. 482p. https://doi.org/10.1016/B978-0-12-372180-8.50042-1 [ Links ]
Zhang M and Jeyakumar JMJ. 2018. Fusarium species complex causing pokkah boeng in China. Fusarium: plant diseases, pathogen diversity, genetic diversity, resistance and molecular markers 139-154. https://doi.org/10.5772/intechopen.73133. [ Links ]
Recibido: 02 de Junio de 2022; Aprobado: 22 de Julio de 2022











 texto en
texto en 


