Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de fitopatología
versión On-line ISSN 2007-8080versión impresa ISSN 0185-3309
Rev. mex. fitopatol vol.40 no.2 Texcoco may. 2022 Epub 03-Oct-2022
https://doi.org/10.18781/r.mex.fit.2203-5
Reportes fitopatológicos
Primer reporte de Clonostachys rosea asociado a la pudrición del fruto de aguacate en Puebla, México
1Centro de Agroecología, Instituto de Ciencias, Benemérita Universidad Autónoma de Puebla, San Pedro Zacachimalpa, 72960, Puebla, México;
2 CONACyT-Centro Regional de Investigación en Salud Pública (CRISP), 4a. Av. Nte. esquina 19, Norte, Centro, CP 30700 Tapachula, Chiapas, México;
3 Centro de Investigación y de Estudios Avanzados del IPN, Unidad Irapuato, Km 9.6 Carretera Irapuato-León, CP 36824, Irapuato, Guanajuato, México;
4Centro de Investigaciones en Ciencias Microbiológicas, Instituto de Ciencias, Benemérita Universidad Autónoma de Puebla, Ciudad Universitaria. C.P. 72570, Puebla, México;
4 CONACYT-Centro Universitario de Vinculación y Transferencia de Tecnología, México;
La sierra norte de Puebla se considera una nueva zona potencial para el cultivo del aguacate Hass. Debido a este motivo, la emergencia de nuevos fitopatógenos aliados a esta zona geográfica queda latente. El objetivo de esta investigación fue aislar los microorganismos asociados a la pudrición del fruto del aguacate reportado recientemente por los productores de esta localidad en el año 2021. La morfología fúngica ligada a la pudrición del aguacate se aisló bajo experimentos en cámara de humedad y se denominó C08-9. El agente fúngico presentó micelio blanco con rápido crecimiento radial (6.5 mm día-1) en agar dextrosa y papa y viró el medio de cultivo a color amarillo a los 7 días. Este presentó conidióforos penicilados adheridos a hifas hialinas organizadas en verticilos con tres o cuatro fiálides, mientras que los conidios primarios mostraron forma ovalada o sub-ovalada. Las dimensiones promedio de los conidios fue de 10.57 µm × 4.42 µm y también se registró la presencia de clamidosporas. La identificación molecular del hongo se logró mediante la amplificación de las secuencias parciales del gen ribosomal 18S (ITS; 543 pb) y del gen del factor de elongación 1 alfa (TEF-1α; 658 pb). Las secuencias correspondientes se depositaron en el banco de genes del NCBI con las accesiones OM473286 y OM715999, respectivamente.
Palabras clave: Persea americana cv. Hass; pudrición blanda; hongo fitopatógeno; sierra nororiental
The northern highlands of Puebla are considered a new potential area for the cultivation of Hass avocado. Then, the emergence of new phytopathogens related to this geographical area is latent. The aim of this investigation was to isolate the microorganisms linked to the avocado fruit rot recently recorded by the producers of this locality in 2021. The fungus associated with the avocado fruit rot was isolated under humidity chamber conditions and it was named as C08-9. The fungal agent presented white cotton mycelium with fast radial growth (6.5 mm day-1) in potato dextrose agar and it turned the culture medium to yellow color after seven days. The fungus contained penicillate conidiophores adhered to hyaline hyphae organized in whorls with three or four phialides whereas primary conidia showed oval to sub-oval shape. The average size of the conidia was 10.57 µm × 4.42 µm and the presence of chlamydospores was also recorded. The molecular identification of the fungus was achieved by amplifying the partial nucleotide sequences of the 18S ribosomal gene (ITS; 543 bp) and the translation elongation factor 1 alpha gene (TEF-1α; 658 bp). The corresponding sequences were deposited at the NCBI-gene bank with the accessions OM473286 and OM715999, respectively.
Key words: Persea americana cv. Hass; soft rot; phytopathogenic fungus; northern highlands
México es el principal exportador de aguacate Hass (Persea americana) en el mundo. El fruto es una fuente importante de vitaminas, fibra, fenoles y minerales que benefician la salud humana (Rosero et al., 2019). Los nutrientes más valiosos del aguacate son los ácidos grasos insaturados acumulados en la pulpa del fruto (Rosero et al., 2019). Al igual que otros frutos, los aguacates son una fuente de proteína, fibra y azúcares reductores que son aprovechados por fitopatógenos oportunistas. Como consecuencia del ataque de patógenos, la calidad de la fruta disminuye significativamente provocando graves pérdidas económicas para los productores.
Las enfermedades fúngicas poscosecha son una de las principales amenazas para el mercado del aguacate. Los géneros Colletotrichum, Lasiodiplodia, Sphaceloma, Pseudocercospora, Rhizopus y Fusarium se asocian comúnmente con el desarrollo de enfermedades poscosecha en aguacate (Perera et al., 2020). Sin embargo, el espectro potencial de agentes fitopatógenos del aguacate puede variar según la región geográfica y las fluctuaciones climáticas. Puebla es el sexto productor de aguacate en México y la sierra norte de este estado se cataloga como una nueva zona para la producción de este valioso fruto. Al ser una zona nueva, la aparición de especies desconocidas con potencial infectivo es latente. En 2021, los productores de aguacate de la sierra norte de Puebla-México reportaron una pudrición agresiva en el fruto que causó daños severos en la producción de aguacate y pérdidas económicas sustanciales. Para abordar el problema, esta investigación se centró en la identificación y aislamiento del fitopatógeno asociado a esta enfermedad.
En condiciones de campo abierto, los síntomas de los frutos enfermos fueron pérdida de turgencia, cambios en el tamaño del fruto, eventual emergencia de micelio y oxidación de la pulpa (Figura 1A). La incidencia de frutos enfermos fue del 56.9% en muestras con diferente estado de maduración. Para investigación subsecuente, se cosecharon 50 frutos enfermos (n=50) de 30 plantas cultivadas en 10 parcelas diferentes durante abril de 2021 en Yaonáhuac, Puebla, México (19° 56′ 55″ N, 97° 26′ 26″ O; 1997 msnm). Estas muestras se trasladaron al laboratorio en bolsas plásticas a 4 °C para ser sanitizadas inmediatamente por inmersión en hipoclorito de sodio al 20% durante 20 min y se enjuagaron varias veces con agua destilada estéril en campana de flujo laminar (Pérez et al., 2021). Posteriormente, los frutos fueron secados y colocados en cámaras de humedad estériles (n=30) durante 10 días a 28 °C y 70% de humedad relativa con el fin de identificar los microorganismos asociados a la pudrición del aguacate (Pérez et al., 2021).
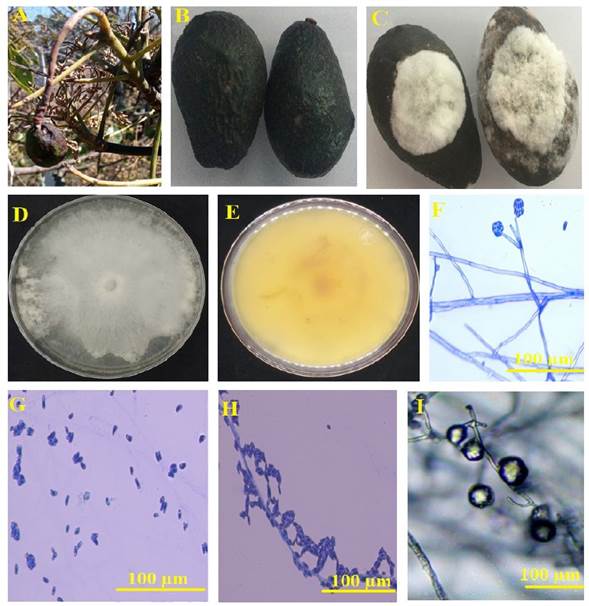
Figura 1 Características macroscópicas y microscópicas de la cepa C08-9 de C. rosea aislada en la sierra norte de Puebla, México. A, Frutos enfermos recolectados en condiciones de campo abierto. B, Aguacates asintomáticos tratados con solución salina pura 21 días después de la inoculación. C, Aguacates enfermos tratados con 1000 conidios disueltos en solución salina después de 21 días de la inoculación. D, Micelio hialino de C. rosea cepa C08-9 en cultivos de PDA de 5 días de edad. E, Cambios en la coloración del medio PDA provocados por la cepa C08-9 de C. rosea. F, Conidióforos penicilados organizados en verticilos adheridos a hifas hialinas que contienen tres o cuatro fiálidas. G-H, conidias primarias que muestran forma ovalada o sub-ovalada. I, Clamidosporas unidas a hifas hialinas.
Durante estos experimentos se observaron, aislaron y mantuvieron cinco morfologías fúngicas diferentes en agar papa dextrosa (PDA; BioxonTM). Las pruebas preliminares de patogenicidad se realizaron mediante la inserción de discos hifales (5 mm de diámetro) de cada hongo en aguacates sanos (recolectados en la zona de estudio) para su posterior incubación en una cámara de humedad durante 21 días. Como resultado, una morfología (designada como aislado C08-9) produjo signos de infección en el sexto día posterior a la inoculación, mientras que los otros hongos no produjeron ningún síntoma después de 21 días. Se realizaron pruebas formales de patogenicidad en aguacates Hass asintomáticos (n=20) utilizando aproximadamente 1000 conidias obtenidas de un cultivo monospórico del aislado C08-9 (10 µL de una solución salina estéril con 1 × 105 conidias mL-1). Las conidias fueron inoculadas por penetración mecánica en el pericarpio de aguacates asintomáticos desinfectados utilizando una jeringa Hamilton (n=20) en condiciones de cámara de humedad. El grupo de control (n=20) solo fue tratado con un volumen equivalente de solución salina. El microorganismo asociado a la pudrición del fruto del aguacate fue re-aislado y sometido a pruebas moleculares junto con el cultivo monospórico originalmente usado. Los análisis moleculares se realizaron con ADN genómico extraído como lo reporta previamente Pérez et al. (2021). La identidad molecular del hongo asociado se obtuvo secuenciando el espaciador transcrito interno (ITS) del gen ribosomal 18S utilizando los cebadores ITS1 (TCCGTAGGTGAACCTGCGG) e ITS4 (TCCTCCGCTTATTGATATGC) y las condiciones de PCR reportadas previamente por Duque-Bautista et al. (2017). La identidad se confirmó amplificando el gen del factor de elongación de traducción 1 alfa (TEF-1α) utilizando los cebadores EF-1H (ATGGGTAAGGAAGACAAGAC) y EF-2T (GGAAGTACCAGTGATCATGTT) (Molnár et al., 2015) utilizando las mismas condiciones de PCR descritas por Duque-Bautista et al. (2017). Los productos de PCR correspondientes se purificaron con el GenElute™ PCR Clean-Up Kit de Sigma-Aldrich Co. (St. Louis Mo. EE. UU.) y se secuenciaron en Macrogen Inc. (Seúl, Corea del Sur). Las secuencias correspondientes se almacenaron en la base de datos de nucleótidos del Centro Nacional de Información Biotecnológica (NCBI). La caracterización morfológica se realizó con un cultivo monospórico crecido en PDA por 7 días el cual fue expuesto a la luz solar por 3 h seguido de incubación a 4 °C por 4 h durante un período de 10 días con el fin de estresarlo. Los microcultivos preparados con el mismo medio se sometieron al mismo proceso de estrés. Después de 10 días, los cultivos y microcultivos se sometieron a análisis microscópico usando un aparato Primo Star Carl Zeiss Primo Star. El tamaño de las conidias se calculó utilizando el software Carl Zeiss™ AxioVision Rel. 4.8.2. La construcción del árbol filogenético se realizó utilizando secuencias con alta homología a la de C. rosea que se obtuvieron de la base de datos de nucleótidos del NCBI. Las secuencias de ambos marcadores moleculares (ITS y TEF-1α) fueron sometidas a alineamientos múltiples utilizando el software Clustal X versión 2.0. Posteriormente, las secuencias se analizaron mediante el software MEGA 11.0.11 para ser concatenadas y así obtener un árbol filogenético. Las secuencias sometidas a análisis filogenéticos fueron las de las accesiones MK752438.1, MK752494.1, MK752493.1, MK752436.1, MK752439.1, MK752495.1, MK752440.1, MK752496.1, MK752434.1, MK752492.1 , MZ433204.1, MZ451398.1, MZ433200.1, MZ451395.1, MZ433199.1, MZ451394.1, MZ433198.1, MZ451393.1, MZ425507.1, MZ451389.1, MT215574, MW071, 9MT.413 .1, MW295970.1, OM473286.1 y OM715999.1. Trichoderma stromaticum cepa GJS 97-181 se consideró como parámetro externo para contrastar los resultados. La historia evolutiva se infirió utilizando el método Neighbor-Joining. Las aproximaciones de “bootstrap” se realizaron con 1000 permutaciones. El árbol se dibujó a escala, con longitudes de rama en las mismas unidades que las distancias evolutivas utilizadas para inferir el árbol filogenético. Las distancias evolutivas se calcularon utilizando el método de máxima verosimilitud compuesta. Se contempló un total de 2379 posiciones en el conjunto de datos final.
De acuerdo con las pruebas de patogenicidad, los aguacates sanos inoculados con solución salina estéril no presentaron síntomas de pudrición blanda después de 21 días post-inoculación (Figura 1B). Sin embargo, los aguacates inoculados con conidios provenientes del hongo asociado a la pudrición de la fruto produjeron signos evidentes de infección después de 6 días post-inoculación, pero estos fueron devastadores después de 21 días (Figura 1C).
Los síntomas observados fueron pérdida de turgencia, cambios en la pigmentación del epicarpio (acumulación de melanina) y proliferación micelial, los cuales coincidieron con las características previamente observadas en los aguacates recolectados en la zona de estudio (Figura 1A). El hongo presentó micelio algodonoso blanco con rápido crecimiento radial en PDA (6.5 mm día-1) y viró el medio de cultivo a color amarillo a los 7 días (Figura 1D-1E). Las características microscópicas del hongo revelaron la presencia de conidióforos penicilados organizados en verticilos conteniendo tres o cuatro fiálides (Sun et al., 2020) (Figura 1F). Las conidias primarias mostraron forma ovalada o sub-ovalada (Figura 1G-1H). El tamaño promedio de las conidias (n=200) fue de 10.57 µm × 4.42 µm. También se observó la presencia de clamidosporas (Figura 1I). Estas características coincidieron con la descripción microscópica reportada por Sun et al. (2020) para C. rosea. Las secuencias parciales de nucleótidos del gen ribosomal 18S (ITS; 543 pb) y del gen del factor de elongación 1 alfa (TEF-1α; 658 pb) se depositaron en la base de datos de nucleótidos del NCBI con las accesiones OM473286 y OM715999, respectivamente. Las secuencias ITS mantuvieron 99.6% de homología con la accesión MH864650 mientras que la secuencia EF-1α tuvo 99.8% de homología con la accesión KX184998 de C. rosea aislada de muestras de suelo. Estos resultados avalaron la identidad del hongo como C. rosea. Hasta donde es sabido, no existe ningún informe sobre la patogenicidad potencial de C. rosea en los aguacates cosechados en todo el mundo. Sin embargo, investigaciones anteriores describen el efecto devastador de cepas silvestres de C. rosea en Vicia faba, Solanum tuberosum y Glycine max (Afshari y Hemmati, 2017). El análisis filogenético de la cepa de C. rosea aislada en esta investigación (C08-9) reveló que la suma de la longitud de la rama fue 0.22056366 y la escala correspondiente para las secuencias concatenadas de los marcadores ITS-EF-1α fue 0.020 (Figura 2).
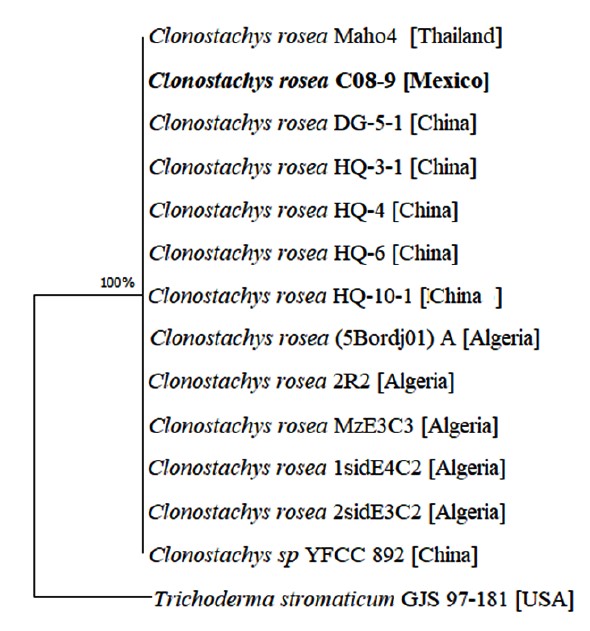
Figura 2 Análisis filogenético mediante el método neighbor-joining usando el programa MEGA 11.0.11 con 1000 permutaciones para las secuencias ITS/TEF-1 alfa de C. rosea. Trichoderma stromaticum se utilizó como referencia externa y la cepa C08-9 reportada en este estudio se muestran en negrita.
La cepa C08-9 de C. rosea aislada en esta investigación se agrupó dentro de muestras reportadas de diversos países. La mayor homología fue con C. rosea aislada de la raíz podrida de Astragalus membranaceus cultivada en China, con la cepa DG-5-1 aislada de la raíz podrida de Angelica sinensis y con la cepa Maho4 aislada de semillas y frutos silvestres recolectados en Tailandia (Perera et al., 2020). Para construir un árbol filogenético, se consideró como referencia externa Trichoderma stromaticum GJS 97-181 por su relación genética con C. rosea. Los datos indican que C. rosea puede tener un origen monofilético y probablemente la cepa C08-9 proviene de una pequeña población habitacional con actividad patógena. Como es sabido, la variación fenotípica producida por cambios genéticos asociados al proceso de adaptación podría estar involucrada en el desarrollo de la patogenicidad de C. rosea. Para mayor investigación, la cepa C08-9 de C. rosea aislada en esta investigación fue criopreservada en glicerol al 15% a -80 °C en el cepario de la Dirección de Innovación y Transferencia de Conocimiento de la Benemérita Universidad Autónoma de Puebla, México. Como comentario final, los resultados sugieren la patogenicidad potencial de C. rosea en el fruto de aguacate y representa el primer paso para la generación de estrategias agroecológicas posteriores para controlar esta nueva amenaza para el mercado del aguacate.
Agradecimientos
W.A.C.P. agradece la beca 1024387 otorgada por CONACyT-México para realizar sus estudios de maestría. La autora expresa un agradecimiento especialmente a la familia Coyotl-Pérez y a la familia Díaz-Pérez por su apoyo incondicional y dedica este trabajo a Rafaela Sandoval Pérez y Enrique Pérez Soriano. N.V.R. también agradece a CONACyT-México por el proyecto 578 del programa “Investigadoras e Investigadores por México”.
REFERENCIAS
Afshari N and Hemmati R. 2017. First report of the occurrence and pathogenicity of Clonastachys rosea on faba bean. Australasian Plant Pathology 46: 231-234. https://doi.org/10.1007/s13313-017-0482-3 [ Links ]
Duque-Bautista H, Zurita-Vásquez GG, Pacheco-Hernández Y, Villa-Ruano N. 2017. Etiology of a black spot symptom in Agave angustifolia: an in vitro approach towards its biological control. Mexican Journal of Phytopathology 35: 326-337. http://dx.doi.org/10.18781/R.MEX.FIT.1701-2 [ Links ]
Molnár O, Bartók T and Szécsi A. 2015. Occurrence of Fusarium verticillioides and Fusarium musae on banana fruits marketed in Hungary. Acta Microbiologica et Immunologica Hungarica 62: 109-119. https://doi.org/10.1556/030.62.2015.2.2 [ Links ]
Perera RH, Hyde KD, Maharachchikumbura SSN, Jones EBG, McKenzie EHC, Stadler M, Lee, HB, Samarakoon MC, Ekanayaka AH, Camporesi E, Liu JK and Liu ZY. 2020. Fungi on wild seeds and fruits. Mycosphere 11: 2108-2480. https://doi.org/10.5943/mycosphere/11/1/14 [ Links ]
Pérez VMAK, Morales MLA, Romero AO, Rivera A, Landeta CG and Villa-Ruano N. 2021. First report of Fusarium temperatum causing fruit blotch of Capsicum pubescens in Puebla, México. Plant Disease. In press https://doi.org/10.1094/PDIS-09-21-1941-PDN [ Links ]
Rosero JC, Cruz S, Osorio C and Hurtado N. 2019. Analysis of phenolic composition of byproducts (seeds and peels) of avocado (Persea americana Mill.) cultivated in Colombia. Molecules 24(17): 320917. https://doi.org/10.3390/molecules24173209 [ Links ]
Sun ZB, Li SD, Xu JL, Lu X and Sun MH. 2020. Biology and applications of Clonostachys rosea. Journal of Applied Microbiology 129: 486-495. https://doi.org/10.1111/jam.14625 [ Links ]
Recibido: 18 de Marzo de 2021; Aprobado: 22 de Abril de 2022











 texto en
texto en 


