Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista mexicana de fitopatología
versão On-line ISSN 2007-8080versão impressa ISSN 0185-3309
Rev. mex. fitopatol vol.40 no.1 Texcoco Jan. 2022 Epub 03-Out-2022
https://doi.org/10.18781/r.mex.fit.2107-3
Notas Fitopatológicas
Primer reporte de Alternaria alternata causante de la mancha dorada en xoconostle (Opuntia matudae) en Hidalgo, México
1 Departamento de Producción Agrícola y Animal, Universidad Autónoma Metropolitana Unidad Xochimilco, Calzada del Hueso 1100, Colonia Villa Quietud, Coyoacán, 04960 Ciudad de México, México;
2 División de Ingeniería en Innovación Agrícola Sustentable, Instituto Tecnológico Superior de Huichapan, El Saucillo sn, Huichapan, 42411, Hidalgo; México;
3 Facultad de Química, Universidad Autónoma de Querétaro, Cerro de las Campanas S/N, Querétaro 76010, México.
La especie Opuntia ficus-indica es afectado por varias plagas y enfermedades, siendo una de las más importantes la mancha dorada. Ésta ha sido reportada en varios países, incluyendo México. Síntomas similares a los causados por la mancha dorada en O. ficus-indica se han observado en el cultivo de xoconostle (Opuntia matudae Scheinvar, cv. Rosa). El objetivo de este estudio fue aislar e identificar el agente causal que ocasiona en este cultivo, los síntomas que se asemejan a los de la mancha dorada en O. ficus-indica. Se realizó un muestreo (10 parcelas) simple al azar en campo sobre plantas de xoconostle que presentaban los síntomas descritos. Se realizaron cortes de tejido vegetal enfermo y se sembraron en cajas con medio PDA. El cumplimiento de los postulados de Koch demostró que el aislamiento (un aislado) de la especie obtenida de las muestras de campo, colonizó los cladodios después de las inoculaciones en el invernadero. Mediante claves taxonómicas, se identificó a Alternaria sp. como microorganismo causante. La caracterización molecular del aislado de Alternaria sp. fue identificado como Alternaria alternata. Este es el primer reporte a nivel mundial de A. alternata como el agente causante de golden spot en el cultivo de xoconostle.
Palabras clave: Opuntia spp.; cladodio; fruto del cladodio; manchas cloróticas.
The species Opuntia ficus-indica is affected by pests and diseases, one of the most important of these being golden spot. The latter has been reported in various countries, including Mexico. Symptoms similar to those of golden spot in O. ficus-indica have been observed in the xoconostle crop (Opuntia matudae Scheinvar, cv. Rosa). The objective of this study was to isolate and identify the causative agent that causes the symptoms, which resembled those of the disease described as golden spot in O. ficus-indica. Simple random sampling in the field (10 plots) was carried out on xoconostle plants that presented the described symptoms. Slices of diseased plant tissue were cut and placed in Petri plates with PDA medium. Compliance with Koch’s postulates showed that the isolated (one aislated) of Alternaria sp. obtained from the field samples colonized the cladodes after inoculations in the greenhouse. Through taxonomic keys, Alternaria sp. was identified as the causative microorganism. Molecular characterization of the isolated Alternaria sp. was identified as Alternaria alternata. This is the first report worldwide of Alternaria alternata as the causal agent of golden spot in a xoconostle crop.
Key words: Opuntia spp.; cladode; fruiting cladode; chlorotic spots.
El género Opuntia es un recurso natural que se usa como cercado vivo, también se siembra en campos comerciales como fuente de forraje y como verdura comestible por el valor nutricional de sus cladiodos y frutas (Griffith, 2004; Defelice, 2004; Sáenz et al., 2006). Es un cultivo con alta demanda a nivel mundial y se exporta a EE.UU., Europa y Japón (Flores et al., 2013). Entre las especies del género Opuntia se encuentran un conjunto de cultivares silvestres genéricamente conocidos como xoconostles o tunas ácidas, cuyo nombre proviene del náhuatl (xoco = agrio y nochtli = tuna) (Gallegos-Vázquez et al., 2012). Estas especies son consideradas de alta adaptabilidad ecológica y, su anatomía y morfología les permite adaptarse a condiciones de estrés ambiental, siendo considerados alimentos vegetales valiosos en América Latina. Los cultivares del xoconostle poseen una cantidad importante de fibra y compuestos antioxidants tales como ácido ascorbico, mientras que las semillas son fuente de fibra, fenoles, flavonoides, ácidos grasos poliinsaturados y tocoferoles (especialmente γ-tocoferol), que le proporcionan buena capacidad antioxidante (Morales et al., 2012), así como compuestos bioactivos de alta calidad que se podrían incorporar en formulaciones alimenticias funcionales (Morales et al., 2014; Morales et al., 2015). Esto hace de la planta un cultivo ideal en zonas donde el desarrollo de otras especies de interés agrícola representa un desafío (Sáenz et al., 2006).
Al igual que con O. ficus-indica y O. monacantha, la especie del xoconostle también presentan problemas fitosanitarios causados por diferentes microorganismos que afectan la calidad y el rendimiento del cultivo (Rodríguez et al., 2001; Choueiri et al., 2005). Entre los problemas más comunes de este tipo en Opuntia se encuentran la mancha dorada (Quezada et al., 2006), necrosis del cladodio (Swart y Kriel 2002), y la mancha dorada producida por A. alternata (Granata y Sidoti, 1997; Swart y Kriel, 2002). Los síntomas de esta última enfermedad han sido descritos como una infección que comienza en las areolas del cladodio, cerca del sitio de penetración, donde aparece una ligera protuberancia, en la que el tejido cambia de color de un verde oscuro original a un verde claro hasta volverse dorado (Méndez et al., 2008).
Una sintomatología similar a la mancha dorada en O. ficus-indica ha sido observado recientemente en ambos lados del cladodio del xoconostle (observación personal). Sin embargo, no conocemos reportes de esta enfermedad en el xoconostle. Por lo tanto, el objetivo de este studio fue realizar un análisis comparativo de la sintomatología de la enfermedad en xoconostle con aquellas reportadas en otras especies de Opuntia e identificar al microorganismo que causa esta sintomatología.
El estudio se llevó a cabo durante los años 2017-2018 en Chapantongo (2017-2018) en Hidalgo, México (20º 17’ N y 99º 24’ O, a 2,120 metros sobre el nivel del mar) en un área agrícola establecida en suelos tipo Phaeozem y Vertisol. El clima es templado-subhúmedo con una precipitación anual promedio de 550 mm y una temperatura anual promedio de 18 °C. Los sitios de estudio presentan una inclinación de 7% norte-sur (INEGI, 2009); los sitios fueron previamente ocupados por pastizales y presentan una capa arable con una profundidad de hasta 20 cm.
Muestreo en campo. Un muestreo aleatorio simple se llevó a cabo en un campo establecido en 10 parcelas que ocupaban una hectárea de superficie, con 13 hileras que contenían 1,250 plantas de O. matudae cv. Rosa. Un total de 200 plantas fueron muestreadas con síntomas que se asemejaban a los de la enfermedad descrita como mancha dorada en O. ficus-indica. De estas, 100 muestras fueron seleccionadas al azar para realizar el aislamiento y la purificación del patógeno causante de la enfermedad. Los síntomas de los cladiodos de las plantas infectadas de O. ficus-indica son manchas cloróticas alrededor de las espinas. Las manchas se desarrollan hasta convertirse en costras redondas de color amarillo dorado, luego el centro se necrotiza dejando un halo amarillento. La enfermedad causada por A. alternata en O. ficus-indica también se observa en las frutas, que con frecuencia presenta los mismos síntomas que se observan en los cladiolos (Granata y Sidoti, 1997). Cladiodos de plantas de O. matudae cv. Rosa con síntomas de la enfermedad fueron recolectados, envueltos en papel estéril y almacenados a 4 ºC hasta su análisis. Se identificaron muestras de plantas y se depositaron en la colección de cultivos del Laboratorio de Fitopatología de la Universidad Autónoma Metropolitana - Xochimilco.
Aislamiento y purificación de hongos. El material vegetal se lavó con agua potable y se desinfectaron 2 cm2 de tejido durante 3 min con una solución de 5% de hipoclorito de sodio y 50% de alcohol. Después de enjuagarse tres veces con agua destilada estéril, fueron colocados sobre papel estéril para retirar el exceso de agua y después se colocaron fragmentos de 0.5 cm2 en cincuenta cajas con Papa Dextrosa Agar (PDA) y otros cincuenta con Agua y Agar (WA). Fueron colocados de manera aleatoria e incubados a 28 ± 2 °C por cinco días. Los hongos fueron identificados mediante el uso de claves específicas (Simmons, 2008). Las mismas cantidades se usaron para la purificación.
Las cepas identificadas como Alternaria sp. se aislaron mediante la técnica de punta de hifa en los medios WA y PDA y se incubaron a 28 ± 2 °C hasta que se confirmó la esporulación. Las esporas se colectaron, y se colocaron en un tubo Eppendorf con 1 mL de solución Tween 20 (0.5%) y se agitaron por 1 min. Las muestras se centrifugaron por 30 s y el sobrenadante se descartó. Se agregó agua estéril destilada para resuspender las esporas. De esta suspensión de esporas se prepararon diluciones al 10-4, 0.5 mL se colocaron en cajas con PDA y WA y se incubaron a 28 ± 2 °C. Después de 24 h se cortó un fragmento del medio de cultivo con esporas germinadas y se colocó en cajas con PDA y WA y se incubó a 28 ± 2 °C hasta la esporulación (Montiel et al., 2016). Se incubaron fragmentos de cultivos monospóricos en un medio de cultivo Agar Rosa de Bengala, agar modificado Czapek Dox y Agar Sabouraud a 28 ± 2 °C por 24 h. Las esporas se identificaron morfológicamente mediante claves taxonómicas (Simmons, 2008).
Identificación morfológica y molecular. Un fragmento de dos cultivos puros de Alternaria se colocaron en un medio PDA y se incubaron a 28 °C hasta alcanzar su desarrollo máximo; el micelio desarrollado se maceró con nitrógeno líquido hasta obtener un fino polvo. A partir de este cultivo se realizó una extracción de ADN genómico con 0.5 g of de micelio en polvo (Shure et al., 1983), se verificó con la técnica de electroforesis en gel de agarosa a 0.8%, se tiñió con bromuro de etidio y la concentración se determinó con el espectrofotómetro NanoDrop 1000. El ADN fúngico se usó para la amplificación del gen ARN 18S ribosomal.
El ADN fúngico extraído se usó para la amplificación del gen ARN 18S ribosomal mediante los oligonucleótidos NS5 / NS6, y la region intergénica ITS1 (ITS5 / ITS2) y ITS2 (ITS5 / ITS4) de los genes que codifican para los ARN ribosomales 18S, 5.8S y 28S, respectivamente (White et al., 1990). La amplificación de los fragmentos (ITS1 fue de un largo de 234 bp y ITS2, de 565 bp) se llevó a cabo con la técnica PCR (30 μL de una mezcla de reacción: JumpStart ™ Reaction mix 2x, 50 ng de gADN fúngico y 10 pM μL-1 de oligonucleótidos). La mezcla se colocó en el termociclador TC-5000 Techne® de acuerdo con el programa (desnaturalización a 94 °C, 160/35 s, 35 cycles; alineamiento a 55 °C, 35 ciclos; extensión a 72 °C, 45 s, 35 ciclos y extensión final a 72 °C, 300 s 35 ciclos) (White et al., 1990). Los productos PCR se separaron por electrophoresis en gel de agarose a 0.8% y se purificaron con el kit de extracción Sigma® GenElute Gel. Los productos de PCR purificados fueron unidos en pGEM T-Easy vector (Promega), transformados en células de Escherichia coli cepa DH5α, re-plantados en medio líquido LB con amplicilina, e incubados a 37 ºC con movimiento constante durante 24 h. De los cultivos obtenidos, el ADN plásmido se purificó con Illustra plasmidPrep Mini Spin Kit de GE Healthcare y la digestión se realizó con las enzimas de restricción EcoRI y PstI; la digestión se separó por electroforesis en gel de agarosa a 0.8% con bromuro de etidio, se fotodocumentó en el BIO-RAD Fluor-S® Max Multi Imager y se cuantificó en el espectrofotómetro NanoDrop 1000. Las secuencias se llevaron a cabo en la Unidad de Síntesis y Secuenciación del Instituto de Biotecnología de la UNAM. Las secuencias obtenidas se editaron mediante FinchTV y fueron identificadas como Altal-ITS1 y Altal-ITS2. Para determinar sus especies se usó la herramienta BLAST de la base de datos del Centro Nacional de Información Biotecnológica (NCBI) database (http://www.ncbi.nlm.nih.gov/BLAST). Para determinar la identidad de la secuencia de Altal-ITS1 y de Altal-ITS2 (234 y 565 bp respectivamente), los aislados usados fueron Alternaria alternata aislado wxm90 (GenBank: HM051066.1); Alternaria sp. ZH7-C2 (GenBank: FJ037737.1); Clon fúngico no-cultivado AA45-2 (GenBank: GU065589.1); Septoria lycopersici aislado NW574B (GenBank: EU520171.1); Alternaria sp. ALT3 (GenBank: HM114272.1); Alternaria alternata cepa KHF-5 (GenBank: MN173818.1); Alternaria alternata aislado Altal-ITS1 (GenBank: MW092952.1); Altal-ITS2 (GenBank: MW092953); Alternaria sp. JM-1 (GenBank: GQ389617.1); Alternaria azukiae cepa wxm133 (GenBank: HM037984.1); Alternaria alternata (GenBank: LC269969.1) y Alternaria alternata isolate R1-1 (GenBank: FJ827039.1). Las secuencias de Altal-ITS1 y Altal-ITS2 se alinearon con las secuencias previas y se contruyó un árbol filogenético mediante el uso de Unipro UGENE v. 41.0 (Okonechnikov et al., 2012).
Prueba de patogenicidad. Se realizó una evaluación de campo bajo condiciones de invernadero, en la que se utilizaron cladodios maduros de xoconostle (O. matudae cv. Rosa) de plantas sanas. Antes de realizar la siembra, se lavaron 20 cladodios con agua esterilizada y se desinfectaron con una solución de hipoclorito de sodio al 5%. Estos cladodios se dejaron a la sombra durante 20 días para dejar cicatrizar los cortes. Luego, se sembraron en bolsas de plástico de 35 x 35 cm llenas con una mezcla de tezontle (piedra volcánica) y arena de sílice (2:1).
Antes de la inoculación llevada a cabo en el invernadero, se realizó la activación de un aislado de forma separada en matraces de 250 mL con un medio de cultivo Papa Dextrosa Agar (PDA). Después de 8 días de incubación a 28 ± 2 °C, se agregaron a cada matraz 20 mL adicionales de Tween 80 a 0.05%, y éstos se colocaron bajo agitación orbital durante 1 min. La solución obtenida de la agitación se pasó a través de un flitro Whatman #40 y el filtrado se diluyó con 130 mL de agua estéril, la cual se aplicó a los cladodios de las plantas de xoconostle. Los cladodios inoculados por aspersión con 13 mL de una solución y un control (agua) fueron los dos tratamientos evaluados. Cada tratamiento constó de 10 repeticiones (cladodios) distribuidos en un arreglo completamente al azar. Cada 15 días se realizaban observaciones en busca de síntomas similares a los de la mancha dorada, anotando el tratamiento y el número de plantas cuando aparecían síntomas. En el caso de aparecer la sintomatología similar a la de la mancha dorada, se desinfectaban fragmentos de 0.5 cm2 de los cladodios en la solución de hipoclorito de sodio al 2%, se sembraban en cajas con PDA y se incubaban a 28 ± 2 °C. Después de 8 días de crecimiento, los cultivos se identificaron morfológicamente con claves taxonómicas (Simmons, 2008).
Análisis estadístico. A los datos se les realizó una prueba de normalidad (prueba Shapiro-Wilk W) y de homocedasticidad (Levene). Se recurrió a las pruebas de Análisis de Varianza Kruskal-Wallis (ANDEVA) y comparación de medias (Steel-Dwass) cuando la supuesta normalidad no pudo ser corregida usando transformaciones. Se usaron las pruebas ANOVA y de Tukey (p <0.05) para separar tratamientos. El análisis y el procesamiento de datos se desarrollaron con los paquetes de software estadísticos JMP® ver. 11 (SAS, 2012).
Muestreo en campo. La presencia de síntomas se observó en 100% de las plantas muestreadas del cultivo de xoconostle. La enfermedad se presentaba, por lo general, en el borde superior del cladodio previo al cladodio en fructificación (Figura 1A, B). Esta comienza en los cladodios como puntos amarillos o manchas cloróticas que normalmente se presentan cerca de las areolas (Figuras 1C, D), similares a las causadas por A. alternata y reportadas por Granata y Sidoti (1997) en tuna y que evolucionaron hasta formar una mancha dorada y necrois en la epidermis (Figures 1E, F). Más adelante, adquirieron la apariencia de quemaduras como resultado de la fusión de las manchas, con la elevación de la cutícula, deshidratación del tejido y formación de una costra. Una sintomatología similar ha sido reportada en O. ficus-indica (Swart y Kriel, 2002; Granata y Sidoti, 1997). Los síntomas hallados en la planta del xoconostle en este estudio no correspondían con los descritos por Ammar et al. (2004) y Flores et al. (2013) producidos por Botryodiplodia theobromae, Alternaria alternata y Fusarium solani en cladodios y pudrición de frutas del tunar, ni con los descritos por Méndez et al. (2008) para la mancha dorada causada por Alternaria sp., Hansfordia sp., Ascochyta sp. en O. ficus-indica. Estos autores exponen que el daño se presenta en el cladodio en fructificación y que afecta al área completa del cladodio en esta especie, a diferencia del xoconostle, donde el daño se observó en el cladodio previo al cladodio apical y no se presenta en las fructificaciones (Figura 1A, B).

Figura 1 Expresión de mancha dorada en Opuntia matudae, var. Rosa en plantas muestreadas en el campo. La sintomatología por lo general se presentaba en la orilla superior del cladodio (A); y en el previo al cladodio en fructificación (B); mancha dorada en el tejido epitelial (C); presencia de mancha dorada en la areola y el engrosamiento del tejido epitelial (D); engrosamiento del tejido causado por la fusión de las manchas doradas, principalmente en el borde superior del cladodio (E) y lesiones concéntricas en tejido del cladodio y necrosis en la epidermis (F).
Las lesiones reportadas por Swart y Kriel (2002) para la mancha dorada en los cladodios de O. ficus-indica presentan un patrón similar, ya que estos autores registran la presencia de clorosis alrededor de las espinas, lo cual se observó en el presente estudio. Sin embargo, la presencia de exudados en las lesiones reportada por Ammar et al. (2004), no fue encontrada.
Identificación morfológica y molecular. La purificación permitió la eliminación de organismos saprofíticos. De 100 muestras, se indentificó a A. alternata en 100% de las cajas incubadas. La característica distintiva del cultivo en el medio de cultivo PDA fue una capa color gris verdoso concéntrica con un borde blanquecino y un color café oscuro en el fondo de la caja. Los conidióforos median de 3 a 6 µm de grosor y un promedio de 50 µm de largo. Los conidios eran cortos, por lo general, con cadenas de 3 a 5 conidios. También se observaron conidióforos secundarios cortos, rectos, ovoides, con un pico corto y cilíndrico de 7-25 µm de largo, 5-12 µm de ancho, color olivo, con 3 septas transversales y 2 longitudinales. De acuerdo con McKenzie (2013), la morfología corresponde a la de A. alternata (Figura 2C-D).
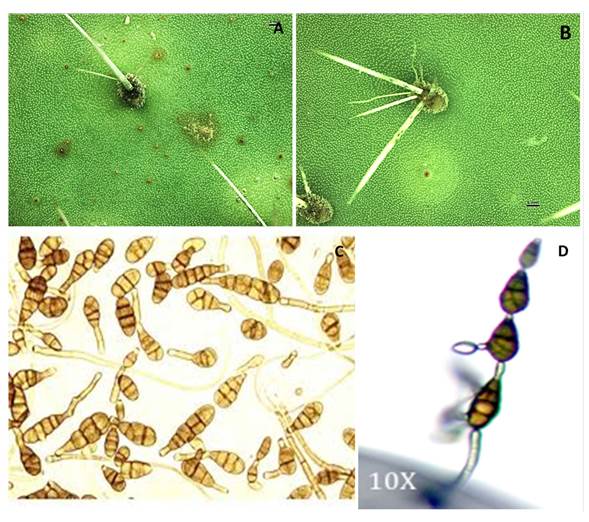
Figura 2 Síntomas causados por la inoculación de Alternaria alternata en cladodios de xoconostle en condiciones de invernadero: sin la presencia del halo clorótico (A); con la presencia del halo clorótico (B); patrón de esporulación del cultivo de Alternaria alternata en cadenas cortas (C); cadenas de conidios (D).
La secuencia de Altal-ITS1 (234 bp de largo Número de accession NCBI: MW092952) y Altal-ITS2 (largo de 565 bp Número de accession NCBI: MW092953) presentó un porcentaje de homología (98%). Los lineamientos de la base de datos de National Center Biotechnology Information y la caracterización morfológica previamente descrita, permitieron la identificación de Alternaria alternata (Figura 3).

Figura 3 Construcción del árbol filogenético comparando las regiones amplificadas Altal-ITS1 y Altal-ITS2 en Alternaria alternata
Experimento en invernadero. Diez meses después de la inoculación realizada en el invernadero comenzó la aparición de síntomas similares a los causados por la mancha dorada en O. ficus-indica. Una diferencia significativa (P≤0.05) se observó entre los tratamientos evaluados, y se encontró que aquellos en que se aplicó la solución conteniendo los aislados, fueron los que presentaron la sintomatología, mientras que el tratamiento control no la presentó. En cladodios inoculados con la solución con el aislamiento se identificaron áreas en color café con un diámetro de entre 1 y 5 mm y una elevación del tejido, pero los halos cloróticos no se registraron (Figura 2A). Sin embargo, también hubo cladodios en los que el halo clorótico estaba presente (Figura 2B). Los microorganismos identificados a partir de los aislamientos correspondieron con Alternaria alternata, observando la presencia de sus conidios en las espinas de los cladodios.
Observaciones morfológicas permitieron identificar a Alternaria alternata como el agente causal de la mancha dorada en O. matudae y los síntomas son similares a los de la mancha dorada en O. ficus-indica. Las caracterizaciones moleculares de los aislamientos Altal-ITS1 y Altal-ITS2 coincidieron con la especie de Alternaria alternata. Se requiere de más investigación para conocer el efecto del manejo integrado de productos y sobre todo de fungicidas en el crecimiento del hongo patógeno A. alternata en xoconostle.
Agradecimientos
Este estudio fue financiado por la Secretaría de Educación Pública (SEP) a través del Programa de Mejoramiento al Profesorado (PROMEP) con el proyecto 34411246 “Rescate y Evaluación de Especies Endémicas de Interés Agrícola” y el Departamento de Producción Agrícola y Animal of the Universidad Autónoma Metropolitana, Unidad Xochimilco, con el proyecto denominado “Determinación Morfológica y Molecular del Agente causal del Mal del Oro en Xoconostles” DCBS.CD.447.12.
REFERENCIAS
Ammar MI, Shltout AM and Kamhawy M. 2004. Cladode and fruit rots of prickly pear (Opuntia ficus-indica L. Mill.). Egyptian Journal of phytopathology 32:119-128. [ Links ]
Choueiri E, Massad R, Jreijiri F, Danet JL, Salar P, Bové J and Foissac X. 2005. First report of a 16SrII group phytoplasma associated with shoot proliferation of a cactus (Opuntia monacantha) in Lebanon. Plant Disease 89:1129. https://doi.org/10.1094/pd-89-1129b [ Links ]
Defelice MS. 2004. Prickly pear cactus, Opuntia spp. A spine-tingling tale. Weed Technology 18:869-877. https://doi.org/10.1614/wt-04-134 [ Links ]
Flores FR, Velázquez VMG, León RR, Flores MHE and Hernández LAN. 2013. Identification of fungal species associated with cladode spot of prickly pear and their sensitivity to chitosan. Journal of Phytopathology 161:544-552. https://doi.org/10.1111/jph.12104 [ Links ]
Gallegos-Vázquez C, Scheinvar L, Núñez-Colín C and Mondragón-Jacobo C. 2012. Morphological diversity of xoconostles (Opuntia spp.) or acidic cactus pears: a Mexican contribution to functional foods. Fruits 67(2):4-20. https://doi.org/10.1051/fruits/2012001 [ Links ]
Granata G and Sidoti A. 1997. Appearance of Alternaria golden spot on cactus pear in Italy. Acta Horticulture 438:129-130. https://doi.org/10.17660/actahortic.1997.438.16 [ Links ]
Griffith MP. 2004. The origins of an important cactus crop, Opuntia ficus-indica (Cactaceae): new molecular evidence. American Journal of Botany 91:1915-1921. https://doi.org/10.3732/ajb.91.11.1915 [ Links ]
INEGI. 2009. Prontuario de información geográfica municipal de los Estados Unidos Mexicanos. Chapantongo, Hidalgo. Instituto Nacional de Estadística y Geografía. http://www3.inegi.org.mx/sistemas/mexicocifras/datos-geograficos/13/13017.pdf [ Links ]
McKenzie, E. 2013. Alternaria alternata (Alternaria alternata). PaDIL https://www.padil.gov.au/maf-border/pest/main/142985/50820 [ Links ]
Méndez GSJ, Talavera MD and García HEJ. 2008. Identificación y control de las enfermedades más comunes en el nopal. Revista de Salud Pública y Nutrición 14:105-113. http://respyn2.uanl.mx/especiales/2008/ee-14-2008/documentos/05.pdf [ Links ]
Montiel SD, Ruíz JD, Olivares OJL and Segundo PE. 2016. Guía práctica para el diagnóstico de microorganismos de interés agrícola. CBS 50. UAM. México. 60 p. [ Links ]
Morales P, Barros L, Ramírez ME, Santos BC and Ferreira ICFR. 2015. Xoconostle fruit (Opuntia matudae Scheinvar cv. rosa) by-products as potential functional ingredients. Food Chemistry 185:289-297. https://doi.org/10.1016/j.foodchem.2015.04.012 [ Links ]
Morales P, Barros L, Ramírez ME, Santos BC and Ferreira ICFR. 2014. Exploring xoconostle by-products as sources of bioactive compounds. Food Research International 65: 437-444. https://doi.org/10.1016/j.foodres.2014.05.067 [ Links ]
Morales P, Ramírez ME, Sánchez MMC, Carvalho AM and Ferreira ICFR. 2012. Nutritional and antioxidant properties of pulp and seeds of two xoconostle cultivars (Opuntia joconostle F.A.C. Weber ex Diguet and Opuntia matudae Scheinvar) of high consumption in Mexico. Food Research International 46: 279-285. https://doi.org/10.1016/j.foodres.2011.12.031 [ Links ]
Quezada A, Sandoval S, Alvarado D and Cárdenas E. 2006. Etiología de la mancha negra del nopal (Opuntia ficus-indica Mill) en Tlalnepantla, Morelos, México. Agrociencia 40: 641-653. https://doi.org/10.24275/uami.hm50tr74r [ Links ]
Rodríguez AG, Fernández PSP and Landa HL. 2001. First Report of Pythium aphanidermatum causing crown and stem rot on Opuntia ficus-indica. Plant Disease 85:231. https://doi.org/10.1094/pdis.2001.85.2.231b [ Links ]
Sáenz C, Berger H, García JC, Galletti L, Cortázar VG. Higuera I, Mondragón C, Rodríguez FA, Sepúlveda E and Varnero MT. 2006. Utilización agroindustrial del nopal. Boletín de Servicios Agrícolas de la FAO. FAO Roma, Italia.162p. [ Links ]
SAS. 2012. Institute, Inc., JMP 10. Basic Analysis and Graphing, Vol. 1. [ Links ]
Simmons GE. 2008. Alternaria: An Identification Manual. The Netherlands [CBS Fungal Diversity Series No. 6.] Mycological Research 112(9) 1130. https://doi.org/10.1016/j.mycres.2008.06.012 [ Links ]
Shure M, Wessler S and Fedoroff N. 1983. Molecular identification and isolation of theWaxylocus in maize. Cell 35 (1): 225-233 https://doi.org/10.1016/0092-8674(83)90225-8 [ Links ]
Swart W and Kriel WM. 2002. Pathogens associated with necrosis of cactus pear cladodes in South Africa. Plant Disease 86: 693. https://doi.org/10.1094/pdis.2002.86.6.693d [ Links ]
Okonechnikov K, Golosova O and Fursov M. 2012. The UGENE team. Unipro UGENE: a unified bioinformatics toolkit. Bioinformatics 28: 1166-1167. https://doi.org/10.1093/bioinformatics/bts091 [ Links ]
White TJ, Bruns T, Lee S and Taylor JW. 1990. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. In: PCR Protocols: A Guide to Methods and Applications, eds. Innis, MA, Gelfand DH, Sninsky JJ, White TJ. Academic Press, Inc., New York, 315-322 pp. https://doi.org/10.1016/b978-0-12-372180-8.50042-1 [ Links ]
Recibido: 29 de Julio de 2021; Aprobado: 24 de Diciembre de 2021











 texto em
texto em 


